一种阳极氧化‑共沉淀制备磁性四氧化三铁的方法与流程
本发明涉及一种阳极氧化-共沉淀制备磁性四氧化三铁的方法,属于磁性材料制备领域。
背景技术:
目前,常见的利用光催化技术处理污水的操作方法有:一、将光催化剂粉末直接分散至污水中,进行光催化处理污水,但存在光催化剂不易分离、难以回收,还可能带来二次污染等弊端;二、将光催化剂制成膜状,负载在玻璃或硅胶等透明载体上,该法的缺陷在于光催化剂与污水接触面积较小,从而导致污水处理效果不理想。
纳米磁性材料具有巨大的比表面积和良好的分离回收特性,将其作为光催化剂的载体,可望利用其磁性来解决悬浆型光催化反应体系中,纳米粉末光催化剂难以分离回收的难题。
纳米fe3o4是一种重要的铁氧体材料,在核磁共振造影成像、微波吸收、催化剂、药物控制释放、高密度磁性记录材料以及磁热疗等领域应用广泛,且可用于制备纳米磁性核壳复合磁性光催化剂,不仅具有纳米粉末光催化剂优良的光催化活性,又可通过外加磁场实现对其便捷地分离回收。
目前常见纳米fe3o4的方法有化学法和微乳液法。其中化学法包括共沉淀法、水热/溶剂热法、金属有机前驱体热解法等,反应设备简单、条件温和、工艺流程短,但影响微粒粒径、结晶度和产品纯度的因素较多,易生成非磁性的α-fe2o3或α-fe2o3、fe3o4的混合物,并且出现不均匀的团聚现象;微乳液法可以很好地控制尺寸分布和形貌,但产率低、溶剂用量大且结晶度低。
技术实现要素:
针对上述现有技术存在的问题,本发明提供一种阳极氧化-共沉淀制备磁性四氧化三铁的方法,可满足作为壳核材料的“核”的需要。
为了实现上述目的,本发明采用的一种阳极氧化-共沉淀制备磁性四氧化三铁的方法,具体包括以下步骤,
1)在烧杯中加入自来水,将220v24w的水质电解器的电极置于自来水中,持续电解50-70s,停止电解后开始搅拌,至电解液冷却至室温,重复上述电解操作6-10次;
2)电解完成后,将电解液进行超声处理,过滤得产品,烘干、研磨,得fe3o4粉末。
作为改进,所述步骤1)中水质电解器的铁电极,先用精磨砂纸打磨,再用去离子水和无水乙醇依次清洗,干燥备用。
作为改进,所述步骤1)中水质电解器的规格为5mm×70mm的铁电极和铝电极,电极长度的70%垂直插入溶液中。
作为改进,所述步骤2)的超声处理具体为,将反应液置于超声仪中超声处理,控制80℃下超声30min。
作为进一步改进,该方法具体包括以下步骤,
1)在烧杯中加入500ml的自来水,将220v24w的水质电解器的电极置于自来水中,持续电解60s,停止电解后搅拌,至电解液冷却至室温,重复上述操作8次;
2)电解完成后,将反应液置于超声仪中超声处理,控制80℃下超声30min,过滤得产品,烘干、研磨,得fe3o4粉末。
另外,本发明还提供了一种上述任一项所述方法制得磁性四氧化三铁在制备纳米磁性核壳复合磁性光催化剂或磁性材料中的应用。
本发明以铁棒和自来水为原料,基于铁阳极的阳极氧化制备磁性fe3o4,还可以根据材料性质需要调控反应条件,获得尺寸、磁性、结晶性和不同形貌的磁性材料,以满足作为壳核材料的“核”的需要。
附图说明
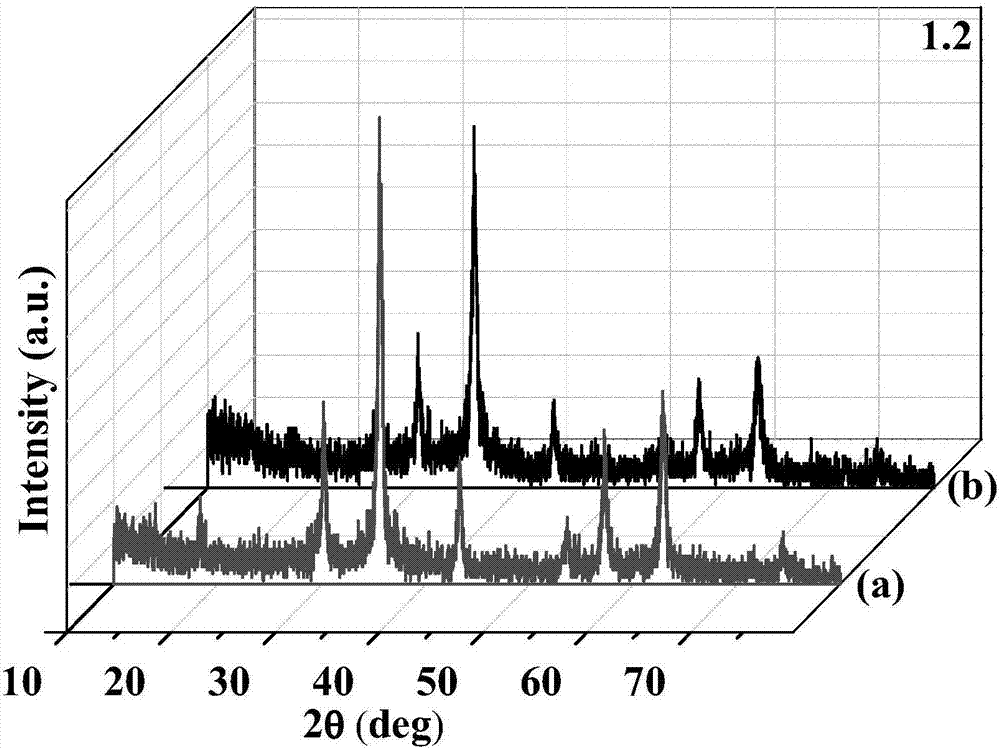
图1为本发明实施例1和实施例2所得fe3o4的xrd图,图中(a)超声处理、(b)不超声处理;
图2为本发明实施例1和实施例2所得fe3o4的3dwaterfall图,图中(a)超声处理、(b)不超声处理;
图3为本发明实施例3中所得fe3o4的xrd图,图中(c)~(g)对应ph分别为5、6.4、7、8、10,且均仅电解1次;
图4为本发明实施例4所得fe3o4的xrd图,图中(h)是ph为6.4、连续电解4次所得;
图5为本发明实施例4、5所得fe3o4的xrd图,图中(i)是ph为6.4、连续电解4次,经过200℃热水处理后所得样品;(j)是ph为6.4、连续电解4次,水的硬度为191所得样品;
图6为本发明部分实施例所得fesem图;
图7为本发明部分实施例所得产品的磁滞回线。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明了,下面通过附图及实施例,对本发明进行进一步详细说明。但是应该理解,此处所描述的具体实施例仅用以解释本发明,并不用于限制本发明的范围。
除非另有定义,本文所使用的所有的技术术语和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同,本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
实施例1
记为实施例a。
一种阳极氧化-共沉淀制备磁性四氧化三铁的方法,具体包括以下步骤,
1)采用220v24w的水质电解器,其电极规格为5mm×70mm(直径×长度)的铁电极和铝电极,用精磨砂纸打磨铁电极,再用去离子水和无水乙醇依次清洗,干燥备用;
2)在烧杯中加入500ml的自来水(ph为6.4),将220v24w的电解器电极长度的70%置于水溶液中;
3)接通220v的交流电电源,持续电解60s(反应液的温度也随之升高至沸腾),停止电解后,通过机械搅拌使反应液充分混合,并与空气接触,随着反应温度降低继而出现大量黑色沉淀;
4)反应液温度降至室温后,采用同样的操作重复电解,共计8次;
5)电解结束后,将反应液置于超声仪中超声处理,控制80℃下超声30min;超声结束,使用布氏漏斗抽滤,烘干,研磨,得到fe3o4样品。
实施例2
对比实施例b。
重复实施例1的步骤,在上述的操作步骤中,不进行超声处理得到fe3o4样品。
实施例3
对比实施例c~g。
重复实施例1的步骤,在上述的操作步骤中,使用1mol/lh2so4或10%的氨水溶液调节溶液的ph分别为5、6.4、7、8、10,且各实施例均仅电解1次时所得fe3o4样品。
实施例4
对比实施例h。
重复实施例1的步骤,在上述的操作步骤中,电解4次时所得fe3o4样品。
实施例5
对比实施例i、j。
i为重复实施例4的步骤,在上述的操作步骤中,电解4次,继续经过200℃水热处理后的fe3o4样品;
j为重复实施例1的步骤,在上述的操作步骤中,水的硬度减小一半(191)后所得fe3o4样品。
对上述各实施例制得fe3o4进行测试表征。
1.1各实施例fe3o4的物相、形貌和磁性测试
xrd:物相测定采用德国brukeraxsd8advancex–射线粉末衍射仪(cukα辐射,
fesm:采用日本日立s-4800扫描电子显微镜进行产品的形貌和尺寸的测定;
震动样品磁强计:(vibratingsamplemagnetometer,vsm,美国ade,7寸电磁铁,5.0kw电磁铁电源,变温范围90k-800k,室温时最大磁场为17000高斯,高温或低温时最大磁场为15000高斯。)
1.2测试结果分析
分析图1中给出的重复电解8次后分别经过超声处理(a)、不超声处理(b)所制备样品的xrd谱图,可以观察到较强的衍射峰,表明制备的产品具有较好的结晶性。通过与fe3o4的jcpds卡片(no.75-1610)比较,2θ在18.24°、30.26°、35.48°、43.26°、53.51°、57.25°、62.76°分别对应(111)、(200)、(311)、(400)、(422)、(511)、(440)晶面,没有其他杂峰出现,表明该合成条件下所得产品为立方相的fe3o4。
从图2的三维叠加图中可以观察到超声处理的产品(a)的xrd衍射峰更为尖锐,这表明超声操作可以有效提高fe3o4的结晶性。但是同时也显示x射峰噪声比较大,这与样品结晶度和晶粒尺寸密切相关。
图3给出的xrd谱图对应的产品为使用1mol/lh2so4或10%的氨水溶液调节溶液的ph分别为5、6.4、7、8、10,且仅电解一次时所得fe3o4。通过分析,图3中呈现的衍射峰不但有fe3o4的x-射线衍射峰,还存在mg0.03ca0.97co3。
图4给出的xrd谱图对应的产品为ph为6.4,分别电解1次、4次和8次时所得产品。在图4中(d)和(h)为电解1次和4次的产品,呈现的衍射峰对应的是fe3o4和少量的mg0.03ca0.97co3,仔细观察可发现,随着电解次数增多衍射峰的强度增大,且mg0.03ca0.97co3的衍射峰减弱;当连续电解次数达到8次时,所得的样品为纯相的fe3o4。这意味着可以通过增加电解次数可以减小mg0.03ca0.97co3杂质,电解次数达到8次时,可以消除mg0.03ca0.97co3杂质。
图5给出的(i)样品xrd谱图,对应为水样ph为6.4,电解4次时所得产品再经过200℃水热处理后的样品。在图5中可以观察到电解4次所得样品中存在fe3o4和少量的mg0.03ca0.97co3;当经过200℃,且ph=5.8的纯水热处理后的样品中不再出现mg0.03ca0.97co3的衍射峰,且衍射峰的强度增强,表明通过电解次数≥4,结合水热处理共同作用可以得到纯相的fe3o4。
水的硬度减小一半后所得样品的xrd谱图见(j),结晶性好,也没有杂峰,但是结晶性小于8次电解。这说明水的硬度减小后,连续8次电解可以得到纯相的四氧化三铁,其颗粒尺寸也小于8次电解所得产品,所以可以通过调节水的硬度获取不同尺寸的磁性fe3o4。
1.3各实施例所得fe3o4的颗粒尺寸
实施例所得产品的粒径大小通过debey-scherrer公式估算,d=kλ/bcosθ,其中,d为晶粒尺寸,λ为x射线波长,b为衍射峰的半峰宽,θ为衍射角,k为scherrer常数,取值0.9,取fe3o4(311)晶面衍射角进行估算,得到fe3o4磁核的平均晶粒尺寸数值列于表1中。
从表1的数据可知,不同合成条件下得到的产品颗粒尺寸不同,其中水热和超声再处理可以有效改善产品的结晶性,颗粒尺寸增大;ph对产品粒径影响不明显,但对形貌的影响较显著(见fesem表征);水的硬度减小,可以得到较小尺寸的fe3o4。
表1不同合成条件下的fe3o4样品尺寸
1.4本发明fe3o4合成机理分析
进一步与图1中的8次电解后的数据比较。重复电解和超声处理对于合成纯相、结晶性好的fe3o4是非常重要的操作。通过ph计测量了电解1、3、6、8次时采用的反应液的ph分别为6.4、5.8、5.5、5.3。根据实验数据,得出该合成过程中的反应如下:
第一阶段,电解反应。铁电极作为阳极发生阳极溶解反应,生成fe2+(见反应(1)),铝电极作为阴极,发生氢气析出的还原反应(见反应(2)),并产生较大量的oh-,由于电解反应的阳极和阴极间未采用隔断,因此有fe(oh)2生成(见反应(3));
fe-2e=fe2+反应(1)
4h2o+2e=h2+2oh-反应(2)
fe2++2oh-=fe(oh)2反应(3)。
第二阶段:超声处理的过程中加速fe(oh)2被空气中的o2氧化成fe(oh)3(见反应(4)),伴随着电解过程中释放的大量的热量,反应温度升高至100℃,加速反应生成,同时发生反应(5)。由于自来水样中含有较多量的钙离子和镁离子,他们的存在可以提供给溶液更高的导电性,加速反应的进行,但同时生成mg0.03ca0.97co3(反应(6));
4fe(oh)2+4h2o+o2=4fe(oh)3反应(4)
fe(oh)2·fe(oh)3=fe3o4+h2o反应(5)
0.03mg2++0.97ca2++2oh-+co2=mg0.03ca0.97co3+h2o反应(6)
第三阶段:重复电解过程中,随着反应过程中消耗oh-,溶液中的h+浓度增大,发生mg0.03ca0.97co3的溶解;在水热处理的过程中,由于电解4次所得样品所含杂质的量较少,水热处理时采用的ph=5.8的去离子水进行处理,都可以消除杂质,得到纯相fe3o4(反应(7));
2h++mg0.03ca0.97co3=0.03mg2++0.97ca2++h2o+co2反应(7)
1.5.fesem分析
本发明所制备部分实施例产品的fesem结果如图6所示,可以观察到不同合成条件下所制备的产品均为颗粒薄片状,其中(a)为8次电解后的纯相fe3o4,(g)为ph=10电解1次所得。从图中对比观察可知:第一,ph值增大,fe3o4由颗粒状向片状颗粒转变;第二,相同电解次数后所得产品,经过水热处理以后的产品颗粒更加均一,尺寸变大;第三,电解次数对产品的形貌影响不大,均为颗粒状物质;第四,水的硬度减小所得的产品的尺寸分布均匀,尺寸减小。亦与根据debey-scherrer公式计算的结果相匹配。
1.6磁学性能分析
图7和表2给出了t=300k时,不同条件下合成的样品的磁滞回线谱图和磁参数。可以看出,用阳极氧化法所制备的fe3o4均出现磁滞现象,产生了闭合的磁滞回线,表现出较强的铁磁性行为。其中,重复8次电解和超声处理所得的纯相fe3o4具有明显的磁滞回线,在外加磁场的作用下,饱和磁化强度强度(ms)为31.38emu/g,矫顽力(hc)为-1oe和剩余磁化强度(mr)为0.062emu/g,说明该方法制备的fe3o4纳米粒子在室温下具有超顺磁性。其饱和磁化强度、剩余磁化强度和矫顽力表现出来随着反应ph的增大,磁性下降。
表2阳极氧化法制备的产品的磁性参数
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!