一种新型小分子氰基比色及荧光增强型探针的制作方法
本发明涉及一类检测氰基的光学探针,尤其是在DMF溶液中氰基遇到该探针产生的现象是肉眼可以观察到的。
背景技术:
在所有的阴离子中氰基毫无疑问是最具有毒性的,人体摄入氰基的致死量是0.5-3.5mg/Kg.但是氰基又被广泛的应用于化学化工的各个领域,包括黄金开采,电镀,冶金等。因此我们迫切的要求,寻找一种有效的方法对氰化物进行高选择性和高灵敏度的检测。现今有多种方法检测离子,包括荧光分光光度计法,紫外可见分光光度计法,原子吸收/发射法,等离子体-质谱法,电化学方法等。其中有机化合物作为离子探针,用紫外可见分光光度计和荧光分光光度计探测离子,与其它检测技术相比,价格低廉,操作简单,灵敏快速,在多种离子的检测中均有应用。
在2012年Yan-Duo Lin等人在基于三苯胺醛衍生物的基础上开发了一种CN-探针,当该探针的H2O/THF (40:60, v/v)溶液中加入CN-在紫外可见光谱中随着CN-量的增加吸光度逐渐向377nm处发生蓝移。同时在荧光光谱中475nm处有了明显的增强,当CN-加入到该小分子探针的溶液中时,溶液由原来的棕色变为无色。该探针对CN-的检出限为6.6 × 10−5M。
2015年陈亚斌等人在基于三唑醛的基础上开发了一种CN-探针。当该探针的DMSO溶液中加入CN-在紫外可见光谱中随着CN-量的增加261nm处吸光度逐渐降低333nm处吸光度逐渐增加。同时在荧光光谱中449nm处有了明显的增强,当CN-加入到该小分子探针的溶液中时,紫外灯下溶液由原来的没有荧光变为蓝色荧光。该探针对CN-的检出限为1.43 × 10−6 M。
本发明将M1对氰基的特定识别作用可实现对氰基的快速即时性检测。
技术实现要素:
本发明的目的是针对上述技术分析,提供一种氰基比色及荧光增强型探针,该探针制备方法简单、成本低,且对氰基选择性好、响应快、灵敏度高。
技术方案:一种新型小分子氰基比色及荧光增强型探针,其特征在于:化合物名称为2,2'-二(2-苯基-1,2,3-三唑基-4-亚氨基)二苯二硫醚(M1)。
上述M1化合物的制备方法包含了2个基本步骤:①用2-苯基-1,2,3-三唑基-4-甲醛与2,2'-二氨基二苯二硫醚对目标分子M1进行合成;② 运用柱层析技术对目标分子M1分离提纯。
M1检测氰基具体步骤如下:
①配制1×10-3摩尔/升M1的DMF溶液;② 取100微升上述DMF溶液加入到比色皿中,使其浓度为1×10-5摩尔/升,搅拌一分钟,测试其紫外及荧光信号;
化合物M1用于氰基检测的具体步骤如下:
①在DMF溶剂体系配制浓度为1×10-5摩尔/升的M1溶液,并记录其紫外和荧光光谱;②向1所述的M1溶液中加入氰基水溶液,搅拌一分钟,通过记录其紫外和荧光光谱就可以对氰基进行识别,且能够根据光谱的变化程度定量氰基的浓度。
化合物M1用于氰基裸眼检测的具体步骤如下:
①在西林瓶中使用DMF溶剂配制浓度为1×10-5摩尔/升的M1溶液2毫升;②分别向其中加入2微升1×10-1摩尔/升氰基水溶液,搅拌一分钟,对比其颜色及荧光变化情况。
该氰基比色探针的检测原理:利用这种小分子的席夫碱C=N键与氰基发生亲核加成反应,使得M1的共轭性发生改变,从而使得溶液的颜色及荧光发生改变。
技术优点:
①M1分子是以比色法与荧光信号开启的方式实现对氰基的检测;② 检测过程中所需用到的配套材料来源丰富,成本低廉且易于实施;③M1分子在DMF溶剂体系中无色,加入氰基后变为黄色且荧光增强,可以通过荧光和比色两种方式检测;④该探针具有较高的检测灵敏度、选择性和快速检测能力。
附图说明
图1. 实施例2中,M1分子在DMF溶液中不同阴离子的紫外和荧光光谱图。
图2. 实施例3中,随着氰基水溶液的加入,M1分子在溶剂中的紫外光谱滴定图。
图3. 实施例4中,M1分子紫外光谱对氰基的响应时间图。
图4. 实施例5中,M1分子在DMF中对各种阴离子(水溶液)的抗干扰性紫外光谱图。
图5. 实施例6中,M1分子在DMF中对各种阴离子(水溶液)在365纳米紫外灯照射下的裸眼识别图。
图6. 实施例7中,M1比色探针在加氰基前后的红外及核磁滴定对比图。
图7. 实施例8中,M1比色探针在加氰基前后的颜色对比图。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但本发明并不限以下实施例。
实施例1、M1分子的制备:
称取2-苯基-1,2,3-三唑基-4-甲醛(1毫摩尔)和2,2'-二氨基二苯二硫醚(0.5毫摩尔)置于反应瓶中,5毫升无水乙醇和三滴冰乙酸,回流30分钟;冷却到室温,过滤得粗产物,洗涤,色谱柱纯化,浓缩,50 ℃真空干燥后得到白色固体,产率98%。FT-IR (KBr) cm-1: 3054.33, 1628.43, 1599.54, 1495.09, 1367.22, 752.14. 1H NMR (400 MHz, 氘代氯仿): δ = 8.74 (2 H, s), 8.44 (2 H, s), 8.12 - 8.15 (4 H, m), 7.68 - 7.70 (2 H, m), 7.51 - 7.55 (4 H, m), 7.39 - 7.43 (2 H, m), 7.21 - 7.26 (4 H, m) 7.10 - 7.12 (2 H, m). 13C NMR (100 MHz, 氘代氯仿): δ = 150.76, 148.29, 147.48, 139.55, 135.25, 132.24, 129.53, 129.42, 128.12, 127.68, 127.17, 126.26, 119.50, 119.10, 117.21. HRMS(ESI) :C30H22N8S2 (M1) 计算值: 559.1487 [M+H]+; 实测值: 559.1483 [M+H]+。
实施例2、滴定实验:
将M1配制成1×10-3摩尔/升的DMF溶液,取100微升加入到DMF溶剂2毫升的比色皿中使其浓度为1×10-5摩尔/升,搅拌一分钟。再将依次将2微升1×10-3摩尔/升不同阴离子水溶液加入其中至上述溶液中,测试(如图1所示)紫外和荧光光谱的变化。
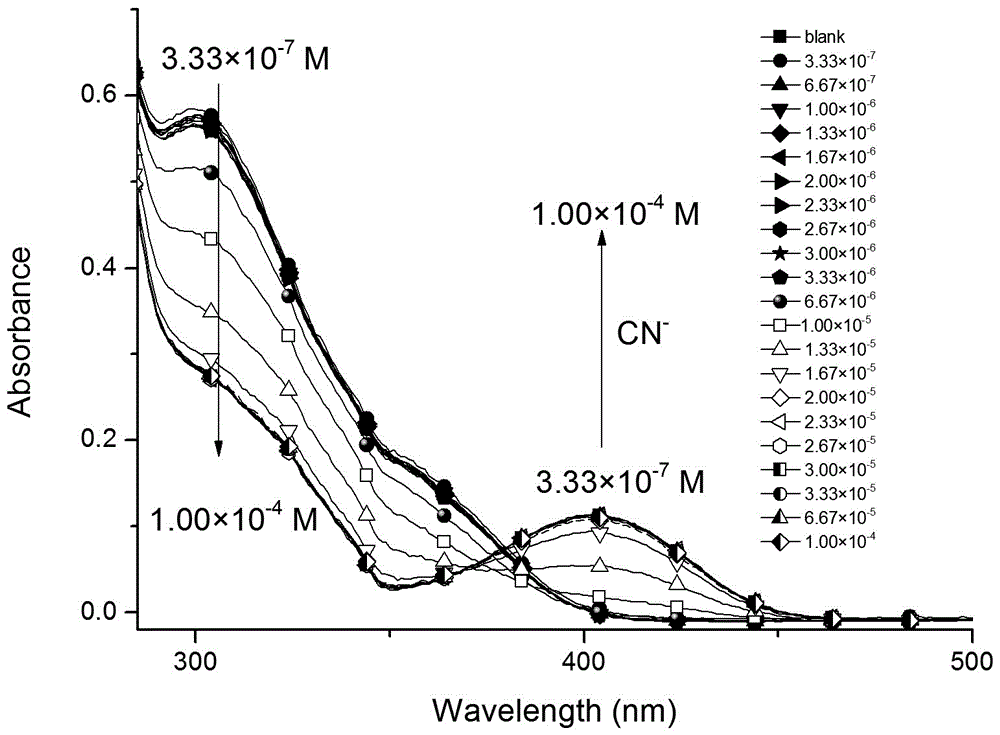
实施例3、滴定实验:
将M1配制成1×10-3摩尔/升的DMF溶液,取100微升加入到DMF溶剂2毫升的比色皿中使其浓度为1×10-5摩尔/升,搅拌一分钟。再将递增浓度的氰基水溶液滴加至上述溶液中,直至紫外强度达到平台;测试数据(如图2所示)表明随着氰基的加入,M1的紫外光谱中心约404纳米处的发射峰逐渐增强,其最低检测限为1.11×10-6 M。
实施例4、M1探针对氰基响应时间实验:
将M1配制成1×10-3摩尔/升的DMF溶液,取100微升加入到DMF溶剂2毫升的比色皿中使其浓度为1×10-5摩尔/升,搅拌一分钟,并记录其紫外及荧光光谱;然后向比色皿中分别滴加2微升1×10-1摩尔/升的氰基水溶液,记录M1的紫外及荧光光谱随时间的变化;测试结果(如图3所示)表明M1分子对氰基的响应时间小于1分钟。
实施例5、不同阴离子的选择干扰性实验:
将M1配制成1×10-3摩尔/升的DMF溶液,取100微升加入到DMF溶剂2毫升的比色皿中使其浓度为1×10-5摩尔/升,搅拌一分钟。然后向比色皿中分别滴加2微升1×10-1摩尔/升的阴离子( CO32-, HSO4- , OH-, F-, Br-, I-, H2PO4-, HPO42-, SCN-, Cl-, NO3-, SO42-, AcO-, S2- )水溶液,分别记录不加阴离子和加入阴离子以及加入阴离子后再加入2微升1×10-1摩尔/升的氰基水溶液的紫外发射光谱;测试数据(如图4所示)表明只有当加入的阴离子是氰根时紫外光谱强度才会显著增强,而加入其他除氰基外的阴离子时发射光谱则没有明显的变化;当加入阴离子后再加入氰基时紫外光谱都出现明显变化,说明此化学传感器有较高的选择性和抗干扰性。
实施例6、裸眼识别实验:
在西林瓶中用DMF溶剂体系配制浓度为1×10-5摩尔/升的M1溶液2毫升;分别向其中加入2微升1×10-1摩尔/升的阴离子(CO32-, HSO4- , OH-, F-, Br-, I-, H2PO4-, HPO42-, SCN-, Cl-, NO3-, SO42-, AcO-, S2- )水溶液和氰基水溶液,并将这些溶液搅拌一分钟,在手提式紫外灯365nm灯光照射下对比其荧光变化;测试数据(如图5所示)表明只有当加入的离子是氰基时发射光强度才会显著增强。
实施例7、检测机理验证实验:
称取M1( 0.05毫摩尔)和四丁基氰化胺( 0.10毫摩尔)加入到二氯甲烷,室温下搅拌5分钟,去除溶剂,50℃真空干燥过夜,测试产物和M1分子的红外光谱及核磁氢谱;测试结果(如图6所示)表明加入氰基后红外光谱上M1分子的席夫碱C=N键 特征峰消失,出现了新的-CN峰,核磁氢谱上M1分子的CH=N键 特征峰消失,出现了新的峰,这说明氰基和C=N键发生了作用。
实施例8、M1探针对氰基响应的比色实验
在西林瓶中用DMF溶剂体系配制浓度为1×10-5摩尔/升的M1溶液2毫升;分别向其中加入2微升和10微升1×10-1摩尔/升的氰基水溶液,将这些溶液放置一分钟可以看到(如图7所示)当氰基加入到M1中时,溶液由无色变为黄色,且颜色的深度与氰基加入的量有关。
- 还没有人留言评论。精彩留言会获得点赞!