一种食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法与流程
本发明属于分子生物学领域,具体涉及一种食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法。
背景技术:
食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)在我国属于高发的恶性肿瘤,ESCC的发展是一个多步骤过程结果,它由正常鳞状上皮向上皮内瘤变发展再到最后的浸润性癌。2000年世界卫生组织将上皮内瘤变分为两类:低级别上皮内瘤变(LGIEN),高级别上皮内瘤变(HGIEN)。有研究表明LGIEN、HGIEN与正常食管鳞状上皮相比发展为鳞状细胞癌的风险分别高出10倍和28倍,因此成功的区分HGIEN、LGIEN,利用癌前各阶段分子标志物对患者组织进行识别将对ESCC的初级预防与药物治疗提供机会。但是现有的研究多利用新鲜或者石蜡包埋的食管鳞状细胞癌手术组织及癌旁组织作为研究的对象,对这些样本进行差异蛋白质方面的研究。而对于癌前不同病变阶段的差异蛋白质鲜有研究。这种现状主要由以下几个原因造成:一、对于纯净石蜡组织样本的获得还是有一定的技术难度。二、对纯净石蜡包埋组织中蛋白质的提取与鉴定尚且没有形成通用的实验方法。三、纯净组织获得的不易,直接导致只能对癌和癌旁组织进行粗略的区分,而无法真正对癌前各阶段的差异蛋白质进行研究,也就无法发现能通用的癌前分子标志物,对ESCC进行有效的初级预防。所以,纯净癌前各阶段组织的获得技术以及差异蛋白质鉴定筛选技术对癌前分子标志物的发现至关重要。
技术实现要素:
针对现有技术中的缺陷和不足,本发明的目的是给出一种食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法,利用该蛋白质能准确的区分病人病理切片上的LGIEN和HGIEN,颠覆了传统通过HE染色依赖医生经验进行判读的方法,避免了人为主观因素的干扰;且得到了一种通用的、更加准确的筛选区分食道鳞状细胞癌前LGIEN和HGIEN的蛋白质的方法。
为达到上述目的,本发明采取的技术方案为:
一种食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法,包括将同一FFPE组织制作成至少两个玻片标本,其中一个玻片标本经HE染色后进行等级组织划分并标记,另一个玻片标本根据经HE染色后进行等级组织划分并标记的玻片标本上的划分区域进行组织切割得到各个等级组织的切割组织;之后对得到的各个等级组织的切割组织依次进行蛋白质的提取、定量、纯化与酶解得到各个等级组织的肽段;最后将得到的各个等级组织的肽段分别经LC-MS/MS进行质谱检测,对质谱检测结果进行统计学分析和生物信息学分析得到LGIEN和HGIEN的标记蛋白质。
具体的,包括:
步骤一、对目标组织进行LCM激光捕获:将食管鳞状细胞癌ESD术后的同一FFPE组织分别制作成HE玻片标本和PEN玻片标本,根据染色的区别将HE玻片标本进行等级组织划分并进行标记,根据HE玻片标本上的标记区域对脱蜡水化后的PEN玻片标本进行LCM激光显微切割得到各个等级组织的切割组织;
步骤二、将步骤一得到的各个等级组织的切割组织依次进行蛋白质的提取、定量、纯化与酶解得到各个等级组织的肽段;
步骤三、步骤二得到的各个等级组织的肽段分别经LC-MS/MS进行质谱检测,对质谱检测结果进行统计学分析和生物信息学分析得到LGIEN和HGIEN的标记蛋白质。
更具体的,所述的等级组织包括正常食管鳞状上皮组织、LGIEN、HGIEN和原位癌组织。
进一步的,所述的蛋白质的提取采用PEB试剂进行提取,PEB试剂包括300mM的Tris-HCL溶液,Tris-HCL溶液中含有体积百分比为2%的SDS,Tris-HCL溶液的pH=8.0。
更进一步的,所述的蛋白质的提取方法包括:按照100mm2的待提取等级组织、100μl PEB试剂及4μl的cocktail蛋白酶抑制剂进行混合,在90℃孵育90min后,4℃下16000xg离心20min收集上清液,上清液在12,000xg~16000xg的转速下离心30~40min得到沉淀物为粗提蛋白质;粗提蛋白质再经定量、纯化与酶解得到各个等级组织的肽段。
还有,所述的PEN玻片标本的脱蜡水化包括:将PEN玻片依次在二甲苯中浸泡10min并重复两次、在无水乙醇中浸泡10min并重复两次,之后在96%的乙醇中浸泡3min并重复两次、70%的乙醇中浸泡3min并重复两次,最后将PEN玻片标本上的溶剂冲洗干净风干即得。
另外,所述的统计学分析和生物信息学分析包括:
生物学分析:利用MaxQuant software environment(version1.4.3.9)软件进行label-free分析,肽段的假阳性检出率设置为0.01,检出数据在Uniprot数据库进行筛选,筛选所有unique peptide+razor≥1的蛋白质;
统计学分析:对经生物学分析得到的蛋白质进行多个个体的重合筛选及差异表达分析,在差异表达分析的结果中筛选与HGIEN和LGIEN相比有统计学差异意义的蛋白质即得食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质。
所述的食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法得到的蛋白质用于区分LGIEN和HGIEN的应用。
具体的,将筛选得到的蛋白质的抗体通过IHC染色法对病理切片进行染色,通过染色后着色强弱的区别进行LGIEN和HGIEN的区分。
本发明的优点为:
1.对纯净组织的获得我们选择激光显微切割技术(LCM),但现有这项技术大都适用于新鲜冰冻组织或者石蜡包埋后经过苏木精染色的组织。目前并无FFPE在不染色情况下进行捕获的文献报道,发明人通过对FFPE组织进行脱蜡水化后与同时连续切片的HE染色片进行拓印,解决了这一问题,而FFPE组织相较于新鲜组织更容易获得与保存;相较于苏木精染色后进行激光捕获,不染色的技术更简洁,更高效(无需脱色处理),能在常温较短时间内对脱去石蜡保护的蛋白质进行高效的提取;
2.通过利用商品化的FFPE蛋白质提取试剂盒与自配试剂PEB试剂的对比使用,确定了更优化的蛋白质提取技术,用PEB试剂进行蛋白质的提取的实验流程更简洁,获得的质谱蛋白数更多,因此,采用PEB试剂对蛋白质进行提取和定量;
3.利用组织形态相对简单的ESD(内镜粘膜下剥离术)术后的FFPE(福尔马林固定石蜡包埋formalin fixed paraffn embed-ded,是病理科普遍采用的组织处理和保存方法)组织,首次实现了对食管鳞状细胞癌前病变各阶段等级组织(正常食管鳞状上皮、LGIEN、HGIEN和原位癌组织)的纯净石蜡包埋组织的捕获、蛋白质提取,本发明通过联合独立的LCM与Q-Exactive技术,对组织形态相对简单的ESD术后FFPE样本进行了成功的蛋白质质谱鉴定,后通过常规免疫组织化学染色(IHC),对质谱筛选的蛋白质分子进行实验验证,有望成为临床病理研究蛋白质分子标志物的常规有效组合手段;并利用生物学和统计学分析最终得到能快速、明显的,利用病理切片区分LGIEN和HGIEN的标记蛋白;
4、本发明筛选获得的蛋白质能够通过开展常规简便的IHC实验手段即可利用该蛋白质准确的区分病人病理切片上的LGIEN和HGIEN,颠覆了传统通过HE染色依赖医生经验进行判读的方法,避免了人为主观因素的干扰。进一步加强病理诊断在判读ESD术后的食管鳞状细胞癌前病变不同阶段的准确性与客观性。对病理诊断具有重要的实践意义。
附图说明
图1为本发明食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法的流程图;
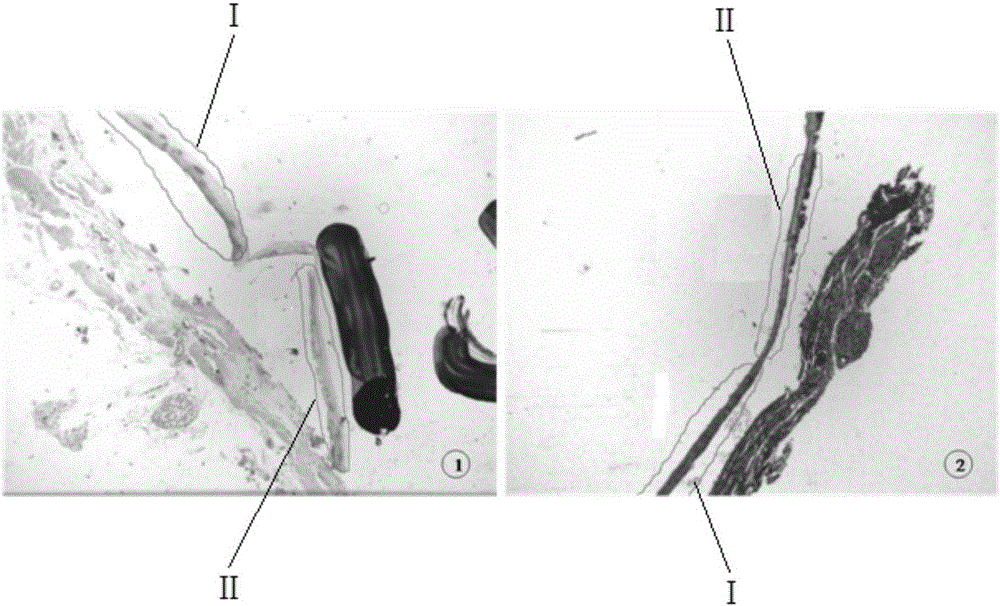
图2中的①为HE玻片染色图,②为与HE玻片拓印对应的PEN膜玻片图;图中Ⅰ代表正常食管鳞状上皮组织,Ⅱ代表LGIEN组织;
图3中①为HGIEN组织HE玻片染色图,②为与HE玻片拓印对应的HGIEN组织PEN膜玻片图,③为原位癌组织HE玻片染色图,④为与HE玻片拓印对应的原位癌组织PEN膜玻片图,图中Ⅲ代表HGIEN组织,IV代表原位癌组织;
图4为Brandford法蛋白质定量,标准曲线图;
图5为SDS-PAGE制胶后,切胶制样图,图中M表示蛋白质Maker;
图6为实施例一中4例病人的蛋白重合数据图;
图7到图17为329个蛋白质差异表达分析统计数据图;
图18为IHC染色验证结果图;
图19为TGM3的临床病理诊断应用图;
以下结合说明书附图和具体实施方式对本发明做具体说明。
具体实施方式
本发明得到的食管鳞状细胞癌前LGIEN和HGIEN的标记差异蛋白质为TGM3,该蛋白质为Protein-glutamine gamma-glutamyltransferase E,protein Id为Q08188,基因名为TGM3。购买商品化的TGM3一抗,利用IHC实验方法,对临床病理诊断难以区分的HGIEN和HGIEN进行IHC染色后,根据染色结果的强弱不同进行(HGIEN表达弱于LGIEN)客观判读。
结合图1,本发明的食管鳞状细胞癌前LGIEN和HGIEN的标记蛋白质的筛选方法包括:
步骤一、对目标组织进行LCM激光捕获:将食管鳞状细胞癌ESD术后的同一FFPE组织分别制作成HE玻片标本和PEN玻片标本,根据染色的区别将HE玻片标本进行等级组织划分并进行标记,根据HE玻片标本上的标记区域对脱蜡水化后的PEN玻片标本进行LCM激光显微切割得到各个等级组织的切割组织;
步骤二、将步骤一得到的各个等级组织的切割组织依次进行蛋白质的提取、定量、纯化与酶解得到各个等级组织的肽段;
步骤三、步骤二得到的各个等级组织的肽段分别经LC-MS/MS进行质谱检测,对质谱检测结果进行统计学分析和生物信息学分析得到LGIEN和HGIEN的标记蛋白质。
具体的步骤包括:
步骤一、对目标组织进行LCM激光捕获:
1.将ESD术后的FFPE标本分别制作成HE玻片标本和PEN玻片标本,根据染色的结果将HE玻片上的样品进行等级区域划分,分为四组,具体染色结果见图2和图3,并对各分级组织HE玻片进行标记。
2.将PEN玻片(leica显微切割玻片)进行组织脱蜡水化后,晾干。在显微镜下PEN玻片与HE玻片进行拓印,标出四个等级组织在PEN玻片上的位置。
3.利用ArcturusXT(Life technologies)激光显微切割仪,分别切割PEN玻片上四个等级组织。在Arcturusxt laser capture microdissection system软件下进行操作。
步骤二、对切割收集的组织进行蛋白质提取与定量:
1.利用自配PEB试剂,对捕获样本进行蛋白质提取。
2.利用Millipore 3K超滤离心柱对提取的蛋白质原液进行初步的纯化与浓缩。
3.利用Brandford法测蛋白质浓度,对提取的蛋白质进行定量。
步骤三、蛋白质纯化与酶解:
1.利用SDS-PAGE gel进行蛋白质电泳纯化。
2.用胰蛋白酶进行酶解。
3.回收肽段,进行真空干燥,保存。
步骤四、质谱分析(LC-MS/MS):
1.使用四级杆轨道离子阱质谱(Q-Exactive Thermo Fisher Scientific)进行蛋白质的质谱检测;
2.利用MaxQuant software environment(version1.4.3.9)软件进行label-free搜库筛选得到所有unique peptide+razor≥1的蛋白;
3.进行统计学与生物信息学分析,利用MaxQuant software environment(version1.4.3.9)软件进行label-free分析。肽段和蛋白的假阳性检出率被设置为0.01,检出数据在Uniprot数据库进行筛选,筛选所有unique peptide+razor≥1的蛋白质,再对蛋白质进行四个等级区域的重合筛选。
4.对重合筛选后的蛋白质再进行两两分组差异表达分析,用对数处理后看差异表达幅度,(>1或者<-1相当于上调2倍或者下调2倍),用Tp.value(成对T检验p值,<0.05为显著差异)在符合条件的蛋白质里,查找差异表达幅度绝对值最大的蛋白,作为目标蛋白。
验证结果:利用免疫组织化学(IHC)技术验证目标的分子标志物
1.购买上一实验步骤中筛选出的蛋白质的一抗,进行IHC实验验证。
2.IHC结果与质谱结果进行比对分析。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例一:
激光显微切割膜玻片(PEN玻片)的制备
1.选取四个食道鳞状细胞癌病人的ESD术后FFPE组织,编号为病人A的FFPE组织、病人B的FFPE组织、病人C的FFPE组织和病人D的FFPE组织,对病人A的FFPE组织、病人B的FFPE组织、病人C的FFPE组织和病人D的FFPE组织分别进行HE玻片标本和PEN玻片标本的制备,
HE玻片标本的制备包括:将FFPE组织切割成3-4μm厚的组织片体,挂于一张普通玻片上并进行HE染色。
PEN玻片标本的制备包括:同时连续切割同一FFPE组织,每张组织10μm厚,摊片在45℃的蒸馏水中,展开后捞片于PEN膜玻片上。
保证同一病人的FFPE组织制作成的HE玻片标本和PEN玻片标本上的组织样品的大小相同。
以病人A的PEN玻片标本为例进行下述操作:
2.PEN玻片标本的脱蜡水化包括:制作后的PEN玻片标本在60~65℃烤片30分钟按照以下步骤进行操作:
(1)将PEN玻片标本在二甲苯中完全浸入10min,重复此步骤一次,保证每次使用新的二甲苯;(2)再放入无水乙醇中完全浸入10min,重复此步骤一次,每次使用新的无水乙醇;(3)再转移玻片至96%的乙醇中,静置3min,重复一次,使用新的96%的乙醇;(4)再转移玻片至70%乙醇中,静置3min,重复一次,使用新的70%乙醇;(5)再将PEN玻片标本浸入双蒸水30s,将玻片有组织的一面轻压在滤纸上吸走大部分水分。待玻片自然风干10秒后,立即进行下一步实验。
3.HE玻片标本进行四个等级区域的划分后,将脱蜡水化后的PEN玻片标本与标记好的HE玻片标本一一对应进行拓印,标注各个等级区域。(如图2和3所示)。
LCM操作:
1.将拓印后的PEN玻片标本置于LCM切割显微镜头下。该镜头下可以同时放两张需要捕获的PEN玻片标本,一张对应HE玻片标本。在4倍和10倍镜头下反复观察比对HE玻片标本与PEN玻片标本,确保需要捕获的目标组织正确。
2、在Arcturusxt laser capture microdissection system软件下进行捕获。
3.每个样本收集100mm2的组织,将收集的组织转移进1.5ml的PE管中进行蛋白质的提取。
已有的文献报道均是对PEN膜玻片上的组织进行苏木精-伊红染色后进行捕获,这一步骤需在组织脱蜡水化后在常温状态下进行,这无疑延长了蛋白质暴露的时间,对蛋白质的质谱鉴定是不利的。我们对这一传统步骤进行了改进,通过已有的HE染色与方向一致的PEN不染色组织进行拓印,标注,极大的缩短了捕获的时间和蛋白质常温暴露的时间,保证了捕获组织的纯净,进而保证了之后对各个组织中的蛋白质提取的纯净。
组织蛋白质提取:
FFPE组织蛋白质提取试剂的比对:
1.任意选取两组已经切割好的面积一致的原位癌组织。同时使用QIAGEN公司商品化的FFPE Tissue Extraction Buffer(EXB)试剂盒与自配的PEB配制试剂(PEB的配制:300mM Tris-HCL溶液中加入2%的SDS,调节溶液的pH=8.0))进行蛋白质提取的比对。
2.两个EP管中同时含有100mm2的捕获组织。标注管1中加入100μl PEB缓冲液,4μl cocktail蛋白酶抑制剂。管2中加入100μl EXB缓冲液,其中含有6μlβ-巯基乙醇,再同样加入4μl cocktail蛋白酶抑制剂。
3.管1在90℃孵育90min后,4℃下16000xg离心20min,转上清至新EP管。
4.管2在冰上孵育5min,涡旋混匀,夹上夹子,100℃孵育20min后,80℃孵育2h,期间酶10min取出摇动1min;2h后放入4℃冰箱1min,去掉夹子。4℃下16000xg离心15min,转上清至新EP管。
5.浓缩上清液;分别加两管上清液至Millipore 3K超滤离心管内。12,000xg~16000xg离心30~40min。
6.浓缩后的液体分别用超纯水补体积至200μl。
7.两管各取25μl纯化与浓缩的蛋白质液体,利用Brandford法测蛋白质浓度,对提取的蛋白质进行定量。
8.提取的蛋白质经过Brandford法进行定量,标准曲线如图4所示,计算后PEB提取液的蛋白质浓度为188.5μg/ml,体积为0.175ml总量约为33μg;EXB提取液的蛋白质浓度为114.3μg/ml,体积为0.175ml总量约为20μg;
9.对提取的蛋白质进行SDS-PAGE胶,跑胶制样,如图5所示。
10.切胶制样后对蛋白质进行脱色酶解(具体步骤见“蛋白质纯化与酶解”),两组样本同时进行质谱分析与搜库(具体步骤见质谱分析)。
结果表明:利用PEB试剂进行捕获组织的蛋白质的提取,共搜出1412个有效蛋白质,EXB试剂盒进行捕获组织的蛋白质的提取,共搜出990个有效蛋白质。通过对商品化的FFPE Tissue Extraction Buffer(EXB)试剂盒与PEB试剂进行蛋白质提取的比对,发现采用PEB试剂进行蛋白质的提取的实验流程更简洁,获得的质谱蛋白数更多,因此,采用PEB试剂对蛋白质进行提取和定量。
蛋白质纯化与酶解
1、蛋白电泳SDS-PAGE:对切割后获得的各个等级组织用PEB试剂进行蛋白质提取的样品在10%SDS polyacrylamide gel中进行蛋白电泳,考马斯亮蓝染色,脱色。
2、切胶:将每个泳道的蛋白条带平行分割成3~4块胶块,每个胶块切碎成约1mm×1mm的小胶块,装入带滤膜的96孔板上。
3、脱色:
(1)每孔中分别加入150μl 50mM NH4HCO3/50%乙腈,放置30min。
(2)200g离心1min,将液体离心至底部收集板中,舍弃液体。
(3)加150μl 100%乙腈放置30min,胶块脱水变白,200g离心1min,舍弃底部收集板中的液体。
(4)加100μL 50mM NH4HCO3,室温放置10min。
(5)加100μl of 50mM NH4HCO3/50%乙腈,放置20min,离心掉液体。
(6)加150μl 100%乙腈放置20min,胶块脱水变白,200g离心1min,舍弃底部收集板中的液体。
4、酶解:更换一个新的96孔底部收集板,加入胰蛋白酶溶液约70~120μL,4℃放置45min,加50μL 50mM NH4HCO3,过夜酶解。
5、回收肽段:加150μL 0.1%TFA/50%乙腈,放置30~40min,200g离心1min,重复一次。加150μL 0.1%TFA/80%乙腈,放置30~40min,200g离心1min。将收集板中的液体移至1.5mL的EP管中。
6、干燥存储:在真空干燥仪SpeedVac中抽干液体,样品保存在–20℃以待后续质谱分析。
质谱分析(LC-MS/MS)
1.肽段通过nanoflow HPLC(Thermo Fisher Scientific)分离,利用与之相连的四级杆轨道离子阱质谱(Q-Exactive Thermo Fisher Scientific)进行分析。每一例患者样本被分为四组,在同一质谱方法下,共16组样本,同批次进样。
2.质谱仪参数设置,为label-free定量定性分析参数。
数据处理:
1.利用MaxQuant software environment(version1.4.3.9)软件进行label-free分析。肽段和蛋白的假阳性检出率被设置为0.01,检出数据在Uniprot数据库进行搜索。
2.对获得质谱数据进行生物信息学的筛选。筛选所有unique peptide+razor≥1的蛋白,A、B、C和D四个病人的所有样本共筛选得到1328个蛋白质。
3.分析每例样本中4组鉴定出的蛋白质,分别用I、II、III和IIII表示正常食管鳞状上皮组织蛋白质、低级别上皮内瘤变组织蛋白质、高级别上皮内瘤变组织蛋白质和原位癌组织蛋白质,这四种蛋白至少在病人A、病人B、病人C和病人D的4个病人中的一个病人的数据中出现,如下图6所示4组均出现的蛋白质筛选后有528个。
4.对筛选得到的528个蛋白质进行两两分组差异表达分析,结果在DEPs for each pairwise comparision.csv文件中,如下图7所示,得到包括HGIEN和LGIEN相比有统计学差异意义的蛋白质(fc3列),共329个蛋白质。图7中ProteinName(蛋白名),ProteinId(蛋白uniprot编号),GeneSymbol(基因名称),fc(对数处理后的差异表达幅度,>1或者<-1相当于上调2倍或者下调2倍),Tp.value(成对T检验p值,<0.05为显著差异)。1,2,3,4,5,6分别表示四个分组阶段(I,II,III,IIII)之间的两两比对,分别为II VS I,III VS I,III VS II,IIII VSI,IIII VS III,IIII VS II;以及其在HGIEN中较LGIEN下调的数值。
对图7中得到的分析数据进行分析,筛选III VS II即第3个分组阶段fc3和Tp.value3对应列下的数据,筛选fc值绝对值最大的蛋白质(即差异最大的蛋白质)即为与HGIEN和LGIEN相比有统计学差异意义的蛋白质,图中的筛选结果为基因名称是TGM3的蛋白质。
IHC实验验证
1.在http://www.proteinatlas.org/网站查找得到TGM3蛋白质的抗体;购买TGM3抗体,通过IHC方法(利用Roche公司的BENCHMARK-XT全自动染色仪)进行验证;
2.取某病人临床ESD术后FFPE标本(本项目中筛选出LGIEN和HGIEN在同一蜡块组织上的标本为例),进行IHC染色;
4.结果如图18所示,①②③分别为HE染色在4x、20x、20x显微镜下显示LGIEN和HGIEN中的差异表达图像;④⑤⑥分别为同一例样本的TGM3抗体在4x、20x、20x显微镜下显示LGIEN和HGIEN中的差异表达图像;其中②和⑤分别是HGIEN的HE和IHC染色在20x显微镜下显示图像;③和⑥是LGIEN N的HE和IHC染色在20x显微镜下显示图像;可见TGM3在食管鳞状上皮组织的胞质和核均着色。利用图像处理分析软件Image Pro Plus 6.0,计算平均着色强度,以均数±标准差(Mean±SD,x±s)表示。按照x水平将TGM3染色结果分为低表达组(+)和高表达组(++)。其中⑤为低表达组(+);⑥为高表达组(++);HE染色结果和免疫组织化学染色结果完全匹配,证明TGM3的特异性较好与区分LGIEN,HGIEN的灵敏度较高。通过HE染色结果判断的LGIEN和HGIEN分别的IHC染色的强弱比对,证明本标记蛋白质是可以有效的区分LGIEN和HGIEN的蛋白质。
临床病理诊断应用
将在临床病理诊断中,LGIEN和HGIEN诊断存在争议的病例病理切片进行TGM3抗体的IHC染色,根据染色结果能轻松客观的做出准确判读。应用如图19所示。在图19中①③为HE染色后不确定分级的ESD术后食管鳞状上皮组织;②④为TGM3抗体的IHC染色结果。根据染色结果比对图18,可见②着色较④浅,与HE染色进行比对后判定②为HGIEN,④为LGIEN,准确简易的对这一例标本进行了病理诊断分级。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于血癌分析与临床处理的细胞抗原及靶信号转导蛋白的复合分布的制作方法
- 鳞状细胞癌抗原阴性宫颈癌血清蛋白质检测的质谱试剂盒的制作方法
- 鳞状细胞癌抗原(scc)定量测定试剂盒及其检测方法
- 一种从血清代谢轮廓筛选恶性卵巢肿瘤标志物的方法
- 一种癌抗原ca15-3的纳米磁微粒化学发光测定试剂盒及其制备方法和检测方法
- 鳞状细胞癌抗原化学发光免疫分析定量测定试剂盒及其制备方法
- 全防紫外线抗疲劳及防恶性黑色素细胞癌光学防护材料的制作方法
- 用于产生针对细胞相关抗原如p2x7、cxcr7或cxcr4的免疫球蛋白的基因免疫的制作方法
- 抗人前列腺特异性膜抗原胞外区单链抗体及其应用的制作方法
- 用于单独测定scca同形异构体的免疫测定法的制作方法