基于量子点的CA125免疫层析试纸条的制备方法与流程
本发明涉及医药诊断技术领域,更具体的是涉及一种新型的基于量子点的CA 125免疫层析试纸条的制备方法。
背景技术:
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势,美国8名妇女一生中就会有1人患乳腺癌。我国虽不是乳腺癌的高发国家,但不宜乐观,近年我国乳腺癌发病率的增长速度却高出高发国家1~2个百分点。位居女性恶性肿瘤的第1位。女性乳腺癌发病率(粗率)全国合计为42.55/10万,城市为51.91/10万,农村为23.12/10万。乳腺癌的早期发现、早期诊断,是提高疗效的关键。因此研究乳腺癌早期诊断方法有重大意义。
血清糖类抗原(Carbohydrate antigen,CA)125是一种广谱肿瘤标志物,乳腺癌患者通常伴随着该物质的血清含量升高,正常人血清中CA 125的含量尚不到35U/mL。因此CA 125血清水平是乳腺癌患者检测的一项关键指标。对乳腺癌的早期诊断,术后监测有重大作用。
免疫层析技术是将免疫标记技术与层析技术结合的一种新型检测技术,其原理是将特异的抗体(或抗原)作为捕获试剂固定于硝酸纤维素膜的特定区域,加入待测样品后,在毛细作用力的推动下,待测样品沿着膜向前移动,当移动至固定有捕获试剂的区域时,样品中的抗原(或抗体)与捕获试剂发生特异性结合,标记试剂(如胶体金,酶等)则显示出一定的颜色从而实现特异性检测的免疫分析方法。其中胶体金免疫层析试纸条已广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。但胶体金作为标记物,抗原浓度低的样本检测条带颜色太浅无法用肉眼识别,限制了其在检测血清肿瘤标志物的应用。量子点(QDs)是一种半导体纳米晶,它具有宽激发谱、窄发射谱、荧光效率高、光稳定性好等优点,是一种备受关注的新型荧光探针。用量子点取代传统的胶体金作为标记物可以弥补胶体金标记的不足。所以本文拟研制基于量子点的CA 125免疫荧光试纸条,从而实现对乳腺癌肿瘤标志物进行快速、方便、灵敏检测,建立乳腺癌检测的新方法。
技术实现要素:
鉴于肿瘤标志物在肿瘤检测中的重要地位、量子点纳米粒子独特的光学性质以及层析技术简便和价格方面的优势。我们将结合量子点和免疫层析试纸条两种技术,利用量子点羧基和CA 125单克隆抗体(Ab1)的氨基反应,制得量子点荧光探针QDs@Ab1。探针、CA 125和包埋在试纸条的另一种CA 125抗体(Ab1’)通过抗体抗原之间的作用,形成一种类似夹心的结构QDs@Ab1-CA 125-Ab1’。对CA 125——乳腺癌肿瘤标志物进行定性定量的检测,建立肿瘤标志物检测的新方法,致力于简单迅速、价格低廉、定性定量、操作简便的乳腺癌诊断方法。
本发明的技术方案如下:
基于量子点的CA 125免疫层析试纸条的制备方法;其步骤如下:
(1)将水溶性量子点与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐加入到反应器,然后向反应器中加入Tris-HCl缓冲液,在旋转混合架上活化量子点的羧基;
(2)反应结束后,采用离心分离进行纯化,用Tris-HCl缓冲液清洗以除去未反应的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,得到活化的水溶性量子点;
(3)将活化的量子点、CA 125单克隆抗体按照摩尔比为1:40~80比例混合于Tris-HCl缓冲液中,涡旋仪上旋转使其混匀,将混合溶液置于旋转混合架上,室温下反应2~3小时;
(4)反应结束后,采用离心分离进行纯化,用Tris-HCl缓冲液清洗除去游离的抗体和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,得到荧光探针QDs@Ab1,然后将产物分散在含有1~5%牛血清白蛋白的Tris-HCl缓冲液中,4℃静置过夜;
(5)将另一种CA 125抗体以及羊抗鼠IgG用Tris-HCl缓冲液稀释到1~2mg/mL,用点样仪喷于硝酸纤维素膜上以形成T线和C线;
(6)将样品垫和结合垫进行预处理;
(7)用含1%的BSA、1%的PEG-4000、0.1%的Tween-20、1%的蔗糖的Tris-HCl缓冲液作为稀释液,对封闭后的水溶性量子点-CA 125单克隆抗体(QDs@Ab1)混合液进行稀释,稀释倍数为5倍,并将稀释后的溶液均匀滴加在预处理后的结合垫上,静置5min,并随后于37℃恒温干燥箱中至完全干燥,得到终处理的结合垫,封袋置于4℃保存备用;
(8)将预处理的样品垫,终处理的结合垫、硝酸纤维素膜、吸水垫按顺序固定于单面塑胶板上,各个垫和膜之间相互重叠1~3mm,完成试纸条的组装。
定性检测:用于激发量子点的紫外灯波长范围为320nm~420nm的普通紫外灯即可;根据双抗夹心的原理,当待测样本中含有CA 125时,复合物将同时被T线和C线捕获,紫外灯照射下出现两条荧光条带,检测结果为阳性;反之,检测样本中不含CA 125时,则只在 C线位置出现荧光条带,检测结果为阴性;如果T线和C线都不出荧光现条带则说明检测无效。(如图1,图2所示)
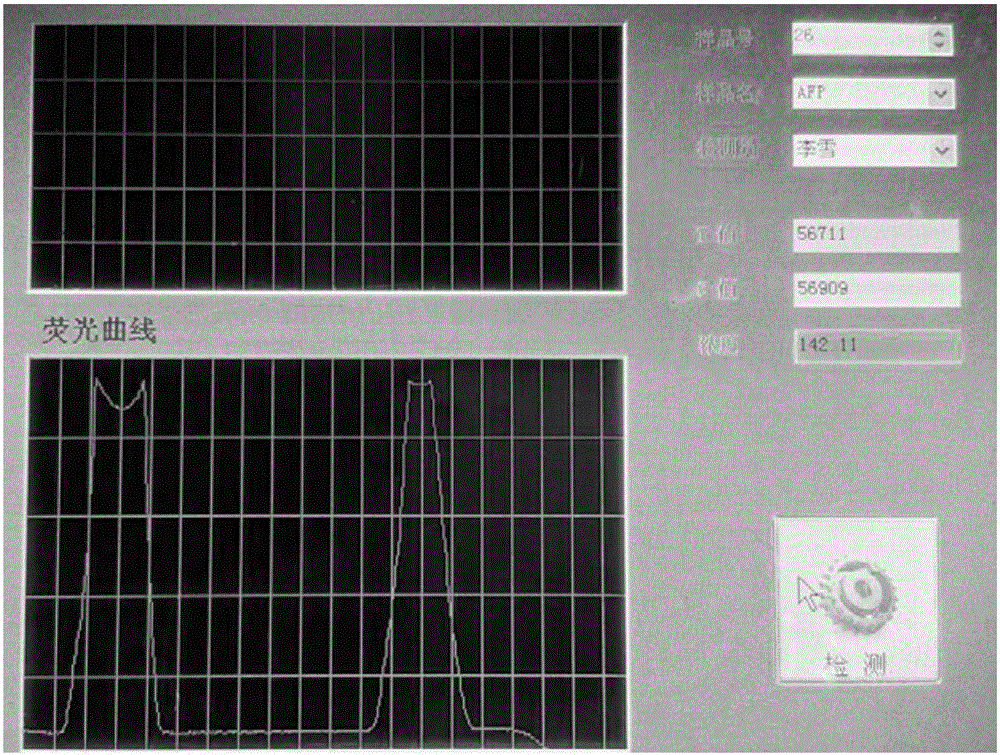
通过一系列浓度梯度的CA 125标准液滴加到免疫层析试纸条上,20分钟后用检测仪读取T线和C线的荧光强度数值,并建立Log(T/C)与CA 125浓度的相对应关联公式,将待测样本检测获得的T线与C线数值通过公式,计算出其CA 125的浓度。
所述的方法中,所述量子点是聚(叔丁基丙烯酸脂-乙基丙烯酸脂-甲基丙烯酸)三嵌段共聚物改性CdZnSe量子点得到的水溶性量子点。(如图3所示)
所述反应体系是Tris-HCl缓冲液。
所述量子点与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐质量分数比为1:4000~10000。
所述样品垫预处理方法如下,样品垫浸入含Tween-20 0.1%~2%的Tris-HCl缓冲液中静置5-10min,然后放入37℃恒温干燥箱中干燥2~4小时,封袋置于4℃保存备用。
所述结合垫预处理方法如下,结合垫浸入含BSA、亲水聚合物、表面活性剂、蔗糖的Tris-HCl缓冲液的处理液中,静置5~10min,然后置于37℃恒温干燥箱中干燥2~4小时,封袋置于4℃保存备用。
所述处理液配方如下:中BSA浓度为1%~4%,亲水聚合物浓度为0.5%~5%,表面活性剂浓度为0.1%~2%,蔗糖浓度为1%~10%。
本发明制备的新型基于量子点的CA 125免疫层析试纸条优势在于:
1.采用量子点这种具有优异的光学性质,已经被广泛应用于示踪、成像以及标记等方面的纳米材料作为探针荧光来源,将纳米技术应用到肿瘤检测领域。
2.采用免疫层析技术作为检测用的基材,免疫层析技术因其简单迅速、价格低廉、可以随时随地等优点在检测领域处于特殊重要的地位。
3.采用量子点的羧基和抗体的氨基之间的反应形成的牢固的化学键,而非传统的静电吸附作用,提高了试纸条抵抗非特异性吸附的能力,量子点荧光强度和CA 125浓度之间正相关关系可同时实现定性和定量检测,特异性强、灵敏度高(图4)。
附图说明
图1:本发明制备的基于量子点的CA 125免疫层析试纸条阴性样品的检测图片。
图2:本发明制备的基于量子点的CA 125免疫层析试纸条阳性样品的检测图片。
图3:本发明制备的基于量子点的CA 125免疫层析试纸条的量子点透射电镜照片
图4:本发明制备的基于量子点的CA 125免疫层析试纸条的特异性实验数值。
图5:实施例1制备的基于量子点的CA 125免疫层析试纸条样品定量检测拟合曲线。
图6:实施案例2制备的基于量子点的CA 125免疫层析试纸条样品定量检测拟合曲线。
图7:实施案例3制备的基于量子点的CA 125免疫层析试纸条样品定量检测拟合曲线。
具体实施方式
下面的实施案例中将对本发明作进一步的阐述,但本发明不限于此。
实施案例1:
1.量子点偶联CA 125抗体(QDs@Ab1)
(1)将水溶性量子点、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)水溶液按照原料质量比为1:4000比例混合于Tris-HCl缓冲液中,在旋转混合架上活化量子点的羧基30min,离心得到活化的量子点。
(2)将活化的量子点、CA 125抗体Ab1按照摩尔比为1:40比例混合于Tris-HCl缓冲液中,将混合溶液置于旋转混合架上,室温下反应2小时;
(3)反应结束后,采用离心分离进行纯化,用Tris-HCl缓冲液清洗三次以除去游离的抗体和EDC,得到荧光探针QDs@Ab1,最后将产物分散在含有1%牛血清白蛋白(BSA)的Tris-HCl缓冲液中,4℃静置过夜。
2.抗体的固定
将CA 125另一位点的抗体(Ab1’)以及羊抗鼠IgG(二抗,Ab2)用Tris-HCl缓冲液稀释到1mg/mL,用点样仪喷于硝酸纤维素膜上以形成T线和C线,然后置于37℃恒温干燥箱中干燥2小时。
3.样品垫、结合物释放垫的预处理以及荧光探针的固化
(1)将样品垫浸入含0.1%Tween-20的Tris-HCl缓冲液中静置5min,然后放入37℃恒温干燥箱中干燥2小时,封袋置于4℃保存备用。
(2)结合垫浸入含1%的BSA、0.5%的PEG-4000、0.1%的TritonX-100、1%的蔗糖的Tris-HCl缓冲液中,静置5min,然后置于37℃恒温干燥箱中干燥2小时,封袋置于4℃保存备用。
(3)将所得荧光探针QDs@Ab1用含1%的BSA、0.5%的PEG-4000、0.1%的TritonX-100、1%的蔗糖的Tris-HCl缓冲液稀释5倍,均匀涂覆在上述已处理的结合物释放垫上,静置5min后于37℃恒温干燥箱中干燥2小时,封袋置于4℃保存备用。
4.试纸条的组装
(1)将所得样品垫,结合物释放垫、硝酸纤维素膜、吸水垫按顺序固定于单面塑胶板上,各个垫和膜之间相互重叠1mm,完成试纸条的组装。
(2)用自动切膜机将组装好的试纸条进行切割,宽度约为3mm,并将其装入塑料板中,最后将其与干燥剂一起装入铝箔袋内密封储存。
5.样品的测试和结果判读
(1)定性和半定量检测:用于激发量子点的紫外灯波长范围为320nm~420nm的普通紫外灯即可;根据夹心免疫的原理,当待测样本中含有CA 125时,复合物将同时被T线和C线捕获,T线生成复合物QDs@Ab1-CA 125-Ab1’,C线生成复合物QDs@Ab1-Ab2。紫外灯照射下出现两条荧光条带,检测结果为阳性;反之,检测样本中不含CA 125时,则只在C线位置出现荧光条带,检测结果为阴性;如果T线和C线都不出荧光现条带则说明检测无效。条带颜色越深说明待测样本中含有的CA 125含量越高。
(2)定量检测:配置一系列浓度梯度的CA 125标准液,如:15U/mL,50U/mL,100U/mL,250U/mL,500U/mL,取50uL滴加到免疫层析试纸条上,10min后用检测仪读取T线和C线的荧光强度,分别将T/C的荧光强度及对应的抗原浓度做拟合曲线,得到荧光强度与浓度对应的公式。拟合曲线见说明书附图5。
实施案例2:
1.量子点偶联CA 125抗体(QDs@Ab1)
(1)将水溶性量子点、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)水溶液按照原料质量比为1:6000比例混合于Tris-HCl缓冲液中,在旋转混合架上活化量子点的羧基30min,离心得到活化的量子点。
(2)将活化的量子点、CA 125抗体Ab1按照摩尔比为1:60比例混合于Tris-HCl缓冲液中,将混合溶液置于旋转混合架上,室温下反应2.5小时;
(3)反应结束后,采用离心分离进行纯化,用Tris-HCl缓冲液清洗三次以除去游离的抗体和EDC,得到荧光探针QDs@Ab1,最后将产物分散在含有2%牛血清白蛋白(BSA)的Tris-HCl缓冲液中,4℃静置过夜。
2.抗体的固定
将CA 125另一位点的抗体(Ab1’)以及羊抗鼠IgG(二抗,Ab2)用Tris-HCl缓冲液稀释到2mg/mL,用点样仪喷于硝酸纤维素膜上以形成T线和C线,然后置于37℃恒温干燥箱中干燥3小时。
3.样品垫、结合物释放垫的预处理以及荧光探针的固化
(1)将样品垫浸入含1%Tween-20的Tris-HCl缓冲液中静置5min,然后放入37℃恒温干燥箱中干燥2小时,封袋置于4℃保存备用。
(2)结合垫浸入含2%的BSA、3%的PVP-10000、1%的Tween-20、7%的蔗糖的Tris-HCl缓冲液中,静置5min,然后置于37℃恒温干燥箱中干燥3小时,封袋置于4℃保存备用。
(3)将所得荧光探针QDs@Ab1用含2%的BSA、3%的PVP-10000、1%的Tween-20、7%的蔗糖的Tris-HCl缓冲液稀释10倍,均匀涂覆在上述已处理的结合物释放垫上,静置5min后于37℃恒温干燥箱中干燥3小时,封袋置于4℃保存备用。
4.试纸条的组装
(1)将所得样品垫,结合物释放垫、硝酸纤维素膜、吸水垫按顺序固定于单面塑胶板上,各个垫和膜之间相互重叠2mm,完成试纸条的组装。
(2)用自动切膜机将组装好的试纸条进行切割,宽度约为3mm,并将其装入塑料板中,最后将其与干燥剂一起装入铝箔袋内密封储存。
5.样品的测试和结果判读
(1)定性和半定量检测:用于激发量子点的紫外灯波长范围为320nm~420nm的普通紫外灯即可;根据夹心免疫的原理,当待测样本中含有CA 125时,复合物将同时被T线和C线捕获,T线生成复合物QDs@Ab1-CA 125-Ab1’,C线生成复合物QDs@Ab1-Ab2。紫外灯照射下出现两条荧光条带,检测结果为阳性;反之,检测样本中不含CA 125时,则只在C线位置出现荧光条带,检测结果为阴性;如果T线和C线都不出荧光现条带则说明检测无效。条带颜色越深说明待测样本中含有的CA 125含量越高。
(2)定量检测:配置一系列浓度梯度的CA 125标准液,如:15U/mL,50U/mL,100U/mL,250U/mL,500U/mL,取50uL滴加到免疫层析试纸条上,20min后用检测仪读取T线和C线的荧光强度,分别将T/C的荧光强度及对应的抗原浓度做拟合曲线,得到荧光强度与浓度对应的公式。拟合曲线见说明书附图6。
实施案例3:
1.量子点偶联CA 125抗体(QDs@Ab1)
(1)将水溶性量子点、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)水溶液按照原料质量比为1:10000比例混合于Tris-HCl缓冲液中,在旋转混合架上活化量子点的羧基30min,离心得到活化的量子点。
(2)将活化的量子点、CA 125抗体Ab1按照摩尔比为1:80比例混合于Tris-HCl缓冲液中,将混合溶液置于旋转混合架上,室温下反应3小时;
(3)反应结束后,采用离心分离进行纯化,用Tris-HCl缓冲液清洗三次以除去游离的抗体和EDC,得到荧光探针QDs@Ab1,最后将产物分散在含有5%牛血清白蛋白(BSA)的Tris-HCl缓冲液中,4℃静置过夜。
2.抗体的固定
将CA 125另一位点的抗体(Ab1’)以及羊抗鼠IgG(二抗,Ab2)用Tris-HCl缓冲液稀释到2mg/mL,用点样仪喷于硝酸纤维素膜上以形成T线和C线,然后置于37℃恒温干燥箱中干燥4小时。
3.样品垫、结合物释放垫的预处理以及荧光探针的固化
(1)将样品垫浸入含2%Tween-20的Tris-HCl缓冲液中静置10min,然后放入37℃恒温干燥箱中干燥4小时,封袋置于4℃保存备用。
(2)结合垫浸入含4%的BSA、5%的PVP-40000、2%的Tween-20、10%的蔗糖的Tris-HCl缓冲液中,静置10min,然后置于37℃恒温干燥箱中干燥4小时,封袋置于4℃保存备用。
(3)将所得荧光探针QDs@Ab1用含4%的BSA、5%的PVP-40000、2%的Tween-20、10%的蔗糖的Tris-HCl缓冲液稀释20倍,均匀涂覆在上述已处理的结合物释放垫上,静置10min后于37℃恒温干燥箱中干燥4小时,封袋置于4℃保存备用。
4.试纸条的组装
(1)将所得样品垫,结合物释放垫、硝酸纤维素膜、吸水垫按顺序固定于单面塑胶板上,各个垫和膜之间相互重叠3mm,完成试纸条的组装。
(2)用自动切膜机将组装好的试纸条进行切割,宽度约为3mm,并将其装入塑料板中,最后将其与干燥剂一起装入铝箔袋内密封储存。
5.样品的测试和结果判读
(1)定性和半定量检测:用于激发量子点的紫外灯波长范围为320nm~420nm的普通紫外灯即可;根据夹心免疫的原理,当待测样本中含有CA 125时,复合物将同时被T线和C线捕获,T线生成复合物QDs@Ab1-CA 125-Ab1’,C线生成复合物QDs@Ab1-Ab2。紫外灯照射下出现两条荧光条带,检测结果为阳性;反之,检测样本中不含CA 125时,则只在C线位置出现荧光条带,检测结果为阴性;如果T线和C线都不出荧光现条带则说明检测无效。条带颜色越深说明待测样本中含有的CA 125含量越高。
(2)定量检测:配置一系列浓度梯度的CA 125标准液,如:15U/mL,50U/mL,100U/mL,250U/mL,500U/mL,取50uL滴加到免疫层析试纸条上,30min后用检测仪读取T线和C线的荧光强度,分别将T/C的荧光强度及对应的抗原浓度做拟合曲线,得到荧光强度与浓度对应的公式。拟合曲线见说明书附图7。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺