检测三聚氰胺残留的荧光微球免疫层析试纸条及其制备方法和应用与流程
本发明属于食品安全中非法添加物检测领域,具体涉及一种检测样品中三聚氰胺残留的荧光微球免疫层析试纸条及其制备方法和应用。
技术背景
三聚氰胺简称三胺,化学名1,3,5-三嗪-2,4,6-三氨,分子式为C3N6H6,相对分子质量为126.12,是一种低毒无味的纯白色单斜棱晶体,广泛应用于涂料、建材、造纸、皮革、纺织等行业中。由于三聚氰胺的含氮量高达66%,是蛋白质平均含氮量的4倍,而常用的凯氏定氮法测定样品中的蛋白质含量时却不能区分这种非蛋白氮,因此被不法商贩利用添加在饲料和食品中以提高食品和饲料中粗蛋白质检测数值。动物实验表明,三聚氰胺对于哺乳动物属于微毒、低毒类化学物质,长期饲喂可能造成生殖、泌尿系统的损害,膀胱、肾部出现结石,并可进一步诱发膀胱癌。联合国负责食品安全标准的机构国际食品法典委员会2010年7月6日表示,该委员会已就食品中三聚氰胺的允许含量设立了新标准。新标准规定,每千克婴儿配方奶粉中的三聚氰胺含量不能超过1mg,而每千克其他食品或动物饲料中的三聚氰胺含量不能超过2.5mg。因此,加强对三聚氰胺检测技术的研究和快速检测技术的发展是非常有必要的。
目前,检测三聚氰胺比较经典的方法有高效液相色谱法(HPLC)、液相色谱-质谱/质谱法(LC-MS/MS)、气相色谱-质谱联用法(GC-MS)等,这些都是比较传统的方法,也是目前的确证方法。另外,目前常用的还有酶联免疫法(ELISA)。但由于以上方法均需先进检测仪器,检测费用昂贵、步骤繁琐耗时,且对操作人员专业性要求较高,不适用于基层企事业单位的大通量快速筛查检测。胶体金免疫层析法具有检测速度快、价格便宜、操作简单等优点,是目前国内外检测三聚氰胺的主要监控方法,但仍存在一些缺陷,如稳定性较差、灵敏度较低、无法实现定量检测、基质效应明显背景干扰大,且颜色单一,难以实现多检和联检。
荧光微球免疫层析技术是继胶体金免疫层析技术后,在荧光染料标记技术上发展起来的,作为一种免疫学检测方法,它是免疫亲和技术、免疫标记技术、免疫层析技术的结合,与胶体金免疫层析技术一样具有快速、操作简便等优点。但是相比胶体金等传统标记物,荧光微球的发光强度可以随激发光的强度增强而增强,所以荧光微球标记有望提高免疫层析技术的检测限;而在微球壳结构的作用下,荧光微球具有相对稳定的形态结构,粒度均一、单分散性好、稳定性好、发光效率高、重复性好,有较好的生物相容性;且形成微球后染料荧光猝灭大大减少,发射强而稳定,且基本不受外界环境介质变化的影响。因此相比上述检测方法,荧光微球免疫层析技术同时具有检测灵敏度高、操作简便的优点。
技术实现要素:
本发明的一个目的是针对上述现有技术的缺陷,提供一种灵敏度高、操作简便、检测快速、价格低廉的检测三聚氰胺残留的荧光微球免疫层析试纸条;本发明的另一个目的是提供上述试纸条的制备方法;本发明的再一个目的是提供上述试纸条在检测三聚氰胺中的应用。
为了实现上述目的,本发明采取的一个技术方案是:
提供一种检测三聚氰胺残留的荧光微球免疫层析试纸条,它包括底板及在底板上依次搭接粘贴的样品结合垫、硝酸纤维素膜和吸水垫,所述样品结合垫上包埋有荧光微球标记的抗三聚氰胺单克隆抗体,所述硝酸纤维素膜上固定有检测区和质控区,检测区喷涂有三聚氰胺半抗原-载体蛋白偶联物,质控区喷涂有羊抗鼠抗抗体。
所述三聚氰胺半抗原-载体蛋白偶联物是由三聚氰胺半抗原与载体蛋白偶联得到,所述载体蛋白为牛血清白蛋白、卵清白蛋白、血蓝蛋白、甲状腺蛋白或人血清白蛋白,所述三聚氰胺半抗原是由三聚氰胺与琥珀酰亚胺基丙醛反应得到,分子结构式为:
所述荧光微球是直径为100~300nm的用聚苯乙烯包裹荧光物质的微球,其表面连接有—COOH基团,所述荧光物质为异硫氰酸荧光素。
本发明采取的另一个技术方案是提供一种制备上述检测三聚氰胺残留的荧光微球免疫层析试纸条的方法,它包括如下步骤:
1)样品结合垫的制备:用市售的荧光微球标记抗三聚氰胺单克隆抗体,并将其以特定缓冲体系稀释后,将样品结合垫浸泡于稀释缓冲液中,经真空冷冻干燥后制备;
2)硝酸纤维素膜的制备:将三聚氰胺半抗原-载体蛋白偶联物喷涂到硝酸纤维素膜上的检测区范围,制成检测区;将羊抗鼠抗抗体喷涂到硝酸纤维素膜上的质控区范围,制成质控区;
3)组装和剪切:在底板上依次搭接地粘贴包埋有荧光微球标记抗三聚氰胺单克隆抗体的样品结合垫、固定有检测区和质控区的硝酸纤维素膜及吸水垫,并剪切成所需的宽度即为荧光微球免疫层析试纸条。
具体地说,步骤包括:
1)将三聚氰胺与琥珀酰亚胺基丙醛反应,制备三聚氰胺半抗原;
2)将三聚氰胺半抗原与载体蛋白偶联,制备三聚氰胺半抗原-载体蛋白偶联物;
3)用三聚氰胺半抗原-载体蛋白偶联物免疫小鼠,将小鼠脾细胞和小鼠骨髓瘤细胞通过融合、筛选,得到分泌三聚氰胺单克隆抗体的杂交瘤细胞株;
4)提取小鼠IgG免疫健康山羊,得到羊抗鼠抗抗体;
5)分别将三聚氰胺半抗原-载体蛋白偶联物和羊抗鼠抗抗体喷涂到硝酸纤维素膜的检测区范围(T)和质控区范围(C);
6)将样品结合垫用含牛血清白蛋白(牛血清白蛋白在缓冲体系中的终浓度为0.5%体积百分含量)、pH7.2、0.1mol/L的磷酸盐缓冲液均匀浸泡2h,37℃下烘干2h;
7)用市售的荧光微球标记抗三聚氰胺单克隆抗体,并将其以特定缓冲体系稀释后,将6)处理过的样品结合垫浸泡于稀释缓冲液中,经真空冷冻干燥后备用;
8)在底板上依次搭接地粘贴包埋有荧光微球标记抗三聚氰胺单克隆抗体的样品结合垫、固定有检测区和质控区的硝酸纤维素膜及吸水垫,并剪切成所需的宽度即为荧光微球免疫层析试纸条。
本发明采取的另一个技术方案是提供一种上述检测三聚氰胺残留的荧光微球免疫层析试纸条在检测三聚氰胺中的应用,它包括如下步骤:
1)样品前处理;
2)用所述的检测三聚氰胺残留的荧光微球免疫层析试纸条进行检测;
3)用荧光检测仪分析检测结果。
与现有技术相比,本发明具有以下有益效果:
(1)特异性强、灵敏度高:本试纸条采用将荧光微球标记的抗三聚氰胺单克隆抗体包埋在样品结合垫上,具有亲水性佳、可大容量吸附抗体偶联物、迅速重湿润、抗体结合物释放充分、性能好、释放快、形态好等优势,从而减少误差,降低成本,增加整个体系的反应灵敏度;
(2)荧光微球表面包裹了聚苯乙烯,实现了对荧光物质异硫氰酸荧光素的保护,减少了外界环境的干扰,增加了荧光微球的稳定性及荧光寿命;
(3)荧光微球表面修饰活性基团—COOH,采用化学偶联的方法来标记抗体,形成抗体与微球的稳定结合。
附图说明
图1为荧光微球免疫层析试纸条剖面结构示意图;
图2为荧光微球免疫层析试纸条俯视图;
图3为三聚氰胺半抗原合成路线图;
图4为三聚氰胺半抗原核磁共振氢谱图。
具体实施方式
下面结合实施例及附图对本发明做进一步详细的描述,但本发明的实施方式不限于此。
实施例1检测三聚氰胺残留的荧光微球免疫层析试纸条的构成
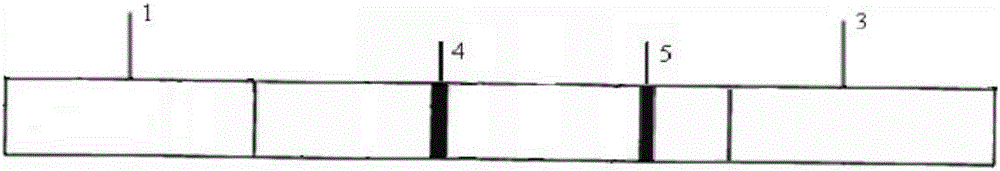
所述试纸条(图1、图2)是由底板、样品结合垫、硝酸纤维素膜和吸水垫组成;
所述样品结合垫1、硝酸纤维素膜2和吸水垫3依次按顺序搭接粘贴在底板6上,样品结合垫的末端与硝酸纤维素膜的始端相连,硝酸纤维素膜的末端与吸水垫的始端相连,样品结合垫的始端与底板的始端对齐,吸水垫的末端与底板的末端对齐;
所述硝酸纤维素膜上固定有检测区4和质控区5,检测区喷涂有三聚氰胺半抗原-载体蛋白偶联物(三聚氰胺半抗原-卵清白蛋白偶联物),质控区喷涂有羊抗鼠抗抗体;
所述底板为PVC底板;所述样品结合垫为玻璃棉;所述吸水垫为吸水纸。
实施例2检测三聚氰胺残留的荧光微球免疫层析试纸条的制备
检测三聚氰胺残留的荧光微球免疫层析试纸条的制备方法主要包括以下步骤:
1)样品结合垫的制备:用市售的荧光微球标记抗三聚氰胺单克隆抗体,并将其以特定缓冲体系稀释后,将样品结合垫浸泡于稀释缓冲液中,经真空冷冻干燥后制备;
2)硝酸纤维素膜的制备:将三聚氰胺半抗原-载体蛋白偶联物喷涂到硝酸纤维素膜上的检测区范围,制成检测区;将羊抗鼠抗抗体喷涂到硝酸纤维素膜上的质控区范围,制成质控区;
3)组装和剪切:在底板上依次搭接地粘贴包埋有荧光微球标记抗三聚氰胺单克隆抗体的样品结合垫、固定有检测区和质控区的硝酸纤维素膜及吸水垫,并剪切成所需的宽度即为荧光微球免疫层析试纸条。
下面分步详细叙述:
(一)各部件的制备
1、三聚氰胺半抗原-载体蛋白偶联物的合成与鉴定
三聚氰胺是小分子物质,只有免疫反应性,没有免疫原性,不能诱发机体产生免疫应答,必须与大分子载体蛋白偶联后才具有免疫原性。
(1)三聚氰胺半抗原的制备(图3)
取三聚氰胺0.5g,加乙醇80mL溶解,加琥珀酰亚胺基丙醛0.67g,加三乙胺0.1mL,60℃油浴加热,搅拌反应4h。停止反应冷却到室温,转入0~5℃低温下平衡温度30min,搅拌,加硼氢化钠0.3g,继续搅拌2h。停止反应,旋蒸,除去乙醇,加水,乙酸乙酯,萃取,无水硫酸钠干燥蒸干,上硅胶柱进行层析纯化,洗脱液二氯甲烷/甲醇(v/v,10/1)洗脱分离,得到半抗原产物0.91g,收率87.19%。1H NMR(CDCl3,300MHz)δ:6.99(4H,s),6.94(2H,s),4.40(2H,t),4.0(1H,s),3.35(2H,t,J=7.500),1.83(1H,m,J=7.017)。
取上述产物经核磁共振氢谱测定,如图4所示,图谱中化学位移δ=4.40、3.35、1.83的为半抗原间隔臂上亚甲基氢共振吸收峰,δ=6.94的为间隔臂上双键氢的共振吸收峰,这些峰的存在,证明半抗原合成成功。。
(2)免疫原的制备
取牛血清白蛋白(BSA)50mg,加pH值为4.5的醋酸盐缓冲液5mL,溶解,加50mmol/L二硫苏糖醇(DTT)0.2mL,室温搅拌过夜,用1mol/L NaOH溶液调节pH到7.4,得到蛋白活化液A液;取4mg三聚氰胺半抗原产物,加甲醇0.2mL溶解澄清,得到B液;将B液逐滴加到A液中,继续搅拌5h,停止反应,0.02mol/L PBS缓冲液透析纯化3d,每天换液3次,得到免疫原,分装,-20℃保存备用。
(3)包被原的制备
取卵清白蛋白(OVA)50mg,加0.05mol/L的磷酸盐缓冲液5mL,溶解,加50mmol/L DTT 0.2mL,室温搅拌过夜,得到蛋白活化液A液;取3mg三聚氰胺半抗原产物,加乙醇100μL溶解,得到B液;将B液滴加到A液中,室温搅拌5h,0.02mol/L PBS缓冲液透析纯化3d,每天换液3次,得到包被原,分装,-20℃保存备用。
(4)三聚氰胺半抗原-载体蛋白偶联物的鉴定
将三聚氰胺半抗原、载体蛋白、三聚氰胺半抗原-载体蛋白偶联物用pH7.4的PBS缓冲液配成0.5mg/mL的溶液,以0.01mol/L pH7.4的PBS缓冲液调零,用紫外分光光度计在波长200~800nm范围内扫描,得到三聚氰胺半抗原、载体蛋白、三聚氰胺半抗原-载体蛋白偶联物的吸收曲线。三者出现不同的吸收曲线,表明三聚氰胺半抗原与载体蛋白偶联成功。
2、三聚氰胺单克隆抗体的制备
(1)动物免疫
将步骤1得到的免疫原注入Balb/c小鼠体内,免疫剂量为150μg/只,使其产生抗血清。
(2)细胞融合和克隆化
取产生特异性抗体的Balb/c小鼠脾细胞与骨髓瘤细胞SP20融合,采用间接竞争酶联免疫分析方法测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,得到并建立产单克隆抗体的杂交瘤细胞株。
(3)细胞冻存和复苏
取处于对数生长期的杂交瘤细胞用冻存液制成细胞悬液,分装于冻存管,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
(4)单克隆抗体的制备与纯化
采用体内诱生法,将Balb/c小鼠(8周龄)腹腔注入灭菌石蜡油,7~14天后腹腔注射杂交瘤细胞,7~10天后采集腹水。经辛酸-饱和硫酸铵法进行腹水纯化,纯度经SDS-PAGE电泳鉴定,小瓶分装,-20℃保存。
3、羊抗鼠抗抗体的制备
以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗抗体。
4、荧光微球标记抗三聚氰胺单克隆抗体的制备
(1)活化:取市售的内部包埋荧光染料、表面修饰有羧基官能团的微球悬液100μL混悬于900μL活化缓冲液中,于4℃10000r/min离心10min后弃上清,重悬微球于1mL活化缓冲液中,以此法洗涤微球2次,加入适量活化剂,混匀后室温震荡活化10min;
(2)偶联:将(1)所述混悬液于4℃10000r/min离心10min后弃上清,重悬于偶联缓冲液中,以此法洗涤微球2次,加入10~20μL抗三聚氰胺单克隆抗体溶液(蛋白浓度1mg/mL),混匀后室温震荡偶联120min;
(3)封闭:将(2)所述混悬液于4℃10000r/min离心10min后弃上清,重悬于封闭缓冲液中,以此法洗涤微球1次,混匀后室温震荡封闭30min;
(4)贮存:将(3)所述混悬液于4℃10000r/min离心10min后弃上清,重悬于贮存缓冲液中,以此法洗涤微球1次,混匀后于4℃避光保存。
所述活化缓冲液为pH 5.5~6.5、0.05mol/L的2-(N-吗啡啉)乙磺酸(MES)缓冲液。
所述活化剂为水溶性碳二亚胺,其中摩尔质量比EDC∶NHS∶COOH=(1.5~3)∶(8~20)∶1,临用前用活化缓冲液稀释至所需浓度。
所述偶联缓冲液为pH 7.5~8.5、0.05mol/L的硼酸盐缓冲液(避免使用存在游离胺的溶剂)。
所述封闭缓冲液为含0.1~0.4mol/L伯胺(盐酸羟胺、乙醇胺或氨基乙醇)、1%~10%BSA的pH 7.4的PB缓冲液。
所述贮存缓冲液为含0.01%NaN3、0.1%BSA的pH 7.4的PB缓冲液。
5、样品结合垫的制备
(1)将样品结合垫用含牛血清白蛋白(BSA在缓冲体系中的终浓度为0.5%体积百分含量)、pH7.2、0.1mol/L的磷酸盐缓冲液均匀浸泡2h,37℃下烘干2h;
(2)将贮存的荧光微球标记的抗三聚氰胺单克隆抗体以贮存缓冲液稀释后,将(1)处理过的样品结合垫浸泡于稀释缓冲液中,经真空冷冻干燥后备用。
6、硝酸纤维素(NC)膜的制备
用0.05mol/L、pH7.2的PBS缓冲液将三聚氰胺半抗原-卵清白蛋白偶联物稀释到100μg/mL,用Isoflow点膜仪将其喷涂于NC膜上的检测区(T),喷膜量为1.0μL/cm;用0.01mol/L、pH7.4的PBS缓冲液将羊抗鼠抗抗体稀释到200μg/mL,用Isoflow点膜仪将其喷涂于NC膜上的质控区(C),喷膜量为1.0μL/cm。将制备好的NC膜置于37℃条件下干燥2h,备用。
(二)试纸条的组装
将样品结合垫、硝酸纤维素膜、吸水垫从左至右依次搭接粘贴固定在底板上,样品结合垫的末端与硝酸纤维素膜的始端相连,硝酸纤维素膜的末端与吸水垫的始端相连,样品结合垫的始端与底板的始端对齐,吸水垫的末端与底板的末端对齐,然后用机器切成3.96mm宽的小条,装在特制的塑料制卡中,形成试纸卡。三聚氰胺荧光微球免疫层析试纸卡在2~8℃阴凉避光干燥保存,有效期为12个月。
实施例3检测三聚氰胺残留的荧光微球免疫层析试纸条的应用
1、样品前处理
将待检牛奶样品置于60~70℃水浴5min,取出,待检。
2、用试纸条检测
吸取100μL待检样本溶液垂直滴加于试纸卡加样孔中,液体流动时开始计时,反应10min;将试纸卡插入KFT-100A型荧光检测仪的承载器中,通过触摸显示屏选择待检项目,按下“开始检测”按键,荧光检测仪将自动对试纸卡进行扫描测试;通过仪器的显示屏幕上读取或打印检测结果。
3、检测结果分析
测试完成后,仪器将根据检测得到的荧光信号的强弱,自动计算出牛奶样本中三聚氰胺的浓度值,并根据预设的阈值给出阴阳性判断。
阴性(-):若荧光检测仪的显示屏幕上结果显示为阴性,表示样本中不含有三聚氰胺或其浓度低于检测限。
阳性(+):若荧光检测仪的显示屏幕上结果显示为阳性,表示样本中三聚氰胺浓度等于或高于检测限。
无效:若质控区未检出荧光信号强度,表明不正确的操作过程或试纸卡已失效。
实施例4检测三聚氰胺残留的荧光微球免疫层析试纸条技术参数的确定
1、检测限试验
向空白牛奶样品中分别添加三聚氰胺标准品至终浓度为0、5.0、10、20μg/L,用试纸条进行检测,结果为:当三聚氰胺标准品浓度为0、5.0μg/L时,荧光检测仪结果显示为阴性;当三聚氰胺标准品浓度为10、20μg/L时,荧光检测仪结果显示为阳性,表明本试纸条对牛奶样品中三聚氰胺的检测限为10μg/L。
2、假阳性率、假阴性率试验
取已知三聚氰胺含量大于10μg/L的阳性牛奶样本和三聚氰胺含量小于10μg/L的阴性牛奶样本各20份,用3个批次生产的荧光微球免疫层析试纸条分别进行检测,计算其阴阳性率。结果见表1。
表1检测阳性、阴性样本结果
结果表明:用3个批次生产的试纸条检测阳性样本时,结果全为阳性,可知阳性符合率为100%,假阴性率为0;检测阴性样本时,结果全为阴性,可知阴性符合率为100%,假阳性率为0。说明本发明的检测三聚氰胺残留的荧光微球免疫层析试纸条可以对牛奶样品中三聚氰胺残留进行快速检测。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺
- 一种基于碳量子点的荧光面料及其制备方法与制造工艺
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺