糖化血红蛋白的检测方法、层析试纸条及其组装方法与流程
本发明涉及层析检测技术领域,尤其涉及一种糖化血红蛋白含量的检测方法、层析试纸条及其组装方法。
背景技术:
近年来,糖化血红蛋白(hba1c)在临床上开始渐渐被高度重视。糖化血红蛋白(hba1c)是血红蛋白a组分的某些特殊分子部位和葡萄糖经过缓慢而不可逆的非酶促反应结合而形成的。因此,当血液中葡萄糖浓度较高时,人体形成的糖化血红蛋白含量也会相对较高。
hba1c是一项说服力较强、数据较客观、稳定性较好的生化检查项目,其不受偶尔一次血糖升高或降低的影响,能够反映糖尿病患者2~3个月以内的糖代谢状况,同时与糖尿病并发症尤其是微血管病变关系密切,在糖尿病学上有重要的临床参考价值。
1993年美国1型糖尿病控制及并发症实验(dcct)和英国大规模的ii型糖尿病控制与并发症关系研究(ukpds)的研究中把hba1c作为糖尿病控制的一个观察指标。1996年4月起在日本,hba1c被纳入老年人保健法中糖尿病筛选的检查项目。2002年美国糖尿病协会(ada)已将其作为监测糖尿病控制的金标准,对其应用也作了明确的规定:即所有糖尿病患者均应常规测定hba1c。其初诊时测定结果为基线时的代谢状况,此后的测定值则作为糖尿病长期治疗控制中的一部分,这样在提高糖尿病诊断水平、血糖控制、慢性并发症的防治中具有十分重要的应用价值。目前通常认为检测hba1c的临床意义有两点:1.在糖尿病的筛选普查中有早期提示的价值,可作为轻症、ii型、“隐性”糖尿病的早期诊断指标。2.在糖尿病的治疗中,hba1c是评价血糖控制好坏的重要标准。
虽然糖化血红蛋白具有以上的重大检验意义,但在临床上,只有30%左右的糖尿病患者能做到定期监测糖化血红蛋白。
对于糖尿病患者而言,良好的血糖控制是预防并发症的关键,而血糖监测在很大程度上取决于患者本人的认知和行动。由于大部分患者选择可靠性不高的日常监测手段,目前超过60%的ii型糖尿病患者的糖化血红蛋白控制不理想。
糖化血红蛋白长期控制不稳定的影响是多方面的,它会改变红细胞对氧的亲和力,加速心脑血管并发症的形成;如果眼睛内的晶体被糖化,则会引发白内障。此外,它可引起肾小球基底膜增厚,诱发糖尿病肾病,并引起血脂和血粘度增高。糖化血红蛋白升高,是心肌梗死、脑卒中死亡的一个高危因素。在男性患者中,糖化血红蛋白每增加1%,死亡率的相对危险性增加24%,女性患者增加28%。一旦糖化血红蛋白超过7%,发生心脑血管疾病的危险性就增加50%以上。
测定糖化血红蛋白的方法根据检测的原理,基本上可分为基于ghb和hb的电荷不同(如离子交换法、电泳法)和基于hb上糖化基团的结构特点(如亲和层析方法、免疫法和酶法等)两类。其中,临床上广泛采用采用离子层析法,其具有精密度高、重复性好且操作简单的优点。但其价格较为昂贵,而且容易受到带电性相近的胎儿血红蛋白(hb-f)的干扰,可能在离子交换hplc分析图上与hba1c峰重叠。
手工微柱操作会受到人工因素影响,可能会洗脱不完全或过度洗脱并受外界环境温度的影响,而某些血红蛋白如hbf异常增加时,也会与糖化血红蛋白同时洗脱,从而使结果产生偏差。由于手工操作层析时间和微柱的质量不易控制,易产生操作技术误差,重复性欠佳。
还有一些使用琼脂凝胶电泳法。根据hb及hba1带正电荷,电泳时向负极移动的原理进行检测。但是普通电泳法对hba和hba1分离效果不理想,目前尚无商品化且具有批量样本通过能力的仪器面世,相当程度地限制了该方法的临床应用。
等电点聚集法是测定ghb的一种新技术。其在聚丙烯酞凝胶中加人载体两性介质(如ampholin)的薄板上形成一个由阳极到阴极逐渐增加的ph梯度,溶血液中各个组份将移动到各自的等电点的ph位置上,这样就得到比一般电泳法更好的分划效果和比较集中的色带,通过分辨率高的微量光密度仪扫描,可以准确地测定出各自组份的含量。由于它能够分辨出一级结构不同的hba、hbac、hbf、hbs及hbc等,可完全避开各种物质的干扰,是一种理想的方法,。但仪器价格相当昂贵,难于用作常规检测和推广使用。
亲和层析检测方法是利用生物高分子能与相应的专一配基分子可逆结合的原理,将配基通过共价键牢固地结合于固相载体上制得亲和吸附系统。但是亲和层析的检测结果为糖化血红蛋白总量,不能测试ghb的单一组份,且包含hba1的糖化组份,因此将亲和色谱所测出的ghb称为总的ghb是不确切的,严格来说是占不同百分数的各种ghb,目前对其测定内容的命名国内外尚不统一。
还有一些近期发展起来的新方法,例如离子捕获法,其原理是糖化血红蛋白与相应抗体结合后,联以荧光标记物,形成一反应复合物,再联结带负电荷的多聚阴离子复合物,而在imx反应孔中的玻璃纤维预先包被了高分子的四胺合物,使纤维表面带正电,使前述的反应复合物吸附在纤维表面,经过一系列清洗后测定其荧光强度,从而得到糖化血红蛋白的浓度,该方法适用于成批糖化血红蛋自标本的检测。
化学发光法则采用离子捕捉免疫分析法,应用抗原抗体反应原理,联以荧光标记物,通过连接带负电的多阴离子复合物,吸附到带正电的纤维表面,经过一系列彻底清洗等步骤后,测定荧光强度变化率,计算浓度。采用专用试剂包和免疫发光分析仪,其检测系统易于规范和重复,可减少操作技术误差,检测的灵敏度和特异性高,批内、批间变异系数小,回收率高,准确度高,交叉污染率小,影响因素少。但是其仪器较贵,不适用于普及。
酶法的原理为用特殊蛋白酶分解hb,3-5min内果糖基氨基酸从hb分离,果糖基氨基酸氧化酶(faod)从果糖基氨基酸产生h2o2,h2o2经pod与da-64反应,选择751nm测吸光度改变求得ghb浓度。此方法较为不稳定。
因此,提供一种灵敏度高、特异性强、操作简便、检测速度快的检测方法来监测病人体内糖化血红蛋白的水平的变化,可以做到及时检测、及时治疗并且减轻病人痛苦,减少家庭负担以及社会负担等,具有重大的现实意义。
技术实现要素:
鉴于上述现有技术的不足之处,本发明的目的在于提供一种糖化血红蛋白的检测方法、层析试纸条及其组装方法,旨在解决现有技术中糖化血红蛋白检测繁琐,成本高的问题。
为了达到上述目的,本发明采取了以下技术方案:
一种层析试纸条,应用于糖化血红蛋白含量的检测,其中,所述层析试纸条包括:
底板,所述底板的一端为用于承载样品的加样区,另一端为用于提供层析动力的吸引区;所述加样区和吸引区之间形成层析反应区;
所述层析反应区内依次设置有接近加样区的第一测试线和接近吸引区的第二测试线;所述第一测试线包被糖化血红蛋白单克隆抗体;所述第二测试线包被血红蛋白单克隆抗体。
所述的层析纸条,其中,所述加样区为固定在所述底板上的样品垫。
所述的层析纸条,其中,所述层析反应区固定在所述底板上的硝酸纤维素膜;
所述样品垫的至少一部分叠合在所述硝酸纤维素膜上。
所述的层析纸条,其中,所述吸引区为吸水滤纸;所述吸水滤纸至少部分与所述硝酸纤维素膜重叠。
所述的层析纸条,其中,所述糖化血红蛋白单克隆抗体的浓度为0.1-0.8mg/ml;所述血红蛋白单克隆抗体的浓度为0.1-0.8mg/ml。
所述的层析纸条,其中,所述第一测试线和第二测试线之间的距离为15-20mm。
一种应用如上所述的层析试纸条的糖化血红蛋白的检测方法,其中,所述方法包括:
将获取的待检测样本加入所述加样区;
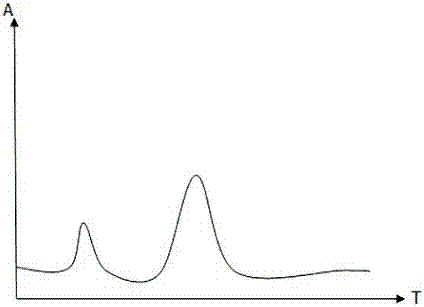
在层析反应完成后,可以得到一条峰形图,如图2所示,其中第1个色谱峰为hba1c峰,第2个色谱峰为hb峰,计算2个峰的峰面积,然后计算出糖化血红蛋白的含量。
所述方法中,其中,所述通过2个峰的峰面积来计算糖化血红蛋白的含量,根据所述第一个峰的峰面积s1和第二个峰的峰面积s2,计算糖化血红蛋白的含量,具体包括:
根据2个峰的峰面积来计算糖化血红蛋白的含量,确定所述第一个峰的峰面积s1和第二个峰的峰面积s2;
通过如下算式计算糖化血红蛋白的含量:
hba1c%=s1/(s1+s2),其中,hba1c%为所述糖化血红蛋白的浓度。
一种层析试纸条的组装方法,其中,所述方法包括:
将硝酸纤维素膜和吸水滤纸分别粘贴在底板上;其中,所述吸水滤纸压住所述硝酸纤维素膜2-4mm;
裁切样本垫并将其一端与所述底板对齐,另一端压在所述硝酸纤维素膜上方,形成试纸大板;
通过斩切机构,将所述试纸大板裁切为宽度为3-6mm的试纸条。
所述的方法,其中,所述方法还包括:
使用划膜仪,在所述试纸条的预定位置,划出第一测试线和第二测试线;其中,划膜浓度为0.5-2ul/cm,划膜速度为30-50mm/s。
有益效果:本发明提供的糖化血红蛋白的检测方法、层析试纸条及其组装方法。其结合了免疫层析法和高效液相色谱法的优点,可以通过结构简单的试纸条检测及计算糖化血红蛋白含量,既提高了传统层析法的灵敏度特异性,又结合了亲和层析色谱的检测方法,操作简便,为进一步poct产品的开发及实现糖化血红蛋白家庭监测奠定了良好基础。
附图说明
图1为本发明实施例提供的层析试纸条的结构示意图;
图2为本发明实施例提供的层析反应完成后得到的峰形图;
图3为本发明实施例提供的糖化血红蛋白的检测方法的方法流程图。
具体实施方式
本发明提供的糖化血红蛋白含量的检测方法、层析试纸条及其组装方法。为使本发明的目的、技术方案及效果更加清楚、明确,以下参照附图并举实施例对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
图1为本发明实施例提供的层析试纸条,其可以应用于糖化血红蛋白含量的检测。如图1所示,所述层析试纸条包括:底板100、加样区200、层析反应区300以及吸引区400。其中,所述加样区200和吸引区400分别位于底板的两端,所述加样区200和吸引区400之间形成层析反应区300。
所述层析反应区300内依次设置有接近加样区的第一测试线301和接近吸引区的第二测试线302。其中,所述第一测试线包被糖化血红蛋白单克隆抗体;所述第二测试线包被血红蛋白单克隆抗体,分别用于与对应的血红蛋白和糖化血红蛋白特异性结合,实现检测。
该层析试纸条基于纸层析的原理进行,吸引区提供层析的动力,吸引加样区内的样品沿图1中所示的层析方向x移动,在层析反应区依次通过所述第一测试线和第二测试线。
在样品通过第一测试线时,样品中的糖化血红蛋白能够与对应的单克隆抗体特异性结合,由于糖化血红蛋白本身是红色,所以可在第一检测线形成红色条带。在样品通过第二测试线时,样品中的血红蛋白则与其相应的单克隆抗体特异性结合,由于血红蛋白本身是红色,所以可在第二检测线也形成相应的红色条带。
在本发明实施例中,划出所述第一测试线和第二测试线的糖化血红蛋白单克隆抗体和血红蛋白单克隆抗体的浓度均可以为0.1-0.8mg/ml。在一些实施例中,所述浓度为0.5mg/ml。
较佳的是,所述第一测试线和第二测试线之间的距离为15-20mm,保证层析效果。具体的,距离可以设置为18mm。
可以理解的是,该红色条带的颜色深浅与样品中相应的蛋白质浓度相关。由此,可以根据红色条带的颜色,确定样品的糖化血红蛋白浓度。
在本发明提供的层析试纸条中,利用了糖化血红蛋白以及血红蛋白自身具有颜色的特点,减省了传统层析法中的结合物垫(不需要使用胶体金、乳胶等颜色标记物),很好的降低了制造的成本。而通过层析试纸的方式对糖化血红蛋白进行检测,整体的检测过程简单可靠,检测耗时短,操作简便,不需要专业人员以及复杂的仪器操作,具有良好的应用前景。
具体的,如图1所示,所述加样区200为固定在所述底板100上的样品垫,所述样品垫至少一部分叠合在作为层析反应区300的硝酸纤维素膜上,样品可以通过叠合部位,从样品垫进入到硝酸纤维素膜中。当然,在另一些实施例中,根据实际情况的需求,还可以使用其他合适的材质,作为层析反应区。
在本实施例中,可以采用吸水滤纸吸引位于样品垫的样品沿层析方向移动。与样品垫相类似的,所述吸水滤纸300也有至少部分与所述硝酸纤维素膜400重叠。
图3为本发明实施例提供的一种应用如上所述的层析试纸条的糖化血红蛋白的检测方法。如图3所示,所述方法包括如下步骤:
s100:将获取的待检测样本加入所述加样区。所述待检测样本可以是人血清或者血浆样本等。
在nc膜的毛细管作用下,加入到加样区的待测样本会向吸水纸端(吸水区)移动。层析移动过程中,待测样本中的糖化血红蛋白抗原与第一测试线上标记的糖化血红蛋白单抗发生抗原-抗体反应从而被捕获。而待测样本中的血红蛋白抗原则会与第二测试线上标记的血红蛋白单抗发生抗原-抗体反应被捕获。
s200:在层析反应完成后,可以获得对应的峰形图并计算所述hba1c峰和hb峰的峰面积。。由于糖化血红蛋白和血红蛋白自身具有红色。因此,特异性结合后,会在第一测试线和第二测试线形成相应的红色条带而不需要使用特定的颜色标记物。
在本实施例中,所述对应的峰形图如图2所示,包括了第一和第二两个色谱峰。其中,第一个色谱峰为hba1c峰,第二个色谱峰为hb峰。
s300:根据所述峰面积计算糖化血红蛋白的含量。
具体的,可以通过如下算式来计算糖化血红蛋白的含量:
hba1c%=s1/(s1+s2),其中,hba1c%为所述糖化血红蛋白的浓度,s1为hba1c峰的峰面积,s2为hb峰的峰面积。
本发明还进一步的提供了上述实施例的层析试纸条的组装方法。所述方法包括如下步骤:
首先,将硝酸纤维素膜和吸水滤纸分别粘贴在底板上;其中,所述吸水滤纸压住所述硝酸纤维素膜2mm。然后,裁切样本垫并将其一端与所述底板对齐,另一端压在所述硝酸纤维素膜上方,形成试纸大板。最后,通过斩切机构,将所述试纸大板裁切为宽度为3-6mm的试纸条。其中,优选宽度为4mm
进一步地,可以使用划膜仪,在所述试纸条的预定位置(即硝酸纤维素膜上),划出第一测试线和第二测试线。其中,所述划膜仪进行测试线划膜时,划膜的浓度为0.5-2ul/cm,划膜速度为30-50mm/s。其中,优选划膜的浓度为1ul/cm,优选划膜速度为40mm/s。
可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及本发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!