一种采用连续监测法定量测定ALT的试剂制备方法与流程
本发明属于生物技术领域,涉及一种采用连续监测法定量测定ALT的试剂制备方法。
背景技术:
:
丙氨酸氨基转移酶(ALT)是能够催化丙氨酸与α-酮戊二酸之间的氨基转移酶,是一种参与人体蛋白质新陈代谢的酶,起着加快人体内蛋白质在体内转化的作用,该酶广泛存在于人体各种组织、器官、肌肉、骨骼中,以肝脏细胞的细胞浆中最多。一旦有肝细胞遭到损害、肝功能下降、肝细胞坏死,细胞内的ALT即可释放到细胞外,从而导致血清中ALT含量升高。ALT活性升高表示有肝细胞损伤,也可见于心肌及骨骼肌损伤。血清ALT活性是肝细胞损伤的敏感指标,尤其是病毒性肝炎的重要标志,目前ALT临床上主要用来检测肝功能。
体外检测丙氨酸氨基转移酶(ALT)的方法主要有赖氏比色法、丙酮酸氧化酶法及连续监测法(速率法)。赖氏比色法的缺点是易受反应产物丙酮酸的反馈抑制影响,导致测定结果的准确度和精密度不高;丙酮酸氧化酶法虽然测定结果较好,但所用的4-氨基安替比林有毒、有致畸性,不满足绿色原则;连续监测法的优点是可以确定线性期并计算每分钟吸光度的变化(ΔA/min),根据此值再准确地计算酶活性,可以利用全自动生化分析仪进行检测;酶和底物反应的特异性好,检测结果准确度高。以上三种方法相比较,采用连续监测法较佳。
本发明的试剂盒主要采用连续监测法进行检测,其检测原理为:ALT催化L-丙氨酸的氨基转移至α-酮戊二酸,生成丙酮酸和L-谷氨酸。乳酸脱氢酶(LDH)催化丙酮酸还原的同时将还原型辅酶(NADH)氧化成氧化型辅酶(NAD+),由于NADH在340nm处有特征吸收,所以NADH的下降速率和ALT的活力成正比。反应式如下:
目前ALT检测试剂盒多采用丙酮酸氧化酶法,如CN 103320497 B(2015.09.09)、CN 100595282 C(2010.03.24)、CN 1086205 C(2002.06.12)均采用此法;CN 104195220 A(2014.12.10)主要讲到缓冲液对ALT试剂的影响;CN 104404127 A(2015.03.11)所述ALT试剂盒采用单一试剂,无法消除内源性干扰。本发明所涉及的采用连续监测法定量测定ALT的试剂制备方法,可应用于丙氨酸氨基转移酶检测试剂盒的制备,具有方法操作简单、结果准确度高、制成的试剂稳定性好的特点。
技术实现要素:
:
本发明的目的在于提供一种采用连续监测法定量测定ALT的试剂制备方法,主要解决现有ALT检测领域存在的准确度低、操作繁琐、污染环境、制成的试剂不稳定等问题。
为了解决内源性α-酮戊二酸对丙氨酸(ALT)测定的干扰,本发明提供的采用连续监测法定量测定ALT的试剂制备方法采用两步法检测,血清与(缺少α-酮戊二酸)的底物溶液混合,37℃保温5min,使样品中所含内源性α-酮戊二酸引起的副反应进行完毕。然后加入α-酮戊二酸启动ALT的催化反应,在主波长340nm处连续监测吸光度下降速率,根据线性反应期吸光度下降速率(-ΔA/min),计算出ALT活力。
本发明的目的通过以下技术方案实现:分别配制浓度为120mmol/L-180mmol/L等浓度的Tris和Tris-HCl溶液,将其相同浓度对应调制成PH=8.4的缓冲溶液,作为试剂1的溶剂;分别配制浓度为60mmol/L-100mmol/L等浓度的Tris和Tris-HCl溶液,将其相同浓度对应调制成PH=7.2的缓冲溶液,作为试剂2的溶剂,其次在试剂1中加入一定量的酶保护剂和稳定剂;在试剂2中加入一定量的稳定剂,充分混合直至完全溶解,之后于试剂1中加入浓度为650mmol/L-850mmol/L的L-丙氨酸、浓度为0.2mmol/L-0.4mmol/L的还原型辅酶(NADH)、浓度为2000U/L-3000U/L的乳酸脱氢酶(LDH);于试剂2中加入浓度为35mmol/L-55mmol/L的α-酮戊二酸,最后于试剂1和试剂2中均加入一定量的防腐剂,2-8℃密封保存。
所述酶保护剂选自牛血清白蛋白(BSA)或甘油与糖类中的一种或多种组合物,其用量为BSA0.1%-2%,甘油5%-20%,优选为BSA 0.5%-1.5%,甘油10%-15%。
以上所述糖类可选自葡萄糖、蔗糖、麦芽糖、果糖中的一种或多种,其用量为1g/L-15g/L,优选为5g/L-10g/L。
所述试剂1和试剂2的稳定剂均选自KCl及表面活性剂组合物,其用量为KCl 1g/L-15g/L,优选为5g/L-10g/L。
以上所述表面活性剂可选自吐温-20(Tween-20)、吐温-80(Tween-80)、曲拉通X-100(Triton X-100)、聚乙二醇6000(PEG 6000)及聚乙二醇8000(PEG 8000)中的一种或多种,其用量为0.1%-2%,优选为0.5%-1.5%。
所述试剂1和试剂2的防腐剂均可选自NaN3或Proclin-300,其用量为NaN30.1g/L-2g/L,Proclin-3000.1%-2%,优选为NaN3 0.6g/L-1g/L,Proclin-3000.5%-1%。
本发明所涉及的一种采用连续监测法定量测定ALT的试剂制备方法可以用来制备丙氨酸氨基转移酶(ALT)检测试剂盒,该类试剂盒适用于各类全自动生化分析仪,现于全自动生化分析仪BS-420上的应用,其具体使用方法如下:
表1 样本检测操作程序
计算方法:样品中的ALT含量(U/L)=ΔAT/min×F
ΔAT/min:测定管平均每分钟相对空白管吸光度变化
注:TV:试剂样品总体积,SV为样品体积; 6.22:NADH在340nm处的毫摩尔分子吸光系数;
1.0:比色皿光径(cm);1000:U/mL到U/L的转换系数。
本发明所使用的质控品为罗氏高、低值质控品;所测样品为不溶血血清。
有益效果:本发明所涉及的一种采用连续监测法定量测定ALT的试剂制备方法,制备的液体双试剂采用两步法检测,有效消除内源性α-酮戊二酸干扰,提高了ALT测定的准确度;本发明的ALT试剂制备方法中加入酶保护剂和稳定剂,提高了制成的ALT试剂盒的稳定性,于37℃水浴可稳定至少一周,说明2-8℃保存可以至少稳定一年。
以下结合具体实施例进一步说明本发明,应理解,具体实施方式仅用于说明本发明,而非限制本发明。
附图说明:
图1是采用本发明实施例1-3及对比实施例的方法制得的试剂于2-8℃保存一周的空白吸光度变化对比试验结果图;
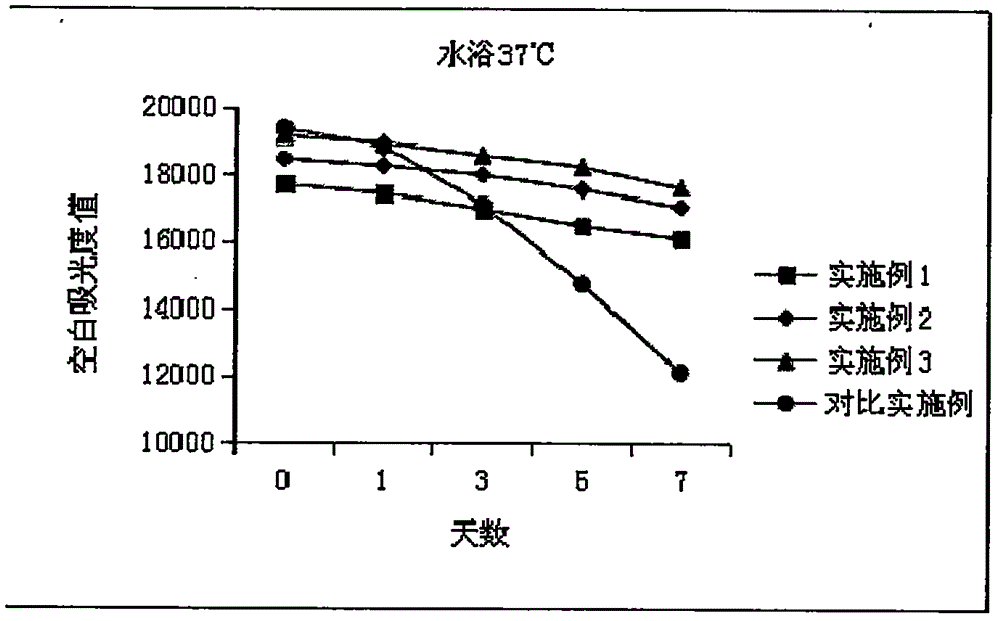
图2是采用本发明实施例1-3及对比实施例的方法制得的试剂于37℃水浴一周的空白吸光度变化对比试验结果图。
具体实施方式
实施例1
分别配制浓度均为120mmol/L的Tris和Tris-HCl溶液,将其调制成PH=8.4的缓冲溶液,作为试剂1的溶剂;分别配制浓度均为100mmol/L的Tris和Tris-HCl溶液,将其调制成PH=7.2的缓冲溶液,作为试剂2的溶剂,其次在试剂1中加入KCl 5g/L、曲拉通X-100 1%、甘油15%、蔗糖5g/L;在试剂2中加入KCl 6g/L、PEG 8000 1.5%,充分混合直至完全溶解,之后于试剂1中加入浓度为650mmol/的L-丙氨酸、浓度为0.2mmol/L的NADH、浓度为2000U/L的LDH;于试剂2中加入浓度为35mmol/L的α-酮戊二酸,最后于试剂1和试剂2中分别加入1g/L的NaN3和0.6g/L的NaN3,2-8℃密封保存。
实施例2
分别配制浓度均为150mmol/L的Tris和Tris-HCl溶液,将其调制成PH=8.4的缓冲溶液,作为试剂1的溶剂;分别配制浓度均为80mmol/L的Tris和Tris-HCl溶液,将其调制成PH=7.2的缓冲溶液,作为试剂2的溶剂,其次在试剂1中加入KCl 8g/L、吐温-20 1%、BSA 1.5%、麦芽糖10g/L;在试剂2中加入KCl 8g/L、PEG 6000 1%,充分混合直至完全溶解,之后于试剂1中加入浓度为750mmol/的L-丙氨酸、浓度为0.3mmol/L的NADH、浓度为2500U/L的LDH;于试剂2中加入浓度为45mmol/L的α-酮戊二酸,最后于试剂1和试剂2中分别加入0.8%的Proclin-300和0.5%的Proclin-300,2-8℃密封保存。
实施例3
分别配制浓度均为180mmol/L的Tris和Tris-HCl溶液,将其调制成PH=8.4的缓冲溶液,作为试剂1的溶剂;分别配制浓度均为60mmol/L的Tris和Tris-HCl溶液,将其调制成PH=7.2的缓冲溶液,作为试剂2的溶剂,其次在试剂1中加入KCl 10g/L、吐温-801.5%、PEG 8000 0.5%、甘油10%、果糖6g/L葡糖糖8g/L;在试剂2中加入KCl 10g/L、曲拉通X-100 0.5%、PEG 6000 0.5%,充分混合直至完全溶解,之后于试剂1中加入浓度为850mmol/的L-丙氨酸、浓度为0.4mmol/L的NADH、浓度为3000U/L的LDH;于试剂2中加入浓度为55mmol/L的α-酮戊二酸,最后于试剂1和试剂2中分别加入1%的Proclin-300和0.8%的Proclin-300,2-8℃密封保存。
对比实施例
分别配制浓度均为180mmol/L的Tris和Tris-HCl溶液,将其调制成PH=8.4的缓冲溶液,作为试剂1的溶剂;分别配制浓度均为60mmol/L的Tris和Tris-HCl溶液,将其调制成PH=7.2的缓冲溶液,作为试剂2的溶剂,在试剂1中加入浓度为850mmol/的L-丙氨酸、浓度为0.4mmol/L的NADH、浓度为3000U/L的LDH;于试剂2中加入浓度为55mmol/L的α-酮戊二酸,最后于试剂1中加入1g/L的NaN3;试剂2中加入0.6g/L的NaN3,2-8℃密封保存。
将采用本发明实施例1-3及对比实施例中的方法配制的液体双试剂进行准确度验证试验。质控品选用罗氏高值质控(ALT靶值:118U/L,靶值范围(±10%):106.2U/L-129.8U/L);罗氏低值质控(ALT靶值:37U/L,靶值范围(±10%):33.3U/L-40.7U/L)。采用BS-420全自动生化分析仪进行检测,具体操作方法如表一所述,采用单点定标法定标后,ALT测定值及空白吸光度值可从仪器上直接读取,为了减少偶然误差,重复测定三次取均值。
采用实施例1-3及对比实施例的方法配制的液体双试剂准确度结果如下:
表2 实施例1-3及对比实施例准确度比较
将采用本发明实施例1-3及对比实施例中的方法配制的液体双试剂进行稳定性验证试验。将以上四种试剂每种平均分成两份,一份至于2-8℃保存,另一份至于37℃水浴中保存,每隔一天测定一次,连续监测一周,观察空白吸光度变化及血清测定值(血清定值75.6U/L,允许误差范围(±10%):68.04U/L-83.16U/L),通过空白吸光度的变化和准确度的测定比较试剂稳定性。
表3 采用实施例1的方法配制的试剂稳定性数据
表4 采用实施例2的方法配制的试剂稳定性数据
表5 采用实施例3的方法配制的试剂稳定性数据
表6 采用对比实施例的方法配制的试剂稳定性数据
由表2可知采用实施例1-3的方法制得的试剂准确度均在允许的误差范围(±10%)内,而采用对比实施例的方法制得的试剂准确度超出了误差允许范围;由图1和图2可以看出,采用实施例1-3的方法制得的试剂的稳定性明显强于采用对比实施例的方法制得的试剂。采用实施例1-3的方法制得的试剂虽然试剂空白有一定程度的下降,但是下降的幅度不大,在允许范围内,说明加入合适的稳定剂和酶保护剂可以减缓NADH的衰减、保护酶的活性,进而提高试剂的稳定性,可延长用此法制得的试剂盒的保存期。
- 还没有人留言评论。精彩留言会获得点赞!