一种测定铜离子含量的试剂盒的制作方法
本发明涉及一种测定铜离子含量的试剂盒,属于重金属快速检测领域。
背景技术:
铜是人类和动物机体必需的微量元素之一。铜参与了机体内蛋白质、脂肪、碳水化合物三大营养物质的代谢,并且在生长、免疫、繁殖等生理过程中起着极其重要的作用。自英国学者Braude首次发现高剂量铜对仔猪生长有促进作用后,铜作为微量元素补充剂广泛添加到饲料中。添加高剂量铜已被认为是一种高效、廉价、使用方便的促生长方式,但高剂量的铜添加往往会造成动物中毒,同时会通过动物排泄物污染周围环境,并在动物产品中蓄积和残留,影响动物产品品质,消费这类动物产品会危害人体健康。因此,我国对饲料中铜的允许量制定了严格的指标:如猪饲料中铜含量不得高于200mg/kg。同时,人体通过各种途径摄入的铜的过量时会导致严重的健康问题,如急性缺血性心脏病、肾脏疾病、神经退行性疾病、贫血和骨功能紊乱等,因此各国对环境和食品中铜的限量均作出了规定。如美国环保署规定饮用水中铜的含量不得超过1.30mg/L;欧盟食品委员会规定人体每天通过食物摄取的铜含量应在1.2-4.2mg范围内。另外,铜在儿茶酚胺代谢、自由基清除、以及血红蛋白、弹性蛋白和胶原合成中起着重要的作用,铜的浓度是一些疾病如Wilson病、小细胞低色素性贫血和骨疾病的诊断指标。因此,建立饲料、环境、血清中铜含量的检测方法是非常必要的。
现有的铜检测方法仍以传统仪器法为主,包括原子吸收分光光度法(AAS)、电感耦合等离子体-原子发射光谱法(ICP-AES)、电感耦合等离子体质谱分析(ICP-MS)和原子荧光光谱分析(AFS)等为主。但是,此类常规检测方法由于需要昂贵的大型仪器,复杂的样品前处理过程,以及专业技术人员操作,无法在短时间内对大量样品进行检测,并在基层实验室中推广。虽然目前有很多文献报道了一些铜离子的新型检测方法,如基于纳米金和纳米银的的可视化检测方法、电化学分析法以及基于抗铜螯合物抗体的免疫分析方法,但这些方法基本上只能应用于比较简单的样品基质如饮用水和湖水等。对于复杂的样品如饲料、食品和血清等,样品中含有大量的其它金属离子如钙、锌、铁、镁以及其它营养成分如蛋白质、氨基酸、维生素及各种添加剂,这些物质均会对测定产生严重的干扰。因此,现有的快速检测手段难以对这些复杂样品进行准确的定量分析。
技术实现要素:
本发明的目的是提供一种测定铜离子含量的试剂盒,本发明试剂盒提高了检测的准确性,能消除了样品中其它成分对检测的干扰。
本发明提供的测定铜离子含量的试剂盒,其包括参数采集试剂、参数采集设备和可读性载体;
所述参数采集试剂包括采集所述可读性载体中涉及的各项参数的试剂;
所述参数采集设备包括采集所述可读性载体中涉及的各项参数的设备;
所述可读性载体上记载了如下测定铜离子含量的步骤:
1)吸光度值的检测
标准曲线组:配制至少3种不同浓度的铜离子标准溶液,将所述铜离子标准溶液分别与BCA工作液混合,测定混合后体系在354nm下的吸光度值,记为A;
样品组:将待测样品溶液与空白BCA工作液混合,测定混合体系在354nm下的吸光度值,记为A1;
将待测样品溶液与所述BCA工作液混合,测定混合体系在354nm下的吸光度值,记为A2;
所述BCA工作液为BCA试剂与盐酸羟胺溶液的混合液;
所述空白BCA工作液为空白BCA试剂与所述盐酸羟胺溶液的混合液;
2)计算铜离子标准溶液标准曲线的斜率
根据式Ⅰ对吸光度值A进行校正,得到校正吸光度值,记为Ac,
式Ⅰ中,VBCA、VCu分别表示步骤1)中加入的所述BCA工作液和所述铜离子标准溶液的体积,单位为μL;CBCA0表示所述BCA工作液的浓度,单位为μg/mL;βBCA为0.00442;
以所述校正吸光度值为纵坐标,以所述铜离子标准溶液的浓度为横坐标,进行线性拟合,得到所述铜离子标准溶液在354nm下的标准曲线的斜率,记为βCu;根据式Ⅱ得到βCu-BCA,
式Ⅱ中,MBCA、MCu、MCu-BCA分别表示BCA、铜和Cu-BCA复合物的相对分子质量,单位为g/M;VBCA和VCu分别为加入的BCA工作液和铜离子标准溶液的体积,单位为mL;βBCA为0.00442,为试剂盒提供值。
3)吸光度值A2与A1的差值记为ΔA,根据式Ⅲ得到所述待测样品溶液中铜离子的浓度Ccu-sample,
式Ⅲ中,βCu-BCA为通过式Ⅱ的测定值,MBCA、MCu、MCu-BCA分别表示BCA、铜和Cu-BCA复合物的相对分子质量,单位为g/M;VBCA和VCu分别为加入的BCA工作液和样品溶液的体积,单位为mL,CBCA0为BCA工作液的浓度,单位为μg/mL;βBCA为0.00442,为试剂盒提供值。
所述的试剂盒中,所述待测样品溶液为待测样品的三氯乙酸溶液的提取液;
所述三氯乙酸溶液按照如下步骤制备:称取适量的三氯乙酸固体,溶于水中,得到质量体积浓度为1g/100mL(1%,w/v)的所述三氯乙酸溶液,所述水具体可为纯水;
所述待测样品为饲料和/或血清和/或饮用水,所述饲料具体可为猪配合饲料、鸡配合饲料、浓缩饲料和预混料中的至少一种以及宠物饲料;
当所述待测样品为为固体样本时,所述待测样品与所述三氯乙酸溶液的质量体积比为1g:(50~100)mL;
当所述待测样品为液体样本时,所述待测样品与所述三氯乙酸溶液的体积比为1:1~10。
所述的试剂盒中,所述BCA试剂为BCA、无水碳酸钠、酒石酸钠、氢氧化钠和碳酸氢钠的水溶液,各组分的浓度依次为:0.5g/L、1g/L、0.8g/L、0.5g/L和0.475g/L;
所述BCA试剂的pH值为11.25;
所述盐酸羟胺溶液由盐酸羟胺固体溶于碳酸缓冲液中得到,其质量体积浓度为1g/100mL;
所述BCA工作液中,所述BCA试剂与所述盐酸羟胺溶液的体积比为5:3;
所述空白BCA试剂为无水碳酸钠、酒石酸钠、氢氧化钠和碳酸氢钠的水溶液,各组分的浓度依次为:1g/L、0.8g/L、0.5g/L和0.475g/L;
所述空白BCA试剂的pH值为11.25;
所述空白BCA工作液中,所述空白BCA试剂与所述盐酸羟胺溶液的体积比为5:3;
所述铜离子标准溶液的质量体积浓度为0~10μg/mL,具体可为0、0.1、0.5、1、2、5和10μg/mL。
所述的试剂盒中,所述可读性载体为试剂盒说明书;所述测定铜离子含量的步骤的内容印刷在卡片上;和/或,
所述可读性载体为计算机可读载体。
所述参数采集设备包括酶标板和酶标仪。
本发明进一步提供了测定铜离子含量的方法,包括以下步骤:
1)吸光度值的检测
标准曲线组:配制至少3种不同浓度的铜离子标准溶液,将所述铜离子标准溶液分别与BCA工作液混合,测定混合后体系在354nm下的吸光度值,记为A;
样品组:将待测样品溶液与空白BCA工作液混合,测定混合体系在354nm下的吸光度值,记为A1;
将待测样品溶液与所述BCA工作液混合,测定混合体系在354nm下的吸光度值,记为A2;
所述BCA工作液为BCA试剂与盐酸羟胺溶液的混合液;
所述空白BCA工作液为空白BCA试剂与所述盐酸羟胺溶液的混合液;
2)计算铜离子标准溶液标准曲线的斜率
根据式Ⅰ对吸光度值A进行校正,得到校正吸光度值,记为Ac,
式Ⅰ中,VBCA、VCu分别表示步骤1)中加入的所述BCA工作液和所述铜离子标准溶液的体积,单位为μL;CBCA0表示所述BCA工作液的浓度,单位为μg/mL;βBCA为0.00442,为试剂盒提供值;
以所述校正吸光度值为纵坐标,以所述铜离子标准溶液的浓度为横坐标,进行线性拟合,得到所述铜离子标准溶液在354nm下的标准曲线的斜率,记为βCu;根据式Ⅱ得到βCu-BCA,
式Ⅱ中,MBCA、MCu、MCu-BCA分别表示BCA、铜和Cu-BCA复合物的相对分子质量,单位为g/M;VBCA和VCu分别为加入的BCA工作液和铜离子标准溶液的体积,单位为mL;βBCA为0.00442,为试剂盒提供值;
3)吸光度值A2与A1的差值记为ΔA,根据式Ⅲ得到所述待测样品溶液中铜离子的浓度Ccu-sample,
式Ⅲ中,βCu-BCA为通过式Ⅱ的测定值,MBCA、MCu、MCu-BCA分别表示BCA、铜和Cu-BCA复合物的相对分子质量,单位为g/M;VBCA和VCu分别为加入的BCA工作液和铜离子标准溶液的体积,单位为mL,CBCA0表示BCA工作液的浓度,单位为μg/mL;βBCA为0.00442,为试剂盒提供值;
则待测样品中铜离子含量即为所测定的待测样品中铜离子浓度乘以稀释倍数。
上述的方法中,步骤1)中,所述待测样品溶液为待测样品的三氯乙酸溶液的提取液;
所述待测样品为饲料和/或血清和/或饮用水,所述饲料具体可为猪配合饲料、鸡配合饲料、浓缩饲料和预混料中的至少一种以及宠物饲料;
当所述待测样品为固体样本时,所述待测样品与所述三氯乙酸溶液的质量体积比为1g:(50~100)mL;
当所述待测样品为液体样本时,所述待测样品与所述三氯乙酸溶液的体积比为1:1~10。
上述的方法中,所述BCA试剂为BCA、无水碳酸钠、酒石酸钠、氢氧化钠和碳酸氢钠的水溶液,各组分的浓度依次为:0.5g/L、1g/L、0.8g/L、0.5g/L和0.475g/L;
所述BCA试剂的pH值为11.25;
所述盐酸羟胺溶液由盐酸羟胺固体溶于碳酸缓冲液中得到,其质量体积浓度为1g/100mL;
所述BCA工作液中,所述BCA试剂与所述盐酸羟胺溶液的体积比为5:3;
所述空白BCA试剂为无水碳酸钠、酒石酸钠、氢氧化钠和碳酸氢钠的水溶液,各总组分的浓度依次为:1g/L、0.8g/L、0.5g/100mL和0.475g/mL;
所述空白BCA试剂的pH值为11.25;
所述空白BCA工作液中,所述空白BCA试剂与所述盐酸羟胺溶液的体积比为5:3;
所述铜离子标准溶液的质量体积浓度为0~10μg/mL,具体可为0、0.1、0.5、1、2、5和10μg/mL。
本发明中,“室温”指的是10~30℃,具体可为25℃。
本发明具有以下优点:
1)本发明试剂盒提高了检测的准确性,基本消除了样品基质中其它成分对检测的干扰。
2)本发明检测方法,无需复杂的样品前处理和贵重仪器。
3)本发明检测方法成本低,抗干扰能力强,检测限低,可以达到0.1mg/L,既可定量检测,也可以用肉眼观察,比较铜标准溶液产生的颜色,对铜离子浓度进行半定量检测。
4)本发明采用采用酶标板作为载体,可一次对大批量饲料样品进行检测。
附图说明
图1为典型的BCA标准曲线和铜测定标准曲线,其中图1A为BCA标准曲线,图1B为铜测定标准曲线。
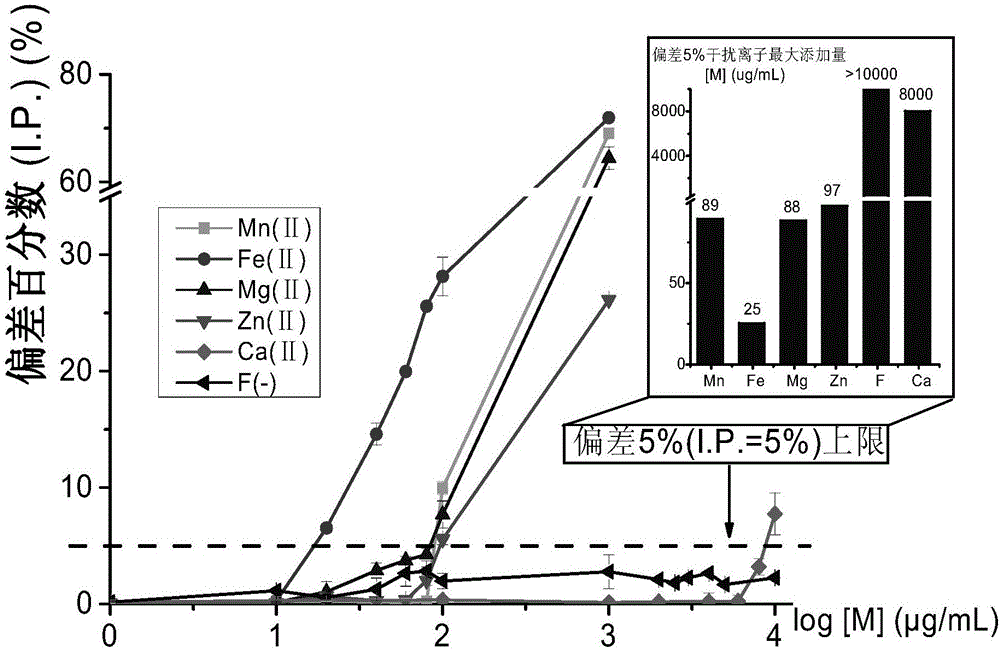
图2为其它重金属离子对本发明试剂盒测定铜的干扰试验。
图3为本发明试剂盒测定与传统的原子吸收光谱法测定的对比试验结果。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中,猪和鸡的配合饲料购于北京同力兴科农业科技有限公司,产品目录号为002和008;血清样品分别商购于美国Gibco公司,产品目录号16000-044;饮用水样本为自来水。
实施例1、
1)参数采集试剂组成
A液:三氯乙酸溶液,配制方法:三氯乙酸固体溶于纯水中,浓度为1g/100mL(1%,w/v)。
B液:BCA溶液,配制方法:称取适量的BCA二钠、无水碳酸钠、酒石酸钠、碳酸氢钠固体,溶于纯水中,终浓度分别为1g/100mL(1%,w/v)、2g/100mL(2%,w/v)、0.16g/100mL(0.16%,w/v)、0.4g/100mL(0.4%,w/v)、0.95g/100mL(0.95%,w/v);调节溶液pH至11.25,将溶液稀释至以BCA浓度计为500mg/L。
C液:盐酸羟胺溶液,配制方法:取盐酸羟胺溶于碳酸缓冲液中,浓度为1g/100mL(1%,w/v)。
D液:BCA工作溶液,将B液与C溶液以5:3(v/v)比例混合,现配现用。
E液:空白BCA工作液,配制方法:将不含BCA钠的B液与C液以5:3(v/v)比例混合。
F液:铜标准溶液0、0.1,0.5,1,2,5,10μg/mL,分别为F1-F7标准液。
2)样品前处理:
饲料样品(配合饲料、浓缩饲料或预混料):样品与A液(三氯乙酸溶液)混合,比例为1g:(50~100)mL,振荡3分钟,定量滤纸过滤或5000rpm离心10分钟,取上清。
血清和水:样品与A液(三氯乙酸溶液)混合,比例为1g/100mL(1%,w/v),振荡3分钟,定量滤纸过滤或5000rpm离心10分钟,取上清。
3)检测:
标准曲线组:酶标板孔中每孔加入150μL不同浓度的铜标准液(F1-F7液),随后每孔加入100μL BCA工作液。
样品组:每个样品测定需两个酶标板孔:背景孔和样品孔。背景孔中加入150μL样品上清液和100μL E液(空白BCA工作液);样品孔中加入150μL样品上清液和100μL D液(BCA工作液)。
所有酶标板孔于室温(20℃)反应15分钟后,置于酶标仪读数,检测波长为354nm。
4)浓度计算:
①标准曲线绘制和βCu值计算:根据3)中的操作步骤,测定354nm下各浓度铜标准溶液产生的吸光值(A),根据下式对吸光值进行校正,获得校正吸光值Ac:
以校正吸光值Ac为纵坐标,以铜标准溶液浓度为横坐标,进行线性拟合,获得标准曲线的斜率,设为βCu。式中βBCA为BCA标准溶液在354nm下测定获得的标准曲线斜率。
典型的BCA标准曲线如图1A所示,其中βBCA=0.00442。因不同批次测定βBCA变异小,因此βBCA由本试剂盒提供,实际操作过程中不需重新测定βBCA。
典型的标准曲线如图1B所示,标准曲线方程为y=0.53766x+0.10439。其中βCu=0.53766。根据βCu根据下列公示可计算βCu-BCA值:
式中,βCu为绘制的标准曲线斜率;MBCA、MCu、MCu-BCA分别表示BCA、铜和Cu-BCA复合物的相对分子质量,单位为g/M;VBCA和VCu分别为加入的BCA工作液和铜标准溶液的体积,单位为mL;βBCA为0.00442,为试剂盒提供值。
最低检测线(LOD)可根据公式计算:
其中s代表空白标准溶液的测定偏差,a代表标准曲线的截距值,k代表标准曲线的斜率。经计算,本方法的最低检测限为0.032μg/mL。
②记录样品中背景孔和样品孔的吸光值,分别记录为A1和A2,代入如下公式中,即可得到样品溶液中铜离子浓度(CCu-sample)。
式Ⅲ中,βCu-BCA为通过式Ⅱ的测定值,MBCA、MCu、MCu-BCA分别表示BCA、铜和Cu-BCA复合物的相对分子质量,单位为g/M;VBCA和VCu分别为加入的BCA工作液和样品溶液的体积,单位为mL;CBCA0为BCA工作液的浓度,单位为μg/mL;βBCA为0.00442,为试剂盒提供值;
样品中铜含量为样品溶液铜离子浓度乘以稀释倍数。
实施例2、添加回收试验
取猪配合饲料、鸡配合饲料、牛血清、自来水,采用原子吸收法测定各样品中铜的含量。随后往各样本中添加高浓度的铜标准溶液,至饲料中添加浓度为0、20、100和400mg/kg,血清和水中添加浓度0、0.5、1、2μg/mL,每个浓度4个平行。采用本试剂盒进行测定。将测定值除以添加值计算回收率,同时计算4个平行测定的相对标准偏差。结果如表1所示。由表1中结果表明:在添加的浓度范围内,平均回收率在86.00%-110.78之间,相对标准偏差小于14.23%。
表1:本试剂盒测定饲料、血清和自来水中铜含量的添加回收试验结果(n=4)
实施例3、其它重金属离子的干扰试验
在饲料中常量元素,微量元素及可能还有的有害元素对本试剂盒方法造成的偏差分析试验。首先测定4μg/mL Cu2+标准溶液产生的吸收值,计为Ab,然后在4μg/mL Cu2+标准溶液中分别添加1-1000μg/mL的Fe2+,Zn2+,Mg2+,Mn2+,和1-10000μg/mL的Ca2+和F-,每种溶液反应产生的吸光值,计为At,以At和Ab值按下列公示计算干扰率(I.P.):
结果如图2所示,产生5%干扰率的离子浓度分别为25、97、88、89、8000和>10000μg/mL的Fe2+、Zn2+、Mg2+、Mn2+、Ca2+和F-,说明本试剂盒测定铜的特异性和选择性较好。
图2显示在偏差百分数为上限5%的情况下,不同干扰离子的最大添加量均如图所示,论证了本发明在干扰离子存在情况下对饲料中铜检测的准确保证性。
实施例4、实际样本测定(与原子吸收光谱测定法的比较)
采用本发明试剂盒方法测定采集的猪、鸡配合饲料35个,测定结果与传统的原子吸收光谱法比较并进行线性回归分析。结果如图3所示。结果表明:本发明试剂盒测定结果与原子吸收法测定结果基本一致,相关性大于0.99。说明本发明试剂盒可用于实际样品的检测。
- 还没有人留言评论。精彩留言会获得点赞!