生物样品用分析仪的质量对照物的制作方法
本发明涉及用于监测生物样品用分析仪和生物样品用自动分析仪的性能的方法。
背景技术:
用于生物样品的自动或半自动分析仪用于多种临床或实验室环境中。通常,由这种自动或半自动分析仪执行的测量的结果,可以形成医学判定的基础,例如开业医生的诊断和/或治疗判定。因此,自动或半自动分析仪通常必须经历严格的质量对照物程序。
这样的分析仪的一个示例是用于执行体外诊断(ivd)方法的装置,其被广泛应用,例如,以帮助诊断疾病或监测治疗的效果。在ivd装置(以及在用于生物样品的其它自动或半自动分析仪)中,周期性地或响应于预定触发事件而插入质量对照物。这些质量对照物可以模拟具体类型的生物样品。质量对照物可以通过使用具有已知特性的具体类型的实际或人工生物样品获得。例如,用于ivd装置的质量对照物可能由来自健康个体的一定量的血液或血浆组成。在其它示例中,ivd装置的质量对照物可以由其中已经添加了特定物质的、来自健康个体的一定量的血液或血浆组成,所述特定物质是例如药物或药物的代谢物。
不幸的是,许多身体物质具有相当有限的保质期。因此,在一些示例中,质量对照物在供应商处来制备和冷冻或冷冻干燥、运送到具体实验室,然后在它们用于监测程序之前不久解冻或重构。
适当地监测生物样品用具体自动或半自动分析仪(例如,ivd装置)的操作所需的不同类型的质量对照物的数量可能相当大。例如,自动或半自动分析仪的每个具体测定可能需要一个以上(例如,“正常”,“轻度异常”和“严重异常”)质量对照物。处理这个数量的质量对照物(特别是以及时的方式)可能是相当复杂的。特别是,制备(包括例如冷冻干燥)许多不同类型的质量对照物制可能是昂贵的。此外,在使用之前手动重构质量对照物可能是相当耗时、乏味且容易出错。
因此,对于生物样品用自动或半自动分析仪进行所需或期望的监测程序,可能在处理生物样品的一般实验室中绑定大量的资源。
技术实现要素:
本发明的第一总体方面涉及一种用于监测生物样品用分析仪性能的方法,所述分析仪具有自动制备装置,所述方法包括:接收要执行监测程序的指令;在收到要执行监测程序的指令后:通过所述自动制备装置从包括多种质量对照物成分的储存库获得至少两种质量对照物成分,通过所述自动制备装置在样品制备容器中混合所述至少两种质量对照物成分,以获得模拟将由所述分析仪分析的生物样品特性的质量对照物;所述方法进一步包括:确定所述质量对照物的至少一个参数;并且基于所述质量对照物的所确定的参数,确定所述分析仪的状态。
本发明的第二总体方面涉及一种用于监测生物样品用分析仪性能的方法,所述分析仪具有自动制备装置,所述方法包括:接收要执行监测程序的指令;在收到要执行监测程序的指令时,通过所述自动制备装置:从包括多种质量对照物成分的储存库获得一种以上基质溶液;从包括多种质量对照物成分的所述储存库获得一种以上改性剂;并且在样品制备容器中混合至少所述一种以上基质溶液和所述一种以上改性剂,以制备模拟要由所述分析仪分析的生物样品特性的质量对照物;所述方法进一步包括:确定所述质量对照物的至少一个参数;如果所述至少一个参数偏离目标参数范围,则将所述分析仪的状态设置为故障状态。
本发明的第三总体方面涉及一种用于分析生物样品的自动分析仪,包括:储存库,用于存储用于制备质量对照物的多种质量对照物成分;自动制备装置,被构造成在收到要执行监测程序的指令之后,从包括多种质量对照物成分的所述储存库获得至少两种质量对照物成分,并且在样品制备容器中混合所述至少两种质量对照物成分,以获得模拟要由所述分析仪分析的生物样品特性的质量对照物;测量装置,被构造成确定所述质量对照物的至少一个参数,以及基于所述质量对照物的所确定的参数确定所述分析仪的状态。
在一些实施例中,第一和第二总体方面的方法和第三总体方面的设备能够具有以下优点中的一个以上。
首先,质量对照物可以直接在性能要被监测的分析仪中(或在安放该分析仪的实验室中)进行制备。这可以减少必须运送到拥有一个以上要被监测的分析仪的实验室中、存储在该实验室中并且最终在该实验室中重构的质量对照物的数量。在一些示例中,质量对照物被冷冻干燥,然后以冻干形式运送到目的地实验室。在目的地实验室使用前,要重构冷冻干燥的质量对照物,这可能是个劳动强度较高和较为耗时且易于出错的过程。在一些示例中,本发明的技术可以取代处理冷冻干燥的质量对照物(或至少减少要处理的冷冻干燥物品的数量)。这可以释放实验室环境中的大量资源。
其次,质量对照物能够通过分析仪的制备装置来制备。例如,一些分析仪包括移液器或适于根据预定配方自动制备样品的其它液体处理单元。当使用根据本发明的技术来制备用于分析仪测量过程的质量对照物时,能够使用这种移液器。以这种方式,本发明的技术能够允许更有效地使用实验室设备。
第三,在一些示例中,分析仪的自动制备装置(例如,移液器)会是相当精确的。与用户对冻干对照物的手动重构相比,这能够提高在分析仪中产生质量对照物的质量和再现性。
第四,在一些示例中,当使用本发明的技术时,可以按照需要制备质量对照物(例如,就在它们用于性能监测程序之前)。这可以减少质量对照物的存储时长。由于许多质量对照物时间长时不稳定,这会使处理质量更有效和成本更低。
第五,在一些实施例中,可以用数量有限质量对照物成分组制备多种不同的质量对照物。例如,血清或血浆(即具体基质)可以用作针对有关血清或血浆样品进行操作的测定的大量质量对照物的基质。以相同的方式,具体药物代谢物(即,改性剂)可以用于制备不同水平的质量对照物或可以与不同的基质组合。这可以减少在实验室中要处理(例如,供应、储存和重构)的物品的数量。
第六,质量对照物成分可以以液体形式(或以不同的前体形式)储存,与由质量对照物成分制备的质量对照物相比,这种形式具有相对长的保质期。例如,已经加入改性剂或已经稀释的血清或血浆样品可能无法长时间稳定。在一些示例中,这些基质包括其效果被所添加的物质或稀释剂削弱的蛋白质,和/或所添加的物质可能被一些基质组分损害,例如被化学转化。这意味着这些质量对照物只能以其即用形式存储相当有限的时间。因此,在一些现有技术的解决方案中,质量对照物以冻干形式存储。如上所述,这可能需要相当复杂的设备和过程。另一方面,根据本发明的至少一些质量对照物成分可以液体形式储存。因此,当使用本发明的技术时,在一些示例中,可以简化质量对照物的储备保存。
第七,质量对照物成分可以按照与用于分析仪中进行分析测试的试剂类似的方式处理。例如,质量对照物成分可以在易于在分析仪外部和内部处理的一次性盒或储箱中制备。
第八,在一些示例中,本发明的技术可以以全自动的方式来执行。分析仪只需要储备选定数量的质量对照物成分,然后就可以自动为大量性能监测程序制备质量对照物。特别是,在给定质量对照物成分的数量的情况下,至少在一些情况下可以制备数量比质量对照物成分的数量更多的质量对照物。这可以例如通过根据具体需要将不同质量对照物成分组合在一起和/或将不同数量的质量对照物成分组合在一起以获得相应不同浓度的质量对照物成分来实现,从而消除了预先具有所有可能的即用型或即时重构型的质量对照物的需要。
在提供了对本发明技术的概述之后,在下面的段落中将讨论在本发明中以特定方式使用的若干术语。
术语“质量对照物”是指用于监测生物样品用分析仪性能的任何物质或组合物。术语“质量对照物”在本发明中用于指在监测分析仪特定测试或测定性能的一个或几个监测程序中使用的物理样品。例如,这种测试或测定可以是凝血酶凝血时间的测定,其中在加入过量凝血酶后,测量在含有抗凝血剂的血液样品血浆中形成凝块所需的时间。在该测试中,质量对照物可以包括血浆作为第一质量对照物成分(基质),凝血酶作为第二质量对照物成分。
在一些实例中,相同的具体质量对照物可用于监测分析仪中多个测试或测定的性能。另一方面,监测任何分析仪中具体测试或测定的性能可以包括不同类型的质量对照物。
术语“质量对照物”不包括分析仪可从待分析的生物样品制备的参考样品。
术语“监测程序”包括用于监测分析仪可对生物样品进行的具体测试(或具体测定)的性能的任何过程。这些测试或测定能够包括分析仪可能对生物样品进行的任何临床或实验室测试或测定。监测程序可以包括确定一个以上质量对照物的一个以上参数。
为了举例说明的目的,随后将列出多种测试或测定。在前面的段落中提到了凝血酶凝血时间测试或测定。在该示例中,模拟在凝血酶凝血时间测试或测定中使用的生物样品的一个以上质量对照物的一个以上参数,可以作为监测程序的一部分来确定。在其它示例中,测试或测定可以是评估凝血外在途径的凝血酶原时间(“pt”)测试或测定。在其它示例中,测试或测定包括部分凝血活酶时间(“ptt”)测试或测定,或作为表征血液凝固的另一种医学测试的活化部分凝血活酶时间(“aptt”或“aptt”)。在其它示例中,测试或测定可以确定纤维蛋白原、抗凝血酶、维伦布兰德因子(vonwillenbrandfactor)、d-二聚体、利伐沙班(rivaroxaban)、肝素、达比加群(dabigatran)、凝血蛋白(例如,因子viii或因子ix)的水平。在其它实例中,测试或测定可以确定药物或药物代谢物或疾病标志物的水平。
在其它示例中,测试或测定可适于检测过敏反应标志物(例如,特定抗体)、贫血标志物(例如,铁蛋白、叶酸或维生素b12)、依赖性引发物质(例如安非它明、巴比妥酸盐、苯并二氮杂、大麻素、可卡因、乙醇、麦角酸二乙胺、美沙酮、甲喹酮、阿片制剂、羟考酮、苯环利定、丙氧芬)或前述依赖性引发物质的代谢物、酶(例如acp、alt/gpt、alp、胰腺酶、ast(got、胆碱酯酶、ck、ck-mb、ggt、gldh、hbdh、乳酸盐或脂肪酶)、生长激素、糖化血红蛋白、免疫抑制剂(例如环孢菌素、mpa、它克莫司)、炎症标志物(例如,抗ccp)、特异性蛋白(例如,alb、a1mg、aslo、apoa、apob、ceru、c3c、c4、crp、hscrp、cysc、ferr、hapt、iga、igg、igm、kappa、lambda、lpa、myo、prea、rf、stfr、trans、aagp、aat或b2mg)、底物(例如白蛋白、氨、co2、胆红素、血尿素氮、钙、胆固醇、肌酸酐、果糖胺、hdl胆固醇、高半胱氨酸、铁、ldh、镁、磷、甘油三酯或尿酸)、治疗药物(例如,对乙酰氨基酚、环孢霉素、mpa或它克莫司)、甲状腺激素或蛋白质(例如,抗tsht、抗tg、抗tpo、降钙素、ft3、ft4、tg、tsh、t4或t3)、甲状腺自身免疫疾病标志物(例如,抗tshr、抗tg或抗tpo),或甲状腺癌标志物(例如,降钙素或tg)。
性能可以通过本发明技术制备的质量对照物进行检测的分析仪,其进一步的示例性测试或测定包含在下面。
术语“质量对照物成分”包括可以是用于监测生物样品用分析仪的具体测试性能的质量对照物的组成部分的任何物质。
在一个示例中,质量对照物成分可包括基质(例如,基质溶液)。这些基质可以来自体液或体液的组分。在其它示例中,基质(例如基质溶液)可以是模拟体液或体液组分特性的人造物质。在一些示例中,基质(例如基质溶液)可以包括血液、唾液、眼晶状体液、脑脊液、汗液、尿液、粪便、精液、牛奶、腹水液、粘液、滑液、腹膜液、羊水、组织、培养的细胞或这些身体物质的成分。在其它实例中,基质可以包括这些身体物质的浓缩或稀释形式。
在一个实例中,基质溶液可以是血浆或血清。在一个实例中,将基质溶液冷冻干燥。在一个实例中,仅质量对照物成分中的基质溶液被冷冻干燥。
作为补充或作为替代,质量对照物成分可以包括改性用试剂(在本发明中也称为“改性剂”)。在一些示例中,改性用试剂可以包括药物、药物的代谢物、在预定的医学或代谢条件下积累的物质、通常不存在于体液中的物质以及通常存在于体液中的物质中的一个以上。例如,改性用试剂可以是肝素、水蛭素、利伐沙班、达比加群、d-二聚体、凝血酶原、药物或药物代谢物、酶、生长激素、免疫抑制剂、蛋白质、炎症标志物、例如白蛋白的底物、胆红素、肌酸酐和疾病标志物。
作为补充或作为替代,质量对照物成分可以包括稀释剂。例如,稀释剂可以是水、盐溶液(例如盐水溶液)。
作为补充或作为替代,质量对照物成分可以包括稳定剂。一般来说,稳定剂可以改善质量对照物(例如,包括特定基质溶液和一种以上改性剂的质量对照物)的稳定性。例如,稳定剂可以是白蛋白、明胶、糖或盐。
作为补充或作为替代,质量对照物成分可以包括试剂。术语“试剂”是指当在分析仪中对生物样品进行特定测试时添加到生物样品中以在血液样品中引发特定反应的物质。试剂可以专用于特定的测试或测定(例如,上述测试或测定)。例如,在要确定血液样品的部分凝血活酶时间的情况下,分析仪可以被构造为将激活剂作为试剂添加到血液样品中,以激活凝血的内在途径。在不同的情况下,具体物质可以是根据本发明的“改性剂”或“试剂”。在一些示例中,分析仪可以不向待分析的生物样品添加试剂。因此,在一些示例中,质量对照物可以不包括试剂。
本文使用的术语“分析仪”/“分析工作单元”/“分析单元”涵盖可以测量生物样品的分析特性的任何设备或设备部件,例如在生物样品与试剂反应之后进行测量以用于获得测量值。
分析仪可操作以确定生物样品或其组分的一个以上参数。例如,参数能够是包含在比色皿中的生物样品的吸收率、透射率或反射率。在其它示例中,参数可以是生物样品用激发光照射过之后的荧光性。除了下面讨论的分析仪的光学测量装置(例如,用以确定吸收率、透射率或反射率)之外,分析仪可以包括通过一个以上化学程序、生物程序、物理程序或其它技术程序来确定样品的参数的测量装置。
分析仪可操作以确定样品或至少一种分析物的所述参数,处理所确定的参数,并返回获得的测量值。由分析仪返回的可能的分析结果列表,包括但不限于样品中分析物的浓度、指示样品中分析物存在(对应于高于检测水平的浓度)的定性(是或否)结果、光学参数、dna或rna序列、从蛋白质或代谢物的质谱获得的数据以及各种类型的物理或化学参数。
分析工作单元可以包括用于移液、配量和混合样品和/或试剂的单元。分析仪可以包括用于保持试剂以进行测定的试剂保持单元。试剂可以例如以容纳单独试剂或试剂组的储箱或盒的形式布置,放置在储存隔室或传送器内的适当容器或位置中。它可以包括可消耗的供给单元。分析仪可以包括工作流程针对某些类型的分析被优化的过程和检测系统。这种分析仪的示例是用于检测化学或生物反应的结果或用于监测化学或生物反应过程的临床化学分析仪、凝血化学分析仪、免疫化学分析仪、尿液分析仪、血液分析仪、核酸分析仪。
术语“生物样品”是指可能含有相关分析物的材料。生物样品可以来源于任何生物来源,例如生理流体,包括血液、唾液、眼晶状体液、脑脊液、汗液、尿、粪便、精液、牛奶、腹水、粘液、滑液、腹膜液、羊水、组织、培养细胞等。生物样品可以在使用前进行预处理,例如从血液制备血浆。处理方法可以包括离心、过滤、蒸馏、稀释、浓缩和/或分离包括相关分析物的样品组分、干扰组分的失活和试剂的添加。生物样品可以直接从源获得或在预处理以改变样品特性后使用。在一些实施例中,初始时为固体或半固体的生物材料可以通过用合适的液体介质溶解或悬浮,而变成液体。在一些示例中,可设想样品中含有某种抗原或核酸。
附图说明
图1是根据本发明可以使用来自质量对照物成分储存库的质量对照物成分产生的不同质量对照物的示意图。
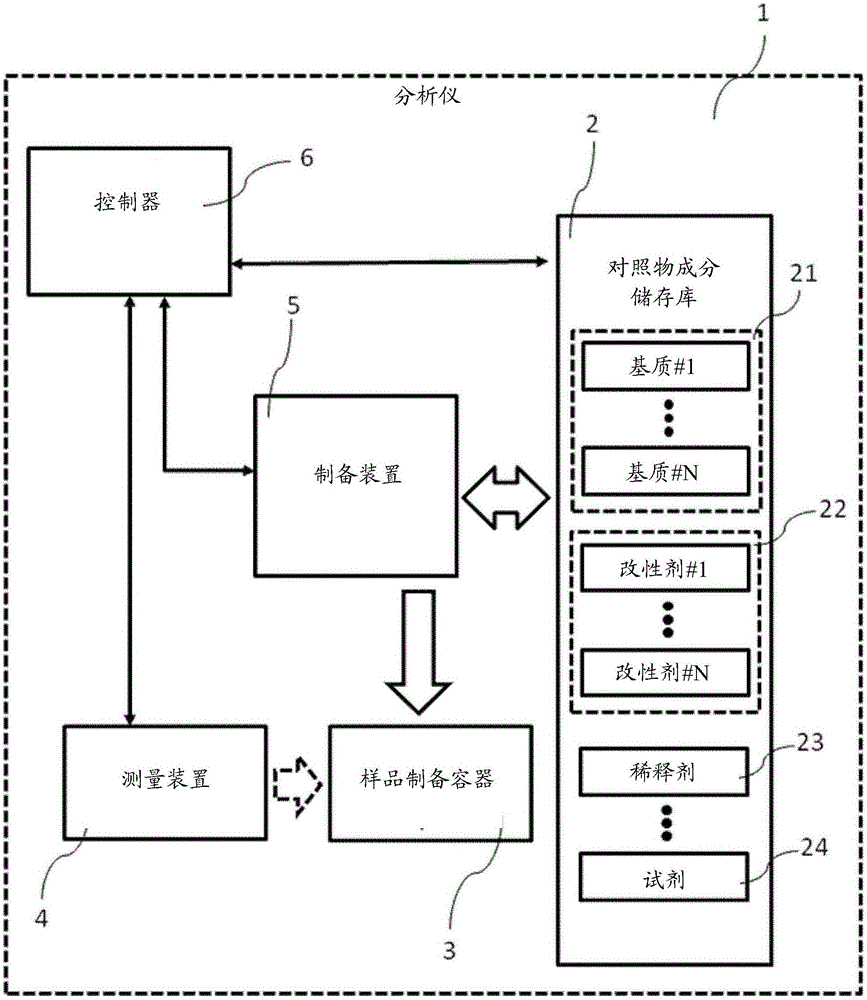
图2是根据本发明的分析仪的示意图,该分析仪包括适于制备质量对照物的组件。
图3是根据本发明包括适于制备质量对照物的组件的另一分析仪的示意图。
图4a至图10是示出根据本发明的用于制备质量对照物的不同方法的流程图。
具体实施方式
随后将讨论本发明的用于监测生物样品用分析仪和生物样品用自动分析仪的性能的方法的具体方面。
结合图1,将讨论根据本发明的用于监测生物样品用分析仪的性能的方法的一些方面。随后,结合图2和图3,将更详细地处理具有质量对照物制备的根据本发明的自动分析仪的不同方面。最后,结合图4a至图10,将示出如何使用本发明的技术来实现复杂的质量对照物程序。
图1示出了用于监测具有自动制备装置的生物样品用分析仪的性能的方法,包括:接收要执行监测程序的指令;在收到要执行监测程序的指令后,通过自动制备装置从包括多种质量对照物成分21、22、23、24的储存库2获得至少两种质量对照物成分;通过所述自动制备装置在样品制备容器中混合所述至少两种质量对照物成分21、22、23、24,以获得模拟将由所述分析仪分析的生物样品的特性的质量对照物31、32、33,所述方法进一步包括确定所述质量对照物的至少一个参数并基于质量对照物31、32、33的所确定的参数确定分析仪的状态。
在图1的示例中,示出了质量对照物31、32、33的三个不同示例。可以看出,每个质量对照物31、32、33分别包括基质31a、32a、33a(例如,基质溶液)、改性剂31b、32b、33b,和试剂31c、32c、33c或稀释剂33d。图1的质量对照物31、32、33的组成纯粹是用于举例说明性的。如上所述,质量对照物还可以不包括任何改进剂,或包括两种或更多种不同类型的改性剂。作为补充或作为替代,质量对照物可以不包括任何基质,或包括两个或更多不同类型的基质。作为补充或作为替代,质量对照物可以不包括任何试剂和/或稀释剂,或包括两种或更多种不同类型的试剂和/或稀释剂。
在下面的段落中,将讨论由液体形式的质量对照物成分制备液体状态的质量对照物的例子。然而,本发明用于制备质量对照物的技术同样可以应用于制备气态或固态的质量对照物,或者处理气态或固态形式的质量对照物成分。例如,施加有改性剂和基质的测试条可以是根据本发明的质量对照物。作为补充或作为替代,质量对照物成分可以以固体和气体形式储存在质量对照物成分储存库中。
返回到图1的示例,第一质量对照物31和第二质量对照物32可以是不同质量对照物成分的液体混合物。第一质量对照物31可以是监测分析仪在进行第一测试或测定时的性能所需的质量对照物。相应地,第二质量对照物32可以是监测分析仪在执行第二测试或测定时的性能所需的质量对照物。
可以看出,第一和第二质量对照物31、32包含相同类型的基质溶液31a、32a(例如血清或血浆)和相同类型的试剂31c、32c。然而,第一和第二质量对照物31、32的改性剂31b、32b不同。另一方面,第三质量对照物33包括与第一质量对照物31相同类型的改性剂33b,但是包括不同类型的基质溶液33a。
相应地,质量对照物成分储存库2可以包括基质溶液21、改性剂22、稀释剂23和试剂24,这些成分能够以不同的方式组合,以在分析仪中制备不同的质量对照物。例如,可以通过以不同的方式组合一组质量对照物成分21、22、23、24来制备不同类型的质量对照物。作为补充或作为替代,可以通过多次地使用来自质量对照物成分储存库2的相同质量对照物成分来制备相同类型的质量对照物的多个实例。以这种方式,较少量的质量对照物成分储备就足以制备大量的质量对照物。
关于用于监测生物样品用分析仪的性能的方法的进一步细节,将在下面结合图4a至图10进行讨论。接下来,将结合图2和图3讨论根据本发明的生物样品用自动分析仪。
图2是根据本发明的用于分析生物样品用自动分析仪1的示意图,该自动分析仪1包括:储存库2,用于存储用于制备质量对照物的多种质量对照物成分21、22、23、24;自动制备装置5,被构造成用于在接收到要执行监测程序的指令之后,从包括储存库2获得至少两种质量对照物成分21、22、23、24,并在样品制备容器3中混合所述至少两种质量对照物成分21、22、23、24,以获得模拟要由分析仪分析的生物样品的特性的质量对照物;测量装置4,被构造为用于确定所述质量对照物的至少一个参数,并且基于所述质量对照物的所确定的参数来确定所述分析仪的状态。
在图2的示例中,分析仪1还包括控制器6,其被构造为用于控制质量对照物的制备和分析过程。特别是,控制器6控制质量对照物成分储存库2、制备装置5和测量装置4的操作。在其它示例中,控制器6可以在分析仪1外部(例如,远离分析仪1设置的控制器)。例如,可以在实验室中提供中央控制器,用以控制多个分析仪和其它实验室设备。
控制器6可以被构造为控制分析仪1的不同装置,以执行根据图4a至图10中任一个的操作。
分析仪1的其他装置将在随后的部分中讨论。
制备装置5可以是构造为在分析仪1中自动处理或制备生物样品或试剂的分析仪的任何装置。在以下部分中,移液器将用作示例自动制备装置。然而,在其它示例中,自动制备装置5可以具有不同的形式。例如,自动制备装置可以包括适于操纵质量对照物成分的机器人夹持器。在其它实例中,自动制备装置可以是被构造成将质量对照物成分分配到样品制备容器中的分配器或喷射器。可以看出,自动制备装置可以具有许多不同的形式。
在自动制备装置5包括移液器的示例中,移液器可被构造成从质量对照物成分储存库2的储箱中对质量对照物成分21、22、23、24进行取样,并将质量对照物成分21、22、23、24分配到样品制备容器3。以相同的方式,移液器能够被构造为从质量对照物成分储存库2中对第二质量对照物成分21、22、23、24(以及任选的是,一个以上另外的质量对照物成分21、22、23、24)进行取样,并且将其分配到样品制备容器3中。以这种方式,用于分析仪的具体测试和测定的质量对照物能够在样品制备容器3中混合。
在一些示例中,移液器5(或其它自动制备装置)可以是用于制备质量对照物的专用装置。在其它示例中,移液器5可以是分析仪的移液器,该移液器构造成自动处理在分析仪中分析的生物样品和/或在分析过程中使用的试剂。换句话说,分析仪的自动移液器5可以具有用于样品制备和质量对照物制备的双重用途。
在一些示例中,自动移液器可包括多个移液头。第一移液管头或第一组移液头可以被构造成用于处理在分析过程中使用的生物样品和/或试剂。第二移液头或第二组移液头可用于处理质量对照物和/或质量对照物成分。
作为补充或作为替代,移液器可以被构造成避免使用相同的移液头来处理生物样品和/或试剂和质量对照物成分的具体组合(以避免样品或质量对照物的污染,或确保制备质量对照物能够独立于测量过程)。
作为补充或作为替代,移液器可以被构造为使用一次性或可清洗的移液头来处理质量对照物成分。以这种方式,可以使用相同的移液头来处理不同的物质。
尽管上述讨论使用移液器作为示例解释了自动样品制备装置5的不同特性,但是可替代的自动制备装置也可以具有上述特征(除非这些特征是移液器专有的)。
接下来将讨论质量对照物成分储存库2。如图2所示,质量对照物成分储存库2可以在分析仪1的内部,分析仪1的性能要通过使用其中存储的质量对照物成分21、22、23、24制备的质量对照物来监测。然而,在其它实施例中,质量对照物成分储存库2可以位于分析仪外部(并且可以由自动制备装置5使用)。例如,多个分析仪可以共享单个质量对照物成分储存库2。
质量对照物成分储存库2可以包括制备各种不同质量对照物所需的多个不同的质量对照物成分21、22、23、24(参见例如上下文中结合图4a至图10讨论的示例质量对照物)。在其它示例中,质量对照物成分储存库2可以被构造为仅包括制备一个具体质量对照物(例如,后续监测程序所需的质量对照物)所需的质量对照物成分21、22、23、24。以相同的方式,质量对照物成分储存库2可以被构造为仅包括制备用于随后监测程序所需的两个或更多个具体质量对照物所需的质量对照物成分21、22、23、24。
在一些示例中,质量对照物成分储存库2可以是储存库的整体部分,所述储存库还容纳在分析仪中对生物样品所进行的分析程序中使用的试剂。在这些示例中,自动制备装置5可以以与试剂相同的方式处理质量对照物成分。
接下来将简要讨论质量对照物成分储存库2的构造。总的来说,质量对照物成分21、22、23、24可以以任何合适的形式存储在质量对照物成分储存库2中。在一些示例中,至少一些质量对照物成分21、22、23、24可以以液体形式储存在质量对照物成分储存库2中。例如,至少一些基质21可以作为基质溶液21a、21b存储在质量对照物成分储存库2中。在其它实施例中,基质21可以冻干形式储存在质量对照物成分储存库2中。作为样品制备过程的一部分,冻干形式的基质可以通过添加例如稀释剂23等另一种质量对照物成分而成为液体形式(重构)。
作为补充或作为替代,改性剂22可以以液体形式储存在质量对照物成分储存库2中。
质量对照物成分21、22、23、24可以包含在任何合适的容器(例如,储箱,罐,比色皿,管,筒或瓶)中。
在一个示例中,容器可以是一次性的并且包含用于制备一个以上具体质量对照物实例的具体质量对照物成分(例如,一次性储箱、罐,比色皿、管、筒或瓶)。在其它示例中,一次性容器可以包含用于制备一个以上具体质量对照物实例的一组质量对照物成分。
在其它实施例中,质量对照物成分可以作为容器套件(例如,一次性容器)提供,其中包括具体类型监测程序所需的质量对照物成分(例如,所有质量对照物成分)。在其它实施例中,质量对照物成分可以作为容器套件(例如,一次性容器)提供,其中包括具体组监测程序所需的质量对照物成分(例如,所有质量对照物成分)。例如,套件可以包括一个以上容器,容器中包括制备针对分析仪一个以上监测步骤的一个以上质量对照物所需的一种以上基质(例如,液体或冻干形式)和一种以上改性剂。容器套件还可以包括套件物品的使用说明。
在其它示例中,质量对照物成分被提供于与分析仪进行的分析过程期间在分析仪中使用的试剂相同类型的容器中。
如图2所示,自动制备装置5将质量对照物成分分配到样品制备容器3中。样品制备容器3可以具有用于制备质量对照物的任何合适的形式。例如,样品制备容器3可以是比色皿、管、盘或碗。在其它示例中,制备容器3可以是基板(例如,显微镜载玻片或测试条或其他基板),在所述基板上可以混合质量对照物成分。
在一些示例中,样品制备容器3可以是一次性样品制备容器。在其它示例中,样品制备容器3可以是可重复使用的(例如,可洗的)。
在图2的示例中,样品制备容器3同时也是测试容器。这意味着,质量对照物被包含在样品制备容器3中的时候,测量装置4可以确定质量对照物的一个以上参数。其它示例将在下面结合图3进行讨论。
在一个示例中,样品制备容器3可以放置在与用于待分析的生物样品的容器相同的位置。在这些示例中,测量装置4可以按照用于分析生物样品的相同设置确定质量对照物的一个以上参数。
例如,分析仪可以包括多个比色皿(或其它容器),生物样品和/或试剂可以通过自动制备装置5分配到其中。在一个示例中,分析仪1被构造为在所述多个比色皿(或其它容器)中的一个以上中制备本发明中所描述的一个以上质量对照物。随后,测量装置可以用于确定质量对照物的一个以上参数。
在下面的段落中将简要讨论测量装置4。一般来说,测量装置4的特性对于本发明的技术是不重要的。不管测量装置4的特性如何,都可以执行用于监测分析仪性能的方法。
在一些示例中,测量装置4是光学测量装置。例如,测量装置4可以是被构造成通过透射和/或反射测量来确定质量对照物的至少一个参数的光度计。作为补充或作为替代,测量装置4可以是被构造为接收来自质量对照物的荧光以确定质量对照物的一个以上参数的光学测量装置。在其它示例中,测量装置4可以包括被构造为拍摄质量对照物的图像的一个以上照相机。测量装置4然后可以基于由所述一个以上照相机拍摄的图像来确定质量对照物的一个以上参数。
在结合图2讨论了第一示例分析仪之后,随后将结合图3讨论图2的分析仪的变型。在图2和图3的分析仪中,多个元件是相同的。将不重复这些元件的描述。
图2和图3的分析仪之间的区别在于,图3的分析仪1'包括与样品测量容器7分离的样品制备容器3。样品制备容器3可以如上面结合图2所述使用以制备质量对照物。
然而,质量对照物随后被转移到样品测量容器7中,以确定相应质量对照物的一个以上参数。在一些示例中,可以将一种以上试剂添加(例如,通过自动样品制备装置)到样品测量容器7。在其它示例中,可以在质量对照物成分容器中制备质量对照物,然后转移以在监测程序中使用。例如,具体的质量对照物成分容器可以包括第一质量对照物成分。然后,可以通过制备装置添加一个以上另外的质量对照物成分以制备质量对照物。然后可以将该质量对照物转移到样品测量容器。
在一个示例中,样品制备容器3可以包括多个容器(例如,杯或比色皿),其中可以同时(或顺序地)制备一组质量对照物。例如,第一质量对照物可以包括基质溶液,但不包括改性剂(例如,“正常”质量对照物)。第二质量对照物可以包括相同的基质溶液和预定第一量的改性剂(例如,第一“异常”质量对照物)。此外,第三质量对照物可以包括大于第一量的预定第二量的改性剂(例如,第二“异常”质量对照物)。分析仪可以被构造为确定有关监测程序的所有三个质量对照物的一个以上参数。
在另一个示例中,分析仪可以被构造为制备包括两种或更多种不同浓度的稀释剂的两个或更多个质量对照物。同样,分析仪可以被构造为确定有关监测程序的两个或更多个质量对照物的一个以上参数。
现在将结合图4a至图10讨论如何制备和在监测程序中使用质量对照物的其它方面。在图4a至图10的示例中,分析仪是使用光学测量装置的凝血分析仪。然而,如上面在概述部分中已经阐述的,分析仪可以是用于生物样品的任何类型的分析仪,并且测量装置可以是任何类型的测量装置。本文结合结合图4a至图10针对具有光学测量装置的凝血分析仪所描述的特征,也可应用于其它类型的分析仪(除非相应的特征是凝血分析仪特有的)。例如,分析仪可以是免疫化学分析仪或临床化学分析仪。
图4a、图4b和图4c示出了第一复合监测程序(结合图4a至图10也被称为“质量对照物运行”),该程序包括根据本发明对不同质量对照物的制备。
该过程开始于401,其中分析仪具有储备的质量对照物成分储存库。下面结合图10讨论质量对照物成分储存库2的储备过程的不同方面。
为了举例说明起见,在图4a至图10的示例中,质量对照物成分储存库2包括以下质量对照物成分:作为基质溶液的重构正常血浆(例如,取自健康个体,在图4a、图4b、图7、图8和图10中标记为“n”),作为第一改性剂的肝素溶液(在图4b、图7、图8和图10中标记为“改性剂1”或“m1”),作为第二改性剂的含有利伐沙班、达比加群和d-二聚体的溶液(在图4b、图7、图8和图10中标记为“改性剂2”或“m2”),用于分析仪不同测试或测定的多种试剂(即,用于确定或检测凝血酶原时间、aptt、凝血酶、d-二聚体、纤维蛋白原、凝血酶凝血时间、肝素抗xa活性、利伐沙班抗xa活性、维伦布兰德因子、因子viii或因子ix,在图4b、图7、图8和图10中的“r*”),以及作为稀释剂的盐水。然而,下述方法也可以与任何其它合适的基质、改性剂、试剂和稀释剂,特别是本发明中描述的其它基质、改性剂、试剂和稀释剂一起使用。
在步骤402,启动监测程序(结合图4a至图10也被称为质量对照物“qc”)。在图4a的示例中,监测程序在预定的时间点开始(换句话说,监测程序根据一时间表开始)。例如,监测程序可以每天在预定时间或每天的多个预定时间(例如,在一个示例中在上午8点、下午2点和下午10点)开始。即使图4a至图4c描述了根据一时间表启动具体监测程序,但是该启动技术也可以应用于本发明的所有其它监测程序。
如图4a所示,监测程序可以由分析仪在预定时间自动启动。下面将讨论其它技术和触发事件。
图4a至图4c的监测程序被设计为监测分析仪在进行与凝血相关的多个测试或测定(即,确定或检测凝血酶原时间、aptt、凝血酶、d-二聚体、纤维蛋白原、凝血酶凝血时间、肝素抗xa活性、利伐沙班抗xa活性、维伦布兰德因子、因子viii或因子ix的测试或测定)时的性能。
与凝血相关的测试或测定分为三个不同的组403、404、405:对于每组测试或测定403,执行“1级质量对照物运行”和“2级质量对照物运行”。这将结合图4b和图4c更详细地讨论。
从图4b开始,由分析仪执行“1级质量对照物运行”。在该监测程序步骤406的过程中,分析仪的自动样品制备装置(例如,移液器)将基质溶液和相应的试剂(例如,用于检测维伦布兰德因子的测试或测定的试剂)分配在比色皿中(图4b中的“测试”),以制备质量对照物。该制备步骤以与要由分析仪分析的实际生物样品的制备步骤类似的方式执行。
在另一步骤407中,分析仪通过使用光学检测方法(例如,光度计)测量凝血时间。因此,在图4b的示例中,凝血时间被确定为质量对照物的参数。同样,具体检测方法对于结合图4a至图10讨论的方法是无关紧要的,并且在其它示例中可以是不同的检测方法(使用不同的测量装置)。
随后,在步骤408,分析仪确定所确定的质量对照物参数是否在预定范围内。在其它示例中,分析仪可以确定所确定的参数是否位于预定阈值之上或之下。在其它示例中,分析仪可以确定参数是否满足预定标准。在所有示例中,预定范围、阈值或标准可以被选择为指示分析仪的适当功能。
例如,凝血时间可以预期在生物样品的预定范围内。如果凝血时间超出此范围,这可能表示分析仪故障。这可以通过根据本发明的监测程序来检测。
在步骤409、410和411,根据检测到的参数与预定范围的比较结果,确定分析仪的状态。在图4a的示例中,如果质量对照物的参数在预定范围内,则状态可以是“有效”,如果不是这种情况,则状态可以是“受阻”。
这种状态确定的结果可能不同。在一个示例中,如果所有监测程序都得出状态是有效的,则分析仪可以继续分析生物样本。在其它示例中,如果使用相应质量对照物的监测程序表明状态是有效的,则分析仪可以通过使用具体测试或测定来继续分析生物样本。另一方面,如果一个监测程序表明状态受阻,则分析仪可以制止分析生物样品。在其它示例中,如果使用相应质量对照物的监测程序表明状态受阻,则可制止分析仪通过使用具体测试或测定来分析生物样品。
作为补充或作为替代,如果分析仪的状态被设置为一具体水平(例如,受阻),则分析仪可以向操作者提示错误消息。作为补充或作为替代,如果分析仪的状态被设置为一具体水平(例如,受阻),则分析仪可以启动一个以上自诊断测试。在其它示例中,如果分析仪的状态被设置为一具体水平(例如,受阻),则分析仪可以启动预定的一组另外监测程序。
在图4a至图10的示例中,分析仪可以具有两个不同的状态水平。然而,在其它示例中,分析仪可以具有多于两个状态水平。例如,不同的状态水平可以指示偏离预定范围或预定阈值的程度。在其它示例中,不同的状态水平可以指示预定参数在预定范围内或者低于/高于预定阈值,但在该范围或阈值的预定边界裕度内。在其它示例中,不同的状态水平可以指示与先前涉及具体质量对照物的监测程序相比的变化程度。
作为补充或作为替代,分析仪的状态可以是一般性的(例如,对于由分析仪执行的所有测试或测定),或者可以在每个测试或每个测定水平上进行设置。
不管具体状态水平如何,响应于将分析仪设置为具体状态水平,都可以触发不同的动作。例如,可以向操作者提示状态消息,和/或可以触发附加的自我诊断测试。
回到图4a,测试程序在图4a中描述的针对分析仪的预定测试或测定中使用的多种试剂的过程中循环进行。
在监测程序的第二子步骤中,分析仪执行如图4c所示的2级质量对照物运行。一般来说,虽然1级质量对照物运行仅涉及包括基质溶液和试剂的质量对照物,但2级质量对照物运行还涉及添加改性剂的质量对照物。
在步骤412、413、414可以看到,自动分析仪的制备装置制备不同的质量对照物:第一质量对照物制备过程包括向基质溶液中添加第一改性剂(m1)。第二质量对照物制备过程包括向基质溶液中添加第二改性剂(m2)。在第三质量对照物制备过程中,将稀释剂(d)加入到基质溶液中。
这三个质量对照物中的每一个在作为样品制备装置的预稀释比色皿中混合(如上文结合图2和图3所述)。随后,将质量对照物转移到测试比色皿(或其它合适的容器)。在质量对照物被包含在相应的测试比色皿中的时候,通过自动制备装置添加试剂。
在随后的步骤415-419中,每个质量对照物经历参数确定过程和状态确定过程,如上面结合图4a对于1级质量对照物运行所进行的讨论。响应于有关2级质量对照物测量结果的分析仪状态水平,可以与响应于有关1级质量对照物测量结果的水平相同或不同。
分析仪对预定组测试和测定中的每个测试或测定进行2级质量对照物运行,然后结束监测程序。在随后的预定时间,可以重新启动监测程序。
如已经讨论的那样,本发明的监测程序可以以不同的方式变化。结合图5a和图5b,这些变化的示例将在随后的段落中讨论。
图5a和图5b的监测程序包括第一组测试或测定(参见图5a),对于该测试或测定,根据时间表或在预定时间点启动监测程序(步骤502)。在一个示例中,第一组测试或测定包括的测试或测定(例如,筛选测试)可比其它测试或测定(例如,在具体诊断或治疗程序中的特定测试)在分析仪上更频繁地进行(步骤502)。第一组测试或测定的监测程序在预定时间点启动(步骤501)。在一些示例中,分析仪然后可以运行结合图4a至图4c描述的监测程序。
另外,图5a和图5b的监测程序包括第二组测试或测定(参见图5b),对于该测试或测定,监测程序根据需要或在接收到预定触发事件时启动(步骤505)。
例如,触发事件可以是检测到具体测试或测定将由分析仪执行(或者具体生物样品被提供给分析仪)(步骤504)。
在其它示例中,触发事件可以是要执行具体监测程序的用户命令。在其它示例中,触发事件可以是检测到具体试剂被存储在分析仪上,或者新批次的试剂被存储在分析仪上。这些触发事件不限于在图5a和图5b的具体方法中使用,而是还可以应用于本发明的所有其它监测程序。
在任选的步骤506中,分析仪可以确定针对具体测试或测定是否可以获得有效的监测程序结果。例如,有效的监测程序结果可以包括针对测试或测定的、不早于预定阈值时间的监测程序结果。
如果针对具体测试或测定可以获得有效的监测程序结果,则监测程序结束508(并且,例如,分析仪能够分析生物样品)。
如果针对具体测试或测定没有获得有效的监测程序结果,则可以启动用于具体测试或测定的监测程序(例如,结合图4a至图4b所述的监测程序,或另一监测程序)(步骤507)。根据监测程序的结果,相应地设置分析仪的状态。
结合图6至图8示出了另一示例性监测程序。在该示例中,分析仪在预定时间点启动监测程序(步骤601)。
然后,分析仪可以针对具体测试或测定组执行结合图4a至图4c所描述的监测程序(步骤602、603)。
另外,图6至图8的监测程序包括3级质量对照物运行(参见图7)和4级质量对照物运行(参见图8)。分析仪以类似于上面结合图4c描述的2级质量对照物运行的方式执行3级质量对照物运行和4级质量对照物运行。然而,对于相应的2、3和4级质量对照物运行,添加到质量对照物中的改性剂和稀释剂的量是不同的。例如,对于2级质量对照物运行,所添加的改性剂的量可以低些,对于3级质量对照物运行则可以高些,而对于4级质量对照物运行可以更高些。此外,稀释剂浓度可以在不同的质量对照物运行之间变化。
一般来说,监测程序可以包括本发明方法中任何数量的质量对照物运行和/或本发明方法中质量对照物运行的组合。例如,一种以上改性剂的浓度可以在多个质量对照物(例如,四个或更多个或五个或更多个质量对照物)中变化。作为补充或作为替代,两种或更多种改性剂或基质可以以一种以上不同的组合方式进行组合。
图9示出了根据本发明的另一监测程序。在图9的示例中,监测程序由于检测到对生物样品测量的参数在预定范围(或低于或高于预定阈值)以外而被触发(步骤703、706)。
在一个示例中,该过程开始于接收到具体测试或测定请求(步骤701)。在第一任选步骤702中,分析仪使用第一组测量参数(例如,生物样品的第一稀释水平)测量生物样品的参数。
在随后的步骤703中,分析仪确定生物样品的具体参数,并确定参数是否满足预定标准(例如,位于预定范围内或低于或高于预定阈值)。如果是这种情况,则可以在步骤704发布测量结果。
然而,如果生物样品的参数不满足预定标准,则分析仪可以利用不同于第一组测量参数的第二组测量参数对生物样品进行一个以上附加测量(步骤706)。例如,分析仪可以稀释或浓缩生物样品,并重新运行测量。
在另一任选步骤707中,分析仪可以确定针对第二组测量参数是否具有有效质量对照物结果(例如,如上面结合图5b中的步骤506的解释)。
如果是这种情况,则分析仪可以利用第二组测量参数重新运行测试或测定(步骤705)。
然而,如果不是这种情况,则在步骤708,分析仪可以执行根据本发明的用于具体测试或测定的监测程序。根据该监测程序的结果和分析仪的状态,分析仪可以接着对生物样品重新运行测试或测定。这结束了图9的方法。
一般来说,本发明的所有监测程序可以自动地执行(即,没有用户干预),除非明确提及用户的干预(例如,用户启动具体监测程序)。特别是,在本发明的方法中,对监测程序中所需质量对照物的制备,可以由分析仪自动执行。
本发明的所有自动化技术能够被编码在计算机可读介质上的指令中或电子信号中。计算机可读介质或电子信号能够包括当由分析仪的控制器执行时使分析仪执行本文所述方法操作的指令。
在一些示例中,自动分析仪可能已经配备有执行本发明监测程序所需的硬件。在这种情况下,分析仪可以被授权以通过软件或固件更新来执行本发明的监测程序。
最后,结合图10,将讨论根据本发明的对质量对照物成分储存库进行储备的过程。
如已经详细描述的那样,可以在质量对照物成分储存库中存储不同的基质(801)、存储改性用试剂(802、803)、存储稀释剂(804)和存储试剂(805)。
在一些示例中,一个以上质量对照物成分可以以预处理形式(例如,冻干形式)运输。在这种情况下,质量对照物成分可以由用户制备以在分析仪中使用(807),或由分析仪自身制备以在分析仪中使用(808)。
在一个示例中,分析仪可以被构造为重构冻干质量对照物成分(例如,使具体基质处于液体形式)(808)。
在质量对照物成分已经被装载到分析仪(由用户,或由进给存储装置以自动方式)(806)之后,分析仪可以准备执行本发明的监测程序。
在前面的详细描述中,已经讨论了本发明的光学测量装置和方法的多个示例。然而,本发明的光学测量装置和方法也可以按以下方面中阐述的那样构造:
1.一种用于监测生物样品用分析仪性能的方法,所述分析仪具有自动制备装置,所述方法包括:
接收要执行监测程序的指令;
在收到要执行监测程序的指令后:
通过所述自动制备装置从包括多种质量对照物成分的储存库获得至少两种质量对照物成分,
通过所述自动制备装置在样品制备容器中混合所述至少两种质量对照物成分,以获得模拟将由所述分析仪分析的生物样品特性的质量对照物;
所述方法进一步包括:
确定所述质量对照物的至少一个参数;并且
基于所确定的质量对照物参数来确定所述分析仪的状态。
2.根据方面1所述的方法,其中,所述至少两种质量对照物成分包括一种以上基质溶液和一种以上改性剂。
3.根据方面2所述的方法,其中,所述基质溶液源自于体液或体液组分,或其中,所述基质溶液是模拟体液或体液组分特性的人造物质。
4.根据方面2或3所述的方法,其中,所述基质溶液源自于血浆或血清,或是模拟血浆或血清特性的人造物质。
5.根据方面2至4中任一项所述的方法,其中,所述基质溶液是冻干的。
6.根据前述方面2至5中任一项所述的方法,其中,所述一种以上改性剂包括下述物质中的一种以上:药物,药物的代谢物,在预定医学或代谢条件下积累的物质,通常不存在于体液中的物质,通常存在于体液中的物质。
7.根据前述方面2至6中任一项所述的方法,其中,所述一种以上改性剂包括下述物质中的一种以上:肝素,水蛭素,利伐沙班,达比加群,d-二聚体,凝血酶原,药物或药物代谢物,酶,生长激素,免疫抑制剂,蛋白质,炎症标志物,白蛋白、胆红素、肌酸酐和疾病标志物等基质。
8.根据前述方面2至7中任一项所述的方法,还包括:通过自动制备装置向样品制备容器中添加稀释剂或试剂。
9.根据方面8所述的方法,其中,所述稀释剂包括水或者盐溶液中的一种以上。
10.根据前述方面2至9中任一项所述的方法,还包括:通过自动制备装置向样品制备容器中添加稳定剂。
11.根据前述方面中任一项所述的方法,其中,所述质量对照物模拟健康供体的生物样品、经受预定医疗或代谢状况的患者的生物样品、或摄取预定药物或其他物质的患者的生物样品。
12.根据前述方面中任一项所述的方法,其中,监测程序包括确定一个质量对照物的至少一个参数。
13.根据前述方面1至11中任一项所述的方法,其中,监测程序包括确定两个或更多个质量对照物的至少一个参数。
14.根据前述方面中任一项所述的方法,其中,包括多种质量对照物成分的所述储存库是所述分析仪的一部分。
15.根据方面14所述的方法,其中,所述储存库包括一个以上储箱,每个储箱都包括制备一个以上具体质量对照物实例所需的质量对照物成分。
16.根据方面15所述的方法,其中,所述储箱是一次性储箱,包括单个质量对照物所需要的质量对照物成分。
17.根据前述方面14至16中任一项所述的方法,其中,储存库包括一个以上储箱,所述一个以上储箱具有能够用于制备两种或更多种不同类型质量对照物的质量对照物成分。
18.根据前述方面2至17中任一项所述的方法,其中,所述质量对照物成分中的至少一个以液体形式存储。
19.根据前述方面中任一项所述的方法,其中,所述方法还包括在样品制备容器中混合所述至少两种质量对照物成分,以获得除先前制备的质量对照物外的另一质量对照物,所述另一质量对照物模拟要由分析仪分析的、不同于先前制备的质量对照物弹性的生物样品特性;
确定所述另一质量对照物的至少一个参数;并且
基于所述先前制备的质量对照物的所确定的参数和所述另一质量对照物的所确定的参数,确定分析仪的状态。
20.根据方面19所述的方法,其中,所述先前制备的质量对照物和所述另一质量对照物共享至少一种公共基质溶液或者至少一种公共改性剂。
21.根据方面20所述的方法,其中,所述先前制备的质量对照物和所述另一质量对照物包括至少一种不同的基质溶液或者至少一种不同的改性剂。
22.根据前述方面中任一项所述的方法,还包括:
接收要执行第二监测程序的指令;
在接收到要执行第二监测程序的指令之后:
通过所述自动制备装置从所述储存库获得至少两个另外质量对照物成分;
通过所述自动制备装置在样品制备容器中混合所述至少两个另外质量对照物成分,以获得除了先前制备的质量对照物之外的另一质量对照物,所述另一质量对照物模拟将由所述分析仪分析的生物样品特性;所述方法进一步包括:
确定所述另一质量对照物的至少一个参数;并且
基于所述另一质量对照物的所确定的参数,确定所述分析仪的状态。
23.根据方面22所述的方法,其中,所述先前制备的质量对照物和所述另一质量对照物共享至少一种公共基质溶液或者至少一种公共改性剂。
24.根据方面22所述的方法,其中,所述先前制备的质量对照物和所述另一质量对照物包括至少一种不同的基质溶液或者至少一种不同的改性剂。
25.根据前述方面中任一项所述的方法,其中,所述监测程序根据预定时间表执行。
26.根据方面25所述的方法,其中,所述监测程序定期地执行。
27.根据前述方面中任一项所述的方法,其中,在接收到触发事件时,执行所述监测程序。
28.根据方面27所述的方法,其中,所述触发事件包括确定:预定类型的生物样本将由所述分析仪分析,具体的测试程序将由所述分析仪执行,新批次的试剂被放置在所述分析仪中,以及所述分析仪已经测量出具体测量结果。
29.根据方面28所述的方法,其中,确定所述分析仪已经测量出具体测量结果,包括确定所述分析仪测量出的测量结果在预定范围之外。
30.根据前述方面中任一项所述的方法,还包括:响应于触发事件或在预定时间,自动生成要执行监测程序的指令。
31.根据前述方面中任一项所述的方法,其中,所述获得步骤、制备步骤和确定步骤由所述分析仪自动执行。
32.根据前述权利要求中任一项所述的方法,其中,基于所述质量对照物的所确定的参数确定分析仪的状态,包括将所确定的参数与预定目标参数比较。
33.根据前述权利要求中任一项所述的方法,其中,所述分析仪的状态可包括所述分析仪准备好分析生物样品的畅行状态和所述分析仪没有准备好分析生物样品的故障状态中的一种。
34.根据前述权利要求中任一项所述的方法,其中,如果所述质量对照物的所确定的参数偏离目标参数或者目标参数范围,则所述分析仪被设置为故障状态。
35.根据前述方面2至34中任一项所述的方法,还包括:制备一个以上另一质量对照物,其中,所述第一质量对照物和所述一个以上另一质量对照物包括不同比例的一种以上改性剂。
36.根据方面35所述的方法,其中,所述第一质量对照物包括预定量的改性剂,使得所述第一质量对照物的至少一个参数处在异常范围中,并且所述一个以上另一质量对照物中的第二质量对照物包括数量高于或低于所述第一质量对照物的改性剂,使得所述第二质量对照物的至少一个参数也处在异常范围中。
37.根据前述方面2至34中任一项所述的方法,还包括:制备一个以上另一质量对照物,其中,所述第一质量对照物和所述一个以上另一质量对照物包括相同的改性剂,但包括不同的基质溶液。
38.根据前述方面中任一项所述的方法,还包括:制备一个以上另一质量对照物,其中,所述第一质量对照物和所述一个以上另一质量对照物包括不同比例的稀释剂。
39.根据前述权利要求中任一项所述的方法,其中,所述分析仪是免疫化学分析仪、临床化学分析仪或者凝血分析仪。
40.根据前述权利要求中任一项所述的方法,其中,所述制备装置包括移液系统,所述移液系统包括一个以上移液器。
41.根据前述方面中任一项所述的方法,其中,所述制备装置还用以制备要在分析仪中分析的样品。
42.根据前述方面中任一项所述的方法,还包括:将所述质量对照物从所述样品制备容器转移到所述分析仪的分析容器中,其中,所述质量对照物的所述至少一个参数在所述质量对照物处于所述分析容器中时确定。
43.根据前述方面中任一项所述的方法,其中,对确定所述质量对照物至少一个参数的步骤的确定,发生在当所述质量对照物被包含在所述样品制备容器中时。
44.根据前述方面中任一项所述的方法,其中,所述分析仪包括用于制备质量对照物的多个样品制备容器。
45.根据前述方面中任一项所述的方法,还包括:在确定所述质量对照物的所述至少一个参数之前,将一种以上试剂添加到所述质量对照物。
46.根据前述方面中任一项所述的方法,其中,所述自动制备装置包括用于制备质量对照物的专用处理器,所述专用处理器不用于处理要在所述分析仪中分析的生物样品。
47.一种用于监测生物样品用分析仪性能的方法,所述分析仪具有自动制备装置,所述方法包括:
接收要执行监测程序的指令;
在收到要执行监测程序的指令时,通过所述自动制备装置:
从包括多种质量对照物成分的储存库获得一种以上基质溶液;
从包括多种质量对照物成分的所述储存库获得一种以上改性剂;并且
在样品制备容器中混合至少所述一种以上基质溶液和所述一种以上改性剂,以制备模拟要由所述分析仪分析的生物样品特性的质量对照物;
所述方法进一步包括:
确定所述质量对照物的至少一个参数;和
如果所述至少一个参数偏离目标参数范围,则将所述分析仪的状态设置为故障状态。
48.一种用于分析生物样品的自动分析仪,包括:
储存库,用于存储用于制备质量对照物的多种质量对照物成分;
自动制备装置,被构造成在收到要执行监测程序的指令之后,从包括多种质量对照物成分的所述储存库获得至少两种质量对照物成分,并且在样品制备容器中混合所述至少两种质量对照物成分,以获得模拟要由所述分析仪分析的生物样品特性的质量对照物;
测量装置,被构造成确定所述质量对照物的至少一个参数,以及基于所述质量对照物的所确定的参数确定所述分析仪的状态。
49.根据方面48所述的自动分析仪,其中,所述自动制备装置被构造成通过使用所述多种质量对照物成分制备多个不同类型的质量对照物,这些质量对照物模拟要由所述分析仪分析的多个不同类型生物样品的特性。
50.根据方面49所述的自动分析仪,其中,制备多个不同质量对照物,包括将至少一个成分重复用于两个或更多个不同的质量对照物。
51.根据方面48至50中任一项所述的自动分析仪,其中,所述储存库包括一个以上储箱,每个储箱包括制备具体质量对照物需要的质量对照物成分。
52.根据方面51所述的自动分析仪,其中,所述储箱是一次性储箱,其包括在单个监测程序中使用的单个质量对照物或多于一个质量对照物所需的质量对照物成分。
53.根据前述方面48至52中任一项所述的自动分析仪,其中,所述储存库包括一个以上储箱,所述一个以上储箱具有能够用于制备两种或更多种不同类型质量对照物的质量对照物成分。
54.根据前述方面48至53中任一项所述的自动分析仪,其中,所述储存库包括一个以上储箱,所述一个以上储箱具有能够用于制备相同类型的两个或更多个质量对照物的质量对照物成分。
55.根据前述方面中任一项所述的自动分析仪,其中,所述分析仪是免疫化学分析仪、临床化学分析仪或者凝血分析仪。
56.根据前述方面中任一项所述的自动分析仪,其中,所述制备装置还被构造成制备要在所述分析仪中分析的样品。
57.根据前述方面中任一项所述的自动分析仪,其中,所述制备装置包括移液系统,所述移液系统包括一个以上移液器。
58.根据方面57所述的自动分析仪,其中,所述制备装置包括专用于制备质量对照物的一个以上移液器。
59.根据方面58所述的自动分析仪,其中,所述制备装置被构造成用至少一个一次性移液头来混合质量对照物。
60.根据前述方面中任一项所述的自动分析仪,还包括转移装置,所述转移装置被构造成将所述质量对照物从所述样品制备容器转移到所述分析仪的分析容器中,其中,所述分析仪被构造成在所述质量对照物处于所述分析容器中时确定所述质量对照物的至少一个参数。
61.根据前述方面中任一项所述的自动分析仪,其中,所述分析仪包括用于制备质量对照物的多个样品制备容器。
62.根据前述方面中任一项所述的自动分析仪,其中,所述分析仪包括测量装置,优选的是包括光学测量装置,进一步优选的是包括光度计。
63.一种存储有指令的计算机可读介质,所述指令在由生物样品用分析仪的控制器执行时使得所述生物样品用分析仪执行方法1至47中任一项的步骤。
64.一种一次性容器套件,用于对具有自动制备装置的生物样品用分析仪进行性能监测,所述套件包括一个以上容器,所述一个以上容器包括:一种以上基质,所述基质来源于体液或体液组分或者是模拟体液或体液组分特性的人造物质;一种以上改性剂,所述改性剂包括药物、药物的代谢物、在预定医学或代谢条件下积累的物质、通常不存在于体液中的物质和通常存在于体液中的物质中的一种以上。
- 还没有人留言评论。精彩留言会获得点赞!