一种猪病毒性传染病血清IgG抗体多重ELISA检测试剂盒及其检测方法与流程
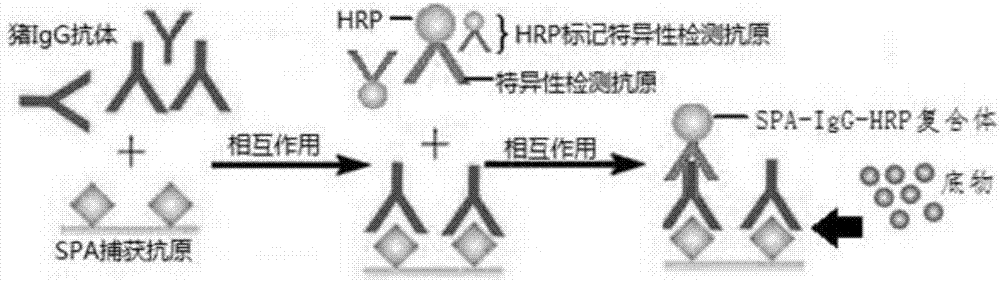
本发明属于生物领域,具体涉及一种猪病毒性传染病血清igg抗体多重elisa检测试剂盒及其检测方法。
背景技术:
:病毒性传染病已成为威胁我国生猪养殖健康发展的严重障碍,其爆发和流行给养猪业者造成了极大经济损失。目前,包括猪瘟病毒(csfv)、猪圆环病毒2型(pcv2)和猪伪狂犬病毒(prv)是养猪业重点防控的病毒性疫病。在生猪疾病的预防工作中,通过实时检测和评价疫苗免疫后血清中抗体水平和区分抗体来源是评价疫苗接种效果、保护猪群健康的关键环节。猪病毒性传染性疾病的血清抗体检测方法主要包括酶联免疫吸附试验(elisa)、乳胶凝集试验、血凝试验、病毒中和试验、单层酶联免疫吸附实验等。由于elisa方法操作简单、成本低廉、对试验条件要求低、敏感性和稳定性好、可以评价抗体水平和种类、适合规模化检测血清样本且结果判定可标准化,因此,是目前应用动物疫病血清抗体水平监控和评价体系中应用最广泛的检测手段。常用血清抗体检测elisa方法基本原理是,利用预先包被在微孔板中来自待检测疫病的抗原(重组抗原或灭活完整病原颗粒)结合血清样本中的特异性igg抗体,加入抗igg的酶(化学发光物、荧光材料等)标记的第二抗体同与抗原结合的igg抗体反应,来检测待检测样本中的抗体含量或者种类。根据抗原抗体反应模式和操作程序的差异,elisa方法可分为包括间接elisa、阻断elisa和竞争elisa。动物疫病检测领域常用的血清抗体elisa试剂盒是只适合单一病原产生的抗体检测,尚未见到一种试剂盒可以同时检测多种病原产生的血清抗体的产品。技术实现要素:本发明的目的是提供一种猪病毒性传染病血清igg抗体多重elisa检测试剂盒,以解决现有血清抗体elisa试剂盒是只适合单一病原产生的抗体检测,无法同时检测多种病原产生的血清抗体的问题。本发明的另一个目的是提供一种用猪病毒性传染病血清igg抗体多重elisa检测试剂盒进行检测的方法。本发明技术方案如下:一种猪病毒性传染病血清igg抗体多重elisa检测试剂盒,包括预包被spa蛋白的检测板、血清样品稀释液、洗涤液、显色液、终止液、四种病原的阴阳性标准对照血清、以及hrp分别标记的csfv的e2抗原、pcv2的cap抗原、prv的gb和ge抗原。优选地,所述预包被spa蛋白的检测板所包被spa蛋白的包被量为2ng~28ng/孔,包被稀释液为50mmol/l的ph值为9.6的碳酸盐缓冲液。制备抗原包被板的目的是捕获血清样本中所有类型的igg抗体。不同的浓度直接影响到检测结果的准确性。优选地,所述预包被spa蛋白的检测板中包被用碳酸盐缓冲液每毫升的组成为1.59mgna2co3和2.93mgnahco3,去离子水充分溶解后保存于4℃温度下。碳酸盐缓冲液条件下,spa抗原可以稳定吸附在酶标板上。优选地,所述预包被spa蛋白的检测板中采用的封闭液组分为质量浓度为1-5%海藻糖、质量浓度0.5-2.0%明胶、体积浓度1-8%马血清,1×pbst,ph7.3,200μl/孔。封闭液中的明胶、马血清和海藻糖可以结合酶标板中spa抗原未能吸附的剩余位置,使整个孔底部都被蛋白覆盖。一是可以保持spa抗原的活性,二是阻断待检测样品中存在的蛋白或者抗体与酶标板中剩余位置发生结合,导致非特异性反应的发生,并且添加的海藻糖具有耐热的特征,可以大幅度延长抗原包被板的保存期限。优选地,所述洗涤液为体积浓度为0.5%的吐温-20的0.1mol/l的ph值为7.2的磷酸盐缓冲液,洗涤液的功能是洗去未结合的和非特异性结合的封闭液中的成份。去污洗涤液为质量浓度1%edta加50mmol/l的ph值为7.2的磷酸盐缓冲液,100μl/孔室温作用1-15min。去污洗涤液目的是除去血清样本中非特异性吸附的igm,避免产生非特异性反应。优选地,所述预包被spa蛋白的检测板中,标准阴、阳性血清和待检测血清样本均以原倍浓度100μl/孔加入到对应的孔中,室温作用60min。优选地,所述hrp标记的csfv的e2抗原、pcv2的cap抗原、prv的gb和prv的ge抗原使用浓度分别为1∶4000、1∶4000,1∶4000、1∶2000,其对应的质量浓度为0.1μg/ml-15μg/ml,37℃孵育60min。hrp-标记的检测抗原可以与对应的特异性igg抗体结合,实现检测目标抗体的目的。优选地,所述预包被spa蛋白的检测板制备中,所用的tmb底物缓冲液组成为,底物溶液a:tmbdmso溶液,浓度为2-6mg/ml;底物溶液b:15-30g/l醋酸钠,柠檬酸1-9g/l,30%双氧水0.1-1ml,蒸馏水溶解至1l。tmb与hrp发生反应,根据血清样本中待检测igg抗体含量的不同,呈现深浅不一蓝色,可以利用450nm激发波长,读取反应结果。优选地,所述终止液为1.5mol/lh2so4。h2so4终止反应,以便读取吸光度值。一种用猪病毒性传染病血清igg抗体多重elisa检测试剂盒进行检测的方法,包括以下步骤:(1)加入血清样本:将待检测血清样本、阳性和阴性对照血清均以原倍浓度100μl/孔加入对应孔中,阴、阳性对照血清做复孔;密封,室温作用60min;(2)去除非特异性反应:用质量浓度为1%edta的去污洗涤液和50mmol/l的磷酸盐缓冲液,以100μl/孔室温作用5min,弃去孔内液体,磷酸盐缓冲液的ph值为7.2;(3)洗板:弃净孔内残余epbs液体,用200-300μl/孔1×pbst洗涤液连续洗涤4次,最后一次弃净孔内液体,拍干;(4)加入hrp-标记抗原:根据需要检测病原的抗体,加入已滴定好hrp标记抗原,100μl/孔,37℃作用1h,洗涤;(5)加入底物显色:以100μl/孔的用量加入tmb底物缓冲液,室温避光显色15min,以100μl/孔的用量加入终止液;(6)结果判定:试验成立条件:计算阳性对照、阴性对照血清各孔的平均吸光度值(od450nm),当阳性标准血清平均od450≥1.0,阴性标准血清od450≤0.20,判定为试验结果成立;判定:当待测样品od450/阴性标准血清od450≥2.10,判定该血清样品为检测病原的抗体阳性;当待测样品od450/阴性标准血清od450<2.10,判定该血清样品为检测的病原抗体阴性。金黄色葡萄球菌蛋白a(staphylococcalproteina,spa)是细胞壁抗原的主要成分,从n端到c依次有s、e、d、a、b、c、x五个结构域组成,分子量与42kd左右,氨基酸组成中无半胱氨酸,所以没有二硫键结构,等电点5.1,属于一种酸性蛋白质,天然结构非常稳定,加热、福尔马林处理、4mol/l尿素、6mol/l盐酸胍、盐酸(ph2.5)和硫氰盐酸等极端条件均不影响其活性。spa与不同种类igg结合的亲和性存在差异,结合能力由强到弱依次是猪、狗、兔、人、猴、小鼠、大鼠、绵羊,结合的igg亚型是igg1、igg2和igg4(吸附率90%~98%),不与igg3结合,可以同血清中少量的igm(吸附率2%~30%)、iga(吸附率1.5%~20%)、igge及b细胞抗原受体结合,结合位点是fabric段的vh功能区。每个spa分子具有双价的结合能力,可以同时结合2个igg分子。spa具有与人和多种哺乳动物血清igg分子fc段非特异性结合的特性,并且不会影响到igg分子fab片段与抗原的特异性结合能力,这种特殊的免疫学性质,使其成为免疫学研究方面独一无二的有用工具,在病原学和血清学检测方面具有潜在的应用价值。本发明采用的是双抗原夹心的反应模式,利用金黄色葡萄球菌蛋白a(staphylococcalproteina,spa)结合待检测猪血清样品中所有igg分子,用辣根过氧化物酶(hrp)标记的重组抗原与spa结合的igg分子反应,建立了可同时检测待测样品中的抗csfv的e2蛋白抗体、抗pcv2的cap蛋白抗体和抗prv的gb和ge蛋白抗体的多重elisa方法,制备的hrp-e2酶标记抗原属于具有复合功能的e2抗原,既能与猪瘟病毒抗血清结合,同时还可以与tmb底物发生反应,直接指示检测的结果。实现了一次elisa反应同时检测四种疫病抗体(检测猪瘟病毒(csfv)、猪圆环病毒2型(pcv2)和猪伪狂犬病毒感染(prv)或免疫猪的血清igg抗体)的目的,其敏感性和特异性与现有单一病原抗体检测试剂盒相当,但显著提升了检测效率,为上述四种疾病疫苗免疫及临床感染猪的血清抗体检测提供了一种有效、快捷的检测试剂。本发明将多种检测抗体集中在一个elisa反应中进行,可以显著提高检测效率、节约检测时间和降低检测成本。本发明提供的多重elisa检测方法是一种具有良好的敏感性、特异性、准确性、时效性、稳定性,可通过一次实验同时完成三种猪病的四种血清igg抗体检测的简易、快速方法,适用于规模化临床血清样品的检测工作。附图说明图1是一种猪病毒性传染病血清igg抗体多重elisa检测试剂盒的实验流程图;图2是一种猪病毒性传染病血清igg抗体多重elisa检测方法的原理图。具体实施方式下面对本发明做进一步说明。说明:1×浓度的缓冲溶液是指在配制溶液的时候,为了方便储存及减少工作量,一般会配制10倍(10x)至1000倍(1000x)工作浓度的浓溶液作为贮存。在使用的时候取少量储存液再稀释至工作浓度(就是所谓的1x)。《材料和方法》1.1抗原、标准阴阳性血清、试剂和spa已知csfv、pcv2、和prv(ge基因缺失疫苗株)阳性血清和阴性血清,e.coli表达的重组抗原包括,csfve2抗原(gst标签)、pcv2cap抗原(his标签)、prvge和gb抗原(his标签),均为现有产品。辣根过氧化酶(hrp)、spa购自sigma公司;琼脂糖4b、镍柱为gehealthcare产品;超滤层析柱(10kd)购自millipore;其它相关试剂均为国产分析纯。1.2抗原制备和纯化1.2.1csfve2重组抗原制备依据现有方法进行可溶性重组csfve2抗原制备和纯化。1.2.2pcv2cap重组抗原制备依据现有方法进行可溶性重组pcv2cap抗原制备和纯化。1.2.3prvge和gb重组抗原制备1.2.3.1prvge基因的克隆、表达和纯化。(1)ge基因克隆和重组表达载体的构建:参考现有genbank:af207700毒株基因序列合成一对扩增ge基因表达引物,用于表达ge蛋白。引物序列,ge109:actggatccatggaggtcccgagtc;ge858:tcactcgaggtggtagatgcaggg,限制性酶切位点分别为bamhi和xhol,扩增片段大小为780bp。pcr扩增、酶切回收后的目的片段亚克隆到pgex-6p-1原核表达上,转化dh5a感受态细胞,鉴定正确的重组质粒命名为6p-e,转化bl-21(de3)感受态细胞,进行重组蛋白表达。(2)ge的表达、纯化和蛋白功能鉴定:挑取5个单克隆菌落分别于5mllb液体培养基试管中,220r/min,37℃过夜振荡培养;分别从5个管中吸取50μl菌液于新的lb液体培养基试管中,220r/min2~3h至od600≈0.5~0.6,在其中的4个管中加入iptg的终浓度1.0mol/l,剩余1管作为阴性对照,37℃200r/min振荡培养4~6h。sds-page鉴定重组e2蛋白:取1ml重组菌到ep管中,10000r/min离心1min,弃掉上清,加入100μltrisph6.8,100℃煮5min,10000r/min离心15min。配制15%的sds-page蛋白质电泳凝胶,每个样品加10μl上清,加入标准蛋白marker5μl,80v浓缩胶,120v分离胶,胶块考马斯亮蓝染色,脱色后观察到了ge蛋白成功表达。免疫印迹实验(westernblotting,wb)结果表明,重组e2蛋白可以被猪伪狂犬ge阳性血清识别,具有良好的反应原性。然后利用琼脂糖4b树脂纯化ge蛋白作为elisa抗体检测的包被抗原。1.2.3.2prvgb基因的克隆、表达、纯化和反应原性的鉴定:参考现有pcv2基因组序列(genbank:kj526439)合成一对扩增gb基因表达引物,用于表达gb蛋白。引物序列,gb1627:actggatccatggcgcacgtgaacgacat;gb2214:gtcaagcttcgagcgcgtgcagctggtt,分别引入限制性酶切位点bamhi和hindiii,扩增580bp大小的gb基因。pcr扩增、酶切回收后的目的片段亚克隆到pet-28a原核表达上,转化dh5a感受态细胞,鉴定正确的重组质粒命名为28a-b,转化bl-21(de3)感受态细胞,进行重组蛋白表达。gb重组蛋白的表达过程参考“”1.2.3.1”部分,获得的重组蛋白用镍亲和层析填料进行纯化,通过4b树脂纯化ge蛋白,wb实验表明重组gb蛋白能够被猪过b抗体阳性血清识别,可以作为elisa抗体检测的包被抗原。1.3spa包被的酶标板制备包被用碳酸盐缓冲液每毫升的组成为1.59mgna2co3和2.93mgnahco3,去离子水充分溶解后保存于4℃温度下。用50mmol/l碳酸盐缓冲液(ph9.6)稀释spa蛋白,100μl/孔包被96孔酶标板,spa包被量为4ng/孔,密封,置于室温作用16~20小时过夜。弃净孔内液体,用洗涤液1×pbst(洗涤液为体积浓度为0.5%的吐温-20的0.1mol/l的ph值为7.2的磷酸盐缓冲液)200-300μl/孔连续洗涤4次,最后一次弃净孔内液体。加入200μl/孔的封闭液(质量浓度5%海藻糖、质量浓度2%的明胶、体积浓度2.5%的马血清、1×pbst,ph7.3)室温作用30min;使用洗涤液1×pbst(洗涤液为体积浓度为0.5%的吐温-20的0.1mol/l的ph值为7.2的磷酸盐缓冲液)洗涤。将四种疫病的标准阴、阳性和待检测血清样品100μl/孔加入到检测孔中,室温孵育60min。用去污洗涤液epbs(质量浓度1%edta,,50mmol/l的磷酸盐缓冲液,ph7.2)100μl/孔室温作用5min,移除非特异性结合的igm抗体,弃去孔内液体,用1×pbst(0.05%tween-20,50mmol/l的磷酸盐缓冲液,ph7.2)200-300μl/孔连续洗涤4次,最后一次弃净孔内液体。根据需要检测抗体的种类,相应孔中加入对应的hrp-抗原,100μl/孔,37℃孵育60min,洗涤同上。加入tmb底物缓冲液(底物溶液a:tmbdmso溶液,浓度为2mg/ml;底物溶液b:27.2g/l醋酸钠,柠檬酸3.2g/l,30%双氧水0.6ml,蒸馏水溶解至1l,底物溶液a和b均避光保存,使用时等量混匀即可。),100μl/孔,室温孵育30min,加入100μl/孔1.5mol的h2so4终止液,od450nm波长测定吸光度值,计算结果。1.4辣根过氧化物酶(hrp)标记重组抗原:采用现有改良过碘酸钠法进行hrp-抗原标记实验,利用琼脂扩散实验鉴定hrp标记抗原的活性鉴定。酶标记率=od403/od280,酶中正铁血红素辅基的吸光度(od403)与抗原蛋白中的色氨酸、酪氨酸的吸光度(od280)之比表示hrp在抗原-酶中所占的比例,其中结合率(%)﹥30为最好,﹥9~10为好,﹥7一般。标记的hrp-抗原分成200μl/管,加入终浓度33%的无菌甘油保存于-20℃,直到滴定工作浓度实验。1.5滴定hrp标记抗原的工作浓度1.5.1滴定hrp标记的csfve2抗原(hrp-e2)的最佳工作浓度分别将3份已知csfv血清抗体阴性和3份已知csf抗体v血清阳性以原倍浓度100μl/孔加入到“1.3”制备的已经封闭的spa抗原包被板的孔中中,每份血清做双孔检测,37℃孵育45min,弃净孔内液体,用200-300μl/孔1×pbst连续洗涤4次,最后一次弃净孔内液体,拍干。将酶标记的hrp-e2抗原以1∶1000,1∶2000,1∶4000,1∶8000,1∶16000稀释,100μl/孔加入相应孔中,每个稀释度重复一次,37℃作用60min,洗涤,加入tmb底物缓冲液100μl/孔,室温避光显色15min,加入100μl/孔终止液(2mh2so4)。在波长od450nm处检测吸光度值,计算阳性血清与阴性血清的吸光度比值,选择阳性血清od值(pos)1.0~1.6,阴性血清od值(neg)<0.2的hrp-e2的稀释浓度为最佳稀释度。1.5.2滴定hrp标记的pcv2-cap(hrp-cap)ppv-vp2(hrp-vp2)、prv-ge(hrp-ge)和gb(hrp-gb)的工作浓度具体实验操作步骤和结果判定方法均同“1.5.1”所述。1.6hrp-e2,hrp-cap,hrp-gb和hrp-ge最佳工作浓度的确定根据酶标记抗原滴定实验的结果,hrp-e2,hrp-cap,hrp-gb和hrp-ge在猪血清igg抗体多重elisa检测试剂盒中的工作浓度如表1所示:表1酶标记抗原滴定实验结果结果抗原hrp-e2hrp-caphrp-gbhrp-ge*pos/od4501.351.431.261.39*neg/od4500.150.120.150.18pos/neg911.928.47.72最佳工作浓度1∶40001∶40001∶40001∶2000备注:*pos/od450与*neg/od450份别是3份csfv阳性血清和3份阴性血清od450在各自对应酶标记抗原浓度下的平均od450值。1.7猪病毒性传染病血清igg抗体多重elisa检测方法的建立1.7.1spa抗原包被:用50mmol/l碳酸盐缓冲液(ph9.6)稀释spa蛋白至被量为4ng/孔,100μl/孔包被96孔酶标板,置于4℃过夜,弃去液体,洗涤,拍干,封闭,洗涤,拍干。1.7.2检测血清样本:用血清稀释液对阳性和阴性对照血清以原倍浓度100μl/孔,阴、阳性对照血清做复孔;将待检血清样品以原倍浓度100μl/孔加入对应孔中,密封,室温作用60min。1.7.3用去污洗涤液epbs(质量浓度1%edta,50mmol/l的磷酸盐缓冲液(ph7.2)100μl/孔室温作用5min,移除非特异性结合的igm抗体,弃去孔内液体,1.7.4洗板。弃净孔内残余epbs液体,用200-300μl/孔1×pbst洗涤液连续洗涤4次,最后一次弃净孔内液体,拍干。1.7.5加入hrp-标记抗原根据需要检测病原的抗体,加入已滴定好hrp标记抗原,100μl/孔,37℃作用60min,洗涤。(例如:检测csfv抗体,对应孔中加入hrp-e2抗原即可。若要同时检测4种蛋白的抗体,对应的孔中加入hrp标记的对应抗原即可实现。)1.7.6加入底物显色100μl/孔加入tmb底物缓冲液,室温避光显色15min,100μl/孔加入终止液。1.7.7结果判定(1)试验成立条件:计算阳性对照、阴性对照血清各孔的平均吸光度值(od450nm),当阳性标准血清平均od450≥1.0,阴性标准血清od450≤0.20,判定为试验结果成立。(2)结果判定当待测样品od450/阴性标准血清od450≥2.10,判定该血清样品为检测病原的抗体阳性;当待测样品od450/阴性标准血清od450<2.10,判定该血清样品为检测的病原抗体阴性。1.8特异性检测用猪病毒性传染病血清igg抗体多重elisa检测方法猪临床常见的病毒性传染病阳性血清进行交叉检测,研究该检测方法的特异性。本elisa中包被的是spa抗原,其可以与猪血清样品中的igg抗体发生结合反应。因此,特异性检测的目的是鉴别hrp标记的对应抗原是否能会与其它常见猪感染的病毒产生的igg抗体发生非特异性结合(即交叉反应),从而导致假阳性结果,干扰实验结果。所以,在进行特异性实验时,选择的血清样品应不含有进行特异性研究的、hrp标记抗原的抗体即可。检测方法,按照“1.7”中所描述的操作程序进行,特异性研究结果如表2所示。表2多重血清抗体elisa检测试剂盒的特异性实验negb表示检测结果阴性,posa表示检测结果阳性1.9多重elisa抗体检测方法的重复性实验制备3批spa抗原包被酶标板,每种病毒抗原选择5份抗体阳性猪血清样品和5份阴性猪血清样品进行批内和批间重复性试验,计算变异系数,验证elisa检测方法的可重复性。结果表明,3个不同批次spa抗原包被酶标板检测5份阴阳性血清,批内变异系数<3.1%,批间变异系数<2.5%,证明本方法具有良好的重复性。1.10临床样品检测实验对50份采集自甘肃某猪场的猪血清样品用于本发明所涉及方法的比对实验。采集外周血时,已经接种猪瘟兔化弱毒疫苗(细胞源)后的21天,但从未接种pcv2疫苗、prv疫苗和ppv疫苗。按照以“1.7”所述的操作方法和标准进行结果判定。通过与市售的商品化试剂盒进行对比实验,比较本发明所涉及试剂盒与商品化试剂盒的阳性检出率。1.10.1猪病毒性传染病血清igg抗体多重elisa检测方法-猪瘟病毒血清抗体检测选择在我国使用较为普遍的idexx生产的csfv血清抗体阻断elisa试剂盒(idexxcsfvabkit)作为参考方法。csfv血清抗体检测商品化试剂盒与本发明中所涉及的igg血清抗体多重elisa检测方法比较结果见表3。从比较结果可以看出,hrp-e2猪瘟抗体检测方法阳性检出率为82%(41/50),阴性检测率为18%(9/50);进口idexxcsfvabkit检测试剂盒阳性检测率为68%(34/50),阴性检测率为32%(16/50)。二种方法的阳性符合率为68.29%,阴性符合率为33.33%,总体符合率达到62%。由于本发明所使用的检测猪瘟病毒抗体的e2抗原来自csfv弱毒疫苗,与田间使用弱毒疫苗后的血清样本的反应性要好于进口的检测试剂盒。本发明研发的多重elisa中,hrp-e2csfv抗体检测试剂盒阳性检出率比进口的高出14%,这个结果符合我国猪瘟抗体的临床规律。近些年,我国始终采取猪瘟疫苗强制免疫政策,疫苗接种覆盖率几乎达到100%,所以群体猪瘟病毒抗体的阳性率始终保持在80%以上。表3猪瘟抗体检测临床血清样品检测结果1.10.2猪病毒性传染病血清igg抗体多重elisa检测方法-pcv2血清抗体检测本发明涉及的pcv2血清抗体检测方法(hrp-cap)与间接免疫荧光(if)实验相比较。if实验操作过程摘要:6孔板中的pk-15细胞长至75%时,将实验室分离的pcv2毒株接种,孵育1h,弃去病毒液,无菌pbs洗涤三次;加入mem细胞维持液培养48h(5%co2,37℃),弃去培养液;加入4%的多聚甲醛固定15min,弃去液体,无菌pbs洗涤三次;加入0.1%的tritonx-100透化10min,弃去多余液体,无菌pbs洗涤三次;将标准pcv2阳性血清、阴性血清和待检测血清样品做1:50稀释,1.5ml/孔,4℃孵育过夜,吸出血清,1×pbst(ph7.2)洗涤4次;加入fitc标记的兔抗猪igg单克隆抗体,37℃孵育5h,弃去液体,1×pbst(ph7.2)洗涤4次,倒置荧光显微镜观察实验结果。igg血清抗体多重elisa检测方法中pcv2血清抗体比较结果见如表4所示。从比较结果可以看出,hrp-cap抗体检测方法阳性检出率为86%(43/50),阴性检测率为14%(7/50)。if实验中,pcv2血清抗体的阳性检测率为76%(38/50),阴性检测率为24%(12/50)。二种方法的阳性符合率为81.39%,阴性符合率为57.14%,总体符合率达到78%。本发明研发的多重elisa中,hrp-cappcv2抗体检测试剂盒阳性检出率比if实验高出10%。两种方法的比较结果说明,elisa方法比if实验敏感性高,并且操作过程、耗费时间和实验费用要远低于if实验,因此,elisa方法是临床上检测pcv2血清抗体的最常用的方法。表4:pcv2检测临床血清样品检测结果虽然该猪场从未接种过pcv2疫苗,但50份血清中pcv2抗体阳性率可达到81.39%,说明该猪场pcv2持续性感染情况比较普遍,但整个猪群未观察到疑似pcv2感染导致的临床症状,仔猪成活率一直平稳。根据大量流行病学调查结果发现,pcv2持续性感染现象几乎已遍及我国乃至全世界的所有猪场,尚无有效方法评估pcv2持续性感染对猪群造成的损失程度,也缺乏有效手段净化pcv2猪群。预防pcv2感染是世界养猪业面临的一大难题。1.10.3猪病毒性传染病血清igg抗体多重elisa检测方法---猪伪狂犬病毒hrp-ge和hrp-gb血清抗体检测prv-ge和gb血清抗体检测试剂盒购自武汉科前生物制品有限公司,方法为间接elisa(ielisa:ielisa-ge,ielisa-gb)。三种试剂盒的比较结果如表5所示。50份血清样品来自从未免疫prv疫苗的猪群,该猪场从未发生过伪狂犬疫情。在本实验中抗伪狂犬e蛋白的抗体为阳性的3头猪,均表现为健康,未观察到任何临床症状。依据本实验结果,说明采自ge和gb抗体的阳性猪曾感染过伪狂犬病毒,目前已经康复。本发明所涉及的hrp-ge和hrp-gb血清抗体检测方法与商品化的ielisa-ge和ielisa-gb总符合率达到92%,说明本方法与商品化具有相似的敏感性和特异性。表5:prvge和gb检测临床血清样品检测结果在本实验中抗prvge蛋白的抗体为阳性的3头猪,均表现为健康,未观察到任何临床症状。依据本实验结果,说明采自ge和gb抗体的阳性猪曾感染过伪狂犬病毒,目前已经康复。本发明所涉及的hrp-ge和hrp-gb血清抗体检测方法与商品化的ielisa-ge和ielisa-gb总符合率达到92%,说明本方法与商品化具有相似的敏感性和特异性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1