一种从全血中分选活性有核细胞并精准涂片的方法与流程
本发明涉及生物学和医学技术领域,尤其是涉及一种从全血中分选活性有核细胞并精准涂片的方法。
背景技术:
细胞是生命的基本单位,生物体内的每个细胞都是独一无二的,它在生物系统中占据特定的空间位置,具有相对独立的遗传体系和基因表达调控机制。细胞尤其是单细胞分析可了解生物的多样性并用于疾病的精准诊断及指导治疗。
细胞的来源包括组织、脑脊液、胸水、腹水、羊水、血液等。因为外周血采集方便、对机体损害小,检测并获取外周血中的单个有核细胞,在肿瘤的早期诊断和治疗、产前诊断、免疫学研究等领域将有更广泛的应用和实际价值,单个细胞的图像分析是技术手段之一。
外周血由血细胞和血浆组成。血细胞包括无核的红细胞及有核细胞(主要为白细胞),其中有核细胞占全血细胞的比例仅为千分之一。对单个核细胞亚群,比如外周血中cd4+t细胞,占全血细胞比例低至万分之一;肿瘤患者外周血中的循坏肿瘤细胞(ctc)和孕妇外周血中的胎儿有核红细胞,占有核细胞的比例低至百万分之一,占全血细胞比例只有亿分之一甚至十亿分之一,这意味着得到一个目的细胞需要检测分选大量样本,因此去除红细胞是提高目的细胞获取效率的必要手段。
目前去除全血中红细胞并保持有核细胞活性的一种方法为红细胞裂解法,这种方法中红细胞裂解液与全血样本的体积比为10-20∶1,一般仅用于100微升左右全血的制备。1毫升的全血需要10-20毫升的红细胞裂解液,而对全血中含量稀少的细胞的分选,比如ctc和孕妇外周血中胎儿有核红细胞,需要全血5-10毫升,甚至更多,因此,这种方法不适合大容量血样(1ml以上)的处理。
另外一种去除红细胞的方法为ficoll密度梯度离心法,离心后,红细胞和粒细胞因比重大,沉于分层液之下,单核细胞和淋巴细胞浮在分层液之上。这种方法操作时间长,对细胞损伤大,单核细胞和淋巴细胞在分层液上为一薄层,难以吸取,细胞得率不稳定。
也就是说,上述两种方法均无法有效获取活性有核细胞。
传统识别有核方法采用荧光试剂标记白细胞,然后在流式细胞仪上对白细胞进行检测分群。但单纯荧光试剂染色无法辨别活性有核细胞,影响对活性有核细胞的分选。
流式细胞仪能将复杂样本中活性有核细胞快速精准地直接分选至载玻片上,但含细胞的液滴迅速干燥,形成盐结晶,导致细胞膜破裂,无法看到完整的细胞。又或者在载玻片上滴等渗液体,将活性有核细胞分选到等渗液体中,然后盖上盖玻片使细胞在等渗液体中保存较长时间,但盖玻片覆盖的过程,会造成细胞流失,并且这种情况下,无法对细胞进行染色处理,等渗液体干燥后,同样形成盐结晶,导致细胞破裂。这两种情况均破坏或影响了细胞的形态,无法进行完整的图像分析。
也就是说,现有的各种技术均无法精准地把活性有核细胞放到载玻片上,且容易丢失,不便于后续形态观察。
技术实现要素:
本发明主要解决的技术问题是提供一种从全血中分选活性有核细胞并精准涂片的方法,解决了现有技术中无法有效获取大容量全血中活性有核细胞并精准涂片的技术问题。
为解决上述技术问题,本发明采用的一个技术方案是:提供一种从全血中分选活性有核细胞并精准涂片的方法,包括:利用离心装置对全血进行离心,以去除全血中的红细胞;加入荧光试剂以识别全血中去除红细胞所得的活性有核细胞亚群;在流式细胞仪上对识别出的全血中去除红细胞所得的活性有核细胞亚群进行分选;将分选出的活性有核细胞收集到含有缓冲液或培养液的收集装置中,并利用离心涂片机对收集装置进行涂片,以将活性有核细胞涂在与收集装置连接的载玻片上。
其中,荧光试剂包括hoechst33342。
其中,利用离心机对全血进行离心,以去除全血中的红细胞的步骤包括:利用离心机以转速范围为800-2000转/分钟对新鲜抗凝的全血进行离心3-10分钟,使全血中的血浆与血细胞分离;抽取血细胞;利用离心机以转速范围为1500-2500转/分钟对血细胞进行离心3-10分钟,以从血细胞获取白细胞层;将白细胞层放入缓冲液中制成细胞悬浮液。
其中,加入荧光试剂以识别全血中去除红细胞所得的活性有核细胞亚群的步骤包括:加入hoechst33342染料以识别全血中去除红细胞所得的活性有核细胞;对hoechst33342设阈值,以识别活性有核细胞亚群。
其中,加入hoechst33342染料以识别全血中去除红细胞所得的活性有核细胞的步骤包括:加入hoechst33342至细胞悬浮液,使细胞悬浮液的浓度处于1-30微克/毫升;将细胞悬浮液处于37度水浴箱中孵育30-90分钟,且每10分钟混匀一次;加入4度预冷的1-4毫升缓冲液;利用离心机以转速范围为800-2000转/分钟对细胞悬浮液进行离心3-5分钟,并吸去上清液;加入300-500微升缓冲液;加入pi染料,使得细胞悬浮液的浓度范围为0.5-0.8微克/毫升。
其中,将分选出的活性有核细胞收集到含有有缓冲液或培养液的收集装置中的步骤包括:调整流式细胞仪输出活性有核细胞的方向和/或收集装置的位置,使活性有核细胞恰好射入收集装置中;将分选出的活性有核细胞注入到设有缓冲液的收集装置中。
其中,利用离心涂片机对收集装置进行涂片,以将活性有核细胞涂在与收集装置连接的载玻片上的步骤包括:将收集装置与载玻片连接;将设有载玻片的收集装置固定在离心涂片机上;启动离心涂片机,使得收集装置跟随离心涂片机转动,从而将收集装置中的活性有核细胞涂到载玻片上。
其中,收集装置包括第一管体和第一管体连通的第二管体,其中第一管体和第二管体的连接呈l型状设置,且第一管体设置在流式细胞仪用于输出活性有核细胞的输出口的下方。
其中,收集装置的第一管体和第二管体的连接处的内壁呈弧形状。
本发明的有益效果是:区别于现有技术的情况,本发明提供的从全血中分选活性有核细胞并涂片的方法包括:利用离心装置对全血进行离心,以去除全血中的红细胞;加入荧光试剂以识别全血中去除红细胞所得的活性有核细胞亚群;在流式细胞仪上对识别出的全血中去除红细胞所得的活性有核细胞亚群进行分选;将分选出的活性有核细胞收集到含有缓冲液或培养液的收集装置中,并利用离心涂片机对收集装置进行涂片,以将活性有核细胞涂在与收集装置连接的载玻片上。通过上述方式,本发明所提供的从全血中分选活性有核细胞并涂片的方法能够有效从大容量全血(大于1毫升全血)中去除红细胞,并从大容量全血中分离得到活性的有核细胞特别是单个活性有核细胞并精准涂到载玻片上。
附图说明
图1是本发明从全血中分选活性有核细胞并精准涂片的方法的流程示意图;
图2是图1中步骤s101的子步骤流程示意图;
图3是图1中步骤s102的子步骤流程示意图;
图4是图3中步骤s1021的子步骤流程示意图;
图5是图1中步骤s104的子步骤流程示意图;
图6是本发明收集装置的结构示意图;
图7是本发明收集装置与载玻片连接的结构示意图。
具体实施方式
下面结合附图和实施方式对本发明进行详细说明。
如图1所示,图1是本发明从全血中分选活性有核细胞并涂片的方法的流程示意图。该方法包括以下步骤:
步骤s101:利用离心装置对全血进行离心,以去除全血中的红细胞。
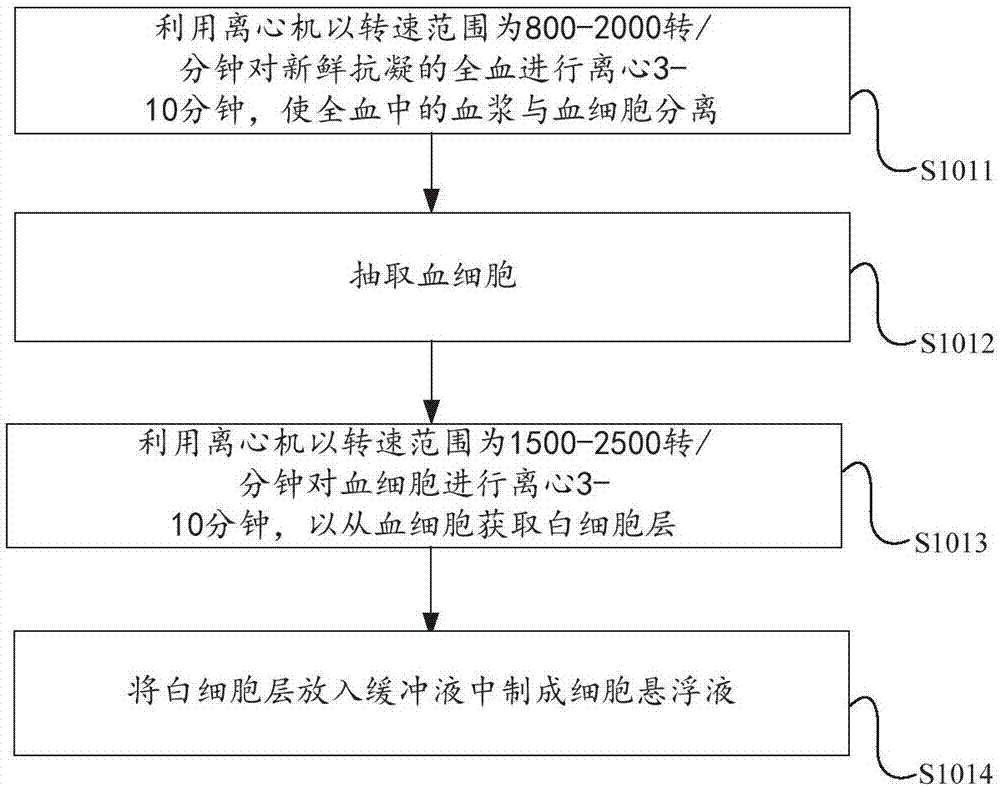
如图2所示,步骤s101包括以下子步骤:
步骤s1011:利用离心机以转速范围为800-2000转/分钟对新鲜抗凝的全血进行离心3-10分钟,使全血中的血浆与血细胞分离。
步骤s1012:抽取血细胞。
步骤s1013:利用离心机以转速范围为1500-2500转/分钟对血细胞进行离心3-10分钟,以从血细胞获取白细胞层。
在本实施例中,可以将血细胞放置在离心管体中,其中离心管体包括有下部管体和毛细管部,毛细管部的内径比较细,且毛细管部也比较长,其中毛细管部的长度是下部管体的长度的2-3倍,容易对细胞分层,且分层明显。
步骤s1014:将白细胞层放入缓冲液中制成细胞悬浮液。
应理解,步骤s101主要是去除外周全血中的红细胞,根据有核细胞与红细胞比重的差异,通过物理离心的方法,利用离心机将全血中的有核细胞浓缩在毛细管部位,这种方法,操作简单,白细胞分层更明显,白细胞易于吸取,对大容量血标本不仅细胞得率高,还最大限度保持了细胞的活性。
步骤s102:加入荧光试剂以识别全血中去除红细胞所得的活性有核细胞亚群。
在本实施例中,荧光试剂包括hoechst33342。
应理解,步骤s102主要是识别活性有核细胞,具体地,在去除红细胞所得的有核细胞经计数后,可直接在流式细胞仪上根据细胞的颗粒大小等物理特征识别有核细胞亚群,以排除碎片、红细胞等背景干扰。
具体地,如图3所示,步骤s102包括以下子步骤:
步骤s1021:加入hoechst33342染料以识别全血中去除红细胞所得的活性有核细胞。
如图4所示,步骤s1021包括以下子步骤:
步骤s1023:加入hoechst33342染料至细胞悬浮液,使细胞悬浮液的浓度处于1-30微克/毫升。
在步骤s1023中,加入hoechst33342染料至细胞悬浮液,使细胞悬浮液中hoechst33342的浓度处于1-30微克/毫升,其中细胞数目范围为1-5×106个。
步骤s1024:将细胞悬浮液处于37度水浴箱中孵育30-90分钟,且每10分钟混匀一次。
步骤s1025:加入4度预冷的1-4毫升缓冲液。
步骤s1026:利用离心机以转速范围为800-2000转/分钟对细胞悬浮液进行离心3-5分钟,并吸去上清液;
步骤s1027:加入300-500微升缓冲液。
步骤s1028:加入pi染料,使得细胞悬浮液的浓度范围为0.5-0.8微克/毫升。该步骤以进一步去除死细胞,可在上机检测前加入pi染料,以排除死细胞。
步骤s1022:对hoechst33342设阈值,以识别活性有核细胞亚群。
在步骤s1022中,以hoechst33342设阈值并与细胞的物理特征相结合识别有核细胞亚群,举例而言,设定阈值为hoechst33342,在hoechst33342vsssc图上,排除hoechst阴性的碎片及残余红细胞;固定hoechst33342阳性的细胞群;分析hoechst33342阳性细胞群中cd45vsssc细胞;设定分选cd45lowsschigh的粒细胞;选择分选模式为单细胞模式。
步骤s103:在流式细胞仪上对识别出的全血中去除红细胞所得的活性有核细胞亚群进行分选。
步骤s104:将分选出的活性有核细胞收集到含有缓冲液或培养液的收集装置中,并利用离心涂片机对收集装置进行涂片,以将活性有核细胞涂在与收集装置连接的载玻片上。
如图5所示,步骤s104包括以下子步骤:
步骤s1041:调整流式细胞仪输出活性有核细胞的方向和/或收集装置的位置,使活性有核细胞恰好射入收集装置中。
应理解,在步骤s1041中,还将收集装置设置在流式细胞仪输出活性有核细胞的输出口的下方。具体可以通过固定装置将收集装置固定在流式细胞仪输出活性有核细胞的输出口的下方。又或者对流式细胞仪进行改造,在流式细胞仪设置有夹具,该夹具能够将收集装置夹住,从而实现收集装置设置在流式细胞仪输出活性有核细胞的输出口的下方。
步骤s1042:将分选出的活性有核细胞注入到设有缓冲液的收集装置中。
如图6-7所示,该收集装置包括第一管体101和第一管体101连通的第二管体102,其中第一管体101和第二管体102的连接呈l型状设置,且第一管体101设置在流式细胞仪用于输出活性有核细胞的输出口的下方。
应理解,本实施例的第一管体101呈漏斗状设置,第一管体101的内径较小的一端与第二管体102连通,这样第一管体101设置在流式细胞仪用于输出活性有核细胞的输出口的下方的内径比较大,更容易落入活性有核细胞的分选液流。当然,本发明并不限定第一管体101呈漏斗状设置,在一些实施例中,第一管体101还可以呈其他形状,如矩形状或圆柱状,只要能够实现包含有单细胞的分选液流落入第一管体101即可。
优选地,缓冲液设置在第一管体101和第二管体102的连接处中,且收集容器的第一管体101和第二管体102的连接处的内壁呈弧形状。
在步骤s1042中,在收集装置中放入50-100微升的缓冲液,其中该缓冲液中可含蛋白。
在步骤s1042中,当活性有核细胞注入到收集装置后,还可以继续朝设有活性有核细胞的收集装置中注入容量范围为50-100微升可包含有蛋白的缓冲液,以通过缓冲液覆盖活性有核细胞。
步骤s1043:将收集装置与载玻片连接。
在本实施例中,第二管体102与载玻片104连接的一端设有一呈圆环状的黏胶层103,可通过该黏胶层103黏住载玻片104,从而实现第二管体102与载玻片104的连接。
进一步的,第二管体102与载玻片104的连接处设有吸水材料层105,能够对涂布在载玻片104上水进行干燥。其中该吸水材料层105呈圆环状,吸水材料层105的内径等于黏胶层103的外径。
步骤s1044:将设有载玻片的收集装置固定在离心涂片机上。
步骤s1045:启动离心涂片机,使得收集装置跟随离心涂片机转动,从而将收集装置中的活性有核细胞涂到载玻片上。
步骤s105:将已涂有活性有核细胞的载玻片取出,干燥,进行后续的图像分析处理。
在步骤s105中,用瑞氏-gimsa染液染色细胞。
与现有技术相比,本发明的显著优点在于:1)对大容量全血标本采用单纯的物理的红细胞去除方法,简便易行,保证细胞活性且有核细胞得率高;2)进一步结合hoechst33342染活性有核细胞,降低了碎片及残余红细胞的干扰,提高了活性有核细胞分选效率;3)利用流式分选活性有核细胞并精准涂片的方法,实现了全血标本尤其是大容量全血标本中活性有核细胞特别是单个活性有核细胞的精准图像分析。
综上,本发明提供的从全血中分选活性有核细胞并涂片的方法包括:利用离心装置对全血进行离心,以去除全血中的红细胞;加入hoechst33342染料以识别全血中去除红细胞所得的活性有核细胞亚群;在流式细胞仪上对识别出的全血中去除红细胞所得的活性有核细胞亚群进行分选;将分选出的活性有核细胞收集到含有缓冲液或培养液的收集装置中,并利用离心涂片机对收集装置进行涂片,以将活性有核细胞涂在与收集装置连接的载玻片上。通过上述方式,本发明所提供的从全血中分选活性有核细胞并涂片的方法能够有效从大容量全血中去除红细胞,并从大容量全血中分离得到活性的有核细胞特别是单个活性有核细胞并实现精准涂片。
以上所述仅为本发明的实施方式,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!