一种测定厌氧反应器中氨浓度的方法与流程
本发明属于化学分析领域,尤其涉及一种测定厌氧反应器中氨浓度的方法。
背景技术:
氨是厌氧消化过程中微生物降解蛋白质和尿素等物质的最终产物。系统中低浓度的氨可以作为微生物的营养物质,而高浓度的氨会严重降低微生物活性。伴随着厌氧消化反应的进行,当微生物异化作用大于同化作用时,氨不断累积,形成高浓度氨氮。有研究表明,总氨达到1700mg/l时即会产生抑制效果;当浓度超过3000mg/l时,厌氧消化过程在任何ph下都会受到抑制。可见,掌握系统中总氨的浓度,对调控厌氧过程是非常必要的。
目前,氨的测定方法较多,其中目测比色法、蒸馏法、甲醛法等虽成本低廉,但都不同程度的存在难以准确定量、受到游离酸和样品底色干扰严重和灵敏度低等问题;分光光度法和基于凯氏定氮的方法则操作繁琐;离子色谱法虽然准确,但却存在着色谱法普遍存在的成本过高问题。
技术实现要素:
有鉴于此,本发明的目的在于提供一种测定厌氧反应器中氨浓度的方法,本发明提供的方法可快速、准确的测定厌氧反应器中的氨浓度,且该方法操作简便,无需使用昂贵的化学分析仪器。
本发明提供了一种测定厌氧反应器中氨浓度的方法,包括以下步骤:
a)、从厌氧反应器中取待测溶液,记录待测溶液的体积;
b)、将所述待测溶液的ph值调节至≤3.5,得到酸性溶液;
c)、调节所述酸性溶液的ph值至8.5~9,得到第一碱性溶液,记录第一碱性溶液的ph值和体积;
d)、使用已知浓度的碱液调节所述第一碱性溶液的ph值至9.5~10,得到第二碱性溶液,记录碱液的用量、第二碱性溶液的ph值和第二碱性溶液的体积;
e)、按照式(i)计算待测溶液的氨浓度:
式(i)中:
can表示测溶液的氨浓度,单位为mol/l;
knh4+表示铵根的解离常数;
(h+)1表示第一碱性溶液的氢离子活度,根据第一碱性溶液的ph值计算得到,单位为mol/l;
(h+)2表示第二碱性溶液的氢离子活度,根据第二碱性溶液的ph值计算得到,单位为mol/l;
ph1表示第一碱性溶液的ph值;
ph2表示第二碱性溶液的ph值;
v0表示步骤a)中测溶液的体积,单位为l;
v1表示第一碱性溶液的体积,单位为l;
v2表示第二碱性溶液的体积,单位为l;
vx表示步骤d)中碱液的用量,单位为l;
cb表示步骤d)中碱液的摩尔浓度,单位为mol/l。
优选的,所述第一碱性溶液ph值为8.75。
优选的,所述第二碱性溶液ph值为9.75。
优选的,步骤b)中,使用盐酸溶液调节所述待测溶液的ph值。
优选的,步骤b)中,ph值调节完毕后,对得到的酸性溶液进行搅拌。
优选的,步骤b)中,所述搅拌的速率为800~1500rpm。
优选的,步骤b)中,所述搅拌的时间≥4min。
优选的,步骤c)中,使用氢氧化钠水溶液和/或氢氧化钾水溶液调节所述酸性溶液的ph值。
优选的,步骤d)中,所述碱液为氢氧化钠水溶液和/或氢氧化钾水溶液。
优选的,所述待测溶液中含有挥发性脂肪酸离子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子、磷酸二氢根、磷酸一氢根、磷酸根离子、硫氢根离子、硫离子、铵根离子、卤素离子和金属离子中的一种或多种。
与现有技术相比,本发明提供了一种测定厌氧反应器中氨浓度的方法。本发明提供的方法包括以下步骤:a)、从厌氧反应器中取待测溶液,记录待测溶液的体积;b)、将所述待测溶液的ph值调节至≤3.5,得到酸性溶液;c)、调节所述酸性溶液的ph值至8.5~9,得到第一碱性溶液,记录第一碱性溶液的ph值和体积;d)、使用已知浓度的碱液调节所述第一碱性溶液的ph值至9.5~10,得到第二碱性溶液,记录碱液的用量、第二碱性溶液的ph值和第二碱性溶液的体积;e)、按照式(i)计算待测溶液的氨浓度。本发明提供的方法通过建立两个不同ph点时待测溶液的电荷平衡和终始体积,推出氨浓度和ph之间的关系,进而通过碱滴定法计算出待测溶液氨的浓度。本发明建立了一种快速测定厌氧反应器中氨浓度的方法,它具有快速、稳定、准确、简便等的特点,既解决了比色法、蒸馏法、甲醛法等方法粗糙、准确度不高的缺点,又避免了离子色谱法成本高、操作复杂的不足,使氨可实现快速、精确的在线检测。实验结果表明:本发明所得到的氨浓度与纳氏法所测得的氨浓度的最大相对误差为6.91%,最小为3.23%,这说明本发明可媲美气纳氏法,方法可靠,准确度高。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
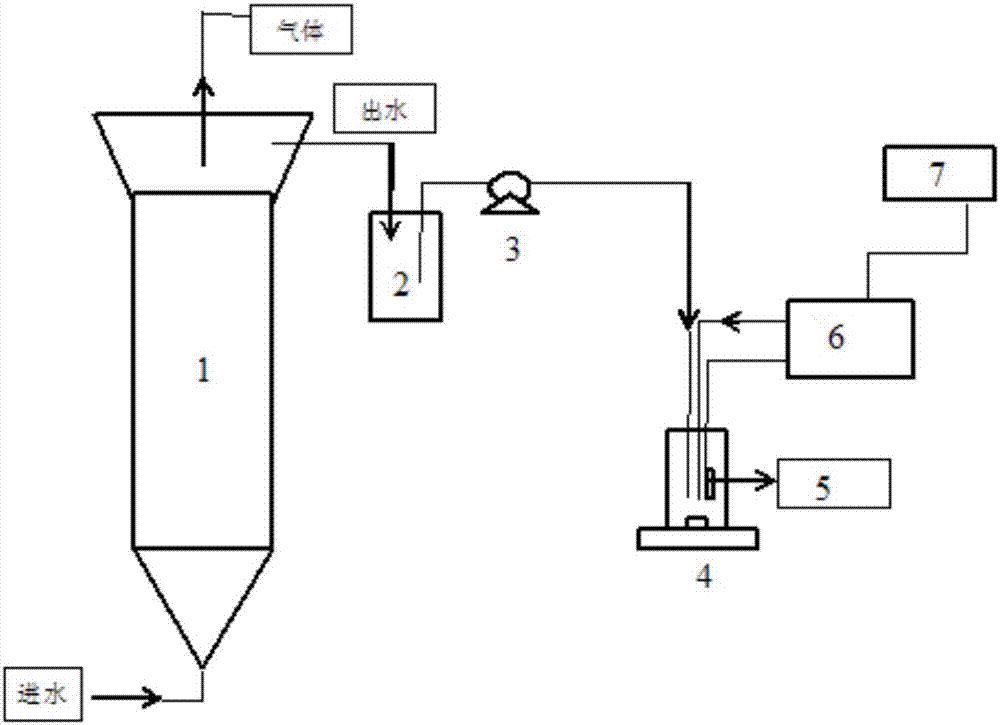
图1是本发明实施例7提供的测定流程图,图1中,1为厌氧反应器,2为出水储瓶,3为泵,4为磁力搅拌仪,5为ph电极,6为滴定仪,7为电脑。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种测定厌氧反应器中氨浓度的方法,包括以下步骤:
a)、从厌氧反应器中取待测溶液,记录待测溶液的体积;
b)、将所述待测溶液的ph值调节至≤3.5,得到酸性溶液;
c)、调节所述酸性溶液的ph值至8.5~9,得到第一碱性溶液,记录第一碱性溶液的ph值和体积;
d)、使用已知浓度的碱液调节所述第一碱性溶液的ph值至9.5~10,得到第二碱性溶液,并记录碱液的用量、第二碱性溶液的ph值和第二碱性溶液的体积;
e)、按照式(i)计算待测溶液的氨浓度:
式(i)中:
can表示测溶液的氨浓度,单位为mol/l;
knh4+表示铵根的解离常数;
(h+)1表示第一碱性溶液的氢离子活度,根据第一碱性溶液的ph值计算得到,单位为mol/l;
(h+)2表示第二碱性溶液的氢离子活度,根据第二碱性溶液的ph值计算得到,单位为mol/l;
ph1表示第一碱性溶液的ph值;
ph2表示第二碱性溶液的ph值;
v0表示步骤a)中测溶液的体积,单位为l;
v1表示第一碱性溶液的体积,单位为l;
v2表示第二碱性溶液的体积,单位为l;
vx表示步骤d)中碱液的用量,单位为l;
cb表示步骤d)中碱液的摩尔浓度,单位为mol/l。
在本发明中,首先从厌氧反应器中取一定量的待测溶液,记录待测溶液的体积。其中,所述待测溶液是指在厌氧反应器中经过一系列厌氧消化反应后化学成分极为复杂的废水,待测溶液中存在多种阴阳离子。在本发明提供的一个实施例中,所述待测溶液中含有挥发性脂肪酸离子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子、磷酸二氢根、磷酸一氢根、磷酸根离子、硫氢根离子、硫离子、铵根离子、卤素离子和金属离子中的一种或多种。
记录测溶液的体积后,将所述待测溶液的ph值调节至≤3.5,得到酸性溶液。在本发明中,优选使用盐酸溶液调节所述待测溶液的ph值,更有选使用浓度≥35wt%的盐酸。在本发明中,优选在对待测溶液进行搅拌下进行ph调节;所述搅拌的速率优选为800~1500rpm,更优选为1000~1200rpm。在本发明中,优选在ph值调节完毕后,对得到的酸性溶液进行搅拌;所述搅拌的速率为800~1500rpm,更优选为1000~1200rpm;所述搅拌的时间优选≥4min。
得到酸性溶液后,调节所述酸性溶液的ph值,得到第一碱性溶液。在本发明中,优选使用氢氧化钠水溶液和/或氢氧化钾水溶液调节所述酸性溶液的ph值;所述氢氧化钠水溶液和/或氢氧化钾水溶液中碱金属离子的浓度优选为0.1~0.5mol/l,更有选为0.3~0.4mol/l;所述氢氧化钠水溶液和/或氢氧化钾水溶液优选采用滴加的方式加入到酸性溶液中;所述滴加的低速可选择0.5~2ml/min,具体可为1ml/min。在本发明中,优选在对酸性溶液进行搅拌下进行ph调节;所述搅拌的速率优选为200~600rpm,更优选为300~400rpm。得到第一碱性溶液后,记录第一碱性溶液的ph值和体积。在本发明中,所述第一碱性溶液ph值为8.5~9,优选为8.75。
记录第一碱性溶液的ph值后,使用已知浓度的碱液调节所述第一碱性溶液的ph值,得到第二碱性溶液。在本发明中,所述碱液优选为氢氧化钠水溶液和/或氢氧化钾水溶液;所述氢氧化钠水溶液和/或氢氧化钾水溶液中碱金属离子的浓度优选为0.1~0.5mol/l,更有选为0.3~0.4mol/l;所述氢氧化钠水溶液和/或氢氧化钾水溶液优选采用滴加的方式加入到第一碱性溶液中;所述滴加的低速可选择0.5~2ml/min,具体可为1ml/min。在本发明中,优选在对第一碱性溶液进行搅拌下进行ph调节;所述搅拌的速率优选为200~600rpm,更优选为300~400rpm。得到第二碱性溶液后,记录碱液的用量、第二碱性溶液的ph值和第二碱性溶液的体积。在本发明中,所述第二碱性溶液ph值为9.5~10,优选为9.75。
在分别获得取待测溶液体积、第一碱性溶液的ph值、第二碱性溶液的ph值和碱液的用量后,按照式(i)计算待测溶液的氨浓度:
式(i)中:
can表示测溶液的氨浓度,单位为mol/l;
knh4+表示铵根的解离常数;
(h+)1表示第一碱性溶液的氢离子活度,根据第一碱性溶液的ph值计算得到,单位为mol/l;
(h+)2表示第二碱性溶液的氢离子活度,根据第二碱性溶液的ph值计算得到,单位为mol/l;
ph1表示第一碱性溶液的ph值;
ph2表示第二碱性溶液的ph值;
v0表示步骤a)中测溶液的体积,单位为l;
v1表示第一碱性溶液的体积,单位为l;
v2表示第二碱性溶液的体积,单位为l;
vx表示步骤d)中碱液的用量,单位为l;
cb表示步骤d)中碱液的摩尔浓度,单位为mol/l。
在本发明中,式(i)基于以下原理和推到方式得到:
在厌氧系统中的多种弱酸碱(盐)缓冲体系中,vfa的pk被统一为4.75,碳酸的pk1=6.36,pk2=10.25,铵根的pk=9.25,硫化氢的pk1=7.04,pk2=11.96,磷酸的pk1=2.15,pk2=7.09,pk2=12.32。可以看出,无论如何选取滴定点,vfa对滴定几乎没有影响,硫化氢与磷酸有较小的影响,而碳酸则会对滴定有重大影响。最终,本方法选择的两个ph点分别为8.75与9.75,在此ph范围内,约有2.5%的h2po4-失去质子变为hpo42-,可忽略不计其对滴定的影响;而约有20.6%的hco3-失去质子变为co32-,其影响不可忽略,因此需要采取酸化搅拌方式去除其影响。
在本发明中,第一碱性溶液的体系中的电荷平衡如下:
[h+]1+n[mn+]1+[nh4+]1=[vfa-]1+[oh-]1+[h2po4-]1+2[hpo42-]1+3[po43-]1+[x-]1式①
式①中,mn+表示n价金属离子,x-表示卤素离子。
在本发明中,第二碱性溶液的体系中的电荷平衡如下:
[h+]2+n[mn+]2+[nh4+]2+[na+]2=[vfa-]2+[oh-]2+[h2po4-]2+2[hpo42-]2+3[po43-]2+[x-]2式②
式②中,na+表示由滴加氢氧化钠溶液引入的钠离子。
将公式①与公式②两边分别乘以对应的体积,即可获得关于物质的量的等式:
{[h+]1+n[mn+]1+[nh4+]1}×v1={[vfa-]1+[oh-]1+[h2po4-]1+2[hpo42-]1+3[po43-]1+[x-]1}×v式③
{[h+]2+n[mn+]2+[nh4+]2+[na+]2}×v2={[vfa-]2+[oh-]2+[h2po4-]2+2[hpo42-]2+3[po43-]2+[x-]2}×v2式④
第一碱性溶液和第二碱性溶液中,溶液中mn+与x-的浓度虽变化,但总物质的量不变,而vfa与磷酸盐的影响可忽略不计,故公式④减去公式③,可得:
[h+]2v2-[h+]1v1-[oh-]2v2+[oh-]1v1+[na+]2v2=[nh4+]1v1-[nh4+]2v2式⑤
由于溶液中氨的总量不变,即第一碱性溶液和第二碱性溶液中的氨浓度分别可表达为:
式⑥和⑦中,knh4+表示铵根的解离常数;tan表示总氨(mol)。
将公式⑥与公式⑦代入公式⑤,即可得到样品中初始氨浓度:
式(i)中,
本发明提供的方法通过建立两个不同ph点时待测溶液的电荷平衡和终始体积,推出氨浓度和ph之间的关系,进而通过碱滴定法计算出待测溶液氨的浓度。本发明建立了一种快速测定厌氧反应器中氨浓度的方法,它具有快速、稳定、准确、简便等的特点,既解决了比色法、蒸馏法、甲醛法等方法粗糙、准确度不高的缺点,又避免了离子色谱法成本高、操作复杂的不足,使氨可实现快速、精确的在线检测。实验结果表明:本发明所得到的氨浓度与纳氏法所测得的氨浓度的最大相对误差为6.91%,最小为3.23%,这说明本发明可媲美气纳氏法,方法可靠,准确度高。
为更清楚起见,下面通过以下实施例进行详细说明。
实施例1:
在室温状态下,分别配置氯化铵浓度为15、45、75、110、150、180、230mm的人工合成反应器出水各0.03l。
1)、在400rpm电磁搅拌,滴速为1ml/min的条件下,向氯化铵浓度为15mm的出水中滴加浓度为0.3m的氢氧化钠溶液至ph为8.75,记录此时体积(v1=30.45×10-3l)。继续用0.3m的氢氧化钠酸溶液滴定,直至体系ph为9.75,氢氧化钠用量为vx=7.44×10-4l,过程最多耗时3min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=30.45×10-3l;v2=v1+vx;vx=7.44×10-4l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨浓度为15.925mm。
2)、相同操作过程,用本发明计算得到的氯化铵浓度为45、75、110、150、180、230mm的人工合成反应器出水中氨浓度分别为45.826mm、79.875mm、109.294mm、151.762mm、191.600mm和236.246mm。
从结果可知,通过本发明所得到的氨浓度与真实值的最大相对误差为6.77%,最小为0.72%,这说明本发明测量范围广,方法可靠,准确度高。
实施例2:
在室温状态下,分别配置磷酸盐浓度为0、2、4、6、8、10mm,铵根浓度为15mm的人工合成反应器出水各0.03l。
1)、在400rpm电磁搅拌,滴速为1ml/min的条件下,向磷酸盐浓度为0mm的出水中滴加浓度为0.3m的氢氧化钠溶液至ph为8.75,记录此时体积(v1=30.36×10-3l)。继续用0.3m的氢氧化钠酸溶液滴定,直至体系ph为9.75,氢氧化钠用量为vx=7.73×10-4l,过程最多耗时3min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=30.36×10-3l;v2=v1+vx;vx=7.73×10-4l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨浓度为15.631mm。
2)、相同操作过程,用本发明计算得到的磷酸盐浓度为2、4、6、8、10mm的人工合成反应器出水中氨浓度分别为15.757mm、15.853mm、16.08mm和46.069mm。
从结果可知,通过本发明所得到的氨浓度与真实值的最大相对误差为6.77%,最小为3.09%,这说明本发明不受磷酸盐影响,方法可靠,准确度高。
实施例3:
在室温状态下,分别配置乙酸浓度为0、3、5、7.5、15、30mm,铵根浓度为15mm的人工合成反应器出水各0.03l。
1)、在400rpm电磁搅拌,滴速为1ml/min的条件下,向乙酸浓度为0mm的出水中滴加浓度为0.3m的氢氧化钠溶液至ph为8.75,记录此时体积(v1=30.311×10-3l);继续用浓度为0.3m的氢氧化钠溶液滴定,直至体系ph为9.75,氢氧化钠溶液用量为vx=7.58×10-4l,过程最多耗时3min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=30.311×10-3l;v2=v1+vx;vx=7.58×10-4l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨的浓度为15.631mm。
2)、相同操作过程,用本发明计算得到的乙酸浓度为3、5、7.5、15、30mm的人工合成反应器出水中氨浓度分别为16.211mm、15.904mm、15.535mm、15.824mm、15.180mm。
从结果可知,通过本发明所得到的氨浓度与真实值的最大相对误差为5.24%,最小为1.10%,这说明本发明不受乙酸影响,方法可靠,准确度高。
实施例4:
在室温状态下,配置高浓度碳酸氢钠溶液20mm,铵根浓度为15mm的人工合成反应器出水0.03l。
在1000rpm电磁搅拌,向碳酸氢钠浓度为20mm的出水中滴加高浓度盐酸溶液至ph≤3.5,保持此状态至少4min,记录此时体积(v'=30.100×10-3l);调整转速为400rpm,滴速为1ml/min,用浓度为0.3m的氢氧化钠溶液滴定至ph为8.75,记录此时体积(v1=30.915×10-3l);继续用浓度为0.3m的氢氧化钠溶液滴定,直至体系ph为9.75,氢氧化钠溶液用量为vx=8.03×10-4l,过程最多耗时10min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=30.915×10-3l;v2=v1+vx;vx=8.03×10-4l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨的浓度为15.846mm。
从结果可知,通过本发明所得到的氨浓度与真实值的相对误差为3.72%,这说明本发明不受碳酸盐影响,方法可靠,准确度高。
实施例5:
在室温状态下,配置高浓度硫化钠溶液10mm,铵根浓度为15mm的人工合成反应器出水0.03l。
在1000rpm电磁搅拌,向硫化钠浓度为10mm的出水中滴加高浓度盐酸溶液至ph≤3.5,保持此状态至少4min,记录此时体积(v'=30.100×10-3l);调整转速为400rpm,滴速为1ml/min,用浓度为0.3m的氢氧化钠溶液滴定至ph为8.75,记录此时体积(v1=31.004×10-3l);继续用浓度为0.3m的氢氧化钠溶液滴定,直至体系ph为9.75,氢氧化钠溶液用量为vx=6.73×10-4l,过程最多耗时10min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=31.004×10-3l;v2=v1+vx;vx=6.73×10-4l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨的浓度为14.488mm。
从结果可知,通过本发明所得到的氨浓度与真实值的相对误差为4.25%,这说明本发明不受硫化物影响,方法可靠,准确度高。
实施例6:
在室温状态下,分别配置氯化钠浓度为0、0.1、0.2、0.3、0.4m(离子强度),铵根浓度为15mm的人工合成反应器出水各0.03l。
1)、在400rpm电磁搅拌,滴速为1ml/min的条件下,向氯化钠浓度为0m的出水中滴加浓度为0.3m的氢氧化钠溶液至ph为8.75,记录此时体积(v1=30.36×10-3l)。继续用0.3m的氢氧化钠酸溶液滴定,直至体系ph为9.75,盐酸用量为vx=7.73×10-4l,过程最多耗时3min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=30.36×10-3l;v2=v1+vx;vx=7.73×10-4l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨浓度为15.925mm。
2)、相同操作过程,用本发明计算得到的氯化钠浓度为0.1、0.2、0.3、0.4mm的人工合成反应器出水中氨浓度分别为15.785mm、15.564mm、14.557mm和16.910mm。
从结果可知,通过本发明所得到的氨浓度与真实值的最大相对误差为7.60%,最小为1.28%,这说明本发明不受氯化钠(离子强度)影响,方法可靠,准确度高。
实施例7
对一养鸡场废水进行滴定,测定流程如图1所示,图1是本发明实施例提供7提供的测定流程图。具体滴定过程为:从厌氧反应器1中收集出水到出水储瓶中,利用泵3将出水泵入到磁力搅拌仪4中,利用连接电脑7的滴定仪6滴定磁力搅拌仪4中的出水,同时利用ph电极5测定出水的ph。
用本发明与纳氏法(naoh-ki-hgi2)测氨浓度,过程如下:
1)、第一个样品:取30ml样品,在1000rpm电磁搅拌下,滴加高浓度盐酸溶液至ph≤3.5,保持此状态至少4min,记录此时体积(v'=31.000×10-3l);调整转速为400rpm,滴速为1ml/min,用浓度为0.3m的氢氧化钠溶液滴定至ph为8.75,记录此时体积(v1=33.157×10-3l);继续用浓度为0.3m的氢氧化钠溶液滴定,直至体系ph为9.75,氢氧化钠溶液用量为vx=1.16×10-3l,过程最多耗时10min。
用本发明的计算公式:
式中:knh4+=5.5×10-10;v0=0.03l;v1=33.157×10-3l;v2=v1+vx;vx=1.16×10-3l;cb=0.3mol/l;ph1=8.75;(h+)1=1×10-8.75mol/l;ph2=9.75;(h+)2=1×10-9.75mol/l。
最终得氨浓度为22.301mm,用纳氏法测的氨浓度为21.602mm。
2)、相同操作过程,用本发明计算得到第二个样品和第三个样品中氨浓度分别为22.671mm、22.567mm,用纳氏法测的氨浓度分别为21.471mm、21.505mm。
从结果可知,通过本发明所得到的氨浓度与纳氏法所测得的氨浓度的最大相对误差为6.91%,最小为3.23%,这说明本发明可媲美气纳氏法,方法可靠,准确度高。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!