方法、阵列及其用途与流程
本发明提供确定胰腺癌相关疾病状态(早期胰腺癌存在、胰腺癌阶段和/或胰腺癌存在)的方法,以及用于此类方法的阵列和试剂盒。
背景技术:
胰腺导管腺癌(pdac)是最致命的癌症之一,有3-4%的5年生存率。这种预后不良背后的关键驱动因素是目前无法在早期诊断患者。数据支持从肿瘤起始直到取得转移能力需要五年多的时间(yachida等人,2010),这清楚地证明如果可利用准确的标志物,就有机会及早检测到。在诊断时,患者常已发展到疾病晚期,并且只有约15%的患者具有可切除肿瘤(conlon等人,1996;sohn等人,2000)。呈现出大的切除肿瘤的这些患者的5年生存率仅为10-20%(conlon等人,1996;sohn等人,2000)。然而,如果肿瘤≤20mm(i-ii期)可以被切除,则5年生存率提高到30-60%(furukawa等人,1996;shimizu等人,2005)。晚期诊断(iii-iv期)是由于非特异性临床症状以及缺乏早期诊断标志物,这一点在本研究中得以解决。有趣的是,研究表明胰腺肿瘤可以早在临床诊断前六个月在无症状阶段切除(gangi等人,2004;pelaez-luna等人,2007)。
迄今为止评估最多的pdac标志物ca19-9具有不良特异性,在其他几种适应症中水平升高,以及在基因型路易斯(lewis)a-b-(5%人群)的患者中完全缺失。因此,不建议将ca19-9用于胰腺癌筛查(locker等人,2006)。如今,虽然最近的发现研究已证明外泌体和核小体均含有与胰腺癌相关的信息,但还没有其他单一的生物标志物能准确地诊断pdac(bauden等人,2015;melo等人,2015)。然而,需要提供具有改善的灵敏度和特异性的生物标志物和生物标志物小组。
技术实现要素:
因此,本发明的第一方面提供诊断或确定胰腺癌相关疾病状态的方法,其包含或由以下步骤组成:
(a)提供来自待测个体的样本;以及
(b)通过测量选自表a中所定义的组的一种或多种生物标志物在测试样本中的存在和/或量来确定测试样本的生物标志物特征;
其中,选自表a中所定义的组的所述一种或多种生物标志物在测试样本中的存在和/或量指示所述个体中的胰腺癌相关疾病。
因此,在一个实施例中,所述方法包含确定测试样本的生物标志物特征,这使得能够针对从中获得样本的个体达到诊断。
“胰腺癌相关疾病状态”包括胰腺癌本身存在、胰腺癌阶段和/或相关病变的存在,如导管内乳头状黏液性肿瘤(intraductalpapillarymucinousneoplasms)(参见下文)。特别地,包括胰腺导管腺癌(pdac)的存在和/或阶段。
在具体实施例中,本发明的方法允许:
(i)早期胰腺癌的诊断和/或分期;和/或
(ii)胰腺癌的诊断和/或分期(即早期或晚期)。
“生物标志物”意指天然存在的生物分子或其组分或片段,其测量可以提供对胰腺癌的诊断和/或预后有用的信息。因此,在表a的上下文中,生物标志物可为天然存在的蛋白质,或其多肽片段或碳水化合物部分(或在路易斯x和唾液酸路易斯x的情况下,本身是碳水化合物部分)。或者,生物标志物可为核酸分子,如mrna、cdna或循环肿瘤dna分子,其编码蛋白质或其部分。
“诊断”意指或包括确定个体中疾病状态的存在或不存在(例如,确定个体是否患有早期胰腺癌或胰腺癌(早期或晚期))。
“分期”意指或包括确定胰腺癌的阶段,例如,确定胰腺癌是否为i期、ii期、iii期或iv期(例如,i期、ii期、i-ii期、iii-iv期或i-iv期)。
“早期胰腺癌”包括或意指胰腺癌,其包含或由i期和/或ii期胰腺癌组成。
可选地或另外地,“早期胰腺癌”包括或意指如由美国癌症联合委员会(ajcc)tnm系统所确定的i期和/或ii期胰腺癌(例如,参见:http://www.cancer.org/cancer/pancreaticcancer/detailedguide/pancreatic-cancer-staging和《ajcc癌症分期手册(ajcccancerstagingmanual)》(第7版),2011,edge等人,斯普林格(springer),其通过引用的方式并入本文中。
tnm癌症分期系统基于3条关键信息:
■t描述主要(原发)肿瘤的大小,以及所述肿瘤是否已在胰腺外生长并进入附近器官中。
■n描述向附近(区域)淋巴结的扩散。
■m指示癌是否已经转移(扩散)到身体的其他器官。(最常见的胰腺癌扩散部位是肝、肺和腹膜-消化器官周围的空间。)
数字或字母出现在t、n和m之后,以提供更多关于这些因素中的每一种的详细信息。
t类别
tx:无法评估主要肿瘤。
t0:没有原发肿瘤的证据。
tis:原位癌(肿瘤局限于胰腺导管细胞的顶层)。(在此阶段很少发现胰腺肿瘤。)
t1:癌仍在胰腺内,并且宽2厘米(cm)(约3/4英寸)或更小。
t2:癌仍在胰腺内,但宽大于2cm。
t3:癌已生长到胰腺外进入附近的周围组织,但没有进入主血管或神经。
t4:癌已生长到越过胰腺进入附近的大血管或神经。
n类
nx:无法评估附近(区域)淋巴结。
n0:癌未扩散到附近的淋巴结。
n1:癌已扩散到附近的淋巴结。
m类
m0:癌未扩散到远处淋巴结(除邻近胰腺的淋巴结以外)或远处器官,如肝、肺、脑等。
m1:癌已扩散到远处淋巴结或远处器官。
胰腺癌的阶段分组
一旦确定了t、n和m类别,就将此信息组合起来以指定0、i、ii、iii或iv的整个阶段(有时后跟字母)。这个过程称为阶段分组。
0期(tis、n0、m0):肿瘤局限于胰腺导管细胞的顶层且未侵入更深的组织。所述肿瘤未扩散到胰腺外。这些肿瘤有时称作原位胰腺癌或胰腺上皮内瘤变iii(paniniii)。
ia期(t1、n0、m0):肿瘤局限于胰腺且宽2cm或更小(t1)。所述肿瘤未扩散到附近的淋巴结(n0)或远处部位(m0)。
ib期(t2、n0、m0):肿瘤局限于胰腺且宽大于2cm(t2)。所述肿瘤未扩散到附近的淋巴结(n0)或远处部位(m0)。
iia期(t3、n0、m0):肿瘤生长到胰腺外但没有进入主血管或神经(t3)。所述肿瘤未扩散到附近的淋巴结(n0)或远处部位(m0)。
iib期(t1-3、n1、m0):肿瘤局限于胰腺或生长到胰腺外但没有进入主血管或神经(t1-t3)。所述肿瘤已扩散到附近的淋巴结(n1),但没有扩散到远处部位(m0)。
iii期(t4、任何n、m0):肿瘤生长到胰腺外进入附近的主血管或神经(t4)。所述肿瘤可能已或可能未扩散到附近的淋巴结(任何n)。所述肿瘤未扩散到远处部位(m0)。
iv期(任何t、任何n、m1):癌已扩散到远处部位(m1)。
可选地或另外地,“早期胰腺癌”包括或意指无症状的胰腺癌。胰腺癌的常见症状包括黄疸(对于胰头肿瘤)、腹痛、体重减轻、脂肪痢(steatorrhoea)和新发糖尿病。例如,胰腺癌可能在观察到症状或症状可观察(例如,常见症状)之前至少1周存在,例如在观察到症状或症状可观察之前≥2周、≥3周、≥4周、≥5周、≥6周、≥7周、≥8周、≥3个月、≥4个月、≥5个月、≥6个月、≥7个月、≥8个月、≥9个月、≥10个月、≥11个月、≥12个月、≥18个月、≥2年、≥3年、≥4年或≥5年。
可选地或另外地,“早期胰腺癌”包括大小和/或发展阶段不足以通过常规临床方法诊断的胰腺癌。
可选地或另外地,“早期胰腺癌”包括或意指在通过常规临床方法诊断胰腺癌或胰腺癌可诊断之前至少1周存在的胰腺癌,例如在通过常规临床方法诊断胰腺癌或胰腺癌可诊断之前≥2周、≥3周、≥4周、≥5周、≥6周、≥7周、≥8周、≥3个月、≥4个月、≥5个月、≥6个月、≥7个月、≥8个月、≥9个月、≥10个月、≥11个月、≥12个月、≥18个月、≥2年、≥3年、≥4年或≥5年。
用于临床胰腺癌诊断的当代最佳实践将为本领域技术人员所熟知,详细综述参见ducreux等人,2015《胰腺癌:用于诊断、治疗和随访的esmo临床实践指南(‘cancerofthepancreas:esmoclinicalpracticeguidelinesfordiagnosis,treatmentandfollow-up’)》《肿瘤学年鉴(annalsofoncology)》,26(补充5):第56版-第68版,其通过引用的方式并入本文中且可在此获得:
https://annonc.oxfordjournals.org/content/26/suppl_5/v56.full.pdf+html。
可选地或另外地,“常规临床诊断”(等[例如,“通过常规临床方法诊断”])包括ct扫描、超声、内窥镜超声、活组织检查(组织病理学)和/或体检(例如,腹部和可能的局部淋巴结)。在一个实施例中,“常规临床诊断”(等)包括在ducreux等人,2015,《胰腺癌:用于诊断、治疗和随访的esmo临床实践指南》,《肿瘤学年鉴》,26(补充5):第56版-第68版中所阐述的胰腺癌诊断程序,所述文献通过引用的方式并入本文中。
可选地或另外地,“常规临床诊断”(等)可包括或排除使用存在于体液(如血液、血清、间质液、淋巴液、尿液、粘液、唾液、痰液、汗液)和或组织中的分子生物标志物。
可选地或另外地,“早期胰腺癌”包括或意指可切除的胰腺癌。
“可切除的胰腺癌”包括或意指胰腺癌包含或由肿瘤组成,所述肿瘤(和/或被认为)能够通过手术去除(即可切除)。
可选地或另外地,包括限于胰腺的胰腺癌(即不延伸越过胰腺和/或未转移)。
可选地或另外地,“早期胰腺癌”包括胰腺癌,所述胰腺癌包含在所有维度上均为30mm或更小的肿瘤(即在此实施例中,患有早期胰腺癌的个体不包含在任何维度上均大于30mm的胰腺癌肿瘤),例如,在所有维度上均等于或小于29mm、28mm、27mm、26mm、25mm、24mm、22mm、21mm、20mm、19mm、18mm、17mm、16mm、15mm、14mm、13mm、12mm、11mm、10mm、9mm、8mm、7mm、6mm、5mm、4mm、3mm、2mm、1mm或等于或0.1mm。可选地或另外地,在所有维度上均为30mm或更小的胰腺癌肿瘤在一个维度上为至少2mm。可选地或另外地,在所有维度上均为30mm或更小的胰腺癌肿瘤所有维度均为至少2mm。
可选地或另外地,“i期胰腺癌”包括或意指ia和/或ib期ajcc。
可选地或另外地,“ii期胰腺癌”包括或意指iia和/或iib期ajcc。
可选地或另外地,“晚期胰腺癌”包括或意指胰腺癌,其包含或由iii期和/或iv期胰腺癌组成。
可选地或另外地,“iii期胰腺癌”包括或意指iii期ajcc。
可选地或另外地,“iv期胰腺癌”包括或意指iv期ajcc。
“胰腺癌”的胰腺癌相关疾病状态包括胰腺癌,其包含或由任何阶段的胰腺癌组成。
“待测样本”、“测试样本”或“对照样本”包括取自个体或衍生自个体的组织或液体样本。优选地,待测样本由哺乳动物提供。哺乳动物可为任何家养或农场动物。优选地,哺乳动物是大鼠、小鼠、豚鼠、猫、狗、马或灵长类动物。最优选地,哺乳动物是人。
优选地,样本是细胞、组织或液体样本(或其衍生物),其包含或由以下组成:血液(分级的或未分级的)、血浆、浆细胞、血清、组织细胞或同样优选的衍生自细胞或组织样本的蛋白质或核酸。优选地,测试和对照样本源自相同物种。优选地,测试和对照样本与年龄、性别和/或生活方式相匹配。
在替代或额外实施例中,组织样本是胰腺组织。在替代或额外实施例中,细胞样本是胰腺细胞样本。
可选地或另外地,可使用本领域已知的常规临床方法来诊断胰腺癌。例如,描述于ducreux等人,2015,《胰腺癌:用于诊断、治疗和随访的esmo临床实践指南》,《肿瘤学年鉴》,26(补充5):第56版-第68版和/或freelove和walling,2006,《胰腺癌:诊断和管理(‘pancreaticcancer:diagnosisandmanagement’)》,《美国家庭医生(americanfamilyphysician)》,73(3):485-492中的那些方法,所述参考文献通过引用的方式并入本文中
因此,可使用选自由以下组成的组的一种或多种方法来诊断胰腺癌:
计算机断层扫描(优选地,双相螺旋计算机断层扫描);经腹超声检查;内窥镜超声检查引导的细针穿刺;内窥镜逆行胰胆管造影术;正电子发射断层扫描;磁共振成像;体检;和活组织检查。
可选地和/或另外地,可使用用于胰腺癌诊断的生物标志物的检测来诊断胰腺癌。例如,可利用由以下组成的组中所描述的一种或多种生物标志物或诊断方法来诊断胰腺癌:wo2008/117067a9;wo2012/120288a2;和wo2015/067969a2。
可选地或另外地,步骤(b)包含或由以下组成:测量表a中所列出的1种或多种生物标志物的存在和/或量,例如表a中所列出的生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种、22种、23种、24种、25种、26种、27种、28种、29种、30种、31种、32种、33种、34种、35种、36种、37种、38种、39种、40种、41种、42种、43种、44种、45种、46种、47种、48种、49种、50种、51种、52种、53种、54种、55种、56种、57种、58种、59种、60种、61种、62种、63种、64种、65种、66种、67种、68种、69种、70种、71种、72种、73种、74种、75种、76种、77种、78种、79种、80种、81种、82种、83种、84种或85种。
可选地或另外地,步骤(b)包含、其组成为或其排除测量chp-1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mapkk2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mapkk6的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量r-ptp-o的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量ubp7的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量apo-a1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量btk的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量c1q的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量c5的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量cdk-2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量igm的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-11的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-12的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-6的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量jak3的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mapk8的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mcp-1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量muc-1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量备解素(properdin)的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量vegf的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量grip-2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mapk9的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量pkbγ的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量prd14的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量r-ptp-η的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量topbp1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量c3的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量cd40l的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量egfr的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量hadh2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量icam-1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-13的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-18的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量肌球蛋白(myomesin)-2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量p85a的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量rantes的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量tgf-b1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-4的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量cims(13)的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量gnai3的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量hsmad2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量h纺锤体检验点蛋白(hspindly)的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量r-ptp-κ的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量stat1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量atp-5b的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量c4的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量chx10的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量因子b的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量her2/erbb-2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-1b的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-7的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量路易斯x的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mcp-3的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量唾液酸路易斯x的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量tbc1d9的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量tnfrsf3的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量agap-2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量c1-inh的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量c1s的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量glp-1r的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量ksyk的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量mapk1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量tens4的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量fasn的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-10的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-3的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量il-8的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量stap2的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量ct17的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量地高辛的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量hshec1的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量par-6b的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量pgam5的表达。可选地或另外地,步骤(b)包含以下步骤、由以下步骤组成或排除以下步骤:测量ifn-γ的表达。
可选地或另外地,胰腺癌相关疾病状态是早期胰腺癌。
可选地或另外地,所述方法用于i期或ii期胰腺癌的诊断和/或分期(即诊断胰腺癌和/或将胰腺癌表征为i期或ii期,而不必确定是哪一阶段)。可选地或另外地,步骤(b)包含或由以下组成:测量下表中所列出的1种或多种生物标志物的存在和/或量:
表a(i),例如表a(i)中所列出的所述生物标志物中的至少2种、3种、4种或5种;
表a(iii),例如表a(iii)中所列出的所述生物标志物中的至少2种、3种、4种、5种或6种;
表a(v),例如表a(v)中所列出的所述生物标志物中的至少2种、3种、4种、5种或6种;以及
表a(xi),例如表a(xi)中所列出的所述生物标志物中的至少2种或3种。
可选地或另外地,步骤(b)包含或由以下组成:测量下表中所列出的1种或多种生物标志物的存在和/或量:
表a(ii),例如表a(ii)中所列出的生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种或16;
表a(iv),例如表a(iv)中所列出的所述生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种或12种;
表a(vi),例如表a(vi)中所列出的所述生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种或13种;以及
表a(xii),例如表a(xii)中所列出的所述生物标志物中的至少2种、3种、4种、5种或6种。
可选地或另外地,所述方法用于i期胰腺癌的诊断和/或分期(即诊断胰腺癌和/或将胰腺癌表征为i期)。
可选地或另外地,步骤(b)包含或由以下组成:测量下表中所列出的1种或多种生物标志物的存在和/或量:
表a(i),例如表a(i)中所列出的所述生物标志物中的至少2种、3种、4种或5种;
表a(iii),例如表a(iii)中所列出的所述生物标志物中的至少2种、3种、4种、5种或6种;
表a(vii)。
可选地或另外地,步骤(b)包含或由以下组成:测量下表中所列出的1种或多种生物标志物的存在和/或量:
表a(ii),例如表a(ii)中所列出的所述生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种或16种;
表a(iv),例如表a(iv)中所列出的所述生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种或12种;以及
表a(viii),例如表a(viii)中所列出的所述生物标志物中的至少2种、3种、4种、5种或6种。
可选地或另外地,所述方法用于ii期胰腺癌的诊断和/或分期。
可选地或另外地,步骤(b)包含或由以下组成:测量下表中所列出的1种或多种生物标志物的存在和/或量:
表a(i),例如表a(i)中所列出的所述生物标志物中的至少2种、3种、4种或5种;
表a(v),例如表a(v)中所列出的所述生物标志物中的至少2种、3种、4种、5种或6种;
表a(ix)。
可选地或另外地,步骤(b)包含或由以下组成:测量下表中所列出的1种或多种生物标志物的存在和/或量:
表a(ii),例如表a(ii)中所列出的所述生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种或16种;
表a(vi),例如表a(vi)中所列出的所述生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种或13种;以及
表a(x),例如表a(x)中所列出的所述生物标志物中的至少2种、3种或4种。
可选地或另外地,所述方法用于诊断或表征iii或iv期胰腺癌(即诊断胰腺癌和/或将胰腺癌表征为iii或iv期),包含或由以下组成:测量用于诊断或表征如上所定义的i或ii期胰腺癌的一种或多种生物标志物的存在或量,以及测量用于诊断或表征如上所定义的i-iv期胰腺癌的一种或多种生物标志物的存在或量。可选地或另外地,‘i或ii’期生物标志物中的一种或多种不同于‘i-iv期生物标志物’中的一种或多种。可选地或另外地,‘i或ii’期生物标志物中的所有均不同于‘i-iv期生物标志物’中的一种或多种。
可选地或另外地,胰腺癌相关疾病状态是胰腺癌(即所述方法用于诊断胰腺癌的存在)。
可选地或另外地,步骤(b)包含或由以下组成:测量选自由chp-1、mapkk2、ubp7、prd14、stat1、agap-2、pgam5、lum、ptpro和usp07组成的组的1种或多种生物标志物(例如,这些生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种或10种)的存在和/或量。
可选地或另外地,步骤(b)包含或由以下组成:测量选自由apo-a1、btk、c1q、c5、cdk-2、igm、il-11、il-12、il-6、jak3、mapk8、mcp-1、muc-1、备解素、vegf、c3、icam-1、il-13、atp-5b、c4、her2/erb-2、il-7、il-3、il-8、gm-csf、il-9、ldl和orp3组成的组的1种或多种生物标志物(例如,这些生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种、22种、23种、24种、25种、26种、27种、28种或29种)的存在和/或量。
可选地或另外地,步骤(b)包含以下步骤:测量图4中所列出的生物标志物中的一种或多种,例如,图4中所列出的生物标志物中的至少2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种、16种、17种、18种、19种、20种、21种、22种、23种、24种、25种、26种、27种、28种、29种、30种或31种。
可选地或另外地,步骤(b)包含测量表a中所列出的所有生物标志物的存在和/或量。
可选地或另外地,所述方法进一步包含或由以下组成:
(c)提供一个或多个来自以下的对照样本:
(i)未患胰腺癌的个体;和/或
(ii)患有胰腺癌的个体,其中所述样本的阶段与测试样本的阶段不同;
(d)通过测量步骤(b)中所测量的所述一种或多种生物标志物在所述对照样本中的存在和/或量来确定所述一个或多个对照样本的生物标志物特征;
其中,在步骤(b)中所测量的所述一种或多种生物标志物在所述测试样本中的存在和/或量不同于步骤(d)中所测量的所述一种或多种生物标志物在所述对照样本中的存在和/或量的情况下,识别所述胰腺癌相关疾病状态。
“与对照样本中的存在和/或量不同”意指或包括测试样本中一种或多种生物标志物的存在和/或量不同于一个或多个对照样本中一种或多种生物标志物的存在和/或量(或与预定的表示相同的存在和/或量的参考值不同)。优选地,测试样本中的存在和/或量与一个或多个对照样本中的存在或量(或对照样本的平均值)相差至少±5%,例如,一个或多个对照样本(例如,阴性对照样本)的至少±6%、±7%、±8%、±9%、±10%、±11%、±12%、±13%、±14%、±15%、±16%、±17%、±18%、±19%、±20%、±21%、±22%、±23%、±24%、±25%、±26%、±27%、±28%、±29%、±30%、±31%、±32%、±33%、±34%、±35%、±36%、±37%、±38%、±39%、±40%、±41%、±42%、±43%、±44%、±45%、±41%、±42%、±43%、±44%、±55%、±60%、±65%、±66%、±67%、±68%、±69%、±70%、±71%、±72%、±73%、±74%、±75%、±76%、±77%、±78%、±79%、±80%、±81%、±82%、±83%、±84%、±85%、±86%、±87%、±88%、±89%、±90%、±91%、±92%、±93%、±94%、±95%、±96%、±97%、±98%、±99%、±100%、±125%、±150%、±175%、±200%、±225%、±250%、±275%、±300%、±350%、±400%、±500%或至少±1000%。
可选地或另外地,测试样本中的存在或量与对照样本中的平均存在或量相差至少>1标准偏差,与对照样本中的平均存在或量相差,例如,与对照样本中的平均存在或量相差≥1.5、≥2、≥3、≥4、≥5、≥6、≥7、≥8、≥9、≥10、≥11、≥12、≥13、≥14或≥15标准偏差。可使用任何合适的手段来确定标准偏差(例如,welford的直接平方和),然而,在一个实施例中,使用直接方法(即[样本减去平均值的平方和,除以样本数]的平方根)确定标准偏差。
可选地或另外地,“与对照样本中的存在和/或量不同”意指或包括以统计学上的显著方式,测试样本中的存在或量与对照样本中的量不相关。“以统计学上的显著方式与对照样本中的量不相关”意指或包括测试样本中的存在或量与对照样本中的存在或量相关,其中p值为>0.001,例如,>0.002、>0.003、>0.004、>0.005、>0.01、>0.02、>0.03、>0.04、>0.05、>0.06、>0.07、>0.08、>0.09或>0.1。可以使用任何合适的确定技术人员已知的p值的手段,包括z-检验、t-检验、学生t-检验、f-检验、曼-惠特尼u检验(mann-whitneyutest)、威尔科克森符号秩检验(wilcoxonsigned-ranktest)和皮尔森卡方检验(pearson'schi-squaredtest)。
可选地或另外地,所述方法进一步包含或由以下组成:
提供一个或多个来自以下的对照样本;
(e)患有胰腺癌的个体(即阳性对照);和/或
(f)患有胰腺癌的个体,其中所述样本与所述测试样本处于同一阶段;
通过测量步骤(b)中所测量的所述一种或多种生物标志物在所述对照样本中的存在和/或量来确定所述对照样本的生物标志物特征;
其中,在步骤(b)中所测量的所述一种或多种生物标志物在所述测试样本中的存在和/或量对应于步骤(f)中所测量的所述一种或多种生物标志物在所述对照样本中的存在和/或量的情况下,识别所述胰腺癌相关疾病状态。
“对应于对照样本中的存在和/或量”意指或包括存在和/或量与阳性对照样本的存在和/或量一致;或比一个或多个阴性对照样本更接近于一个或多个阳性对照样本的存在和/或量(或对应于预定的表示相同的存在和/或量的参考值)。优选地,存在和/或量在一个或多个对照样本的所述存在和/或量(或对照样本的平均值)的±40%内,例如,在一个或多个对照样本(例如,阳性对照样本)的±39%、±38%、±37%、±36%、±35%、±34%、±33%、±32%、±31%、±30%、±29%、±28%、±27%、±26%、±25%、±24%、±23%、±22%、±21%、±20%、±19%、±18%、±17%、±16%、±15%、±14%、±13%、±12%、±11%、±10%、±9%、±8%、±7%、±6%、±5%、±4%、±3%、±2%、±1%、±0.05%或0%内。
可选地或另外地,测试样本中的存在或量与对照样本中的平均存在或量相差≤5标准偏差,例如,与对照样本中的平均存在或量相差≤4.5、≤4、≤3.5、≤3、≤2.5、≤2、≤1.5、≤1.4、≤1.3、≤1.2、≤1.1、≤1、≤0.9、≤0.8、≤0.7、≤0.6、≤0.5、≤0.4、≤0.3、≤0.2、≤0.1或0标准偏差,条件是不同和对应的生物标志物表达的标准偏差范围不重叠(例如,邻接但不重叠)。
可选地或另外地,“对应于对照样本中的存在和/或量”意指或包括以统计学上的显著方式,测试样本中的存在或量与对照样本中的量相关。“以统计学上的显著方式与对照样本中的量相关”意指或包括测试样本中的存在或量与对照样本中的存在或量相关,其中p值≤0.05,例如,≤0.04、≤0.03、≤0.02、≤0.01、≤0.005、≤0.004、≤0.003、≤0.002、≤0.001、≤0.0005或≤0.0001。
可以通过技术人员已知的任何合适的手段来确定生物标志物的差异表达(上调或下调)或其缺乏。差异表达确定为至少小于0.05的p值(p=<0.05),例如,至少<0.04、<0.03、<0.02、<0.01、<0.009、<0.005、<0.001、<0.0001、<0.00001或至少<0.000001。可选地或另外地,使用支持向量机(supportvectormachine,svm)确定差异表达。可选地或另外地,svm是如下所述的svm。最优选地,svm是或衍生自下表5中所述的svm。
本领域技术人员将理解,差异表达可涉及单个生物标志物或组合考虑的多个生物标志物(即作为生物标志物特征)。因此,p值可与单个生物标志物或一组生物标志物相关。实际上,当单独考虑时,具有大于0.05的差异表达p值的蛋白质,当其表达水平与一种或多种其他生物标志物组合考虑时仍可用作根据本发明的生物标志物。
如所附实例中举例说明的,组织、血液、血清或血浆测试样本中某些蛋白质的表达可指示个体中的胰腺癌。例如,单个测试样本中某些血清蛋白的相对表达可指示个体中存在胰腺癌。
在替代或额外实施例中,将步骤(b)中所测量的一种或多种生物标志物在测试样本中的存在和/或量与代表步骤(d)和/或(f)中的测量值的预定义参考值进行比较。
可选地或另外地,从中获得所述一个或多个对照样本的所述个体在获得所述样本时未患非癌性胰腺疾病或病症,例如急性胰腺炎、慢性胰腺炎和自身免疫性胰腺炎、胰腺的导管内乳头状黏液性瘤变(intraductalpapillarymucinousneoplasia,ipmn)。
可选地或另外地,从中获得所述一个或多个对照样本的所述个体在获得所述样本时未患任何胰腺疾病或病症。
可选地或另外地,未患胰腺癌的所述个体在获得所述样本时未患任何疾病或病症。
可选地或另外地,未患胰腺癌的所述个体是健康个体。
可选地或另外地,患有胰腺癌的一个或多个个体患有选自由以下组成的组的胰腺癌:腺癌(例如,胰腺导管腺癌或管状乳头状胰腺腺癌)、胰腺肉瘤、恶性浆液状囊腺瘤、腺鳞状上皮癌、印戒细胞癌、肝样癌、胶样癌、未分化癌和具有破骨细胞样巨细胞的未分化癌。
可选地或另外地,胰腺癌(pancreaticcancer)是胰腺腺癌(pancreaticadenocarcinoma)(例如,胰腺导管腺癌)。
可选地或另外地,患有胰腺癌的一个或多个个体未患选自由以下组成的组的一种或多种胰腺癌:腺癌(例如,胰腺导管腺癌或管状乳头状胰腺腺癌)、胰腺肉瘤、恶性浆液状囊腺瘤、腺鳞状上皮癌、印戒细胞癌、肝样癌、胶样癌、未分化癌和具有破骨细胞样巨细胞的未分化癌。
可选地或另外地,重复所述方法。
可选地或另外地,重复所述方法,并且其中在步骤(a)中,在与先前方法重复不同的时间取得待测样本。
可选地或另外地,使用在与所用的先前测试样本不同的时间段取得的测试样本重复所述方法。
可选地或另外地,使用距所用的先前测试样本1天至104周之间取得的测试样本重复所述方法,例如,在1周至100周之间、在1周至90周之间、在1周至80周之间、在1周至70周之间、在1周至60周之间、在1周至50周之间、在1周至40周之间、在1周至30周之间、在1周至20周之间、在1周至10周之间、在1周至9周之间、在1周至8周之间、在1周至7周之间、在1周至6周之间、在1周至5周之间、在1周至4周之间、在1周至3周之间或在1周至2周之间。
可选地或另外地,使用选自由以下组成的组的每个时期取得的测试样本重复所述方法:1天、2天、3天、4天、5天、6天、7天、10天、2周、3周、4周、5周、6周、7周、8周、9周、10周、15周、20周、25周、30周、35周、40周、45周、50周、55周、60周、65周、70周、75周、80周、85周、90周、95周、100周、104周、105周、110周、115周、120周、125周和130周。
可选地或另外地,所述方法重复至少一次,例如,2次、3次、4次、5次、6次、7次、8次、9次、10次、11次、12次、13次、14次、15次、16次、17次、18次、19次、20次、21次、22次、23次、24次或25次。
可选地或另外地,连续重复所述方法。
可选地或另外地,重复所述方法直到使用本发明的方法和/或常规临床方法在个体中诊断出胰腺癌和/或对胰腺癌进行分期。
可选地或另外地,每次重复使用取自同一个体的测试样本。
可选地或另外地,步骤(b)包含测量所述一种或多种生物标志物的蛋白质或多肽的表达。
可选地或另外地,使用一种或多种能够与表a中所列出的生物标志物结合的第一结合剂进行步骤(b)、(d)和/或步骤(f)。本领域技术人员将了解,第一结合剂可包含或由以下组成:对蛋白质生物标志物之一具有特异性的单一物质,或多种不同物质(每种物质都对不同的蛋白质生物标志物具有特异性)。
可以基于结合剂结合给定主结构的能力,从文库中选择合适的结合剂(也称作结合分子),如下所论述。
至少一种类型的结合剂且更通常地所有类型的结合剂,可包含或由以下组成:抗体或其抗原结合片段,或其变体。
产生和使用抗体的方法是本领域熟知的,例如参见《抗体:实验室手册(antibodies:alaboratorymanual)》,1988,harlow和lane,冷泉港出版社(coldspringharborpress),isbn-13:978-0879693145,《使用抗体:实验室手册(usingantibodies:alaboratorymanual)》,1998,harlow和lane,冷泉港出版社,isbn-13:978-0879695446和《制作和使用抗体:实践手册(makingandusingantibodies:apracticalhandbook)》,2006,howard和kaser,crc出版社,isbn-13:978-0849335280(其公开内容通过引用的方式并入本文中)。
因此,片段可含有可变重(vh)或可变轻(vl)区中的一个或多个。例如,术语抗体片段包括fab样分子(better等人(1988)《科学(science)》240,1041);fv分子(skerra等人(1988)《科学》240,1038);其中vh和vl配对区通过柔性寡肽连接的单链fv(scfv)分子(bird等人(1988)《科学》242,423;huston等人(1988)《美国国家科学院院刊(proc.natl.acad.sci.usa)》85,5879)和包含分离的v区的单区抗体(dab)(ward等人(1989)《自然》341,544)。
术语“抗体变体”包括任何合成抗体、重组抗体或抗体杂交物,如但不限于:通过免疫球蛋白轻链和/或重链可变区域和/或恒定区域的噬菌体呈现产生的单链抗体分子,或本领域技术人员已知的能够以免疫测定形式与抗原结合的其他免疫活性分子。
涉及保留抗体片段特异结合位点的抗体片段的合成的技术的一般性综述可见于winter和milstein(1991)《自然》349,293-299。
分子文库可用作来源,如抗体文库(clackson等人,1991,《自然》,352,624-628;marks等人,1991,《分子生物学杂志(jmolbiol)》,222(3):581-97)、肽文库(smith,1985,《科学(science)》,228(4705):1315-7)、表达的cdna文库(santi等人,(2000)《分子生物学杂志》296(2):497-508)、除抗体框架以外的其他支架上的文库,如亲和体(gunneriusson等人,1999,《应用环境微生物学(applenvironmicrobiol)》65(9):4134-40)或基于适体的文库(kenan等人,1999,《分子生物学方法(methodsmolbiol)》118,217-31),从中选择对给定主结构具有特异性的结合分子以用于本发明的方法。
分子文库可以在原核细胞(clackson等人,1991,前面所引用的;marks等人,1991,前面所引用的)或真核细胞(kieke等人,1999,《美国国家科学院院刊》,96(10):5651-6)中体内表达,或可体外表达而不涉及细胞(hanes和pluckthun,1997,《美国国家科学院院刊》94(10):4937-42;he和taussig,1997,《核酸研究(nucleicacidsres)》25(24):5132-4;nemoto等人,1997,《febs学报(febslett)》,414(2):405-8)。
在使用基于蛋白质的文库的情况下,编码潜在结合分子的文库的基因常常被包裹在病毒中,并且所述潜在的结合分子呈现在病毒表面(clackson等人,1991,前面所引用的;marks等人,1991,前面所引用的;smith,1985,前面所引用的)。
最常用的此类系统是在其表面呈现抗体片段的丝状噬菌体,所述抗体片段表达为噬菌体的次要外壳蛋白的融合体(clackson等人,1991,前面所引用的;marks等人,1991,前面所引用的)。然而,已使用用于呈现的其他系统,其使用其他病毒(ep39578)、细菌(gunneriusson等人,1999,前面所引用的;daugherty等人,1998,《蛋白质工程(proteineng)》11(9):825-32;daugherty等人,1999,《蛋白质工程》12(7):613-21)和酵母(shusta等人,1999,《分子生物学杂志》292(5):949-56)。
此外,已利用在所谓的核糖体呈现系统中多肽产物与其编码mrna的连接(hanes和pluckthun,1997,前面所引用的;he和taussig,1997,前面所引用的;nemoto等人,1997,前面所引用的)或多肽产物与编码dna的连接(参见美国专利第5,856,090号和wo98/37186)来开发呈现系统。
当潜在的结合分子选自文库时,通常采用一种或多种具有规定主结构的选择肽。提供结构、降低肽或允许与结合分子相互作用的带电、极性或疏水性侧链的柔性的氨基酸残基可用于选择肽的主结构的设计。
例如:
(i)脯氨酸可使肽结构稳定,因为其侧链与α碳以及氮结合;
(ii)苯丙氨酸、酪氨酸和色氨酸具有芳香族侧链并且是高度疏水性的,而亮氨酸和异亮氨酸具有脂肪族侧链并且也是疏水性的;
(iii)赖氨酸、精氨酸和组氨酸具有碱性侧链并且在中性ph下带正电荷,而天冬氨酸和谷氨酸具有酸性侧链并且在中性ph下带负电荷;
(iv)天冬酰胺和谷氨酰胺在中性ph下是中性的,但含有可能参与氢键的酰胺基团;
(v)丝氨酸、苏氨酸和酪氨酸侧链含有羟基,其可参与氢键。
通常,结合剂的选择可涉及使用阵列技术和系统以分析与对应于结合分子类型的斑点的结合。
在替代或额外实施例中,一种或多种第一结合剂固定在表面上(例如,在多孔板或阵列上)。
抗体的可变重(vh)和可变轻(vl)区涉及抗原识别,这是由早期蛋白酶消化实验首先发现的事实。通过啮齿动物抗体的“人类化”得到进一步确认。啮齿动物来源的可变区可与人类来源的恒定区融合,使得所得抗体保留啮齿动物亲本抗体的抗原特异性(morrison等人(1984)《美国国家科学院院刊》81,6851-6855)。
抗原特异性由可变区赋予并且与恒定区无关,这从涉及抗体片段的细菌表达的实验中得知,所述抗体片段均含有一个或多个可变区。这些分子包括fab样分子(better等人(1988)《科学》240,1041);fv分子(skerra等人(1988)《科学》240,1038);其中vh和vl配对区通过柔性寡肽连接的单链fv(scfv)分子(bird等人(1988)《科学》242,423;huston等人(1988)《美国国家科学院院刊》85,5879)和包含分离的v区的单区抗体(dab)(ward等人(1989)《自然》341,544)。涉及保留抗体片段特异结合位点的抗体片段的合成的技术的一般性综述可见于winter和milstein(1991)《自然(nature)》349,293-299。
“scfv分子”意指其中vh和vl配对区通过柔性寡肽连接的分子。
使用抗体片段而非全部抗体的优点是多方面的。较小尺寸的片段可引起改善的药理学性质,如更好的实体组织渗透。去除全部抗体的效应子功能,如补体结合。fab、fv、scfv和dab抗体片段都可以在大肠杆菌(e.coli)中表达和分泌,因此允许容易地产生大量的所述片段。
全部抗体和f(ab')2片段是“二价”的。“二价”意指所述抗体和f(ab')2片段具有两个抗原结合位点。与此相反,fab、fv、scfv和dab片段是单价的,仅具有一个抗原结合位点。
抗体可为单克隆抗体或多克隆抗体。可通过已知技术制备合适的单克隆抗体,例如《单克隆抗体:技术手册(monoclonalantibodies:amanualoftechniques)》,hzola(crc出版社,1988)和《单克隆杂交瘤抗体:技术和应用(monoclonalhybridomaantibodies:techniquesandapplications)》,jgrhurrell(cr出版社,1982)中所公开的技术,所述参考文献均通过引用的方式并入本文中。
可选地或另外地,所述第一结合剂包含或由以下组成:抗体或其抗原结合片段。
可选地或另外地,所述抗体或其抗原结合片段是重组抗体或其抗原结合片段。
可选地或另外地,所述抗体或其抗原结合片段选自由以下组成的组:scfv;fab;免疫球蛋白分子的结合区。
可选地或另外地,抗体或抗原结合片段能够与以下竞争以与表a中所指定的生物标志物结合:表8中所定义的所述生物标志物的抗体。
“能够与如本文中所定义的抗体分子(或所述抗体或抗原结合片段的变体、融合体或衍生物,或所述变体或其衍生物的融合体,其保留对所需生物标志物的结合特异性)竞争”以与表a中所指定的生物标志物结合,意指或包括所测试的抗体或抗原结合片段能够至少部分地抑制或以其他方式干扰如本文中所定义的抗体分子的结合。
例如,抗体或抗原结合片段可能能够抑制本文中所定义的抗体分子的至少10%结合,例如至少20%、30%、40%、50%、60%、70%、80%、90%、35%或甚至100%。
可通过本领域技术人员熟知的方法确定竞争性结合,如elisa(如本文中所述)和/或spr(如所附实例中所述)。
可选地或另外地,抗体或抗原结合片段是表8中所定义的抗体或其抗原结合片段或其变体。
可选地或另外地,抗体抗体或抗原结合片段包含表8中所指定的vh和vl区,或其变体。
本发明的抗体或抗原结合片段的“变体”包括守恒或非守恒的插入、缺失和取代。特别地,包括抗体或抗原结合片段的序列的变体,其中此类变量基本上不改变抗体或抗原结合片段的活性。特别地,包括抗体或抗原结合片段的变体,其中此类变化基本上不改变表8中所指定的各生物标志物的结合特异性。
多肽变体可具有氨基酸序列,其与本文中所定义的本发明的抗体或抗原结合片段的氨基酸序列中的一个或多个具有至少70%同一性-例如,与本文中所定义的本发明的抗体或抗原结合片段的氨基酸序列中的一个或多个具有至少75%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性。
可使用合适的计算机程序确定两个多肽之间的序列同一性百分比,例如威斯康星大学遗传计算组(universityofwisconsingeneticcomputinggroup)的gap程序,并且应了解,相对于序列已最佳比对的多肽计算同一性百分比。
或者,可使用clustalw程序进行比对(如thompson等人,1994,《核酸研究(nucl.acidres.)》22:4673-4680中所述,所述参考文献通过引用的方式并入本文中。
所用参数可以如下:
-快速成对比对参数:k-元组(字)大小;1,窗口大小;5,空位罚分(gappenalty);3,顶部对角线数量;5。评分方法:x百分比。
-多重比对参数:空位开放罚分(gapopenpenalty);10,空位扩展罚分(gapextensionpenalty);0.05。
-评分矩阵:blosum。
或者,bestfit程序可用于确定局部序列比对。
抗体可与表8中所定义的抗体中的一种或多种共享cdr(例如,1、2、3、4、5或6)cdr。
可以使用本领域已知的任何合适方法来定义cdr。常用的方法包括paratome(kunik、ashkenazi和ofran,2012,《paratome:一种用于基于序列或结构系统识别抗体中抗原结合区域的在线工具(paratome:anonlinetoolforsystematicidentificationofantigen-bindingregionsinantibodiesbasedonsequenceorstructure)《核酸研究》,40:w521-w524;http://www.ofranlab.org/paratome/)、kabat(wu和kabat,1970,《本琼氏蛋白和骨髓瘤轻链可变区域的序列分析和其对抗体互补性的意义(ananalysisofthesequencesofthevariableregionsofbencejonesproteinsandmyelomalightchainsandtheirimplicationsforantibodycomplementarity)》。《实验医学杂志(j.exp.med.)》,132:211-250)、chothia(chothia和lesk,1987《免疫球蛋白高变区域的典型结构(canonicalstructuresforthehypervariableregionsofimmunoglobulins)》《分子生物学杂志(j.mol.biol.)》,196:901-917;chothia等人,1989《免疫球蛋白高变区域的构象(conformationofimmunoglobulinhypervariableregions)》《自然》,342:877-883)和imgt(lefranc等人,2003《用于免疫球蛋白和t细胞受体可变区及ig超家族v样区的imgt独特编号(imgtuniquenumberingforimmunoglobulinandtcellreceptorvariabledomainsandigsuperfamilyv-likedomains)》《发育与比较免疫学(dev.comp.immunol.)》27:55-77;lefranc等人,2005《用于免疫球蛋白和t细胞受体恒定区及ig超家族c样区的imgt独特编号(imgtuniquenumberingforimmunoglobulinandtcellreceptorconstantdomainsandigsuperfamilyc-likedomains)》《发育与比较免疫学》,29:185-203;http://www.imgt.org)。例如,所用方法可为imgt方法。
可选地或另外地,所述第一结合剂固定在表面上(例如,在多孔板或阵列上)。
可选地或另外地,用可检测部分标记所述测试样本中的所述一种或多种生物标志物。
可选地或另外地,用可检测部分标记所述对照样本中的所述一种或多种生物标志物。
“可检测部分”包括以下含义:所述部分是可被检测的部分,并且可确定所述部分的相对量和/或位置(例如,阵列上的位置)。
合适的可检测部分是本领域熟知的。
因此,可检测部分可为荧光和/或发光和/或化学发光部分,其在暴露于特定条件时可被检测。例如,荧光部分可能需要以特定波长和强度暴露于辐射(即光)以引起荧光部分的激发,从而使所述荧光部分能够在可检测的特定波长下发射可检测荧光。
或者,可检测部分可为酶,其能够将(优选地不可检测)底物转化成可以可视化和/或检测的可检测产物。在下文中关于例如elisa测定更详细地论述合适的酶的实例。
或者,可检测部分可为放射性原子,其可用于成像。合适的放射性原子包括用于闪烁扫描研究的99mtc和123i。其他易于检测的部分包括,例如,用于磁共振成像(magneticresonanceimaging,mri)的自旋标记,如再次的123i、131i、111in、19f、13c、15n、17o、钆、锰或铁。显然,待检测的试剂(例如本文中所述的测试样本和/或对照样本中的一种或多种生物标志物和/或用于检测所选蛋白质的抗体分子)必须具有足够的适合的原子同位素以便使可检测部分易于检测。
可按已知的方式将放射性标记或其他标记并入本发明的试剂(即本发明的方法的样本和/或本发明的结合剂中存在的蛋白质)中。例如,如果结合部分是多肽,则其可为生物合成的,或可为通过化学氨基酸合成使用合适的氨基酸前体合成的,所述氨基酸前体涉及例如氟-19代替氢。例如,如99mtc、123i、186rh、188rh和111in的标记可以通过结合部分中的半胱氨酸残基附接。钇-90可以通过赖氨酸残基附接。iodogen方法(fraker等人(1978),《生物化学、生物物理学研究通讯(biochem.biophys.res.comm.)》80,49-57)可以用于并入123i。参考文献(《免疫闪烁扫描中的单克隆抗体(monoclonalantibodiesinimmunoscintigraphy)》),j-fchatal,crc出版社,1989)详细描述其他方法。使其他可检测部分(如酶促、荧光、发光、化学发光或放射性部分)与蛋白质结合的方法是本领域熟知的。
优选地,用可检测部分标记所述对照样本中的所述一种或多种生物标志物。可检测部分可选自由以下组成的组:荧光部分;发光部分;化学发光部分;放射性部分;酶促部分。然而,优选所述可检测部分是生物素。
可选地或另外地,所述可检测部分选自由以下组成的组:荧光部分;发光部分;化学发光部分;放射性部分;酶促部分。
可选地或另外地,所述可检测部分是生物素。
可选地或另外地,使用包含能够与所述一种或多种生物标志物结合的第二结合剂的测定进行步骤(b)、(d)和/或步骤(f),所述第二结合剂包含可检测部分。
可选地或另外地,所述第二结合剂包含或由以下组成:抗体或其抗原结合片段。
可选地或另外地,所述抗体或其抗原结合片段是重组抗体或其抗原结合片段。
可选地或另外地,所述抗体或其抗原结合片段选自由以下组成的组:scfv;fab;免疫球蛋白分子的结合区。
可选地或另外地,所述可检测部分选自由以下组成的组:荧光部分;发光部分;化学发光部分;放射性部分;酶促部分。
可选地或另外地,所述可检测部分是荧光部分(例如alexafluor染料,例如alexa647)。
可选地或另外地,检测方法包含或由以下组成:elisa(酶联免疫吸附剂测定)。
用于检测血清或血浆蛋白的优选测定包括酶联免疫吸附剂测定(elisa)、放射免疫测定(ria)、免疫辐射测量测定(irma)和免疫酶促测定(iema),包括使用单克隆和/或多克隆抗体的夹心测定。示例性夹心测定由david等人描述于美国专利第4,376,110号和第4,486,530号中,其通过引用的方式并入本文中。载玻片上细胞的抗体染色可用于细胞学实验室诊断测试中熟知的(如本领域技术人员熟知的)方法中。
通常,这些测定是elisa(酶联免疫吸附剂测定),其通常涉及通常在固相测定中使用产生有色反应产物的酶。已广泛采用如辣根过氧化物酶和磷酸酶的酶。扩增磷酸酶反应的一种方式是使用nadp作为底物以产生nad,其现充当第二酶系统的辅酶。来自大肠杆菌的焦磷酸酶提供良好的结合物,因为所述酶不存在于组织中、是稳定的并产生良好的反应颜色。也可以使用基于酶如荧光素酶的化学发光系统。
elisa方法是本领域熟知的,例如参见《elisa指南(分子生物学中的方法)(theelisaguidebook(methodsinmolecularbiology))》,2000,crowther,humanapress,isbn-13:978-0896037281(其公开内容通过引用的方式并入)。
经常使用与维生素生物素的结合,因为这可以通过其与酶联抗生物素蛋白或链霉抗生物素蛋白的反应而容易地被检测,其以巨大的特异性和亲和力与所述维生素生物素结合。
可选地或另外地,使用阵列进行步骤(b)、(d)和/或步骤(f)。
阵列本身是本领域熟知的。通常,其由线性或二维结构形成,所述线性或二维结构具有间隔开的(即离散的)区域(“斑点”),每个区域具有有限面积,形成在固体支持物的表面上。阵列也可以是珠粒结构,其中每个珠粒可以通过分子代码或颜色代码识别或以连续流动识别。还可以顺序进行分析,其中样本通过一系列斑点,每个斑点从溶液中吸附一类分子。固体支持物通常是玻璃或聚合物,最常用的聚合物是纤维素、聚丙烯酰胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。固体支持物可呈以下形式:管状物、珠粒、盘状物、硅片、微孔板、聚偏二氟乙烯(pvdf)膜、硝化纤维素膜、尼龙膜、其他多孔膜、无孔膜(尤其例如塑料、聚合物、有机玻璃、硅)、多个聚合物针或多个微量滴定孔,或任何其他适用于固定蛋白质、多核苷酸和其他合适分子和/或进行免疫测定的表面。结合过程是本领域熟知的,并且通常由交联共价结合或物理吸附蛋白质分子、多核苷酸等至固体支持物组成。通过使用熟知的技术,如接触或非接触印刷、掩模或光刻,可以定义每个斑点的位置。关于综述参见jenkins,r.e.,pennington,s.r.(2001,《蛋白质组学(proteomics)》,2,13-29)和lal等人(2002,《当代药物研究(drugdiscovtoday)》15;7(增刊18):s143-9)。
通常,阵列是微阵列。“微阵列”包括离散区域密度至少约100/cm2且优选地至少约1000/cm2的区域阵列的含义。微阵列中的区域具有典型尺寸,例如,直径在约10-250μm之间的范围内,并且以大约相同的距离与阵列中的其他区域分隔。阵列也可为宏阵列或纳米阵列。
一旦识别和分离了合适的结合分子(如上所论述),技术人员可以使用分子生物学领域中熟知的方法制造阵列。
可选地或另外地,所述阵列是基于珠粒的阵列。
可选地或另外地,所述阵列是基于表面的阵列。
可选地或另外地,所述阵列选自由以下组成的组:宏阵列;微阵列;纳米阵列。
可选地或另外地,所述方法包含:
(i)用生物素标记所述样本中存在的生物标志物;
(ii)使经生物素标记的蛋白质与包含多个scfv的阵列接触,所述scfv固定在其表面上的不连续位置,所述scfv对表a中的蛋白质中的一种或多种具有特异性;
(iii)使固定的scfv与包含荧光染料的链霉抗生物素蛋白结合物接触;以及
(iv)检测阵列表面上离散位置处所述染料的存在
其中所述染料在阵列表面上的表达指示所述样本中来自表iii的生物标志物的表达。
可选地或另外地,步骤(b)、(d)和/或(f)包含测量编码所述一种或多种生物标志物的核酸分子的表达。
可选地或另外地,所述核酸分子是cdna分子或mrna分子。
可选地或另外地,所述核酸分子是mrna分子。
可选地或另外地,使用选自由以下组成的组的方法进行步骤(b)、(d)和/或(f)中所述一种或多种生物标志物的表达的测量:南方杂交(southernhybridisation)、北方杂交(northernhybridisation)、聚合酶链反应(polymerasechainreaction,pcr)、逆转录酶pcr(rt-pcr)、定量实时pcr(qrt-pcr)、纳米阵列、微阵列、宏阵列、自动射线照相术和原位杂交。
可选地或另外地,使用dna微阵列确定步骤(b)中所述一种或多种生物标志物的表达的测量。
可选地或另外地,使用一个或多个结合部分进行步骤(b)、(d)和/或(f)中所述一种或多种生物标志物的表达的测量,所述结合部分能够各自独立地选择性地与编码表a中所确定的所述生物标志物之一的核酸分子结合。
可选地或另外地,所述一个或多个结合部分各自包含或由核酸分子组成。
可选地或另外地,所述一个或多个结合部分各自包含或由以下组成:dna、rna、pna、lna、gna、tna或pmo。
可选地或另外地,所述一个或多个结合部分各自包含或由dna组成。
可选地或另外地,所述一个或多个结合部分的长度为5至100个核苷酸。
可选地或另外地,一个或多个核酸分子的长度为15至35个核苷酸。
可选地或另外地,结合部分包含可检测部分。
可选地或另外地,所述可检测部分选自由以下组成的组:荧光部分;发光部分;化学发光部分;放射性部分(例如,放射性原子);或酶促部分。
可选地或另外地,所述可检测部分包含或由放射性原子组成。
可选地或另外地,所述放射性原子选自由以下组成的组:锝-99m、碘-123、碘-125、碘-131、铟-111、氟-19、碳-13、氮-15、氧-17、磷-32、硫-35、氘、氚、铼-186、铼-188和钇-90。
可选地或另外地,所述结合部分的所述可检测部分是荧光部分。
可选地或另外地,步骤(a)、(c)和/或(e)中所提供的所述样本选自由以下组成的组:未分级的血液、血浆、血清、组织液、胰腺组织、乳汁、胆汁和尿液。
可选地或另外地,步骤(a)、(c)和/或(e)中所提供的所述样本选自由未分级的血液、血浆和血清组成的组。
可选地或另外地,步骤(a)、(c)和/或(e)中所提供的所述样本是血清。
可选地或另外地,如通过rocauc值所确定的,所述方法的预测准确度为至少0.50,例如至少0.55、0.60、0.65、0.70、0.75、0.80、0.85、0.90、0.95、0.96、0.97、0.98或至少0.99。
可选地或另外地,如通过rocauc值所确定的,所述方法的预测准确度为至少0.70。
通常,使用支持向量机(svm)进行诊断,如可从http://cran.r-project.org/web/packages/e1071/index.html获得的那些(例如e10711.5-24)。然而,也可使用任何其他合适的手段。
支持向量机(svm)是一组用于分类和回归的相关监督学习方法。给定一组训练实例,每个实例标记为属于两个类别之一,svm训练算法构建模型,所述模型预测新实例是否落入一个类别或另一个类别之中。直观地,svm模型将实例表示为空间中的点,映射使得单独类别的实例除以尽可能宽的明显空位。然后将新实例映射到同一空间,并基于所述新实例落入的空位的一侧预测属于一个类别。
更正式地,支持向量机在高维或无限维空间中构造超平面或超平面集,其可以用于分类、回归或其他任务。直观地,通过与最近的任何类型训练数据点具有最大距离(所谓的功能容限)的超平面来实现良好的分离,因为通常容限越大,分类器的泛化误差越低。有关svm的更多信息,参阅例如burges,1998,《数据挖掘和知识发现(dataminingandknowledgediscovery)》,2:121-167。
在本发明的替代或额外实施例中,在进行本发明的方法之前使用来自患有已知疾病状态的个体(例如,已知患有胰腺癌的个体、已知患有急性胰腺炎的个体、已知患有慢性胰腺炎的个体或已知健康的个体)的生物标志物谱来“训练”svm。通过运行此类训练样本,svm能够了解哪些生物标志物谱与胰腺癌相关。一旦训练过程完成,svm就能够了解所测试的生物标志物样本是否来自患有胰腺癌的个体。
但是,可以通过利用必要的训练参数对svm进行预编程来绕过这种训练程序。例如,可以基于任何或所有表a中所列出的生物标志物的测量值,使用表5中详述的svm算法,根据已知的svm参数进行诊断。
技术人员将了解,可以通过利用适合的数据(即来自患有已知胰腺癌状态的个体的生物标志物测量值)选择训练svm机,来确定针对表a中所列出的生物标志物的任何组合的合适的svm参数。或者,可根据本领域已知的任何其他合适的统计方法使用实例和图示的数据来确定特定的胰腺癌相关疾病状态。
优选地,本发明的方法的准确度为至少60%,例如61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%准确度。
优选地,本发明的方法的灵敏度为至少60%,例如61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%灵敏度。
优选地,本发明的方法的特异性为至少60%,例如61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%特异性。
“准确度”意指方法的正确结果的比例,“灵敏度”意指被正确分类为阳性的所有pac阳性样本的比例,并且“特异性”意指被正确分类为阴性的所有pac阴性样本的比例。
可使用技术人员已知的任何合适的手段来量化信号强度。可选地或另外地,使用scanarrayexpress软件版本4.0量化信号强度。可对信号强度数据进行归一化(即调整技术变量)。可使用技术人员已知的任何合适的方法进行归一化。可选地或另外地,使用经验贝叶斯(bayes)算法combat(johnson等人,2007)对数据进行归一化。
可选地或另外地,被测试的个体是基因型路易斯a-b-。
所测试的个体可为任何种族。可选地或另外地,所测试的个体是高加索人(caucasian)和/或中国人(例如,汉族人)。
可选地或另外地,步骤(a)、(c)和/或(e)中所提供的样本在胰腺癌治疗(例如,切除、化疗、放疗)之前提供。
可选地或另外地,被测试的个体患有选自由慢性胰腺炎、遗传性胰腺导管腺癌和珀茨-杰格斯(peutz-jeghers)综合征组成的组的一种或多种病症。
在替代或额外实施例中,胰腺癌选自由以下组成的组:腺癌、腺鳞状上皮癌、印戒细胞癌、肝样癌、胶样癌、未分化癌和具有破骨细胞样巨细胞的未分化癌。优选地,胰腺癌是胰腺腺癌。更优选地,胰腺癌是胰腺导管腺癌,也称作外分泌胰腺癌。
可选地或另外地,所述方法包含确定本发明的胰腺癌相关疾病状态的存在或不存在的主动步骤。
可选地或另外地,在所述个体被诊断出患有胰腺癌的情况下,所述方法包含以下步骤:
(g)为所述个体提供胰腺癌治疗。
因此,本发明的相关方面提供治疗患有胰腺癌的个体的方法,其包含以下步骤:
(a)使用根据本发明的第一方面的方法诊断个体患有胰腺癌;以及
(b)治疗被诊断出患有胰腺癌的个体(例如,参见thota等人,2014,《肿瘤学(oncology)》28(1):70-4,其公开内容通过引用的方式并入本文中)。
可选地或另外地,胰腺癌治疗选自由手术、化疗、免疫治疗、化学免疫治疗和热化疗组成的组。
在替代或额外实施例中,胰腺癌治疗选自由以下组成的组:手术、化疗、免疫治疗、化学免疫治疗和热化疗(例如,ac化疗;卡培他滨(capecitabine)和多西紫杉醇(docetaxel)化疗
因此,本发明包含用于治疗胰腺癌的抗肿瘤剂,其中基于本发明的第一方面的方法的结果确定剂量方案。
本发明包含抗肿瘤剂在治疗胰腺癌中的用途,其中基于本发明的第一方面的方法的结果确定剂量方案。
本发明包含抗肿瘤剂在制备用于治疗胰腺癌的药物中的用途,其中基于本发明的第一方面的方法的结果确定剂量方案。
本发明包含治疗胰腺癌的方法,其包含提供足量的抗肿瘤剂,其中基于本发明的第一方面的方法的结果确定足以治疗胰腺癌的抗肿瘤剂的量。
在一个实施例中,抗肿瘤剂包含或由以下组成:烷基化剂(atc代码l01a)、抗代谢物(atc代码l01b)、植物碱或其他天然产物(atc代码l01c)、细胞毒性抗生素或相关物质(atc代码l01d),或另一种抗肿瘤剂(atc代码l01x)。
因此,在一个实施例中,抗肿瘤剂包含或由选自由以下组成的组的烷基化剂组成:氮芥类似物(例如环磷酰胺、苯丁酸氮芥、美法仑、甲川氯、异环磷酰胺、曲磷胺、泼尼莫司汀(prednimustine)或苯达莫司汀),烷基磺酸盐(例如白消安、曲奥舒凡或甘露舒凡),次乙亚胺(例如噻替派、三亚胺醌或卡波醌),亚硝基脲(例如卡莫司汀、洛莫司汀、司莫司汀、链脲霉素、福莫司汀、尼莫司汀或雷莫司汀),环氧化物(例如依托格鲁),或另一种烷基化剂(atc代码l01ax,例如二溴甘露醇、哌泊溴烷、替莫唑胺(temozolomide)或达卡巴嗪(dacarbazine)。
在另一个实施例中,抗肿瘤剂包含或由选自由以下组成的组的抗代谢物组成:叶酸类似物(例如甲氨蝶呤、雷替曲塞、培美曲塞或普拉曲沙),嘌呤类似物(例如巯嘌呤、硫鸟嘌呤、克拉屈滨,氟达拉滨,氯法拉滨,或奈拉滨(nelarabine))或嘧啶类似物(例如阿糖胞苷、氟尿嘧啶(5-fu)、喃氟啶、卡莫氟、吉西他滨、卡培他滨、阿扎胞苷或地西他滨)。
在再一实施例中,抗肿瘤剂包含或由选自由以下组成的组的植物碱或其他天然产物组成:长春花属生物碱或长春花属生物碱类似物(例如长春碱、长春新碱、长春地辛、长春瑞滨或长春氟宁),鬼臼毒素衍生物(例如依托泊苷或替尼泊苷),秋水仙碱衍生物(例如秋水仙碱(demecolcine)),紫杉烷(例如太平洋紫杉醇、多西紫杉醇或聚谷氨酸紫杉醇(paclitaxelpoliglumex))或另一种植物碱或天然产物(atc编码l01cx,例如曲贝替定(trabectedin))。
在一个实施例中,抗肿瘤剂包含或由选自由以下组成的组的细胞毒性抗生素或相关物质组成:放线菌素(例如放线菌素d),蒽环霉素或相关物质(例如阿霉素、柔红霉素、表柔比星、阿克拉霉素、左柔比星、艾达霉素、米托蒽醌、吡柔比星、戊柔比星、氨柔比星或派蒽醌(pixantrone))或另一种(atc编码l01dc,例如博来霉素、普卡霉素、丝裂霉素或伊沙匹隆)。
在又一实施例中,抗肿瘤剂包含或由选自由以下组成的组的另一种抗肿瘤剂组成:铂化合物(例如顺铂、卡铂、奥克赛铂(oxaliplatin)、赛特铂(satraplatin)或聚铂(polyplatillen)),甲基肼(例如丙卡巴肼),单克隆抗体(例如依决洛单抗(edrecolomab)、利妥昔单抗、曲妥珠单抗、阿仑单抗、吉妥珠单抗、西妥昔单抗、贝伐单抗、帕尼单抗、卡托莫西单抗(catumaxomab)或奥法木单抗(ofatumumab)),用于光动力/放疗的敏化剂(例如卟吩姆钠、氨基乙酰丙酸甲酯、氨基乙酰丙酸、替莫泊芬(temoporfin)或乙丙昔罗(efaproxiral))或蛋白激酶抑制剂(例如伊马替尼、吉非替尼、厄洛替尼、舒尼替尼、索拉非尼、达沙替尼、拉帕替尼、尼罗替尼、坦西莫司、依维莫司、帕唑帕尼、凡德他尼、阿法替尼、马赛替尼或托赛拉尼(toceranib))。
在再一实施例中,抗肿瘤剂包含或由选自由以下组成的组的另一种肿瘤剂组成:安吖啶、天冬酰胺酶、六甲蜜胺、羟基脲、氯尼达明、喷司他汀、米替福新、马索罗酚、雌氮芥、维甲酸、丙脒腙、拓朴替康、噻唑呋林、伊立替康(开普拓(camptosar))、亚利崔托宁、米托坦、培门冬酶、贝瑟罗汀、三氧化二砷地尼白介素、硼替佐米、塞内昔布、阿那格雷、奥利默森、塞西马集(sitimageneceradenovec)、伏立诺他、罗米地辛、高三尖杉酯(omacetaxinemepesuccinate)、艾日布林或亚叶酸。
在一个实施例中,抗肿瘤剂包含或由一种或多种抗肿瘤剂(例如本文所定义的一种或多种抗肿瘤剂)的组合组成。用于治疗胰腺癌的联合治疗的一个实例是folfirinox,其由以下四种药物构成:
·fol-亚叶酸(甲酰四氢叶酸);
·f-氟尿嘧啶(5-fu);
·irin-伊立替康(开普拓);以及
·ox-奥克赛铂(奥沙利铂(eloxatin))。
因此,本发明的第二方面提供用于诊断或确定个体中胰腺癌相关疾病状态的阵列,其包含一种或多种如本发明的第一方面中所定义的结合剂。
可选地或另外地,所述一种或多种结合剂能够与表a中所定义的所有蛋白质结合。
本发明的第三方面提供选自表a中所定义的组的一种或多种生物标志物作为确定个体中胰腺癌相关疾病状态的生物标志物的用途。
可选地或另外地,表a中所定义的所有蛋白质用作确定个体中胰腺癌相关疾病状态的标志物。
本发明的第四方面提供如本发明的第一方面中所定义的一个或多个结合部分确定个体中胰腺癌相关疾病状态的用途。
可选地或另外地,使用表a中所定义的所有蛋白质的生物标志物。
本发明的第五方面提供用于诊断或确定个体中胰腺癌相关疾病状态的试剂盒,其包含:
(a)如本发明的第一方面中所定义的一种或多种结合剂或根据本发明的第二方面的阵列;
(b)用于进行如上文中(例如,在本发明的第一方面中)所定义的方法的说明书。
本发明的第六方面提供一种治疗个体中胰腺癌的方法,其包含以下步骤:
(a)根据本发明的第一方面任何中所定义的方法确定胰腺癌相关疾病状态;以及
(b)为所述个体提供胰腺癌治疗。
可选地或另外地,所述胰腺癌治疗选自由手术(例如,切除)、化疗、免疫治疗、化学免疫治疗和热化疗组成的组。
本发明的第八方面提供用于操作本发明方法的计算机程序,例如,用于解释步骤(c)的表达数据(和随后的表达测量步骤),并且从而诊断或确定胰腺癌相关疾病状态。计算机程序可为经编程的svm。计算机程序可记录在本领域技术人员已知的合适的计算机可读载体上。合适的计算机可读载体可包括压缩盘(包括cd-rom、dvd、蓝光等)、软盘、闪存驱动器、rom或硬盘驱动器。计算机程序可安装在适合于执行计算机程序的计算机上。
现在将参考以下表格和图示描述体现本发明的某些方面的优选的非限制性实例:
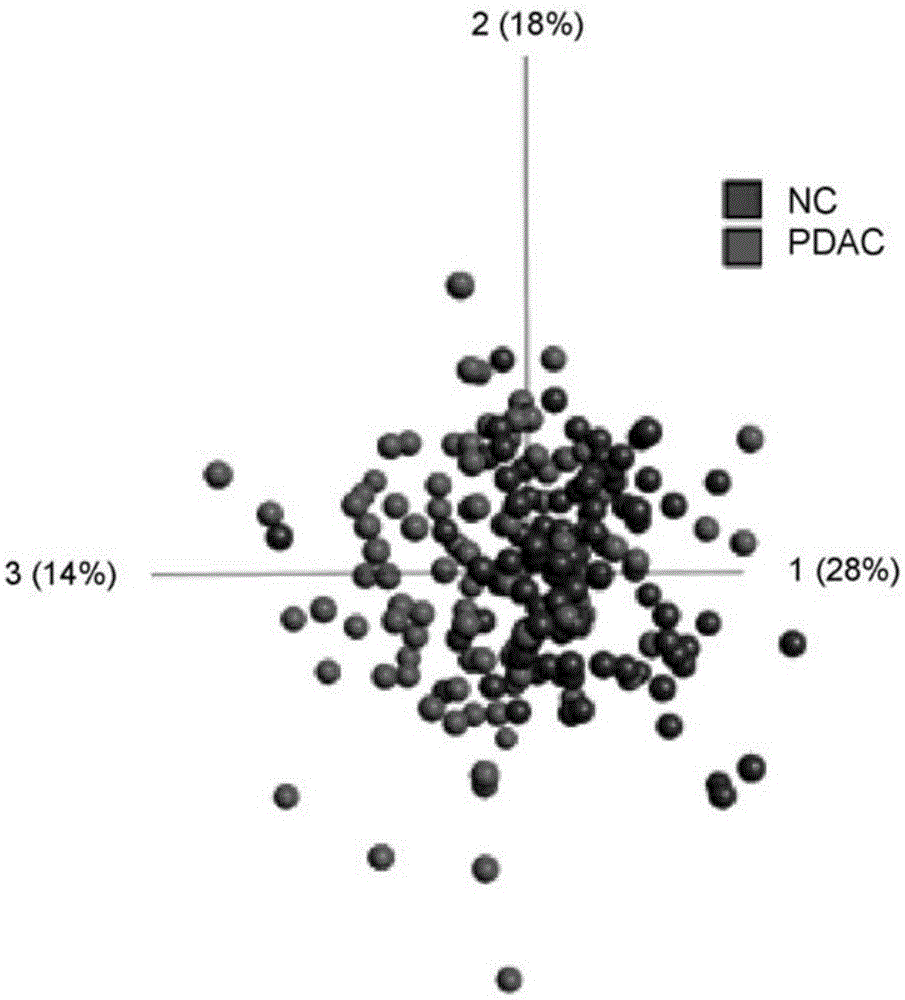
图1胰腺癌(pdac)相对于正常对照(normalcontrol,nc)的区别。
(a)pdac(灰色)和nc(黑色)的主组分分析(principalcomponentanalysis,pca)。使用anova将数据过滤至q<0.1;(b)在与a)中的pca绘制同步的pca绘制中,对应于过滤后剩余的11种抗体的相对蛋白质水平。灰色=上调水平,黑色=pdac相对于nc的下调水平;(c)来自支持向量机分析(svm)的auc为0.88的roc曲线,其中pdac相对于nc的留一法(loo)交叉验证基于未过滤数据(使用来自所有抗体的未过滤数据)。
图2针对pdac识别血浆蛋白特征。
通过从每组(pdac和nc)中随机选择2/3的样本到训练集中,并将剩余的1/3样本送至测试集中,生成训练集和测试集。训练集用于定义用于区分pdac和nc的压缩特征。(a)通过基于svm的逐步后向消除训练集中的抗体来进行变量过滤。在每个迭代步骤中,确定并绘制分类的kullback-liebler(k-l)误差。当分类误差达到其最小值时,在消除过程中剩余的抗体用作在训练集中构建新模型的独特特征;(b)从来自训练集的特征模型得到的roc曲线,“冻结”并直接应用到先前未见过的测试集样本上;(c)在10组不同的随机创建的训练集和测试集中重复此程序共10次。绘制由每个相应测试组中的冷冻生物标志物特征模型产生的roc曲线下的面积(auc值);(d)将从后向消除(backwardelimination,be)过程中的总排名得出的抗体得分(空心圆)与基于t-测试(w)测试等级的得分(实心圆)进行比较。
图3pdac阶段相对于对照的区别。
a)来自使用未过滤数据(所有抗体)的svm分析的auc值,将nc与根据患者pdac阶段分组的患者进行比较。b)在一个或多个pdac阶段相对于nc中威尔科克森p<0.05的抗体。“up”=pdac相对于nc中的上调,“down”=pdac相对于nc中的下调,白色=无显著差异。
图4.原发肿瘤位置的区别和与先前在血清中的研究的比较(gerdtsson,2015)。
来自在西班牙5个不同地点征集的156名pdac患者的血清用于pankrasii[parker等人,2011,porta等人,1999]研究(gerdtsson等人,2016,《分子肿瘤学(moloncol.)》10(8):1305-16)。
“up”=在头肿瘤相对于体肿瘤/尾肿瘤中上调,“down”=在头肿瘤相对于体肿瘤/尾肿瘤中下调,n/a=未包括在研究中的抗体。
图5.与先前的群组的比较。
a)被比较的三项研究的细节。b)从在以下中被分析的重叠标志物得出的文氏(venn)图:(i)iii-iv期pdac相比于对照的高加索人群组,(ii)慢性胰腺炎患者相比于对照,以及(iii)当前阶段pdac相对于对照的中国人群组。出于比较的原因,目前的群组中仅包括iii+iv期样本。数字表示显著(威尔科克森p<0.05)差异表达的标志物。[1]wingrenc,sandstroma,segersvardr,carlssona,anderssonr,lohrm,borrebaeckca,《识别与胰腺癌相关的血清生物标志物特征(identificationofserumbiomarkersignaturesassociatedwithpancreaticcancer)》,《癌症研究(cancerres.)》2012;72:2481-90;[2]《使用重组抗体微阵列的胰腺炎的血清蛋白质组谱揭示疾病相关的生物标志物特征(serumproteomeprofilingofpancreatitisusingrecombinantantibodymicroarraysrevealsdisease-associatedbiomarkersignatures)》,《蛋白质组学临床应用(proteomicsclinappl.)》2012;6:486-96。
实例
摘要
在本研究中,使用重组抗体微阵列平台来分析来自胰腺癌患者和正常对照个体的213个血浆样本。根据疾病阶段即可切除的疾病(i/ii期)、局部晚期(iii期)和转移性疾病(iv期)对所述群组进行分层。svm分析显示,所有pdac阶段都可以与对照区分开来。这是第一次患有i/ii期pdac肿瘤的患者可以基于血浆蛋白特征高精度地与对照区分开来,这指示早期诊断的可能性和手术可切除肿瘤的增加率。
引论
胰腺导管腺癌(pdac)是最致命的癌症之一,有3-4%的5年生存率。这种预后不良背后的关键驱动因素是目前无法在早期诊断患者。数据支持从肿瘤起始直到取得转移能力需要五年多的时间(yachida等人,2010),这清楚地证明如果可利用准确的标志物,就有机会及早检测到。在诊断时,患者常已发展到疾病晚期,并且只有约15%的患者具有可切除肿瘤(conlon等人,1996;sohn等人,2000)。呈现出大的切除肿瘤的这些患者的5年生存率仅为10-20%(conlon等人,1996;sohn等人,2000)。然而,如果肿瘤≤20mm(i-ii期)可以被切除,则5年生存率提高到30-60%(furukawa等人,1996;shimizu等人,2005)。晚期诊断(iii-iv期)是由于非特异性临床症状以及缺乏早期诊断标志物,这一点在本研究中得以解决。有趣的是,研究表明胰腺肿瘤可以早在临床诊断前六个月在无症状阶段切除(gangi等人,2004;pelaez-luna等人,2007)。
迄今为止评估最多的pdac标志物ca19-9具有不良特异性,在其他几种适应症中水平升高,以及在基因型路易斯a-b-(5%人群)的患者中完全缺失。因此,不建议将ca19-9用于胰腺癌筛查(locker等人,2006)。如今,虽然最近的发现研究已证明外泌体和核小体均含有与胰腺癌相关的信息,但还没有其他单一的生物标志物能准确地诊断pdac(bauden等人,2015;melo等人,2015)。然而,如今的癌症诊断领域正朝着标志物小组移动,因为这产生增加的灵敏度和特异性(brand等人,2011;bunger等人,2011)。
炎症似乎是肿瘤进展的关键组成部分(coussens和werb,2002)并且免疫调节血浆蛋白质组可能因此是潜在癌症生物标志物的来源。
先前的研究也已证明,增加的免疫调节蛋白数(n=20-25)将产生高度疾病特异性特征,反映了对疾病的全身反应(carlsson等人,2011b;ingvarsson等人,2008;wingren等人,2012)。然而,免疫调节蛋白质组的分析与数个挑战相关,如(i)血浆蛋白呈现出巨大的动态浓度范围;(ⅱ)癌症标志物更可能在最低丰度蛋白质中发现(haab等人,2005;surinova等人,2011);(iii)预期低丰度标志物的血浆水平的疾病相关变化是小的,需要相当大数目的样本以充分统计(alonzo等人,2002)。
为了应对这些挑战,我们在本研究中使用灵敏的抗体微阵列平台分析了来自患有i-iv期胰腺癌的中国患者和正常对照的213份血浆样本。目的是通过将对照样本与i-iv期进行比较来识别与阶段相关的pdac标志物,并且结果支持单一血液样本中的信息含量足以发现甚至更早期的疾病阶段的概念。因此,使得能够早期诊断pdac,特别是对于高风险患者如慢性胰腺炎、遗传性pdac和珀茨-杰格斯综合征患者的益处而言。
材料和方法
血浆样本
本回顾性研究经天津医科大学肿瘤研究所和医院伦理委员会(tmucih)批准。知情同意后,在tmucih征集血液,分离血浆并储存在-80℃下。使用从2012年1月01日至2013年12月13日征集的总共213个血浆样本(表1)。登记的pdac患者(n=118)均为中国汉族人,并在tmucih接受治疗。没有患者在抽血时接受过化疗或放疗。所有pdac样本均由经验丰富的病理学家进行细胞学确认。患者被诊断出患有胰腺导管腺癌,但以下情况除外:恶性浆液状囊腺瘤(n=1)、胰腺肉瘤(n=2)、管状乳头状胰腺腺癌(n=1)。五例患者被诊断出患有pdac伴肝转移。诊断时肿瘤阶段和大小以及肿瘤在胰腺内的位置的数据基于临床病理学。根据美国癌症协会(americancancersociety)的指南进行分期(表1),并将切除程度分类为r0。从在tmucih进行常规体检的天津健康居民中征集正常对照(nc)样本(n=95),并且与pdac患者基因上无关(表1)。在标记时将样本id重新编码和随机化,并且所有后阶段实验程序的操作者对样本注释和临床数据不知情。使用先前优化的方案(wingren等人,2012)在一个单一场合下标记所有样本。
抗体微阵列的产生
所述抗体微阵列含有350种人体重组scfv抗体,从内部设计的噬菌体呈现抗体文库中选择和产生,如先前已描述的在大肠杆菌中生产(pauly等人,2014)且以14列/载玻片和3个重复斑点/阵列印刷到载玻片上。用于本研究的所有载玻片均在单一场合下印刷,运往中国的tmucih,并在印刷后4周内用于分析。
抗体微阵列分析
运用随机抽样每天处理十个载玻片(140个单独子阵列)。简而言之,将阵列用pbsmt阻断,用pbst洗涤,并与生物素化的血浆样本一起在rt(室温)下孵育2小时。洗掉未结合的蛋白质,并使用1μg/mlalexafluor647-链霉抗生物素蛋白检测结合的蛋白质(rt下1小时)。洗掉过量的试剂,并将载玻片干燥并立即在luxscan10k微阵列扫描仪(博奥生物(capitalbio))中以10μm分辨率使用635nm和532nm激发激光扫描。
数据采集、质量控制和预处理
由对患者id和临床数据不知情的两名经训练的分析员(asg和mn)使用具有固定循环选项的scanarrayexpress软件4.0版(珀金埃尔默生命和分析科学(perkinelmerlifeandanalyticalsciences))来量化信号强度。对于每个微阵列,网格是使用来自微阵列印刷的alexafluor555信号而被定位的,并用于量化对应于结合的蛋白质的相对水平的alexafluor647信号。由于高背景和/或低整体信号造成的差质量图像,因此未对十一个样本(10个pdac,1个nc)进行量化。对于经量化的阵列,评估每个斑点的斑点饱和度、平均强度和信噪比。排除十四个抗体,因为(i)中位信号强度低于截止限值,定义为背景(平均pbs信号)+2标准偏差(n=8),(ii)在超过50%的样本(n=1)中最低扫描仪强度设置中有饱和信号,以及(iii)抗体印刷不充分(n=5)。基于剩余的202个样本和336种抗体,在局部背景减除后使用平均斑点强度组合数据集。每个数据点代表3个重复斑点的平均值,除非任何复点cv超过所述平均值的15%,在这种情况下将此复点丢弃并替代地使用2个剩余的复点的平均值。复点的平均cv为7.9%(±4.1%)。应用15%的截止cv,从所有3个复点计算79%的数据值且从2个复点计算剩余的21%。此外,将患有黄疸的患者(n=27)与未患黄疸的患者(n=81)进行比较,以分析胆红素水平是否是抗体微阵列分析中的混杂因素。同样,生成性别调整数据集,以评估性别是否是混杂因素。使用经验贝叶斯算法combat(johnson等人,2007)对所记录的数据进行归一化,以调整技术变量,随后对来自每个阵列的数据进行线性缩放以调整样本背景水平的变量。缩放因子基于所有样本中具有最低标准偏差的抗体的20%,并通过将每个阵列上的这些抗体的强度总和除以所有阵列的平均总和来计算(carlsson等人,2008;ingvarsson等人,2008)。
数据分析
使用基于主组分分析的程序(qlucore、lund、sweden)分析和可视化样本和可变分布。将anova应用于初始数据过滤。使用威尔科克森或学生t-检验、benjaminihochberg程序评估单独标志物的表现以进行错误发现率控制和倍数变化。使用支持向量机(svm)应用其中约束成本设置为1的线性核(linearkernel),评估不同亚组的分离。使用留一法交叉验证程序创建用于区分两个组的模型。
为了最小化过度诠释并证明数据集的稳健性,将所述数据集随机划分到训练集和测试集中,并将基于svm的后向消除算法应用于训练集中。因此,在数据的训练集(由来自每个亚组的总样本的2/3组成)中产生生物标志物特征,并且其在含有剩余1/3样本的测试集中被评估。在训练集中,如先前所述,使用基于svm的后向消除算法进行过滤(carlsson等人,2011a)并在相应的测试集中对基于所得抗体特征的模型进行测试。出于此目的,使用十对不同的训练集和测试集,得到共识列表,其中给予每种抗体对应于其在10个训练集中的中位消除顺序的消除得分。使用接收者操作特征(receiveroperatingcharacteristic,roc)曲线评估性能并报告为曲线下面积(auc)值。记录每个特征在其各自测试集中的灵敏度和特异性、阳性和阴性预测值,以用于对应于灵敏度和特异性的最大总和的svm判决值阈值。
结果
病例与对照之间的区别以及与胰腺癌相关的血浆蛋白特征的识别
初始地,我们展示可以使用pca、q值过滤和利用留一法交叉验证的svm分析,将pdac病例与正常对照区分开来。主组分分析揭示pdac和nc样本的适中分离(图1a)并且截止q值为0.1的差异分析导致11种抗体在pdac相比于nc中呈现出显著不同的表达水平(图1b)。所述抗体中的三个靶向载脂蛋白a1(apo-a1),并且相比于nc,pdac中显示出降低的蛋白质水平。备解素、c1q、c3、igm和il-8在pdac中也显示出降低的水平,而vegf、mapk-8和chp-1在癌症组中升高。此外,具有使用来自所有336种抗体的数据的留一法交叉验证的svm证明,分离pdac与nc的auc值为0.88(p值=6.4x10-21,图1c)。值得注意的是,患有黄疸的患者不能显著地与未患黄疸的患者区分,证明胆红素血不是混杂因素(数据未显示)。经性别调整的数据集中的显著(威尔科克森p<0.05)标志物的比较显示,性别均不是混杂因素(表4)。
使用未过滤数据(auc0.88)pdac与nc之间的高水平区别促使深入数据过滤以识别压缩的pdac相关蛋白质特征。为了避免将模型过度拟合到数据,首先将样本分成训练集以产生抗体特征模型,然后在不同的测试集上评估所述抗体特征模型。在训练集中,使用基于svm的后向消除来过滤抗体,并且将分类中的kullback-leibler(kl)误差相对于经消除的抗体的数目作图。图2a说明第一训练集中的消除过程,其中在313次迭代后观察到明显的最小误差,对应于最终的24种抗体特征。基于所述特征,在训练集中构建svm模型,并在单独的测试集中评估所述模型,其中所述模型产生0.87的auc值(图2b)。为了测试数据集的稳健性,在总共10对不同的随机产生的训练集和测试集中重复所述消除程序,其在术语上产生了10种特征,所述特征被确定为癌症相比于对照的最佳分离。特征的长度在17-29个抗体(中位数23.5)范围内。测试集中的auc值在0.77-0.87范围内,其中平均值为0.83(图2c)。灵敏度和特异性的平均值分别为0.77(范围0.56-0.94)和0.86(范围0.55-0.97),其中相应的平均阳性预测值为0.86(范围0.71-0.97)且平均阴性预测值为0.77(范围0.64-0.89)。
基于消除的反向顺序对每种抗体进行评分(其中数字1是待消除的最后抗体),并且按其中位消除得分的顺序从10次连续消除轮次排序。表2列出排名最高的25种抗体,其中有所述抗体的p值和q值、p值排序以及pdac相对于nc的倍数变化。中位消除得分分别为1和2的前2种抗体备解素和vegf是9/10训练集中最后消除的抗体(备解素),且是8/10训练集中倒数第二消除的抗体(vegf)。排名前25位的抗体共同表示20种不同的特异性。
设计后向消除程序以识别抗体的最佳组合,而不考虑基于个体抗体的一维数据分离,并且表2中所呈现的共识特征仅基于后向消除排序。值得注意的是,前两种抗体也是基于p值和q值排名最高的两种。事实上,排名最高的五种抗体都呈现出pdac相对于nc的显著高的p值和q值(p<4.47e-06和q<5.00e-04)。共识特征抗体的后向消除排序(be-得分)和t-检验排序(w-得分)一起绘制在图2d中。前五种抗体后,w-得分开始与be-得分偏离,且然后失去任何相关性。因此,排名最高的五种抗体(备解素、vegf、il-8、c3和chp-1)隐射共识特征的高度稳定核心,如后向消除程序和单变量差异表达分析所示。然而,与先前利用类似方法分析的数据集一致的当前数据显示,需要通过正交标志物对特征核心进行补充,以在灵敏度且特别是特异性方面达到临床上的相关准确度水平,以区分pdac相对于nc。
i-iv期胰腺癌之间的区别
不同疾病阶段之间的区别是非常令人感兴趣的,因为这与在胰腺癌非侵入性阶段中诊断胰腺癌的能力相关。为了评估所识别的标志物在早期诊断中的重要性,根据疾病阶段对pdac样本进行分层。利用留一法交叉验证的svm显示所有pdac阶段均与nc分离,并且分类准确性随疾病进展而增加,其中auc值为0.71、0.86、0.90和0.93,用于将nc分别与i、ii、iii和iv期区分开来(图3a)。分组到阶段中导致样本数目较小,在i期的n=11至iii期的n=34例患者范围。为了提高的统计效力,还进行分组到早期局限性疾病(i/ii期)和晚期侵袭性疾病(iii/iv期)中。将这些组与nc区分开来,其中auc值为0.80(早期)和0.96(晚期)。
图3b显示当相比于nc时在阶段组中的至少一个中呈现出显著(威尔科克森p<0.05)差异蛋白质水平的所有抗体。在所述的五个核心候选标志物(备解素、vegf、il-8、c3和chp-1)中,备解素在所有阶段均下调,chp-1在所有阶段均上调且il-8仅在疾病iii/iv期中下调。
值得注意的是,在我们先前关于iii/iv期高加索人pdac患者中的血清标志物的研究中,c5被评为后向消除过滤分析中最突出的标志物,而目前的研究将所述c5抗体排在第14位(表2)。然而,当进行阶段特异性分析时,明显地c5仅在疾病晚期升高,这与前一项研究相干(wingren等人,2012)。值得注意的是,阶段特异性分析指出几种早期标志物候选蛋白,例如已经可在疾病i/ii期中测量的水平升高的bkt、cdk2、mapk-8、agap-2、il-13、il-6、ptpro、usp-7、muc-1以及水平降低的apo-a1和c1q。
与肿瘤位置相关的标志物
还按原发肿瘤在胰腺中的位置对样本进行分组,并将来自位于胰头的肿瘤与位于胰体和/或胰尾的肿瘤的血浆进行比较。本分析排除具有在其他位置(颈=4,颈+体=1,头+尾=1)处的肿瘤的样本。应用威尔科克森p<0.05的截止值,37种抗体在头相对于体/尾中显示出显著不同的强度水平(图4)。头(n=63)相对于体/尾(n=39)局部肿瘤的auc为0.64(p=5.4e-3)。虽然这些组在svm分析中未明显分离,但所述37种显著抗体与早期研究中所识别的抗体非常吻合(图4),尽管在样本形式(血清/血浆)、种族(高加索人/亚洲人)、技术方法(测定方案和仪器)和数据处理(归一化程序)(gerdtsson,2015)方面存在差异。与前一项研究无关的唯一蛋白质是c3,发现其在血浆中升高,但在头相对于体/尾局部肿瘤中的血清中降低。值得注意的是,在头与体/尾局部肿瘤之间被区分出来的蛋白质(图4)也明显不同于pdac相对于nc的蛋白质特征(表2)。
源自高加索人和中国人的标志物之间的相关性
接下来,我们评估中国胰腺癌受试者中的血浆蛋白特征与先前在晚期pdac高加索人群组中所识别的血清蛋白特征的一致性,相对于健康对照以及患有胰腺炎的患者进行分析(wingren等人,2012)。值得注意的是,自前一项研究以来,抗体微阵列含量已显著扩大,使两项研究的相关性测量变得困难。前一项研究仅含有目前所用的抗体的36%,并且例如不包括核心标志物chp-1。然而,其他四种核心特征蛋白(备解素、vegf、il-8和c3)都是先前所公布的血清pdac特征的一部分。除了核心小组外,当比较两项研究中排名最高的25种抗体(表2)时,两个种族群组之间存在明显重叠,证明基于血液的蛋白质组学分析受样本供体(高加索人/亚洲人)的基因构成或样本形式(血清/血浆)的影响较小。
在先前的高加索人群组中也显示pdac可以与对照和胰腺炎区分开来(wingren等人,2012)。由于我们的亚洲人群组不包括慢性胰腺炎样本,我们替代地比较存在于本研究和先前研究中的显著(威尔科克森p<0.05)标志物(sandstrom等人,2012;wingren等人,2012)。五种标志物(c3、c5、il-12、il-8、备解素)通常在血清和血浆pdac样本以及胰腺炎样本中表达。尽管存在这种重叠,但相比于慢性胰腺炎,pdac相关蛋白显著不同。此外,当前和先前的研究已证明,不管标志物的子集是否与炎症或非相关适应症重叠,正是多重特征中的标志物的组合提供最精确的准确性。
论述
为了识别血浆标志物特征,初始使用两种互补策略,(i)单变量差异表达分析,其为测定中的每种抗体产生多重测试校正的q值,以及(ii)设计以精确鉴别最佳标志物组合的后向消除方法,对用于区分病例和对照的正交信息有利(carlsson等人,2011a)。这两种策略导致识别出五种蛋白质备解素、vegf、il-8、c3和chp-1的稳健核心特征。备解素或补体因子p在两项独立的研究中先前确定为在血清(wingren等人,2012)和血浆(gerdtsson等人,未发表的观察)中强烈下调,但除此之外,据我们所知,未预先与pdac相关联。与此相反,与肿瘤生长的血管生成依赖性相关的vegf为许多癌症包括pdac中的已知上调标志物(itakura等人,1997)。特异性已通过质谱法验证的所述vegf抗体在早期研究中也证明pdac中显著升高的vegf水平(gerdtsson,2015;wingren等人,2012)。il-8和补体因子c3先前也已显示出与晚期胰腺癌相关(chen等人,2013;shaw等人,2014;wingren等人,2012)。与此相反,先前未测量过chp-1(钙调磷酸酶同源蛋白-1),且我们认为其与pdac的关联对于本研究而言是新颖的。chp-1是ca2+结合系列的一部分,并且是位于多个亚细胞区室中的广泛表达蛋白。除了涉及跨质膜运输之外,这种大概的多能性蛋白的功能基本上是未知的(jimenez-vidal等人,2010)
结果显示,需要向核心特征补充额外的蛋白质,以便获得最高的可能的灵敏度和特异性。这里,大约23个标志物显示出提供pdac相对于nc的最佳区别。除了5-蛋白核心外,还识别了几种感兴趣的可能的标志物。apo-a1是最强的差异表达蛋白之一,如所有三种apo-a1特异性抗体(q值0.003-0.02)所示。先前已见到其在来自pdac患者的血浆中的显著下调(honda等,2012)(gerdtsson等人,未发表的观察)。apo-a1是血浆中高密度脂蛋白(highdensitylipoprotein,hdl)的主要组分,并且降低的hdl水平与心血管健康状况不佳相关。因此,本研究中所观察到的降低的apo-a1水平可反映pdac与吸烟和肥胖的关联。根据我们先前的研究,另一种强烈下调标志物是补体因子c1q(wingren等人,2012)。值得注意的是,虽然apo-a1和c1q都是基于单变量分析的顶级标志物,但其并未被包括在从后向消除分析得出的共识特征中,所述后向消除分析仅考虑组合特征而不是其中单独标志物的性能。与此相反,两种方法都将mapk-8识别为高得分标志物。先前未在多参数测定中对mapk-8(涉及数个细胞过程和传信通路的丝氨酸/苏氨酸蛋白激酶)进行分析,且其在pdac中的区分能力和作用需在未来的研究中进行证实。值得注意的是,虽然样本亚组的年龄匹配较好,但pdac和nc组的性别分布存在偏移。为了研究pdac相对于nc的分类器是否受到性别偏差的影响,通过额外的combat归一化步骤创建经性别调整的数据集。结果清楚地证明,经性别调整的数据集中pdac相对于nc的重要抗体列表与原始数据集的列表高度相似。此外,基于svm的分析还证明,如相比于pdac相对于nc,男性相对于女性分离较差,再次显示性别不是pdac相对于nc分类器的混杂因素。
据我们所知,这是第一项识别血浆中阶段特异性pdac标志物的蛋白质组学研究。由于早期诊断显著增加pdac患者的预期寿命(furukawa等人,1996;shimizu等人,2005),所定义的与i/ii期相关的标志物在设计临床相关测试时是特别重要的。虽然pdac相对于nc的区别随着pdac阶段增加,但我们仍能够将i/ii期患者与正常个体区分开来。结果基于使用来自微阵列分析的所有数据,但可以被压缩为高能特征。特别地,包括agap-2、btk、cdk-2、il-13、il-6、muc-1、ptpro、usp-7的几种蛋白质显示在局部受限的早期癌症中的水平升高。其中的四种:agap-2、cdk-2、ptpro和usp7,先前未在我们的微阵列测定中测量过。cdk-2或周期蛋白依赖性激酶2涉及控制细胞周期,并且cdk的异常活化是熟知的许多癌症(包括pdac)的检验印记(feldmann等人,2011)。剩余的新颖的标志物先前未与pdac关联,特别是先前已确定的其他pdac标志物(ingvarsson等人,2008;wingren等人,2012),包括在90%的pdac病例中过表达的muc-1(winter等人,2012)、细胞因子il-6(bellone等人,2006)和il-13(gabitass等人,2011),以及酪氨酸激酶btk。
本研究的焦点确实是识别阶段特异性血浆蛋白和区分可切除胰腺癌与播散性疾病的能力。然而,癌症相对于胰腺炎的差异诊断有时是困难的,并且在最近研究中解释的问题特别聚焦于胰腺炎症,其中我们发现可以识别蛋白质特征,其在急性、慢性和自身免疫性胰腺炎与正常对照之间被明确地区分开来(sandstrom等人,2012)。重要的是,炎症相关的蛋白质特征也不同于本研究中的i、ii、iii、iv期相关的标志物特征。这些发现得到先前研究的进一步支持,所述研究识别将胰腺癌患者与对照的组合(包括患有不同胰腺炎性适应症的患者,以及健康个体)区分开来的特征(wingren等人,2012)。
先前已证明由于在胰腺中定位而产生的肿瘤的生物多样性(ling等人,2013)。在胰体和胰尾内的肿瘤比在胰头内的肿瘤(77%的pdac)更罕见(lau等人,2010)。因为在例如血供及淋巴和静脉回流中存在差异,在体肿瘤和尾肿瘤的疾病呈现中也存在差异,所述尾肿瘤引起较少黄疸、更多疼痛、更高的白蛋白和cea水平和更低的ca19-9水平(eyigor等人,2010;watanabe等人,2004)。体肿瘤和尾肿瘤比头肿瘤更常在晚期被检测到并且具有更高的转移率。由于生物差异可以导致不同的治疗功效(wu等人,2007),可以区分肿瘤定位的标志物具有临床相关性且可以辅助个性化治疗策略。然而,很少在基因水平(突变、缺失和扩增的总数目或k-ras点突变中没有显著变化)上发现差异(ling等人,2013)。这里,37种抗体识别在头肿瘤与体肿瘤/尾肿瘤之间显示差异蛋白表达水平的标志物,并且这种表达模式与先前的研究非常吻合。因此,这些结果对于在疾病早期区分体肿瘤/尾肿瘤和头肿瘤的血液蛋白生物标志物特征的未来发展而言是鼓舞人心的。
种族遗传多样性被很好地描述,并且除环境因素外与例如世界上不同地方的癌症发生率和进展联系在一起(gupta等人,2014;rastogi等人,2004)。正相反,我们在这里显示亚洲人出身和高加索人出身的pdac患者表达类似的疾病相关蛋白质特征。虽然生物异质性确实是探求基因生物标志物的一道坎(gupta等人,2014),但我们的研究结果表明,由于相比于基因突变,整个蛋白质水平的多样性较少,因此蛋白质组学生物标志物可能会更稳健且可在不同种族之间传递。
总之,我们已经证明可以首次将可切除的胰腺癌(i/ii期)以及局部晚期(iii期)和远处转移(iv期)疾病准确地区分开来,这是聚焦于早期诊断胰腺癌的测试的先决条件。此外,我们提供以下信息:可以识别与胰腺中不同肿瘤位置相关的血浆蛋白标志物。
参考文献
alonzo,t.a.,pepe,m.s.,moskowitz,c.s.,2002,《用于检测疾病存在的医学测试的比较研究的样本大小计算(samplesizecalculationsforcomparativestudiesofmedicaltestsfordetectingpresenceofdisease)》,《医学统计学(statmed.)》21,835-852。
bauden,m.,pamart,d.,ansari,d.,herzog,m.,eccleston,m.,micallef,j.,andersson,b.,andersson,r.,2015,《循环核小体作为胰腺癌中的表观遗传生物标志物(circulatingnucleosomesasepigeneticbiomarkersinpancreaticcancer)》,《临床表观遗传学(clinepigenet)》7,106。
bellone,g.,smirne,c.,mauri,f.a.,tonel,e.,carbone,a.,buffolino,a.,dughera,l.,robecchi,a.,pirisi,m.,emanuelli,g.,2006,《人胰腺癌细胞和手术标本中的细胞因子表达谱:对生存的意义(cytokineexpressionprofileinhumanpancreaticcarcinomacellsandinsurgicalspecimens:implicationsforsurvival)》,《癌症免疫学免疫疗法(cancerimmunolimmunother.)》,55,684-698。
brand,r.e.,nolen,b.m.,zeh,h.j.,allen,p.j.,eloubeidi,m.a.,goldberg,m.,elton,e.,arnoletti,j.p.,christein,j.d.,vickers,s.m.,langmead,c.j.,landsittel,d.p.,whitcomb,d.c.,grizzle,w.e.,lokshin,a.e.,2011,《用于检测胰腺癌的血清生物标志物小组(serumbiomarkerpanelsforthedetectionofpancreaticcancer)》,《临床癌症研究(clincancerres.)》,17,805-816。
bunger,s.,laubert,t.,roblick,u.j.,habermann,j.k.,2011,《用于改善胰腺癌诊断的血清生物标志物:当前综述(serumbiomarkersforimproveddiagnosticofpancreaticcancer:acurrentoverview)》,《癌研究与临床肿瘤学(jcancerresclinoncol.)》,137,375-389。
carlsson,a.,wingren,c.,ingvarsson,j.,ellmark,p.,baldertorp,b.,ferno,m.,olsson,h.,borrebaeck,c.a.,2008,《使用重组抗体微阵列对转移性乳腺癌的血清蛋白质组谱进行分析(serumproteomeprofilingofmetastaticbreastcancerusingrecombinantantibodymicroarrays)》,《欧洲癌症杂志(eurjcancer)》44,472-480。
carlsson,a.,wingren,c.,kristensson,m.,rose,c.,ferno,m.,olsson,h.,jernstrom,h.,ek,s.,gustavsson,e.,ingvar,c.,ohlsson,m.,peterson,c.,borrebaeck,c.a.,2011a,《原发性乳腺癌患者的分子血清肖像预测远处转移的发展(molecularserumportraitsinpatientswithprimarybreastcancerpredictthedevelopmentofdistantmetastases)》,《美国国家科学院院刊》108,14252-14257。
carlsson,a.,wuttge,d.m.,ingvarsson,j.,bengtsson,a.a.,sturfelt,g.,borrebaeck,c.a.,wingren,c.,2011b,《使用重组抗体微阵列对系统性红斑狼疮和系统性硬化症的血清蛋白质谱进行分析(serumproteinprofilingofsystemiclupuserythematosusandsystemicsclerosisusingrecombinantantibodymicroarrays)》,《分子与细胞蛋白质组学(molcellproteomics)》,10,m110005033。
chen,j.,wu,w.,zhen,c.,zhou,h.,yang,r.,chen,l.,hu,l.,2013,《补体c3、补体c4b1和载脂蛋白e在胰腺癌中的表达及临床意义(expressionandclinicalsignificanceofcomplementc3,complementc4b1andapolipoproteineinpancreaticcancer)》,《肿瘤学学报(oncollett.)》6,43-48。
conlon,k.c.,klimstra,d.s.,brennan,m.f.,1996,《对胰腺导管腺癌进行疗效性切除术后的长期生存(long-termsurvivalaftercurativeresectionforpancreaticductaladenocarcinoma)》,5年生存者的临床病理分析,《外科学年鉴(annsurg.)》223,273-279。
coussens,l.m.,werb,z.,2002,《炎症和癌症(inflammationandcancer)》《自然》420,860-867。
eyigor,c.,karaca,b.,kuzeyli-yildirim,y.,uslu,r.,uyar,m.,coker,a.,2010,《晚期胰腺癌的肿瘤定位是否会对症状和疼痛的治疗产生影响?(doesthetumorlocalizationinadvancedpancreaticcancerhaveaninfluenceonthemanagementofsymptomsandpain?)》《b.u.肿瘤学杂志(jb.u.on.)》15,543-546。
feldmann,g.,mishra,a.,bisht,s.,karikari,c.,garrido-laguna,i.,rasheed,z.,ottenhof,n.a.,dadon,t.,alvarez,h.,fendrich,v.,rajeshkumar,n.v.,matsui,w.,brossart,p.,hidalgo,m.,bannerji,r.,maitra,a.,nelkin,b.d.,2011,《周期蛋白依赖性激酶抑制剂dinaciclib(sch727965)抑制鼠异种移植模型中的胰腺癌生长和进展(cyclin-dependentkinaseinhibitordinaciclib(sch727965)inhibitspancreaticcancergrowthandprogressioninmurinexenograftmodels)》,《癌症生物学及治疗(cancerbiolther.)》12,598-609。
furukawa,h.,okada,s.,saisho,h.,ariyama,j.,karasawa,e.,nakaizumi,a.,nakazawa,s.,murakami,k.,kakizoe,t.,1996,《小胰腺腺癌的临床病理特征(clinicopathologicfeaturesofsmallpancreaticadenocarcinoma)》,集体研究,《癌症》78,986-990。
gabitass,r.f.,annels,n.e.,stocken,d.d.,pandha,h.a.,middleton,g.w.,2011,《胰腺癌、食道癌和胃癌中升高的髓样抑制细胞是独立的预后因子,且与th2细胞因子白细胞介素-13的显著升高相关(elevatedmyeloid-derivedsuppressorcellsinpancreatic,esophagealandgastriccancerareanindependentprognosticfactorandareassociatedwithsignificantelevationoftheth2cytokineinterleukin-13)》,《癌症免疫学免疫疗法》,60,1419-1430。
gangi,s.,fletcher,j.g.,nathan,m.a.,christensen,j.a.,harmsen,w.s.,crownhart,b.s.,chari,s.t.,2004,《ct上观察到的异常与胰腺癌的临床诊断之间的时间间隔:诊断前获得的ct扫描的回顾性综述(timeintervalbetweenabnormalitiesseenonctandtheclinicaldiagnosisofpancreaticcancer:retrospectivereviewofctscansobtainedbeforediagnosis)》,《美国放射学杂志(amjroentgenol)》,182,897-903。
gerdtsson,a.s.m.,n.;
gupta,s.,venkatesh,a.,ray,s.,srivastava,s.,2014,《生物标志物研究的挑战和前景:来自发展中国家的当前展望(challengesandprospectsforbiomarkerresearch:acurrentperspectivefromthedevelopingworld)》,《生物化学与生物物理学报(biochimbiophysacta)》1844,899-908。
haab,b.b.,geierstanger,b.h.,michailidis,g.,vitzthum,f.,forrester,s.,okon,r.,saviranta,p.,brinker,a.,sorette,m.,perlee,l.,suresh,s.,drwal,g.,adkins,j.n.,omenn,g.s.,2005,《hupo血浆蛋白质组项目参考试样的免疫测定和抗体微阵列分析:样本类型之间的系统性变化和质谱数据的校准(immunoassayandantibodymicroarrayanalysisofthehupoplasmaproteomeprojectreferencespecimens:systematicvariationbetweensampletypesandcalibrationofmassspectrometrydata)》,《蛋白质组学》5,3278-3291。
honda,k.,okusaka,t.,felix,k.,nakamori,s.,sata,n.,nagai,h.,ioka,t.,tsuchida,a.,shimahara,t.,shimahara,m.,yasunami,y.,kuwabara,h.,sakuma,t.,otsuka,y.,ota,n.,shitashige,m.,kosuge,t.,buchler,m.w.,yamada,t.,2012,《改变的胰腺癌患者的血浆载脂蛋白修饰:蛋白质表征和多机构验证(alteredplasmaapolipoproteinmodificationsinpatientswithpancreaticcancer:proteincharacterizationandmulti-institutionalvalidation)》,《公共科学图书馆:综合(plosone)》7,e46908。
hou,j.,xu,j.,jiang,r.,wang,y.,chen,c.,deng,l.,huang,x.,wang,x.,sun,b.,2013,《雌激素敏感的ptpro表达通过控制stat3来压制肝细胞癌进展(estrogen-sensitiveptproexpressionrepresseshepatocellularcarcinomaprogressionbycontrolofstat3)》,《肝病学(hepatol.)》57,678-688。
huang,y.t.,li,f.f.,ke,c.,li,z.,li,z.t.,zou,x.f.,zheng,x.x.,chen,y.p.,zhang,h.,2013,《ptpro启动子甲基化可预测her2阳性乳腺癌的较差结果:个性化治疗的指示(ptpropromotermethylationispredictiveofpooreroutcomeforher2-positivebreastcancer:indicationforpersonalizedtherapy)》,《转化医学杂志(jtranslmed.)》11,245。
ingvarsson,j.,wingren,c.,carlsson,a.,ellmark,p.,wahren,b.,engstrom,g.,harmenberg,u.,krogh,m.,peterson,c.,borrebaeck,c.a.,2008,《使用基于抗体微阵列的血清蛋白质谱检测胰腺癌(detectionofpancreaticcancerusingantibodymicroarray-basedserumproteinprofiling)》,《蛋白质组学》8,2211-2219。
itakura,j.,ishiwata,t.,friess,h.,fujii,h.,matsumoto,y.,buchler,m.w.,korc,m.,1997,《血管内皮生长因子在人类胰腺癌中的增强表达与局部疾病进展相关(enhancedexpressionofvascularendothelialgrowthfactorinhumanpancreaticcancercorrelateswithlocaldiseaseprogression)》,《临床癌症研究》3,1309-1316。
jimenez-vidal,m.,srivastava,j.,putney,l.k.,barber,d.l.,2010,《核定位的钙调磷酸酶同源蛋白chp1与上游结合因子相互作用并抑制核糖体rna合成(nuclear-localizedcalcineurinhomologousproteinchp1interactswithupstreambindingfactorandinhibitsribosomalrnasynthesis)》,《生物化学杂志(jbiolchem)》,285,36260-36266。
jin,q.,kong,b.,yang,x.,cui,b.,wei,y.,yang,q.,2007,《chp2的过表达增强卵巢癌中的肿瘤细胞生长、侵袭和转移(overexpressionofchp2enhancestumorcellgrowth,invasionandmetastasisinovariancancer)》,《活体杂志(invivo)》21,593-598。
johnson,w.e.,li,c.,rabinovic,a.,2007,《使用经验贝叶斯方法调整微阵列表达数据中的批处理效应(adjustingbatcheffectsinmicroarrayexpressiondatausingempiricalbayesmethods)》,《生物统计学(biostatistic)》8,118-127。
lau,m.k.,davila,j.a.,shaib,y.h.,2010,《胰头癌、胰体癌和胰尾癌的发病率和生存率:美国的一项基于人群的研究(incidenceandsurvivalofpancreaticheadandbodyandtailcancers:apopulation-basedstudyintheunitedstates)》,《胰腺杂志(pancreas)》39,458-462。
ling,q.,xu,x.,zheng,s.s.,kalthoff,h.,2013,《胰头癌和胰体癌/胰尾癌之间的多样性:临床参数和体外模型(thediversitybetweenpancreaticheadandbody/tailcancers:clinicalparametersandinvitromodels)》,《国际肝胆胰疾病杂志(hepatobilpancreatdisintl.)》12,480-487。
locker,g.y.,hamilton,s.,harris,j.,jessup,j.m.,kemeny,n.,macdonald,j.s.,somerfield,m.r.,hayes,d.f.,bast,r.c.,jr.,2006,《在胃肠癌中使用肿瘤标志物的建议的asco2006更新(asco2006updateofrecommendationsfortheuseoftumormarkersingastrointestinalcancer)》,《临床肿瘤学杂志(jclinoncol.)》24,5313-5327。
melo,s.a.,luecke,l.b.,kahlert,c.,fernandez,a.f.,gammon,s.t.,kaye,j.,lebleu,v.s.,mittendorf,e.a.,weitz,j.,rahbari,n.,reissfelder,c.,pilarsky,c.,fraga,m.f.,piwnica-worms,d.,kalluri,r.,2015,《磷脂酰肌醇蛋白聚糖-1识别癌症外泌体并检测早期胰腺癌(glypican-1identifiescancerexosomesanddetectsearlypancreaticcancer)》,《自然》523,177-182。
motiwala,t.,kutay,h.,ghoshal,k.,bai,s.,seimiya,h.,tsuruo,t.,suster,s.,morrison,c.,jacob,s.t.,2004,《蛋白酪氨酸磷酸酶受体型o(ptpro)表现出人类肺癌中候选肿瘤抑制因子的特征(proteintyrosinephosphatasereceptor-typeo(ptpro)exhibitscharacteristicsofacandidatetumorsuppressorinhumanlungcancer)》,《美国国家科学院院刊》101,13844-13849。
pannala,r.,basu,a.,petersen,g.m.,chari,s.t.,2009,《新发糖尿病:胰腺癌早期诊断的潜在线索(new-onsetdiabetes:apotentialcluetotheearlydiagnosisofpancreaticcancer)》,《柳叶刀·肿瘤(lancetoncol.)》10,88-95。
pauly,f.,smedby,k.e.,jerkeman,m.,hjalgrim,h.,ohlsson,m.,rosenquist,r.,borrebaeck,c.a.,wingren,c.,2014,《使用重组抗体微阵列通过血浆蛋白谱识别b细胞淋巴瘤子集(identificationofb-celllymphomasubsetsbyplasmaproteinprofilingusingrecombinantantibodymicroarrays)》,《白血病研究(leukemiares.)》38,682-690。
pelaez-luna,m.,takahashi,n.,fletcher,j.g.,chari,s.t.,2007,《早期症状性胰腺癌的可切除性及其与糖尿病发病的关系:ct扫描和诊断前的禁食血糖值的回顾性综述(resectabilityofpresymptomaticpancreaticcanceranditsrelationshiptoonsetofdiabetes:aretrospectivereviewofctscansandfastingglucosevaluespriortodiagnosis)》,《美国胃肠病学杂志(amjgastroenterol.)》102,2157-2163。
rastogi,t.,hildesheim,a.,sinha,r.,2004,《发展中国家癌症流行病学的机会(opportunitiesforcancerepidemiologyindevelopingcountries)》,《自然癌症综述(naturerevcancer)》4,909-917。
sandstrom,a.,andersson,r.,segersvard,r.,lohr,m.,borrebaeck,c.a.,wingren,c.,2012,《使用重组抗体微阵列的胰腺炎的血清蛋白质组谱揭示疾病相关的生物标志物特征(serumproteomeprofilingofpancreatitisusingrecombinantantibodymicroarraysrevealsdisease-associatedbiomarkersignatures)》,《蛋白质组学临床应用》,6,486-496。
shaw,v.e.,lane,b.,jenkinson,c.,cox,t.,greenhalf,w.,halloran,c.m.,tang,j.,sutton,r.,neoptolemos,j.p.,costello,e.,2014,《用于区分胰腺癌与良性胰腺疾病的血清细胞因子生物标志物小组(serumcytokinebiomarkerpanelsfordiscriminatingpancreaticcancerfrombenignpancreaticdisease)》,《分子癌症(molcancer)》13,114。
shimizu,y.,yasui,k.,matsueda,k.,yanagisawa,a.,yamao,k.,2005,《小胰腺癌是可治愈的:单个研究所的新的计算机断层扫描发现、病理学研究和术后结果(smallcarcinomaofthepancreasiscurable:newcomputedtomographyfinding,pathologicalstudyandpostoperativeresultsfromasingleinstitute)》,《胃肠病学和肝病学杂志(jgastroenterolhepatol.)》20,1591-1594。
sohn,t.a.,yeo,c.j.,cameron,j.l.,koniaris,l.,kaushal,s.,abrams,r.a.,sauter,p.k.,coleman,j.,hruban,r.h.,lillemoe,k.d.,2000,《切除胰腺腺癌-616例患者:结果、后果和预后指标(resectedadenocarcinomaofthepancreas-616patients:results,outcomes,andprognosticindicators)》,《胃肠外科杂志(jgastrointestsurg.)》567-579。
song,m.s.,salmena,l.,carracedo,a.,egia,a.,lo-coco,f.,teruya-feldstein,j.,pandolfi,p.p.,2008,《通过hausp-pml网络调节pten的去泛素化和定位(thedeubiquitinylationandlocalizationofptenareregulatedbyahausp-pmlnetwork)》,《自然》455,813-817。
steinhauer,c.,wingren,c.,hager,a.c.,borrebaeck,c.a.,2002,《设计用于蛋白质芯片应用的单框架重组抗体片段(singleframeworkrecombinantantibodyfragmentsdesignedforproteinchipapplications)》,《生物技术供应(biotechniquessuppl.)》38-45。
stoevesandt,o.,taussig,m.j.,2012,《亲和蛋白质组学的欧洲和国际合作(europeanandinternationalcollaborationinaffinityproteomics)》,《自然生物技术(nbiotechnol.)》29,511-514。
surinova,s.,schiess,r.,huttenhain,r.,cerciello,f.,wollscheid,b.,aebersold,r.,2011,《关于血浆蛋白生物标志物的研究进展(onthedevelopmentofplasmaproteinbiomarkers)》,《蛋白质组学研究杂志(jproteomeres.)》10,5-16。
watanabe,i.,sasaki,s.,konishi,m.,nakagohri,t.,inoue,k.,oda,t.,kinoshita,t.,2004,《发病症状和肿瘤位置作为胰腺癌的预后因素(onsetsymptomsandtumorlocationsasprognosticfactorsofpancreaticcancer)》,《胰腺》28,160-165。
wingren,c.,borrebaeck,c.a.,2008,《直接标记的复杂蛋白质组的抗体微阵列分析(antibodymicroarrayanalysisofdirectlylabelledcomplexproteomes)》,《生物技术当前舆论(curropinbiotechnol.)》19,55-61。
wingren,c.,sandstrom,a.,segersvard,r.,carlsson,a.,andersson,r.,lohr,m.,borrebaeck,c.a.,2012,《识别与胰腺癌相关的血清生物标志物特征(identificationofserumbiomarkersignaturesassociatedwithpancreaticcancer)》,《癌症研究》72,2481-2490。
wingren,c.,steinhauer,c.,ingvarsson,j.,persson,e.,larsson,k.,borrebaeck,c.a.,2005,《基于亲和标记的单链fv抗体的微阵列:复杂蛋白质组中分析物的灵敏检测(microarraysbasedonaffinity-taggedsingle-chainfvantibodies:sensitivedetectionofanalyteincomplexproteomes)》,《蛋白质组学》5,1281-1291。
winter,j.m.,tang,l.h.,klimstra,d.s.,brennan,m.f.,brody,j.r.,rocha,f.g.,jia,x.,qin,l.x.,d'angelica,m.i.,dematteo,r.p.,fong,y.,jarnagin,w.r.,o'reilly,e.m.,allen,p.j.,2012,《一种新型的基于生存的胰腺癌组织微阵列验证muc1和间皮素作为生物标志物(anovelsurvival-basedtissuemicroarrayofpancreaticcancervalidatesmuc1andmesothelinasbiomarkers)》,《公共科学图书馆:综合》7,e40157。
wu,t.c.,shao,y.f.,shan,y.,wu,j.x.,zhao,p.,2007,[《胰体和胰尾恶性肿瘤的手术效果:与胰头癌相比(surgicaleffectofmalignanttumorofbodyandtailofthepancreas:comparewithpancreaticheadcancer)》],《中华外科杂志(zhonghuawaikezazhi)》[中国外科杂志]45,30-33。
xia,c.,ma,w.,stafford,l.j.,liu,c.,gong,l.,martin,j.f.,liu,m.,2003,《ggap——双功能gtp结合和gtp酶激活蛋白的新家族(ggaps,anewfamilyofbifunctionalgtp-bindingandgtpase-activatingproteins)》,《分子细胞生物学(molcellbiol)》,23,2476-2488。
yachida,s.,jones,s.,bozic,i.,antal,t.,leary,r.,fu,b.,kamiyama,m.,hruban,r.h.,eshleman,j.r.,nowak,m.a.,velculescu,v.e.,kinzler,k.w.,vogelstein,b.,iacobuzio-donahue,c.a.,2010,《远处转移在胰腺癌的遗传进化期间后期发生(distantmetastasisoccurslateduringthegeneticevolutionofpancreaticcancer)》,《自然》467,1114-1117。
zhao,g.y.,lin,z.w.,lu,c.l.,gu,j.,yuan,y.f.,xu,f.k.,liu,r.h.,ge,d.,ding,j.y.,2014,《usp7过表达预示肺鳞状细胞癌和大细胞癌的预后不良(usp7overexpressionpredictsapoorprognosisinlungsquamouscellcarcinomaandlargecellcarcinoma)》,《肿瘤生物学(tumourbiol.)》36,1721-1729。
*选择肽抗体,而非数据库编录号。
'↑'指示生物标志物在pc中上调;
'↓'指示生物标志物在pc中下调;
'↑↓'指示生物标志物在pc中失调,但趋势可能是上调或下调(即生物标志物在某些pc亚型中上调、在其他pc亚型中下调和/或其他非失调);
表1.临床样本
*根据美国癌症协会指南进行分期
表2.前25种特征候选分析物
表3:阵列上包括的抗体
*通过蛋白质阵列、细胞因子阵列、elisa、阻断/强化实验和/或质谱法确定特异性
表4:显著(威尔科克森p<0.05)标志物的比较
表5
表6-(示例性特征1)的roc-auc
特征根据所示顺序累积,例如,具有三种分析物的特征包含备解素、vegf和c1q。
表7-(示例性特征2)的roc-auc
特征根据所示顺序累积,例如,具有三种分析物的特征包含r-ptp-o、ubp7和prd14。
表8-实例中使用的scfv抗体的氨基酸序列
*scfv抗体的结构描述于
- 还没有人留言评论。精彩留言会获得点赞!