针对T细胞免疫球蛋白和粘蛋白3(TIM-3)的抗体的制作方法
本申请要求以下美国临时申请序列号的权益:2016年2016年11月1日提交的62/416,131和2016年11月29日提交的62/427,775,两个临时申请的内容据此通过引用整体并入。
背景技术:
癌症是一个严重的公共卫生问题,根据美国癌症协会,2016年癌症事实与数据(http://www.cancer.org/acs/groups/content/@research/documents/document/acspc-047079.pdf),仅2016年在美国预计有约595,690人会死于癌症。
技术实现要素:
蛋白t细胞免疫球蛋白和粘蛋白结构域-3(tim-3),也称为甲型肝炎病毒细胞受体2(havcr2),是一种th1特异性细胞表面蛋白,它调节巨噬细胞活化并增强小鼠实验性自身免疫性脑脊髓炎的严重性。tim-3在多种免疫细胞类型的表面上高表达,这些细胞包括例如th1ifn-γ+细胞、th17细胞、自然杀伤(nk)细胞、单核细胞和肿瘤相关树突细胞(dc)(参见,例如,clayton等人,j.immunol.,192(2):782-791(2014);jones等人,j.exp.med.,205:2763-2779(2008);monney等人,nature,415:536-541(2002);hastings等人,eur.j.immunol.,39:2492-2501(2009);seki等人,clin.immunol.,127:78-88(2008);ju等人,b.j.hepatol.,52:322-329(2010);anderson等人,science,318:1141-1143(2007);baitsch等人,plosone,7:e30852(2012);ndhlovu等人,blood,119:3734-3743(2012)。tim-3也在多种慢性病毒感染(例如,hiv、hcv和hbv)和某些癌症中的“耗竭的”或受损的cd8+t细胞中高表达(参见,例如,mcmahan等人,j.clin.invest.,120(12):4546-4557(2010);jin等人,procnatlacadsciusa,107(33):14733-14738(2010);golden-mason等人,j.virol.,83(18):9122-9130(2009);jones等人,同上;fourcade等人,j.exp.med.,207(10):2175-2186(2010);sakuishi等人,j.exp.med.,207(10):2187-2194(2010);zhou等人,blood,117(17):4501-4510(2011);ngiow等人,cancerres.,71(10):3540-3551(2011))。
tim-3的推定配体包括磷脂酰丝氨酸(nakayama等人,blood,113:3821-3830(2009))、半乳糖凝集素-9(zhu等人,nat.immunol.,6:1245-1252(2005))、高迁移率族蛋白1(hmgb1)(chiba等人,natureimmunology,13:832-842(2012))和癌胚抗原细胞粘附分子1(ceacam1)(huang等人,nature,517(7534):386-90(2015))。
tim-3用于调节免疫反应的各个方面。tim-3和半乳糖凝集素-9(gal-9)的相互作用诱导细胞死亡,并且这种相互作用的体内阻断加剧了自身免疫并消除了实验模型中的耐受性,强烈暗示tim-3是负调节分子。与对t细胞的作用形成对比,tim-3-gal-9相互作用通过促进细胞内病原体的巨噬细胞清除而表现出抗微生物作用(参见,例如,sakuishi等人,trendsinimmunology,32(8):345-349(2011))。在体内,已显示抑制tim-3可增强实验性自身免疫性脑脊髓炎的病理学严重性(monney等人,同上;以及anderson,a.c.和anderson,d.e.,curr.opin.immunol.,18:665-669(2006))。研究还表明,tim-3-半乳糖凝集素-9途径的失调可能在慢性自身免疫性疾病中发挥作用,例如多发性硬化(anderson和anderson,同上)。tim-3通过其独特的结合槽结合磷脂酰丝氨酸来促进凋亡细胞的清除(参见,例如,dekruyff等人,j.immunol.,184(4):1918-1930(2010))。
目前正在研究例如通过使用单克隆抗体来抑制tim-3活性,作为基于临床前研究的肿瘤免疫疗法(参见,例如,ngiow等人,cancerres.,71(21):1-5(2011);guo等人,journaloftranslationalmedicine,11:215(2013);以及ngiow等人,cancerres.,71(21):6567-6571(2011))。
需要另外的tim-3拮抗剂(例如抗体),其以高亲和力结合tim-3并有效中和tim-3活性。
本公开提供了抗体药剂和与之有关的各种组合物和方法,包括例如多肽、核酸、细胞和各种方法学等。
本发明提供了与tim-3结合的新型抗体。在一些实施方案中,本发明的抗体以高亲和力结合tim-3并有效中和tim-3活性。在一些实施方案中,明确提供了抗体重链多肽(seqidno:1)和轻链多肽(seqidno:2)序列。
本公开提供了一种多肽或分离的免疫球蛋白重链多肽,其具有seqidno:1中所示氨基酸序列。本发明还提供了一种多肽或分离的免疫球蛋白重链多肽,其具有与seqidno:1中所示的氨基酸序列有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%总体同一性的氨基酸序列。在一些实施方案中,相对于seqidno:1中所示序列的序列差异不在cdr内。在一些实施方案中,多肽或分离的免疫球蛋白重链多肽包括seqidno:1的全部三个cdr。在一些实施方案中,多肽或免疫球蛋白重链多肽包括信号肽。在一些实施方案中,包括信号肽的多肽或免疫球蛋白重链多肽具有seqidno:5中所示的氨基酸序列。
在一些实施方案中,提供的多肽或免疫球蛋白重链多肽是igg4多肽或包含igg4多肽。在一些实施方案中,提供的多肽或免疫球蛋白重链多肽包含人ighg4*01多肽。在一些实施方案中,提供的多肽或免疫球蛋白重链多肽在igg重链区内包含一个或多个突变。在一些实施方案中,提供的多肽或免疫球蛋白重链多肽包含在重链恒定区中具有一个或多个突变的igg4重链恒定区。在一些实施方案中,提供的多肽或免疫球蛋白重链多肽包含在铰链区中具有一个或多个突变的igg4重链恒定区。设想在一些实施方案中,igg4铰链区中的突变可以防止半分子与其他igg4分子交换。在一些实施方案中,igg4铰链区中的所述一个或多个突变可以包括丝氨酸至脯氨酸的稳定突变,其防止半分子与其他igg4分子交换。在一些实施方案中,igg4铰链区中的所述一个或多个突变可包括s228p突变。参见,例如,j.biol.chem.2015;290(9):5462-5469。
本公开提供了一种多肽或分离的免疫球蛋白轻链多肽,其具有seqidno:2中所示氨基酸序列。本发明还提供了一种多肽或分离的免疫球蛋白轻链多肽,其具有与seqidno:2中所示的氨基酸序列有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%总体同一性的氨基酸序列。在一些实施方案中,相对于seqidno:2中所示序列的序列差异不在cdr内。在一些实施方案中,多肽或分离的免疫球蛋白轻链多肽包括seqidno:2的全部三个cdr。在一些实施方案中,提供的多肽或免疫球蛋白轻链多肽是κ轻链。在一些实施方案中,提供的多肽或免疫球蛋白轻链多肽包含人igkc*01多肽。在一些实施方案中,多肽或免疫球蛋白轻链多肽包括信号肽。在一些实施方案中,包括信号肽的多肽或免疫球蛋白轻链多肽具有seqidno:6中所示的氨基酸序列。
在一些实施方案中,本公开提供了一种抗tim-3抗体药剂,其包含至少一条具有seqidno:1中所示的氨基酸序列的免疫球蛋白重链和至少一条具有seqidno:2中所示的氨基酸序列的免疫球蛋白轻链。在一些实施方案中,抗tim-3抗体药剂包含两条免疫球蛋白重链,每条重链均具有seqidno:1中所示的氨基酸序列。替代性地或另外地,在一些实施方案中,抗tim-3抗体药剂包含两条免疫球蛋白轻链,每条轻链均具有seqidno:2中所示的氨基酸序列。在一些实施方案中,抗tim-3抗体药剂具有规范的抗体形式。
在一些实施方案中,提供的重链、轻链和/或抗体药剂在一个或多个位点糖基化。在一些实施方案中,聚糖与fc区n-连接。在一些实施方案中,抗体药剂在asn297(kabat编号)处糖基化。
在一些实施方案中,本公开提供了包含如本文所述的重链、轻链和/或抗体药剂的一种或多种糖型(glycoform)的组合物。在一些实施方案中,提供的组合物包含多个以指定的绝对和/或相对量存在的此类糖型。在一些实施方案中,本公开提供了可以基本上不含如本文所述的重链、轻链和/或抗体药剂的一种或多种特定糖型的组合物。
在一些实施方案中,提供的重链、轻链和/或抗体药剂具有包括一个或多个二硫键的结构。在一些实施方案中,所述一个或多个二硫键是在igg4免疫球蛋白的预期位置处的二硫键或包括该二硫键。
在一些实施方案中,抗tim-3抗体药剂与另一种抗体药剂,例如对淋巴细胞活化基因3(lag-3)或程序性死亡1(pd-1)有特异性的抗体药剂一起施用。
在一些实施方案中,抗体药剂与tim-3和另一种抗原结合,产生“双重反应性”抗体药剂(例如双特异性抗体)。例如,抗体药剂可以与tim-3和免疫系统的另一种负调节因子,例如程序性死亡1(pd-1)或淋巴细胞活化基因3蛋白(lag-3)结合。
另外,本公开提供了编码前述免疫球蛋白多肽的分离或纯化的核酸序列,包含此类核酸序列的载体,包含前述免疫球蛋白多肽的抗tim-3抗体药剂,编码此类抗tim-3抗体药剂的核酸序列,包含此类核酸序列的载体,包含此类载体的分离的细胞,包含此类抗tim-3抗体药剂或此类载体与药学上可接受的载剂的组合物,以及通过向哺乳动物施用有效量的此类组合物来治疗哺乳动物的癌症、感染性疾病或自身免疫性疾病的方法。
附图说明
本文所包括的附图,由以下附图组成,仅用于说明目的而不是用于限制。
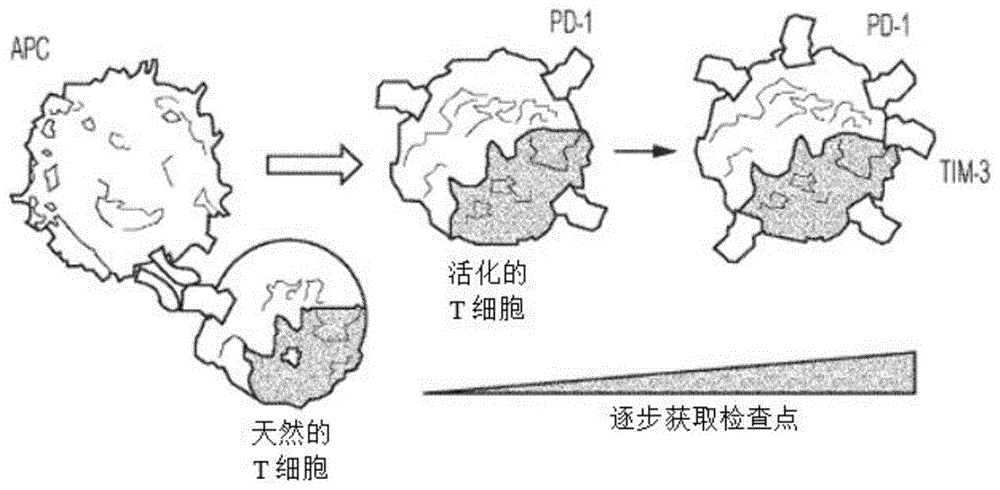
图1描绘了tim-3调节t细胞活化的未必按比例绘制的示意图。
图2描绘了示例性体外t细胞耗竭模型的结果。(a)在反应性(刺激前)细胞和耗竭的(刺激后)细胞中pd-1和tim-3的靶向表达。(b)用抗tim-3抗体药剂(黑色条)和同种型对照(透明条)处理的耗竭(刺激后)细胞中ifn-γ产量的定量。
具体实施方式
本公开提供了抗体药剂和与之有关的各种组合物和方法,包括例如多肽、核酸、细胞和各种方法学等。本发明的抗原结合蛋白以高亲和力结合tim-3并有效中和tim-3活性。明确提供了免疫球蛋白重链多肽(seqidno:1和5)和免疫球蛋白轻链多肽(seqidno:2和6)序列。在一些实施方案中,免疫球蛋白重链多肽和/或免疫球蛋白轻链多肽经分离。如本文所用,术语“免疫球蛋白”或“抗体”是指在脊椎动物的血液或其他体液中发现的蛋白质,其被免疫系统用于鉴别和中和外来物,诸如细菌和病毒。完整的免疫球蛋白通常由四个多肽组成:重(h)链多肽的两个相同拷贝和轻(l)链多肽的两个相同拷贝。每条重链含有一个n端可变(vh)区和三个c端恒定(ch1、ch2和ch3)区,每条轻链含有一个n端可变(vl)区和一个c端恒定(cl)区。免疫球蛋白轻链,基于其恒定结构域的氨基酸序列,可以指定为两种不同类型之一,kappa(κ)或lambda(λ)。在典型的免疫球蛋白中,每条轻链通过二硫键与重链连接,并且两条重链通过二硫键相互连接。轻链可变区与重链的可变区对齐,并且轻链恒定区与重链的第一恒定区对齐。其余重链恒定区彼此对齐。
每对轻链和重链的可变区形成抗体的抗原结合位点。vh和vl区具有相同的总体结构,每个区包含四个通过三个互补决定区(cdr)连接的框架(fw或fr)区。如本文所用,术语“框架区”是指可变区内位于高变区或互补决定区(cdr)之间的相对保守的氨基酸序列。在典型的免疫球蛋白中,在每个可变结构域中存在四个框架区,称为fr1、fr2、fr3和fr4。框架区形成提供可变区的结构框架的β折叠(参见,例如,c.a.janeway等人(编辑),immunobiology,第5版,garlandpublishing,newyork,ny(2001))。
在典型的免疫球蛋白中,在每个可变结构域中存在三个互补决定区(cdr),称为cdr1、cdr2和cdr3。cdr形成抗体的“高变区”,其负责抗原结合。cdr形成环,该环连接由框架区形成的β-折叠结构,并且在一些情况下包含β-折叠结构的一部分。虽然轻链和重链的恒定区不直接牵涉于抗体与抗原的结合,但恒定区可影响可变区的取向。恒定区还表现出各种效应子功能,例如通过与效应分子和细胞相互作用而参与抗体依赖性补体介导的裂解或抗体依赖性细胞毒性。
本公开至少部分地提供了与t细胞免疫球蛋白和粘蛋白3(tim-3)结合的抗体药剂。如本文所用,术语“抗体药剂”是指与特定抗原特异性结合的药剂。在一些实施方案中,该术语涵盖包括足以赋予特异性结合的免疫球蛋白结构元件的任何多肽或多肽复合物。示例性抗体药剂包括但不限于单克隆抗体或多克隆抗体。在一些实施方案中,抗体药剂可包括一个或多个恒定区序列,其是小鼠、兔、灵长类动物或人抗体的特征。在一些实施方案中,抗体药剂可包括一个或多个人源化、灵长类化、嵌合等序列元件,如本领域已知的。在许多实施方案中,术语“抗体药剂”用于指一种或多种本领域已知或开发的构建体或形式,用于以替代呈现方式利用抗体结构和功能特征。例如,实施方案,根据本发明使用的抗体药剂是选自但不限于以下的形式:完整iga、igg、ige或igm抗体;双特异性或多特异性抗体(例如,
在一些实施方案中,抗tim-3抗体药剂包含免疫球蛋白重链多肽和/或免疫球蛋白轻链多肽。tim-3是一种60kda的1型跨膜蛋白,它由三个结构域组成:n端ig可变(igv)样结构域、中间富含ser/thr的粘蛋白结构域和具有短细胞内尾的跨膜结构域(参见,例如,kane,l.p.,journalofimmunology,184(6):2743-2749(2010))。tim-3最初在终末分化的th1细胞上鉴定出,并通过诱导t细胞凋亡而负调节t细胞反应(参见,例如,hastings等人,eur.j.immunol.,39(9):2492-2501(2009))。tim-3也在活化的th17和tc1细胞上表达,并且cd4+t细胞和cd8+t细胞上tim-3表达的失调与几种自身免疫性疾病、病毒感染和癌症相关(参见,例如,liberal等人,hepatology,56(2):677-686(2012);wu等人,eur.j.immunol.,42(5):1180-1191(2012);anderson,a.c.,curr.opin.immunol.,24(2):213-216(2012);以及han等人,frontiersinimmunology,4:449(2013))。
与tim-3及其组分结合的某些其他抗体是本领域已知的(参见,例如,美国专利8,101,176;美国专利8,552,156;和美国专利8,841,418)。某些抗tim-3抗体也可从诸如abcam(cambridge,ma)和r&dsystems,inc.(minneapolis,mn)等来源商购获得。
在一些实施方案中,提供的重链、轻链和/或抗体药剂在一个或多个位点糖基化。如本文所用,“聚糖”是糖蛋白的糖聚合物(部分)组分。术语“聚糖”涵盖游离聚糖,包括已经从糖蛋白上切割或以其他方式释放的聚糖。在一些实施方案中,聚糖与fc区n-连接。在一些实施方案中,抗体药剂在asn297(kabat编号)处糖基化。
在一些实施方案中,本公开提供了包含如本文所述的重链、轻链和/或抗体药剂的一种或多种糖型(glycoform)的组合物。术语“糖型”在本文中用于指糖蛋白的特定形式。即,糖蛋白包括具有与不同聚糖或聚糖集合连接的潜力的特定多肽时,则该糖蛋白的每种不同型式(即,多肽与特定聚糖或聚糖集合连接的情况)称为“糖型”。在一些实施方案中,提供的组合物包含如本文所述的重链、轻链和/或抗体药剂中的一种或多种的多个糖型。在一些实施方案中,提供的组合物包含多个以指定的绝对和/或相对量存在的此类糖型。在一些实施方案中,本公开提供了可以基本上不含如本文所述的重链、轻链和/或抗体药剂的一种或多种特定糖型的组合物。
在一些实施方案中,糖型的量表示为“百分比”。对于任何给定参数,“百分比”是指特定聚糖(聚糖x)的摩尔数相对于制剂的聚糖总摩尔数。在一些实施方案中,“百分比”是指n-糖酰胺酶f(pngase)释放的fc聚糖x的摩尔数相对于检测到的n-糖酰胺酶f释放的fc聚糖的总摩尔数。
在一些实施方案中,提供的重链、轻链和/或抗体药剂具有包括一个或多个二硫键的结构。在一些实施方案中,所述一个或多个二硫键是在igg4免疫球蛋白的预期位置处的二硫键或包括该二硫键。在一些实施方案中,二硫键存在于对应于选自seqidno:1的残基22、96、127、140、196、219、222、254、314、360和418的位置的一个或多个残基处。在一些实施方案中,二硫键存在于对应于选自seqidno:2的残基23、88、134、194和214的位置的一个或多个残基处。在一些实施方案中,所提供的tim-3抗体药剂包含一个或多个二硫键,其中第一半胱氨酸选自seqidno:1的残基22、96、127、140、196、219、222、254、314、360和418,并且第二半胱氨酸选自seqidno:2的残基23、88、134、194和214。在一些实施方案中,所提供的tim-3抗体药剂包含一个或多个二硫键,其中第一半胱氨酸选自seqidno:1的残基22、96、127、140、196、219、222、254、314、360和418,并且第二半胱氨酸选自seqidno:1的22、96、127、140、196、219、222、254、314、360和418。在一些实施方案中,所提供的tim-3抗体药剂包含一个或多个二硫键,其中第一半胱氨酸选自seqidno:2的残基23、88、134、194和214,并且第二半胱氨酸选自seqidno:2的残基23、88、134、194和214。
在一些实施方案中,所提供的tim-3抗体药剂包含由第一半胱氨酸和第二半胱氨酸形成的一个或多个二硫键,其中所述一个或多个二硫键选自:(a)第一残基是seqidno:2的残基23,并且第二残基是seqidno:2的残基88;(b)第一残基是seqidno:2的残基134,并且第二残基是seqidno:2的残基194;(c)第一残基是seqidno:2的残基214,并且第二残基是seqidno:1的残基127;(d)第一残基是seqidno:1的残基22,并且第二残基是seqidno:1的残基97;(e)第一残基是seqidno:1的残基140,并且第二残基是seqidno:1的残基196;(f)第一残基是seqidno:1的残基219,并且第二残基是seqidno:1的残基222;(g)第一残基是seqidno:1的残基254,并且第二残基是seqidno:1的残基314;以及(h)第一残基是seqidno:1的残基360,并且第二残基是seqidno:1的残基418。在一些实施方案中,所提供的tim-3抗体药剂包含由第一半胱氨酸和第二半胱氨酸形成的二硫键,其中所述抗体药剂在以下任一者处包含二硫键:(a)第一残基是seqidno:2的残基23,并且第二残基是seqidno:2的残基88;(b)第一残基是seqidno:2的残基134,并且第二残基是seqidno:2的残基194;(c)第一残基是seqidno:2的残基214,并且第二残基是seqidno:1的残基127;(d)第一残基是seqidno:1的残基22,并且第二残基是seqidno:1的残基97;(e)第一残基是seqidno:1的残基140,并且第二残基是seqidno:1的残基196;(f)第一残基是seqidno:1的残基219,并且第二残基是seqidno:1的残基222;(g)第一残基是seqidno:1的残基254,并且第二残基是seqidno:1的残基314;以及(h)第一残基是seqidno:1的残基360,并且第二残基是seqidno:1的残基418。
在一些实施方案中,分离的免疫球蛋白重链多肽,包含与seqidno:1或5至少90%相同(例如,至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同)的氨基酸序列。
在一些实施方案中,分离的免疫球蛋白轻链多肽,包含与seqidno:2或6至少90%相同(例如,至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同)的氨基酸序列。
如本文所述,核酸或氨基酸序列“同一性”可以通过将目标核酸或氨基酸序列与参考核酸或氨基酸序列进行比较来测定。百分比同一性是目标序列与参考序列之间同样(即,相同)的核苷酸或氨基酸残基的数量除以最长序列的长度(即,目标序列或参考序列的长度,以较长者为准)。许多用于获得最佳比对并计算两个或更多个序列之间的同一性的数学算法是已知的并且并入许多可用的软件程序中。此类程序的实例包括clustal-w、t-coffee和align(用于核酸和氨基酸序列的比对)、blast程序(例如blast2.1、bl2seq及其新近版本)和fasta程序(例如,fasta3x、fastm和ssearch)(用于序列比对和序列相似性搜索)。序列比对算法还公开于例如altschul等人,j.molecularbiol.,215(3):403-410(1990),beigert等人,proc.natl.acad.sci.usa,106(10):3770-3775(2009),durbin等人编辑,biologicalsequenceanalysis:probalisticmodelsofproteinsandnucleicacids,cambridgeuniversitypress,cambridge,uk(2009),soding,bioinformatics,21(7):951-960(2005),altschul等人,nucleicacidsres.,25(17):3389-3402(1997),和gusfield,algorithmsonstrings,treesandsequences,cambridgeuniversitypress,cambridgeuk(1997))。
上述免疫球蛋白重链多肽和/或轻链多肽的一个或多个氨基酸可以被不同的氨基酸置换或取代。氨基酸“置换”或“取代”是指多肽序列内在给定位置或残基处的一个氨基酸被相同位置或残基处的另一个氨基酸置换。
氨基酸大致分为“芳香族”或“脂肪族”。芳香族氨基酸包括芳香环。“芳香族”氨基酸的实例包括组氨酸(h或his)、苯丙氨酸(f或phe)、酪氨酸(y或tyr)和色氨酸(w或trp)。非芳香族氨基酸大致分为“脂肪族”。“脂肪族”氨基酸的实例包括甘氨酸(g或gly)、丙氨酸(a或ala)、缬氨酸(v或val)、亮氨酸(l或leu)、异亮氨酸(i或he)、甲硫氨酸(m或met)、丝氨酸(s或ser)、苏氨酸(t或thr)、半胱氨酸(c或cys)、脯氨酸(p或pro)、谷氨酸(e或glu)、天冬氨酸(a或asp)、天冬酰胺(n或asn)、谷氨酰胺(q或gln)、赖氨酸(k或lys)和精氨酸(r或arg)。
脂肪族氨基酸可以细分为四个亚类。“大脂肪族非极性亚类”由缬氨酸、亮氨酸和异亮氨酸组成。“脂肪族弱极性亚类”由甲硫氨酸、丝氨酸、苏氨酸和半胱氨酸组成。“脂肪族极性/带电亚类”由谷氨酸、天冬氨酸、天冬酰胺、谷氨酰胺、赖氨酸和精氨酸组成。“小残基亚类”由甘氨酸和丙氨酸组成。带电/极性氨基酸类可以细分为三个亚类:由赖氨酸和精氨酸组成的“带正电的亚类”,由谷氨酸和天冬氨酸组成的“带负电的亚类”和由天冬酰胺和谷氨酰胺组成的“极性亚类”。
芳香族氨基酸可以细分为两个亚类:由组氨酸和色氨酸组成的“氮环亚类”和由苯丙氨酸和酪氨酸组成的“苯基亚类”。
氨基酸置换或取代可为保守性、半保守性或非保守性。短语“保守性氨基酸取代”或“保守性突变”是指一种氨基酸被另一种具有共同性质的氨基酸置换。定义各个氨基酸之间共同性质的功能方式是分析同源生物的相应蛋白质之间氨基酸变化的标准化频率(schulz和schirmer,principlesofproteinstructure,springer-verlag,newyork(1979))。根据此类分析,可以定义氨基酸分类,其中基团内的氨基酸优先彼此交换,因此它们对总体蛋白质结构的影响大部分彼此相似(schulz和schirmer,同上)。
保守性氨基酸取代的实例包括上述亚类中的氨基酸的取代,例如,赖氨酸取代精氨酸且反之亦然,使得可以保持正电荷;谷氨酸取代天冬氨酸且反之亦然,使得可以保持负电荷;苏氨酸取代丝氨酸,使得可以保持游离-oh;以及天冬酰胺取代谷氨酰胺,使得可以保持游离-nh2。
“半保守性突变”包括在上文列出的同一类中,但不是同一亚类中的氨基酸的氨基酸取代。例如,天冬氨酸取代天冬酰胺或天冬酰胺取代赖氨酸涉及同一类,但不是同一亚类中的氨基酸。“非保守性突变”涉及不同类之间的氨基酸取代,例如,赖氨酸取代色氨酸或苯丙氨酸取代丝氨酸等。
本公开至少部分地提供了一种分离的抗tim-3抗体药剂,其包含、基本上由或由本文所述的本发明分离的氨基酸序列组成。如本文所用,术语“分离的”(或“纯化的”)是指从其天然环境中存在的其他组分移出或分开的核酸序列(例如,多核苷酸)或氨基酸序列(例如,多肽)。例如,分离的多肽是与在其中产生多肽的细胞的其他组分(例如,内质网或细胞质蛋白和rna)分开的多肽。分离的多核苷酸是与其他核组分(例如组蛋白)和/或上游或下游核酸序列分开的多核苷酸。分离的核酸序列或氨基酸序列可以至少60%不含,或至少75%不含,或至少90%不含,或至少95%不含,或至少98%不含,或至少99%不含指定核酸序列或氨基酸序列的天然环境中存在的其他组分。
所谓“抗tim-3抗体药剂”是指与tim-3蛋白特异性结合的分子,优选蛋白质分子。在一些实施方案中,tim-3结合剂是抗tim-3抗体药剂。在一些实施方案中,分离的抗tim-3抗体药剂包含、基本上由或由免疫球蛋白重链多肽(例如,seqidno:1)和/或免疫球蛋白轻链多肽(例如,seqidno:2)组成。在一些实施方案中,分离的抗tim-3抗体药剂包含、基本上由或由免疫球蛋白重链多肽(其序列包含seqidno:1)和/或免疫球蛋白轻链多肽(其序列包含seqidno:2)组成。
在一些实施方案中,提供的多肽或重链多肽基本上由seqidno:1或seqidno:5的氨基酸序列组成,并且还可包含不会实质性影响多肽(例如,通过影响本发明重链多肽对tim-3的亲和力)的附加组分。此类组分的实例包括,例如,促进纯化或分离的蛋白质部分诸如生物素;乘客突变;不含包括游离半胱氨酸的问题位点的序列;附加糖基化位点和高可能性脱酰胺或异构化位点。
在一些实施方案中,提供的多肽或免疫球蛋白重链多肽由seqidno:1或seqidno:5的氨基酸序列组成,并且不包含任何附加组分(即,不是本发明免疫球蛋白重链多肽内源的组分)。
在一些实施方案中,抗tim-3抗体药剂包括下述变体,其中免疫球蛋白重链多肽和/或免疫球蛋白轻链多肽中的一个或多个氨基酸以任何组合被不同的氨基酸残基置换,或者可以缺失或是插入的,只要没有因氨基酸置换、插入和/或缺失而实质性减弱(例如,增强或改善)抗tim-3抗体药剂的生物活性。tim-3结合剂的“生物活性”是指,例如,对特定tim-3表位的结合亲和力,对tim-3与其受体结合的中和或抑制,对体内tim-3活性的中和或抑制(例如,ic50),药代动力学性质和交叉反应性(例如,与tim-3蛋白的非人同源物或直系同源物或与其他蛋白质或组织)。本领域公认的抗原结合剂的其他生物学性质或特征包括例如亲合力、选择性、溶解性、折叠、免疫毒性、表达和配制。可以使用标准技术观察、测量和/或评估上述性质或特征,所述标准技术包括但不限于elisa、竞争性elisa、表面等离子体共振分析(biacoretm)或动力学排除测定(kinexatm)、体外或体内中和测定、受体-配体结合测定、细胞因子或生长因子产生和/或分泌测定,以及信号转导和免疫组织化学测定。
如本文所用的关于抗tim-3抗体药剂活性的术语“抑制”或“中和”是指基本上拮抗、阻止、预防、限制、减缓、破坏、改变、消除、终止或逆转例如tim-3的生物活性或与tim-3相关的疾病或病状的进展或严重程度的能力。在一些实施方案中,抗tim-3抗体药剂将tim-3的活性抑制或中和至少约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约98%、约99%、约100%,或由前述任何两个值限定的范围(例如,20%至100%、40%至100%或60%至95%等)。
在一些实施方案中,抗tim-3抗体药剂是全抗体或其片段(例如,抗体片段)。在一些实施方案中,抗体或抗体片段包含基于野生型igg1、igg2或igg4抗体或其变体的重链恒定区。应当理解,每种抗体类别或同种型都参加一组不同的效应子机制,一旦被识别就处理或中和抗原。因此,在一些实施方案中,当抗tim-3抗体药剂为抗体时,其可以表现出一种或多种效应子功能,诸如通过与效应分子和细胞的相互作用(例如,补体系统的活化)而参与抗体依赖性补体介导的裂解或抗体依赖性细胞毒性。
在一些实施方案中,抗tim-3抗体药剂包含igg4重链恒定区。在一些实施方案中,抗tim-3抗体药剂在igg重链区内包含一个或多个突变。在一些实施方案中,抗tim-3抗体药剂包含在重链恒定区中具有一个或多个突变的igg4重链恒定区。在一些实施方案中,抗tim-3抗体药剂包含在铰链区中具有一个或多个突变的igg4重链恒定区。设想在一些实施方案中,igg4铰链区中的突变可以防止半分子与其他igg4分子交换。在一些实施方案中,igg4铰链区中的所述一个或多个突变可以包括s228p突变或丝氨酸至脯氨酸的稳定突变,其防止半分子与其他igg4分子交换。参见,例如,j.biol.chem.2015;290(9):5462-5469。
抗tim-3抗体药剂也可以是抗体偶联物。在这方面,抗tim-3抗体药剂可以是(1)抗tim-3抗体和(2)蛋白质或非蛋白质部分的偶联物。例如,抗tim-3抗体药剂可以是与肽、荧光分子或化学治疗剂偶联的抗体。
抗tim-3抗体药剂可以是人抗体、非人抗体或嵌合抗体,或者可以从人抗体、非人抗体或嵌合抗体获得。“嵌合”意指包含人和非人区域的抗体或其片段。在一些实施方案中,抗tim-3抗体药剂是人源化抗体。“人源化”抗体是包含人抗体支架和至少一个获自或源自非人抗体的cdr的单克隆抗体。非人抗体包括从任何非人动物,诸如啮齿动物(例如小鼠或大鼠)分离的抗体。人源化抗体可包含一个、两个或三个获自或源自非人抗体的cdr。在一些实施方案中,本发明的tim-3结合剂的cdrh3获自或源自小鼠单克隆抗体,而抗tim-3抗体药剂的其余可变区和恒定区获自或源自人单克隆抗体。
人抗体、非人抗体、嵌合抗体或人源化抗体可以通过任何手段获得,包括通过体外来源(例如,杂交瘤或重组产生抗体的细胞系)和体内来源(例如,啮齿动物)。产生抗体的方法是本领域已知的,并且在例如
在一些实施方案中,抗tim-3抗体药剂结合tim-3的表位,这阻断tim-3与其任何推定的配体(例如,磷脂酰丝氨酸、半乳糖凝集素-9、高迁移率族蛋白1(hmgb1)和癌胚抗原细胞粘附分子1(ceacam1))的结合并抑制tim-3介导的信号传导。本公开还提供了tim-3的分离的或纯化的表位,该表位以间接或变构方式阻断tim-3与其任何推定配体的结合。在一些实施方案中,抗tim-3抗体药剂结合tim-3的表位,这样阻断tim-3与其一种、两种或更多种假定配体的结合。
本公开还提供了一种或多种分离或纯化的核酸序列,其编码本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽和/或本发明的抗tim-3抗体药剂。
术语“核酸序列”旨在涵盖dna或rna的聚合物,即多核苷酸,其可以是单链或双链的并且可以含有非天然或改变的核苷酸。如本文所用的术语“核酸”和“多核苷酸”是指任何长度的核苷酸(核糖核苷酸(rna)或脱氧核糖核苷酸(dna))的聚合形式。这些术语是指分子的一级结构,因此包括双链和单链dna,以及双链和单链rna。所述术语包括作为等效物的由核苷酸类似物产成的rna或dna类似物,和经修饰的多核苷酸,例如但不限于甲基化和/或封端的多核苷酸。核酸通常通过磷酸键连接形成核酸序列或多核苷酸,但本领域已知许多其他连键(例如硫代磷酸酯、硼烷磷酸酯等)。编码本发明的免疫球蛋白重链多肽的核酸序列包括,例如,seqidno:3。编码本发明的免疫球蛋白轻链多肽的核酸序列包括,例如,seqidno:4。
本公开还提供了一种载体,其包含编码本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽和/或本发明的抗tim-3抗体药剂的一种或多种核酸序列。所述载体可以是,例如质粒、附加体、粘粒、病毒载体(例如逆转录病毒或腺病毒)或噬菌体。合适的载体和载体制备方法是本领域熟知的(参见,例如,sambrook等人,molecularcloning,alaboratorymanual,第3版,coldspringharborpress,coldspringharbor,n.y.(2001),和ausubel等人,currentprotocolsinmolecularbiology,greenepublishingassociatesandjohnwiley&sons,newyork,n.y.(1994))。
除了编码本发明的多肽、本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽和/或本发明的抗tim-3抗体药剂的核酸序列外,载体还可以包含提供编码序列在宿主细胞中的表达的表达控制序列,诸如启动子、增强子、多腺苷酸化信号、转录终止子、信号肽(例如,骨粘连蛋白信号肽)、内部核糖体进入位点(ires)等。示例性表达控制序列是本领域已知的并且在例如goeddel,geneexpressiontechnology:methodsinenzymology,第185卷,academicpress,sandiego,calif.(1990)中有描述。
大量来自多种不同来源的启动子,包括组成型、诱导型和阻抑型启动子,是本领域熟知的。启动子的代表性来源包括例如,病毒、哺乳动物、昆虫、植物、酵母和细菌,并且来自这些来源的合适启动子易于获得,或者可以基于例如从诸如atcc的贮藏所以及其他商业或个人来源公开可获得的序列合成制备。启动子可以是单向的(即,在一个方向上启动转录)或双向的(即,在3’或5’方向启动转录)。启动子的非限制性实例包括,例如t7细菌表达系统、pbad(araa)细菌表达系统、巨细胞病毒(cmv)启动子、sv40启动子、rsv启动子。诱导型启动子包括,例如tet系统(美国专利5,464,758和5,814,618)、蜕皮激素诱导系统(no等人,proc.natl.acad.sci.,93:3346-3351(1996))、t-rextm系统(invitrogen,carlsbad,ca)、lacswitchtm系统(stratagene,sandiego,ca)和cre-ert他莫昔芬(tamoxifen)诱导重组酶系统(indra等人,nuc.acid.res.,27:4324-4327(1999);nuc.acid.res.,28:e99(2000);美国专利7,112,715;及kramer和fussenegger,methodsmol.biol.,308:123-144(2005))。
如本文所用的术语“增强子”是指增加例如与之可操作地连接的核酸序列的转录的dna序列。
增强子可以位于离核酸序列的编码区许多千碱基处,并且可以介导调节因子的结合、dna甲基化的模式或dna结构的变化。大量来自多种不同来源的增强子是本领域熟知的,并且可以作为克隆多核苷酸或在克隆多核苷酸内获得(来自例如atcc等贮藏所以及其他商业或个体来源)。许多包含启动子(例如常用的cmv启动子)的多核苷酸也包含增强子序列。增强子可位于编码序列的上游、内部或下游。
载体还可包含“选择标记基因”。如本文所用,术语“选择标记基因”是指在相应选择剂的存在下,允许表达要特异性选择的或对其进行特异性选择的核酸序列。合适的选择标记基因是本领域已知的,并且在例如国际专利申请公开wo1992/008796和wo1994/028143;wigler等人,proc.natl.acad.sci.usa,77:3567-3570(1980);o'hare等人,proc.natl.acad.sci.usa,78:1527-1531(1981);mulligan和berg,proc.natl.acad.sci.usa,78:2072-2076(1981);colberre-garapin等人,j.mol.biol.,150:1-14(1981);santerre等人,gene,30:147-156(1984);kent等人,science,237:901-903(1987);wigler等人,cell,11:223-232(1977);szybalska和szybalski,proc.natl.acad.sci.usa,48:2026-2034(1962);lowy等人,cell,22:817-823(1980);以及美国专利5,122,464和5,770,359中有描述。
在一些实施方案中,载体是“附加型表达载体”或“附加体”,其能够在宿主细胞中复制,并且在适当的选择压力存在下作为dna的染色体外区段持续存在于宿主细胞内(参见,例如,conese等人,genetherapy,11:1735-1742(2004))。代表性的市售附加型表达载体包括但不限于利用爱泼斯坦-巴尔核抗原1(ebna1)和爱泼斯坦-巴尔病毒(ebv)复制起点(orip)的附加型质粒。来自invitrogen(carlsbad,ca)的载体prep4、pcep4、prep7和pcdna3.1以及来自stratagene(lajolla,ca)的载体pbk-cmv代表使用t-抗原和sv40复制起点代替ebna1和orip的游离型载体的非限制性实例。
其他合适的载体包括整合表达载体,其可以随机整合到宿主细胞的dna中,或者可以包括重组位点以实现表达载体和宿主细胞染色体之间的特异性重组。此类整合表达载体可以利用宿主细胞染色体的内源表达控制序列来实现所需蛋白质的表达。以定点方式整合的载体的实例包括,例如,来自invitrogen(carlsbad,ca)的flp-in系统(例如,pcdnatm5/frt),或cre-lox系统的组分,诸如可以在来自stratagene(lajolla,ca)的pexchange-6核心载体中所找到的。随机整合到宿主细胞染色体内的载体的实例包括,例如,来自lifetechnologies(carlsbad,ca)的pcdna3.1(在不存在t-抗原的情况下引入时),来自millipore(billerica,ma)的ucoe,和来自promega(madison,wi)的pci或pfn10a(act)flexitm。
也可以使用病毒载体。代表性的市售病毒表达载体包括但不限于可从crucell,inc.(leiden,thenetherlands)获得的基于腺病毒的per.c6系统,来自invitrogen(carlsbad,ca)的基于慢病毒的plp1,和来自stratagene(lajolla,ca)的逆转录病毒载体pfb-erv加上pcfb-egsh。
编码本发明的氨基酸序列的核酸序列可以在同一载体上(即顺式)提供给细胞。单向启动子可用于控制每个核酸序列的表达。在一些实施方案中,双向和单向启动子的组合可用于控制多个核酸序列的表达。编码本发明的氨基酸序列的核酸序列可替代性地在单独的载体上(即反式)提供给细胞群。每个单独的载体中的每个核酸序列可包含相同或不同的表达控制序列。可以同时或依次地将单独的载体提供给细胞。
可以将包含编码本发明的氨基酸序列的核酸的载体引入能够表达由其编码的多肽的宿主细胞中,包括任何合适的原核或真核细胞。因此,本公开提供了一种包含本发明载体的分离的细胞。宿主细胞包括可以容易且可靠地生长,具有相当快的生长速率,具有良好表征的表达系统,并且可以容易且有效地转化或转染的细胞。
合适的原核细胞的实例包括但不限于来自杆菌属(bacillus)的细胞(诸如枯草杆菌(bacillussubtilis)和短杆菌(bacillusbrevis))、埃希氏菌属(escherichia)(诸如大肠埃希氏菌(e.coli))、假单胞菌属(pseudomonas)、链霉菌属(streptomyces)、沙门氏菌属(salmonella)和欧文氏菌属(erwinia)的细胞。有用的原核细胞包括,例如,大肠埃希氏菌的各种菌株(例如,k12、hb101(atcc编号33694)、dh5α、dh10、mc1061(atcc编号53338)和cc102)。
在一些实施方案中,将本发明的载体引入真核细胞内。合适的真核细胞是本领域已知的,包括例如酵母细胞、昆虫细胞和哺乳动物细胞。合适的酵母细胞的实例包括来自克鲁维酵母属(kluyveromyces)、毕赤酵母属(pichia)、鼻孢子虫属(rhino-sporidium)、酵母属(saccharomyces)和裂殖酵母属(schizosaccharomyces)的酵母细胞。酵母细胞包括,例如,酿酒酵母(saccharomycescerivisae)和巴氏毕赤酵母(pichiapastoris)。
合适的昆虫细胞在例如kitts等人,biotechniques,14:810-817(1993);lucklow,curr.opin.biotechnol.,4:564-572(1993);和lucklow等人,j.virol.,67:4566-4579(1993)中有描述。昆虫细胞包括例如sf-9和hi5(invitrogen,carlsbad,ca)。
在一些实施方案中,利用哺乳动物细胞。许多合适的哺乳动物宿主细胞是本领域已知的,并且许多可从美国模式培养物保藏所(atcc,manassas,va)获得。合适的哺乳动物细胞的实例包括但不限于中国仓鼠卵巢细胞(cho)(atcc编号ccl61)、chodhfr-细胞(urlaub等人,proc.natl.acad.sci.usa,97:4216-4220(1980))、人胚肾(hek)293或293t细胞(atcc编号crl1573)和3t3细胞(atcc编号ccl92)。其他合适的哺乳动物细胞系是猴cos-1(atcc编号crl1650)和cos-7细胞系(atcc编号crl1651),以及cv-1细胞系(atcc编号ccl70)。其他示例性哺乳动物宿主细胞包括灵长类动物细胞系和啮齿动物细胞系,包括转化的细胞系。正常的二倍体细胞,源自原代组织体外培养的细胞株以及原代外植体也是合适的。其他合适的哺乳动物细胞系包括但不限于小鼠神经母细胞瘤n2a细胞、hela、小鼠l-929细胞和bhk或hak仓鼠细胞系,所有这些细胞系均可从atcc获得。选择合适的哺乳动物宿主细胞的方法及用于细胞的转化、培养、扩增、筛选和纯化的方法是本领域已知的。
在一些实施方案中,所述哺乳动物细胞是人细胞。例如,哺乳动物细胞可以是人淋巴样细胞系或淋巴来源的细胞系,例如前b淋巴细胞来源的细胞系。人淋巴样细胞系的实例包括但不限于ramos(crl-1596)、daudi(ccl-213)、eb-3(ccl-85)、dt40(crl-2111)、18-81(jack等人,proc.natl.acad.sci.usa,85:1581-1585(1988))、raji细胞(ccl-86)、per.c6细胞(crucellhollandb.v.,leiden,thenetherlands)及其衍生物。
编码本发明的氨基酸序列的核酸序列可以通过“转染”、“转化”或“转导”引入细胞内。如本文所用,“转染”、“转化”或“转导”是指通过使用物理或化学方法将一种或多种外源多核苷酸引入宿主细胞内。许多转染技术是本领域已知的,包括例如磷酸钙dna共沉淀(参见,例如,murrayej(编辑),methodsinmolecularbiology,第7卷,genetransferandexpressionprotocols,humanapress(1991));deae-葡聚糖;电穿孔;阳离子脂质体介导的转染;钨粒子促进的微粒轰击(johnston,nature,346:776-777(1990));和磷酸锶dna共沉淀(brash等人,mol.cellbiol,7:2031-2034(1987))。感染性粒子在合适的包装细胞中生长后,可将噬菌体或病毒载体引入宿主细胞中,其中许多包装细胞可商购获得。
本公开提供了一种组合物,其包含有效量的本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽、本发明的tim-3结合剂、本发明的编码前述任一种的核酸序列或本发明的包含本发明的核酸序列的载体。在一些实施方案中,所述组合物是药学上可接受的(例如,生理学上可接受的)组合物,其包含载剂,优选药学上可接受的(例如生理学上可接受的)载剂,和本发明的氨基酸序列、抗原结合剂或载体。在本发明的背景下可以使用任何合适的载剂,并且此类载剂是本领域中熟知的。载剂的选择将部分地由可施用该组合物的特定部位和用于施用该组合物的特定方法决定。该组合物任选可以是无菌的。可将组合物冷冻或冻干用于储存,并在使用前在合适的无菌载剂中重构。该组合物可以根据例如remington:thescienceandpracticeofpharmacy,第21版,lippincottwilliams&wilkins,philadelphia,pa(2001)中描述的常规技术生成。
本公开还提供了治疗下述任何疾病或病症的方法,在所述疾病或病症中tim-3蛋白的表达、不正确表达(例如,过表达)或活性增加引起或促成疾病的病理学效应,或tim-3蛋白水平或活性的降低在哺乳动物诸如人类中具有治疗益处。哺乳动物包括例如小鼠、大鼠、兔、狗、猫、牛、马、非人灵长类动物和人。
tim-3是免疫反应的负调节因子,因此是治疗的靶标(图1)。因此,本公开还提供了治疗哺乳动物中对tim-3抑制或中和有反应的病症的方法。该方法包括将上述组合物施用给患有对tim-3抑制或中和有反应的病症的哺乳动物,由此在该哺乳动物中治疗该病症。“对tim-3抑制有反应”或“对tim-3中和有反应”的病症是指tim-3水平或活性降低在哺乳动物(例如人类)中具有治疗益处的任何疾病或病症,或tim-3的不正确表达(例如,过表达)或活性增加导致或促成疾病或病症的病理学影响的任何疾病或病症。对tim-3抑制有反应的病症包括例如癌症、感染性疾病和自身免疫性疾病。
本公开还提供了在患有对tim-3抑制有反应的病症的哺乳动物中增强免疫反应或增加免疫细胞活性的方法。在一些实施方案中,此类方法包括施用有效量的本文所述的任何tim-3结合剂或抗体药剂。在一些实施方案中,tim-3结合剂的施用增强或增加哺乳动物或其组织中的免疫反应或免疫细胞活性。在一些实施方案中,免疫反应是体液或细胞介导的免疫反应。在一些实施方案中,免疫反应是cd4或cd8t细胞反应。在一些实施方案中,免疫反应是b细胞反应。
本发明的方法可用于治疗本领域已知的任何类型的癌症,例如黑素瘤、肾细胞癌、肺癌、膀胱癌、乳腺癌、宫颈癌、结肠癌、胆囊癌、喉癌、肝癌、甲状腺癌、胃癌、唾液腺癌、前列腺癌、胰腺癌、腺癌(例如,肺腺癌)或梅克尔(merkel)细胞癌(参见,例如,bhatia等人,curr.oncol.rep.,13(6):488-497(2011))。在一些实施方案中,癌症是子宫内膜癌、乳腺癌、卵巢癌、宫颈癌、输卵管癌、睾丸癌、原发性腹膜癌、结肠癌、结直肠癌、胃癌、小肠癌、肛殖区鳞状细胞癌、黑素瘤、肾细胞癌、肺癌、非小细胞肺癌、肺鳞状细胞癌、胃癌、膀胱癌、胆囊癌、肝癌、甲状腺癌、喉癌、唾液腺癌、食道癌、头颈癌、头颈部鳞状细胞癌、腺癌、肺腺癌、前列腺癌、胰腺癌、间皮瘤、梅克尔细胞癌、肉瘤、成胶质细胞瘤或血液学癌症(例如多发性骨髓瘤、b细胞淋巴瘤、t细胞淋巴瘤、霍奇金淋巴瘤(hodgkin’slymphoma)/原发性纵隔b细胞淋巴瘤或慢性粒细胞白血病)。在一些实施方案中,要用本文所述的本发明的方法和/或组合物治疗的癌症的特征在于微卫星不稳定或其缺乏。微卫星不稳定性(“msi”)是或包含某些细胞(诸如肿瘤细胞)的dna中的变化,其中微卫星重复序列(dna的短、重复序列)的数量不同于它从中遗传的dna中所含的重新序列的数量。微卫星不稳定性起因于修复因缺陷dna错配修复(mmr)系统而产生的复制相关错误的失败。这种失败使整个基因组中,但尤其是在称为微卫星的重复dna区域中的错配突变持续存在,导致突变负荷增加。已经证明,至少一些以msi-h为特征的肿瘤对某些抗pd-1药剂具有改善的反应(le等人,(2015)n.engl.j.med.372(26):2509-2520;westdorp等人,(2016)cancerimmunol.immunother.65(10):1249-1259)。
在一些实施方案中,癌症具有高度微卫星不稳定性的微卫星不稳定状态(例如,msi-h状态)。在一些实施方案中,癌症具有低度微卫星不稳定性的微卫星不稳定状态(例如,msi-l状态)。在一些实施方案中,癌症具有微卫星稳定的微卫星不稳定状态(例如,mss状态)。在一些实施方案中,通过基于下一代测序(ngs)的测定、基于免疫组织化学(ihc)的测定和/或基于pcr的测定来评估微卫星不稳定状态。在一些实施方案中,通过ngs检测微卫星不稳定性。在一些实施方案中,通过ihc检测微卫星不稳定性。在一些实施方案中,通过pcr检测微卫星不稳定性。
在实施方案中,癌症与高肿瘤突变负荷(tmb)相关。在一些实施方案中,癌症与高tmb和msi-h相关。在一些实施方案中,癌症与高tmb和msi-l或mss相关。在一些实施方案中,癌症是与高tmb相关的子宫内膜癌。在一些相关的实施方案中,子宫内膜癌与高tmb和msi-h相关。在一些相关的实施方案中,子宫内膜癌与高tmb和msi-l或mss相关。
在一些实施方案中,癌症是错配修复缺陷癌。微卫星不稳定性可起因于修复因缺陷dna错配修复(mmr)系统而产生的复制相关错误的失败。这种失败使整个基因组中,但尤其是在称为微卫星的重复dna区域中的错配突变持续存在,导致突变负荷增加,突变负荷增加可改善对某些pd-1药剂的反应。同上。在一些实施方案中,癌症是超突变癌。在一些实施方案中,癌症隐匿聚合酶ε(pole)的突变。
本发明的方法可用于治疗任何类型的感染性疾病(即,由细菌、病毒、真菌或寄生虫所引起的疾病或病症)。可通过本发明的方法治疗的感染性疾病的实例包括但不限于由人免疫缺陷病毒(hiv)、呼吸道合胞病毒(rsv)、流感病毒、登革热病毒(denguevirus)、乙型肝炎病毒(hbv,或丙型肝炎病毒(hcv))引起的疾病。
本发明的方法可用于治疗任何类型的自身免疫性疾病(即,由免疫系统过度活性引起的疾病或病症,其中身体攻击并损害其自身组织),诸如在例如mackayi.r.和rosen.r.编辑,theautoimmunediseases,第五版,academicpress,waltham,ma(2014)中描述的那些。可通过本发明的方法治疗的自身免疫性疾病的实例包括但不限于多发性硬化、1型糖尿病、类风湿性关节炎、硬皮病、克罗恩病(crohn’sdisease)、银屑病、系统性红斑狼疮(sle)和溃疡性结肠炎。
施用包含本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽、本发明的tim-3结合剂、编码前述任一种的本发明的核酸序列或包含本发明的核酸序列的本发明的载体的组合物诱导针对哺乳动物的癌症或感染性疾病的免疫反应。哺乳动物包括例如小鼠、大鼠、兔、狗、猫、牛、马、非人灵长类动物和人。“免疫反应”可需要例如抗体产生和/或免疫效应细胞(例如t细胞)的活化。
如本文所用,术语“治疗”等是指获得所需药理学和/或生理学效应。在一些实施方案中,该效应是治疗性的,即该效应部分或完全治愈疾病和/或由该疾病引起的不良症状。为此,本发明的方法包括施用“治疗有效量”的抗tim-3抗体药剂。“治疗有效量”是指在必要的剂量下持续必要的时间段,有效实现所需治疗结果的量。治疗有效量可根据诸如个体的疾病状态、年龄、性别和体重等因素以及抗tim-3抗体药剂在个体中引发所需反应的能力而变化。例如,抗tim-3抗体药剂的治疗有效量是降低人体中tim-3生物活性的量。
另外或替代性地,药理学和/或生理学效应可以是防治性的,即,该效应完全或部分地预防疾病或其症状。在这方面,本发明的方法包括施用“防治有效量”的抗tim-3抗体药剂。“防治有效量”是指在必要的剂量下持续必要的时间段,有效实现所需防治结果(例如,预防疾病发作)的量。
典型剂量可以,例如,在1pg/kg至20mg/kg动物或人体重的范围内;然而,低于或高于该示例性范围的剂量也在本发明的范围内。肠胃外日剂量可为约0.00001μg/kg至约20mg/kg总体重(例如,约0.001μg/kg、约0.1μg/kg、约1μg/kg、约5μg/kg、约10μg/kg、约100μg/kg、约500μg/kg、约1mg/kg、约5mg/kg、约10mg/kg,或由前述任何两个值限定的范围)。在一些实施方案中,为约0.1μg/kg至约10mg/kg总体重(例如,约0.5μg/kg、约1μg/kg、约50μg/kg、约150μg/kg、约300μg/kg、约750μg/kg、约1.5mg/kg、约5mg/kg,或由前述任何两个值限定的范围)。在一些实施方案中,为约1μg/kg至5mg/kg总体重(例如,约3μg/kg、约15μg/kg、约75μg/kg、约300μg/kg、约900μg/kg、约2mg/kg、约4mg/kg,或由前述任何两个值限定的范围)。在一些实施方案中,为每天约0.5至15mg/kg体重(例如,约1mg/kg、约2.5mg/kg、约3mg/kg、约6mg/kg、约9mg/kg、约11mg/kg、约13mg/kg,或由前述任何两个值限定的范围)。可以通过定期评估受治患者来监测治疗或防治功效。对于几天或更长时间的重复施用,根据情况,可以重复治疗直至出现对疾病症状的所需抑制,或者替代性地,治疗可持续患者一生。然而,其他剂量方案可以是有用的并且在本发明的范围内。所需剂量可通过单次推注施用组合物,通过多次推注施用组合物,或通过连续输注施用组合物来递送。
包含有效量的本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽、本发明的tim-3结合剂、编码前述任一种的本发明的核酸序列或包含本发明的核酸序列的本发明的载体的组合物可以使用标准施用技术施用给哺乳动物,包括口服、眼部、肠胃外、静脉内、腹膜内、皮下、肺部、支气管、含服、皮内,真皮内、透皮、局部、肌肉内、鼻内、含服、舌下、肠内、动脉内、胃内、特定器官内(例如,肝内)、直肠、皮下、舌下、气管、阴道、玻璃体、髓内、鞘内、心室内、粘膜或栓剂施用。在一些实施方案中,组合物适于肠胃外施用。如本文所用的术语“肠胃外”包括静脉内、肌肉内、皮下、直肠、阴道和腹膜内给药。在一些实施方案中,通过静脉内、腹膜内或皮下注射,使用外周全身递送将组合物施用于哺乳动物。哺乳动物包括例如小鼠、大鼠、兔、狗、猫、牛、马、非人灵长类动物和人。
一旦施用于哺乳动物(例如人),就可通过本领域已知的任何合适方法测量抗tim-3抗体药剂的生物活性。例如,可以通过测定特定tim-3结合剂的稳定性来评估生物活性。在一些实施方案中,抗tim-3抗体药剂(例如抗体)的体内半衰期为约30分钟至45天(例如,约30分钟、约45分钟、约1小时、约2小时、约4小时、约6小时、约10小时、约12小时、约1天、约5天、约10天、约15天、约25天、约35天、约40天、约45天或由前述任何两个值限定的范围)。在一些实施方案中,抗tim-3抗体药剂的体内半衰期为约2小时至20天(例如,约5小时、约10小时、约15小时、约20小时、约2天、约3天、约7天、约12天、约14天、约17天、约19天或由前述任何两个值限定的范围)。在一些实施方案中,抗tim-3抗体药剂的体内半衰期为约10天至约40天(例如,约10天、约13天、约16天、约18天、约20天、约23天、约26天、约29天、约30天、约33天、约37天、约38天、约39天、约40天或由前述任何两个值限定的范围)。
抗tim-3抗体药剂的稳定性可以使用本领域已知的任何其他合适的测定来测量,例如,测量血清半衰期、差示扫描量热法(dsc)、热转移测定和脉冲追踪测定。可以在本发明的背景下使用的测量体内和体外蛋白质稳定性的其他测量方法在例如proteinstabilityandfolding,b.a.shirley(编辑),humanpress,totowa,newjersey(1995);proteinstructure,stability,andinteractions(methodsinmolecularbiology),shiverj.w.(编辑),humanapress,newyork,ny(2010);和ignatova,microb.cellfact.,4:23(2005)中有描述。
抗tim-3抗体药剂的稳定性可以根据转变中点值(tm)来测量,该值是50%氨基酸序列呈其天然构象,而另外50%变性时的温度。通常,tm越高,蛋白质越稳定。在一些实施方案中,本发明的tim-3结合剂的体外转变中点值(tm)为约60-100℃。例如,抗tim-3抗体药剂的体外tm为约65-80℃(例如,66℃、68℃、70℃、71℃、75℃或79℃)、约80-90℃(例如,约81℃、85℃或89℃)或约90-100℃(例如,约91℃、约95℃或约99℃)。
还可以通过测定特定tim-3结合性抗体药剂对tim-3或其表位的结合亲和力来评估该特定tim-3结合性抗体药剂的生物活性。术语“亲和力”是指两种药剂可逆性结合的平衡常数,并且以解离常数(kd)表示。结合剂对配体的亲和力,诸如抗体对表位的亲和力,可以为,例如,约1皮摩尔(pm)至约100微摩尔(μm)(例如,约1皮摩尔(pm)至约1纳摩尔(nm),约1nm至约1微摩尔(μm),或约1μm至约100μm)。在一些实施方案中,抗tim-3抗体药剂可与tim-3蛋白结合,其kd小于或等于1纳摩尔(例如,0.9nm、0.8nm、0.7nm、0.6nm、0.5nm、0.4nm、0.3nm、0.2nm、0.1nm、0.05nm、0.025nm、0.01nm、0.001nm,或由前述任何两个值限定的范围)。在一些实施方案中,抗tim-3抗体药剂可与tim-3结合,其kd小于或等于200pm(例如,190pm、175pm、150pm、125pm、110pm、100pm、90pm、80pm、75pm、60pm、50pm、40pm、30pm、25pm、20pm、15pm、10pm、5pm、1pm,或由前述任何两个值限定的范围)。可以使用任何本领域公认的测定法来测量针对目标抗原或表位的免疫球蛋白亲和力。这些方法包括例如荧光激活细胞分选(facs)、可分离珠粒(例如,磁珠)、表面等离子体共振(spr)、溶液相竞争(kinexatm)、抗原淘选、竞争结合测定和/或elisa(参见例如,janeway等人(编辑),immunobiology,第5版,garlandpublishing,newyork,ny,2001)。
[1]抗tim-3抗体药剂可以单独施用或与其他药物组合施用。例如,抗tim-3抗体药剂可以与用于治疗或预防本文公开的疾病的其他药剂组合施用,诸如对癌细胞具有细胞毒性,调节癌细胞的免疫原性或促进对癌细胞的免疫反应的药剂。在这方面,例如,抗tim-3抗体药剂可以与至少一种其他抗癌剂,包括例如本领域已知的任何化学治疗剂、电离辐射、小分子抗癌剂、癌症疫苗、生物学疗法(例如,其他单克隆抗体、癌症杀伤病毒、基因疗法和过继性t细胞转移),和/或手术组合使用。在一些实施方案中,用抗tim-3抗体药剂治疗的受试者(例如哺乳动物,例如人)已经用或将会用化学疗法(例如,基于铂的化学疗法)治疗。在一些实施方案中,化学治疗剂是放线菌素(actinomycin)、全反式视黄酸、阿扎胞苷(azacitidine)、硫唑嘌呤(azathioprine)、博来霉素(bleomycin)、硼替佐米(bortezomib)、卡铂(carboplatin)、卡培他滨(capecitabine)、顺铂(cisplatin)、苯丁酸氮芥(chlorambucil)、环磷酰胺(cyclophosphamide)、阿糖胞苷(cytarabine)、柔红霉素(daunorubicin)、多西紫杉醇(docetaxel)、去氧氟尿苷(doxifluridine)、多柔比星(doxorubicin)、表柔比星(epirubicin)、埃博霉素(epothilone)、依托泊苷(etoposide)、氟尿嘧啶(fluorouracil)、吉西他滨(gemcitabine)、羟基脲、伊达比星(idarubicin)、伊马替尼(imatinib)、伊立替康(irinotecan)、氮芥(mechlorethamine)、巯基嘌呤(mercaptopurine)、甲氨蝶呤(methotrexate)、米托蒽醌(mitoxantrone)、奥沙利铂(oxaliplatin)、紫杉醇(paclitaxel)、培美曲塞(pemetrexed)、替尼泊苷(teniposide)、硫鸟嘌呤(tioguanine)、拓扑替康(topotecan)、戊柔比星(valrubicin)、威罗菲尼(vemurafenib)、长春碱(vinblastine)、长春新碱(vincristine)、长春地辛(vindesine)或长春瑞滨(vinorelbine)。在一些此类实施方案中,化学治疗剂是基于铂的化学治疗剂,诸如顺铂、卡铂、奥沙利铂、奈达铂(nedaplatin)、四硝酸三铂、菲铂(phenanthriplatin)、吡铂(picoplatin)或沙铂(satraplatin)。在一些此类实施方案中,化学治疗剂是叶酸抗代谢物,诸如培美曲塞。在一些实施方案中,用抗tim-3抗体药剂治疗的受试者(例如,哺乳动物,例如人)已经用或将会用抗血管生成剂治疗,例如贝伐单抗(bevacizumab)、伊曲康唑(itraconazole)、羧胺三唑、tnp-470、烟曲霉素(fumagillin)、cm101、il-12、血小板因子-4、苏拉明(suramin)、su5416、血小板反应蛋白(thrombospondin)、血管抑制类固醇、肝素、软骨源性血管生成抑制因子(例如肽肌钙蛋白i和软骨调节素i)、基质金属蛋白酶抑制剂、血管抑素、内皮抑素、2-甲氧雌二醇、替可加兰(tecogalan)、四硫钼酸盐、血小板反应蛋白、沙利度胺(thalidomide)、催乳素(prolactin)、αvβ3抑制剂、来那度胺(lenalidomide)、利诺胺(linomide)、雷莫卢单抗(ramucirumab)、他喹莫德(tasquinimod)、雷珠单抗(ranibizumab)、索拉非尼(sorafenib)、舒尼替尼(sunitinib)、帕唑帕尼(pazopanib)、依维莫司(everolimus)、金属蛋白酶组织抑制剂(timp1和timp2)、bfgf可溶性受体、转化生长因子β、干扰素α、干扰素β、可溶性kdr和flt-1受体、胎盘增殖蛋白相关蛋白、帕唑帕尼、舒尼替尼、索拉非尼、阿西替尼(axitinib)、帕纳替尼(ponatinib)、卡博替尼(cabozantinib)、瑞格非尼(regorafenib)、凡德他尼(vandetanib)、乐伐替尼(lenvatinib)、司马沙尼(semaxanib)、su6668、瓦他拉尼(vatalanib)、替沃扎尼(tivozanib)、西地尼布(cediranib)、鱼精蛋白(protamine)、肝素、类固醇,抗坏血酸醚、硫酸化多糖ds4152、烟曲霉素、agm12470、癌立消(neovastat)、ro4929097、mrk-003、mk-0752、pf03084014、medi0639、姜黄素(curcumin)、3,3'-二吲哚基甲烷(dim)、白藜芦醇(resveratrol)、3,5-双(2,4-二氟亚苄基)4-哌啶酮(difid)和表没食子儿茶素-3-没食子酸酯(egcg)、和厚朴酚(honokiol)、flt2-11、cbo-p11、je-11、v1及其任何组合。在一些实施方案中,抗tim-3抗体药剂可与抗炎剂组合使用,包括例如皮质类固醇(例如泼尼松和氟替卡松)和非类固醇抗炎药(nsaid)(例如,阿司匹林、布洛芬和萘普生)。
在一些实施方案中,抗tim-3抗体药剂用于治疗感染性疾病。当本发明的方法治疗感染性疾病时,抗tim-3抗体药剂可以与至少一种抗菌剂或至少一种抗病毒剂组合施用。在这方面,抗菌剂可以是本领域已知的任何合适的抗生素。抗病毒剂可以是特异性靶向特定病毒的任何合适类型的疫苗(例如,减毒活疫苗、亚单位疫苗、重组载体疫苗和小分子抗病毒疗法(例如,病毒复制抑制剂和核苷类似物)。
在一些实施方案中,抗tim-3抗体药剂用于治疗自身免疫性疾病。当本发明的方法治疗自身免疫性疾病时,抗tim-3抗体药剂可与抗炎剂组合使用,包括例如皮质类固醇(例如泼尼松和氟替卡松)和非类固醇抗炎药(nsaid)(例如,阿司匹林、布洛芬和萘普生)。
在一些实施方案中,当抗tim-3抗体药剂用于治疗癌症或感染性疾病时,tim-3结合剂可以与抑制免疫检查点途径的其他药剂组合施用。例如,抗tim-3抗体药剂可以与抑制或拮抗程序性死亡1蛋白(pd-1)、淋巴细胞活化基因-3蛋白(lag-3)和/或细胞毒性t淋巴细胞相关蛋白4(ctla-4)途径的药剂组合施用。同时靶向这些免疫检查点途径中的两种或更多种的组合治疗已显示出改善的和潜在协同性的抗肿瘤活性(参见,例如,sakuishi等人,j.exp.med.,207:2187-2194(2010);ngiow等人,cancerres.,71:3540-3551(2011);和woo等人,cancerres.,72:917-927(2012))。在一些实施方案中,本发明的tim-3结合剂与抑制lag-3信号传导的药剂和/或抑制pd-1信号传导的药剂组合施用。在一些实施方案中,将本发明的tim-3结合剂施用于已经施用或将会施用抑制lag-3信号传导的药剂的受试者,使得受试者接受两者的治疗。在一些实施方案中,将本发明的tim-3结合剂施用于已经施用或将会施用抑制pd-1信号传导的药剂的受试者,使得受试者接受两者的治疗。在一些实施方案中,接受本发明的tim-3药剂治疗的哺乳动物已经或将会接受用抑制pd-1的药剂和抑制lag-3的药剂进行治疗,使得哺乳动物接受所有三种。
在一些实施方案中,本发明的tim-3结合剂与结合lag-3的抗体和/或结合pd-1的抗体组合施用。在一些实施方案中,抗pd-1抗体是选自由以下项组成的组的抗体:bgb-a317、bi754091、ibi308、incshr-1210、jnj-63723283、js-001、medi-0680、mga-012、纳武单抗(nivolumab)、pdr001、帕博利珠单抗(pembrolizumab)、pf-06801591、regn-2810、tsr-042及其衍生物。在一些实施方案中,抑制pd-1的药剂是抗pd-l1/l2药剂。在一些实施方案中,抗pd-l1/l2药剂是抗pd-l1抗体。在一些实施方案中,抗pd-l1抗体药剂是阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)、cx-072、得瓦鲁单抗(durvalumab)、faz053、ly3300054、pd-l1米拉分子(millamolecule)或其衍生物。
在一些实施方案中,受试者正在接受或将会接受一种或多种与tim-3结合剂组合的附加疗法。在一些实施方案中,附加疗法是parp抑制剂。在一些实施方案中,parp抑制剂是abt-767、azd2461、bgb-290、bgp15、cep8983、cep9722、dr2313、e7016、e7449、氟唑帕利(shr3162)、imp4297、ino1001、jpi289、jpi547、单克隆抗体b3-lyspe40偶联物、mp124、尼拉帕尼(niraparib)(zejula)(mk-4827)、nu1025、nu1064、nu1076、nu1085、奥拉帕尼(olaparib)(azd2281)、ono2231、pd128763、r503、r554、芦卡帕尼(rucaparib)(rubraca)(ag-014699、pf-01367338)、sbp101、sc101914、希明哌瑞(simmiparib)、他拉唑帕尼(talazoparib)(bmn-673)、维利帕尼(veliparib)(abt-888)、ww46、2-(4-(三氟甲基)苯基)-7,8-二氢-5h-硫代吡喃并[4,3-d]嘧啶-4-醇及其盐或衍生物。在一些实施方案中,parp抑制剂是尼拉帕尼、奥拉帕尼、芦卡帕尼、他拉唑帕尼和维利帕尼。在一些实施方案中,附加疗法包括用递送抑制pd-1的药剂的组合物治疗和用parp抑制剂治疗,使得受试者接受用所有三种治疗。在一些实施方案中,附加疗法包括用递送抑制pd-1的药剂的组合物治疗,用递送抑制lag-3的药剂的组合物治疗,和用parp抑制剂治疗,使得受试者接受用所有四种治疗。
在这方面,治疗哺乳动物的对tim-3抑制有反应的病症(例如,癌症或感染性疾病)的方法还可包括向哺乳动物施用包含(i)与tim-3蛋白结合的抗体和(ii)药学上可接受的载剂的组合物,或包含(i)与pd-1蛋白结合的抗体和(ii)药学上可接受的载剂的组合物。哺乳动物包括例如小鼠、大鼠、兔、狗、猫、牛、马、非人灵长类动物和人。
除治疗用途外,本文所述的抗tim-3抗体药剂可用于诊断或研究应用。在这方面,抗tim-3抗体药剂可用于诊断以下病症或疾病的方法中,其中tim-3的不正确表达(例如,过表达)或活性增加引起或促成该疾病或病症的病理学效应。以类似的方式,抗tim-3抗体药剂可用于测定中以监测正在检测对tim-3抑制有反应的疾病或病症的受试者中的tim-3蛋白水平。研究应用包括,例如,利用抗tim-3抗体药剂和标记物检测样品中,例如人体液或细胞或组织提取物中的tim-3蛋白的方法。抗tim-3抗体药剂可以在有或没有修饰(例如经可检测部分的共价或非共价标记)的情况下使用。例如,可检测部分可以是放射性同位素(例如,3h、14c、32p、35s或125i),荧光或化学发光化合物(例如,异硫氰酸荧光素、若丹明或荧光素)、酶(例如,碱性磷酸酶、β-半乳糖苷酶或辣根过氧化物酶)或辅基。本领域已知的用于将抗原结合剂(例如,抗体)单独偶联至可检测部分的任何方法均可在本发明的背景下采用(参见,例如,hunter等人,nature,194:495-496(1962);david等人,biochemistry,13:1014-1021(1974);pain等人,j.immunol.meth.,40:219-230(1981);和nygren,j.histochem.andcytochem.,30:407-412(1982))。
tim-3蛋白水平可以使用本发明的tim-3结合剂通过本领域已知的任何合适方法测量。这些方法包括,例如放射免疫测定(ria)和facs。tim-3的正常或标准表达值可以使用任何合适的技术确定,例如,通过在适于形成抗原-抗体复合物的条件下,将包含或怀疑包含tim-3的样品与tim-3特异性抗体组合。用可检测物质直接或间接标记抗体,以利于检测结合或未结合的抗体。合适的可检测物质包括各种酶、辅基、荧光材料、发光材料和放射性材料(参见,例如,zola,monoclonalantibodies:amanualoftechniques,crcpress,inc.(1987))。然后将样品中表达的tim-3多肽的量与标准值进行比较。
抗tim-3抗体药剂可以在试剂盒,例如预定量的试剂与用于进行诊断测定的说明书的包装组合中提供。如果抗tim-3抗体药剂经酶标记,则试剂盒理想地包括酶所需的底物和辅因子(例如,提供可检测发色团或荧光团的底物前体)。另外,试剂盒中可以包括其他添加剂,诸如稳定剂、缓冲剂(例如封闭缓冲剂或裂解缓冲剂)等。可以改变各种试剂的相对量以提供溶液中大幅优化测定灵敏度的试剂浓度。所述试剂可呈干粉(通常是冻干的)提供,其包括在溶解时将会提供具有适当浓度的试剂溶液的赋形剂。
在以下示例性实施方案的描述过程中,本发明的其他特征将变得显而易见,示例性实施方案是为了说明本发明而给出的,而非旨在限制本发明。
范例
实施例1-对某些示例性抗tim-3抗体的描述
该实施例描述了特定抗tim-3抗体重链多肽和轻链多肽序列以及编码它们的核酸。
抗tim-3抗体重链多肽(seqidno:1)
evqllesggglvqpggslrlscaaasgftfssydmswvrqapgkgldwvstisgggtytyyqdsvkgrftisrdnskntlylqmnslraedtavyycasmdywgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
抗tim-3抗体轻链多肽(seqidno:2)
diqmtqspsslsasvgdrvtitcrasqsirrylnwyhqkpgkapklliygastlqsgvpsrfsgsgsgtdftltisslqpedfavyycqqshsapltfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
具有信号序列的抗tim-3抗体重链多肽(seqidno:5)
mefglswlflvailkgvqcevqllesggglvqpggslrlscaaasgftfssydmswvrqapgkgldwvstisgggtytyyqdsvkgrftisrdnskntlylqmnslraedtavyycasmdywgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
具有信号序列的抗tim-3抗体轻链多肽(seqidno:6)
mdmrvpaqllgllllwlrgarcdiqmtqspsslsasvgdrvtitcrasqsirrylnwyhqkpgkapklliygastlqsgvpsrfsgsgsgtdftltisslqpedfavyycqqshsapltfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
编码抗tim-3抗体重链多肽的核苷酸序列(seqidno:3)
编码抗tim-3抗体轻链多肽的核苷酸序列(seqidno:4)
以上序列描述了利用人ighg4*01重链基因和人igkc*01κ轻链基因作为支架的示例性人源化单克隆抗tim-3抗体。在igg4重链的铰链区中存在单个ser至pro的点突变。该突变位于规范的s228位置,对应于包括信号序列的seqidno:5中的残基240。不希望受理论束缚,设想该点突变用于稳定抗体重链的铰链。
该实施例进一步描述了该示例性人源化单克隆抗tim-3抗体的生物物理和生物化学表征。将lys-c和胰蛋白酶消化的肽很好地分离并通过在线lc-ms分析进行检测。通过比较非还原(nr)条件与还原条件下的总离子色谱图来确认二硫键键合。二硫键与igg4分子的预期二硫键模式一致。预期链间和链内二硫连键中涉及的残基列于下表(表1、2和3)。
表1–具有如seqidno:1所示氨基酸序列的示例性抗tim-3抗体药剂重链的二硫连键中涉及的预期残基。
表2–具有如seqidno:2所示氨基酸序列的示例性抗tim-3抗体药剂轻链的二硫连键中涉及的预期残基。
表3.抗tim-3抗体的示例性二硫键分配
lc:轻链;hc:重链
该示例性抗tim-3抗体在成熟蛋白质序列中的每条重链(seqidno:1)的ch2结构域中的天冬酰胺残基290处显示出被占用的n-糖基化位点。该位点表达的n-糖基化是通常在哺乳动物细胞培养物中表达的igg上观察到的寡糖物质的混合物,例如,下面显示的是来自于在中国仓鼠卵巢(cho)细胞中培养的这种示例性抗tim-3抗体的制剂中的聚糖物质的相对丰度(表4)。
表4-抗tim-3抗体结合剂的聚糖分析
实施例2-示例性抗tim-3抗体与重组tim-3的结合
该实施例描述了示例性抗tim-3抗体(具有分别如seqidno:1和2中所示的重链和轻链)与重组tim-3多肽的结合。具体地说,该实施例证明了正如分别使用表面等离振子共振(spr)和流式细胞术所测定的,示例性抗体与可溶性tim-3融合物和细胞表达的重组tim-3的高亲和力结合。
使用biacoret200进行spr分析,并使用biacoret200评估软件测定动力学常数。选择实验参数使得在最高抗原浓度下达到饱和并且rmax值保持在50反应单位(ru)以下。使用edc活化的胺偶联化学将ge抗小鼠igg(fc特异性)固定在biacorecm5芯片上。然后将二聚体可溶性人tim-3migg2afc捕获到该表面上达到约70ru或更低的目标捕获水平。接下来,使示例性抗tim-3抗体(分别具有如seqidno:1和2中所示的重链和轻链)流过具有被捕获的抗原(tim-3融合体)的表面。捕获和分析物结合在hbs-ep+缓冲液中进行。在每个循环之间除去捕获的抗原和抗体,以确保每种抗原浓度具有新的结合表面。使用1:1结合模型全局拟合所得的传感图以计算缔合和解离速率(分别为k缔合和k解离)和解离常数作为总亲和力(kd)的量度。spr测量证明示例性抗tim-3抗体以高亲和力与人和食蟹猴tim-3结合,kd估计分别为7和17pm(表4)。进一步的结合分析确定了示例性抗tim-3抗体基本上不与人tim-1多肽或人pd-1多肽结合(数据未显示)。
用cho-k1细胞系克隆进行流式细胞术研究,其中稳定转染天然人或食蟹猴tim-3。将示例性抗tim-3抗体(具有分别如seqidno:1和2中所示的重链和轻链)稀释成3倍稀释液。将示例性抗体的稀释液添加到表达人或食蟹猴tim-3的cho-k1细胞(1e5个细胞)中并在冰上孵育。将细胞洗涤两次并在冰上与pe偶联的山羊抗人igg4一起孵育以检测抗体结合。洗涤细胞并在碘化丙啶存在下重悬以排除死细胞,并且固定然后在bdfacsarray(bdbiosciences)上分析荧光。使用非线性(s形)回归分析,在graphpadprism(graphpadsoftware,inc.)中分析数据的中值荧光强度,绘图并进行曲线拟合以计算ec50值。发现该示例性抗tim-3抗体与细胞表面人和食蟹猴tim-3结合,ec50分别为0.17和0.27nm(表5)。
表5.通过表面等离子体共振(spr)和表达tim-3的cho-k1细胞检测的示例性抗tim-3抗体与tim-3的结合
k缔合=缔合速率常数;k解离=解离速率常数;kd=解离常数。
该实施例证明,本发明范围内的抗tim-3抗体可以高亲和力特异性结合tim-3多肽。
实施例3–tim-3阻断增强耗竭的免疫细胞中的t细胞活化
该实施例描述了示例性抗tim-3抗体药剂在特征在于pd-1和tim-3表达增加的体外t细胞耗竭模型中的表征(图2a)。具体地,从mbp-tracker小鼠中取出脾脏并处理以产生脾细胞的单细胞悬液。将细胞以3x106个/ml重悬,并用wt-mbp或apl-mbp刺激72小时。刺激后,通过ficoll密度梯度纯化t细胞,随后以2x106个/ml在20u/mlil-2中重新铺板保持四天。4天后,收集细胞,重悬(4x105个/ml,最终每孔2x104个),并使用经辐射的apc(来自b10plxc57bl/6小鼠,4x106个/ml,最终每孔2x105个)、单剂量的apl-mbp肽连同测试或参考物质或适当的对照再刺激72小时。收集培养物上清液并冷冻储存用于随后的评估。
通过elisa评估细胞因子的产生情况表明tim-3阻断显著增强了该系统中ifn-γ的产生(图2b)。因此,该实施例证明了抗tim-3抗体可以激活耗竭的免疫细胞。
已经这样描述了本发明的至少几个方面和实施方案,应当理解,各种改变、修改和改进对于本领域技术人员来说将是显而易见的。此类改变、修改和改进旨在成为本公开的一部分,并且旨在落入本发明的精神和范围内。因此,前面的描述仅仅是作为例子,并且本发明通过后面的权利要求得以详细描述。
本文引用的所有参考文献,包括出版物、专利申请和专利均据此通过引用并入,其程度如同单独且明确地指出每个参考文献通过引用并入并且在本文中进行整体阐述一样。
除非本文另有说明或明确与上下文相矛盾,否则在描述本发明的上下文中(尤其是在以下权利要求的上下文中)使用术语“一”和“一个(种)”和“所述(该)”和“至少一个(种)”以及类似的指示物应解释为涵盖单数和复数两种。除非本文另有说明或明确与上下文相矛盾,否则使用术语“至少一个(种)”,后面是一项或多项的列表(例如,“a和b中的至少一个”),应解释为意指从所列项中选择的一项(a或b)或所列项(a和b)中的两个或更多个的任何组合。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应解释为开放式术语(即,意指“包括但不限于”)。除非本文另有说明,否则本文中对数值范围的叙述仅仅旨在用作单独提及落入该范围内的每个单独的值的简写方法,并且将每个单独的值并入本说明书中,如同本文对其单独叙述一样。除非本文另有说明或明确与上下文相矛盾,否则本文所述的所有方法均可按任何合适的顺序进行。除非另外要求,否则本文提供的任何及所有实例或示例性语言(例如,“诸如”)的使用仅仅旨在更好地说明本发明,而不是对本发明的范围构成限制。说明书中的任何语言都不应解释为表示任何未要求保护的要素对于本发明的实践是必不可少的。
- 还没有人留言评论。精彩留言会获得点赞!