羊乳寡糖测定方法与流程
本发明涉及一种羊乳寡糖分离及测定方法。
背景技术:
乳是一种复杂的营养成分包括脂肪、蛋白质、碳水化合物,其中乳也提供了哺乳动物的营养需要。在碳水化合物中乳糖的含量超过80%,而游离乳寡糖含量占总糖的4%左右,因此乳糖的去除对于乳寡糖的分析产生了重要的作用。
研究证明,乳寡糖可以平衡肠道微生物群以调节免疫系统,唾液酸化的寡糖可以促进脑发育,并且作为半乳糖的来源用于合成半乳糖脑苷脂,唾液酸用于脑灰质中的神经节苷脂以及糖蛋白产生。研究发现,人乳中含有200余种低聚糖,然而,由于大小,电荷和结构的差异性,迄今为止,只有低分子量的人乳低聚糖可以通过化学方法合成。因此,寻找具有类似于人乳低聚糖生物活性的替代来源并应用于婴儿配方食品已引起人们的关注。羊乳是婴幼儿配方粉的重要乳基料之一,有研究表明羊乳中低聚糖含量约为0.25-0.30g/l,是牛乳低聚糖含量的8倍左右,是潜在的母乳低聚糖替代物。但由于检测方法的限制及技术壁垒,我国羊乳中低聚糖结构的研究较为落后,因此建立有效的羊乳低聚糖检测手段对我国羊乳低聚糖研究具有重要意义。
基于这些生理功能,人们开始关注于乳寡糖的研究。国内对于羊乳寡糖结构的研究鲜有报道,且并没有一个羊乳寡糖的检测方法。低聚糖的分离和纯化是低聚糖检测的关键,因其自身组成、连接、衍生化、微观不均一性等方面的高度复杂性,使其监测具有很大困难。在对羊乳中的低聚糖进行分析时,一些高丰度的低聚糖会遮盖低丰度低聚糖的检测信号,阻碍了低聚糖的完全鉴定,这就需要对低聚糖样品进行富集纯化操作,减少杂质的混合,提高检测的灵敏度。由于羊乳中乳糖含量较高,而低聚糖的含量较低,分离低含量成分的难度很大,另一个方面,羊乳中寡糖的单糖个数一般为3-10之间,分子量相近,更是增加了操作难度,同时,同分异构体的保留时间和质谱图又非常相似,给定性带来很大困难。因此选择合适的方法,对羊乳寡糖进行分离并测定,是一项探索性很强的工作。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种羊乳寡糖测定方法,通过凝胶柱层析,实现了对低聚糖测定影响物质乳糖的有效去除,获得羊乳寡糖样品,随后利用高效阴离子交换色谱对乳糖去除率及低聚糖保留率进行定量分析,利用超高效液相q-exactivefocus质谱对羊乳低聚糖进行鉴定,通过对液相条件的优化实现了对羊乳寡糖同分异构体的定性及定量分析。采用本发明所述测定方法,最终鉴定出了49种羊乳寡糖并实现了对该49种羊乳寡糖结构组成的分析,分离效果好,且样品无需衍生化,保留了寡糖的原始结构,另外操作过程简单,结果稳定,重复性好。
为了实现根据本发明的这些目的和其它优点,提供了一种羊乳寡糖测定方法,包括以下步骤:
步骤一、对羊乳脱脂、脱蛋白,提取羊乳寡糖粗品;
步骤二、对所述羊乳寡糖粗品利用sephadex-g10凝胶柱除乳糖,得到羊乳寡糖样品;
步骤三、利用carbopactmpa20糖分离柱对所述羊乳寡糖样品的乳糖脱除率及低聚糖保留率进行测定;
步骤四、优化液相条件并采用超高效液相q-exactivefocus质谱对所述羊乳寡糖样品的成分及结构进行定性及定量分析。
优选的是,所述步骤一中,羊乳脱脂、脱蛋白的具体方法为:
取羊乳在3~8℃、8000~10000rpm条件下离心15~30min,去除上层的脂肪和底部少量的蛋白质,取出中间层按体积比1:2~1:6的比例加入无水乙醇,温度为-80~4℃下反应2~12h,反应结束后在3~8℃下4000×g离心15~30min,取上清液,干燥,得到所述羊乳寡糖粗品。
优选的是,所述干燥采用真空浓缩仪浓缩干燥。
优选的是,所述步骤二中,除乳糖的具体方法包括:
首先将sephadex-g10凝胶放置在烧杯中用超纯水浸泡10~15h,真空泵除气泡1~2h后加入层析柱中,所述层析柱的规格为1.6×60cm,然后使用超纯水在流速为2.5~3ml/min下预压12h;
将所述羊乳寡糖粗品上样到sephadex-g10凝胶柱中,采用超纯水为洗脱液,流速为2~2.5ml/min,利用自动收集器每2min收集一次过柱液体,所述过柱液体经苯酚-硫酸法检测,置于-80℃冰箱中备用。
优选的是,其特征在于,所述步骤三中,测定乳糖脱除率及低聚糖保留率的具体方法为:
采用超纯水作为流动相a,250mmnaoh作为流动相b,柱温为35℃,以0.4ml/min的流速对所述羊乳寡糖样品进行梯度洗脱,梯度洗脱的条件:0-40.1min,7.2%-100%a;40.2-45min,100%-100%a;45.1-55min,100%-7.2%a;剩余液相部分为流动相b。采用金电极脉冲安培检测器,检测样品中乳糖含量,并收集含有羊乳寡糖的收集管。
优选的是,所述步骤四中,超高效液相q-exactivefocus质谱的液相条件为:
采用acquityuplc氨基色谱柱,色谱柱规格2.1mm×100mm,柱填料粒径为1.5~2μm,柱温30~40℃,流速0.2~0.5ml/min,流动相a为乙腈,流动相b为10mm甲酸铵,梯度洗脱的条件为:0-20min,95%-78%a;20-35min,78%-73%a;35-38min,73-62%a;38-45min,62%-50%a;45-55min,50%-95%a;55-65min,95%-95%a;液相剩余部分为流动相b。
优选的是,所述步骤四中,超高效液相q-exactivefocus质谱的质谱条件为:
电喷雾离子源:正离子模式和负离子模式喷雾电压均为5~20kv。一级离子的质量扫描范围300--2000m/z,柱温为30~40℃。
本发明至少包括以下有益效果:
本发明利用sephadex-g10凝胶柱对已脱脂和脱蛋白的羊乳进行分离纯化,有效去除影响物质乳糖,再通过液相条件的优化对低聚糖同分异构体进行定性及定量分析,最后通过质谱仪器的合理设定,鉴定出了羊乳中49种羊乳寡糖成分,并实现了对该49种羊乳寡糖结构的分析。
本发明测定方法简单可行,结果稳定,可用于羊乳寡糖的纯化分离和测定。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明实施例1中羊乳寡糖样品的总离子流图。
图2为本发明实施例1中羊乳寡糖样品中hex2neu5ac1的异构体的总离子流图。
图3为本发明实施例2中羊乳寡糖样品的总离子流图。
图4为本发明实施例2中羊乳寡糖样品中hex2neu5ac1的异构体的总离子流图。
图5为本发明实施例3中羊乳寡糖样品的总离子流图。
图6为本发明实施例3中羊乳寡糖样品中hex2neu5ac1的异构体的总离子流图。
图7为本发明实施例3中羊乳寡糖粗品的离子色谱图。
图8为本发明实施例3中羊乳寡糖样品的离子色谱图。
图9为对比例1中羊乳寡糖样品的离子色谱图。
图10为对比例2中羊乳寡糖样品的离子色谱图。
图11为对比例3中羊乳寡糖样品的离子色谱图。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
本发明所述羊乳寡糖测定方法,包括以下步骤:
步骤一、对羊乳脱脂、脱蛋白,提取羊乳寡糖粗品;
步骤二、对所述羊乳寡糖粗品利用sephadex-g10凝胶柱除乳糖,得到羊乳寡糖样品;
步骤三、利用carbopactmpa20糖分离柱对所述羊乳寡糖样品的乳糖脱除率及低聚糖保留率进行测定;
步骤四、优化液相条件并采用超高效液相q-exactivefocus质谱对所述羊乳寡糖样品的成分及结构进行定性及定量分析。
在一个实施例中,所述步骤一中,羊乳脱脂、脱蛋白的具体方法为:
取羊乳在3~8℃、8000~10000rpm条件下离心15~30min,去除上层的脂肪和底部少量的蛋白质,取出中间层按体积比1:2~1:6的比例加入无水乙醇,温度为-80~4℃下反应2~12h,反应结束后在3~8℃下4000×g离心15~30min,取上清液,干燥,得到所述羊乳寡糖粗品。
在一个实施例中,所述干燥采用真空浓缩仪浓缩干燥。
在一个实施例中,所述步骤二中,除乳糖的具体方法包括:
首先将sephadex-g10凝胶放置在烧杯中用超纯水浸泡10~15h,真空泵除气泡1~2h后加入层析柱中,所述层析柱的规格为1.6×60cm,然后使用超纯水在流速为2.5~3ml/min下预压12h;
将所述羊乳寡糖粗品上样到sephadex-g10凝胶柱中,采用超纯水为洗脱液,流速为2~2.5ml/min,利用自动收集器每2min收集一次过柱液体,所述过柱液体经苯酚-硫酸法检测,置于-80℃冰箱中备用。
在一个实施例中,其特征在于,所述步骤三中,测定乳糖脱除率及低聚糖保留率的具体方法为:
采用超纯水作为流动相a,250mmnaoh作为流动相b,柱温为35℃,以0.4ml/min的流速对所述羊乳寡糖样品进行梯度洗脱,梯度洗脱的条件:0-40.1min,7.2%-100%a;40.2-45min,100%-100%a;45.1-55min,100%-7.2%a;剩余液相部分为流动相b。采用金电极脉冲安培检测器,检测样品中乳糖含量,并收集含有羊乳寡糖的收集管。
在一个实施例中,所述步骤四中,超高效液相q-exactivefocus质谱的液相条件为:
采用acquityuplc氨基色谱柱,色谱柱规格2.1mm×100mm,柱填料粒径为1.5~2μm,柱温30~40℃,流速0.2~0.5ml/min,流动相a为乙腈,流动相b为10mm甲酸铵,梯度洗脱的条件为:0-20min,95%-78%a;20-35min,78%-73%a;35-38min,73-62%a;38-45min,62%-50%a;45-55min,50%-95%a;55-65min,95%-95%a;液相剩余部分为流动相b。
在一个实施例中,所述步骤四中,超高效液相q-exactivefocus质谱的质谱条件为:电喷雾离子源:正离子模式和负离子模式喷雾电压均为5~20kv。一级离子的质量扫描范围300--2000m/z,柱温为30~40℃。
实施例1
步骤一、对羊乳脱脂、脱蛋白。取羊乳在4℃、10000rpm条件下离心30min,去除上层的脂肪和底部少量的蛋白质,取出中间层按体积比1:2的比例加入无水乙醇,温度为-20℃下反应4h,反应结束后在4℃下4000×g离心30min,取上清液,真空浓缩仪浓缩干燥,得到所述羊乳寡糖粗品。
步骤二、对所述羊乳寡糖粗品利用sephadex-g10凝胶柱进行纯化除乳糖。首先将sephadex-g10凝胶放置在烧杯中用超纯水浸泡12h,除气泡2h,然后加入层析柱中,所述层析柱的规格为3.6×60cm,然后使用超纯水在流速为2.5ml/min下预压12h。将所述羊乳寡糖粗品上样到sephadex-g10凝胶柱中,采用超纯水为洗脱液,流速为2.5ml/min,利用自动收集器每2min收集一次过柱液体,用苯酚-硫酸法检测所述过柱液体,在收集到第12管时出现颜色变化,将所述第12管以后出现颜色变化的过柱液置于-80℃冰箱中备用。
步骤三、利用carbopactmpa20糖分离柱对所述纯化的羊乳寡糖样品进行定量分析,采用超纯水作为流动相a,250mmnaoh作为流动相b,柱温为35℃,以0.4ml/min的流速对所述纯化的羊乳寡糖液体进行梯度洗脱,梯度洗脱的条件:0-40.1min,7.2%-100%a;40.2-45min,100%-100%a;45.1-55min,100%-7.2%a;剩余液相部分为流动相b。采用金电极脉冲安培检测器,检测样品中乳糖含量,并收集含有羊乳寡糖的收集管。
步骤四、采用超高效液相q-exactivefocus质谱对所述纯化的羊乳寡糖样品的成分及结构进行定性分析。
所述超高效液相q-exactivefocus质谱的液相条件为:采用acquityuplc氨基色谱柱,色谱柱规格2.1mm×100mm,柱填料粒径为1.7μm,柱温35℃,流速0.2ml/min,流动相a为乙腈,流动相b为10mm甲酸铵,梯度洗脱的条件为:0-18min,95%-68%a;18-30min,68%-62%a;30-38min,62%-50%a;液相剩余部分为流动相b。
所述超高效液相q-exactivefocus质谱的质谱条件为:电喷雾离子源:正离子模式和负离子模式喷雾电压均为20kv。一级离子的质量扫描范围300--2000m/z,柱温为35℃。
实施例2
步骤一、对羊乳脱脂、脱蛋白。取羊乳在4℃、10000rpm条件下离心30min,去除上层的脂肪和底部少量的蛋白质,取出中间层按体积比1:2的比例加入无水乙醇,温度为-20℃下反应4h,反应结束后在4℃下4000×g离心30min,取上清液,真空浓缩仪浓缩干燥,得到所述羊乳寡糖粗品。
步骤二、对所述羊乳寡糖粗品利用sephadex-g10凝胶柱进行纯化除乳糖。首先将sephadex-g10凝胶放置在烧杯中用超纯水浸泡12h,除气泡2h,然后加入层析柱中,所述层析柱的规格为3.6×60cm,然后使用超纯水在流速为2.5ml/min下预压12h。将所述羊乳寡糖粗品上样到sephadex-g10凝胶柱中,采用超纯水为洗脱液,流速为2.5ml/min,利用自动收集器每2min收集一次过柱液体,用苯酚-硫酸法检测所述过柱液体,在收集到第12管时出现颜色变化,将所述第12管以后出现颜色变化的过柱液置于-80℃冰箱中备用。
步骤三、利用carbopactmpa20糖分离柱对所述纯化的羊乳寡糖样品进行定量分析,采用超纯水作为流动相a,250mmnaoh作为流动相b,柱温为35℃,以0.4ml/min的流速对所述纯化的羊乳寡糖液体进行梯度洗脱,梯度洗脱的条件:0-40.1min,7.2%-100%a;40.2-45min,100%-100%a;45.1-55min,100%-7.2%a;剩余液相部分为流动相b。采用金电极脉冲安培检测器,检测样品中乳糖含量,并收集含有羊乳寡糖的收集管。
步骤四、采用超高效液相q-exactivefocus质谱对所述纯化的羊乳寡糖样品的成分及结构进行定性分析。
所述超高效液相q-exactivefocus质谱的液相条件为:采用acquityuplc氨基色谱柱,色谱柱规格2.1mm×100mm,柱填料粒径为1.7μm,柱温35℃,流速0.2ml/min,流动相a为乙腈,流动相b为10mm甲酸铵,梯度洗脱的条件为:0-18min,95%-74%a;18-30min,74%-69%a;30-38min,69%-62%a;38-45min,62%-50%a;液相剩余部分为流动相b。
所述超高效液相q-exactivefocus质谱的质谱条件为:电喷雾离子源:正离子模式和负离子模式喷雾电压均为20kv。一级离子的质量扫描范围300--2000m/z,柱温为35℃。
实施例3
步骤一、对羊乳脱脂、脱蛋白。取羊乳在4℃、10000rpm条件下离心30min,去除上层的脂肪和底部少量的蛋白质,取出中间层按体积比1:2的比例加入无水乙醇,温度为-20℃下反应4h,反应结束后在4℃下4000×g离心30min,取上清液,真空浓缩仪浓缩干燥,得到所述羊乳寡糖粗品。
步骤二、对所述羊乳寡糖粗品利用sephadex-g10凝胶柱进行纯化除乳糖。首先将sephadex-g10凝胶放置在烧杯中用超纯水浸泡12h,除气泡2h,然后加入层析柱中,所述层析柱的规格为3.6×60cm,然后使用超纯水在流速为2.5ml/min下预压12h。将所述羊乳寡糖粗品上样到sephadex-g10凝胶柱中,采用超纯水为洗脱液,流速为2.5ml/min,利用自动收集器每2min收集一次过柱液体,用苯酚-硫酸法检测所述过柱液体,在收集到第12管时出现颜色变化,将所述第12管以后出现颜色变化的过柱液置于-80℃冰箱中备用。
步骤三、利用carbopactmpa20糖分离柱对所述纯化的羊乳寡糖样品进行定量分析,采用超纯水作为流动相a,250mmnaoh作为流动相b,柱温为35℃,以0.4ml/min的流速对所述纯化的羊乳寡糖液体进行梯度洗脱,梯度洗脱的条件:0-40.1min,7.2%-100%a;40.2-45min,100%-100%a;45.1-55min,100%-7.2%a;剩余液相部分为流动相b。采用金电极脉冲安培检测器,检测样品中乳糖含量,并收集含有羊乳寡糖的收集管。
步骤四、采用超高效液相q-exactivefocus质谱对所述纯化的羊乳寡糖样品的成分及结构进行定性分析。
所述超高效液相q-exactivefocus质谱的液相条件为:采用acquityuplc氨基色谱柱,色谱柱规格2.1mm×100mm,柱填料粒径为1.7μm,柱温35℃,流速0.2ml/min,流动相a为乙腈,流动相b为10mm甲酸铵,梯度洗脱的条件为:0-20min,95%-78%a;20-35min,78%-73%a;35-38min,73-62%a;38-45min,62%-50%a;液相剩余部分为流动相b。
所述超高效液相q-exactivefocus质谱的质谱条件为:电喷雾离子源:正离子模式和负离子模式喷雾电压均为20kv。一级离子的质量扫描范围300--2000m/z,柱温为35℃。
对比例1
第二步采用sep-pakc18和石墨化柱法对羊乳寡糖粗品进行纯化和富集,首先用5ml的甲醇平衡sep-pakc18柱,然后用10ml(0.1%tfa)超纯水溶液冲洗sep-pakc18柱。将羊乳寡糖粗品溶于400μl(0.1%tfa)超纯水溶液,然后加到sep-pakc18柱中。收集洗脱液,将洗脱液再次加入sep-pakc18柱中(此步骤重复两次)。最后用3ml(0.1%tfa)超纯水溶液冲洗sep-pakc18柱,收集洗脱液,此洗脱液即为纯化的羊乳寡糖样品。利用石墨化柱对纯化的羊乳寡糖样品除盐,首先采用3倍柱体积80%的乙腈溶液(20%的含有0.1%tfa的溶液)和超纯水分别活化和平衡石墨化柱。将sep-pakc18柱的洗脱液上样,收集洗脱液(流速0.5~1.0ml/min),此步骤重复两次。用3倍柱体积的超纯水冲洗柱子,目的吸附柱底pgc填料上的寡糖,以便于除盐。最后用0.5ml10%乙腈溶液(90%含有0.1%tfa的溶液)、20%乙腈溶液(80%含有0.1%tfa的溶液)、40%乙腈溶液(60%含有0.1%tfa的溶液)将寡糖分步洗脱,获得纯化富集后的羊乳寡糖样品。其他步骤同实施例3。
对比例2
第二步采用超滤膜包法对羊乳寡糖粗品进行纯化,取50ml羊乳寡糖粗品,利用截留分子量为650da的超滤膜对其进行过滤分离,过滤时间分别为4h,5h,6h,获得过滤液为纯化的羊乳寡糖样品。其他步骤同实施例3。
对比例3
第二步采用透析法对羊乳寡糖粗品进行纯化,将羊乳寡糖粗品加入到截留分子量为1000da的透析袋中,放置4℃冰箱24h,每隔8h换一次水,换3次水后,透析袋内溶液不再增加,获得纯化的羊乳寡糖样品。其他步骤同实施例3。
下面对各实施例和对比例的试验结果及分析:
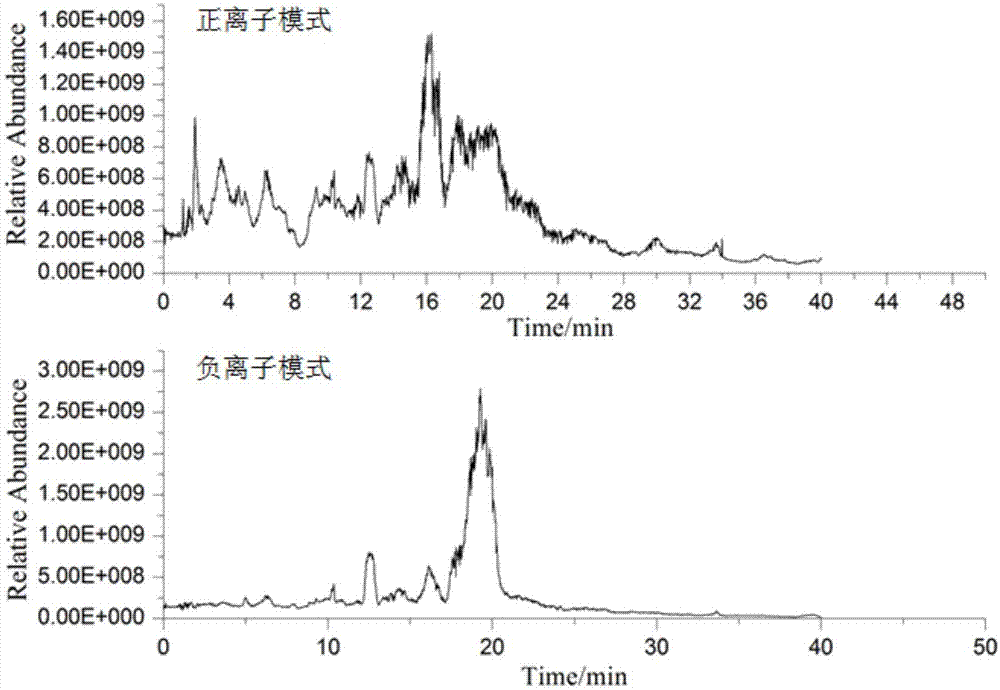
各实施例中羊乳寡糖样品经高效液相色谱分离后的总离子流图如图1-3所示。实施例1中液相的洗脱条件为0-18min,95%-68%a;18-30min,68%-62%a;30-38min,62%-50%a,由图1可知18-22min之间的峰并没有分开,图2中hex2neu5ac1-1和hex2neu5ac1-2异构体在正负离子模式下也没有分开。参照高效液相色谱分离的原则和xbridge氨基柱的特点进行后续的高效液相色谱条件的优化,实施例2中液相的洗脱条件优化为0-18min,95%-74%a;18-30min,74%-69%a;30-38min,69%-62%a;38-45min,62%-50%a,结合图3和图4可知,总离子流图中保留时间在20-27min之间的峰没被分开,但可以看出其他保留时间的峰明显被分开,同时hex2neu5ac1-1和hex2neu5ac1-2异构体相交的峰面积减少,说明优化效果明显。进一步优化液相条件,实施例3中液相的洗脱条件优化为0-20min,95%-78%a;20-35min,78%-73%a;35-38min,73-62%a;38-45min,62%-50%a,图5色谱峰基本被分开,图6中hex2neu5ac1-1和hex2neu5ac1-2异构体也明显被分开且效果较好。
利用本发明所述carbopactmpa20糖分离柱对实施例3中所述羊乳寡糖粗品和羊乳寡糖样品以及各对比例中所述羊乳寡糖样品进行测定,定量分析其乳糖含量,结果如表1所示:
表1乳糖的去除率
由表1可知,通过对比例2所述方法对羊乳寡糖粗品进行纯化除乳糖,结果显示乳糖的去除率最低,仅为38.4%,说明所述测定方法乳糖去除率低,分离效果不佳。对比例1和对比例3所述测定方法,结果显示样品乳糖含量低,乳糖去除率高,但结合离子色谱图9和图11可知二者乳糖和乳寡糖含量均很低,说明对比例1和对比例3所述测定方法虽然乳糖去除率高,但羊乳寡糖也有很大程度的损耗,分离效果均不佳。本发明所述测定方法,乳糖去除率很高,对比图8可知其既能对乳糖很好的分离,实施过程中又不对羊乳寡糖产生损耗,分离效果好,且便于操作。
将羊乳寡糖粗品和实施例纯化后的羊乳寡糖样品用本发明所述优化好的流动相条件通过超高效液相q-exactivefocus质谱测定,分析二者乳寡糖成分及结构,测定结果如表2、表3所示。表2为未纯化前所述羊乳寡糖粗品的质谱结果,结果显示未纯化前所述羊乳寡糖粗品中可测定出18种羊乳寡糖的结构,表3为纯化后的羊乳寡糖样品的质谱结果,结果显示经本发明所述测定方法可检测出49种羊乳寡糖结构。
由以上结果可知,本发明所述羊乳寡糖测定方法,操作过程简单,分离效果好,可从羊乳中检测出49种羊乳寡糖结构。
表2羊乳寡糖粗品中检测到羊乳寡糖结构
注:+正离子模式下检测到的低聚糖;-负离子模式下检测到的低聚糖
表3实施例3中检测到的羊乳寡糖结构
注:+正离子模式下检测到的低聚糖;-负离子模式下检测到的低聚糖
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!