DNA微囊及金电极-DNA树枝状大分子传感器的制备方法以及在检测多氯联苯中的应用与流程
本发明属于电化学传感器技术领域,具体涉及一种dna微囊及金电极-dna树枝状大分子传感器的制备方法以及在检测多氯联苯中的应用,具体涉及一种基于目标物pcb-72触发dna微囊释放亚甲基蓝信号分子及互补dna引发非线性杂交链式反应构建出金电极-dna树枝状大分子传感器进而实现对多氯联苯的超灵敏检测。
背景技术:
多氯联苯(pcbs)是一种持久性的有机化学污染物,虽然作为热载体、绝缘油、润滑油等在工业中得到了广泛应用,却会造成严重的环境污染问题。pcbs不仅很难分解,而且会通过皮肤、呼吸道、消化道被人体吸收。严重危及到人们的生存与健康。甚至超痕量的pcbs也会在人体组织中富集。
当前出现的高效分析检测pcbs有气相色谱/高分辨率质谱(gc/hrms)、气相色谱/电子捕获检测器(gc/ecd)、高效液相色谱/光电二极管阵列(hplc/pda)等方法通常需要复杂的设备以及熟练的操作技术。因此,与免疫认知以及不同信号资料(如荧光、电化学、比色等)相联系的更新颖、简便、高效的生物传感技术被运用于pcbs的检测中。但由于抗体的处理繁琐且昂贵,且抗体对温度变化比较敏感,存活的时间较短,因此用免疫传感器检测pcbs有很大的局限性。
而dna适配体由于成本低,易合成等特点在分子识别和生物传感器方面有较好的应用前景,特别是有科研团队首次筛选出多聚联苯的适配体,已有一些基于比色、荧光、表面增强拉曼等研究方法的出现,但依旧存在着检测灵敏度低,检测范围窄。而出现的电化学方法都是存在着昂贵的标记成本和复杂的修饰过程。
技术实现要素:
为解决上述技术问题,本发明提供了一种dna微囊及金电极-dna树枝状大分子传感器的制备方法以及在检测多氯联苯中的应用。基于目标物pcb-72触发dna微囊释放亚甲基蓝信号分子及互补dna引发非线性杂交链式反应构建出金电极-dna树枝状大分子传感器进而实现对多氯联苯的超灵敏检测。
本发明采取的技术方案为:
一种dna微囊的制备方法,包括以下步骤:
(1)制备亚甲基蓝负载的碳酸钙微粒;
(2)将亚甲基蓝负载的碳酸钙微粒悬浮在聚羟基脂肪酸溶液中,吸附一段时间后,经洗涤、离心,制备得到pah包被的微粒;
(3)将pah包被的微粒和与pah共轭的核酸启动子dnas1溶液一起孵育,然后经洗涤、离心之后,再次与dnas2溶液一起孵育,经洗涤、离心,制备得到dna-pah凝胶颗粒;
(4)将dna-pah凝胶颗粒加入到edta溶液中孵育以溶解掉碳酸钙模板核心,然后经洗涤离心之后,得到所述dna微囊,将dna微囊储存在hepes缓冲液得到dna微囊溶液。
步骤(3)中,所述核酸启动子dnas1的基因序列为:
5'-ttt-ttc-act-cgg-acc-cca-ttc-tcc-ttc-cat-ccc-tca-tcc-gtc-cac-cat-caa-cta-gtt-3';双划线处为核酸适配体识别区;
所述dnas2的基因序列为:
5'-aac-tag-ttg-atg-aag-ctg-gac-ataa-tag-gca-cac-gac-ataa-tag-gca-cac-3'。
步骤(3)中,所述核酸启动子dnas1溶液的制备方法为:将核酸启动子dnas1溶解在缓冲溶液b中配制得到0.1μm的核酸启动子dnas1溶液;并按照相同的方法配制得到0.1μm的dnas2溶液;所述缓冲溶液b的成分为:25mmtris、100mmnacl和10mmmgcl2;所述缓冲溶液b的ph为7.4;
所述步骤(3)中的孵育时间均为30min。
步骤(4)中,所述edta溶液的浓度为0.5m,所述孵育的时间为1h;所述dna微囊溶液中的微粒浓度为10mm。
本发明还提供了所述的制备方法制备得到的dna微囊在制备金电极-dna树枝状大分子传感器和定量检测多氯联苯(pcb-72)中的应用。
本发明还提供了一种金电极-dna树枝状大分子传感器的制备方法,包括以下步骤:
(a)将金电极经抛光预处理之后,在dnas3溶液中孵育,清洗之后,再将其置于6-巯基己醇溶液中孵育,经洗涤、干燥之后,得到s3探针修饰的金电极;
(b)将多氯联苯(pcb-72)加入到上述制备方法制备得到的dna微囊溶液中,制备得到含有pcb-72的dna微囊溶液;
(c)将步骤(a)处理之后的金电极在含有pcb-72的dna微囊溶液进行孵育;
(d)将dnas4溶液和dnas5溶液按照体积比1:1进行混合得到杂交溶液ⅰ,并将步骤(c)处理之后的金电极在杂交溶液ⅰ中孵育;
(e)将dnas6溶液和dnas7溶液按照体积比1:1进行混合得到杂交溶液ⅱ,并将步骤(d)处理之后的金电极在杂交溶液ⅱ中孵育;即可得到金电极-dna树枝状大分子传感器。
所述dnas3的基因序列为:
5'-gtg-tgc-cta-tta-tgt-ctc-ctc-ctg-tgt-gcc-tat-tat-gtc-tcc-tcc-tca-gct-tca-tca-act-agt-tcg-tca-(ch2)6-sh-3';
所述dnas4的基因序列为:
5'-tga-cga-act-agt-tga-tga-agc-tg-3';
所述dnas5的基因序列为:
5'-gtgcctattatgtcgtgtgcctattatgtccagctt-3';
所述dnas6的基因序列为:
5'-aggaggagacataataggcacactgacgaactagttgatgaagctg-3';
所述dnas7的基因序列为:
5'-gtg-tgc-cta-tta-tgt-ctc-ctc-ctg-tgt-gcc-tat-tat-gtc-tcc-tcc-tca-gct-tca-tca-act-agt-tcg-tca-3'。
所述dnas3、s4、s5、s6、s7溶液的制备方法均与核酸启动子dnas1溶液相同;所述dnas3、dnas4、dnas5溶液的浓度均为0.1μm;所述dnas6、dnas7溶液的浓度均为0.5μm。
所述步骤(a)中,所述6-巯基己醇溶液的浓度为2mm;金电极在dnas3溶液中孵育时间为10h;金电极在6-巯基己醇溶液中的孵育时间为30min。
所述步骤(b)中,pcb-72在dna微囊溶液中的浓度为10ng/l。
所述步骤(c)中,金电极在含有pcb-72的dna微囊溶液中的孵育时间为30min。
所述步骤(d)中,金电极在杂交溶液ⅰ的孵育时间为30min。
所述步骤(e)中,金电极在杂交溶液ⅱ的孵育时间为2.0h。
步骤(a)~(e)中的温育温度均为37℃。
本发明还提供了一种多氯联苯(pcb-72)的定量检测方法,包括以下步骤:
(a)将多组金电极经抛光预处理之后,分别在dnas3溶液中孵育1h,清洗之后,再将其置于6-巯基己醇溶液中孵育30min,经洗涤、干燥之后,得到多组s3探针修饰的金电极;
(b)分别将多氯联苯(pcb-72)加入到上述制备方法制备得到的dna微囊溶液中,制备得到一系列含有不同pcb-72浓度的dna微囊溶液;
(c)分别将步骤(a)处理之后的各组金电极在不同pcb-72浓度的dna微囊溶液中进行孵育30min;
(d)将dnas4溶液和dnas5溶液按照体积比1:1进行混合得到杂交溶液ⅰ,并将步骤(c)处理之后的各组金电极分别在杂交溶液ⅰ中孵育30min;
(e)将dnas6溶液和dnas7溶液按照体积比1:1进行混合得到杂交溶液ⅱ,并将步骤(d)处理之后的各组金电极分别在杂交溶液ⅱ中孵育2.0h,得到金电极-dna树枝状大分子传感器;
(f)分别以步骤(e)得到的各组金电极-dna树枝状大分子传感器为工作电极,饱和甘汞电极为参比电极,铂丝为辅助电极,tris缓冲溶液为电解液,进行dpv测试,分别得到各组dpv响应曲线;
(g)以各组的dpv响应曲线中的峰值电流为纵坐标,pcb-72浓度为横坐标构建线性曲线,得出线性方程;根据线性方程即可计算出任意dpv峰值电流多对应的待测pcb-72的浓度。
进一步地,步骤(b)中,所述pcb-72的浓度分别为0.00001ng/l、0.0001ng/l、0.00025ng/l、0.0005ng/l、0.001ng/l、0.005ng/l、0.01ng/l、0.025ng/l、0.05ng/l、0.1ng/l、0.25ng/l、0.5ng/l、1ng/l、2.5ng/l、5ng/l、10ng/l。
所述步骤(g)中的线性方程为i=21.5170+1.4727ogc,r=0.9918,其中i是电流强度,单位为μa;c是pcb-72浓度,单位为m;r是回归系数。
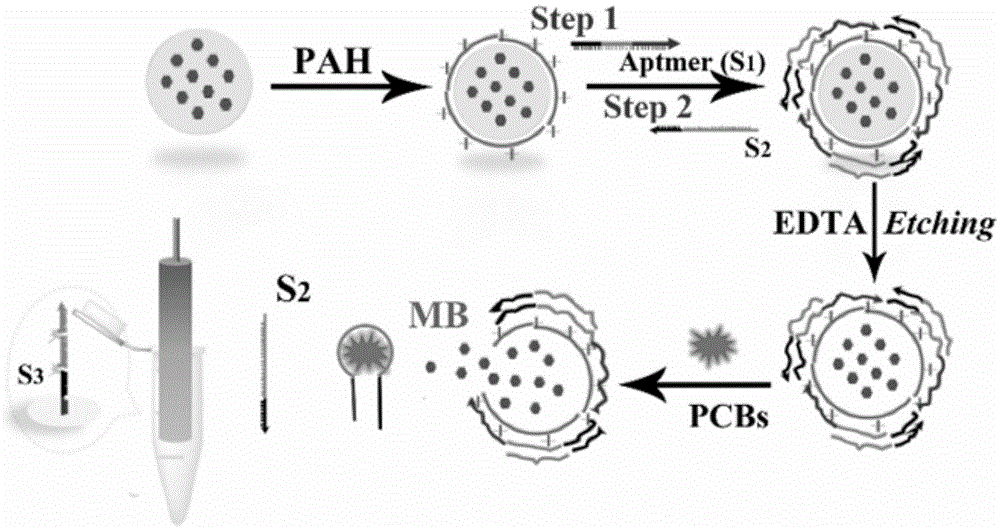
本发明提供的技术方案中,首先将亚甲基蓝(mb)负载在碳酸钙微粒上;然后利用pah包被负载了mb的碳酸钙微粒使碳酸钙微粒的表面带上正电荷以利于后续核酸启动子s1的负载;通过将pah包被的微粒在核酸启动子s1溶液中孵育,在微粒的表面结合上核酸启动子s1;然后继续在dnas2溶液中进行孵化,利用s1、s2碱基序列的配对继续在s1的外层结合上dnas2;然后利用edta将碳酸钙模板核心溶解掉而制备得到dna微囊。
这样当dna微囊遇到目标物pcb-72时,pcb-72由于与核酸启动子dnas1的特异性结合而使dnas1脱落,并致使dnas2脱落,进而使得dna微囊解离而使其中包被的mb释放出来进而与金电极上的dna序列结合。
当dnas3探针修饰的金电极插入到含有pcb-72的dna微囊溶液中时,dnas3上的碱基序列与s2互补配对进而使dnas2结合到金电极上产生双链结构s2-s3,利用同样的原理,s2-s3继续与s4、s5互补配对进行杂交反应,然后再继续引发与s6、s7的非线性杂交链式反应,进而形成金电极-dna树枝状大分子传感器,然后以金电极-dna树枝状大分子传感器为工作电极,饱和甘汞电极为参比电极,铂丝为辅助电极,tris缓冲溶液为电解液,进行dpv测试,金电极-dna树枝状大分子的构建可实现电化学信号的放大。
本发明通过改变dna微囊溶液中的pcb-72的浓度,测试得到的金电极的dpv信号随着pcb-72浓度的增大而逐渐增强,进而可利用dpv峰值电流与pcb-72浓度构建线性曲线,进而可实现对于pcb-72的超灵敏检测。
本发明基于目标物pcb-72触发dna微囊释放mb信号分子及互补dna引发树枝状大分子的非线性杂交链式反应,因此插入具有电化学活性的亚甲基蓝信号分子,从而使得电化学检测信号得到放大。利用亚甲基蓝产生的差示脉冲伏安法(dpv)强度信号,构建与pcb-72浓度的线性关系,实现对pcb-72的定量检测。本发明对于pcb-72的检测限可低至0.5ng/l、且具有灵敏度高、选择性好、稳定性好的特点。
附图说明
图1为dna微囊制备及pcbs触发dna微囊的示意图;
图2为金电极-dna树枝状大分子传感器构建的示意图;
图3为亚甲基蓝负载的碳酸钙微粒(a)、dna-pah凝胶颗粒(b)及dna微囊(c)的sem图;
图4a为实施例3中的不同浓度pcb-72对应的dpv响应图(a),a~p分别表示pcb-72浓度为:0.00001ng/l、0.0001ng/l、0.00025ng/l、0.0005ng/l、0.001ng/l、0.005ng/l、0.01ng/l、0.025ng/l、0.05ng/l、0.1ng/l、0.25ng/l、0.5ng/l、1ng/l、2.5ng/l、5ng/l、10ng/l;
图4b为实施例3中电流强度相对于不同浓度的pcb-72的变化和标准曲线(b);
图4c为比较例中的中的不同浓度pcb-72对应的dpv响应图(c),a~m分别表示pcb-72浓度为:0.0005ng/l、0.001ng/l、0.005ng/l、0.01ng/l、0.025ng/l、0.05ng/l、0.1ng/l、0.25ng/l、0.5ng/l、1ng/l、2.5ng/l、5ng/l、10ng/l;
图4d为比较例中电流强度相对于不同浓度的pcb-72的变化和标准曲线(d);;
图5为mb浓度(a)、配制dna序列s1-s7的缓冲液的ph(b)、电极在dna序列s1-s7孵育温度(c)、电极在杂交溶液ⅱ的孵育时间(d)的优选实验图;
图6为金电极-dna树枝状大分子传感器对氯苯(a)、pcb-28(b)、pcb-52(c)、pcb-101(d)、pcb-72(e)的选择性实验图(a);稳定性实验图(b)以及氯苯、pcb-28、pcb-52、pcb-101和pcb-72的结构式(c);
图7a为实施例2中的金电极-dna树枝状大分子传感器构建时,微囊溶液中不含有pcb-72时的dpv响应图(a)及微囊溶液中含有pcb-72时的dpv响应图(b);
图7b分别为没有制备dna微囊而直接将pcb-72溶解在hepes缓冲液中(a)、未经edta溶解碳酸钙模板核心(b)、微囊溶液中不含有pcb-72(c)、比较例条件下pcb-72浓度为10ng/l时(d)、实施例2条件下pcb-72浓度为10ng/l时(e)所构建的金电极-dna树枝状大分子传感器的dpv响应图;
图7c为图7b中各条件所对应的z'-z”图。
具体实施方式
下面结合说明书附图和实施例对本发明进行详细说明。
文本中所涉及的各溶液制备方法如下:
pah溶液:将聚羟基脂肪酸溶解在缓冲溶液a中配制得到,所述缓冲溶液a的成分为:10mmhepes,500mmnacl以及50mmmgcl2,ph7.0;
dnas1、s2、s3、s4、s5、s6、s7溶液:分别将s1、s2、s3、s4、s5、s6、s7溶解在缓冲溶液b中配制得到,所述缓冲溶液b的成分为:25mmtris、100mmnacl和10mmmgcl2,ph7.4;
缓冲溶液c:25mmhepes,25mmmgcl2和10mmnacl,ph7.2;
6-巯基己醇(mch)溶液:6-巯基己醇溶解在tris缓冲液中配制得到。
实施例1
一种dna微囊的制备方法,包括以下步骤:水溶液
(1)将cacl2水溶液(300μl,0.33m)和na2co3水溶液(300μl,0.33m)室温下磁力搅拌,加入mb水溶液(30μl,8.0mg/ml),用去离子水调节液体总体积至1020μl;磁力搅拌110s后使悬浮液在室温下静置70s;使微粒在900rpm下离心20s,移去悬浮液,将余下的颗粒置于清水中洗涤;重复三次洗涤步骤,移去沉淀反应中的副产物制备亚甲基蓝负载的碳酸钙微粒,其sem图如图3a所示,其粒径在1~2μm;
(2)震荡使6mg亚甲基蓝负载的碳酸钙微粒悬浮在300ml、1mg/ml的pah溶液中中;经过20min吸附间隔之后,再用10mmhepes缓冲溶液(ph7.0,包含500mmnacl)洗涤微粒两次,经900rpm离心20s,制备得到pah包被的微粒;
(3)将pah包被的微粒与300ml与paa共轭的0.1μm的核酸启动子dnas1溶液一起震荡孵育30min,用缓冲溶液c洗涤两次之后,900rpm离心20s;再将其与dnas2溶液一起孵育30min,用缓冲溶液c洗涤两次之后,900rpm离心20s,制备得到dna-pah凝胶颗粒,其sem图如图3b所示,其粒径在1~2μm;
(4)将dna-pah凝胶颗粒加入到120ml、ph7.5的0.5medta溶液中孵育1h以溶解掉碳酸钙模板核心,在悬浮液变得澄清后,通过缓慢离心除去上清液edta溶液以避免dna微囊的聚集。用10mmhepes缓冲液(ph7.0,含有500mmnacl)将dna微囊洗涤三次,通过以500rpm离心20分钟。然后将dna微囊在4℃下储存在hepes缓冲液中得到dna微囊溶液以供进一步使用,所述dna微囊溶液经凝胶电泳测试其微粒浓度为10mm。所述dna微囊的sem图如图3c所示,其粒径在500~1000nm。其制备示意图如1中的前3步。
实施例2
一种金电极-dna树枝状大分子传感器的制备方法,包括以下步骤:
(a)将金电极浸入90℃的溶液中5分钟进行化学预处理,然后用超纯水充分洗涤。随后,依次用1.0、0.3和0.05μm氧化铝抛光电极,并在乙醇和超纯水中超声处理3分钟,然后将电极在0.1mh2so4中,以饱和甘汞电极为参比电极,铂丝为辅助电极进行伏安循环,其电位在-0.2和1.5v之间,扫描速率为0.1v/s,直到获得代表性的稳态循环伏安图。使用纯氮气干燥电极后,立即将电极在0.1μmdnas3溶液中孵育10h,然后用超纯水冲洗ge,并在2mm6-巯基己醇(mch)溶液中孵育30分钟以除去非特异性的金电极表面的dna吸附。再用超纯水彻底冲洗并在n2流下干燥后,将s3探针修饰的ge(s3/ge)在4℃下储存在hepes缓冲液中以供进一步使用。
(b)将多氯联苯pcb-72加入到dna微囊溶液中至多氯联苯浓度为10ng/l,在37℃下保持5分钟,制备得到含有pcb-72的dna微囊溶液;
(c)将步骤(a)处理之后的金电极在含有pcb-72的dna微囊溶液进行孵育30min;
(d)将0.1μmdnas4溶液和0.1μmdnas5溶液按照体积比1:1进行混合得到杂交溶液ⅰ,并将步骤(c)处理之后的金电极在杂交溶液ⅰ中孵育30min;
(e)将0.5μmdnas6溶液和0.5μmdnas7溶液按照体积比1:1进行混合得到杂交溶液ⅱ,并将步骤(d)处理之后的金电极在杂交溶液ⅱ中孵育2.0h;即可得到金电极-dna树枝状大分子传感器。其制备示意图如图1中的最后一步及图2所示。其dpv响应图如图7b中的曲线e所示,其z'-z”图如图7c中的曲线e所示。
实施例3
一种多氯联苯(pcb-72)的定量检测方法,包括以下步骤:
(a)将多组金电极按照实施例2中步骤(a)中的方法抛光预处理之后,分别在0.1μmdnas3溶液中孵育10h,清洗之后,,然后用超纯水冲洗ge,并在2mm6-巯基己醇(mch)溶液中孵育30分钟以除去非特异性的金电极表面的dna吸附,再用超纯水彻底冲洗并在n2流下干燥后,将s3探针修饰的ge(s3/ge)在4℃下储存在hepes缓冲液中以供进一步使用;
(b)分别将多氯联苯(pcb-72)加入到dna微囊溶液中,制备得到一系列含有不同pcb-72浓度的dna微囊溶液;所述pcb-72浓度分别为0.00001ng/l、0.0001ng/l、0.00025ng/l、0.0005ng/l、0.001ng/l、0.005ng/l、0.01ng/l、0.025ng/l、0.05ng/l、0.1ng/l、0.25ng/l、0.5ng/l、1ng/l、2.5ng/l、5ng/l、10ng/l;
(c)分别将步骤(a)处理之后的各组金电极在不同pcb-72浓度的dna微囊溶液中进行孵育30min;
(d)将0.1μmdnas4溶液和0.1μmdnas5溶液按照体积比1:1进行混合得到杂交溶液ⅰ,并将步骤(c)处理之后的各组金电极分别在杂交溶液ⅰ中孵育30min;
(e)将0.5μmdnas6溶液和0.5μmdnas7溶液按照体积比1:1进行混合得到杂交溶液ⅱ,并将步骤(d)处理之后的各组金电极分别在杂交溶液ⅱ中孵育2h,得到金电极-dna树枝状大分子传感器;
(f)分别以步骤(e)得到的各组金电极-dna树枝状大分子传感器为工作电极,饱和甘汞电极为参比电极,铂丝为辅助电极,tris缓冲溶液为电解液,进行dpv测试,分别得到各组dpv响应曲线,如图4a所示;
(g)以各组的dpv响应曲线中的峰值电流为纵坐标,pcb-72浓度为横坐标构建线性曲线,如图4b所示,所述得出线性方程i=21.5170+1.4727ogc,r=0.9918,其中i是电流强度,单位为μa;c是pcb-72浓度,单位为m;r是回归系数;根据线性方程即可计算出任意dpv峰值电流多对应的待测pcb-72的浓度。
此方法对于pcb-72的检测限可低至0.5ng/l。
比较例
其他同实施例3,只是省去了步骤(e),其得到各组dpv响应曲线,如图4c所示;线性曲线如图4d所示,所述得出线性方程i=7.9966+0.6002logc,r=0.9944,其中i是电流强度,单位为μa;c是pcb-72浓度,单位为m;r是回归系数。
从图4c和4d中可以看出,本比较例中的检测灵敏度显著低于实施例3。
实施例4
为了获得高测定灵敏度,本发明分别对金电极-dna树枝状大分子传感器构建过程中的mb浓度、配制dna序列s1-s7的缓冲液的ph、电极在dna序列s1-s7孵育温度、金电极在杂交溶液ⅱ中的孵育时间进行优化。
4.1mb浓度
由于mb浓度是影响mbdna树枝状大分子电流强度的关键参数,因此研究了mb浓度的影响。如图5a所示,随着mb浓度的增加,电流首先迅速增加当mb的浓度高于8mg/ml时,电流然后趋于稳定。因此,本发明中选择了浓度为8mg/ml的mb对碳酸钙微粒进行负载。
4.2配制dnas1-s7溶液所使用的缓冲溶液的ph
图5b显示了ph值对dna树枝状聚合物修饰电极在缓冲溶液中在4.0至10.0的ph范围内的响应的影响。显然,ph值在4.0-7.4范围内时,电流随着ph的增大而增加,然而,当ph高于7.4时,电流迅速下降,因此本发明选用ph为7.4的缓冲溶液来配制dnas1-s7溶液。
4.3金电极在dna序列s1-s7孵育温度
如图5c所示,电流响应随着孵育温度从5℃升高到37℃而增加,但随着孵育温度从37℃升高到45℃逐渐降低。因此本发明将金电极在dna溶液中的孵化温度选择为37℃。
4.4金电极在杂交溶液ⅱ中的孵育时间
从图5d中可以看出,随着孵育时间的增加,电化学响应增强,并且在120分钟后保持恒定至饱和值,表明金电极在杂交溶液ⅱ中的孵育120分钟时可以电极的电化学响应值达到最大,因此,将金电极在杂交溶液ⅱ中的孵育时间设定为120分钟。
实施例5
金电极-dna树枝状大分子传感器的选择性及稳定性研究
分别将氯苯、pcb-72、pcb-28、pcb-52、pcb-101这五种物质分别溶解在dna胶囊溶液中,使浓度均为10ng/l,然后,重复实施例3中的(c)-(f)步骤,测量并比较来自每种物质的dpv信号。如图6a所示,只有pcb-72的信号最强,因此金电极-dna树枝状大分子传感器对于pcb-72具有较高的选择性。
将pcb-72溶解在dna胶囊溶液中,使其浓度均为0.5ng/l,然后,重复实施例3中的(c)-(f)步骤,将电极密封并在4℃下储存。每天测试一次电极的dpv连续测试7天,如图6b所示,7天后仍然保持较高的电流值,可见金电极-dna树枝状大分子传感器的稳定性良好。
上述参照实施例对一种dna微囊及金电极-dna树枝状大分子传感器的制备方法以及在检测多氯联苯中的应用进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!