双受体时间分辨时间分辨荧光共振能量转移法的制作方法
相关申请的交叉引用
本申请要求于2012年2月6日提交的第61/595,459号美国申请的权益,这里通过引用将其全部内容整体并入本文。
技术领域
本发明涉及利用时间分辨荧光共振能量转移法(time-resolved fluorescence resonance energy transfer)确定样品中是否存在一种或多种分析物的多重测定。
背景技术:
时间分辨荧光共振能量转移法(TR-FRET)应用是基于给体(donor)和受体(acceptor)分子之间的能量传递。FRET是从荧光给体分子至合适的受体分子的非辐射能量转移。如果紧邻受体分子且给体分子的发射光谱和受体分子的激发光谱重叠,那么给体分子能够使其激发能量转移至受体分子,而不是发射荧光。接着,受体分析会在受体发射波长下发射荧光。出现受体发射波长的荧光表明给体和受体分子彼此紧邻,给体和受体分子需要相隔小于约20nm,例如相隔5~10nm,以发生能量转移。通常,通过生物亲和性相互作用,例如蛋白质-蛋白质结合、抗原-抗体结合、配体-受体结合、DNA杂交和DNA-蛋白质结合,实现给体和受体分子的紧密靠近。
存在多种给体和受体分子。通常,用于FRET测定中的给体和受体分子是具有短半衰期的荧光基团。通过来自样品组分例如缓冲液、蛋白质、化合物和细胞溶胞产物的背景荧光能够降低常规FRET化学的性能。必须校正这种自荧光(auto-fluorescence)的检测后的荧光强度,该自荧光降低测定灵敏度,并且能够使结果翻译复杂化。这种类型的背景荧光是短暂的(具有纳秒范围内的寿命),并且因此使用时间分辨方法能够加以消除。
TR-FRET利用镧系元素的离子例如铕(Eu)、铽(Tb)、钐(Sm)、镝(Dy)的离子的特有性质。鉴于它们特定的光物理和光谱性质,稀土离子的络合物对生物学中的荧光应用是感兴趣的。具体地,当和更常见的荧光基团相比时,它们具有大的斯托克斯位移和长发射半衰期(从微秒至毫秒)。
通过直接激发产生镧系元素离子的荧光是困难的,因为这些离子具有较差的吸光能力。镧系元素必须首先和有机部分(organic moieties)络合,该有机部分捕获光并通过分子内的非辐射过程将光转移至镧系元素。稀土元素的螯合物和穴合物是集光部分的实例。所收集的能量被转移至稀土离子,其然后发射它特有的长寿命荧光。镧系元素螯合物常常也具有高量子产率,从而使少量给体产生光亮信号,因此提高了灵敏度。此外,它们的发射峰是相当窄的,从而对受体发射光的干扰很小。用于技术平台的重要金属中的一个是铕(在约315~350nm下激发,而在约600~635nm下发射)。
技术实现要素:
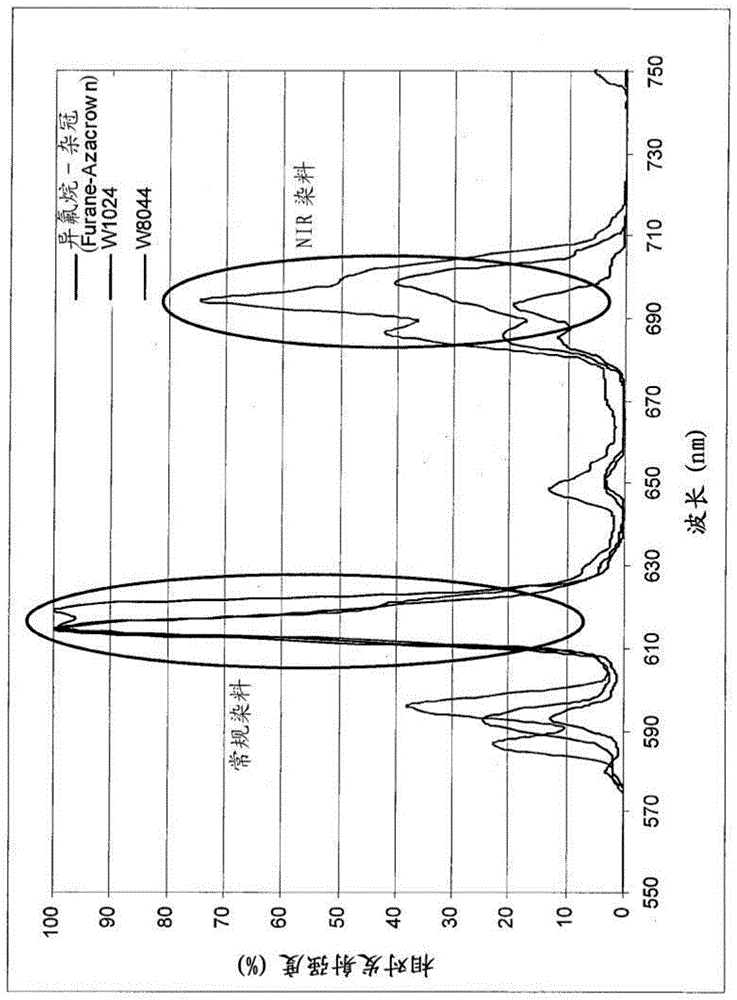
本发明是至少部分基于TR-FRET的新方法。铕发射至少一种波长的能量。不计杂峰,它具有两个主要的发射峰:一个峰在约600~635nm,而另一个在约675~715nm(图1)。该观测结果增大了具有两个存在于TR-FRET测定中的受体分子的概率:将与600~635nm的发射峰相互作用的一个,和将与675~715nm的反射峰相互作用的一个。因此,一种镧系元素螯合剂受体允许检测样品中的分析物或变体(modification)的两种同时测定。
一方面,本发明提供了独立确定样品中是否存在两种分析物的方法。该方法包括使样品接触第一分析物特异性的结合配偶体(analyte-specific binding partner)和第二分析物特异性的结合配偶体,其中该第一和第二分析物特异性的结合配偶体分别接合(conjugate)镧系元素螯合剂部分;使样品暴露于能够激发在第一和第二分析物特异性的结合配偶体中的螯合剂中的镧系元素的波长范围内的光;以及,独立确定第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体是否分别结合第一分析物和第二分析物,由此独立确定样品中的这两种分析物是否存在。
另一方面,本发明特征在于确定酶对两种不同的底物是否具有活性的方法。该方法包括提供包含两种不同底物的样品;在足以从第一底物中产生第一分析物且从第二底物中产生第二分析物的条件下,使该样品和酶接触;使该样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体;其中第一和第二分析物特异性的结合配偶体分别接合镧系元素螯合剂部分;使样品暴露于能够激发第一和第二分析物特异性的结合配偶体中螯合剂中的镧系元素的波长范围内的光;以及,独立确定第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体是否分别结合第一分析物和第二分析物,由此确定酶是否对第一和第二底物具有活性。
又一方面,本发明提供了确定两种酶是否独立地对底物具有活性的方法。该方法包括:提供包含底物的样品;在足以用第一酶产生第一分析物和用第二酶产生第二分析物的条件下,使样品接触两种不同的酶;使样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体,其中第一和第二分析物特异性的结合配偶体分别接合镧系元素螯合剂部分;使样品暴露于能够激发第一和第二分析物特异性的结合配偶体中螯合剂的镧系元素的波长范围内的光;以及,独立地确定第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体是否分别结合第一分析物和第二分析物,由此独立地确定第一和第二酶对底物的活性。
一方面,本发明特征在于独立地确定样品中是否存在两种分析物的方法。该方法可以包括使该样品接触结合第一荧光能量共振转移(FRET)受体的第一分析物特异性的结合配偶体、结合第二FRET受体的第二分析物特异性的结合配偶体和包含镧系元素螯合物配偶体的化合物;使样品暴露于能够激发螯合剂中的镧系元素的波长范围内的光;以及,独立地确定第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体分别结合第一分析物和第二分析物,由此独立地检测样品中是否存在这两种分析物。在一些实施方式中,第一和第二分析物分别包含亲和标记物,而具有镧系元素螯合部分的化合物进一步包括亲和标记物特有的结合配偶体。
又一方面,本文描述了独立地确定两种酶是否对底物具有活性的方法。该方法包括:提供包含底物的样品,其中该底物标记有亲和标记物;在足以用第一酶产生第一分析物和用第二酶产生第二分析物条件下,使该样品接触两种不同的酶;使该样品接触具有镧系元素螯合部分的亲和标记物特有的结合配偶体;使该样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体,其中第一和第二分析物特异性的结合配偶体分别接合能够由波长为约600~635nm的光激发的检测部分和能够由波长为约675~715nm的光激发的另一检测部分;使该样品暴露于能够激发螯合物中镧系元素的波长范围内的光;以及,独立地确定第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体是否分别结合第一分析物和第二分析物,由此独立地确定第一和第二酶对底物的活性。
在一些实施方式中,两种螯合部分的镧系元素是相同的。在一个实施方式中,接合的螯合部分(conjugated chelate moiety)在两种结合配偶体中是相同的。能够使用任何合适的镧系元素螯合部分。在一些实施方式中,螯合部分可以选自吡啶、联吡啶、三吡啶、水杨酸、香豆素衍生物、菲咯啉和吡唑衍生物(et al.,J Fluoresc15:529~42,2005,通过引用将其并入本文)。
在一些实施方式中,第一和第二分析物分别独立地接合检测部分。在一些实施方式中,该检测部分是FRET受体。在一个实施方式中,检测部分中的一种能够由波长为约600~635nm(例如600~610nm、605~615nm、610~620nm、615~625nm、620~635nm、625~635nm)的光激发,而检测部分中的另一种能够由波长为约675~715nm(例如675~685nm、685~695nm、690~700nm、695~705nm、690~710nm、700~710nm、700~715nm、705~715nm)的光激发。
在一些实施方式中,镧系元素选自铕、铽、钐和镝。
在一些实施方式中,使样品暴露于波长为约275~350nm的光。在一些实施方式中,使样品暴露于波长为约315~350nm(例如315~320nm、315~325nm、320~330nm、325~335nm、330~340nm、320~340nm、325~340nm、330~340nm、325~345nm、330~345nm、335~345nm、340~350nm)。
在一些实施方式中,确定第一分析物特异性的结合配偶体是否结合第一分析物包括检测波长为约650~680nm(例如655~665nm、655~670nm、660~670nm、660~675nm、665~675nm)的发射光。
在一些实施方式中,确定第二分析物特异性的结合配偶体是否结合第二分析物包括检测波长为约715~750nm(例如715~725nm、715~730nm、720~730nm、720~735nm、725~735nm、725~740nm、730~740nm)的发射光。
在一些实施方式中,第一和第二分析物特异性的结合配偶体分别包括分析物结合分子。
在一些实施方式中,样品对于可见光是不透明的。在一些实施方式中,样品包括纯化分子、膜、组织提取液、血液(以及包含血清和血浆的血液衍生物)、细胞溶胞产物和细胞培养上清液,以及其它生物流体(脑脊液、尿)。
附图说明
图1是示出了铕螯合物的发射光谱的曲线图。
图2是使用标记有不同受体分子(ULight和NIR-染料)进行测定的示意图。
图3是使用两种分别标记有不同的受体分子(ULight和NIR-染料)抗体和靶肽进行测定的示意图。
图4是多重TR-FRET测定后的原理示意图。
图5A和图5B是示出了从单重检测测定得到的信号检测的线图。
图6是示出了从多重分析测定得到的信号检测的线图。
图7A和图7B是示出了从单酶(single enzyme)的多重检测测定、酶滴定得到的信号检测的线图。
图8A和8B是示出了从单酶的多重检测测定、辅因子滴定得到的信号检测的线图。
图9是示出了从多重的双酶辅因子滴定测定得到的信号检测的线图。
图10A和10B是示出了从单酶的多重检测测定、抑制剂滴定得到的信号检测的线图。
图11是示出了从双酶的多重检测测定、抑制剂滴定得到的信号检测的线图。
图12是示出了从用于确定Z值的双酶的多重检测测定得到的信号检测的散点图。
除非另有声明,本文所使用的全部技术和科学术语具有和本发明所属技术领域的技术人员所通常理解的相同含义。本文描述了用于本发明的方法和材料;还可以使用本领域已知的其它合适的方法和材料。这些材料、方法和实例至少示例性的,而不希望是限定性的。本文所提及的全部出版物、专利申请、专利、序列表、数据库项(database entry)和其它引用文献通过引用整体并入。
发明详述
使用现有的FRET技术测量样品中的多种分析物在技术上是挑战性的。为了测量样品中多于一种的分析物,通常会需要使用多对供体和受体分子。这产生了对多种激发波长的需要和潜在的复杂分析,其能够涉及峰重叠和串扰。将受到同一波长激发时发出两种不同发射峰的单供体分子和双受体分子组合能够允许在单一样品中同时检测两种分析物,从而降低了复杂性、节省了试剂和节约了时间。
通常在TR-FRET中,镧系元素螯合物(例如包括镧系元素离子例如铕离子、铽离子、钐离子或镝离子的螯合物)在约315~350nm(例如320~340nm)下被激发以产生约600~635nm(例如610~620nm)的光。该能量能够转移至紧邻(例如1~20nm)的受体分子。然后,该受体分子在约655~675nm(例如660~670nm)下发荧光。
在约315~350nm(例如320~340nm)下激发的铕螯合物还在约675~715nm(例如680~710nm)发光。通过使用在约675~715nm(例如680~710nm)下吸收并且在约715~740nm(例如720~730nm)发射的受体分子,尽管使用单螯合物也能够产生第二中发光颜色。这容许在一个样品中对两种样品加以测量,并还产生约715~740nm的非常穿透性的光,能够在不透明的样品(例如含纯化分子的样品、膜、组织提取物、血液(以及包含血清和血浆的血液衍生物)、细胞的溶胞产物和细胞培养上清液,以及其它生物流体(例如脑脊髓流体、尿))中读取该光。
在不透明的介质中实施TR-FRET是复杂的,因为在常规TR-FRET所发出的光不会穿透这些介质。然而,约715~740nm(例如720~730nm)的发射光在这些波长下是高穿透性的。此外,波长大于约675nm(例如约675~715和约715~740nm的发射光)的发射波长在常见化合物中是稀少的,因此降低了在借助镧系元素(例如铕、铽、钐和镝)的螯合物的第二主发射峰所进行的测定中干扰的风险。如果干扰是问题,那么第二波长是测定中的潜在对照标准。
荧光共振能量转移
在一些实施方式中,本文所述方法使用用于检测两种或更多种分析物的基于FRET的单一测定。基于FRET的测定记载于第5,981,200号美国专利,通过引用将其并入本文。FRET需要至少两种染料分子:充当FRET给体的第一染料和充当FRET受体的第二染料。通常,FRET给体是能量给体,而FRET受体是能量受体。FRET是在FRET给体和FRET受体之间发生的能量转移(如下文详细描述的),和是在所谓的FRET测定期间测得的信号。
具有合适的发射和激发光谱的彼此紧邻的荧光分子能够进行FRET。该过程如下进行:首先,例如使用皮秒激光脉冲激发FRET给体,并通过吸收光子形式的能量使其从基态转化成激发态。第二,FRET给体以荧光形式发出这种刚吸收的能量。第三,如果受激发的给体分子足够接近合适的受体分子,那么能够以荧光的形式将激发态从给体转移至受体。这种能量转移称作FRET。第四,FRET导致给体的荧光或发光减弱,并且如果给体本身是发光的,FRET导致受体的发光增强。能够使用FRET检测系统测量由受体所发出的光,并且该光和FRET是成比例的。因此,所采集的信息能够用于定性和定量分析。在一些实施方式中,从给体所发出的光会和从受体所发出的光是不同波长的。
FRET的效率,即当能量从给体转移至受体染料所产生的信号,依赖于给体和受体之间的距离(1/d),并且只有当给体和受体是紧密靠近时FRET才会发生。信号减弱正比于分离距离的六次幂。因此,FRET测量了与距离相关的相互作用。使用FRET所作的测量是在约1~20nm的范围内。
因此,如本文所使用的,相互作用是指在能够由FRET测量方法所检测到的分子之间的距离变化。为了检测这种相互作用,FRET给体和FRET受体偶联于一个或多个分子并且一个或多个分子之间的相互作用导致在FRET给体和FRET受体之间距离的变化是必要的。
在一些实施方式中,FRET可以包括但不限于(A)以结合对形式连接于不同分子的FRET给体和FRET受体;(B)在单一分子内连接于不同区域的FRET给体和FRET受体;和(C)在三元络合物中连接于两个不同分子的FRET给体和FRET受体。然而,在(C)中,FRET给体和FRET受体依附的两个单独分子必须以在给体和受体之间能够发生足够的能量转移的方式络合。
因此,FRET能够呈现出(A)来自FRET给体的荧光信号强度的减弱;(B)FRET给体的激发态寿命的缩短;和/或(C)通常在表示受体特征的较长波长(较低能量)下的荧光的再发射。
能够选择能量受体,使得它们抑制由给体所释放的能量,这些能量受体称为猝灭剂;或者使得FRET受体自身能够发出荧光能量,即它们发荧光。该能量受体称为荧光基团(fluorophore group)或荧光基团(fluorophore)。金属络合物适合作为荧光能量给体和荧光能量受体。选择用于FRET的荧光基团通常是明亮的并以10-9~10-4秒的时标(timescale)发生。该亮度和时标使得FRET的检测变得容易,并允许使用多种检测方法。
在一些实施方式中,基于以下中的一种或多种(包括全部)选择FRET给体和FRET受体:(1)FRET给体的发射光谱应该和FRET受体的激发光谱重叠;(2)FRET配偶体(即FRET给体和FRET受体)的发射光谱应该表现出非重叠的荧光性;(3)FRET的量子产率(即从FRET给体转移至FRET受体的能量)应该尽可能高(例如FRET在整个的1~20nm(例如5~10nm)的测量距离内应该具有约1~100%(例如30%、40%、50%、60%、70%、80%、85%、90%、95%、98%和99%)的效率);(4)FRET信号(即荧光)必须区别于样品所产生的荧光(例如自发荧光);以及,(5)FRET给体和FRET受体应该具有促进FRET信号检测的半衰期(例如FRET可以是明亮的并可以以范围为10-9~10-4的时间度标进行,如上所述)。
任何在约600~635nm或约675~715nm下激发的FRET受体可以用于本发明的方法。在一些实施方式中,使用以及在近红外波长范围内激发的FRET受体。熟练的从业者会鉴别可供使用的众多商业可得的FRET受体,例如在PerkinElmer中商业可得的FRET受体(例如产品)、在Invitrogen中商业可得的FRET受体(例如产品)和在Cisbio Bioassays中商业可得的FRET受体(例如产品)。
在一些实施方式中,基于表1中所列出的荧光基团中的一种或多种选择FRET给体和FRET受体。
表1:FRET分子的实例
当选择FRET给体和FRET受体的组合时还可能考虑以下内容。
第5,998,146号美国专利(通过应用并入本文)描述了镧系元素螯合物、特别是结合有荧光基团或猝灭剂的铕和铽的络合物的应用。该专利还记载了长寿命的镧系元素螯合物的性质。
基于作为能量给体的金属络合物和来自作为能量受体的藻胆蛋白类的染料的FRET体系是本领域已知的(EP 76 695;Hemmilae,Chemical Analysis117,John Wiley&Sons,Inc.,(1991)135~139)。确立的商业体系(例如来自Wallac,OY或Cis Bio Packard)使用由作为金属络合物的镧系元素螯合物和藻胆蛋白组成的FRET对。
镧系元素螯合物、特别是铕或铽的络合物的性质是已知的,并能够和猝灭剂以及荧光基团结合使用。
钌络合物本身用作特别是电化学发光的荧光基团或发光基团。例如从EP 178 450和EP 772 616中获知钌-螯合物,EP 178 450和EP 772 616还描述了用于将这些络合物偶联至生物分子的方法。在EP 178 450和EP 772 616中没有讨论钌-螯合物在FRET体系中作为能量给体的用途。
别藻蓝蛋白具有例如不寻常的高消光系数(约700000L/M cm)和还有极其高的发射系数的性质。这些是在FRET体系中作为荧光基团受体的先决条件。此外,这些染料易于溶于水且是稳定的是已知的。
术语小分子量荧光基团是指具有分子量在300~3000Da之间的荧光性染料。就重要的特性而言,如此小分子的荧光性基团例如呫吨(xanthene)、花青苷、罗丹明和噁嗪相比于APC具有明显的缺点。因此,举例来说,它们的消光系数明显更小并在约100000L/M cm的量级上。
用于标记FRET分子的方法是本领域已知的。例如,能够直接或间接地(例如借助标记物或利用抗生物素蛋白-抗生物素蛋白链菌素的相互作用)标记结合配偶体,正如Yang et al.,Analytical Biochemistry 351:158~160,2006中所记载的,通过引用将其并入本文。在一些实施方式中,能够直接标记结合配偶体。用于直接标记结合结构单元(bonding member)的方法是本领域已知的。这些方法包括用FRET给体和FRET受体标记这些分子。通常,结合配偶体例如蛋白质可以在100μM的碳酸氢盐缓冲液(pH 8.3)中配置为最终蛋白质浓度为约1.0mg/ml。然后,该溶液可以和所需的标记物混合,并在室温下培养约1小时。然后,使用微柱(micro column)可以从分子例如(蛋白质)中分离未引入的标记物。
TR-FRET
在一些实施方式中,本发明的方法和测定利用同一TR-FRET测定技术。TR-FRET是时间分辨荧光法(TRF)和FRET的结合。TRF通过推迟读取荧光信号(例如推迟约10纳秒)的方式降低背景荧光。凭借这种延迟(即选通周期),测量了样品中更长的持续荧光。因此,使用的TR-FRET,不是共检测干扰性背景荧光(其可能例如来源于样品中的干扰物质),而是只测量由能量转移所产生或抑制的荧光。借助于合适的测量装置确定所得到TR-FRET体系的荧光。该时间分辨检测系统使用例如脉冲激光二极管、发光二极管(LED)或脉冲染料激光器作为激发光源。在合适的时间延迟后、即干预背景信号已经延迟后进行测量。现有技术描述了用于确定时间分辨FRET信号的装置和方法。
该技术要求重要信号必须对应于具有长荧光寿命的化合物。该长寿命的荧光化合物为稀土镧系元素。例如,Eu3+具有毫秒级的荧光寿命。
如上所述,TR-FRET需要FRET给体和FRET受体。对于FRET,能够基于以下要求中的一个或多个(包括全部)选择TR-FRET给体和受体对:(1)FRET给体的发射光谱应该和FRET受体的激发光谱重叠;(2)FRET配偶体(即FRET给体和FRET受体)的发射光谱应该表现出非重叠的荧光;(3)FRET的量子产率(即从FRET给体转移至FRET受体的能量)应该尽可能高(例如,在整个1~20nm、例如5~10nm的测量距离,FRET应该具有约1~100%、例如30%、40%、50%、60%、70%、80%、85%、90%、95%、98%和99%的效率);(4)FRET信号(即荧光)必须区别于由样品所产生的荧光(例如自发荧光);和(5)FRET给体和FRET受体应该具有允许对FRET信号进行检测(例如,FRET可以是明亮的并且可以在10~9~10~4秒的时间度标内进行)的半衰期。
在一些实施方式中,可以基于表1中列出的荧光基团中的一种或多种选择TR-FRET给体和TR-FRET受体。
在一些实施方式中,TR-FRET给体可以是镧系元素离子,例如结合螯合物的镧系元素离子。在一些实施方式中,镧系元素离子可以为铕离子、铽离子、钐离子或镝离子。正如本文所使用的,Eu包括Eu和全部的Eu离子(例如Eu3+)。在一些实施方式中,TR-FRET可以为DsRed。在一些实施方式中,TR-FRET可以Ri2。应当理解选择合适的TR-FRET给体需要考虑上述列出的标准和所选的具体TR-FRET受体。
在一些实施方式中TR-FRET受体可以选自荧光素、Cy5、别藻蓝蛋白(APC-例如XL665、d2和BG~647)和荧光蛋白(例如GFP、CFP、YFP、BFP、RFP和其它GFP变体)。
在一些实施方式中,TR-FRET给体可以是铽,而TR-FRET受体可以是荧光素。在一些实施方式中,TR-FRET给体可以是Eu,而TR-FRET受体可以是Cy5或APC(例如XL665、d2、BG-647和Cy5相关的TR-FRET受体)。
在一些实施方式中,TR-FRET给体和TR-FRET受体可以和另一种增强该TR-FRET给体和/或该TR-FRET受体的功能的化合物相结合。例如,TR-FRET给体和TR-FRET受体可以和封装穴合物(cryptate encapsulation)相结合以延长荧光基团的半衰期。任选地或附加地,TR-FRET给体和TR-FRET受体可以和例如增强系统相结合。在一些实施方式中,TR-FRET给体和TR-FRET受体可以和例如增强或延长TR-FRET信号的寿命或检测的缓冲液、盐、增强剂(enhancer)、螯合物或稳定剂(例如光稳定剂)相结合。
在上述筛选测定中还可以包括多种其它试剂。这些包括试剂,如盐、中性蛋白质(例如白蛋白、洗涤剂等),该试剂可以用于促进最佳的蛋白质-蛋白质结合和/或减小非特异性或背景相互作用。可以使用提高测定效率的试剂,例如蛋白酶抑制剂、核酸酶抑制剂、抗菌抑制剂等。以任何提供必要结合的量级添加组分的混合物。在任何合适的温度下、通常在4~40oC之间进行培养。选择培养时间段以得到最佳活性,但是还可以优化该培养时间段以易于快速高通量的筛选。
可以用合适的TR-FRET给体和受体直接或间接地标记分子(例如蛋白质),正如前面所述的并且记载于美国专利4,925,804号、美国专利5,637,509号、美国专利4,761,481号、美国专利4,920,195号、美国专利5,032,677号、美国专利5,202,423号、美国专利5,324,825号、美国专利5,457,186号、美国专利5,571,897号、美国专利7,250,517号、US2005/0202565,通过引用将其并入本文。
应用
本文所述的技术部分涉及检测在至少两个分子(例如分析物和分析物特异性的结合配偶体)之间的相互作用。分析物特异性的结合配偶体的实例包括例如蛋白质、抗体、适体和肽。本文还提供了用于检测两种分析物以及两种分析物特异性的结合配偶体和一种FRET给体存在与否的方法。通常,该方法包括(i)和FRET对的第一结构单元相关的分析物特异性的结合配偶体和(ii)和FRET对的第二结构单元相关的分析物的应用。该第二分析物特异性的结合配偶体可以和FRET对的相同第一结构单元相关联,而第二分析物可以和FRET对的第二结构单元相关联,所述FRET对的第二结构单元由不同于FRET对的第一结构单元的发射波长的光所激发。任选地,该方法使用和FRET对的第二结构单元相关联的第二分析物特异性的结合配偶体,所述FRET对的第二结构单元由不同于FRET对的第一结构单元的发射波长的光所激发,而第二分析物可以和FRET对的相同第一结构单元相关联。
在这些方法中,分析物和分析物特异性的结合配偶体的相互作用导致产生可检测的光信号。测量该光信号作为分析物存在与否或者和分析物特异性的结合配偶体相关的分析物的含量的读出结果。该光信号可以是例如来自分析物的光发射,其在当FRET对的第二结构单元(例如FRET受体)受到来自FRET对的第一结构单元(例如FRET给体)的发射光照射而激发时产生。可以理解在一些实施方式中,这种增强过程(stimulation process)可以按相反地方向奏效。例如,来自FRET对的激发第二结构单元(此情形下,FRET给体)的发射可以相反地激发FRET对的第一结构单元(此情形下,FRE受体)。下文描述了多种示例性的反应方案,借此可以刺激FRET对的第一或第二结构单元以发出光信号。
分析物特异性的结合配偶体的高浓度使对分析物的亲和力增大。因此,本文所述的方法能够在例如分析物浓度小的情况下表现出灵敏度增加。此外,能够实施本文所述的方法而不需要或借助于放射性同位素。
如下实施了检测分析物、例如改性分析物(如磷酸化分子)的方法,或者检测或分析分析物和分析物特异性的结合配偶体之间的相互作用的方法。使包含分析物的样品和分析物特异性的结合配偶体接触,其中所述分析物是和FRET对的第二结构单元相关的,所述分析物特异性的结合配偶体是和FRET对的第一结构单元相关的。通过首先用光激发FRET对的第一结构单元的方式能够检测分析物和分析物特异性的结合配偶体之间的相互作用。该光激发FRET对的第一结构单元,其本身又发出波长为能够激发FRET对的第二结构单元的光。然后,受到激发的FRET对的第二结构单元发出被检测器所检测的光信号。由FRET对的第二结构单元所发出的光信号的存在或数量表明了和分析物特异性的结合配偶体相关的分析物的存在或数量。任选地,当FRET对的第二结构单元是FRET给体并且FRET对的第一结构单元是FRET受体时,能够通过检测来自FRET对的第一结构单元的光发射的存在或数量确定分析物和分析物特异性的结合配偶体之间的相互作用。换言之,可以用光(例如,产生自激光器的光)激发FRET对的第二结构单元,其本身又发出波长为能够激发FRET对的第一结构单元的光。
在一个示例性测定方案中,如下实施了确定样品中是否存在两种分析物(例如,肽、蛋白质或其后翻译的变体)的方法,如图2所示。例如,用不同的FRET受体、例如ULight和近红外(NIR)-染料(例如Cy7TM)标记的两种分析物、例如肽。通过各自接合于镧系元素螯合物部分(例如铕螯合物给体)的本身特有的结合配偶体(例如抗体)识别这些分析物,所述镧系元素螯合物充当两种FRET受体的FRET给体。用315~350nm的外加光激发铕螯合物,然后该铕螯合物在约600~635nm和约675~715nm的波长范围内发光,该光本身又激发和分析物相关的两种FRET受体(例如在600~635nm范围内可被激发的ULight或另一种FRET受体,和在675~715nm范围内可被激发的Cy7TM或另一种FRET受体)。激发后,FRET受体在约655~675nm(ULight)和约715~740nm(Cy7TM)下发光。然后检测所发出的光并将其和样品中的分析物的存在、缺失或数量相联系。该方法允许例如两种不同酶对样品中底物的活性进行测试,或者允许单一酶对样品中两种不同底物的活性进行测试。
在另一项示例性测定方案中,如图3所示,用标记物(例如,诸如生物素、地高辛配基、荧光素,二硝基苯酚的非肽标记物和还有诸如FLAG、HisTag、cmyc、HA,V5、链霉素标记物(streptag)的肽标记物)。通过标记有镧系元素离子螯合物(例如铕或铽的离子螯合物)的抗标记物分子(例如,用于生物素的抗生物素蛋白链菌素/streptactin,和用于其它的链霉素标记物或抗体)。该络合物是标记有FRET受体分子的分析物特异性的结合配偶体(例如抗体)的靶体。这允许在一种样品中测试两种不同的酶活性,或者测试单一酶对两种不同底物的活性。它还允许测试单一底物的多种活性。
本发明方法的另一种应用和红外光的高穿透性相关。使用近红外发射,信号能够穿透络合物和常见的不透明基质例如高密度的膜制剂、组织提取液、血液(以及包括血清和血浆的血液衍生物)、溶胞产物和细胞培养的上清液以及其它生物流体(脑脊液、尿),这使得本发明的方法可适用于体内TR-FRET测定。
测定相互作用的方法可以用于例如确定具体的分析物特异性的结合配偶体的特异性,或者反之亦然。例如,这些方法可以用于确定例如转录因子(例如,锌指蛋白)的核酸结合蛋白的结合特异性。例如,一种分析物特异性的结合配偶体可以和第一核酸序列相结合,而另一种分析物特异性的结合配偶体可以和另一种核酸序列相结合。第一和第二核酸序列中的一种可以和核酸结合蛋白质钯分子接触。
能够并通常可以在生理学pH的水性缓冲介质中实施这些方法。然而,能够使用提供容许的测定灵敏度(例如,在分析物特异性的结合配偶体和分析物之间的容许结合、酶的容许活性和/或FRET对之间的容许FRET)的多种条件中的任一种。通常选择pH以实现容许的测定灵敏度和特异性。必须予以考虑的因素为相关反应的速率的pH依赖性、结合结构单元的结合和非特异性结合的还原等。
可以使用多种缓冲液以实现所需的pH和在测定期间保持pH。示例性的缓冲液包括硼酸盐、磷酸盐、碳酸盐或三羟甲基氨基甲烷(参见例如,Sambrook et al.,1989,Molecular Cloning–A Laboratory Manual,Cold Spring Harbor Press)。
尽管测定介质中多种溶剂的浓度通常会取决于待测的重要组分的浓度范围,但是可以凭经验确定这些试剂中每一种的最终浓度以优化整个范围内的测定灵敏度。
多种光发射和光检测仪器中的任一种可以用于启动FRET(例如,激发FRET给体或激发能够激发FRET给体的试剂)和/或检测由所述FRET产生的发射。作为上述方法学的结果,可以利用视觉、照相方法、感光测定术、分光光度方法(spectrophotometrically)或通过其他便利的手段检测或测量由FRET对的第一和第二结构单元所产生的光发射,以确定和介质中每种组分的含量相关的含量。例如,使用光度计能够检测和/或测量分析物和/或分析物特异性的结合配偶体之间的相互作用。
以允许对多个反应快速准备、处理和分析的任何形式实施检测方法(或本文所描述的任何筛选方法)。这可以是例如在多空测定板(例如96孔或386孔)中。可以人工地或机械式地制备各种溶剂的原料溶液,并且随后使用市场可得的能够检测FRET的分析软件、机器和检测仪器。可以和本文所述方法和组合物结合使用的具体仪器包括例如VictorTM、EnVisionTM、FusionTM和ViewLuxTM设备,其可从PerkinElmer(波士顿,马萨诸塞州)购买。
在一些实施方式中,本文所述的方法中的任一个可以包括获得分析物的步骤。例如,所述分析物为抗体时,所述方法可包括从产生抗体的受试动物(例如哺乳动物,诸如鼠、兔、鼠、羊、牛、马、狗、猫或人)或细胞(例如杂交瘤细胞)中分离抗体的步骤。在另一实例中,当分析物为转录因子时,所述方法可包括从天然源中分离该转录因子或获得重组转录因子的步骤。上文以及标题为“样品”的章节中具体描述了从天然的或重组的源获得或分离分析物的方法。
在一些实施方式中,本文所述的方法中的任一个还可以包括使分析物偶联于FRET对的结构单元的步骤。
可以将上述方法应用于多种应用,其包括但绝非限于下文中的应用。
检测酶活性
本文描述了用于检测样品中酶活性的各种方法。因为许多酶活性(例如,激酶、乙酰基转移酶、甲基转移酶、磷酸酶或代谢酶例如牵涉克雷布斯循环的酶)的异常的功能或表达和疾病状态(例如癌症、炎症或代谢紊乱)相关,所以本文所述的组合物在例如用于确定受试者是否具有或处于产生以酶的异常功能或表达为特征的疾病的风险。可以检测任何酶活性,特别是那些牵涉翻译后修饰的酶,例如引入或除去化学基团的情形。
所述方法可包括以下步骤:使分析物特异性的结合配偶体和其各自的分析物接触;和,检测分析物和其各自的分析物特异性的结合配偶体的结合。分析物和分析物特异性的结合配偶体的结合力在所述样品存在时和在所述样品不存时相比的差值表明了样品中酶活性的存在、缺失或大小。在一些实施方式中,分析物和固相载体相关。参见例如US 2008/0261239,其公开内容通过引用整体并入本文。
这些方法还包括以共价或非共价的方式使FRET对的第二结构单元和分析物结合,和/或以共价或非共价的方式使分析物特异性的结合配偶体和固相载体结合。共价或非共价结合的方法记载于US 2008/0261239,其公开内容通过引用整体并入本文。
通过本文所描述的方法可以检测各种酶活性中的任一种。例如,所述酶活性可以是例如蛋白酶活性、激酶活性、磷酸酶活性、磷酸二酯酶活性、核苷酸环化酶的活性、泛素连接酶的活性、甲基转移酶活性、乙酰化酶活性、脱乙酰酶活性、DNA聚合酶活性、RNA聚合酶活性、DNA连接酶活性和异构酶活性。下文给出了关于酶活性的其它内容。
可使用本文所描述的方法或组合物加以检测、测量或另行分析的蛋白酶类型的实例包括但不限于:丝氨酸蛋白酶(如胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶或枯草杆菌蛋白酶)、苏氨酸蛋白酶、半胱氨酸蛋白酶(如木瓜蛋白酶、组织蛋白酶、半胱氨酸蛋白酶或钙蛋白酶)、天冬氨酸蛋白酶(如HIV-1蛋白酶、凝乳酶、肾素或天冬氨酸蛋白酶)、金属蛋白酶和谷氨酸蛋白酶。
激酶是能够通过向其引入一个或多个磷酸基团(称为“磷酸化”方法)修饰底物的酶。使用本文所述的组合物和方法可以检测或测量许多不同类型的激酶的活性。例如,可以检测或测量酪氨酸激酶、苏氨酸/丝氨酸激酶、糖激酶或脂质激酶的活性。示例性的激酶包括例如Akt激酶家族、极光激酶家族(Aurora kinase family)、PDK1、MAPKAP K2、Erk激酶家族、CAMK激酶家族、细胞周期蛋白依赖性激酶(例如CDK1、CDK2、CDK4、CDK6)、RAF激酶家族、酪蛋白激酶家族、PKC家族、PKA家族、PKB家族、PKG家族、GSK3beta、ROCK、SGK、Rsk家族和Nek家族;蛋白酪氨酸激酶包括受体酪氨酸激酶,例如FGFR、EGFR、PDGFR、C-kit、IGFR、胰岛素受体、TrkA、TrkB、TrkC、C-Met或C-Ret,和胞质酪氨酸激酶,例如Src、Lck、Lyn、Fyn、Yes、Syk、Hck、Abl和Eph的家族;或脂质激酶,例如PI3激酶、PI4激酶或PI5激酶。
磷酸酶能够从底物除去磷酸部分。磷酸酶的活性可以包括例如酪氨酸特异性磷酸酶、苏氨酸/丝氨酸磷酸酶、双特异性磷酸酶、糖磷酸酶、组氨酸特异性磷酸酶或脂质磷酸酶的活性。
乙酰基转移酶是一类把乙酰基从供体转移至受体的转移酶。实例包括组蛋白乙酰转移酶,其包括CBP组蛋白乙酰转移酶、胆碱乙酰转移酶、氯霉素乙酰转移酶、5-羟色胺-N-乙酰转移酶、NatA乙酰转移酶和NatB乙酰转移酶。
脱乙酰酶是从蛋白质中的残留除去乙酰基的酶。实例包括组蛋白脱乙酰酶和sirtuins。
甲基转移酶,也称为“甲基化酶”,是一类把甲基基团从供体转移至受体的转移酶。甲基化通常在DNA的核酸碱基或蛋白质结构的氨基酸上发生。甲基转移酶能够使用结合于S-腺苷甲硫氨酸中硫的甲基基团作为甲基供体。
脱甲基酶是从蛋白质和其它物质中除去甲基基团的酶。它们应用于多个过程,例如在基因调节、趋化性和信号转导中。
糖基化是使糖类(即糖基供体)转移至另一个分子(糖基受体)的羟基或其它官能团的反应。糖基化酶(Glycosylase)是使聚糖连接蛋白质、脂质、核酸或其它有机分子的酶。去糖基化是从分子中除去糖基团的反应。
泛素连接酶(也称为E3泛素连接酶)是与E2泛素接合酶结合导致泛素通过异肽键连接于目标蛋白质的赖氨酸上的蛋白质;E3泛素连接酶以由蛋白酶体降解的特异性蛋白质底物为目标。通常,泛素连接酶牵涉到多遍在蛋白化:第二泛素连接第一泛素,第三泛素连接第二泛素,等等。多遍在蛋白化标记由蛋白酶体降解的蛋白质。
脱遍在蛋白酶(Deubiquitinating enzymes,DUB)是一大类的通过切断泛素-蛋白质键调节泛素依赖性代谢途径的蛋白酶。人类基因组编码了近100个对五个基因家族中的泛素具有特异性的DUB。潜在地,DUB可充当泛素体系的正调节物和负调节物。除泛素回收外,它们牵涉到泛素前体的加工、蛋白质遍在蛋白化的校正和抑制性泛素链的解体。
苏素化是翻译后修饰,其在多个细胞过程例如核质运输、转录调节、细胞凋亡、蛋白质稳定、应激反应和通过细胞周期的渐进(progression through the cell cycle)中起作用。小泛素类调节剂(Small Ubiquitin-like Modifier,SUMO)蛋白质连接和脱离细胞中的蛋白质以改变它们的功能。对体内蛋白质SUMO接合(SUMO conjugation)的检测会提供用于认识SUMO调节的有用信息,所述SUMO调节作为调节许多核蛋白活性的重要控制机理出现。SUMO对其目标的连接类似于泛素的连接(因为它是用于例如NEDD 8的泛素类蛋白质)。使用ATP由蛋白酶(在人体中,这些是SENP蛋白酶或酵母菌中的Ulp1)从SUMO切断C端肽以揭示二甘氨酸调节。然后,使SUMO结合为异源二聚体的E1酶(SUMO活化酶(SAE))。然后,将它送至为接合酶(Ubc9)的E2。最后,少数E3连接蛋白中的一个使它附着于所述蛋白质。
磷酸二酯酶(例如环核苷酸磷酸二酯酶)包括一大类的基于生物化学和分子性质有机化生成11个不同家族的酶。例如,PDE包括人磷酸二酯酶3B、人磷酸二酯酶11A1、人磷酸二酯酶4A4、人磷酸二酯酶4D3和牛脾磷酸二酯酶(类型II)。
酶活性能够修饰分析物和/或分析物特异性的结合配偶体。例如,酶活性可以使分析物或分析物特异性的结合配偶体磷酸化。
在所述方法的一些实施方式中,相比于在样品不存在时结合力的大小,在样品存在时分析物和其分析物特异性的结合配偶体之间的结合力的减小表明样品中酶活性的存在、缺失或大小。例如,通过降低分析物和分析物特异性的结合配偶体之间的结合力的方式可以检测样品中特定蛋白酶的存在,所述特定蛋白酶能够除去结合于分析物特异性的结合配偶体的分析物部分。在另一个实例中,当分析物特异性的结合配偶体优先结合非磷酸化分析物并且通过特定的磷酸酶除去磷酸部分时,可以以分析物特异性的结合配偶体和磷酸化的分析物之间的结合的减弱确定样品中磷酸酶的存在或含量。
在所述方法的一些实施方式中,相比于样品不存在时结合力的大小,在样品存在时分析物和其分析物特异性的结合配偶体之间的结合力的增大表明样品中酶活性的存在、缺失或大小。例如,当分析物特异性的结合配偶体优先结合磷酸化的分析物并且通过特定激酶使该分析物磷酸化时,通过分析物特异性的结合配偶体和分析物之间的结合力的大小的增加可以确定样品中激酶的存在或含量。
鉴定调节相互作用或酶活性的化合物
本文的特征还在于用于鉴定调整分析物和分析物特异性的结合配偶体之间的结合力的化合物。该方法可以包括以下步骤:在受试化合物存在下,使分析物和分析物特异性的结合配偶体以及FRET对的第一结构单元接触,其中所述分析物和FRET对的第二结构单元相连接;和,检测分析物和分析物特异性的结合配偶体的结合,其中受试化合物存在时与受试化合物不存在时的分析物和分析物特异性的结合配偶体之间的结合力的差值表示受试化合物调整了分析物特异性的结合配偶体和分析物之间的相互作用。
所述方法还可以包括以下步骤:以共价的或非共价的方式使FRET对的第二结构单元结合分析物和/或以共价的或非共价的方式使分析物特异性的结合配偶体结合固相载体。用于共价的或非共价的结合的方法还记载于US2008/0261239,其全部内容通过引用整体并入本文。
所述方法还包括以下步骤:在使分析物特异性的结合配偶体(和固相载体相关的)和分析物接触后,从未结合的分析物中分离固相载体(如上所述)。
在使分析物和分析物特异性的结合配偶体接触之前,可以使受试化合物和分析物接触。在使分析物特异性的结合配偶体和分析物接触之前,可以使受试化合物和分析物特异性的结合配偶体接触。在一些实施方式中,在受试化合物存在下,可以使分析物特异性的结合配偶体和分析物接触(即,使分析物和分析物特异性的结合配偶体同时均和受试化合物接触)。
所述受试化合物可以是例如本文所述的化合物中的任一种(参见下文的“化合物”)。受试化合物可以是抑制或增强分析物特异性的结合配偶体和分析物之间的结合的化合物。
在所述方法的一些实施方式中,相比于不存在化合物时结合力的大小,存在化合物时分析物和分析物特异性的结合配偶体之间的结合力的减小表明化合物抑制了分析物特异性的结合配偶体和分析物之间的相互作用。
在所述方法的一些实施方式中,相比于不存在化合物时结合力的大小,存在受试化合物下的分析物和分析物特异性的结合配偶体之间的结合力的增大表明化合物增强了分析物特异性的结合配偶体和分析物之间的相互作用。
用于鉴定调节酶活性的化合物的方法可以包括以下步骤:提供分析物特异性的结合配偶体和FRET对的第一结构单元、具有FRET对的第二结构单元的分析物、和能够修改分析物特异性的结合配偶体和分析物之一或两者的酶;在所述酶和受试化合物存在下,使分析物和分析物特异性的结合配偶体接触;以及,检测分析物和分析物特异性的结合配偶体之间的结合力,其中相比于不存在受试化合物下的结合力,在受试化合物存在下的分析物和分析物特异性的结合配偶体之间的结合的差值表明所述受试化合物调节了酶的活性。
所述方法还包括以下步骤:以共价的或非共价的方式使FRET对的第二结构单元和分析物结合,和/或以共价的或非共价的方式使分析物特异性的结合配偶体和固相载体结合。上文描述了用于共价的或非共价的结合的方法。
所述方法可以包括以下步骤:在使所述分析物特异性的结合配偶体(和固相载体相连接)和分析物接触,从未结合的分析物中分离固相载体(如上所述)。
在使分析物和分析物特异性的结合配偶体接触之前,可以使酶和受试化合物与分析物接触。在使分析物特异性的结合配偶体和分析物接触之前,可以使酶和受试化合物与分析物特异性的结合配偶体接触。在一些实施方式中,在酶和受试化合物存在下使分析物特异性的结合配偶体和分析物接触。所述酶可以是例如本文所述的那些酶中的任一种。受试化合物可以是例如本文所述的化合物中的任一种(参见下文的“化合物”)。受试化合物可以是抑制或增强分析物特异性的结合配偶体和分析物之间的结合力。
在所述方法的一些实施方式中,相比于不存在化合物时的结合力的大小,存在受试化合物时的分析物和分析物特异性的结合配偶体之间结合力的减小表明了受试化合物抑制了酶的活性。在所述方法的一些实施方式中,相比于不存在化合物时的结合力的大小,存在受试化合物时的分析物和分析物特异性的结合配偶体之间结合力的增大表明了受试化合物增强了酶的活性。
例如,当激酶能够使分析物磷酸化并且分析物特异性的结合配偶体能够结合分析物(例如,去铁胺和三价金属阳离子)的磷酸化形式时,可以通过激酶存在下的目标分子和分析物特异性的结合配偶体之间的结合力大小确定激酶的活性。如上所述,在受试化合物存在和不存在下,可以使用激酶(在允许分析物磷酸化的条件下)培养分析物。相比于不存在化合物时的分析物特异性的结合配偶体和分析物的结合力的大小,存在受试化合物时的分析物特异性的结合配偶体和分析物的结合力的减小表明了该化合物抑制了酶的活性。相反地,相比于不存在化合物时分析物特异性的结合配偶体和分析物的结合力的大小,存在受试化合物时的分析物特异性的结合配偶体和分析物的结合力的增大表明了受试化合物增强了酶的活性。
在所述方法的一些实施方式中,相比于不存在化合物时的结合力的大小,存在受试化合物时的分析物和分析物特异性的结合配偶体之间结合力的减小表明了该化合物抑制了酶的活性。在所述方法的一些实施方式中,相比于不存在化合物时的结合力的大小,存在受试化合物时的分析物和分析物特异性的结合配偶体之间的结合力的增大表明了受试化合物增强了酶的活性。
样品
样品可以是任何化合物。样品的成分可以是已知的或未知的。在许多情况下,样品包含或怀疑样品包含一种或多种酶活性。样品可以来源于生物体或者可以是人造来源的酶。样品可以是例如一种包含一种或多种已知数量或已知活性的酶的样品。
在一些实施方式中,样品可以包含一种或多种分析物(例如本文所描述的分析物中的任一种)或一种或多种和FRET对的第二结构单元相关的分析物。
样品可以是从个体获得的试样,或者可以来源于该试样。例如,样品可以是通过活体解剖得到的组织切片,或放置于或适于组织培养的细胞。样品还可以是或包含生物流体试样,例如尿、血液、血浆、血清、唾液、精液、痰、脑脊髓液、泪液、粘液、汗液、乳汁、精液等。生物样品还可以是或包含来自溃疡或其它表面出牙(例如水疱和脓肿),或者可以是来自正常的、恶性的或可疑组织的组织提取液。若需要,还可以进一步分离样品至包含特定组分或细胞类型的部分。例如,可以将血液样品分离成血清和包含特定类型的血液细胞例如红细胞或白细胞的部分。若需要,样品可以是来自单体的样品组合(集合体),例如组织或流体样品的组合等。
还可以处理样品以易于对酶或其酶活性的检测。例如,如果样品包含细胞括其它生物结构,那么可以使用冷冻/解冻处理、干燥和再水化、搅匀(dounce)、洗涤或其它方法处理样品。释放或增溶酶还可以是有益的,前提是这不会干扰酶活性或相关的测定方法。
可以从体液和组织获得样品,其中通常使正被测试的特定酶表达,例如从干燥得到的肝酶。
可用常规照管处理样品以保留分析物和分析物特异性的结合配偶体的酶活性和/或活性或结构。例如,当分析物从天然源例如溶胞产物中分离出时,可以使用多种可影响分子的结构和功能的缓冲剂和/或蛋白质水解酶或核酸酶活性的抑制剂来处理溶胞产物。保留样品中的酶、分析物或分析物特异性的结合配偶体的活性或完整性的用于获得样品的合适方法是本领域技术人员所熟知的。该方法包括使用保留或减少样品中酶的变化的合适缓冲液和/或抑制剂,包括核酸酶、蛋白酶和磷酸酶的抑制剂。该抑制剂包括例如螯合剂如乙二胺四乙酸(EDTA)、乙二醇双(2-氨基乙醚)-N,N,N’,N’-四乙酸(EGTA),蛋白酶的抑制剂例如苯甲基磺酰氯(PMSF)、抑肽酶、亮肽素、抗蛋白酶等,磷酸酶抑制剂例如磷酸盐、氟化钠、钒酸盐等。可以选择抑制剂使得它们不会干扰或只是最低限度地影响所需酶活性。例如,如果待测的酶活性是蛋白酶,那么用于得到保留酶活性或完整性的样品的方法不会包括蛋白酶抑制剂,其不利地影响特定的酶活性。用于含酶样品的合适缓冲液和条件是公知的(参见例如Ausubel et al.,Current Protocols in Molecular Biology(Supplement 47),John Wiley&Sons,New York(1999);Harlow and Lane,Antibodies:A Laboratory Manual(Cold Spring Harbor Laboratory Press(1988);Harlow and Lane,Using Antibodies:A Laboratory Manual,Cold Spring Harbor Press(1999);Tietz Textbook of Clinical Chemistry,3rd ed.Burtis and Ashwood,eds.W.B.Saunders,Philadelphia,(1999))。
合适的话,可以处理样品以消除或最小化干扰物质的存在。若需要,可以通过本领域技术人员所熟知的多种方法、包括亚细胞分离和色谱技术,如离子交换、憎水和反相、尺寸排阻、亲和性、憎水电荷诱导层析等(Ausubel et al.supra,1999;Scopes,Protein Purification:Principles and Practice,third edition,Springer~Verlag,New York(1993);Burton and Harding,J Chromatogr A814:71~81,1998)。
为了应用于本文所述的方法,样品可以以各种物理状态。例如,样品可以是液体或固体,可以是溶解的或悬浮于液体中,可以是以乳状液或凝胶的,以及可以被吸附在材料上。
可以修饰样品的一种或多种性质使得容许或更高效地容许样品结合的相互作用出现和/或酶作用于底物上。这些性质是本领域技术人员所熟知的并通常包括盐度、pH、表面活性剂性质、粘度和温度。
化合物
可以在本文所述的方法中任一种中筛选的受试化合物包括多种化学类型。化合物可以是生物分子,其包括但不限于,肽、多肽、肽模拟物(例如,类肽)、氨基酸、氨基酸类似物、糖类、脂肪酸、类固醇、嘌呤、嘧啶、衍生物或其结构类似物、多核苷酸和多核苷酸类似物。化合物可以是小分子化合物或大分子化合物。
通常,小分子化合物是具有分子量在约50~2500道尔顿范围内的相对小的有机分子。这些化合物可以包括用于和蛋白质的结构相互作用(例如,氢键)所必需的官能团,并可以包括至少氨基(amine)、羰基、羟基或羧基,和优选所述化学官能团中的至少两种。这些化合物通常可以包括由上述官能团中的一个或多个取代的环状碳(cyclical carbon)或杂环结构、和/或芳香族的或聚芳香族的结构(例如,嘌呤核(purine core))。
此外,有益于作为本文所述的一些方法中的小分子化合物的是核酸适体,其是以高亲合力和多种蛋白质结合的并抑制与所述配体蛋白、受体或其它分子结合的相对短的核酸(DNA、RNA或两者组合)序列。适体通常是长度上约25~40个核苷酸,并具有的分子量在约8~16kDa的范围内。可以通过称为SELEX(systemic evolution of ligands by exponential enrichment,指数富集的配基系统进化)的体内演化过程得到对目标是高特异性和亲和性的适体(参见例如Zhang et al.,Arch Immunol Ther Exp 52:307~315,2004,其公开内容通过引用整体并入本文)。用于增强稳定性的方法(例如,通过使用核苷酸类似物)和增强核酸适体的体内生物利用度(例如,受试者循环系统中的体内持久性)(参见Zhang et al.(2004)and Brody et al.,Reviews in Molecular Biotechnology 74:5~13,2000,其公开内容通过引用整体并入本文)。
大分子化合物可以包括例如抗体(参见下文)的大蛋白或含两个或多个蛋白的大分子复合物。
可以从许多潜在来源、包括化学文库(chemical library)、天然产物文库(natural product library)和包括随机肽、寡核苷酸或有机分子的组合文库鉴定化合物。化学文库由随机化学结构组成,所述化学结构中的一些是已知化合物或类似物或者在其它药物发现筛选中确定为“(hit)”或“(lead)”的化合物,而其它是来源于天然产物,还有其它是从非直接合成的有机化学得来的。天然产物文库是微生物、动物、织物或海洋生物的集合,其通过以下用于产生筛选混合物:(1)来自土壤、织物或海洋微生物的培养液的发酵和提取,或(2)织物或海洋生物的提取。天然产物文库包括多肽、非核糖体的多肽或其变体(非天然产生的)。为了查阅,参见Science 282:63~68,1998。组合文库包括众多数量的作为混合物的肽、寡核苷酸或有机化合物。通过常规的自动合成方法、PCR、克隆或专有的合成方法相对容易地准备这些文库。
还有其它有用的文库包括肽、蛋白质、肽模拟物、多平行合成集合(multiparallel synthetic collection)、重组和多肽的文库。为了查阅组合化学和由其产生的文库,参见Myers,Curr Opin Biotechnol 8:701~707,1997。通过使用多个本文所述的文库对化合物的确定允许对所测试的化合物“hit”或“lead”随后进行修饰以优选“hit”或“lead”的能力,从而抑制在例如分析物特异性的结合配偶体和分析物之间的相互作用。
化合物可以是大分子,例如抗体或结合抗原的抗体片段,其对例如分析物或分析物特异性的结合配偶体是特异性的。该抗体或其片段通常会结合或接近(a)分析物结合的分析物特异性的结合配偶体的区域,(b)分析物特异性的结合配偶体的分析物区域。然而,该化合物还可以变构地起作用,并由此它们还可以和不仅位于调解相互作用的所述两分子的区域而且另外影响它们相互作用的位置处的分析物或分析物特异性的结合配偶体结合。正如本申请通篇所使用的,术语“抗体”是指整个抗体(例如,IgM、IgG、IgA、IgD或IgE)分子,其由本领域已知的多种方法中的任一种所产生。抗体可以产生于或来源于多种物种中的任一种,所述物种是例如人、非人类的灵长类动物(例如猴、狒狒或黑猩猩)、马、牛、猪、绵羊、山羊、狗、猫、兔、豚鼠、沙鼠、仓鼠、大鼠和小鼠)。
抗体可以是纯化的或重组的抗体。还有抗体片段和嵌合抗体和产自非人类(例如小鼠、大鼠、沙鼠或仓鼠)的抗体的人源化抗体。正如本文所使用的,术语“抗体片段”是指和抗原结合的片段,例如Fab、F(ab')2、Fv和单链的Fv(scFv)片段。scFv片段是单链的多肽链,其包括衍生scFv的抗体的重链和轻链可变区。此外,双特异抗体(Poljak,Structure 2(12):1121~1123,1994;Hudson et al.,J Immunol Methods 23(1~2):177~189,1999,其公开内容通过引用整体并入本文)和细胞内抗体(Huston et al.,Hum Antibodies10(3~4):127~142,2001;Wheeler et al.,Mol Ther 8(3):355~366,2003;Stocks,Drug Discov Today 9(22):960~966,2004,其公开内容通过引用整体并入本文)可以应用于本发明的方法中。
可以使用现有的技术产生包含分子的结合区域的抗体片段。例如,可以通过抗体分子的胃蛋白酶消化制造F(ab')2片段,并且可以通过减少F(ab')2片段的二硫键或通过用木瓜蛋白酶和还原剂处理抗体产生Fab片段。参见例如National Institutes of Health,Current Protocols In Immunology,Coligan et al.,ed.2.8,2.10(Wiley Interscience,1991),其公开内容通过引用整体并入本文。可以制造scFv片段,正如美国专利4,642,334号中所记载的,其公开内容通过引用整体并入本文。
以上确定的化合物可用通过任何化学或生物方法合成,或者可以从天然来源得到。以上确定的化合物还可以是纯相的,或可以是含一种或多种其它非活性成分(例如,不会结合的或抑制分析物特异性的结合配偶体和分析物之间相互作用的其余化合物或成分),并且可以以测定-、生理学的-或药学可接受的稀释剂或载体的形式制得。
以下的实施例进一步描述本发明,其不是对权利要求所限定的本发明保护范围的限定。
实施例
酶促多重测定用于外遗传赖氨酸甲基转移酶SET7/9和G9a。两者作用于肽底物,其衍生自在分别针对SET7/9和G9a的位点H3K4和H3K9上组蛋白H3。对酶测定的检测使用时间分辨荧光共振能量转移Ultra技术,其是非放射性的、均匀近程测定。
所示结果表明该测试适合于Z’值为0.79~0.80的高通量的筛选。抑制剂特异性使其用于对以不同方式作用于两个目标的潜在的活化剂和抑制剂的筛选是理想的测定。
材料和方法
G9a测定缓冲液:50mM Tris-HCl pH 9.0,50mM NaCl,1mM DTT,和0.01%Tween-20
SET7/9测定缓冲液:50mM Tris-HCl pH 9.0,5mM MgCl2,1mM DTT,和0.01%Tween~20
检测缓冲液
生物素-H3(1-21)(Anaspec Cat.No.61702,Lot No.71148)
SET7/9human recombinant(Enzo Cat.No.201~178~C100,Lot No.L25760/a)
G9a人重组体(BPS Cat.No.51001,Lot No.101020)
S-(5’-腺苷)-L-甲硫氨酸氯化物(SAM)(Sigma A7007,Lot No.119K5157)
西奈芬净100mM(Sigma S8559,Lot No.100M4070)
Eu-W8044Labeled SA(Cat.No.502339B)
Anti-H3K9Me2(Cat.No.05-1249,Lot No.NG1800813)
Anti-H3K4me2(Cat.No.TRF0402,Lot No.6)
ULight染料(SETA Cat.No.K8-1662,Lot No.240211-7150)
AlexaFluor-700染料(Invitrogen Cat.No.A20010,Lot No.778180)
聚-L-赖氨酸(Sigma P8920)
白色不透明的384-孔光板(Cat.No.6007299)是购自PerkinElmer,Inc.
TopSeal-A(Cat.No.6005185)是购自PerkinElmer,Inc.
培养箱设定为23℃
reader购自PerkinElmer,Inc.。
随后进行酶测定,其中室温下对5μL生物素酰化的H3(1–21)、2.5μL肽、2.5μL SAM培养60分钟;加入10μL的检测混合物:铕-抗生物素蛋白链菌素、Ulight-anti-H3K9me2、NIR-dye~anti-H3K4me2和PLK并在室温下将其培养60分钟;以及,使用337nm的激光器和665nm/730nm的滤光器读取基板。
测定原理示于图4中,其中染料标记的抗体特异性地识别经修饰的组蛋白H3肽,而铕-抗生物素蛋白链菌素结合于和其连接的生物素基团,从而允许进行TR-FRET。
实施例1:单重检测测定
单重检测分析方案不同于酶方案,并如下进行:在室温下将5μL Ulight-anti-H3K9me2或AlexaFluor-700-anti-H3K4me2、5μL的bio-H3K4me2(1–21)肽、5μL的bio-H3K9me2(1–21)肽、5μL的铕-抗生物素蛋白链菌素培养60分钟,并使用激光滤光器在665nm和730nm下读取基板。
图5A和图5B中,分别实施了对bio-H3K4me2(1–21)和bio-H3K9me2的滴定,染料标记的抗体和铕-抗生物素蛋白链菌素的浓度分别为30nM和3nM。
实施例2:多重检测测定
多重检测测定和单重检测分析相比具有稍微不同的方案,其如下进行:在室温下将5μL Ulight-anti-H3K9me2、5μL AlexaFluor-700-anti-H3K4me2、5μL bio-H3K4me2(1–21)肽、5μL bio-H3K9me2(1–21)肽、5μL铕-抗生物素蛋白链菌素培养60分钟,并使用激光滤光器在665nm和730nm下读取基板。
以类似于上述的方式进行底物滴定。应该指出,Ulight-anti-H3K9me2和AlexaFluor-700-anti-H3K4me2的浓度分别是30nM和3nM(图6)。
实施例3:多重-单酶、酶滴定
图7A示出了在整个0~1.2nM的浓度范围内的G9a滴定。使用300nM的bio H3(1–21)的肽和300μM的SAM用于酶促反应,并使用3nM的铕-抗生物素蛋白链菌素、0.3nM的AlexaFluor-700-anti-H3K4me2、3nM的Ulight-anti-H3K9me2和0.0001%的PLK用于所述检测。将0.3nM G9a应用于随后的实验。应该指出酶促反应的培养时间为30分钟。
图7B示出了在整个0–20nM浓度范围内的SET7/9滴定。除了将30nM的bio-H3(1-21)肽用于酶促反应,和将3nM的AlexaFluor-700-anti-H3K4me1用于所述测定外,所使用的溶剂量类似于上述的。选择60分钟的反应时间、10nM的SET7/9和0.3nM的G9a用于后续的多重实验。
实施例4:多重-单酶、辅因子滴定
图8A和8B均示出了在整个0~300μM浓度范围内的SAM滴定。所使用的酶浓度是如在所述多重单酶滴定中所指出的。使用100nM的bio-H3(1–21)。
实施例5:多重-双酶,辅因子滴定
除在2.5μL的等分部分包含两种酶外,在和单酶辅因子滴定相同的条件下实施SAM滴定。使用10μM的SAM浓度用于随后的实验(图9)。
实施例6:多重-单酶、抑制剂滴定
抑制剂滴定的酶部分和标准的酶促反应略有不同,并如下列出:5μL的抑制剂、2.5μL的酶、室温下培养15分钟和2.5μL的底物/辅因子的混合物。检测步骤保持不变。
图10A和10B示出了在0~1mM浓度范围内的西奈芬净滴定。选择300μM的西奈芬净用于Z’实验。
实施例7:多重-双酶、抑制剂滴定
图11中所示的是西奈芬净滴定。条件类似于上述实施例5中所提及的,其中2.5μL的等分部分中包含两种酶。
实施例8:多重-双酶、Z’测定
已经开发出新型的、非辐射性的、少量的多重测定用于TR-FRET 平台,其允许同时测量两种分析物(例如,变体)。针对外因遗传的和转录后变体,可以使用该测定还表现出激活剂和抑制剂的特异性。该测定表明了基于它们的生物化学区分酶的能力。使用0.79和0.80的Z’值,该测定是稳定的并适合用于高通量的筛选。
其它实施方式
应当理解尽管结合具体的说明书已经描述了本发明,前述的说明书意在阐述而不是限定本发明的保护范围,其由所附的权利要求的范围确定。其它方面、优点和变体落入随后的权利要求的范围内。
具体地,本发明涉及以下方面:
1.独立地确定样品中是否存在两种分析物的方法,其包括:
使所述样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体,其中所述的第一和第二分析物特异性的结合配偶体分别和镧系元素螯合物部分偶联;
使所述样品暴露于能够激发所述的第一和第二分析物特异性的结合配偶体中螯合物的镧系元素的波长范围内的光下;和
独立地确定是否所述第一分析物特异性的结合配偶体和所述第二分析物特异性的结合配偶体分别结合所述第一分析物和所述第二分析物,从而独立地确定所述样品中是否存在所述两种分析物。
2.确定酶对两种不同的底物是否具有活性的方法,其包括:
提供包含两种不同底物的样品;
在足以从所述第一底物产生第一分析物并且从所述第二底物产生第二分析物的条件下,使所述样品和酶接触;
使所述样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体,其中所述第一和第二分析物特异性的结合配偶体分别和镧系元素螯合物部分偶联;
使所述样品暴露于能够激发所述第一和第二分析物特有的结合部分中螯合物的镧系元素的波长范围内的光;以及
独立地确定所述第一分析物特异性的结合配偶体和所述第二分析物特异性的结合配偶体是否分别结合所述第一分析物和所述第二分析物,由此确定所述酶是否对所述第一底物和所述第二底物具有活性。
3.确定两种酶是否独立地对底物具有活性的方法,其包括:
提供包含底物的样品;
在足以用第一酶产生第一分析物并且用第二酶产生第二分析物的条件下使所述样品和两种不同的酶接触;
使所述样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体,其中所述第一和第二分析物特异性的结合配偶体分别和镧系元素螯合物部分偶联;
使所述样品暴露于能够激发所述的第一和第二分析物特异性的结合配偶体的螯合物中的镧系元素的波长范围内的光;以及
分别独立地确定是否所述第一分析物特异性的结合配偶体和所述第二分析物特异性的结合配偶体结合所述第一分析物和所述第二分析物,从而独立地确定所述第一酶和所述第二酶对所述底物的活性。
4.独立地确定样品中是否存在两种分析物的方法,其包括:
使所述样品接触结合有第一荧光能量共振转移(FRET)受体的第一分析物特异性的结合配偶体、结合有第二FRET受体的第二分析物特异性的结合配偶体和具有镧系元素螯合物部分的化合物;
使所述样品暴露于能够激发所述的第一和第二分析物特异性的结合配偶体的螯合物中的镧系元素的波长范围内的光;以及
分别独立地确定是否所述第一分析物特异性的结合配偶体和所述第二分析物特异性的结合配偶体结合所述第一分析物和所述第二分析物,从而独立地确定所述样品中是否存在所述两种分析物。
5.确定两种酶是否独立地对底物具有活性的方法,其包括:
提供包含底物的样品,其中所述底物标记有亲和标记物;
在足以用第一酶产生第一分析物并且用第二酶产生第二分析物的条件下使所述样品和两种不同的酶接触;
使所述样品具有镧系元素螯合物部分的亲和标记物特异性的结合配偶体接触;
使所述样品接触第一分析物特异性的结合配偶体和第二分析物特异性的结合配偶体,其中所述第一和第二分析物特异性的结合配偶体分别偶联于检测部分,其中之一是能够被波长为约600~635nm的光所激发,而另一检测部分能够被波长为约675~725的光所激发;
使所述样品暴露于能够激发所述螯合物中镧系元素的波长范围内的光;以及
分别独立地确定是否所述第一分析物特异性的结合配偶体和所述第二分析物特异性的结合配偶体结合所述第一分析物和所述第二分析物,从而独立地确定所述第一酶和所述第二酶对所述底物的活性。
6.项1~3所述的方法,其中在所述两个螯合物部分中的镧系元素是相同的。
7.项1~3所述的方法,其中所述偶联后的螯合物部分在两个结合配偶体中是相同的。
8.项1~3所述的方法,其中所述第一和第二分析物分别独立地偶联于检测部分。
9.项8所述的方法,其中所述检测部分之一能够被波长为约600~635nm的光所激发,而另一检测部分能够被波长为约675~715nm的光所激发。
10.项1~5的方法,其中所述镧系元素选自由铕、铽、钐和镝组成的组。
11.项1~5的方法,其中使所述样品暴露于波长为约315~350nm的光。
12.项1~5的方法,其中使所述样品暴露于波长为约320~340的光。
13.项1~5的方法,其中确定所述第一分析物特异性的结合配偶体是否结合所述第一分析物包括检测波长为约655~675nm的发射光。
14.项1~5的方法,其中确定所述第二分析物特异性的结合配偶体是否结合所述第二分析物包括检测波长为约715~740nm的发射光。
15.项1~5的方法,其中所述第一和第二分析物特异性的结合配偶体分别包括分析物结合分子。
16.项1~5所述的方法,其中所述样品对可见光是不透明的。
17.项1~5所述的方法,其中所述样品包括纯化分子、膜、组织提取液、血液(以及包含血清和血浆的血液衍生物)、细胞溶胞产物和细胞培养上清液,以及其它生物流体(脑脊液、尿)。
18.项4所述的方法,其中所述第一和第二分析物分别包括亲和标记物,并且具有镧系元素螯合物部分的所述化合物进一步包括亲和标记物特异性的结合配偶体。
- 还没有人留言评论。精彩留言会获得点赞!