一种高均一性单价链霉亲和素四聚体的应用的制作方法
[0001]
本发明涉及生物技术领域,具体地涉及一种由高均一性单价链霉亲和素四聚体在检测领域中提高稳定性的应用。
背景技术:
[0002]
链霉亲和素(streptavidin,下称sa)是streptomyces avidinii菌的外分泌物,与亲和素(avidin)有相似生物学特性的一种蛋白质,其分子量及结合生物素的能力与鸡蛋清中的亲和素相似,等电点6.0,非特异性结合远比亲和素低;sa是四聚体蛋白,大小为66kda。一分子链霉亲和素可以高度特异性地与四分子生物素结合,两者之间的亲和力极为强烈,链霉亲和素-生物素复合物的解离常数处于10mol/l数量级。
[0003]
在目前的体外诊断行业(ivd)和生物研究方面,链霉亲和素的四聚体主要应用到酶联免疫分析,以及与生物素结合应用于生物研究。在体外诊断行业研究开发免疫检测试剂盒时,其中有用到标记物。
[0004]
然而,在目前的生物研究和诊断应用中,四价的链霉亲和素仍然具有一些显著缺陷。第一,在市场上研发的组成试剂盒的成分中,其中一个组分是其中一个抗体标记生物素,其与四价的链霉亲和素标记荧光标记物的混合物进行结合,形成一个试剂盒组分。此种方法组成的试剂盒在后期测试和稳定性测试时,信号在短期内一直不稳定会下降。后来研究发现,此标记方法存在一个弊端,抗体标记生物素再和四价的链霉亲和素标记荧光标记物的混合物结合就会容易聚集形成大的聚体,继而短时间内就会产生沉淀。这一不稳定性使得试剂盒研发受阻。第二,人们在开发试剂盒时用抗体直接标记荧光标记物,以取代上面提到的方法。经过测试信号和稳定性实验研究,发现此方法虽然通过调节可减少沉淀的产生,但是还是容易产生沉淀以及不稳定性仍然存在。
[0005]
使用以上的方法所研发的试剂盒,其效果仍然不理想,仍然有容易形成沉淀这一现象。
[0006]
因此,本领域迫切需要开发一种改进的能够显著提高检测体系的稳定性的利用链霉亲和素进行体外诊断检测或生物研究的方法。
技术实现要素:
[0007]
本发明的目的就是提供一种改进的能够显著提高检测体系的稳定性的利用链霉亲和素进行体外诊断检测或生物研究的方法。
[0008]
在本发明的第一方面,提供了一种检测体系,所述检测体系包括:
[0009]
(a)一种多元复合物,所述多元复合物具有如式i所示的结构,
[0010]
(a-b)-(c-d
m
)
n
ꢀꢀ
(式i)
[0011]
式中的各元件包括:
[0012]
a为第二结合蛋白,所述第二结合蛋白可以特异性地结合于目标分析物;
[0013]
b为生物素;
[0014]
c为所述单价链霉亲和素四聚体;
[0015]
d为荧光标记物;
[0016]
“-”
为键或连接基团;
[0017]
并且,m为1到6之间的实数;
[0018]
并且,n为2到8之间的实数;
[0019]
(b)第一结合蛋白,所述第一结合蛋白交联于固相载体z0,并且所述第一结合蛋白可以特异性地结合于目标分析物;
[0020]
(c)任选的目标分析物;
[0021]
其中,所述第一结合蛋白和第二结合蛋白可分别与目标分析物的结合,两者互相之间不具有竞争性。
[0022]
在另一优选例中,所述荧光标记物为藻红蛋白rpe。
[0023]
在另一优选例中,所述单价链霉亲和素四聚体中,包含链霉亲和素野生型单体和链霉亲和素突变体单体。
[0024]
在另一优选例中,所述链霉亲和素突变体单体不具有结合生物素的功能。
[0025]
在另一优选例中,所述链霉亲和素野生型单体的氨基酸序列如seq id no:1所示。
[0026]
在另一优选例中,所述链霉亲和素突变体单体中,包括基于链霉亲和素野生型单体的以下突变:n12a、s16d和s34a。
[0027]
在另一优选例中,所述链霉亲和素突变体单体的氨基酸序列如seq id no:2所示。
[0028]
在另一优选例中,所述单价链霉亲和素四聚体中,所述链霉亲和素野生型单体和链霉亲和素突变体单体的摩尔比为1:3。
[0029]
在另一优选例中,所述单价链霉亲和素四聚体中,可包括用于蛋白质纯化的标签。
[0030]
在另一优选例中,所述标签的序列位于链霉亲和素野生型单体和/或链霉亲和素突变体单体的n端、c端或中间。
[0031]
在另一优选例中,所述标签包括:his标签、gst标签、trx标签、mbp标签、ha标签、c-myc标签、flag标签,或其组合。
[0032]
在另一优选例中,所述第二结合蛋白选自下组:抗原、抗体、配体、受体或其组合。
[0033]
在另一优选例中,所述m为1到6之间的正整数。
[0034]
在另一优选例中,所述m为1、2、3、4、5或6。
[0035]
在另一优选例中,所述m为2、3或4。
[0036]
在另一优选例中,所述n为3到8之间的正整数。
[0037]
在另一优选例中,所述n为3、4、5、6、7或8。
[0038]
在另一优选例中,所述n为3或4。
[0039]
在另一优选例中,所述多元复合物的浓度为0.01至0.4mg/ml,较佳地0.015至0.25mg/ml,更佳地0.03至0.07mg/ml。
[0040]
在另一优选例中,所述第一结合蛋白选自下组:抗原、抗体、配体、受体或其组合。
[0041]
在另一优选例中,所述固相载体材质选自下组:金属、玻璃、胶体、塑料或其组合。
[0042]
在另一优选例中,所述的固相载体材质包括:均聚物、共聚物、或其组合。
[0043]
在另一优选例中,所述的固相载体材质选自下组:聚苯乙烯、聚乙烯、聚丙烯、或其组合。
[0044]
在另一优选例中,所述的固相载体材质选自下组:微球、微孔板、板条、试管、或其组合。
[0045]
在另一优选例中,所述的z0为微球(bead)、颗粒(particle)或磁珠。
[0046]
在另一优选例中,所述检测体系中,所述z0的浓度,因为检测平台不同,偏差较大,为1
×
104至1.0
×
108个/ml,较佳地为1
×
104至1.5
×
107个/ml,更佳地为2
×
104至1.5
×
107个/ml。
[0047]
在另一优选例中,所述目标分析物包括:抗原、抗体、配体、受体、小分子,或其组合。
[0048]
在本发明的第二方面,提供了一种如本发明第一方面所述的检测体系的用途,用于检测样本中是否含有目标分析物。
[0049]
在另一优选例中,所述样本为离体样本或体外样本。
[0050]
在另一优选例中,所述样本来源于全血,优选为血清。
[0051]
在另一优选例中,当所述样本中含有目标分析物时,从分离自所述检测体系的固相载体中,可以检测到所述荧光标记物所发出的荧光信号。
[0052]
在另一优选例中,当所述样本中不含有目标分析物时,从分离自所述检测体系的固相载体中,无法检测到所述荧光标记物所发出的荧光信号。
[0053]
在本发明的第三方面,提供了一种试剂盒,所述试剂盒包括:容器以及位于所述容器内的用于形成如本发明第一方面所述的检测体系的原料试剂,其中,所述原料试剂中不包括待测样本中的目标分析物。
[0054]
在另一优选例中,所述试剂盒包括:
[0055]
(a)第一容器以及位于第一容器中的如本发明第一方面所述的检测体系中的第二结合蛋白a;
[0056]
(b)第二容器以及位于第二容器中的如本发明第一方面所述的检测体系中的生物素b;
[0057]
(c)第三容器以及位于第三容器中的如本发明第一方面所述的检测体系中的单价链霉亲和素四聚体c;
[0058]
(d)第四容器以及位于第四容器中的如本发明第一方面所述的检测体系中的荧光标记物d;
[0059]
(e)第五容器以及位于第五容器中的如本发明第一方面所述的检测体系中的第一结合蛋白;
[0060]
(f)第六容器以及位于第六容器中的如本发明第一方面所述的检测体系中的固相载体。
[0061]
在另一优选例中,所述的第一容器、第二容器、第三容器和第四容器可以是相同的或不同的容器。
[0062]
在另一优选例中,所述第五容器和第六容器可以是相同的或不同的容器。
[0063]
在另一优选例中,所述的第一容器、第二容器、第三容器、第四容器、第五容器和第六容器可以是相同的或不同的容器。
[0064]
在另一优选例中,所述试剂盒中还包括:
[0065]
(g)第七容器中以及位于第七容器中的校准品;
[0066]
(h)第八容器以及位于第八容器中的样本稀释液;
[0067]
(i)第九容器以及位于第九容器中的洗涤液;和/或
[0068]
(j)第十容器以及位于第十容器中的用于反应体系的缓冲液。
[0069]
在本发明的第四方面,提供了一种检测样本中是否存在目标分析物的方法,所述方法包括以下步骤:
[0070]
(i)提供如本发明第一方面所述的检测体系,其中不含有目标分析物,将所述不含有目标分析物的检测体系与样本或其稀释液进行混合,形成混合液,使其进行反应;
[0071]
(ii)从步骤(i)所得混合液中分离固相载体;和
[0072]
(iii)检测固相载体上是否携带来自于本发明第一方面所述的检测体系中的荧光标记物的荧光信号。
[0073]
在另一优选例中,在步骤(i)中,可包括子步骤:
[0074]
(i)将如本发明第一方面所述的检测体系中的第一结合蛋白和固相载体进行交联反应,形成含有交联于固相载体的第一结合蛋白的体系i;
[0075]
(ii)将步骤(i)中所得的体系i与样本或其稀释液进行混合,形成体系ii;
[0076]
(iii)提供如本发明第一方面所述的检测体系中的多元复合物,并将其与步骤(ii)所得的体系ii混合,形成步骤(i)中所述的混合液。
[0077]
在另一优选例中,在步骤(ii)中,还包括洗涤分离的固相载体的步骤,且该步骤可重复1-5次,优选地重复3次。
[0078]
在另一优选例中,在步骤(iii)中,所述的检测包括荧光检测法。
[0079]
在另一优选例中,所述荧光检测法采用酶标仪或者荧光分光光度计进行检测。
[0080]
在另一优选例中,所述的检测是体外或离体进行的。
[0081]
在另一优选例中,所述的检测是非诊断性的并且是非治疗性的。
[0082]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0083]
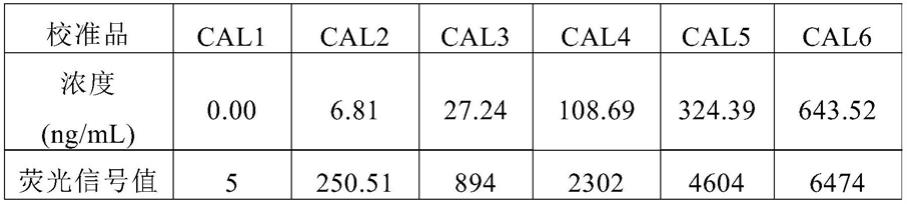
图1显示了本发明中高均一性单价链霉亲和素的四聚体制备纯化后的电泳图。
[0084]
图中数字1-4分别表示煮沸后的单价sa、二价sa、三价sa和四价sa;图中数字5-8表示未煮沸的无活性sa四聚体、单价sa四聚体、二价sa四聚体和四价sa四聚体。
[0085]
图2显示了本发明一实例中单价的链霉亲和素以1:1、1:2、1:3以及1:4标记藻红蛋白(rpe)的示意图。
[0086]
其中,
①-④
分别是指单价sa标记rpe分子比1:1、1:2、1:3和1:4的示意图。
[0087]
图3显示了市售四价的链霉亲和素标记藻红蛋白(rpe)分子比是1:1的示意图
[0088]
图4显示的是本发明中一实例中标有生物素的抗体与图2中单价链霉亲和素标记藻红蛋白(rpe)分子比分别是1:1和1:3的混合物进行不同分子比混合的示意图。
[0089]
其中,图4
①
和
②
分别表示:当分子比单价sa:rpe=1:1时,分子比ab-biotin:sa-rpe=1:3和1:4的混合示意图;图4
③
和
④
分别表示:当分子比单价sa:rpe=1:3时,分子比ab-biotin:sa-rpe=1:3和1:4的混合示意图。
[0090]
图5显示了标有生物素的抗体与图3中的市售四价链霉亲和素标记藻红蛋白(rpe)分子比是1:1的混合物进行分子比是1:0.86混合的示意图。
[0091]
图6显示的是抗体直接标记藻红蛋白(rpe)的示意图。
[0092]
图7显示的是本发明被用于癌胚抗原项目进行免疫检测时稳定性对比图片。
[0093]
其中,图7a和图7b中,对照组1是市售四价链霉亲和素标记藻红蛋白与抗体生物素的混合物,对照组2是抗体直接标记藻红蛋白与抗体生物素的混合物。,实验组是单价链霉亲和素标记藻红蛋白与抗体生物素的混合物。
[0094]
图8显示的是实施例2中常规稳定性测试中对照组1对应的荧光信号数据变化趋势图。
[0095]
其中,图8a是校准品cal1-cal6和质控品con1-con2相应的数据变化趋势图,图8b是质控品con1-con2和样本s1-s4相应的数据变化趋势图.
具体实施方式
[0096]
本发明人经过广泛而深入的研究,经过大量的筛选,首次开发了一种利用高均一性单价链霉亲和素四聚体来检测目标分析物的方法。
[0097]
本发明人首次发现,利用单价链霉亲和素的结合特性,调整其与荧光标记物结合的比例,以及调整单价链霉亲和素-荧光标记物与抗体-生物素结合的比例,可有效控制链霉亲和素标记荧光标记物与抗体标记生物素混合物的大小,减少聚集带来的沉淀现象以及解决荧光信号测值不稳定的问题。具体地,本发明人发现,通过制备单价链霉亲和素,然后让其与藻红蛋白以一定1:1至1:6的比例混合,抗体生物素与其形成的复合物以1:3至1:8的比例结合,形成一个多元复合物。此多元复合物在夹心法的流式荧光免疫检测试剂盒中作为其中的一个组分即为二抗,可以完全解决研发试剂盒带来的稳定性不好的问题。
[0098]
实验结果表明,通过把单价链霉亲和素与荧光标记物混合应用到免疫检测中,可有效控制与之结合的荧光蛋白数量以及严格控制单价链霉亲和素标记荧光蛋白混合物与抗体生物素混合物的用量,较大程度上降低聚集的可能性,延缓或减少沉淀,提高原材料的使用效率,避免原材料的浪费。同时可有效增加链霉亲和素与荧光蛋白聚集物的稳定性以及与抗体生物素结合混合物的稳定性,提高试剂稳定性,确保检测结果的有效性。
[0099]
在此基础上,完成了本发明。
[0100]
术语
[0101]
如本文所用,术语“四价链霉亲和素”、“四价sa”可互换使用,其组成链霉亲和素四聚体的四个单体蛋白都有活性,即一分子四价的链霉亲和素可以高度特异性地结合四分子的生物素。本发明采用的是市售四价的链霉亲和素。
[0102]
如本文所用,术语“标记物”指可以与抗原抗体以及一些蛋白结合的一类物质,可用于免疫分析技术中的免疫检测、荧光显微技术和流式细胞荧光测定等临床诊断及生物工程技术,主要常用的标记物有放射性核素、荧光物质、酶标记物、化学发光剂、量子点和胶体金,其中常用的荧光物质有有机化合物荧光素、稀土离子螯合物和荧光底物,而有机化合物荧光素包括异硫氰酸荧光素、四乙基罗丹明、四甲基异硫氰酸罗丹明和藻红蛋白等。在本发明的一个实施方式中,采用的是市售的藻红蛋白,简称rpe。
[0103]
如本文所用,术语“抗体”、“ab”可互换使用,是指一类由浆细胞分泌可以与抗原特
异性结合的免疫球蛋白,而且用常规标记方法可以与生物素和标记物等物质结合。其常被用于免疫检测等领域。本发明采用的是市售抗体。
[0104]
如本文所用,术语“生物素”、“biotin”可互换使用,是指可以与链霉亲和素高度特异性结合地的小分子物质而且可以用于标记抗体,以及用于免疫检测等领域中。本发明采用的是市售生物素。
[0105]
如本文所用,术语“抗体标记荧光标记物”、“ab-rpe”可互换使用,是指用常规的标记方法,抗体直接标记藻红蛋白形成混合物。其常被用于免疫检测中。在本发明中,其作为二抗使用。
[0106]
如本文所用,术语“抗体标记生物素”“ab-biotin”可互换使用,是指用常规的标记方法,抗体直接标记生物素形成混合物,再和链霉亲和素与藻红蛋白的混合物结合。其常被用于免疫检测。
[0107]
如本文所用,术语“链霉亲和素标记荧光标记物”、“sa-rpe”可互换使用,是指用常规的标记方法,链霉亲和素标记藻红蛋白形成混合物,再和抗体与生物素的混合物结合(此混合物在本发明中作为二抗)。其常被应用于免疫检测。
[0108]
单价链霉亲和素(单价sa)
[0109]
在已有的技术中,人们开发出了一种单价链霉亲和素(简称单价sa)。在单价sa中,组成链霉亲和素的四聚体蛋白只有一个单体具有活性,另外三个单体是活性缺失体,即一分子单价链霉亲和素可以高度特异性地结合一分子的生物素。
[0110]
在本发明的实施方式中,所述链霉亲和素野生型单体的氨基酸序列如seq id no:1所示。
[0111]
maeagitgtwynqlgstfivtagadgaltgtyesavgnaesryvltgrydsapatdgsgtalgwtvawknnyrnahsattwsgqyvggaearintqwlltsgtteanawkstlvghdtftkvkpsaas(seq id no:1)
[0112]
在本发明的实施方式中,所述链霉亲和素突变体单体的氨基酸序列如seq id no:2所示。
[0113]
maeagitgtwyaqlgdtfivtagadgaltgtyeaavgnaesryvltgrydsapatdgsgtalgwtvawknnyrnahsattwsgqyvggaearintqwlltsgtteanawkstlvghdtftkvkpsaas(seq id no:2)
[0114]
目前,单价的链霉亲和素被应用于神经胶质素测试、研究细胞表面蛋白转运等方面。另外,有些报道中提到突变链霉亲和素或突变链霉亲和素亚基可以结合到标签上,例如放射性标签、荧光标签、发光标签、发色团标签,以及产生可检测底物的物质和酶,如马萝卜过氧化物酶、荧光素酶或碱性磷酸酶。而且磁共振成像、pet探头和中子捕获治疗用硼10标记也可与突变链霉亲和素或突变链霉亲和素亚基结合。
[0115]
本发明所采用的单价链霉亲和素是参照美国专利申请us20070099248的专利《单价链霉亲和素复合物》中所提供的方法制备所得,其全文内容通过引用并入本文。
[0116]
在本发明中,单价链霉亲和素与藻红蛋白不同比例混合范围指sa与rpe的分子比,较佳的sa:rpe=1:1至1:6,优选的分子比1:3。
[0117]
单价链霉亲和素-藻红蛋白与抗体-生物素结合的理论比例范围指两者的分子比,ab-biotin:sa-rpe=1:1至1:n。为保证测试信号的实用性,以及考虑到节省原材料用量,本发明实验的比例范围为ab-biotin:sa-rpe=1:2至1:8,优选的分子比为1:4。
[0118]
为了便于理解本发明,本发明人提供了以下基本原理。然而,应理解,本发明的保
护范围并不受限于本发明的基本原理。
[0119]
(1)高均一性单价链霉亲和素四聚体的制备
[0120]
1.1将链霉亲和素野生型和活性缺失突变体分别克隆到pet21a载体中的ecroi和xhoi酶切位点得到两个重组质粒;
[0121]
1.2重组质粒转化到e.coli感受态细胞bl21(de3)中,细胞培养到0d600=0.7时加入诱导齐iptg至终浓度为1mm进行诱导,37℃诱导5小时后收集细胞,-20℃冻存;
[0122]
1.3冻存细胞按缓冲液:菌体重量5m1/g的比例使用破菌缓冲液重悬后在冰浴中进行超声波破碎,离心后取沉淀使用洗涤缓冲液重悬,在16℃搅拌洗涤30min,离心弃掉上清,重复洗涤至包涵体的纯度达到90%以上。
[0123]
1.4将尿素溶解的野生型、突变体链霉亲和素包涵体以质量比1:3进行充分混合,并利用快速稀释复性法进行包涵体的复性。复性的样品在4℃条件下搅拌4小时以上,离心弃掉沉淀;
[0124]
1.5将得到的链霉亲和素四聚体用ni-a缓冲液重悬,离心弃掉沉淀,得到的上清用nta介质进行亲和纯化,使用咪唑浓度梯度进行洗脱。
[0125]
所述的链霉亲和素野生型的c端带有his8-tag标签的重组蛋白。
[0126]
所述的链霉亲和素活性缺失突变体不含his8-tag标签。
[0127]
步骤1.3和1.4)所述的破菌缓冲液和所述的洗涤缓冲液都是由10mm pbs ph8.0制成。
[0128]
步骤1.4)所述的溶解缓冲液由10mm pbs ph8.0、8m urea制成。
[0129]
所述的快速稀释复性法进行包涵体的复性过程具体为:于4℃下将溶解的包涵体逐滴加入复性缓冲液(10mm pbs ph8.0)中,并充分搅拌,通过控制复性缓冲液的体积以保证复性过程中尿素的浓度不高于0.5m;
[0130]
步骤1.5)所述的ni-a缓冲液由10mm pbs ph8.0、5%甘油缓冲液制成;梯度咪唑浓度是指20mm咪唑、70mm咪唑,100mm咪唑,125mm咪唑和250mm咪唑溶液
[0131]
本发明的有益效果为:本发明提供了一种兼容野生型和突变体的链霉亲和素,将野生型、突变体链霉亲和素包涵体以质量比1:3混合,复性得到具有活性的多种链霉亲和素四聚体,并通过多步分离纯化得到的链霉亲和素单价四聚体,其具有较高的均一性、无重组标签,并且能够耐受多种因素而保持单价四聚体的稳定性。
[0132]
(2)链霉亲和素(单价和市售四价)标记藻红蛋白(rpe)的类型
[0133]
2.1市售四价链霉亲和素以1:1的分子比例标记藻红蛋白
[0134]
市售四价链霉亲和素先用还原剂dtt活化继而纯化透析,然后用交联剂spdp交联;藻红蛋白(rpe)通过疏水柱(hic)纯化后,用交联剂smcc交联。在标记四价链霉亲和素蛋白时加入1倍分子量的藻红蛋白进行标记,得到的标记产物记为a1。标记混合见图3示意图;
[0135]
2.2单价链霉亲和素分别以1:1、1:2、1:3、1:4、1:5和1:6的分子比例标记藻红蛋白
[0136]
单价链霉亲和素用与四价链霉亲和素相同的方法进行标记。在标记单价链霉亲和素蛋白时分别加入1倍、2倍、3倍、4倍、5倍和6倍分子量的藻红蛋白进行标记,得到的标记产物记为a
′
1、a
′
2、a
′
3、a
′
4、a
′
5和a
′
6。其中部分标记混合见图2示意图;
[0137]
(3)链霉亲和素和藻红蛋白标记的产物与标有生物素的第二抗体混合的类型
[0138]
3.1标记产物a1与第二抗体-生物素混合
[0139]
标有生物素的第二抗体中分别加入0.86倍分子量的市售四价链霉亲和素和藻红蛋白标记的产物进行混合,此时一分子链霉亲和素可以结合四个生物素。结合后的复合物分别记为b1-1,即实验中的二抗。见图5示意图;
[0140]
3.2标记产物a
′
1、a
′
2、a
′
3、a
′
4、a
′
5和a
′
6分别与第二抗体-生物素混合
[0141]
标有生物素的第二抗体中分别加入3倍和4倍分子量的单价链霉亲和素和藻红蛋白不同分子比标记的产物进行混合,此时因为链霉亲和素是单价的,所以只能结合一个生物素。结合后的复合物分别记为b
′
1-1、b
′
1-2、b
′
2-1、b
′
2-2、b
′
3-1、b
′
3-2、b
′
4-1、b
′
4-2、b
′
5-1、b
′
5-2、b
′
6-1和b
′
6-2即都是实验中的二抗。其中部分混合见图4示意图;
[0142]
(4)藻红蛋白-链霉亲和素-生物素-第二抗体的混合物用于体外诊断中免疫检测信号提高稳定性
[0143]
4.1藻红蛋白标记链霉亲和素
[0144]
取不同质量比的藻红蛋白(保存在60%的(nh4)2so4溶液中)分别标记链霉亲和素(四价和单价的同时进行),避光反应,透析去除还原剂dtt,保存待用。
[0145]
4.2生物素标记抗体
[0146]
取一定质量经过纯化透析后特异识别抗原(ag)的抗体,加入生物素的二甲基亚砜(dmso)溶液,避光反应,透析去除未反应的生物素,保存待用。
[0147]
4.3藻红蛋白标记的霉亲和素结合生物素标记的抗体
[0148]
取不同分子比的藻红蛋白-链霉亲和素(分单价和四价),加入到标有生物素的第二抗体溶液中进行结合,生成产物为藻红蛋白-链霉亲和素(分单价和四价)-生物素-抗体,即为二抗,记为b液。
[0149]
4.4捕获抗体包被微球
[0150]
针对某种抗原(ag)的捕获抗体与羧基化的聚苯乙烯微球(beads)共价交联得到beads与捕获抗体的耦联混合物为ab-beads,即为一抗记为c液。
[0151]
4.5抗原校准品溶液的配制
[0152]
用抗原(ag)的标准品配制一定浓度的标准品溶液。
[0153]
4.6体外诊断免疫反应以及信号检测
[0154]
根据tesmi f3999+luminex多功能流式点阵仪进行测试,把相应的a液、校准品、b液和c液依次根据该机器上的常规15+15min模式进行手工测试。分别有对照组和实验组,对照组中有市售四价的链霉亲和素标记藻红蛋白(rpe)与抗体标记生物素混合物和抗体直接标记藻红蛋白(rpe)混合物的两种类型;实验组是自制单价链霉亲和素标记藻红蛋白(rpe)和抗体标记生物素混合物的样例。
[0155]
4.7体外诊断免疫检测信号稳定性
[0156]
实验操作过程同4.6所述。稳定性实验分为短期常规稳定性检测和短期加速稳定性检测:
[0157]
(1)短期常规稳定性检测:
①
对照组1和2:市售四价链霉亲和素标记藻红蛋白(rpe)与抗体标记生物素混合物和抗体直接标记藻红蛋白(rpe)混合物的保存温度都为2-8℃;
②
实验组:自制单价链霉亲和素标记藻红蛋白(rpe)和抗体标记生物素混合物的保存温度也是2-8℃;
③
对照组1和2和实验组进行稳定性测试的时间分别是1天、4天、7天、14天、38天和68天。
[0158]
(2)短期加速稳定性检测:
①
对照组1和2:市售四价链霉亲和素标记藻红蛋白(rpe)与抗体标记生物素混合物和抗体直接标记藻红蛋白(rpe)混合物的保存温度都为室温;
②
实验组:自制单价链霉亲和素标记藻红蛋白(rpe)和抗体标记生物素混合物的保存温度也是室温;
③
对照组1和2和实验组进行稳定性测试的时间分别是1天、4天、7天和14天。
[0159]
(通过每次测试的信号变化的百分比来评定此发明物进行标记带来的稳定性)
[0160]
本发明的主要优点包括:
[0161]
1)通过单价sa,能高度特异性地的结合一分子生物素,在聚合/标记过程中,控制藻红蛋白-单价链霉亲和素与抗体-生物素混合后复合物的大小,避免有巨大聚合物的形成,从而形成沉淀等,提高中间品,继而提高检测试剂的稳定性,保障了检测的稳定性及准确性。
[0162]
2)通过单价sa能高度特异性地的结合一分子生物素,在不降低检测灵敏度、特异性等性能的基础上,以及不会有沉淀形成,保障稳定性的基础上来看,大大减少了抗体以及标记物藻红蛋白的用量,节约原料成本。同时稳定的中间品及试剂,也可进一步延长试剂的使用时间,一定程度上,减少了因不稳定导致的重新配置所带来的成本、时间浪费现象。
[0163]
3)对于组建试剂盒以及免疫检测节约大量时间成本,提高研发水平和效率利用本发明,可省略为保障四价-链霉亲和素-藻红蛋白与抗体-生物素复合物以及直接标记模式抗体-藻红蛋白复合物的稳定性而反复测定的时间和人工成本,具有更高的效率。
[0164]
4)本发明的单价sa不仅可以应用到免疫检测中的流式平台上,还可以应用到化学发光平台以及其他平台,应用范围较广。
[0165]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0166]
实施例1:市售四价的链霉亲和素和自制单价链霉亲和素被用于癌胚抗原免疫分析检测
[0167]
1、单价链霉亲和素的制备
[0168]
1.1原料
[0169]
pet21a载体;
[0170]
e.coli感受态细胞bl21(de3);
[0171]
诱导剂iptg;
[0172]
10mm pbs溶液、10mm pbs+5%甘油溶液和10mm pbs+8m urea溶液;
[0173]
20mm咪唑、70mm咪唑,100mm咪唑,125mm咪唑和250mm咪唑溶液;
[0174]
sds-page(15%)电泳材料;
[0175]
超声波细胞破碎仪(scientz-ii17);
[0176]
日立高速冷冻离心机(cr21g)。
[0177]
1.2操作步骤
[0178]
01.根据上述单价链霉亲和素制备的基本原理进行实验操作;
[0179]
02.见图1中的两张示意图:用sds-page电泳来鉴定洗脱后得到的链霉亲和素四聚
体(煮沸和非煮沸)分离的各个洗脱峰分别取两组样品,一组加热煮沸的和另外一组不进行加热煮沸的,都使用sds-page(15%)分析结果。因为链霉亲和素四聚体比较稳定,不加热的时候在sds-page过程中仍保持四聚体的形式,如图1中的数字5、6、7和8对应的图片;而100℃加热5min可以破坏链霉亲和素的四聚体,形成单体,如图1中的数字1、2、3和4对应的图片。所以对两组sds-page的结果进行综合分析能够揭示各个洗脱峰的组成,最后确认洗脱峰在咪唑浓度为70mm时含有较高纯度的1个野生型单体(w)和3个突变单体(m)组成的单价链霉亲和素四聚体(w1m3);
[0180]
2.市售四价的链霉亲和素和单价链霉亲和素被用于免疫分析检测
[0181]
此处以tesmi f3999+luminex多功能流式点阵仪检测癌胚抗原为例说明本专利可检测信号提高稳定性的有效性。
[0182]
根据基本原理的阐述,市售的四价链霉亲和素用于免疫分析,信号理论上应与常规抗体直标的信号一致或者高于其;自制的单价链霉亲和素用于免疫分析应能达到市售四价链霉亲和素的信号且同样应与常规抗体直标的信号一致或者高于。
[0183]
2.1癌胚抗原相应的抗体直接标记藻红蛋白检测癌胚抗原(见图6)
[0184]
2.1.1操作
[0185]
01.将本公司市售的甲胎蛋白/癌胚抗原定量检测试剂盒校准品(批号151101)中的cal1-cal6复溶;
[0186]
02.将标记的cea-rpe(浓度为0.439mg/ml)和磁性微球(浓度:1.5*107个/ml)用pbs-tbn稀释液(批号:180501)稀释到相应的工作浓度0.8ug/ml和1.0*105个/ml;
[0187]
03.根据甲胎蛋白/癌胚抗原定量检测试剂盒说明书操作,获取校准品cal1-cal6这六个平行样的荧光信号,结果见下表:
[0188]
表1:校准品cal1-cal6的荧光信号值
[0189][0190]
2.2常规抗体-生物素与四价链霉亲和素-藻红蛋白结合检测癌胚抗原
[0191]
2.2.1原料
[0192]
市售的四价链霉亲和素(sa);
[0193]
公司购买的cea抗体;
[0194]
生物素(biotin,市售);
[0195]
藻红蛋白(20mg/ml,rpe,市售);
[0196]
疏水柱(hic柱)阴离子柱(deae柱)填料
[0197]
市售的交联剂spdp(浓度为3mg/320ul)和smcc(2mg/ml)、活化剂dtt(50mmol/l)、试剂gly(10%)和dmso以及自制的pbs(10mmol/l)溶液。
[0198]
2.2.2操作
[0199]
01.取适量市售四价的链霉亲和素,用10mm pbs溶液配制到浓度均为2mg/ml;
[0200]
02.对四价链霉亲和素进行活化用spdp交联剂和dtt活化剂,使其可以和活化好的藻红蛋白(rpe)进行结合;
[0201]
03.取适量的藻红蛋白(rpe),经过疏水柱(hic)纯化,再用smcc试剂进行活化,然后经过阴离子柱deae进行纯化;
[0202]
04.把活化好的链霉亲和素和藻红蛋白以常规的比例进行混合(即分子比sa:rpe=1:1),混合条件2℃-8℃、过夜;
[0203]
05.取适量的癌胚抗原cea标记抗体(浓度:2.0mg/ml)和质量为1.42mg的生物素(biotin),用dmso配制到浓度为1.5mg/ml,两者以一定质量比(m/m)进行反应,反应条件2℃-8℃、2h;终止用10%gly终止;
[0204]
06.反应好的cea-biotin和sa-rpe以常规的分子比(cea-biotin:sa-rpe=1:0.86)进行混合(混合物浓度为0.4761mg/ml);
[0205]
07.测试操作:将本公司市售的甲胎蛋白/癌胚抗原定量检测试剂盒校准品(批号151101)中的cal1-cal6复溶;将标记的cea-biotin-sa-rpe(浓度:0.4761mg/ml)和磁性微球(浓度:1.5*107个/ml)用pbs-tbn稀释液稀释到相应的工作浓度0.8ug/ml和1.0*105个/ml;
[0206]
08.根据甲胎蛋白/癌胚抗原定量检测试剂盒说明书操作,获取校准品cal1-cal6这六个平行样的荧光信号,结果见下表:
[0207]
表2:校准品cal1-cal6的荧光信号值
[0208][0209][0210]
2.3抗体-生物素与单价链霉亲和素-藻红蛋白结合检测癌胚抗原
[0211]
2.3.1原料
[0212]
自制单价链霉亲和素
[0213]
其他使用的试剂与上述四价的链霉亲和素是相同的
[0214]
2.3.2操作
[0215]
01.取适量自制单价的链霉亲和素,用10mmol/l的pbs溶液配制到浓度均为1.39mg/ml;
[0216]
02和03操作步骤和上述2.2.2的操作一致。
[0217]
04.根据上述基本原理的阐述:把活化好的单价链霉亲和素和藻红蛋白以其中的一种比例进行混合(分子比sa:rpe=1:3),混合条件2℃-8℃、过夜;
[0218]
05.操作步骤和上述2.2.2的操作一致;
[0219]
06.根据上述基本原理的阐述:反应好的cea-biotin和sa-rpe以一种分子比进行混合。即当分子比sa:rpe=1:3时,混合分子比为(cea-biotin:sa-rpe=1:4),此混合物的浓度为0.0445mg/ml;
[0220]
07和08操作步骤和上述2.2.2的操作一致,获取校准品cal1-cal6这六个平行样的荧光信号,结果见下表:
[0221]
表3:分子比sa:rpe=1:3时校准品cal1-cal6的荧光信号值
[0222][0223][0224]
通过以上2.1、2.2以及2.3这三个免疫信号测试实验可知:自制单价的链霉亲和素免疫检测癌胚抗原时,在sa:rpe=1:3以及在分子比cea-biotin:sa-rpe=1:4时,单价链霉亲和素标记藻红蛋白在测试荧光信号与抗体直接标记藻红蛋白的荧光信号相比,高于抗体直标的信号;另外,与常规市售四价链霉亲和素标记藻红蛋白免疫检测癌胚抗原时(即当sa:rpe=1:1,cea-biotin:sa-rpe=1:0.86)测试荧光信号差异不大,信号几乎一致。
[0225]
实施例2:单价链霉亲和素与藻红蛋白混合的一种比例以及这一比例与抗体生物素混合的一种比例在用于免疫检测的稳定性实验
[0226]
此处以tesmi f3999+luminex多功能流式点阵仪检测癌胚抗原为例说明本专利可提高稳定性的有效性。
[0227]
根据基本原理的阐述以及示意图的体现,本专利的单价链霉亲和素的应用应该不仅在测试信号能达到或高于市售四价的链霉亲和素和抗体直接标记藻红蛋白的信号而且在用于免疫检测应比市售四价的链霉亲和素以及现在用的抗体直接标记发光物它们的稳定性要好、要高。
[0228]
1短期常规稳定性测试和加速稳定性测试实验
[0229]
1.1原料
[0230]
本公司市售“甲胎蛋白/癌胚抗原定量检测试剂盒校准品”(批号151101);
[0231]
癌胚抗原的质控品(con-1,con-2,批号:180501);
[0232]
癌胚抗原相关的血清4个(s1、s2、s3和s4);
[0233]
抗体(cea)包被的磁性微球(浓度:1.5*107个/ml,批号180401);
[0234]
对照组1:本公司生产部标记的二抗(0.439mg/ml,cea-rpe,批号180701-1)对照组2:市售四价链霉亲和素sa:rpe=1:1时,同时分子比为cea-biotin:sa-rpe=1:0.86(浓度:0.4761mg/ml)
[0235]
实验组:根据上述基本原理:选择自制单价链霉亲和素sa:rpe=1:3时,同时分子比为
[0236]
cea-biotin:sa-rpe=1:4(浓度:0.0445mg/ml)
[0237]
对照组和实验组的试剂保存温度分为是2-8℃和室温两种,都加入了0.02%的防腐剂nan3;
[0238]
tesmi f3999+luminex多功能流式点阵仪检测平台上肿瘤标志物通用的a液(批号:180301)和d液(鞘流液);
[0239]
pbs-tbn稀释液(批号:180501)。
[0240]
1.2操作
[0241]
01.将甲胎蛋白/癌胚抗原定量检测试剂盒校准品中的cal1-cal6复溶;同时把质控品和样本血清放置室温待用。
[0242]
02.将标记的cea-rpe以及自制的cea-biotin:sa-rpe和磁性微球用pbs-tbn稀释液稀释到相应的工作浓度0.8ug/ml和1.0*105个/ml;
[0243]
03.根据甲胎蛋白/癌胚抗原定量检测试剂盒说明书操作,获取校准品cal1-cal6这六个平行样的荧光信号
[0244]
04.稳定性测试结果见表1、表2、表3和表4,稳定性表观图片见图7a和图7b
[0245]
根据上述稳定性测试的基本原理可知稳定性测检测间用的校准品始终是同一批次,浓度和有效期是一样的以及在这期间用的配对抗体(包被磁性微球的抗体)的浓度和批次始终是一致的;对照组1、对照组2和实验组在稳定性测试期间检测使用的工作浓度和批次也是一致的;另外,在检测稳定性期间的质控品和样本也始终是同一批次、同一样本和同一浓度,其中质控品有2个(批次始终相同,随机抽一个批次),其中检测样本有4个(分别随机从浓度高、中、低抽出4个样本)
[0246]
表1:常规短期稳定性测试时(2-8℃保存)校准品cal1-cal6的荧光信号值
[0247]
[0248]
[0249][0250]
表2:短期加速稳定性测试时(室温保存)校准品cal1-cal6的荧光信号值
[0251]
[0252][0253]
结合表1和表2以及附图8可知每组各自的实验数据变化趋势是一致的,测试中对照组和实验组的cal1-cal6信号、质控品信号和样本信号都是同步变化的,下降的比例和波动趋势几乎是一致的,因测试数据量较庞大,所以选择对照组和实验组中的校准品中cal4信号和样本中的s3作为代表进行统计测试信号变化情况,总结见表3和表4。
[0254]
表3:短期常规稳定性检测信号(以测试中的cal4和s3为例)以及现象总结表
[0255]
[0256][0257]
表4:短期加速稳定性检测信号(以测试中的cal4和s3为例)以及现象总结表
[0258][0259]
通过表3、表4可知:初始对照组2和实验组荧光信号差不多,均高于对照组1。
[0260]
从常规稳定性测试来看,对照组1从第4天出现浑浊,第14天出现沉淀,此时以校准
品cal4和样本s3为代表的荧光信号值已下降近一半,对照组2同样在第14天出现沉淀,荧光信号降低也接近一半。而实验组,在38天以前,常规稳定性测试中信号几乎没有出现下滑,在38天以后信号下降幅度在10%左右,但样品仍是透明状态。
[0261]
在加速稳定性测试中,对照组1在第14天以校准品cal4和样本s3为代表的荧光信号下降分别是76.5%和80.1%,且有沉淀产生,对照组2对应的荧光信号下降分别是82.6%和83.3%,也有沉淀产生。而实验组仅下降0.8%,有效避免了沉淀的产生,确保了荧光信号的稳定。
[0262]
实施例3:单价链霉亲和素与藻红蛋白混合的其他比例应用于癌胚抗原免疫分析检测
[0263]
此处用同与实施例2的仪器检测癌胚抗原为例说明本专利的范围较大。
[0264]
根据基本原理的阐述,本专利的单价链霉亲和素在一定范围内与藻红蛋白不同比例混合,继而这些比例的混合物与抗体生物素一种比例混合进行实验。
[0265]
单价链霉亲和素与藻红蛋白混合的其他比例用于癌胚抗原的稳定性测试,根据实施例2的实验设计,由于测试数据太庞大,我们根据其的稳定性测试时间和数据规律,选择在常规2-8℃温度保存的情况下测试,稳定性测试的对象只选择相应的校准品(cal1-cal6),测试时间选择在第1天和第50天作为代表;在稳定性测试期间应用的校准品批号始终相同。
[0266]
1单价链霉亲和素与藻红蛋白(即sa:rpe=1:1和1:6)应用癌胚抗原的信号和稳定性测试实验
[0267]
1.1原料
[0268]
用到的校准品和抗体包被的微球同与实施例2;
[0269]
本公司生产部标记的二抗对照组1:cea-rpe(浓度:0.439mg/ml)
[0270]
对照组2:市售四价链霉亲和素sa:rpe=1:1时,同时分子比为cea-biotin:sa-rpe=1:0.86(浓度:0.4761mg/ml)
[0271]
实验组1:自制单价链霉亲和素sa:rpe=1:1时,同时分子比为
[0272]
①
cea-biotin:sa-rpe=1:4(c=0.1020mg/ml),
[0273]
实验组2:自制单价链霉亲和素sa:rpe=1:6时,同时分子比为
[0274]
②
cea-biotin:sa-rpe=1:4(c=0.0242mg/ml),
[0275]
对照组和实验组的样品保存温度都是2-8℃,都加入了0.02%的防腐剂nan3
[0276]
1.2操作
[0277]
01.测试操作:具体实验操作步骤同于实施例2;
[0278]
02.根据甲胎蛋白/癌胚抗原定量检测试剂盒说明书操作,获取校准品cal1-cal6这六个平行样的荧光信号,
[0279]
单价链霉亲和素与藻红蛋白混合(即sa:rpe=1:1和1:6)被用于癌胚抗原的测试数据结果见表5
[0280]
表5:单价链霉亲和素与藻红蛋白混合(即sa:rpe=1:1和1:6)测试荧光信号值
[0281][0282]
从表5可知,此数据变化趋势类似于实施例2中数据的变化,所以上述两种比例的测试都选择校准品cal5的信号值变化作为代表进行总结。
[0283]
表6:单价链霉亲和素与藻红蛋白混合(即sa:rpe=1:1和1:6)测试数据(以校准品cal5为代表)总结表
[0284][0285]
通过表5和表6的数据可知:在单价链霉亲和素与藻红蛋白混合比例范围内的随机两个比例(即sa:rpe=1:1和1:6)对照组2、实验组1和实验组2的测试荧光信号都较高于对照组1的信号。
[0286]
第一天对照组1、对照组2、实验组1和实验组2的信号都没下降,而且样品都是透明状态。放置50天后,对照组1和对照组2的荧光信号分别下降了80.5%和84.5%,且样品几乎全沉淀了;实验组1和实验组2的荧光信号仅仅下降了3.7%,很大程度上控制了样品的聚集以及沉淀的产生,高效的保持测试荧光信号的稳定。继而说明单价链霉亲和素与藻红蛋白在混合比例sa:rpe=1:1-1:6的范围都是适用的。
[0287]
实施例4:单价链霉亲和素与藻红蛋白的混合物与抗体生物素不同比例混合应用于癌胚抗原免疫分析检测
[0288]
此处用同于实施例2的仪器检测癌胚抗原为例说明本专利的范围较大。
[0289]
根据基本原理的阐述,本专利的单价链霉亲和素与藻红蛋白在范围内随机一种比例混合,继而与抗体生物素不同比例混合进行实验,此实验就随机选择两个比例进行实验。
[0290]
此实验的设计方案同与实施例2,所以选择在常规2-8℃温度保存的情况下测试,稳定性测试的对象只选择相应的校准品(cal1-cal6),测试时间同样选择在第1天和第50天作为代表;在稳定性测试期间应用的校准品批号始终相同。
[0291]
1单价链霉亲和素和藻红蛋白的混合物与抗体生物素不同比例混合(即当sa:rpe=1:3时,ab-biotin:sa:rpe=1:3和1:8)应用癌胚抗原的信号和稳定性测试实验
[0292]
1.1原料
[0293]
用到的校准品和抗体包被的微球同于实施例2;
[0294]
对照组1:市售四价链霉亲和素sa:rpe=1:1时,同时分子比为cea-biotin:sa-rpe=1:0.86(浓度:0.4761mg/ml)
[0295]
自制单价链霉亲和素sa:rpe=1:3时,同时分子比为
[0296]
实验组1:
①
cea-biotin:sa-rpe=1:3(c=0.0581mg/ml),
[0297]
实验组2:
②
cea-biotin:sa-rpe=1:8(c=0.0227mg/ml),
[0298]
对照组和实验组的样品保存温度都是2-8℃,都加入了0.02%的防腐剂nan3
[0299]
1.2操作
[0300]
01.测试操作:具体实验操作步骤同于实施例2;
[0301]
02.根据甲胎蛋白/癌胚抗原定量检测试剂盒说明书操作,获取校准品cal1-cal6这六个平行样的荧光信号,
[0302]
单价链霉亲和素和藻红蛋白的混合物与抗体生物素不同比例混合(即当sa:rpe=1:3时,cea-biotin:sa:rpe=1:3和1:8)的测试结果见表7
[0303]
表7:混合物不同比例(即cea-biotin:sa:rpe=1:3和1:8)测试荧光信号值
[0304][0305][0306]
从表7可知,此数据变化趋势类似于实施例2,所以上述两种比例的测试可以选择校准品cal5的信号值变化作为代表进行总结。
[0307]
表8:混合物不同比例(即cea-biotin:sa:rpe=1:3和1:8)测试数据(以校准品cal5为代表)总结表
[0308][0309]
通过表7和表8的数据可知:在单价链霉亲和素和藻红蛋白的混合物与抗体生物素不同比例混合(即cea-biotin:sa:rpe=1:3和1:8),实验组1测试荧光信号一直较高于对照
组的信号。实验组2开始低于对照组的荧光信号,后期信号高于对照组的信号且一直是稳定的。
[0310]
第一天对照组1、实验组1和实验组2的信号都没下降,而且样品都是透明状态。放置50天后,对照组1的荧光信号下降了80.3%,且样品几乎全沉淀了;实验组1和实验组2的荧光信号分别下降了5.0%和2.7%,很大程度上控制了样品的聚集以及沉淀的产生,高效的保持测试荧光信号的稳定。继而说明混合物比例在cea-biotin:sa:rpe=1:3和1:8都是适用的,此范围可以更高。
[0311]
上述实施例1、2、3和4讲述的都是以免疫检测中肿瘤标志物为实验对象,此实验说明本发明在肿瘤标志物中是通用的。以此推及,在其他免疫项目中也同样具有普遍适用性。即,本发明还适用于免疫检测中的自身免疫项目、心肌标志物、肝功能检测以及torch和呼吸道感染等项目。
[0312]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1