一种轻量型切口疝补片三维超声图像特征提取方法与流程
本发明属于图像处理技术领域,具体涉及一种轻量型切口疝补片三维超声图像特征提取方法。
背景技术:
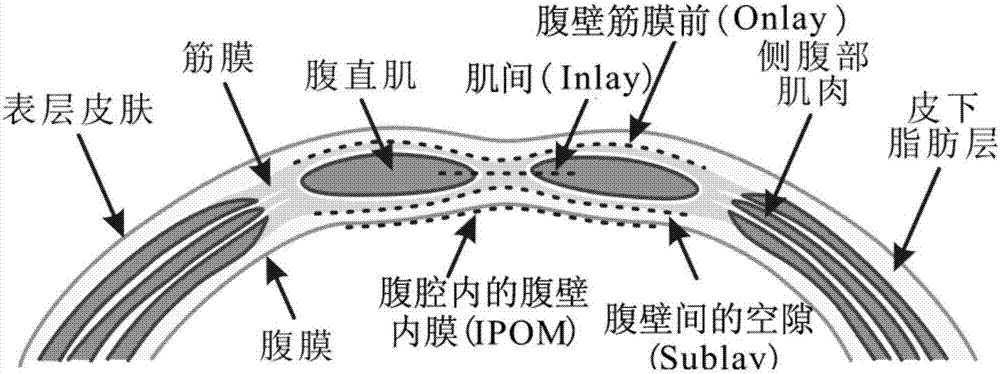
轻量型补片厚度通常不足0.5mm,编织孔径在3mm以上,异物残留量很小,导致其回声信号较弱,在成像结果中的线条状高回声像不够明显。同时,在腹壁疝修补术中,轻量型补片可以被放置于腹壁筋膜前(Onlay)、肌间(Inlay)、筋膜与腹膜间的空隙(Sublay)和腹腔内的腹膜内壁(IPOM)四个与腹壁解剖结构层次相关的位置(如图2所示),而所有植入位置都较为靠近筋膜组织。然而,在HHUS(hand-held ultrasound,二维手持超声)的剖面视图(横断面和/或矢状面)中,由于轻量型补片和筋膜组织通常都显示为一个线状的高回声区域[9]。因此,HHUS剖面视图的条状纹理特征所反映的是轻量型补片和筋膜组织相互重叠的混合纹理属性。筋膜可以看作是轻量型补片鉴别时的解剖学噪声,不仅有害于人工检测,更大大降低了该条状纹理在计算机图像识别时对筋膜和轻量型补片的鉴别诊断价值。
由于HHUS图像中轻量型补片和筋膜组织相互重叠,因此很难将轻量型补片从其周围的筋膜组织中区分出来。然而,ABUS(automated 3-D breast ultrasound,自动化三维乳腺超声)通过其冠状面(手术平面)为轻量型补片的鉴别提供了额外的诊断信息,新的冠状面视图能够从筋膜组织中分离出轻量型补片,从而呈现出了显著的轻量型补片网孔纹理可视化。因此,ABUS提供了有选择性地分析轻量型补片冠状面纹理特征的可能性,具有提供更加准确的特征参数来描绘网孔纹理的潜能,能够从本质上为轻量型补片的识别提供更准确的特征参数。
技术实现要素:
本发明的目的在于提出一种轻量型切口疝补片三维超声图像特征提取方法,以便能够准确地提取轻量型切口疝补片三维超声图像特征,便于后续处理过程中自动分类识别。
本发明提出的轻量型切口疝补片三维超声图像特征提取方法,首先使用纹理特征萃取算法自动量化提取ABUS图像的VOI(volume of interest,感兴趣容积)中待分类区域的相关纹理特征参数,以便用于对补片和筋膜的区分;然后针对二维纹理参数对切口疝补片术后卷曲、收缩等空间变换较为敏感的问题,引入了三维纹理参数和三维位置参数,来提高轻量型补片 分类识别算法的鲁棒性;最后使用类间距算法和顺序前进搜索法来进行特征选择。
本发明的具体步骤如下:
S1:构建一个ABUS冠状面的2-D(two-dimensional,二维)前景掩模;
S2:提取VOI;
S3:对VOI图像进行预处理操作;
S4:经过预处理之后,给定一组VOI的待分类区域,逐一对每个待分类区域进行特征提取,对每一个待分类区域总共提取40项特征;
S5:对提取的40项特征进行特征选择,最终选取11个使轻量型补片和筋膜的分类误差达到最小的特征作为特征组合。
下面就本发明方法中步骤涉及的相关技术细节作进一步的具体描述:
1.步骤S1中,所述构建一个冠状面的2-D前景掩模,其步骤为:
S1.1:将所有位于0.5至0.9倍扫描总深度的ABUS冠状面切片C1-Cn取出,对所有C1-Cn图像中相同位置的像素点做均值处理,得到一张冠状面均值图像Cmean;
S1.2:使用Otsu算法对图像Cmean进行阈值处理,得到二值图像Cbinary;
S1.3:采用形态学开运算对Cbinary图像中的连通区域进行边界平滑处理,并对其最大白色连通区域中由病灶或阴影造成的黑色空洞进行填充,得到冠状面2-D前景掩模图像Cmask。
2.步骤S2中,所述提取VOI,其步骤为:
S2.1:从ABUS冠状面掩模图像Cmask左上角开始,将图像等分为50×50像素的图像块;当在右边界和下边界处遇到像素不足无法分块时,则添加适当黑色区域;
S2.2:将所有全黑图像块(所有像素点的二值化取值之和为0)的冠状面位置特征置为0,将所有与前景掩模边界相交的图像块(所有像素点的二值化取值之和在1至49之间)的冠状面位置特征置为1,将所有全白图像块(所有像素点的二值化取值之和为50)的冠状面位置特征置为2;
S2.3:逐一将所有冠状面位置特征不为0的图像块选取为当前ROI(region of interest,当前感兴趣区域);使用所有与ROI相关的ABUS横断面和矢状面图像区域,将2-D的ROI扩展为3-D的VOI;逐一将当前VOI送入后续特征提取模块,直至完成对所有VOI的遍历。
3.步骤S3中,所述对VOI图像进行预处理操作,其步骤为:
S3.1:使用3-D ISRAD(intelligent speckle reducing anisotropic diffusion,智能斑点降噪各向异性扩散)算法[1]对自动提取出的VOI进行三维滤波处理,以尽量滤除ABUS图像同质区域中所含的斑点噪声而不破坏例如轻量型补片网状纹理等细节特征;
S3.2:使用Otsu算法[8]对位于VOI中心的单帧横断面图像做二值化处理,得到备选白色连通区域;
S3.3:使用开运算删除二值图像中所有面积小于15像素的白色连通区域;
S3.4:萃取出每个白色连通区域的最小外切边界框,计算出边界框的宽度、高度和顶点坐标;
S3.5:删除边界框的宽度<15像素的白色连通区域;
S3.6:对所有剩余白色连通区域进行编号标注,以作为待分类区域。
4.步骤S4中,所述逐一对每个待分类区域进行特征提取,其步骤为:
S4.1:提取待分类区域的2-D纹理特征;
S4.2:提取待分类区域的3-D纹理特征;
S4.3:提取待分类区域所处扫描深度的局部特征,以一个基于待分类区域所处扫描深度即ABUS的Y-方向的局部特征fdepth来表征补片的出现几率;
S4.4:提取待分类区域与疝囊位置关系的环境特征,以一个基于待分类区域与疝囊位置关系的位置参数fadjacency来表征补片的出现几率。
这里主要使用已被理论证明有效并得到广泛应用的GLCM(gray level co-occurrence matrix,灰度共生矩阵)[2]来将待分类区域图像中的灰度值转化为纹理信息。同时,针对轻量型补片在冠状面会呈现出显著的网状纹理的特点,还加入了较适合于网状纹理分析的FD(fractal dimension,分形维数)[3]特征。针对轻量型补片在术后可能会出现的具有空间变换特征的收缩、卷曲等的临床现象,还进一步引入了3-D GLCM[4]和3-D FD[5]以提取待分类区域的三维纹理特征。针对ABUS扫描属性和切口疝补片植入位置特性,还提出了两项待分类区域的位置特征(即局部特征和环境特征对应)。综上,总共使用40项参数来对每个待分类区域进行特征表述。其中,包括25项2-D纹理特征,13项3-D纹理特征,1项基于待分类区域所处扫描深度的局部特征,1项基于待分类区域与疝囊位置关系的环境特征。
5.步骤S4.1中,所述提取待分类区域的2-D纹理特征,分两步进行:
第一步,计算待分类区域横断面单帧切片的12项2-D GLCM纹理特征。首先,提取出VOI中心的单帧横断面降噪图像;其次,对每个待分类区域在扫描深度方向做上下5像素的区域扩展;接着,分割出每个待分类区域的横断面单帧切片;最后,对该单帧切片计算12项描述符,作为该待分类区域横断面单帧切片的2-D GLCM纹理特征;
第二步,计算待分类区域冠状面切片序列的12项2-D GLCM纹理特征和1项2-D FD特征。首先,提取出与每个待分类区域所处扫描深度对应的所有冠状面切片序列;其次,对于 每项描述符fi(i=1...n,n是冠状面切片序列的层数),使用描述符fi依次对每张冠状面切片进行计算,得出一组特征值[f1...fn];最后,取[f1...fn]的均值Fmean作为该项描述符对于待分类区域冠状面切片序列的特征值。
对于2-D GLCM,如同最初由学者Haralick在文献[2]中对GLCM的定义,二维图像中的两个像素点的空间位置差异可以用位移向量来描述。d为两像素点间的距离,为两像素点与坐标轴的夹角。对于一个给定距离d,在4个独立的方向上共可能有8个相邻的像素对出现,如图4所示。那么,在二维图像中的方向相隔d的一对像素对,分别具有灰度i和j出现的概率,即记为pij。将由pij组成的矩阵归一化即可得到图像的灰度共生矩阵。
Haralick在文献[2]中,共提出从GLCM中计算出的14项纹理特征。本发明选择了其中的12项特征,包含能量(f1-Energy)、对比度(f2-Contrast)、相关(f3-Correlation)、方差(f4-Variance)、同质性(f5-Homogeneity)、均值(f6-Sum Average)、熵(f7-Entropy)、自相关(f8-Autocorrelation)、差异性(f9-Dissimilarity)、集群阴影(f10-Cluster Shade)、集群突出(f11-Cluster Prominence)和最大概率(f12-Maximum Probability)。
其中,Ng为灰度级别,p(i,j)是灰度对(i,j)出现的概率,即灰度共生矩阵归一化的结果。矩阵行和列的平均值和标准差为和
对于2-D FD,二维分形维数由图像傅里叶变换的功率谱进行估计。使用如下的FFT(fast fourier transform,快速傅里叶变换)来对二维图像进行DFT(discrete fourier transform,离散傅里叶变换):
其中,I是尺寸为(M,N)的二维图像区域,u和v分别是在x和y方向的空间频率(u=0,1,...M-1,v=0,1,...N-1)。功率谱密度P通过F(u,v)按如下方法估计:
P(u,v)=|F(u,v)|2 (14)
为计算2-D FD,对P沿跨越FFT频域的径向切片方向进行平均。频率空间被均匀地等分为24个方向,而对每个方向的径向分量均匀地采样30个点。计算出log(Pf)对log(f)的最小二乘拟合,其中代表径向频率[10],则FD以如下形式相关于这个双对数曲线的斜率β:
其中,DT是拓扑维数,对于二维图像,DT=2。
6.步骤S4.2中,所述提取待分类区域的3-D纹理特征,对每个待分类区域的容积数据,计算12项3-D GLCM纹理特征和1项3-D FD特征。
对于3-D GLCM,将2-D GLCM按文献[4]的方法推广为3-D GLCM。三维图像中的两个体素点的空间位置差异可以用位移向量来描述。d为两体素点间的距离,为两体素点间的方位角,θ为两体素点间的天顶角。对于一个给定距离d,在13个独立的方向上,共可能有26个相邻的体素对出现,如图5所示。这里,仍然选择提取与2-D GLCM中相同的12项3-D GLCM纹理特征。
对于3-D FD,三维分形维数由容积图像的3-D傅里叶变换的功率谱进行估计。使用如下 的3-D FFT来对整个三维图像进行3-D DFT:
其中,I是尺寸为(M,N,K)的三维图像区域,u,v和w分别是在x,y和z方向的空间频率。功率谱密度P按如下方法估计:
P(u,v,w)=|F(u,v,w)|2 (17)
为计算3-D FD,对P沿跨越3-D FFT频域的径向扇区方向进行平均。频率空间被均匀地在24个方位角方向和12个天顶角方向进行等分,而对每个方向的径向分量均匀地采样30个点。计算出log(Pf)对log(f)的最小二乘拟合,其中代表径向频率[10],则3-D FD以如下形式相关于这个双对数曲线的斜率β:
其中,DT是拓扑维数,对于三维图像,DT=3。
7.步骤S4.3中,所述提取待分类区域所处扫描深度的局部特征,基于腹壁沿ABUS扫描Y方向的解剖学特征及四种无张力修补术式的补片植入位置特点,轻量型补片在腹部皮肤以下1-3cm深度区域内的出现几率最大。因此,提出一个基于待分类区域所处扫描深度(ABUS的Y-方向)的局部特征fdepth来表征补片的出现几率,并沿ABUS扫描深度方向对该局部特征按图6所示的情况进行划分,即从探头界面向皮肤以下深度进行区间划分,分别为区间0~1cm、区间1~3cm和区间3~6cm。根据待分类区域的深度参数,对局部特征fdepth设置如下:1)区间0~1cm,轻量型补片出现几率中等偏上,即fdepth设置为③,原因是此区域位置较浅,仅有Onlay和Inlay术式有可能在此区域放置补片。但两者因复发率较高,目前临床中应用并不太多。2)区间1~3cm,轻量型补片出现几率最高,即fdepth设置为④,原因是此区域正好是目前临床中应用最多的Sublay和IPOM术式放置补片的位置;3)在3~6cm区间,随着深度的增加,放置补片的可能性逐渐减小,故从上到下,即此区域的fdepth设置为②和①。
8.步骤S4.4中,所述提取待分类区域与疝囊位置关系的环境特征,分如下两步进行。
第一步,为确定疝囊位置,提出一种基于ABUS数据的快速疝囊检测定位算法。首先,检测ABUS冠状面图像中的所有黑色目标;其次,在滤除伪黑色目标后,测算出最大黑色目标也就是疝囊在X-、Y-和Z-方向的尺寸;第三,为确保整个疝囊都包含于VOI容积之中, 将疝囊尺寸在三个方向都扩大40像素;第四,从ABUS容积数据集中裁剪出含有疝囊的VOI容积;第五,使用3-D ISRAD算法对VOI进行斑点降噪处理;最后,从VOI的每帧横断面图像中分割出疝囊轮廓,完成算法对ABUS数据中疝囊的检测和定位处理。
第二步,在疝囊检测完成后,对冠状面位置特征进行调整。对与疝囊冠状面投影区域重叠或相交的待分类区域的冠状面位置特征加2;对与疝囊冠状面投影区距离3cm以内的待分类区域的冠状面位置特征加1。在距离疝囊位置越近的待分类区域中出现补片的几率就越大,因此,提出一个基于待分类区域与疝囊位置关系的位置参数fadjacency来表征补片的出现几率。所以,以待分类区域的冠状面位置特征取值作为环境特征fadjacency的取值。待分类区域的fadjacency取值越大,相应的补片出现几率就越大。
9.步骤S5中,所述对提取的40项特征进行特征选择,其步骤为:
(1)使用DBC(distance between class,类间距)法[6]分别计算每项特征的类间距。首先,在切口区域含轻量型补片的全部18个病例(病例组)和切口区域不含补片的55个病例(对照组)中,结合本实验病例数,由医生人为选取代表所有不同病例的278个与本发明自动获得的待分类区域尺寸相同的典型样本区域。其中包括125个仅含轻量型补片的典型区域和153个仅含筋膜的典型区域;其次,使用前面所提取的40个特征对所有278个样本区域做特征参数计算和归一化;第三,分别计算每项特征的类间距;
(2)对40个特征的按类间距从大到小排序,选取类间距较大的前25个特征,作为特征选择的初筛结果;
(3)对初步选出的25个的特征使用SFS(sequential forward selection,顺序前进搜索)法[7]进行选择,以得到使分类正确率最高的特征组合。首先,从278个已由医生确定的样本中,随机选取训练集139例和测试集139例。其次,分类器选用SVM(support vector machine,支持向量机),用训练集训练分类器,用测试集测试分类效果。为了减少实验样本有限所引起的误差,共进行100次随机实验,每次均重新随机均匀划分训练集和测试集。根据最终结果,当选取4项2-D纹理特征(二维冠状面图像的能量、同质性、熵、分形维数),6项3-D纹理特征(三维待分类容积的能量、相关、同质性、熵、自相关、分形维数)和1项待分类区域的三维度位置参数(fadjacency)这11项特征时,能够使轻量型补片和筋膜的分类误差达到最小,所以最终选取该11项特征作为特征组合。
如前所述,对每一个待分类区域总共提取了40项特征。由于这些特征之间存在一定的冗余,而且每个特征的分类能力也不尽相同。同时,为了减少特征维数,提高分类准确性、减少分类工作时间。本发明通过选用DBC和SFS对上述40项特征进行特征选择。最终,选取11个使轻量型补片和筋膜的分类误差达到最小的特征作为特征组合。它们是4项2-D纹理特征(二维冠状面图像的能量、同质性、熵、分形维数),6项3-D纹理特征(三维待分类容积的能量、相关、同质性、熵、自相关、分形维数)和1项待分类区域的三维度位置参数(fadjacency)。
与现有技术相比,本发明不仅对应用前景广阔的轻量型补片,使用ABUS技术对其进行有效可靠的特征提取,而且实现了对轻量型切口疝补片三维超声图像特征的优化选择,有效提高分类识别的准确性、减少分类工作时间。本发明方法特征选择效果好,效率高,能够有效提高轻量型切口疝补片三维超声图像的分类精度。
附图说明
图1为本发明的轻量型切口疝补片三维超声图像特征提取方法流程图。
图2为腹壁结构与四种补片植入位置示意图。轻量型补片(黑色虚线)可以放置于腹壁筋膜前(Onlay),放置于肌间(Inlay),放置于筋膜与腹膜间的空隙(Sublay),或放置于腹腔内的腹膜内壁(IPOM)。
图3为轻量型补片和筋膜的典型ABUS图像。其中,(a)和(b)分别为轻量型补片和筋膜在ABUS冠状面的图像;(c)和(d)为二者在ABUS横断面的图像。
图4为像素对在二维图像中的空间位置关系图。对于一个给定的中心像素点(白色),在4个独立的方向上,共可能有8个相距归一化距离d的像素对(灰色)。
图5为像素对在三维图像中的空间位置关系图。对于一个给定的中心体素点(白色),在13个独立的方向上,共可能有26个相距归一化距离d的体素对(灰色)。
图6为腹壁区域的ABUS成像示意图及基于扫描深度的局部特征值设定示意图。
图7为ROI的自动提取。其中,(a)前景掩模图像Cmask;(b)将Cmask在下边界处添加黑色区域,并等分为50×50像素的图像块;(c)ROI提取结果,冠状面位置特征为1的ROI以细白色框表示,冠状面位置特征为2的ROI以粗白色框表示。
图8为VOI扩展过程。其中,(a)ABUS原始容积数据的三个正交平面(A:横断面,S:矢状面,C:冠状面);(b)VOI的三正交平面视图;(c)VOI的三维视图。
图9.VOI图像预处理过程示意图。其中,(a)位于VOI中心的单帧横断面原始图像;(b)3-D ISRAD降噪图像;(c)二值图像;(d)图像(c)的微小目标删除结果;(e)图像(d)的最小外切边界框萃取结果;(f)狭窄目标删除及备选目标编号标注结果。
图10为图9(f)中5个待分类区域的横断面单帧切片和冠状面切片序列。其中,(a)横断面的5个单帧切片;(b)冠状面的5组切片序列。
图11为基于ABUS数据的快速疝囊检测定位算法对含疝囊VOI的自动提取结果。(a) ABUS原始容积数据的三个正交平面(A:横断面,S:矢状面,C:冠状面);(b)VOI的三正交平面视图;(c)VOI的三维视图。
图12为待分类区域冠状面位置特征的调整结果。(a)疝囊检测结果的三维重建视图;(b)疝囊冠状面投影与所有待分类区域;(c)需要对冠状面位置特征进行调整的待分类区域。冠状面位置特征加2的待分类区域以粗白色框表示,冠状面位置特征加1的待分类区域以细白色框表示。
图13为全部40项特征的DBC计算结果。其中特征f39是扫描深度特征fdepth,特征f40是待分类区域冠状面位置特征fadjacency。
具体实施方式
下面结合附图和具体实施方式对本发明做具体说明,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
参照附图1,本技术方案的轻量型切口疝补片三维超声图像特征提取方法包括以下的步骤:
S1:构建一个ABUS冠状面的2-D前景掩模,实验结果如图7(a)所示;
(1)将所有位于0.5至0.9倍扫描总深度的ABUS冠状面切片C1-Cn取出,对所有C1-Cn图像中相同位置的像素点做均值处理,得到一张冠状面均值图像Cmean;
(2)使用Otsu算法对图像Cmean进行阈值处理,得到二值图像Cbinary;
(3)采用形态学开运算对Cbinary图像中的连通区域进行边界平滑处理,并对其最大白色连通区域中由病灶或阴影造成的黑色空洞进行填充,得到冠状面2-D前景掩模图像Cmask。
S2:提取VOI;
(1)从ABUS冠状面掩模图像Cmask左上角开始,将图像等分为50×50像素的图像块。当在右边界和下边界处遇到像素不足无法分块时,则添加适当黑色区域,实验结果如图7(b)所示;
(2)将所有全黑图像块(所有像素点的二值化取值之和为0)的冠状面位置特征置为0,将所有与前景掩模边界相交的图像块(所有像素点的二值化取值之和在1至49之间)的冠状面位置特征置为1,将所有全白图像块(所有像素点的二值化取值之和为50)的冠状面位置特征置为2,实验结果如图7(c)所示;
(3)逐一将所有冠状面位置特征不为0的图像块选取为当前ROI。使用所有与ROI相关的ABUS横断面和矢状面图像区域,将2-D的ROI扩展为3-D的VOI。逐一将当前VOI 送入后续特征提取模块,直至完成对所有VOI的遍历,实验结果如图8所示。
S3:对VOI图像进行预处理操作,实验结果如图9所示;
(1)使用3-D ISRAD算法对自动提取出的VOI进行三维滤波处理;
(2)使用Otsu算法对位于VOI中心的单帧横断面图像做二值化处理,得到备选白色连通区域;
(3)使用开运算删除二值图像中所有面积小于15像素的白色连通区域;
(4)萃取出每个白色连通区域的最小外切边界框,计算出边界框的宽度、高度和顶点坐标;
(5)删除边界框的宽度<15像素的白色连通区域;
(6)对所有剩余白色连通区域进行编号标注,以作为待分类区域。
S4:经过预处理之后,给定一组VOI的待分类区域,可逐一对每个待分类区域进行特征提取,对每一个待分类区域总共提取40项特征;
(1)提取待分类区域的2-D纹理特征;
(a)计算待分类区域横断面单帧切片的12项2-D GLCM纹理特征。首先,提取出VOI中心的单帧横断面降噪图像;其次,对每个待分类区域在扫描深度方向做上下5像素的区域扩展;接着,分割出每个待分类区域的横断面单帧切片;最后,对该单帧切片计算12项描述符,作为该待分类区域横断面单帧切片的2-D GLCM纹理特征。如图10(a)给出了图9中所示的5个待分类区域横断面单帧切片;
(b)计算待分类区域冠状面切片序列的12项2-D GLCM纹理特征和1项2-D FD特征。首先,提取出与每个待分类区域所处扫描深度对应的所有冠状面切片序列;其次,对于每项描述符fi(i=1...n,n是冠状面切片序列的层数),使用描述符fi依次对每张冠状面切片进行计算,得出一组特征值[f1...fn];最后,取[f1...fn]的均值Fmean作为该项描述符对于待分类区域冠状面切片序列的特征值。如图10(b)给出了图9中所示的5个待分类区域冠状面切片序列;
12项2-D GLCM纹理特征包含能量(f1-Energy)、对比度(f2-Contrast)、相关(f3-Correlation)、方差(f4-Variance)、同质性(f5-Homogeneity)、均值(f6-Sum Average)、熵(f7-Entropy)、自相关(f8-Autocorrelation)、差异性(f9-Dissimilarity)、集群阴影(f10-Cluster Shade)、集群突出(f11-Cluster Prominence)和最大概率(f12-Maximum Probability),分别按公式1-12计算;
对于2-D FD,二维分形维数由图像傅里叶变换的功率谱进行估计。使用公式13 FFT来 对二维图像进行DFT,谱密度P通过F(u,v)按公式14估计;
为计算2-D FD,对P沿跨越FFT频域的径向切片方向进行平均。频率空间被均匀地等分为24个方向,而对每个方向的径向分量均匀地采样30个点。计算出log(Pf)对log(f)的最小二乘拟合,其中代表径向频率,则FD按公式15相关于这个双对数曲线的斜率β;
(2)提取待分类区域的3-D纹理特征,计算12项3-D GLCM纹理特征和1项3-D FD特征。将2-D GLCM按文献[4]的方法推广为3-D GLCM。对于3-D FD,三维分形维数由容积图像的3-D傅里叶变换的功率谱进行估计。使用公式16的3-D FFT来对整个三维图像进行3-D DFT,功率谱密度P按公式17估计;
为计算3-D FD,对P沿跨越3-D FFT频域的径向扇区方向进行平均。频率空间被均匀地在24个方位角方向和12个天顶角方向进行等分,而对每个方向的径向分量均匀地采样30个点。计算出log(Pf)对log(f)的最小二乘拟合,其中代表径向频率,则3-D FD按公式18相关于这个双对数曲线的斜率β;
(3)提取待分类区域所处扫描深度的局部特征,提出一个基于待分类区域所处扫描深度(ABUS的Y-方向)的局部特征fdepth来表征补片的出现几率,并沿ABUS扫描深度方向对该局部特征按图6所示的情况进行划分。根据待分类区域的深度参数,对局部特征fdepth设置如下:1)区间0~1cm,fdepth=③,2)区间1~3cm,fdepth=④,3)在3~6cm区间,将此区域的fdepth特征设置为②和①;
(4)提取待分类区域与疝囊位置关系的环境特征,提出一个基于待分类区域与疝囊位置关系的位置参数fadjacency来表征补片的出现几率。
为确定疝囊位置,提出一种基于ABUS数据的快速疝囊检测定位算法。首先,检测ABUS冠状面图像中的所有黑色目标;其次,在滤除伪黑色目标后,测算出最大黑色目标也就是疝囊在X-、Y-和Z-方向的尺寸;第三,为确保整个疝囊都包含于VOI容积之中,将疝囊尺寸在三个方向都扩大40像素;第四,从ABUS容积数据集中裁剪出含有疝囊的VOI容积;第五,使用3-D ISRAD算法对VOI进行斑点降噪处理;最后,从VOI的每帧横断面图像中分割出疝囊轮廓,完成算法对ABUS数据中疝囊的检测和定位处理。算法对含疝囊VOI的自动提取结果如图11所示。
在疝囊检测完成后,对冠状面位置特征进行调整。对与疝囊冠状面投影区域重叠或相交的待分类区域的冠状面位置特征加2;对与疝囊冠状面投影区距离3cm以内的待分类区域的 冠状面位置特征加1。最终以待分类区域的冠状面位置特征取值作为环境特征fadjacency的取值。待分类区域冠状面位置特征的调整结果如图12所示。
S5:对提取的40项特征进行特征选择,最终选取11个使轻量型补片和筋膜的分类误差达到最小的特征作为特征组合;
(1)使用DBC分别计算每项特征的类间距。首先,在切口区域含轻量型补片的全部18个病例(病例组)和切口区域不含补片的55个病例(对照组)中,由医生手动选取出278个与本论文自动获得的待分类区域尺寸相同的典型样本区域。其中包括125个仅含轻量型补片的典型区域和153个仅含筋膜的典型区域。其次,使用前面所提取的40个特征对所有278个样本区域做特征参数计算和归一化。第三,分别计算每项特征的类间距并对40个特征按类间距从大到小进行排序。最后,选取类间距较大的前25个特征作为特征选择的初筛结果。实验结果如图13所示;
(2)对40个特征的按类间距从大到小排序,选取类间距较大的前25个特征;
(3)对初步选出的25个的特征使用SFS进行选择。首先,从278个已由医生确定的样本中,随机选取训练集139例和测试集139例。其次,分类器选用SVM,用训练集训练分类器,用测试集测试分类效果。为了减少实验样本有限所引起的误差,共进行100次随机实验,每次均重新随机均匀划分训练集和测试集。最终,选取11个使轻量型补片和筋膜的分类误差达到最小的特征作为特征组合。它们是4项2-D纹理特征(二维冠状面图像的能量、同质性、熵、分形维数),6项3-D纹理特征(三维待分类容积的能量、相关、同质性、熵、自相关、分形维数)和1项待分类区域的三维度位置参数(fadjacency)。
本发明选取使轻量型补片和筋膜的分类误差达到最小的特征作为特征组合,实现了对轻量型切口疝补片三维超声图像特征的优化选择,有效提高分类识别的准确性、减少分类工作时间。本发明针对二维纹理参数对切口疝补片术后卷曲、收缩等空间变换敏感的问题,提出了应用三维纹理参数并辅以ABUS三维度位置参数来提取轻量型切口疝补片特征的方法,能够有效提高轻量型切口疝补片三维超声图像的分类精度。
参考文献
[1]Wu J,Wang Y,Yu J,Shi X,Zhang J,Chen Y,Pang Y."Intelligent speckle reducing anisotropic diffusion algorithm for automated 3-D ultrasound images."Journal of the Optical Society of America A,2015,32(2):248-257.
[2]Haralick R.M.,Shanmugam K.,Dinstein I.H."Textural features for image classification."IEEE Transactions on Systems,Man and Cybernetics 1973,SMC-3(6):610-621.
[3]Chaudhuri B.B.,Sarkar N."Texture segmentation using fractal dimension."IEEE Transactions on Pattern Analysis and Machine Intelligence,1995,17(1):72-77.
[4]Chen W.,Giger M.L.,Li H.,Bick U.,Newstead G.M."Volumetric texture analysis of breast lesions on contrast-enhanced magnetic resonance images."Magnetic Resonance in Medicine,2007,58(3):562-571.
[5]Tang D.,Marangoni A.G."3D fractal dimension of fat crystal networks."Chemical Physics Letters,2006,433(1-3):248-252.
[6]Li H.,Jiang T.,Zhang K."Efficient and robust feature extraction by maximum margin criterion."IEEE Transactions on Neural Networks,2006,17(1):157-165.
[7]Gunal S.,Gerek O.N.,Ece D.G.,Edizkan R."The search for optimal feature set in power quality event classification."Expert Systems with Applications,2009,36(7):10266-10273.
[8]Otsu N.A threshold selection method from gray-level histograms[J].IEEE Transactions on Systems,Man,and Cybernetics,1979,9(1):62-66.
[9]Wu J.,Wang Y.,Yu J.,Chen Y.,Pang Y.,Diao X.,Qiu Z."Identification of implanted mesh after incisional hernia repair using an automated breast volume scanner."Journal of Ultrasound in Medicine,2015,34(6):1071-1081.
[10]Kontos D.,Bakic P.R.,Carton A.K.,Troxel A.B.,Conant E.F.,Maidment A.D."Parenchymal texture analysis in digital breast tomosynthesis for breast cancer risk estimation:a preliminary study."Academic Radiology,2009,16(3):283-298.。
- 还没有人留言评论。精彩留言会获得点赞!