用于糖尿病治疗的多转基因猪的制作方法与工艺
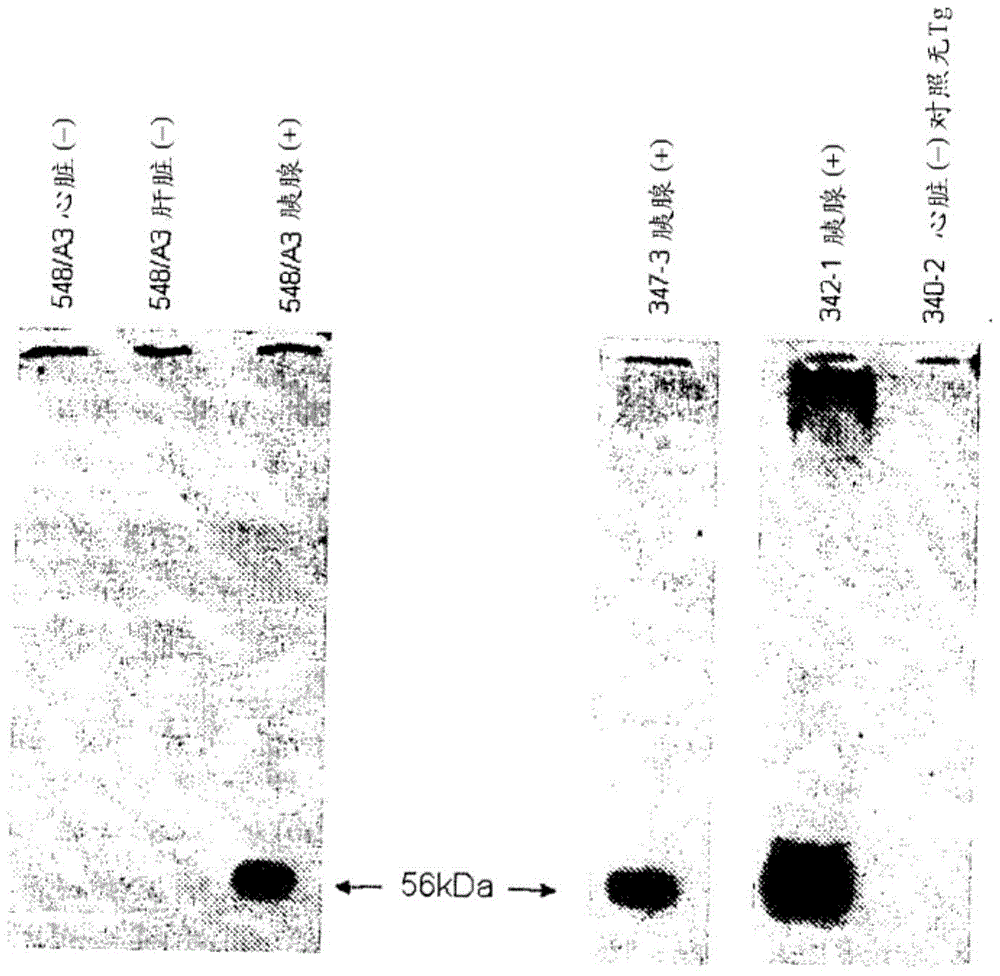
用于糖尿病治疗的多转基因猪本申请是以下申请的分案申请:申请日:2010年8月16日;申请号:201080045779.9;发明名称:同上。相关申请这个非临时专利申请根据35U.S.C.§119要求于2009年8月14日提交的名称为“Multi-TransgenicPigsforDiabetesTreatment”的美国临时专利申请号61/234,150的优先权,所述专利的完整公开内容在此全部引入本文作为参考。发明领域本发明提供了对于异种移植治疗特别有用的特定供体动物、组织和细胞。特别地,本发明包括猪科动物以及衍生自其的组织和细胞,其缺乏功能α1,3半乳糖基转移酶(αGT)的任何表达,并且表达使得这些动物成为用于胰岛异种移植的合适供体的一种或多种另外的转基因。还提供了使用衍生自此类动物的组织和细胞治疗和预防糖尿病的方法。发明背景糖尿病胰岛素是通过胰腺产生的激素,它将糖从血流中移动到身体的细胞内,在其中它变成必需能源。在哺乳动物中,胰岛素在胰腺中郎格罕氏岛(胰岛)的β细胞(β-细胞)内合成。在健康成人胰腺中存在约一百万个岛(胰腺总质量的约1-2%),其分布遍布该器官。糖尿病是特征在于血液中异常高水平的糖(高血糖症)的疾病状态,其因为身体无法产生足够的胰岛素(1型糖尿病)或因为身体无法响应产生的胰岛素(2型糖尿病)。不受控制的高血糖症可以导致严重并发症,包括失明、心脏病、肾疾病和甚至死亡。单独在美国,超过20,000,000人具有糖尿病。2型糖尿病(T2D)是到目前为止的最常见类型,并且与缺乏体力活动和肥胖相关。根据在2007年由世界卫生组织(WHO)汇编的统计学,全世界超过180,000,000人具有糖尿病,导致2,900,000例死亡(全球总死亡率的6%),并且与超过$2300亿的经济总负荷相关。1型糖尿病(T1D)远不如T2D常见。它是其中患者的自身免疫系统破坏身体的胰岛素产生胰腺β细胞的自身免疫病。一般在年轻时诊断出,它是需要终生治疗的慢性疾病。治疗一般是胰岛素替代治疗的形式,所述治疗一般通过注射或泵递送。成功的胰岛素管理取决于给定方案可以如何紧密地模拟正常生理学胰岛素释放模式。存在几种不同形式的可获得的胰岛素,并且特定形式/方案的选择可以反映患者的优先选择和坚持特定治疗方案的能力。尽管在胰岛素的药理学和递送中取得进展,使用胰岛素替代治疗达到紧密升糖控制可以是非常苛求的。因此,许多T1D患者仍经历高和低血糖症的发作,并且因而患有长期并发症。考虑到胰岛素替代治疗的负荷,治疗替代方案是高度希望的。移植的人胰腺(同种异体移植)为T1D患者提供了潜在治愈。来源包括其为近期死去或存活供体(部分胰腺移植)的人供体。受体的天然胰腺一般留在原地,并且供体胰腺附着在不同位置中。挑战包括在任何手术操作中固有的风险以及对于大多数移植器官常见的排斥可能性。同种异体移植胰腺的排斥可以在移植后数秒(急性)到数年(慢性)内的任何时间出现。为了避免排斥,必须无限期地服用免疫抑制药物。这些药物可以是难以耐受的,使得患者处于感染病增加的危险中,并且已与高血压、肾问题和肝病症联系。移植的危险和免疫抑制药物疗法的延长使用对于糖尿病患者是唯一成问题的(即,与其他器官移植受体比较),因为药物疗法一般仍是选项,然而是不希望的。2003年研究发现对于具有功能性肾的患者,接受仅胰腺移植的患者的存活率比用常规疗法管理其糖尿病的患者的存活率更差(Venstrom等人2003;290:2817-2823)。因此,胰腺移植通常仅对具有1型糖尿病伴晚期肾病的个体执行。仅岛细胞(与整个胰腺比较)的移植提供了基于较小侵袭性移植的替代方案。此处,从供体胰腺中分离岛(胰岛,islets)且经由对于门静脉的导管注射到患者内(即不需要较大的剖腹术)。岛行进到肝,在其中它们变得固定,取代胰岛素产生且基本上将肝变成替代胰腺。然而,早期岛移植具有极低成功率,并且患者仅短时间段保持胰岛素非依赖性。在Edmonton方案和其他早期岛移植程序之间的主要差异是使用免疫抑制药物和来自超过一个胰腺的岛移植的特定组合。具体而言,Edmonton方案使用包括达克珠单抗、西罗莫司和他克莫司的免疫抑制药物的组合。达克珠单抗在移植后立即静脉内给予并且随后中断。患者随后无限期地给予西罗莫司和他克莫司。整个胰腺和岛移植程序取决于目前并不存在的人胰腺供体的可靠供应。目前,每年仅3000个尸体胰腺变得可用,远达不到2,000,000加上具有T1D的患者需要的那些。基因治疗呈现了另一种治疗替代方案。在人胰岛中引入和表达转基因以阻止免疫排斥且改善岛移植物的增殖和存活已成为许多研究的焦点(由下述综述:McCabe等人,DiabetesMetabResRev.2006May-Jun;22(3):241-52;Chuang等人,2008;Martin等人,EndocrDev.2007;12:24-32;Faideau等人,Diabetes.2005Dec;54Suppl2:S87-96)。经由人岛的离体转导的转基因递送已得到研究(Garcia-Ocana等人,JournalofBiolChem.,2003,278:343-351;Li等人,TransplantationProceedings,39:3436-3437)。然而,在这些系统中的免疫调节基因表达对于长期糖尿病控制是不足够的,因为腺病毒感染的岛移植物在约一个月中被排斥(参见Sakata等人,DiabetesResearchandClinicalPractice,2008,80:352-359)。此外,用于人中的基因治疗的腺病毒载体在其递送特定基因的能力中是有限的,并且已触发免疫应答且甚至引起一例死亡(Flotte,J.ofCellularPhysiology,2007,213:301-305)。可替代的非病毒基因递送系统的效率很低且是暂时的。人胰腺细胞的遗传修饰因此未能有效解决T1D患者的需要。异种移植异种移植(来自不同物种供体的器官、组织和细胞的移植)可以有效解决人供体胰腺的短缺。异种移植也有利地(i)在可预测的非紧急基础上供应;(ii)在控制环境中产生;和(iii)可在移植前用于表征和研究。取决于供体和受体物种之间的关系,异种移植可以描述为协调或不协调的。协调物种是系统发育紧密相关的物种(例如小鼠与大鼠)。不协调物种是并非紧密相关的(例如猪与人)。猪已成为异种移植领域中大多数研究的焦点,因为猪与人共享许多解剖和生理特征。猪也具有相对短的妊娠期,可以在无病原体环境中育种,并且可能不呈现与通常不用作食物来源的动物(例如灵长类动物)有关的相同伦理问题。猪至灵长类动物异种移植领域中的科学知识和专家经验经过最近10年已快速增长,导致救命猪科异种移植物的灵长类动物受体的相当大延长的存活(Cozzi等人,Xenotransplantation,16:203-214.2009)。近来,在岛异种移植领域中已报道了显著进展(HeringBJ等人,NatMed,12:301–303.2006;CardonaK等人,NatMed,12:304–306.2006.;GianelloP和DufraneD.,Xenotransplantation,14:441.2007),并且这个进展已提示可以暗示岛而不是实体器官可能是未来临床异种移植试验中的第一种移植类型。遗传修饰虽然在许多方面是有利的,但异种移植也产生了比同种异体移植更复杂的免疫学情况。像这样,相当大的努力已针对通过遗传修饰解决免疫屏障(vanderWindt等人,Xenotransplantation.2007Jul;14(4):288-97,Cowan和D’Apice,CurrOpinOrganTransplant.2008Apr;13(2):178-83)。异种移植物排斥可以分成3个时期:超急性排斥、急性体液异种移植物排斥和T细胞介导的细胞排斥。超急性排斥(HAR)是在移植物再灌注后数分钟到数小时内导致不可逆的移植物损害且丧失的极快速事件。它通过在移植时受体内存在的异种反应性天然抗体的存在触发。人具有针对猪细胞上发现的α1,3-半乳糖(Gal)表位的天然存在的抗体。这种抗体以高数量产生,并且目前认为它是HAR的主要介质。(Sandrin等人,ProcNatlAcadSciUSA.1993Dec1;90(23):11391-5,1993;由Sandrin和McKenzie,ImmunolRev.1994Oct;141:169-90综述)。遗传修饰猪的最初努力已集中于从猪细胞中去除α1,3-半乳糖(Gal)表位。在2003年,Phelps等人(Science,2003,299:411-414)报道缺乏αGT(GTKO)的任何功能表达的首批活猪的产生,其代表异种移植中的重大突破(还参见给予Revivicor,Inc.的PCT公开号WO04/028243和给予ImmergeBiotherapeutics,Inc.的PCT公开号WO04/016742)。后续研究已显示来自GTKO猪的器官移植物不经历HAR(Kuwaki等人,NatMed.2005Jan;11(1):29-31,Yamada等人,NatMed.2005Jan;11(1):32-4)。尽管Gal介导的HAR目前已知是整个器官的异种移植中的重要因素。并不明确HAR是否也是成体岛异种移植中的关键因素,因为来自成体猪的胰腺β细胞的纯群体不表达显著水平的免疫原性Gal表位。事实上,在一个研究中,发现GTKO猪胰岛不比野生型岛对破坏更不敏感(Rood等人(2007)Transplantation83:202-210)。然而,与成体岛不同,胎儿和新生儿岛不表达Gal。异种移植组织中的补体调节剂的表达已暗示为对抗HAR的不同策略(Squinto,CurrOpinBiotechnol.1996Dec;7(6):641-5)。给予Imutran的欧洲专利0495852暗示使异种移植物组织与受体补体限制因子结合,以减少受体中的补体激活(还参见Diamond等人,TransplImmunol.1995Dec;3(4):305-12)。表达人DAF(hDAF)和/或人CD59(hCD59)的转基因猪已得到报道(Byrne等人,TransplantProc.,1996Apr;28(2):758)。CD46已使用对于高遍在表达最佳化的小基因在猪细胞中表达,并且看起来在小鼠移植模型中保护猪科细胞(Loveland等人,Xenotransplantation,2004,11:171:183;McKenzie等人,Xenotransplantation.2003Nov;10(6):615-21)。然而,这些因子的表达已是可变的且在胰腺细胞中一般是极低的(参见Bennet等人,Transplantation,2001,72:312-319)。即使当避免HAR时,异种移植物也经历延迟形式的排斥,急性体液异种移植物排斥(AHXR)–也称为延迟性异种移植物排斥(DXR)。一般认为它通过异种反应性抗体包括非Gal抗体以及移植物内皮、补体和凝血系统的后续激活起始(Miyagawa等人Xenotransplantation,2010,1:11-25)。尽管由体液应答呈现的威胁就血管化移植物的存活和功能而言是关键的,但通过细胞机制的移植物损害危险也是重要的。T细胞介导的急性应答在异种移植排斥中起重要作用,尽管其在胰岛细胞移植中的作用仍未得到充分阐明。在迄今为止鉴定的几个T细胞共刺激途径中,最显著的是CD28途径和有关细胞毒性T淋巴细胞相关蛋白质(CTLA4)途径。迄今为止,关于CTLA4-Ig作为免疫抑制试剂的许多研究已集中于将可溶形式的CTLA4-Ig施用于患者(参见美国专利号7,304,033;PCT公开号WO99/57266;和Lui等人JImmunolMethods2003277:171-183)。为了减少对患者的总体免疫抑制负荷,已提出了此类蛋白质的转基因表达。已开发了表达CTLA4-Ig的转基因小鼠(Ronchese等人JExpMed(1994)179:809;Lane等人JExpMed.(1994)Mar1;179(3):819;Sutherland等人Transplantation.200069(9):1806-12)。此外,给予AlexionPharmaceuticals,Inc.的PCT公开号WO01/30966和给予Revivicor的PCT公开号WO07/035213公开了仅表达CTLA4-Ig转基因的转基因猪。还参见Phelps等人,Xenotransplantation,16(6):477-485.2009。产生了在脑组织中表达CTLA4-Ig的猪,但高血浆表达显示引起负面效应(Martin等人(2005)Transg.Rsch.14:373-84)。存在关于在有蹄动物中长期表达免疫抑制转基因是否产生关于有蹄动物或来自此类动物任何组织的受体的安全关注的疑问。除细胞和体液免疫应答外,与岛移植相关的重大挑战是在移植的岛输注且与受体血液接触后立即地岛团块的大量早期丧失,这是称为立即经血液介导的炎症应答(IBMIR)的现象(Bennet等人,UpsJMedSci2000,105:125-133)。抗凝血剂转基因的添加已暗示阻止对于异种移植物的凝血应答(由Cowan,Xenotransplantation,2007;14:7-12综述)。然而,这些报道已集中于与器官移植相关的凝血减少。此外,由于即使在小型哺乳动物例如小鼠中也可见的出血表型,适合于异种移植的表达抗凝血剂的动物的产生已证明是困难的(参见Dwyer等人(2004)JClinInvest113:1440-46)。此外,存在关于抗凝作用对于阻止IBMIR是否有用的疑问。已发现在异种移植模型中,补体耗尽或抗凝作用的使用不足以阻止IBMIR(Rood等人2007Transplantation83:202-210)。Cabric等人(2006)CellTranspl15:759-67和(2007)Diabetes56:2008-15)暗示基因治疗方法对于避免胰岛中的IBMIR是不合适的,因为它们将新DNA引入岛内,并且与诱导炎症或甚至适应性免疫应答的危险相关,并且经转导的岛显示受损的葡萄糖刺激的胰岛素释放。相反,它们暗示岛细胞用试剂例如肝素的预处理。尽管由于人胰岛的供应有限和品质,特别是来自猪科供体的岛的异种移植是使用同种异体移植的吸引人的替代方案,但存在主要障碍。立即和延迟性免疫应答和岛破坏潜在需要免疫抑制剂治疗的毒性混合物。已提出了解决特定免疫应答的遗传修饰动物的产生,然而,这种产生已得到有限成功,这是由于与免疫抑制剂原位表达相关的毒性。存在关于适合于异种移植治疗的改良动物和组织的需要。特别地,存在关于改良动物和组织以产生胰岛素产生异种移植物的需要,这将减少患者中的糖尿病而不需要显著或长期免疫抑制治疗。发明概述本发明提供了对于异种移植治疗特别有用的遗传修饰的供体动物、组织和细胞。更具体而言,遗传修饰的供体动物充当克服显著体液(HAR和AHXR/DXR)和细胞免疫应答(ACXR)以及限制立即经血液介导的炎症反应(IBMIR)的组织和细胞的来源,使得其对于用于糖尿病且特别是I型糖尿病的异种移植治疗是特别有用的,其使用临床上相关的免疫抑制剂方案,且伴随对于长期免疫抑制剂或抗凝血剂治疗的减少需要。本发明的存活、遗传修饰的猪科动物的特征在于总体减少的免疫反应性(即,由于缺乏功能α1,3半乳糖基转移酶(αGT)的表达),以及选自抗凝血剂、免疫调节剂和细胞保护剂的对于克服移植排斥关键的转基因表达。在本发明之前,不了解可以促使动物成为无免疫应答和血友病的这些类型的转基因是否可以在简单动物中表达,所述简单动物将能够成为合适的移植供体,因为预期动物的活力将是严重缩短的。本发明人已发现可以获得此类供体动物、组织和细胞,特别是当由于缺乏功能α1,3半乳糖基转移酶(GTKO)的表达总体减少免疫反应性与特定转基因的组织特异性表达组合时。在本发明的一个实施方案中,提供了猪科动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且在胰腺组织中特异性表达至少一种转基因。在一个特定实施方案中,在胰腺组织中特异性表达的转基因是至少一种抗凝血剂。在另一个特定实施方案中,在胰腺组织中特异性表达的转基因是至少一种免疫调节剂。在一个具体实施方案中,在胰腺组织中特异性表达的转基因是至少一种免疫抑制剂。在一个进一步特定的实施方案中,在胰腺组织中特异性表达的转基因是至少一种细胞保护剂转基因。在本发明的另一个实施方案中,提供了在胰腺组织中特异性表达多重转基因的GTKO动物、组织和细胞。在一个特定实施方案中,多重转基因选自抗凝血剂、免疫调节剂和细胞保护剂转基因。在一个特定实施方案中,提供了在胰腺组织中特异性表达至少2种转基因的GTKO动物、组织和细胞。在一个具体实施方案中,至少2种转基因都是抗凝血剂。在一个特定实施方案中,提供了在胰腺组织中特异性表达至少3种转基因的GTKO动物、组织和细胞。在一个具体实施方案中,至少3种转基因包括2种抗凝血剂转基因和免疫抑制剂转基因。在一个进一步具体的实施方案中,提供了GTKO动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且在胰腺组织中特异性表达TFPI、CD39和CTLA4。在本发明的一个进一步实施方案中,提供了猪科动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且表达至少一种第一种转基因和至少一种第二种转基因,其中所述第二种转基因在胰腺组织中特异性表达。在一个实施方案中,至少一种第一种转基因是免疫调节剂。在一个特定实施方案中,至少一种第一种转基因是补体抑制剂。在另一个实施方案中,至少一种第一种基因是补体抑制剂,并且在胰腺组织中特异性表达的至少一种第二种转基因是选自包括(i)抗凝血剂;(ii)免疫抑制剂;和(iii)细胞保护剂的组。在一个实施方案中,提供了猪科动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且表达至少一种补体抑制剂和选自抗凝血剂、免疫抑制剂和细胞保护剂的至少一种另外的转基因。在一个具体实施方案中,提供了猪科动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且表达至少一种补体抑制剂和至少一种抗凝血剂。在一个特定实施方案中,补体抑制剂是CD46,并且至少一种抗凝血剂选自TFPI、CD39、水蛭素、血栓调节蛋白和EPCR。在一个进一步特定的实施方案中,至少一种补体抑制剂是CD46,并且至少一种另外的转基因是免疫抑制剂,例如CTLA4。在一个具体实施方案中,提供了猪科动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且进一步表达至少一种补体抑制剂、至少一种抗凝血剂和至少一种免疫抑制剂。任选地,猪科动物、组织和细胞还表达至少一种细胞保护转基因。在一个实施方案中,转基因在胰腺细胞中特异性表达。在一个特定实施方案中,转基因在胰岛细胞中特异性表达。在一个具体实施方案中,转基因在β细胞中特异性表达。表达可以处于任何水平,但在一个具体实施方案中,表达处于高水平。在一个特定实施方案中,细胞是装入胶囊的。根据本发明的抗凝血剂可以选自包括组织因子途径抑制剂(TFPI)、水蛭素、血栓调节蛋白、内皮蛋白质C受体(EPCR)和CD39的组。在一个特定实施方案中,抗凝血剂是TFPI。在另一个实施方案中,抗凝血剂是CD39。根据本发明的免疫调节剂可以是补体抑制剂或免疫抑制剂。在一个具体实施方案中,免疫调节剂是补体抑制剂。补体抑制剂可以是CD46(或MCP)、CD55、CD59或CR1。在另一个具体实施方案中,免疫调节剂是免疫抑制剂。免疫抑制剂可以是CTLA4-Ig。其他免疫调节剂可以是II类反式激活因子(CIITA)及其突变体、PDL1、PDL2、或肿瘤坏死因子-α-相关凋亡诱导配体(TRAIL)、Fas配体(FasL、CD95L)、称为整联蛋白结合蛋白质(CD47)的CD47、HLA-E、HLA-DP、HLA-DQ、HLA-DR。根据本发明的细胞保护剂转基因可以是抗凋亡、抗氧化剂或抗炎转基因。在特定实施方案中,细胞保护剂转基因选自包括A20、HO-1、FAT-1和可溶性TNF-α受体(sTNFR1)的组。在一个具体实施方案中,本发明提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达和TFPI的胰腺特异性表达。在另一个具体实施方案中,本发明提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、TFPI的胰腺特异性表达和CD39的胰腺特异性表达。在一个特定实施方案中,CD46是遍在表达的。在另一个具体实施方案中,本发明提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、TFPI的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在一个特定实施方案中,CD46是遍在表达的。在一个进一步具体的实施方案中,本发明提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、TFPI的胰腺特异性表达、CD39的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在一个特定实施方案中,CD46是遍在表达的。在另一个具体实施方案中,本发明提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、细胞保护转基因的表达、TFPI的胰腺特异性表达、CD39的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在一个特定实施方案中,CD46是遍在表达的。在另一个具体实施方案中,本发明提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、细胞保护转基因的表达、TFPI的胰腺特异性表达和CD39的胰腺特异性表达。在一个特定实施方案中,CD46是遍在表达的。在一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于有此需要的宿主。在一个特定实施方案中,宿主是糖尿病宿主。在一个实施方案中,糖尿病宿主是糖尿病灵长类动物。在一个特定实施方案中,宿主是糖尿病人。在一个具体实施方案中,宿主是患有1型糖尿病(T1B)的人。在一个实施方案中,组织是猪科胰腺组织。在另一个实施方案中,细胞是胰腺衍生的细胞、整个岛或分离的胰岛细胞。在一个特定实施方案中,细胞是岛。在另一个特定实施方案中,胰腺细胞是β细胞。在一个实施方案中,胰腺细胞是成体细胞。在另一个实施方案中,胰腺细胞是胎儿或新生儿细胞。在一个实施方案中,提供了治疗或预防糖尿病的方法,其包括施用从本发明的猪科动物中分离的岛细胞。在一个可替代实施方案中,提供了通过将本发明的组织或细胞施用于糖尿病宿主,减少由糖尿病宿主需要的胰岛素量的方法。在一个特定实施方案中,在治疗后,宿主需要减少的或不需要外源胰岛素。在一个实施方案中,在治疗后,宿主需要少约5%-约25%的胰岛素。在另一个实施方案中,在治疗后,宿主需要少约25%-约50%的胰岛素。在另外一个实施方案中,在治疗后,宿主需要少约50%-约75%的胰岛素。在一个再进一步的实施方案中,在治疗后,宿主需要少约75%-约100%的胰岛素。在一个特定实施方案中,在治疗后,宿主需要小于4单位的胰岛素/天、小于3单位的胰岛素/天、小于2、小于2单位的胰岛素/天、或小于1单位的胰岛素/天。在一个实施方案中,在治疗后,宿主不需要外源胰岛素。在其他实施方案中,本文提供的组织或细胞可以在再移植程序中使用,例如在特定实施方案中,此类程序可以是必需的,以维持足够水平的岛以长期控制糖血症。在本发明的一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于患有糖尿病的宿主,其中所述宿主在治疗后不需要或需要减少的免疫抑制治疗。在一个实施方案中,与其他方法比较,一种或多种免疫抑制药物/试剂的剂量是减少的。在一个具体实施方案中,与其他移植方法中使用的剂量比较,达克珠单抗、他克莫司和/或西罗莫司中的一种或多种的剂量是减少的。在另一个实施方案中,与其他方法比较,一种或多种免疫抑制药物/试剂的类型数目是减少的。在一个实施方案中,与其他方法比较,免疫抑制的持续时间是缩短的。在另一个实施方案中,与其他方法比较,使用更低的或不使用维持免疫抑制。在一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于患有糖尿病的宿主,其中与其他方法比较,IEQ/kg(胰岛当量/kg)需求是减少的。在另一个实施方案中,IEQ/kg低于100,000。在一个进一步的实施方案中,IEQ/kg低于50,000。在一个实施方案中,IEQ/kg低于25,000。在另一个实施方案中,IEQ/kg低于10,000。在一个进一步的实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的胰腺细胞或岛施用于患有糖尿病的宿主,其中所述组织或细胞通过门静脉内输注施用。在一个特定实施方案中,岛通过门静脉内输注施用。在一个实施方案中,将岛施用到腹膜内间隔内、肾包膜下、肾囊、网膜或经由胰腺床输注。在另一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的胰腺细胞或岛施用于患有糖尿病的宿主,其中所述组织或细胞是装入胶囊的。在一个实施方案中,细胞是装入微胶囊的。在一个替代实施方案中,细胞是装入大胶囊的。在另一个实施方案中,细胞不是装入胶囊的。在一个特定实施方案中,细胞以含有纯化海藻酸盐和细胞的薄片层的形式提供。在一个具体实施方案中,岛是装入微胶囊的、装入大胶囊的或作为含有纯化海藻酸盐和胰岛的薄片层提供。在进一步的实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病宿主,其中在移植后,宿主具有一些或所有功能性移植细胞。在一个实施方案中,与在执行其他方法后存在的功能性移植的岛数目比较,宿主具有更多功能性移植的岛。在一个实施方案中,岛功能性定义为大于0.3ng/dl的基础或刺激的猪科C肽。在一个实施方案中,岛功能性定义为与大于50%减少的外源胰岛素需要组合的可检测的猪科C肽,其中所述C肽由移植的材料产生。在一个特定实施方案中,10、20、30、40、50、60、70、80、90、100%移植的岛是功能性的。在其他实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病患者,其中在移植后,宿主可以维持血糖量正常。在一个实施方案中,血糖量正常维持至少3个月。在另一个实施方案中,血糖量正常维持至少6或至少12个月。在其他实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病患者,其中在移植后,宿主的空腹和非空腹血糖水平(分别为FBG和NFBG)维持在正常水平。在一个实施方案中,正常水平应维持至少3个月。在另一个实施方案中,正常水平应维持至少6个月。在另一个实施方案中,正常水平应维持至少12个月。在一个特定实施方案中,可以维持约70–约100mg/dL(3.9-5.5mmol/L)的FBG。在另一个实施方案中,可以维持约70–约130mg/DL的FBG。在另一个特定实施方案中,NFBG可以维持在小于约200mg/dL。在一个实施方案中,在治疗后,宿主具有小于约8.0%的糖化血红蛋白水平。在另一个实施方案中,在治疗后,宿主具有小于约6.5%的糖化血红蛋白水平。在一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病宿主,其中在移植后,所述宿主成功地通过静脉内葡萄糖耐量测试。在一个实施方案中,测试可以在移植后1、3、6和/或12个月时执行。在另一个实施方案中,如果在不存在非人灵长类动物C肽的显著应答的情况下,证实对于以猪科C肽形式的葡萄糖的显著应答,那么测试的结果是成功的。在另一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于患有糖尿病的糖尿病宿主,其中所述宿主在移植后成功地通过精氨酸刺激测试。在一个实施方案中,测试可以在移植后1、3、6和/或12个月时执行。在另一个实施方案中,如果在不存在非人灵长类动物C肽的显著应答的情况下,证实对于以猪科C肽形式的葡萄糖的显著应答,那么测试的结果是成功的。在一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病宿主,其中在移植后,供体C肽水平是可检测的。在另一个实施方案中,猪科C肽水平大约在约0.3–约0.96之间。在一个具体实施方案中,猪科C肽水平大约在约0.21–约0.63(ng/ml)之间。在另一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病宿主,其中在移植后,进行宿主的组织学分析。在一个实施方案中,在尸检后天然胰腺的组织学分析指出减少的胰岛素阳性β细胞,在一个非限制性例子中,无一胰岛素阳性β细胞。在一个进一步的实施方案中,岛移植的肝或其他部位的组织学检查指出多个活的胰岛素阳性细胞。在一个进一步的实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将本发明的组织或细胞施用于糖尿病宿主,其中在移植后,存在与移植程序、免疫抑制方案、耐受诱导方案或岛的装入胶囊中的一个或多个相关的并非众多或严重的威胁生命的并发症。根据本发明的下述说明书、权利要求和本领域已知的知识,本发明的其他实施方案对于普通技术人员将是显而易见的。附图描述专利或申请文件含有以彩色实现的至少一个附图。具有一个或多个彩色附图的本专利或专利申请公开物的拷贝将在申请和支付必需费用后由专利局提供。图1是在本发明中使用的载体的代表性图。“pREV788”是基础载体;pREV790是具有TFPI-CD4转基因的基础载体;pREV792是具有pCTLA4-Ig转基因的基础载体;并且pREV835是具有CD39转基因的基础载体。图2显示如在还原和变性条件下通过蛋白质印迹分析检测的,在转基因猪器官裂解产物中pCTLA4-Ig蛋白质表达的图像。用对于融合蛋白的Ig部分特异性的抗体检测条带。347-3和342-1是胎儿548/A3的再克隆,并且340-2是非转基因动物(用作阴性对照)。图3是用FITC标记的抗人TFPI抗体染色的细胞图像,显示在成体转基因小鼠胰腺中观察到的高水平hTFPI,具有在岛中的局限性表达。H&E染色显示代表性岛形态。图4是来自用FITC标记的抗人TFPIAb和FITC标记的抗人IgG1(其与pCTLA4-Ig的人Ig部分结合)染色的548/A3的胎儿胰腺图像,显示TFPI和pCTLA4-Ig的表达。图5是来自用FITC标记的抗人TFPIAb和FITC标记的抗人IgG1(其与pCTLA4-Ig的人Ig部分结合)染色的,2.5月龄小猪347-3(548/A3的再克隆)的胰腺图像,显示TFPI和pCTLA4-Ig转基因的表达。关于胰岛素的染色显示与转基因那种相似的模式。还显示了野生型猪和同种型对照。图6是来自用FITC标记的抗人CD39染色的小猪320-2的胰腺图像,显示CD39的高表达。还显示了关于胰岛素的染色。图7是来自用FITC标记的抗人CD46染色的小猪342-3(548/A3的再克隆)的胰腺图像,显示CD46的高表达。图8举例说明与野生型岛比较,来自猪390-1的岛中释放的磷酸盐水平。图9是关于猪390-1中的CD46、TFPI、CTLA4-Ig、CD39和胰岛素的染色结果。发明详述存在越来越多的证据表明:岛移植物中存在的供体血管内皮细胞在涉及移植后受体中岛组织的血管再生的新血管形成中起重要作用(Linn等人,FASEB,(2003)17:881-883;Brissova等人,Diabetes(2004)53:1318-1325;JohanssonU等人,AmJ.Transplant.(2005)5:2632-2639;Nyqvist等人,Diabetes,(2005)54:2287-2293)。某些新血管衬有供体内皮细胞,而其他血管可能作为供体和受体细胞的嵌合体重建(Brissova等人,Diabetes(2004)53:1318-1325)。如果没有活供体内皮细胞的存在,血管再生是延迟和不完全的,导致许多岛的缺血损伤和死亡。因此,本发明包含具有GTKO遗传背景加上针对岛移植中的改良结果的其他转基因的猪。来自在胰腺中特异性表达其他转基因的GTKO猪的岛将提供供体内皮细胞且因此岛的显著保护。“转基因”是已从一个生物转移到另一个的基因或遗传材料。一般地,该术语描述含有基因序列的DNA区段,所述基因序列已从一个生物中分离且引入不同生物内。DNA的这个非天然区段可以保留在转基因生物中产生RNA或蛋白质的能力,或它可以改变转基因生物的遗传密码的正常功能。一般而言,将DNA引入生物种系内。例如,在高等脊椎动物中,这可以通过将外源DNA注射到受精卵的核内来完成。当插入细胞内时,转基因可以是其为mRNA(信使RNA)的拷贝的cDNA(互补DNA)区段,或停留在基因组DNA的原始区域中的基因自身。转基因可以是基因组序列,特别是当作为大克隆引入BAC(细菌人工染色体)或粘粒中时。除非另有说明,在本说明书的背景中的转基因“表达”意指来自非天然核酸的肽序列在宿主中的至少一种细胞中表达。肽可以由掺入宿主基因组中的转基因表达。“供体”意欲包括任何非人生物,其可以充当用于异种移植的供体组织或细胞的来源,包括但不限于哺乳动物、鸟、鸡、爬行动物、鱼和昆虫。供体可以处于任何发育阶段,包括但不限于胎儿、新生儿、幼体和成体。“动物”一般是哺乳动物。“哺乳动物”意欲包括任何非人哺乳动物,包括但不限于猪、绵羊、山羊、牛(牛科)、鹿、骡、马、猴、犬、猫、大鼠和小鼠。在本发明的一个实施方案中,提供了遗传修饰的猪及其产生方法。本发明的动物是“遗传修饰的”或“转基因的”,这意指它们具有加入或掺入的转基因或其他外源DNA,或修饰包括靶向、重组、中断、缺失、破坏、替代、抑制、增强或以其他方式改变的内源基因,以介导在动物的至少一种细胞中且一般在动物的至少一种种系细胞内的基因型或表型效应。在某些实施方案中,动物可以具有在其基因组的一个等位基因上整合的转基因(杂合转基因的)。在其他实施方案中,动物可以具有在2个等位基因上的转基因(纯合转基因的)。术语“有蹄动物”指有蹄的哺乳动物。偶蹄动物是偶数蹄(偶蹄的)有蹄动物,包括羚羊、骆驼、牛、鹿、山羊、猪和绵羊。奇蹄动物是奇数蹄有蹄动物,这包括马、斑马、犀牛和貘。如本文使用的,术语有蹄动物指成体、胚胎或胎儿有蹄动物。术语“猪科”、“猪科动物”、“猪”和“猪类”是指相同类型动物的一般术语,与性别、大小或品种无关。本发明的“细胞”衍生自动物。尽管细胞可以衍生自成熟动物,但在某些实施方案中,细胞衍生自胎儿或新生儿组织。在本发明的一个特定实施方案中,细胞且尤其是胰岛细胞衍生自转基因猪科动物,且特别是已生长至足够大小以用作成体岛供体的转基因猪。在特定实施方案中,动物存活断奶后年龄。在具体实施方案中,动物是至少6月龄。在特定实施方案中,动物存活至达到育种年龄。在特定实施方案中,动物是至少300磅的猪科动物。在具体实施方案中,动物是猪科母猪且已产仔至少一次。“高”水平的表达视为足以提供表型(可检测的表达或治疗利益)。一般地,‘高’水平的表达足以能够减少移植物排斥,包括超急性排斥(HAR)、急性体液异种移植物排斥(AHXR)、T细胞介导的细胞排斥和立即经血液介导的炎症应答(IBMIR)。先前不了解抗凝血剂和免疫抑制转基因是否可以以能够减少这些排斥类型的水平在胰岛细胞中表达。转基因动物在一个实施方案中,提供了具有至少4个遗传修饰的猪科动物、组织和细胞。此类遗传修饰可以包括但不限于,基因的添加和/或缺失,包括敲除和敲入,以及重排。在一个特定实施方案中,提供了具有至少4个遗传修饰的猪科动物、组织和细胞,其中所述遗传修饰中的至少一个、至少2个、至少3个或4个是转基因,并且所述转基因中的至少一个、至少2个、至少3个或4个是遍在表达的。在一个特定实施方案中,提供了具有至少4个遗传修饰的猪科动物、组织和细胞,其中至少一个遗传修饰是敲除。在一个特定实施方案中,提供了具有至少一种敲除的基因且表达至少3种转基因的猪科动物、组织和细胞。在一个具体实施方案中,至少一种基因通过同源重组被敲除。在一个实施方案中,提供了具有至少5个遗传修饰的猪科动物、组织和细胞。此类遗传修饰可以包括例如,其他基因的添加和/或缺失,包括敲除和敲入,以及重排。在一个特定实施方案中,提供了具有至少5个遗传修饰的猪科动物、组织和细胞,其中所述遗传修饰中的至少一个、至少2个、至少3个或至少4个或5个是转基因,并且所述转基因中的至少一个、至少2个、至少3个、至少4个或5个是遍在表达的。在一个特定实施方案中,提供了具有至少5个遗传修饰的猪科动物、组织和细胞,其中至少一个遗传修饰是敲除。在一个特定实施方案中,提供了具有至少一种敲除的基因且表达至少4种转基因的猪科动物、组织和细胞。在一个具体实施方案中,至少一种基因通过同源重组被敲除。在一个实施方案中,提供了猪科动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且在胰腺组织中表达至少一种转基因。在其他实施方案中,提供了在胰腺组织中表达多重转基因的GTKO动物、组织和细胞。在特定亚实施方案中,动物、组织和细胞表达至少一种免疫调节剂。在特定实施方案中,动物、组织和细胞表达超过一种免疫调节剂。在特定实施方案中,提供了表达至少一种免疫调节剂和至少一种抗凝血剂转基因的GTKO动物、组织和细胞。在一个实施方案中,免疫调节剂是免疫抑制剂。在一个替代实施方案中,免疫调节剂是补体抑制剂。在一个特定实施方案中,免疫调节剂的表达是对于胰腺特异性的。在一个进一步特定的实施方案中,免疫抑制剂的表达是对于胰腺特异性的。在一个再进一步特定的实施方案中,补体抑制剂的表达是对于胰腺特异性的。在其他亚实施方案中,动物、组织和细胞表达至少一种抗凝血剂。在特定实施方案中,动物、组织和细胞表达超过一种抗凝血剂。在一个特定实施方案中,抗凝血剂的表达是对于胰腺特异性的。在一个亚实施方案中,动物、组织和细胞表达至少一种细胞保护转基因。在另一个实施方案中,动物、组织和细胞表达超过一种细胞保护转基因。在一个实施方案中,转基因在岛中特异性表达,在一个特定实施方案中,提供了在β细胞中的特异性表达。在一个实施方案中,本发明包括GTKO动物、组织和细胞,其缺乏功能α1,3半乳糖基转移酶(GTKO)的任何表达,且表达至少一种补体抑制剂以及选自抗凝血剂、免疫抑制剂和细胞保护剂的至少一种另外的转基因。在一个特定实施方案中,至少一种另外的转基因的表达是对于胰腺特异性的。在一个具体实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种补体抑制剂(例如CD46)和至少一种抗凝血剂(例如TFPI)。在另一个具体实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种补体抑制剂(例如CD46)和至少2种抗凝血剂(例如TFPI和CD39)。在另一个具体实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种补体抑制剂(例如CD46)和至少一种免疫抑制剂(例如CTLA4)。在一个进一步具体的实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种补体抑制剂(例如CD46)和细胞保护转基因(例如A20)。在特定实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂和至少一种抗凝血剂转基因。在一个进一步特定的实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂和至少2种抗凝血剂转基因。在一个具体实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂和至少一种抗凝血剂转基因,其中所述至少一种免疫抑制剂和至少一种抗凝血剂转基因的表达是对于胰腺特异性的。在另外一个具体实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂和至少2种抗凝血剂转基因,其中所述至少一种免疫抑制剂和至少2种抗凝血剂转基因的表达是对于胰腺特异性的。在一个实施方案中,转基因在岛中特异性表达,在一个特定实施方案中,提供了在β细胞中的特异性表达。在一个实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫调节剂、至少一种抗凝血剂和至少一种细胞保护转基因。在一个进一步的实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂、至少一种抗凝血剂转基因和至少一种细胞保护转基因。在一个进一步特定的实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂、至少2种抗凝血剂转基因和至少一种抗细胞保护转基因。在一个特定实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂、至少一种抗凝血剂转基因和至少一种细胞保护转基因,其中所述至少一种免疫抑制剂和至少一种抗凝血剂转基因的表达是对于胰腺特异性的。在一个特定实施方案中,提供了GTKO动物、组织和细胞,其表达至少一种免疫抑制剂、至少一种补体抑制剂、至少2种抗凝血剂转基因和至少一种细胞保护转基因,其中所述至少一种免疫抑制剂和至少2种抗凝血剂转基因的表达是对于胰腺特异性的。在一个具体实施方案中,抗凋亡转基因的表达是对于胰腺特异性的。在一个实施方案中,转基因在岛中特异性表达,在一个特定实施方案中,提供了在β细胞中的特异性表达。在一个实施方案中,本文描述的转基因猪科动物是活的。在另一个实施方案中,本文描述的动物是能繁殖的。在进一步的实施方案中,本文描述的动物可以将一些其遗传修饰稳定地传递给其后代。在再进一步的实施方案中,本文描述的动物可以将所有其遗传修饰稳定地传递给其后代。在特定实施方案中,当动物自然育种时,动物可以将所有其遗传修饰稳定地传递给其后代。在其他实施方案中,多重转基因显示出对于后代的共分离。在特定实施方案中,细胞衍生自活动物的胰腺。在特定实施方案中,细胞是胰岛。在更特定的实施方案中,细胞是胰腺β细胞。在特定实施方案中,细胞是产生胰岛素的。在一些进一步的实施方案中,细胞包括岛细胞簇。在再进一步的实施方案中,细胞是岛样细胞。在一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、补体抑制剂的表达、抗凝血剂转基因的胰腺特异性表达和免疫抑制剂转基因的胰腺特异性表达。在一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、补体抑制剂的表达、2种抗凝血剂转基因的胰腺特异性表达和免疫抑制剂转基因的胰腺特异性表达。在一个实施方案中,转基因在岛细胞中特异性表达,在一个特定实施方案中,提供了在β细胞中的特异性表达。在另一个实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、补体抑制剂的表达、细胞保护转基因的表达、抗凝血剂转基因的胰腺特异性表达和免疫抑制剂转基因的胰腺特异性表达。在一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、补体抑制剂的表达、细胞保护转基因的表达、2种抗凝血剂转基因的胰腺特异性表达和免疫抑制剂转基因的胰腺特异性表达。在一个具体实施方案中,细胞保护转基因的表达也是胰腺特异性的。在一个实施方案中,转基因在岛中特异性表达,在一个特定实施方案中,提供了在β细胞中的特异性表达。免疫调节剂可以是补体抑制剂或免疫抑制剂。在具体实施方案中,免疫调节剂是补体抑制剂。补体抑制剂可以是CD46(或MCP)。在其他实施方案中,补体抑制剂是CD55、CD59或CR1。在特定实施方案中,转基因由遍在启动子表达。在特定其他实施方案中,转基因由主要在胰腺细胞中活跃的启动子表达。表达可以处于任何水平,但在具体实施方案中,表达处于高水平。免疫调节剂还可以是免疫抑制剂。免疫抑制剂可以能够下调T细胞介导的应答。特别地,免疫抑制剂可以是CTLA4-Ig或其突变体。在其他实施方案中,免疫抑制剂转基因是干扰CD28活性的配体,例如B7受体肽或其突变体。在特定实施方案中,转基因由主要在胰腺细胞中活跃的启动子表达。表达可以处于任何水平,但在具体实施方案中,表达处于高水平。在其他实施方案中,免疫调节剂可以选自包括II类反式激活因子(CIITA)及其突变体、PDL1、PDL2、肿瘤坏死因子-α-相关凋亡诱导配体(TRAIL)、Fas配体(FasL、CD95L)、整联蛋白结合蛋白质(CD47)、HLA-E、HLA-DP、HLA-DQ或HLA-DR的组。在特定其他实施方案中,转基因由主要在胰腺细胞中活跃的启动子表达。表达可以处于任何水平,但在具体实施方案中,表达处于高水平。在一个实施方案中,抗凝血剂选自包括组织因子途径抑制剂(TFPI)、水蛭素、血栓调节蛋白、内皮蛋白质C受体(EPCR)和CD39的组。在一个特定实施方案中,抗凝血剂是TFPI。在另一个实施方案中,抗凝血剂是CD39。在特定其他实施方案中,转基因由主要在胰腺细胞中活跃的启动子表达。表达可以处于任何水平,但在具体实施方案中,表达处于高水平。细胞保护转基因可以是抗凋亡、抗氧化剂或抗炎转基因。在特定实施方案中,细胞保护剂转基因选自包括A20、HO-1、FAT-1和可溶性TNF-α受体(sTNFR1)的组。在特定其他实施方案中,转基因由主要在胰腺细胞中活跃的启动子表达。表达可以处于任何水平,但在具体实施方案中,表达处于高水平。在特定实施方案中,一种或多种免疫抑制剂或抗凝血剂转基因在表达高水平的CD46的GTKO猪科动物的胰腺组织中表达。在特定实施方案中,提供了衍生自GTKO动物的猪科动物、组织和细胞,所述GTKO动物表达高水平的CD46,并且在胰腺组织特别是胰岛细胞中表达TFPI和CTLA4-Ig。在一个分开的实施方案中,提供了衍生自GTKO动物的猪科动物、组织和细胞,所述GTKO动物表达高水平的CD46,并且在胰腺组织特别是胰岛细胞中表达CD39和CTLA4-Ig。在某些实施方案中,免疫调节剂具有人蛋白质的序列。在其他实施方案中,免疫调节剂具有猪蛋白质的序列。在某些实施方案中,抗凝血剂具有人蛋白质的序列。在其他实施方案中,抗凝血剂具有猪蛋白质的序列。在某些实施方案中,细胞保护转基因具有猪蛋白质的序列。在另一个实施方案中,细胞保护转基因具有人蛋白质的序列。在特定实施方案中,猪科动物、组织或细胞表达人CD46转基因。在特定实施方案中,猪科动物、组织或细胞表达人CTLA4-Ig转基因。在特定实施方案中,猪科动物、组织或细胞表达人TFPI。在特定实施方案中,猪科动物、组织或细胞表达人CD39。在特定实施方案中,猪科动物、组织或细胞表达猪CD46转基因。在特定实施方案中,猪科动物、组织或细胞表达猪CTLA4转基因。在特定实施方案中,猪科动物、组织或细胞表达猪TFPI。在特定实施方案中,猪科动物、组织或细胞表达猪CD39。在一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、TFPI的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在另一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、TFPI的胰腺特异性表达、CD39的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在一个实施方案中,转基因在岛细胞中特异性表达,在一个特定实施方案中,提供了在β细胞中的特异性表达。在一个特定实施方案中,CD46可以是人CD46。在另一个特定实施方案中,人CD46可以以高水平表达。在另一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、细胞保护转基因的表达、TFPI的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在另一个特定实施方案中,提供了具有至少下述遗传修饰的猪科动物、组织和细胞:缺乏GT的表达、CD46的表达、细胞保护转基因的表达、TFPI的胰腺特异性表达、CD39的胰腺特异性表达和CTLA4-Ig的胰腺特异性表达。在特定实施方案中,转基因由主要在胰腺细胞中活跃的启动子表达。在特定实施方案中,启动子是胰腺或岛特异性启动子,例如来自脊椎动物的胰岛素启动子,包括但不限于鱼或哺乳动物启动子,例如罗非鱼、人、猪、大鼠或小鼠。在具体实施方案中,启动子是大鼠胰岛素启动子(RIP)。在特定实施方案中,将另外的调节元件包括增强子元件掺入转基因表达系统内。增强子可以是例如pdx-1启动子或鸡肌动蛋白增强子,或可以是绝缘子元件例如鸡β-珠蛋白绝缘子,用于转基因的增强表达(ChungJH,BellAC,FelsenfeldG.,ProcNatlAcadSciUSA.1997Jan21;94(2):575-80)。在特定实施方案中,表达仅在胰腺组织中且不在其他猪科组织中。此外,表达可以存在于胎儿、新生儿和成熟组织中,其各自可以是供体岛的来源。在本发明的特定实施方案中,细胞且尤其是胰岛细胞衍生自转基因猪科动物,且特别是已生长至足够大小以用作成体岛供体的转基因猪。在特定实施方案中,动物存活断奶后年龄。在具体实施方案中,动物是至少6月龄。在特定实施方案中,动物存活至达到育种年龄。在特定实施方案中,动物是至少300磅的猪科动物。在一个特定实施方案中,可以移植装入胶囊的岛。在一个实施方案中,提供了用于治疗或预防糖尿病的方法,其包括将猪科胰腺组织、胰腺衍生的细胞、整个岛或分离的胰岛细胞施用于患有糖尿病的宿主(糖尿病宿主或糖尿病患者),其中所述细胞显示出表达至少一种免疫抑制剂和至少一种抗凝血剂转基因。在另一个实施方案中,从本文提供的猪科动物中分离的岛细胞用于治疗或逆转糖尿病。在一个实施方案中,本文提供的岛细胞可以用于减少由糖尿病宿主需要的胰岛素量。在移植后,患者可能需要比在移植前需要的那种少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%的胰岛素。在移植后,宿主可能需要比在移植前需要的那种少约5%-约25%的胰岛素。在移植后,宿主可能需要比在移植前需要的那种少约25%-约50%的胰岛素。在移植后,宿主可能需要比在移植前需要的那种少约50%-约75%的胰岛素。在移植后,宿主可能需要比在移植前需要的那种少约75%-约100%的胰岛素。在一个特定实施方案中,在移植后,宿主可能需要小于0.6、0.5、0.4、0.3、0.2、0.1、0.05或0.01单位的外源胰岛素/千克(kg)/天。在一个实施方案中,在移植后,宿主需要小于约0.01–约0.1单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,患者需要小于约0.1–约0.25单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,患者需要小于约0.25–约0.5单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,患者需要小于约0.5–约0.6单位的外源胰岛素/千克(kg)/天的任何数目。在一个特定实施方案中,在移植后,患者需要小于4单位的胰岛素/天。在一个实施方案中,在移植后,患者需要小于2单位的胰岛素/天。在一个实施方案中,在移植后,患者需要小于2单位的胰岛素/天。在另一个实施方案中,在移植后,患者需要小于1单位的胰岛素/天。在一个实施方案中,在移植后,患者不需要外源胰岛素。在其他实施方案中,本文提供的岛可以在再移植程序中使用,例如在特定实施方案中,此类程序可以是必需的,以维持足够水平的岛以长期控制糖血症。在本发明的特定实施方案中,提供了治疗或预防灵长类动物中的糖尿病的方法,涉及给有此需要的灵长类动物施用本发明的组织或细胞。在一个实施方案中,灵长类动物是非人灵长类动物,在一个非限制性例子中,是猴。在另一个实施方案中,灵长类动物是人。在一个实施方案中,胰腺细胞是成体细胞。在另一个实施方案中,胰腺细胞是胎儿或新生儿细胞。在另外的实施方案中,动物还可以含有遗传修饰以表达免疫调节剂。免疫调节剂可以是补体途径抑制剂基因,并且在特定实施方案中,选自CD55、CD59、CR1和CD46(MCP)。补体抑制剂可以是人CD46(hCD46),其中表达通过小基因构建体(参见Loveland等人,Xenotransplantation,11(2):171-183.2004)。免疫调节剂还可以是具有T细胞介导的效应例如CTLA4-Ig的免疫抑制剂基因,或II类MHC(CIITA)的显性失活抑制剂,或调节B细胞或T细胞介导的免疫功能的表达的其他基因。在进一步的实施方案中,此类动物可以进一步修饰,以消除影响免疫功能的基因的表达。在另外的实施方案中,动物还可以含有遗传修饰以表达抗凝血剂。抗凝血剂可以包括但不限于TFPI、水蛭素、血栓调节蛋白、EPCR和CD39。此外,动物可以进行遗传修饰,以抑制CMP-Neu5Ac羟化酶基因(参见例如,美国专利公开2005-0223418)、iGb3合成酶基因(参见例如,美国专利公开2005-0155095)和/或Forssman合成酶基因(参见例如,美国专利公开2006-0068479)的表达。此外,动物可以进行遗传修饰,以减少促凝血剂的表达。特别地,在一个实施方案中,动物进行遗传修饰,以减少或消除促凝血剂例如FGL2(纤维蛋白原样蛋白质2)基因的表达(参见例如,Marsden等人(2003)JdinInvest.112:58-66;Ghanekar等人(2004)JImmunol.172:5693-701;Mendicino等人(2005)Circulation.112:248-56;Mu等人(2007)PhysiolGenomics.31(1):53-62)。在其中表达转基因的实施方案中,这种表达可以经由遍在或组织特异性启动子,并且可以包括另外的调节元件例如增强子、绝缘子、基质附着区(MAR)等。为了完成这些另外的遗传修饰,在一个实施方案中,从遗传修饰的猪中分离的细胞可以进一步修饰,以含有多重遗传修饰。在某些实施方案中,这些细胞可以用作供体,以产生经由核转移具有多重遗传修饰的猪。在其他实施方案中,遗传修饰的动物可以一起育种,以达到多重遗传修饰。靶向急性体液排斥的转基因异种移植目前被严重且充分证明的排斥问题阻碍。这个过程可以分成不同阶段,其中第一个在移植数分钟内出现且称为“超急性排斥”(HAR)。HAR通过与外源组织结合的预先形成的天然抗体的高滴度的遍在存在定义。这些天然抗体与供体组织上皮上的靶表位的结合认为是HAR中的起始事件。在供体组织由受体血液灌注的数分钟内的这种结合随后为补体激活、血小板和纤维蛋白沉积且最终为供体器官中的间质水肿和出血,所有这些引起受体中的组织排斥(Strahan等人(1996)FrontiersinBioscience1,e34-41)。在人中HAR的主因是天然抗Gal抗体,这包含人和猴中的约1%抗体。这种最初超急性排斥随后通过迟发型血管应答(也称为急性体液异种移植物排斥(AHXR)、急性血管性排斥(AHXR)或延迟性异种移植物排斥(DXR))加强。在超急性应答过程中内皮细胞的裂解和死亡伴随外膜细胞的水肿和暴露,所述外膜细胞在其表面上组成性表达组织因子(TF)。认为组织因子在体内凝血级联的起始中是关键的,并且它暴露于血浆触发凝血反应。凝血酶和TNF-α变得局限在受损组织周围,并且这诱导TF通过内皮细胞的进一步合成和表达。在静止内皮细胞周围的环境不利于凝血。几种天然凝血抑制剂与内皮细胞的细胞外蛋白聚糖相关,例如组织因子途径抑制剂、抗凝血酶III和血栓调节蛋白。然而,外源组织通过异种反应性天然抗体(XNA)的识别引起这些分子的丧失。连同组织因子的暴露和诱导,在内皮细胞周围的抗凝血剂环境从而变成促凝血剂。异种移植物的血管化区域从而变成血块部位,这是受损组织的特征。血流被损害,并且移植的器官变得缺血。更完全量的延迟性血管排斥可以在Bach等人(1996)ImmunolToday.1996Aug;17(8):379-84中发现。本发明提供了可以用于异种移植中的动物、组织和细胞,以产生下述中的一种或多种的低至无水平:HAR、AHXR/DXR和/或ACXR。在一个实施方案中,动物、组织或细胞可以用于异种移植中,以产生低至无水平的HAR和AHXR。在另一个实施方案中,动物、组织或细胞可以用于异种移植中,以产生低至无水平的HAR、AHXR和ACXR。如下述节段中将详细讨论的,本发明的实施方案包括在供体组织中补体调节剂表达、免疫抑制剂表达、抗凝血剂表达和/或部分或完全耗尽的功能αGT表达的多种组合。在一个实施方案中,从本文提供的猪科动物中分离的岛细胞显示为表达一种或多种转基因。在进一步的实施方案中,来自本文提供的猪科动物的岛细胞可以引发通过人淋巴细胞(MLR测定)针对所述猪科细胞的免疫应答减少。在另一个实施方案中,表达转基因的岛细胞显示为抑制在异种移植环境中出现的凝血和血栓形成。α1,3半乳糖基转移酶(αGT)如先前指出的,在人中HAR的主因是天然抗半乳糖α1,3-半乳糖(Gal)抗体,这包含人和猴中的约1%IgG抗体。除旧大陆猴、猿和人外,大多数哺乳动物携带在其细胞表面上的糖蛋白,其含有Gal表位(Galili等人,J.Biol.Chem.263:17755-17762,1988)。人、猿和旧大陆猴不表达Gal,而是以高数量产生天然存在的抗Gal抗体,其在来自携带Gal表位的动物的组织异种移植到人内后引起立即超急性反应(Sandrin等人,ProcNatlAcadSciUSA.1993Dec1;90(23):11391-5,1993;由Sandrin和McKenzie,ImmunolRev.1994Oct;141:169-90综述)。已执行多种策略以消除或调节由异种移植引起的抗Gal体液应答,包括表位由α-半乳糖苷酶的酶促去除(Stone等人,Transplantation63:640-645,1997)、特异性抗gal抗体去除(Ye等人,Transplantation58:330-337,1994)、表位由其他碳水化合物部分的戴帽,这未能消除αGT表达(Tanemura等人,J.Biol.Chem.27321:16421-16425,1998和Koike等人,Xenotransplantation4:147-153,1997)和补体抑制蛋白质的诱导(Dalmasso等人,Clin.Exp.Immunol.86:31-35,1991,Dalmasso等人Transplantation52:530-533(1991))。C.Costa等人(FASEBJ13,1762(1999))报道在转基因猪中αGT的竞争性抑制导致表位数目中的仅部分减少。类似地,S.Miyagawa等人(J.Biol.Chem276,39310(2000))报道封闭N-乙酰氨基葡萄糖转移酶III转基因猪中的gal表位表达的尝试,还导致gal表位数目的仅部分减少,且未能显著延长灵长类动物受体中的移植物存活。在猪科细胞和活动物中αGT基因座的简单等位基因敲除已得到报道。Denning等人(NatureBiotechnology19:559-562,2001)报道在绵羊中αGT基因的一个等位基因的靶向基因缺失。Harrison等人(TransgenicsResearch11:143-150,2002)报道杂合αGT敲除体细胞猪科胎儿成纤维细胞的产生。在2002年,Lai等人(Science295:1089-1092,2002)和Dai等人(NatureBiotechnology20:251-255,2002)报道猪的产生,其中αGT基因的一个等位基因被成功致使失活。Ramsoondar等人(BiolofReproduc69,437-445(2003))报道还表达人α-1,2-岩藻糖基转移酶(HT)的杂合αGT敲除猪的生成,其表达HT和αGT表位。给予TheCuratorsoftheUniversityofMissouri的PCT公开号WO03/055302证实用于在异种移植中使用的杂合αGT敲除微型猪的产生,其中与野生型比较,在击倒猪中功能αGT的表达是减少的。给予AustinResearchInstitute的PCT公开号WO94/21799和美国专利号5,821,117;给予Bresatec的PCT公开号WO95/20661;和给予BioTransplant,Inc.和TheGeneralHospitalCorporation的PCT公开号WO95/28412、美国专利号6,153,428、美国专利号6,413,769和US公开号2003/0014770提供了基于αGT基因的cDNA产生αGT阴性猪科细胞的讨论。在异种移植领域中的近期重大突破是缺乏αGT的任何功能表达的首批活猪的产生(Phelps等人Science299:411-414(2003);还参见Revivicor,Inc.的PCT公开号WO04/028243和ImmergeBiotherapeutics,Inc.的PCT公开号WO04/016742)。在一个实施方案中,提供了动物、组织和细胞,其缺乏功能αGT(GTKO)的任何表达,且在胰腺组织中表达至少一种另外的转基因。另外的转基因一般选自:1)免疫调节剂,包括补体抑制剂(即CD46(MCP)、CD55、CD59、CR1等)或免疫抑制剂(即CTLA-4、B7等),或2)抗凝血剂(即TFPI、水蛭素、血栓调节蛋白、EPCR、CD39等)。在其他实施方案中,提供了动物、组织和细胞,其缺乏功能αGT的任何表达,且在胰腺组织中表达至少一种免疫调节剂和至少一种抗凝血剂。在某些实施方案中,胰腺组织是猪科的。在进一步的实施方案中,胰腺组织包含胰岛细胞、或岛或岛-细胞簇。在特定实施方案中,细胞是胰岛。在更特定的实施方案中,细胞是胰腺β细胞。在特定实施方案中,细胞是产生胰岛素的。在再进一步的实施方案中,细胞是岛样细胞。岛细胞簇可以包括α、β、δ、PP或ε细胞中的任何一种或多种。一般地,产生胰高血糖素的α细胞构成天然胰腺中约15-20%的总岛细胞,产生胰岛素和糊精的β细胞构成天然胰腺中约65-80%的岛细胞,产生生长抑制素的δ细胞构成天然胰腺中约3-10%的总岛细胞,产生胰腺多肽的PP细胞构成天然胰腺中约3-5%的总岛细胞,并且产生饥饿素的ε细胞构成天然胰腺中<1%的总岛细胞(参见Elayat等人(1995).J.Anat.186:629-37)。在本发明中还包括具有减少水平的功能αGT表达的动物、组织和细胞,其同时在胰腺组织中表达下述中的至少一种:1)免疫调节剂,包括补体抑制剂(即CD46、CD55、CD59、CR1等)或免疫抑制剂(即CTLA-4、B7等),或2)抗凝血剂(即TFPI、水蛭素、血栓调节蛋白、EPCR、CD39等)。在某些实施方案中,提供了动物、组织和细胞,其具有减少水平的功能αGT表达,且在胰腺组织中表达至少一种免疫调节剂和至少一种抗凝血剂。在某些实施方案中,胰腺组织是猪科的。在进一步的实施方案中,胰腺组织包含胰岛细胞。功能αGT的表达可以减少例如至少约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约95%。完全或减少水平的功能αGT表达可以通过本领域技术人员已知的任何方法来达到。在本发明的一个方面,提供了其中αGT基因的一个等位基因经由遗传靶向事件灭活的猪科动物。在本发明的另一个方面,提供了其中αGT基因的2个等位基因经由遗传靶向事件灭活的猪科动物。在一个实施方案中,基因可以经由同源重组靶向。在其他实施方案中,基因可以是被破坏的,即遗传编码的部分可以被改变,从而影响那个基因区段的转录和/或翻译。例如,基因的破坏可以通过置换、缺失(“敲除”)或插入(“敲入”)技术出现。可以插入关于所需蛋白质的另外基因或调节现有序列转录的调节序列。在本发明的一个实施方案中,αGT基因的等位基因是致使失活的,从而使得所得到的αGT酶可以不再在细胞表面上生成Gal。在一个实施方案中,αGT基因可以转录成RNA,但不翻译成蛋白质。在另一个实施方案中,αGT基因可以以截短形式转录。此类截短的RNA可以不被翻译或可以翻译成无功能的蛋白质。在一个替代实施方案中,αGT基因可以以这样的方式灭活,使得不出现基因的转录。在一个进一步的实施方案中,αGT基因可以被转录且随后翻译成无功能的蛋白质。在某些实施方案中,活性αGT的表达可以通过使用替代方法减少,例如靶向基因转录或翻译的那些。例如,表达可以通过使用靶向天然αGT基因或其mRNA的反义RNA或siRNA得到减少。在其他实施方案中,位点特异性重组酶用于靶向基因组的区域用于重组。此类系统的例子是CRE-lox系统和Flp-Frt系统。具有αGT基因的2个失活等位基因的猪不是天然存在的。先前发现在通过遗传靶向事件尝试敲除αGT基因的第二个等位基因时,鉴定了阻止第二个等位基因产生功能性αGT酶的点突变。因此,在本发明的另一个方面,αGT基因可以通过至少一个点突变致使失活。在一个实施方案中,αGT基因的一个等位基因可以通过至少一个点突变致使失活。在另一个实施方案中,αGT基因的2个等位基因可以通过至少一个点突变致使失活。在一个实施方案中,这个点突变可以经由遗传靶向事件出现。在另一个实施方案中,这个点突变可以是天然存在的。在一个进一步的实施方案中,突变可以经由诱变剂在αGT基因中诱导。在一个具体实施方案中,点突变可以是在αGT基因的外显子9的第二个碱基上的T至G突变。在αGT基因中携带天然存在的点突变的猪允许产生αGT缺陷的猪,其不含抗生素抗性基因,并且从而具有制备更安全产物用于人使用的潜力。在其他实施方案中,可以存在至少2个、至少3个、至少4个、至少5个、至少10个或至少20个点突变,以致使αGT基因失活。在其他实施方案中,提供了其中αGT基因的2个等位基因含有点突变的猪,所述点突变阻止功能性αGT酶的任何表达。在一个具体实施方案中,提供了在αGT基因的2个等位基因中外显子9的第二个碱基上的T至G突变的猪。本发明的另一个方面提供了其中αGT基因的2个等位基因灭活的猪科动物,由此一个等位基因通过遗传靶向事件灭活,并且另一个等位基因经由突变灭活。在一个实施方案中,提供了其中αGT基因的2个等位基因灭活的猪科动物,由此一个等位基因通过遗传靶向事件灭活,并且另一个等位基因由于在外显子9的第二个碱基上的T至G点突变的存在灭活。在一个具体实施方案中,提供了其中αGT基因的2个等位基因灭活的猪科动物,由此一个等位基因经由针对外显子9的靶向构建体灭活,并且另一个等位基因由于在外显子9的第二个碱基上的T至G点突变的存在灭活。免疫调节剂免疫调节剂包括补体调节剂和免疫抑制剂。(i)补体调节剂补体是用于一系列血液蛋白质的集合术语,且是免疫系统的主要效应机制。补体激活及其在靶结构上的沉积可以导致直接补体介导的细胞裂解,或由于炎症的有力调节剂的生成以及免疫效应细胞的召募和激活,可以间接导致细胞或组织破坏。介导组织损伤的补体激活产物在补体途径的各个点上生成。在宿主组织上的不适当补体激活在许多自身免疫和炎性疾病的病理学中起重要作用,并且还负责与例如心肺炎症和移植排斥后的生物不相容性相关的许多疾病状态。在宿主细胞膜上的补体沉积通过在细胞表面上表达的补体抑制蛋白质阻止。补体系统包含约30种蛋白质的集合,且是免疫系统的主要效应机制之一。补体级联主要经由经典(通常是抗体依赖性的)或替代(通常是抗体不依赖性的)途径激活。经由任一途径的激活导致C3转化酶的生成,所述C3转化酶是级联的关键酶促复合物。C3转化酶将血清C3切割成C3a和C3b,其中后者与激活部位共价结合且导致C3转化酶的进一步生成(扩增环)。激活产物C3b(以及仅经由经典途径生成的C4b)及其分解产物是重要的调理素,并且涉及促进靶细胞的细胞介导的裂解(通过吞噬细胞和NK细胞)以及免疫复合物转运和溶解。C3/C4激活产物及其在免疫系统的多种细胞上的受体在调节细胞免疫应答中也是重要的。C3转化酶参与C5转化酶的形成,所述C5转化酶是切割C5以获得C5a和C5b的复合物。C5a具有强大的促炎和趋化性质,并且可以召募且激活免疫效应细胞。C5b的形成起始末端补体途径,导致补体蛋白质C6、C7、C8和(C9)n的顺次装配,以形成膜攻击复合物(MAC或C5b-9)。在靶细胞膜中MAC的形成可以导致直接的细胞裂解,但还可以引起细胞激活和多种免疫调节剂的表达/释放。存在膜补体抑制剂的2个广泛类别:补体激活途径的抑制剂(抑制C3转化酶形成)和末端补体途径的抑制剂(抑制MAC形成)。补体激活的膜抑制剂包括补体受体1(CR1)、衰变加速因子(DAF或CD55)和膜辅因子蛋白质(MCP或CD46)。它们都具有这样的蛋白质结构,其由不同数目的约60-70个氨基酸的重复单位(称为短共有重复序列(SCR))组成,这是C3/C4结合蛋白质的共有特征。已鉴定了人补体激活抑制剂的啮齿类动物同系物。啮齿类动物蛋白质Cr1是与DAF和MCP类似起作用的补体激活的广泛分布抑制剂。啮齿类动物还表达DAF和MCP,尽管Cr1看起来在功能上是啮齿类动物中补体激活的最重要调节剂。尽管在人中未发现Cr1的同系物,但Cr1的研究及其在动物模型中的用途是临床上相关的。末端补体途径的控制和宿主细胞膜中的MAC形成主要通过CD59的活性出现,所述CD59是通过糖基化磷脂酰肌醇(GPI)锚与质膜附着的广泛分布的20kD糖蛋白。CD59在装配MAC中与C8和C9结合且阻止膜插入。通过膜结合的补体调节蛋白质如DAF、MCP和CD59,宿主细胞受保护免于其自身补体。当器官移植到另一个物种内时,受体中的天然抗体结合供体器官的内皮且激活补体,从而起始快速排斥。先前已暗示与人细胞形成对比,猪的那些对人补体非常敏感,并且认为这是因为猪细胞表面补体调节蛋白质针对人补体是无效的。当器官移植到另一个物种内时,受体中的天然抗体结合供体器官的内皮且激活补体,从而起始快速排斥。几个策略已显示阻止或延迟排斥,包括IgM天然抗体的去除和全身性去补体或使用sCR1、肝素或C1抑制剂的补体抑制。对于排斥问题的替代方法是在转基因猪中表达人、膜结合的补体调节分子。已生成了表达衰变加速因子DAF(CD55)、膜辅因子蛋白质MCP(CD46)和反应性裂解的膜抑制剂MIRL(CD59)的转基因猪。(参见Klymium等人MolReprodDev(2010)77:209–221)。这些人抑制剂已显示在猪血管内皮上是丰富表达的。来自对照动物的心脏由人血液的离体灌注引起在数分钟内补体介导的器官破坏,然而得自转基因动物的心脏对补体是抗拒的且存活数小时。如上概述的关于在猪器官中表达人补体调节蛋白质以使其“人源化”的原理基于下述假定:内源猪调节蛋白质在抑制人补体方面无效,并且从而在异种移植的背景中很少促成器官存活。涉及在非人灵长类动物中的猪岛异种移植的研究已显示补体激活的重要性,包括补体组分(C3、C5、C9、SC5b-9)的沉积,和在移植后12-24小时内在岛移植物中观察到的IgM的显著结合。补体激活可以在与IBMIR相关的炎症应答中起重要作用,所述IBMIR阻止大部分输注的岛移入(Cantarovich等人,Xenotransplantation9:25,2002;Kirchhof等人,Xenotransplantation11(5),396,2004;Tjernberg等人,Transplantation.2008Apr27;85(8):1193-9)。此外,可溶性补体抑制剂可以在体外阻止补体介导的岛裂解(Bennet等人,Transplantation69(5):711,2000)。给予Morgan等人的美国专利7,462,466描述了几种人补体调节蛋白质(CRP)的猪科类似物的分离和表征。研究举例说明表达人补体调节蛋白质分子的猪器官对补体损害是抗性的,不是因为它们表达人CRP分子,而是因为它们表达极大增加量的功能CRP分子。Morgan等人发现猪科CRP的表达增加可以在保护供体器官不受导致超急性排斥的补体损害中与表达人补体调节蛋白质的供体器官是同样有效的。CD46已表征为具有调节性质的蛋白质,其能够保护宿主细胞不受经由经典和替代途径激活的补体介导的攻击(Barilla-LaBarca,M.L.等人,J.Immunol.168,6298-6304(2002))。在由低水平的天然或诱导的抗Gal或抗非Gal抗体介导的炎症和体液排斥过程中,hCD46可以提供不受补体裂解的保护。因此,更多的岛能够移入且随后更好地保护不受排斥,从而减少免疫抑制需要。在本发明的一个实施方案中,提供了动物、组织和细胞,其表达至少一种补体调节剂,且缺乏功能αGT的任何表达或在胰腺组织中表达下述中的至少一种:1)免疫抑制剂(即CTLA-4、B7等),或2)抗凝血剂(即TFPI、水蛭素、血栓调节蛋白、EPCR、CD39等)。在其他实施方案中,提供了动物、组织和细胞,其表达至少一种补体调节剂,缺乏功能αGT的任何表达且在胰腺组织中表达下述中的至少一种:1)免疫抑制剂(即CTLA-4、B7等),或2)抗凝血剂(即TFPI、水蛭素、血栓调节蛋白、EPCR、CD39等)。在一个实施方案中,补体抑制剂(例如CD46、DAF)在它通常在其中表达的每一种细胞中表达。在另一个实施方案中,补体抑制剂是遍在表达的。在再进一步的实施方案中,提供了动物、组织和细胞,其表达至少一种补体调节剂,缺乏功能αGT的任何表达,表达至少一种免疫抑制剂(即CTLA-4、B7等),且在胰腺组织中表达至少一种抗凝血剂(即TFPI、水蛭素、血栓调节蛋白、EPCR、CD39等)。在某些实施方案中,胰腺组织是猪科的。在进一步的实施方案中,胰腺组织包含胰岛细胞。在某些实施方案中,补体调节剂可以是补体抑制剂。在进一步的实施方案中,补体抑制剂可以是膜补体抑制剂。膜补体抑制剂可以是补体激活途径的抑制剂(抑制C3转化酶形成)或末端补体途径的抑制剂(抑制MAC形成)。补体激活的膜抑制剂包括补体受体1(CR1)、衰变加速因子(DAF或CD55)、膜辅因子蛋白质(MCP或CD46)等。末端补体途径的膜抑制剂可以包括CD59等。在其中表达补体调节剂的情况下,可以表达2种或更多种不同的补体调节剂。在本发明的一些实施方案中,补体调节剂是人补体调节剂。在其他实施方案中,补体调节剂是猪科补体调节剂。在一个实施方案中,根据本发明的动物、组织或细胞可以进行修饰,以转基因表达一种或多种补体调节剂。动物、组织或细胞可以进行修饰,以表达补体调节剂肽、其生物学活性片段或衍生物。在一个实施方案中,补体调节剂肽是全长补体调节剂。在一个进一步的实施方案中,补体调节剂肽可以含有小于全长补体调节剂蛋白质。本领域技术人员已知的任何人或猪科补体调节序列或其生物学活性部分或片段可以是根据本发明的组合物和方法。在另外的实施方案中,任何共有补体调节剂肽可以根据本发明使用。在另一个实施方案中,核酸和/或肽序列与本文描述的补体调节剂肽和核苷酸序列至少80%、85%、90%或95%同源。在进一步的实施方案中,可以使用显示出与补体调节剂相似的活性的任何片段或同源序列。(ii)免疫抑制剂“免疫抑制剂”转基因能够下调免疫应答。对于任何类型的移植程序,在功效和毒性之间的平衡是关于其临床接受的关键因素。就岛移植而言,进一步的关注是许多目前免疫抑制试剂特别是糖皮质激素或钙神经素抑制剂例如他克莫司损害β细胞或诱导外周胰岛素抗性(Zeng等人Surgery(1993)113:98-102)。包括西罗莫司、低剂量他克莫司和针对IL-2受体的单克隆抗体(mAb)的无类固醇免疫抑制方案(“Edmonton方案”)已在单独用于具有1型糖尿病的患者的岛移植试验中使用(Shapiro,A.M.J.等人,(2000),N.Eng.J.Med.,343:230-238)。使用“Edmonton方案”的近期成功已更新了关于使用岛移植以治疗糖尿病的热情。然而,关于他克莫司毒性的关注可以限制这种治疗在人中的应用。封闭关键T细胞共刺激信号特别是CD28途径的生物学试剂是保护岛的潜在替代物。封闭CD28途径的试剂的例子包括但不限于可溶性CTLA4,包括突变型CTLA4分子。T细胞激活涉及移植排斥的发病机理。T细胞的激活需要至少2组发信号事件。第一种通过与抗原呈递细胞(APC5)上的主要组织相容性复合物(MHC)分子组合的经由抗原肽的T细胞受体的特异性识别起始。第二组信号是抗原非特异性的,且通过与其在APC上的配体相互作用的T细胞共刺激受体递送。在不存在共刺激的情况下,T细胞激活受损或取消,这可以导致克隆无反应的抗原特异性无反应状态,或通过凋亡死亡的缺失。因此,T细胞共刺激的封闭可以提供用于以抗原特异性方式抑制不希望有的免疫应答,同时保存正常免疫功能的方法(Dumont,F.J.2004Therapy1,289-304)。在迄今为止鉴定的几个T细胞共刺激途径中,最突出的是CD28途径。CD28,在T细胞上表达的细胞表面分子,及其在树突细胞、巨噬细胞和B细胞上存在的反受体,B7.1(CD8O)和B7.2(CD86)分子,已得到表征且鉴定为用于中断T细胞共刺激信号的有吸引力的靶。与CD28同源的第二种T细胞表面分子称为细胞毒性T淋巴细胞结合蛋白质(CTLA4)。CTLA4是细胞表面发信号分子,但与CD28的作用相反,CTLA4负面调节T细胞功能。CTLA4对于B7配体具有比CD28高20倍的亲和力。关于人CTLA4的基因在1988年克隆且在1990年染色体作图(Dariavach等人,Eur.J.Immunol.18:1901-1905(1988);Lafage-Pochitaloff等人,Immunogenetics31:198-201(1990);美国专利号5,977,318)。CD28/B7途径已变成用于破坏T细胞共刺激信号的有吸引力的靶。CD28/B7抑制剂的设计已采用这种系统的内源负调节剂CTLA4。CTLA4-免疫球蛋白(CTLA4-Ig)融合蛋白已作为抑制T细胞共刺激的方法广泛研究。对于任何免疫抑制治疗必须达到困难的平衡;必须提供足够的抑制以克服疾病或排斥,但过度免疫抑制将抑制整个免疫系统。CTLA4-Ig的免疫抑制活性已在器官移植和自身免疫病的动物模型的临床前研究中得到证实。可溶性CTLA4近期已在具有肾衰竭、银屑病和类风湿性关节炎的人患者中进行测试,并且已配制为由Bristol-MyersSquibb开发的药物(阿巴西普,可溶性CTLA4-Ig),所述药物已批准用于治疗类风湿性关节炎。这种药物是选择性T细胞共刺激调节剂的新类别中的第一个。Bristol-MyersSquibb也用贝拉西普(LEA29Y)执行用于同种异体移植肾移植物的II期临床试验。LEA29Y是突变形式的CTLA4,其已改造为对于B7受体具有比野生型CTLA4更高的亲和力,与免疫球蛋白融合。RepligenCorporation也用其CTLA4-Ig执行用于特发性血小板减少性紫癜的临床试验。名称为“MethodsforprotectingallogeneicislettransplantusingsolubleCTLA4mutantmolecules”的美国专利U5730403描述了可溶性CTLA4-Ig和CTLA4突变分子保护同种异体移植岛移植物的用途。尽管来自一个生物的CTLA-4能够与来自另一个生物的B7结合,但对于同种异体移植B7发现最高亲合力。因此,虽然来自供体生物的可溶性CTLA-4因此可以与受体B7(在正常细胞上)和供体B7(在异种移植的细胞上)结合,但它优先结合在异种移植物上的B7。因此,在包含用于异种移植的猪科动物或细胞的本发明的一个实施方案中,猪科CTLA4是一般的。通过ImperialCollege的PCT公开号WO99/57266描述了猪科CTLA4序列和可溶性CTLA4-Ig的施用用于异种移植治疗。VaughnA.等人,JImmunol(2000)3175-3181描述了可溶性猪科CTLA4-Ig的结合和功能。猪科CTLA4-Ig结合猪科(而不是人)B7,封闭在受体T细胞上的CD28且致使这些局部T细胞无反应,而不引起总体T细胞免疫抑制(参见Mirenda等人,Diabetes54:1048-1055,2005)。迄今为止,关于CTLA4-Ig作为免疫抑制试剂的许多研究已集中于将可溶形式的CTLA4-Ig施用于患者。改造为表达CTLA4-Ig的转基因小鼠已被制备且实施几个系列的实验。Ronchese等人检查了一般地在小鼠中表达CTLA4-Ig后免疫系统功能(Ronchese等人JExpMed(1994)179:809;Lane等人JExpMed.(1994)Mar1;179(3):819)。Sutherland等人(Transplantation.200069(9):1806-12)描述了在小鼠中通过转基因胎儿胰腺同种异体移植分泌的CTLA4-Ig的保护效应,以测试转基因表达的CTLA4-Ig对同种异体岛移植物的作用。Lui等人(JImmunolMethods2003277:171-183)报道了在哺乳动物特异性启动子的控制下表达CTLA4-Ig的转基因小鼠的产生,以在用于用作生物反应器的转基因动物的乳中诱导可溶性CTLA4-Ig的表达。AlexionPhamaceuticalsInc.的PCT公开号WO01/30966描述了含有与补体蛋白质CD59附着的T细胞抑制剂CTLA-4的嵌合DNA构建体,以及含有其的转基因猪科细胞、组织和器官。PCT公开号WO2007035213(Revivicor)描述了已遗传修饰为表达CTLA4-Ig的转基因猪科动物。尽管已建议了CTLA4-Ig表达动物的开发,但这些动物是严重无免疫应答的。近来,使用CAG增强子/启动子遍在表达CTLA4-Ig的由Revivicor,Inc.产生的猪被发现具有无免疫应答的表型,并且在一般畜牧环境中不是活的(参见实施例11)。在本发明中,与来自大鼠Ins2基因(Gerrish等人,2004)的启动子组合的,已知在胎儿和成体岛中指导基因表达的来自Pdx-1基因的岛谱系特异性增强子(Lomedico等人,1979)用于构建用于在所得到的转基因动物的岛中局部和特异地驱动免疫抑制剂转基因表达的载体。另外的免疫调节剂且特别地免疫抑制剂可以在动物、组织和细胞中表达。例如,在小鼠中已灭活以产生无免疫应答表型的基因可以被克隆且在猪中通过基因靶向被破坏。在小鼠中已靶向且可以靶向以产生无免疫应答的猪的某些基因包括β2-微球蛋白(MHII类缺陷,Koller等人,Science,248:1227-1230)、TCRα、TCRβ(Mombaerts等人,Nature,360:225-231)、RAG-1和RAG-2(Mombaerts等人,(1992)Cell68,869-877,Shinkai等人,(1992)Cell68,855-867,US5859307)。在一个实施方案中,根据本发明的动物或细胞可以进行修饰,以转基因表达细胞毒性T淋巴细胞结合的蛋白质4-免疫球蛋白(CTLA4)。动物或细胞可以进行修饰,以表达CTLA4肽或其生物学活性片段(例如细胞外结构域、其中至少跨膜结构域已被去除的截短形式的肽)或其衍生物。肽可以是例如人或猪科的。CTLA4肽可以是突变的。突变的肽可以对于猪科和/或人B7分子具有比野生型更高的亲和力。在一个具体实施方案中,突变的CTLA4可以是CTLA4(Glu104,Tyr29)。CTLA4肽可以这样进行修饰,使得它在细胞内表达。CTLA4肽的其他修饰包括内质网停留信号对于N或C末端的添加。内质网停留信号可以是例如序列KDEL。CTLA4肽可以与肽二聚化结构域或免疫球蛋白(Ig)分子融合。CTLA4融合肽可以包括可以连接2种肽的连接序列。在另一个实施方案中,根据本发明产生的缺乏功能免疫球蛋白的表达的动物可以施用作为药物的CTLA4肽或其变体(pCTLA4-Ig或hCTLA4-Ig(阿巴西普/Orencia,或贝拉西普),以抑制其T细胞应答。如本文使用,术语CTLA4用于指CTLA4或这些变体中的任一种,例如,CTLA4-Ig或本领域已知的其它。在一个实施方案中,CTLA4肽是全长CTLA4。在一个进一步的实施方案中,CTLA4肽可以含有小于全长CTLA4蛋白质。在一个实施方案中,CTLA4肽可以含有CTLA-4肽的细胞外结构域。在一个特定实施方案中,CTLA4肽是CTLA4的细胞外结构域。在再进一步的实施方案中,本发明提供了突变形式的CTLA4。在一个实施方案中,突变形式的CTLA4可以对于猪科和/或人B7具有比野生型更高的亲和力。在一个具体实施方案中,突变的CTLA4可以是人CTLA4(Glu104,Tyr29)。在一个实施方案中,CTLA4可以是截短形式的CTLA4,其中蛋白质的至少跨膜结构域已被去除。在另一个实施方案中,CTLA4肽可以这样进行修饰,使得它在细胞内表达。在一个实施方案中,高尔基保留信号可以加入CTLA4肽的N或C末端。在一个实施方案中,高尔基保留信号可以是序列KDEL,这可以加入CTLA4肽的N或C末端。在进一步的实施方案中,CTLA4肽可以与肽二聚化结构域融合。在一个实施方案中,CTLA4肽可以与免疫球蛋白(Ig)融合。在另一个实施方案中,CTLA4融合肽可以包括连接2种肽的连接序列。本领域技术人员已知的任何人CTLA4序列或其生物学活性部分或片段可以是根据本发明的组合物和方法。非限制性例子包括但不限于下述Genbank登记号,其描述人CTLA4序列:NM005214.2;BC074893.2;BC074842.2;AF414120.1;AF414120;AY402333;AY209009.1;BC070162.1;BC069566.1;L15006.1;AF486806.1;AC010138.6;AJ535718.1;AF225900.l;AF225900;AF411058.l;M37243.1;U90273.1;和/或AF316875.l。编码CTLA4肽的进一步核苷酸序列可以选自包括但不限于来自EST数据库的下述Genbank登记号的那些:CD639535.1;A1733018.1;BM997840.1;BG536887.1;BG236211.1;BG058720.l;A1860i99.l;AW207094.l;AA210929.1;A1791416.1;BX113243.1;AW515943.1;BE837454.1;AA210902.1;BF329809.1;A1819438.1;BE837501.1;BE837537.1;和/或AA873138.1。在另外的实施方案中,任何共有CTLA4肽可以根据本发明使用。在另一个实施方案中,核酸和/或肽序列与天然CTLA4肽和核苷酸序列至少80%、85%、90%或95%同源。在进一步的实施方案中,可以使用显示出与CTLA4相似的活性的任何片段或同源序列。在其他实施方案中,显示出T细胞抑制活性的氨基酸序列可以是猪科CTLA4序列的氨基酸38–162或人CTLA4序列的氨基酸38–161(参见例如,PCT公开号WO01/30966)。在一个实施方案中,使用的部分应具有至少约25%且优选至少约50%的母体分子活性。在其他实施方案中,本发明的CTLA4核酸和肽可以与免疫球蛋白基因及其分子或片段或区域融合。提及本发明的CTLA4序列包括与免疫球蛋白融合的那些序列。在一个实施方案中,Ig可以是人Ig。在另一个实施方案中,Ig可以是IgG,特别是IgG1。在另一个实施方案中,Ig可以是IgG的恒定区。在一个特定实施方案中,恒定区可以是IgG1的Cγ1链。在本发明的一个特定实施方案中,猪科CTLA4的细胞外结构域可以与人Cγ1Ig融合。在另一个特定实施方案中,人CTLA4的细胞外结构域可以与IgG1或IgG4融合。在一个进一步特定的实施方案中,突变的CTLA4(Glu104,Tyr29)的细胞外结构域可以与IgG1融合。(iii)其他免疫调节剂可以使用的其他免疫调节剂包括II类反式激活因子(CIITA)及其突变体PDL1、PDL2、肿瘤坏死因子-α-相关凋亡诱导配体(TRAIL)、Fas配体(FasL、CD95L)、整联蛋白结合蛋白质(CD47)、HLA-E、HLA-DP、HLA-DQ或HLA-DR。(a)CIITA:II类反式激活因子(CIITA)是二或多功能结构域蛋白质,其充当转录激活子且在MHCII类基因的表达中起关键作用。先前已证实编码缺乏氨基末端151个氨基酸的蛋白质的突变形式的人CIITA基因充当HLAII类表达的有力显性失活抑制剂(Yun等人,IntImmunol.1997Oct;9(10):1545-53)。猪科MHCII类抗原是通过人CD4+T细胞的直接T细胞识别的有力刺激物,并且因此可能在临床异种移植中对于转基因猪供体的排斥应答中起重要作用。据报道一种突变的人CIITA构建体在猪细胞中是有效的,显著抑制IFN[γ]诱导的以及组成性猪科MHCII类表达。此外,携带突变的人CIITA构建体的稳定转染的猪血管内皮细胞系未能刺激通过纯化CD4+T人细胞的直接T细胞异种识别(Yun等人,Transplantation.2000Mar15;69(5):940-4)。来自CIITA-DN转基因动物的器官、组织和细胞可以在人受体中诱导减少得多的T细胞排斥应答。与其他转基因组合,突变的CIITA的转基因表达可以使长期异种移植存活成为可能,具有临床上可接受水平的免疫抑制。(b)PDL1、PDL2:关于T细胞激活的一般共刺激分子是CD80/86或CD40。除经过过去数年的这些阳性共刺激途径外,已发现了介导负信号且对于调节T细胞激活重要的新共刺激途径。这些较新途径之一是由程序性死亡1(PD-1)受体及其配体PD-L1和PD-L2组成的途径。PD-1受体在静止细胞中不表达,但在T和B细胞激活后上调。PD-1含有基于细胞质免疫受体酪氨酸的转换基序,并且PD-L1或PD-L2与PD-1的结合导致T细胞中的抑制信号。近期数据暗示PD1/PD配体途径可能在显示出调节活性的T细胞亚群的控制中起作用。在小鼠中,PD-1信号已显示是调节性T细胞(Treg)的抑制活性和适应性Treg的生成所需的。这些观察暗示PD-1/PDLig和相互作用不仅抑制T细胞应答,还可以引发免疫调节。几个证据系证实PD-1/PD配体途径可以控制同种异体移植物的移入和排斥,暗示这些分子是关于在器官移植后的免疫调节的有利靶。事实上,同种异体移植物存活的延长可以通过在大鼠移植模型中PDL1Ig基因转移至供体心脏获得。此外,通过注射PD-L1Ig增强PD-1发信号也已报道为在小鼠中保护移植物不受排斥。近期数据还显示在小鼠中PD-L1IG在岛移植物上的过表达可以部分延长岛移植物存活。人PD-L1或PD-L2在猪细胞和组织中的转基因表达应减少经由致敏作用的直接途径起始的早期人抗猪T细胞应答(Plege等人,Transplantation.2009Apr15;87(7):975-82)。通过Treg的诱导,可能还可以通过达到长效耐受所需的间接途径控制对于异种移植物致敏的T细胞。(c)TRAIL/FasL:凋亡诱导配体例如Fas配体(FasL、CD95L)或肿瘤坏死因子-α-相关凋亡诱导配体(TRAIL、Apo-2L)的表达可以消除攻击异种移植物的T细胞。TRAIL是具有与其他肿瘤坏死因子家族成员的那种同源的细胞外结构域的II型膜蛋白质,显示与FasL的最高氨基酸同一性(28%)。TRAIL优先对肿瘤细胞发挥其凋亡诱导作用。在正常细胞中,TRAIL受体的结合不导致细胞死亡。近期研究已显示免疫细胞包括T细胞、天然杀伤细胞、巨噬细胞和树突细胞的细胞毒性效应至少部分通过TRAIL介导。人TRAIL在转基因猪中的表达可以提供合理策略,用于在异种移植至灵长类动物后保护猪组织不受细胞介导的排斥。人TRAIL的稳定表达已在转基因猪中达到,并且表达的TRAIL已显示在体外是生物学功能的(Klose等人,Transplantation.2005Jul27;80(2):222-30)。(d)CD47:CD47,称为整联蛋白结合蛋白质,是遍在表达的50-kDa细胞表面糖蛋白,其充当关于信号调节蛋白质(SIRP)α(也称为CD172a、SHPS-1)的配体,在巨噬细胞上的免疫抑制受体。CD47和SIRPα构成在多种细胞过程中起重要作用的细胞间通信系统(CD47-SIRPα系统),所述细胞过程包括细胞迁移、B细胞粘附和T细胞激活。此外,CD47-SIRPα系统牵涉通过巨噬细胞的吞噬作用的负调节。通过与抑制性巨噬细胞受体SIRPα的结合,在几个细胞类型(即红细胞、血小板或白血病)表面上的CD47可以保护不受通过巨噬细胞的吞噬作用。CD47-SIRPα相互作用在自身识别和吞噬作用的抑制中的作用已通过下述观察举例说明:原代、野生型小鼠巨噬细胞快速吞噬得自CD47缺陷小鼠的未受调理素作用的RBC,而不是来自野生型小鼠的那些。已报道通过其SIRPα受体,CD47抑制Fcγ和补体受体介导的吞噬作用。已证实猪科CD47在人巨噬细胞样细胞系不诱导SIRPα酪氨酸磷酸化,并且可溶性人CD47-Fc融合蛋白抑制人巨噬细胞针对猪科细胞的吞噬活性。还指出用于表达人CD47的猪科细胞操作根本上减少细胞对通过人巨噬细胞的吞噬作用的敏感性(Ide等人,ProcNatlAcadSciUSA.2007Mar20;104(12):5062-6)。人CD47在猪科细胞上的表达可以提供对于人巨噬细胞上的SIRPα的抑制信号,提供阻止巨噬细胞介导的异种移植物排斥的方法。(e)NK细胞应答。HLA-E/β2微球蛋白和HLA-DP、HLA-DQ、HLA-DR:人天然杀伤(NK)细胞代表成功的猪科至人异种移植的潜在障碍,因为它们浸润离体由人血液灌注的猪器官,并且在体外直接和在人血清的存在下通过抗体依赖性细胞介导的细胞毒性裂解猪细胞。NK细胞自身反应性通过在正常自体细胞上抑制性NK受体的主要组织相容性复合物(MHC)I类配体的表达阻止。在大多数激活的人NK细胞上表达的抑制性受体CD94/NKG2A与人白细胞抗原(HLA)-E特异性结合。非经典人MHC分子HLA-E是关于荷有CD94/NKG2A的NK细胞的有力抑制配体,并且与经典MHC分子不同,不诱导同种异体T细胞应答。HLA-E在内质网中装配且作为稳定的三聚复合物转运至细胞表面,所述三聚复合物由HLA-E重链、β2-微球蛋白(β2m)和衍生自某些MHCI类分子的前导序列的肽组成。HLA-E的表达已显示提供针对异基因人NK细胞细胞毒性的部分保护(Weiss等人,Transplantation.2009Jan15;87(1):35-43)。HLA-E在猪器官上的转基因表达具有基本上减轻人NK细胞介导的猪科异种移植物排斥的潜力,而无同种异体应答的危险。此外,已成功地生成了携带其他HLA基因的转基因猪,目标是“人源化”猪科器官、组织和细胞(Huang等人,Proteomics.2006Nov;6(21):5815-25,还参见US6639122)。抗凝血剂岛-血液反应的特征在于加速的凝血和血小板消耗,导致在前48小时中80-90%岛团块的丧失,并且已显示与补体裂解系统的激活和在岛上组织因子的上调相关(Johansson等人Diabetes,2005,54:1755;Moberg等人,Lancet,2002,360:1999-2000;Berman等人,Transplantion2007,84:308-313)。先前,这些抗凝血剂转基因已引入动物内,目的是在猪内皮中表达其用于器官异种移植。在本发明中,与来自大鼠Ins2基因(GerrishK等人,Mol.Endocrinol.,2004,18(3):533)的启动子组合的,已知在胎儿和成体岛中指导基因表达的来自Pdx-1基因的岛谱系特异性增强子(LomedicoP等人,Cell,1979,18:545),用于构建用于在所得到的转基因动物的岛中局部和特异地驱动抗凝血剂表达的载体。组织因子途径抑制剂(TFPI)是单链多肽,其可以可逆地抑制因子Xa(Xa)和凝血酶(因子IIa),并且因此抑制TF依赖性凝血。关于TFPI的综述,请参见Crawley和Lane(ArteriosclerThrombVascBiol.2008,28(2):233-42)。Dorling和同事生成了表达融合蛋白的转基因小鼠,所述融合蛋白由与人CD4的跨膜/细胞质结构域连接的人TFPI的3个Kunitz结构域,具有P-选择素尾用于靶向Weibel-Palade细胞内贮存颗粒(ChenD等人AmJTransplant2004;4:1958-1963.)。所得到的在内皮上TFPI的激活-依赖性展示足以完全抑制小鼠心脏异种移植物通过环孢菌素治疗的大鼠的血栓形成介导的急性体液排斥。还存在凝血的有效调节可能阻止慢性排斥的建议。类似结果用表达水蛭素/CD4/P-选择素融合蛋白的转基因小鼠心脏获得,指出凝血酶生成或活性的抑制是这个模型中的保护的关键。水蛭素是在医用水蛭(例如欧洲医用水蛭(Hirudomedicinalis))的唾液腺中天然存在的肽,并且是凝血酶的有力抑制剂。Dorling和同事(Chen等人,JTransplant.2004Dec;4(12):1958-63)还生成了表达膜栓系的水蛭素融合蛋白的转基因小鼠,并且将其心脏移植到大鼠内(小鼠-大鼠Xeno-Tx)。与在3天内全部排斥的对照非转基因小鼠心脏比较,来自转基因小鼠的2个品系的100%器官对体液排斥是完全抗性的,并且当T细胞介导的排斥通过施用环孢菌素A抑制时,存活超过100天。Riesbeck等人,(Circulation.1998Dec15;98(24):2744-52)还探究了在哺乳动物细胞中表达水蛭素融合蛋白作为用于阻止细胞内血栓形成的策略。在细胞中的表达减少局部凝血酶水平且抑制纤维蛋白形成。因此,水蛭素是用于阻止异种移植中存在的血栓形成效应的另一种抗凝血剂目的转基因。通过与凝血酶形成1:1化学计量复合物,血栓调节蛋白(TM)在抗凝血剂途径中凝血酶诱导的蛋白质C激活中充当辅因子。内皮细胞蛋白质C受体(EPCR)是增强蛋白质C激活的N糖基化I型膜蛋白质。这些蛋白质在蛋白质C抗凝血剂系统中的作用由VandeWouwer等人,ArteriosclerThrombVascBiol.2004Aug;24(8):1374-83综述。这些及其他抗凝血剂转基因的表达已通过多个团体探究,以潜在解决对于异种移植的凝血屏障(由Cowan和D’Apice,CurOpinOrganTransplant.2008Apr;13(2):178-83综述)。Esmon和同事(Li等人,JThrombHaemost.2005Jul;3(7):1351-9在转基因小鼠的内皮上超表达EPCR,并且显示此类表达保护小鼠不受血栓形成攻击。Iino等人,(JThrombHaemost.2004May;2(5):833-4),暗示经由基因治疗在供体岛中离体超表达TM作为阻止岛移植中的血栓并发症的方法。CD39是主要血管三磷酸核苷二磷酸水解酶(NTPDase)且将ATP和ADP转换为AMP且最终为腺苷。细胞外腺苷在血栓形成和炎症中起重要作用,并且因此已就其在移植中的有利作用进行研究(由Robson等人SeminThrombHemost.2005Apr;31(2):217-33综述)。近期研究已显示CD39在减少炎症应答中具有主要效应(Beldi等人,FrontBiosci,2008,13:2588-2603)。表达hCD39的转基因小鼠显示出在心脏移植模型中受损的血小板聚集、延长的出血时间和对于全身性血栓栓塞的抗性(Dwyer等人,JClinInvest.2004May;113(10):1440-6)。他们还显示在胰岛上表达CD39,并且当与人血液一起温育时,与野生型岛比较,这些岛显著延迟凝血时间(Dwyer等人,Transplantation.2006Aug15;82(3):428-32)。在转基因猪中由组成型启动子系统以高水平表达hCD39的初步努力显示高出生后致死率(Revivicor,Inc.,未公开的数据)。因此,存在以这样的方式在猪中表达抗凝血剂转基因的需要,所述方式不损害动物的健康,仍提供足够水平的表达用于在临床异种移植中利用。细胞保护转基因本发明包括细胞保护转基因(“细胞保护剂”)。细胞保护剂转基因考虑包括抗凋亡、抗氧化剂和抗炎剂。例子包括:(a)A20:A20提供抗炎和抗凋亡活性。血管化的移植器官可以受保护不受通过抗炎、抗凝血剂和/或抗凋亡分子的内皮细胞激活和细胞损害。在具有用于调节急性血管排斥(AVR)的巨大潜力的基因中有人A20基因(hA20),其首先鉴定为在人脐静脉内皮细胞中的肿瘤坏死因子(TNF)-α诱导因子。分别地经由几个级联的封闭和转录因子核因子-κB,通过保护内皮细胞不受TNF介导的凋亡和炎症,人A20具有双重细胞保护功能。已产生了活的A20转基因小猪,并且在这些动物中,hA20的表达局限于骨骼肌、心脏和PAEC,其通过hA20表达保护不受TNF介导的凋亡和至少部分不受CD95(Fas)L介导的细胞死亡。此外,来自hA20转基因克隆的猪的心肌细胞部分受保护不受心脏病发作(Oropeza等人,Xenotransplantation.2009Nov;16(6):522-34)。(b)HO-1:HO提供抗炎、抗凋亡和抗氧化剂活性。血红素氧化酶(HO),血红素分解代谢中的限速酶,也命名为HSP32,属于热休克蛋白质成员,其中血红素环切割成亚铁离子、一氧化碳(CO)和胆绿素,其随后通过胆绿素还原酶转换为胆红素。已克隆了HO的3种同种型,包括HO-1、HO-2和HO-3。HO-1的表达是高度可诱导的,而HO-2和HO-3是组成性表达的(MainesMD等人,AnnualReviewofPharmacology&Toxicology1997;37:517-554,和ChoiAM等人,AmericanJournalofRespiratoryCell&MolecularBiology1996;15:9-19)。HO-1-/-小鼠的分析暗示编码HO-1的基因调节铁稳态,并且充当具有潜在抗氧化剂、抗炎和抗凋亡效应的细胞保护基因(PossKD等人,ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica1997;94:10925-10930,PossKD等人,ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica1997;94:10919-10924,和SoaresMP等人,NatureMedicine1998;4:1073-1077)。类似发现近期在人中HO-1缺陷的病例报告中描述(YachieA等人,JournalofClinicalInvestigation1999;103:129-135)。负责HO-1的细胞保护效应包括抗炎、抗氧化和抗凋亡的分子机制由其反应产物介导。HO-1表达可以在体外和体内通过具有不同金属的原卟啉介导。钴原卟啉(CoPP)和铁原卟啉(FePP)可以上调HO-1的表达。相比之下,锡原卟啉(SnPP)和锌原卟啉(ZnPP)抑制HO-1在蛋白质水平的活性。近来,已证明HO-1的表达抑制小鼠至小鼠心脏移植的排斥(SatoK等人,J.Immunol.2001;166:4185-4194),保护岛细胞不受凋亡,并且改善在移植后岛细胞的体内功能(PileggiA等人,Diabetes2001;50:1983-1991)。还已证明HO-1通过基因转移的施用提供不受氧过多诱导的肺损伤的保护(OtterbeinLE等人,JClinInvest1999;103:1047-1054)、HO-1的上调保护遗传上肥胖的Zucker大鼠肝不受缺血/再灌注损伤(AmersiF等人,JClinInvest1999;104:1631-1639),并且HO-1基因的取消或表达调节顺铂诱导的肾小管凋亡(ShiraishiF等人,AmJPhysiolRenalPhysiol2000;278:F726-F736)。在转基因动物模型中,显示HO-1的超表达阻止对于低氧的肺炎症和血管应答(MinaminoT等人,Proc.Natl.Acad.Sci.USA2001;98:8798-8803),并且保护心脏不受缺血和再灌注损伤(YetSF等人,CirRes2001;89:168-173)。已产生了携带HO-1转基因的猪,然而,与其在异种移植中的使用相关的临床效应未得到报道(US7378569)。(c)FAT-1:FAT-1提供了抗炎活性。多不饱和脂肪酸(PUFA)在抑制(n-3类别)炎症中起作用。哺乳动物细胞缺乏将n-6转换为n-3PUFA的去饱和酶。因此,必需n-3脂肪酸必须由饮食供应。然而,与哺乳动物不同,自由生活的线虫秀丽隐杆线虫(Caenorhabditiselegans)表达n-3脂肪酸去饱和酶,其在烃链的n-3位置上将双键引入n-6脂肪酸内,以形成n-3PUFA。已产生了转基因小鼠,其表达秀丽隐杆线虫fat-1基因,并且因此能够将6系列的饮食PUFA有效转换为3系列的PUFA,例如EPA(20:5n-3)和DHA(22-6n-3)。(Kang等人,Nature.2004Feb5;427(6974):504)。另一个团体产生了转基因小鼠模型,其中fat-1cDNA的密码子就在哺乳动物系统中的有效翻译进一步最佳化;n-3PUFA的内源产生通过超表达秀丽隐杆线虫n-3脂肪酸去饱和酶基因mfat-1达到。这个团体显示通过mfat-1的转基因表达的n-3PUFA细胞增加和n-6PUFA减少在小鼠分离的胰岛中增强葡萄糖-、氨基酸-和GLP-1-刺激的胰岛素分泌,并且致使岛对细胞因子诱导的细胞死亡强烈抗性(Wei等人,Diabetes.2010Feb;59(2):471-8)。(d)可溶性TNF-α受体(sTNFR1):肿瘤坏死因子(TNF、恶液质素(cachexin)或恶病质素,并且以前称为肿瘤坏死因子-α)是涉及全身炎症的细胞因子,并且是刺激急性期反应的一组细胞因子的成员。TNF的主要作用是在免疫细胞的调节中。TNF能够诱导凋亡性细胞死亡,诱导炎症。可溶性TNF-α受体1(sTNFR1)是TNFR1的细胞外结构域和TNF-α的拮抗剂(Su等人,1998.ArthritisRheum.41,139–149)。sTNFR1在异种移植物中的转基因表达可能具有有利的抗炎效应。具有相关抗氧化剂性质的其他细胞保护包括但不限于SOD和过氧化氢酶(Catalyse)。氧是关于好氧生物的必需分子,并且在ATP生成中起占优势的作用,即氧化磷酸化。在这个过程期间,活性氧(ROS)包括超氧化物阴离子(O(2)(-))和过氧化氢(H(2)O(2))作为副作用产生。在人中,抗氧化剂防御系统平衡ROS的生成。超氧化物歧化酶(SOD)和过氧化氢酶是具有抗氧化剂性质的2种酶。SOD催化超氧化物自由基至过氧化氢的歧化,后者通过过氧化氢酶和谷胱甘肽过氧化物酶转换为水。起因于ROS生成的细胞损害可以在转基因背景中出现。因为减少的抗氧化剂防御,胰腺β细胞对于自由基和炎症损害是特别易受影响的。常用的抗排斥药物在抑制适应性免疫应答方面是极佳的;然而,大多数对于岛是有害的,并且无法充分保护不受起因于岛分离和缺血再灌注损伤的活性氧和炎症。因此,存在用抗氧化剂离体处理岛,或经由在供体组织中的基因治疗或转基因表达来表达抗氧化剂基因的兴趣。EC-SOD和过氧化氢酶的离体基因转移在抗原诱发性关节炎的大鼠模型是抗炎的(Dai等人,GeneTher.2003Apr;10(7):550-8)。此外,EC-SOD和/或过氧化氢酶基因通过门静脉的递送显著减弱在小鼠模型中的肝I/R损伤(He等人,LiverTranspl.2006Dec;12(12):1869-79)。在近期小鼠研究中,与未经处理的对照比较,在同基因、亚最佳同基因或异基因移植前,用催化抗氧化剂处理的胰岛显示出极佳的功能。在这个相同研究中,催化抗氧化剂处理的同种异体岛的糖尿病鼠受体显示出移植后改善的升糖控制,并且证实同种异体移植物排斥中的延迟(Sklavos等人,Diabetes.2010Jul;59(7):1731-8.Epub2010Apr22)。在另一个小鼠研究中,超表达MnSOD的岛移植物比对照移植物适当起作用长约50%(Bertera等人,Diabetes.2003Feb;52(2):387-93)。此外,特定抗凝血剂也提供抗炎活性,包括血栓调节蛋白、EPCR和CD39。遗传修饰的动物的产生遗传修饰的动物可以通过本领域技术人员已知的任何方法产生,所述方法包括但不限于选择育种,核转移,DNA引入卵母细胞、精子、受精卵或卵裂球内,或经由胚胎干细胞的使用。在某些实施方案中,可以在动物中鉴定遗传修饰,所述动物随后一起育种,以形成具有遗传修饰的所需组(或单一遗传修饰)的动物群。这些后代可以进一步育种,以在其后代中产生不同或相同组的遗传修饰(或单一遗传修饰)。只要需要,对于具有一种或多种所需遗传修饰的动物的这种育种循环就可以继续。在这个背景中的“群”可以包含随着时间过去产生的具有一种或多种相同或不同遗传修饰的多代动物。“群”还可以指具有一种或多种相同或不同遗传修饰的单代动物。对于遗传修饰(经由例如但不限于同源重组)有用的细胞包括例如上皮细胞、神经细胞、表皮细胞、角化细胞、造血细胞、黑色素细胞、软骨细胞、淋巴细胞(B和T淋巴细胞)、红细胞、巨噬细胞、单核细胞、单个核细胞、成纤维细胞、心肌细胞及其他肌细胞等。此外,用于产生遗传修饰动物的细胞(经由例如但不限于核转移)可以得自不同器官,例如皮肤、肺、胰腺、肝、胃、肠、心脏、生殖器官、膀胱、肾、尿道及其他泌尿器官等。细胞可以得自身体的任何细胞或器官,包括所有体细胞或生殖细胞。另外,可以进行遗传修饰的动物细胞可以得自多种不同器官和组织,例如但不限于皮肤、间充质、肺、胰腺、心脏、肠、胃、膀胱、血管、肾、尿道、生殖器官,和完整或部分胚胎、胎儿或成体动物的分解制备物。在本发明的一个实施方案中,细胞可以选自但不限于上皮细胞、成纤维细胞、神经细胞、角化细胞、造血细胞、黑色素细胞、软骨细胞、淋巴细胞(B和T)、巨噬细胞、单核细胞、单个核细胞、心肌细胞、其他肌细胞、粒层细胞、卵丘细胞、表皮细胞、内皮细胞、郎格罕氏岛细胞、血细胞、血液前体细胞、骨细胞、骨前体细胞、神经干细胞、原始干细胞、成人干细胞、间充质干细胞、肝细胞、角化细胞、脐静脉内皮细胞、主动脉内皮细胞、微血管内皮细胞、成纤维细胞、肝星形细胞、主动脉平滑肌细胞、心肌细胞、神经元、枯否细胞、平滑肌细胞、许旺细胞和上皮细胞、红细胞、血小板、嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞、脂肪细胞、软骨细胞、胰岛细胞、甲状腺细胞、甲状旁腺细胞、耳下腺细胞、肿瘤细胞、神经胶质细胞、星形细胞、红细胞、白细胞、巨噬细胞、上皮细胞、体细胞、垂体细胞、肾上腺细胞、毛细胞、膀胱细胞、肾细胞、视网膜细胞、视杆细胞、视锥细胞、心细胞、起搏细胞、脾细胞、抗原呈递细胞、记忆细胞、T细胞、B细胞、浆细胞、肌细胞、卵巢细胞、子宫细胞、前列腺细胞、阴道上皮细胞、精细胞、睾丸细胞、生殖细胞、卵细胞、莱迪希(leydig)细胞、管周细胞、睾丸支持细胞、黄体素细胞、子宫颈细胞、子宫内膜细胞、乳房细胞、滤泡细胞、粘液细胞、纤毛细胞、非角质化上皮细胞、角质化上皮细胞、肺细胞、杯状细胞、柱状上皮细胞、鳞状上皮细胞、骨细胞、成骨细胞和破骨细胞。在一个替代实施方案中,可以使用胚胎干细胞。可以采用胚胎干细胞系,或可以从宿主例如猪科动物中新鲜获得胚胎干细胞。细胞可以在合适的成纤维细胞滋养层上生长,或在白血病抑制因子(LIF)的存在下生长。胚胎干细胞是优选生殖细胞类型,可以采用胚胎干细胞系,或可以从宿主例如猪科动物中新鲜获得胚胎干细胞。细胞可以在合适的成纤维细胞滋养层上生长,或在白血病抑制因子(LIF)的存在下生长。在其他谱系中,特别有利的细胞包括干细胞例如造血干细胞、胚胎干细胞、间充质干细胞等,郎格罕氏岛,可以分泌多巴胺的肾上腺髓质细胞,成骨细胞,破骨细胞,上皮细胞,内皮细胞,白细胞例如B和T淋巴细胞,骨髓单核细胞等,神经元,神经胶质细胞,神经节细胞,视网膜细胞,肝脏细胞例如肝细胞,骨髓细胞,角化细胞,毛囊细胞和成肌细胞(肌)细胞。在一个特定实施方案中,细胞可以是成纤维细胞或具有与成纤维细胞无法区分的形态或表型的成纤维细胞样细胞,或在老化前至少10或至少12或至少14或至少18或至少20天的寿命,或足以允许同源重组和非衰老核的核转移的寿命;在一个具体实施方案中,细胞可以是胎儿成纤维细胞。成纤维细胞是合适的体细胞类型,因为它们可以大量得自发育中的胎儿和成年动物。这些细胞可以在体外以快速倍增时间容易地繁殖,并且可以克隆繁殖用于在基因靶向程序中使用。待使用的细胞可以来自胎儿动物,或可以是新生儿或来自起源中的成体动物。细胞可以是成熟或未成熟的且是分化或非分化的。同源重组同源重组允许内源基因中的位点特异性修饰,并且从而新改变可以改造到基因组内。同源重组中的主要步骤是DNA链交换,这涉及具有含有互补序列的至少一条DNA链的一对DNA双链体,以形成含有异源双链体DNA的中间重组结构(参见例如,Radding,C.M.(1982)Ann.Rev.Genet.16:405;美国专利号4,888,274)。异源双链体DNA可以采取几个形式,包括含有三联体形式的三条DNA链,其中单条互补链侵入DNA双链体内(Hsieh等人(1990)GenesandDevelopment4:1951;Rao等人,(1991)PNAS88:2984)),并且当2条互补DNA链与DNA双链体配对时,可以形成经典Holliday重组连接或卡形结构(Holliday,R.(1964)Genet.Res.5:282),或双重-D环(于1991年9月4日提交的“DiagnosticApplicationsofDouble-DLoopFormation”美国序列号07/755,462)。形成后,异源双链体结构可以通过链断裂和交换分辨,从而使得所有或部分侵入DNA链剪切成受体DNA双链体,加入或替换受体DNA双链体的区段。可替代地,异源双链体结构可以导致基因转换,其中使用侵入链作为模板,侵入链的序列通过错配碱基修复转移至受体DNA双链体(Genes,第3版(1987)Lewin,B.,JohnWiley,NewYork,N.Y.;Lopez等人(1987)NucleicAcidsRes.15:5643)。无论是通过断裂和再连接的机制还是通过基因转换的一种或多种机制,在同源配对关节上异源双链体DNA的形成可以作用于将遗传序列信息从一个DNA分子转移到另一个。同源重组(基因转换和典型链断裂/再连接)在DNA分子之间转移遗传序列信息的能力致使靶向同源重组成为基因工程和基因处理中的有力方法。在同源重组中,进入的DNA与基因组中的位点相互作用且整合到基因组的位点内,所述位点含有基本上同源的DNA序列。在非同源(“随机”或“不正当”)整合中,进入的DNA在基因组中的同源序列上未发现,而是在其他地方在大量潜在位置之一上整合。一般而言,用高等真核生物细胞的研究已揭示同源重组的频率远远小于随机整合的频率。这些频率的比具有用于“基因靶向”的直接牵涉,所述“基因靶向”取决于经由同源重组的整合(即在基因组中在外源“靶向DNA”和相应“靶DNA”之间的重组)。本发明可以使用同源重组以灭活基因或插入片段,并且上调或激活细胞例如上文描述的细胞中的基因。DNA可以包含在特定基因座上一种或多种基因的至少部分,伴随一种或多种天然基因引入至少一个、任选2个拷贝内的改变,以便阻止功能基因产物的表达。改变可以是插入、缺失、替换、突变或其组合。当改变引入待灭活基因的仅一个拷贝内时,具有靶基因的单个未突变拷贝的细胞扩增,并且可以实施第二个靶向步骤,其中改变可以与第一个改变相同或不同,通常不同,并且当涉及缺失或替换时,可以重叠至少部分最初引入的改变。在这个第二个靶向步骤中,可以使用具有相同臂(arms)的同源性但含有不同哺乳动物选择标记的靶向载体。所得到的转化体就功能靶抗原的不存在进行筛选,并且细胞的DNA可以进一步筛选,以确保野生型靶基因的不存在。可替代地,关于表型的纯合性可以通过育种对于突变杂合的宿主来达到。许多文件描述在哺乳动物细胞中同源重组的使用。这些文件的举例说明是Kucherlapati等人(1984)Proc.Natl.Acad.Sci.USA81:3153-3157;Kucherlapati等人(1985)Mol.Cell.Bio.5:714-720;Smithies等人(1985)Nature317:230-234;Wake等人(1985)Mol.Cell.Bio.8:2080-2089;Ayares等人(1985)Genetics111:375-388;Ayares等人(1986)Mol.Cell.Bio.7:1656-1662;Song等人(1987)Proc.Natl.Acad.Sci.USA84:6820-6824;Thomas等人(1986)Cell44:419-428;Thomas和Capecchi,(1987)Cell51:503-512;Nandi等人(1988)Proc.Natl.Acad.Sci.USA85:3845-3849;和Mansour等人(1988)Nature336:348-352;Evans和Kaufman,(1981)Nature294:146-154;Doetschman等人(1987)Nature330:576-578;Thoma和Capecchi,(1987)Cell51:503-512;Thompson等人(1989)Cell56:316-321。随机插入在一个实施方案中,编码转基因序列的DNA可以随机插入细胞的染色体内。随机整合可以起因于本领域技术人员已知的将DNA引入细胞内的任何方法。这可以包括但不限于电穿孔,声孔作用,基因枪的使用,脂转染,磷酸钙转染,树枝状聚合物(dendrimers)的使用,显微注射,病毒载体包括腺病毒、AAV和逆转录病毒载体的使用,和II组核酶。在一个实施方案中,编码DNA可以设计为包括报道基因,从而使得转基因或其表达产物的存在可以经由报道基因的激活检测到。可以使用本领域已知的任何报道基因,例如上文描述的那些。通过在细胞培养中选择其中报道基因已激活的那些细胞,可以选择含有转基因的细胞。在其他实施方案中,编码转基因的DNA可以经由电穿孔引入细胞内。在其他实施方案中,DNA可以经由脂转染、感染或转化引入细胞内。在一个实施方案中,电穿孔和/或脂转染可以用于转染成纤维细胞。在一个特定实施方案中,转染的成纤维细胞可以用作用于核转移的核供体,以如本领域已知的和下文描述的生成转基因动物。已就报道基因的存在染色的细胞随后可以通过FACS分选,以富集细胞群体,从而使得我们具有更高百分比的含有编码目的转基因的DNA的细胞。在其他实施方案中,FACS分选的细胞随后可以培养一段时间例如12、24、36、48、72、96或更多小时,或此类时间段,以允许DNA整合以获得稳定转染的细胞群体。用于产生转基因动物的载体核酸靶向载体构建体可以设计为在细胞中达到同源重组。在一个实施方案中,靶向载体使用“多聚腺苷酸陷阱”进行设计。与启动子陷阱不同,多聚腺苷酸陷阱载体捕获更广谱的基因,包括在靶细胞(即成纤维细胞或ES细胞)中不表达的那些。多聚腺苷酸陷阱载体包括驱动缺乏多聚腺苷酸信号的选择标记基因表达的组成型启动子。替换多聚腺苷酸信号的是设计为剪接到下游外显子内的剪接供体位点。在这个策略中,选择标记基因的mRNA可以在捕获内源基因的多聚腺苷酸信号后得到稳定,与其在靶细胞中的表达状态无关。在一个实施方案中,构建了包含选择标记的靶向载体,所述选择标记缺乏关于多聚腺苷酸的信号。这些靶向载体可以通过任何合适方法引入哺乳动物细胞内,所述方法包括但不限于转染、转化、病毒介导的转导、或用病毒载体感染。在一个实施方案中,靶向载体可以含有与目的基因组序列同源的3'重组臂和5'重组臂(即侧接序列)。3'和5'重组臂可以这样进行设计,从而使得它们侧接基因组序列的至少一个功能区的3'和5'末端。功能区的靶向可以致使其失活,这导致细胞不能产生功能蛋白质。在另一个实施方案中,同源DNA序列可以包括一个或多个内含子和/或外显子序列。除核酸序列外,表达载体可以含有选择标记序列,例如增强型绿色荧光蛋白(eGFP)基因序列、起始和/或增强子序列、多聚腺苷酸尾序列、和/或提供构建体在原核和/或真核宿主细胞中的表达的核酸序列。选择标记可以位于5'和3'重组臂序列之间。细胞的靶向基因座的修饰可以通过将DNA引入细胞内产生,其中DNA具有与靶基因座的同源性并且包括标记基因,允许选择包含整合构建体的细胞。在靶载体中的同源DNA将与在靶基因座上的染色体DNA重组。标记基因可以在两侧上由同源DNA序列3'重组臂和5'重组臂侧接。用于构建靶向载体的方法已在本领域中描述,参见例如,Dai等人,NatureBiotechnology20:251-255,2002;WO00/51424。多种酶可以催化外源DNA插入宿主基因组内。病毒整合酶、转座酶和位点特异性重组酶介导病毒基因组、转座子或噬菌体整合到宿主基因组内。具有这些性质的酶的广泛集合可以衍生自广泛多样的来源。逆转录病毒组合几个有用特征,包括其基因组的相对简单性、易于使用及其整合到宿主细胞基因组内的能力,允许在转导的细胞或其后代中的长期转基因表达。因此,它们已用于大量基因治疗方案中。基于慢病毒载体的载体已成为用于基因治疗和转基因应用的有吸引力的候选物,如腺伴随病毒(sdeno-associatedvirus)一样,其为连同辅助病毒一起在哺乳动物细胞中共复制的小DNA病毒(细小病毒属),所述辅助病毒例如腺病毒、单纯疱疹病毒或人巨细胞病毒。病毒基因组基本上由仅2个ORF(rep,非结构蛋白质,和cap,结构蛋白质)组成,通过可变剪接和可变启动子使用由所述ORF衍生(至少)7种不同多肽。在辅助病毒的存在下,rep蛋白质介导AAV基因组的复制。整合和因此潜伏病毒感染在不存在辅助病毒的情况下出现。转座子也是有利的。这些是可以在多种生物中发现的移动DNA的区段。尽管活跃转座子在许多原核系统和昆虫中发现,但在脊椎动物中不存在功能天然转座子。果蝇P元件转座子已作为基因组改造工具使用多年。睡美人转座子(sleepingbeautytransposon)由在类鲑鱼中发现的无功能转座子拷贝建立,并且在哺乳动物细胞中比原核和昆虫转座子明显更活跃。位点特异性重组酶是催化在DNA区段之间的DNA链交换的酶,所述DNA区段仅具有有限程度的序列同源性。它们与长度30–200个核苷酸的识别序列结合,切割DNA主链,交换涉及的2个DNA双螺旋且再连接DNA。在一些位点特异性重组系统中,简单多肽足以执行所有这些反应,而其他重组酶需要不同数目的辅助蛋白质以实现这些任务。位点特异性重组酶可以分类为具有不同生物化学性质的2个蛋白质家族,即酪氨酸重组酶(其中DNA与酪氨酸残基共价附着)和丝氨酸重组酶(其中共价辅助在丝氨酸残基上出现)。用于基因组修饰方法的最流行的酶是Cre(衍生自大肠杆菌噬菌体P1的酪氨酸重组酶)和fC3l整合酶(衍生自链霉菌属(Streptomyces)噬菌体fC3l的丝氨酸重组酶)。几个其他噬菌体衍生的位点特异性重组酶(包括Flp、λ整合酶、噬菌体HK022重组酶、噬菌体R4整合酶和噬菌体TP901-1整合酶)已成功地用于介导稳定基因插入哺乳动物基因组内。近来,位点特异性重组酶已从链霉菌属噬菌体纯化。fC31重组酶是解离酶家族的成员且介导噬菌体整合。在这个过程中,噬菌体attP位点与细菌基因组中的相应attP位点重组。交换生成2个位点,attL和attR,在不存在辅助蛋白质的情况下,其不再是关于重组酶作用的靶。反应还在哺乳动物细胞中发生,并且因此可以用于介导治疗基因的位点特异性整合。酪氨酸重组酶的位点特异性已难以通过直接蛋白质工程修饰,因为催化结构域和DNA识别结构域是紧密交织的。因此,特异性中的变化通常伴随活性中的丧失。丝氨酸重组酶可能更顺应改造,并且Tn3解离酶的活性过多的衍生物已通过天然DBD交换人锌指转录因子Zif268的锌指结构域进行修饰。所得到的嵌合蛋白质称为Z-解离酶的DNA位点特异性已转变为Zif268的那种。锌指蛋白质可以通过体外蛋白质进化进行修饰,以识别任何DNA序列,因此这种方法可以使得嵌合重组酶的开发成为可能,其可以将治疗基因整合到精确基因组位置内。用于增强或介导重组的方法包括AAV载体介导的位点特异性重组和同源重组的组合,和锌指核酸酶介导的重组(参考:Geurts等人,Science,325:433,2009)。如本文使用的,术语“载体”指对插入的核酸提供有用的生物学或生物化学性质的核酸分子(优选DNA)。根据本发明,“表达载体”包括在载体转化到细胞内后,能够增强一种或多种分子的表达的载体,所述分子已插入或克隆到载体内。此类表达载体的例子包括噬菌体、自主复制序列(ARS)、着丝粒、和能够在体外或细胞中复制或待复制或将所需核酸区段传输至动物的细胞内的所需位置的其他序列。在本发明中有用的表达载体包括染色体、附加体和病毒衍生的载体,例如衍生自细菌质粒或噬菌体的载体,和衍生自其组合的载体,例如粘粒和噬菌粒或基于病毒例如腺病毒、AAV、慢病毒的载体。载体可以具有一个或多个限制性核酸内切酶识别位点,在其上序列可以以可确定方式切割,而不丧失载体的必需生物学功能,并且核酸片段可以剪接到其内以便造成其复制和克隆。载体可以进一步提供引物位点,例如用于PCR、转录和/或翻译起始和/或调节位点、重组信号、复制子、选择标记等。明确的是,还可以应用插入所需核酸片段的方法,所述方法不需要使用同源重组、转座子或限制性酶(例如但不限于PCR片段的UDG克隆(美国专利号5,334,575),TA品牌PCR克隆(InvitrogenCorp.,Carlsbad,Calif.)),以将核酸克隆到根据本发明待使用的载体内。在靶向基因座上纯合的细胞可以通过将DNA引入细胞内产生,其中DNA与靶基因座具有同源性并且包括标记基因,允许选择包含整合的构建体的细胞。在靶载体中的同源DNA将与染色体DNA重组在靶基因座上。标记基因可以在两侧上由同源DNA序列3'重组臂和5'重组臂侧接。用于构建靶向载体的方法已在本领域中描述,参见例如,Dai等人(2002)NatureBiotechnology20:251-255;WO00/51424,图6;和GeneTargeting:APracticalApproach.Joyner,A.OxfordUniversityPress,USA;第2版,2000年2月15日。可以制备多种构建体用于在靶基因座上的同源重组。通常,构建体可以包括与靶基因座同源的至少25bp、50bp、100bp、500bp、1kbp、2kbp、4kbp、5kbp、10kbp、15kbp、20kbp或50kbp序列。在测定靶DNA序列的同源性程度中可以涉及多种考虑,例如靶基因座的大小、序列的可用性、在靶基因座上双交换事件的相对效率和靶序列与其他序列的相似性。靶向DNA可以包括其中DNA基本上同基因侧接所需序列修饰的序列,具有待修饰的基因组中的相应靶序列。基本上同基因的序列可以与相应靶序列(除所需序列修饰外)至少约95%、97-98%、99.0-99.5%、99.6-99.9%或100%等同。靶向DNA和靶DNA优选可以共享100%等同的至少约75、150或500个碱基对的DNA段。相应地,靶向DNA可以衍生自与待靶向的细胞系紧密相关的细胞;或靶向DNA可以衍生自与待靶向的细胞相同细胞系或动物的细胞。合适的选择标记基因包括但不限于:赋予在特定培养基底物上生长的能力的基因,例如tk基因(胸苷激酶)或赋予在HAT培养基(次黄嘌呤、氨基蝶呤和胸苷)上生长的能力的hprt基因(次黄嘌呤磷酸核糖转移酶);允许在MAX培养基(霉酚酸、腺嘌呤和黄嘌呤)上生长的细菌gpt基因(鸟嘌呤/黄嘌呤磷酸核糖转移酶)。参见Song等人(1987)Proc.Nat’lAcad.Sci.U.S.A.84:6820-6824。还参见Sambrook等人(1989)MolecularCloning--ALaboratoryManual,ColdSpringHarborLaboratory,ColdSpringHarbor,N.Y.,参见第16章。选择标记的其他例子包括:赋予对于化合物例如抗生素的抗性的基因,赋予对于在所选底物上生长的能力的基因,编码产生可检测信号例如发光的蛋白质的基因,例如绿色荧光蛋白、增强型绿色荧光蛋白(eGFP)。广泛多样的此类标记是已知且可获得的,包括例如抗生素抗性基因例如新霉素抗性基因(neo)(Southern,P.和P.Berg,(1982)J.Mol.Appl.Genet.1:327-341);和潮霉素抗性基因(hyg)(NucleicAcidsResearch11:6895-6911(1983),和TeRiele等人(1990)Nature348:649-651)。在本发明的方法中有用的另外报道基因包括乙酰羟酸合酶(AHAS)、碱性磷酸酶(AP)、β半乳糖苷酶(LacZ)、β葡糖醛酸糖苷酶(GUS)、氯霉素乙酰转移酶(CAT)、绿色荧光蛋白(GFP)、红色荧光蛋白(RFP)、黄色荧光蛋白(YFP)、青色荧光蛋白(CFP)、辣根过氧化物酶(HRP)、萤光素酶(Luc)、胭脂碱合酶(NOS)、章鱼碱合酶(OCS)及其衍生物。多重选择标记是可获得的,其赋予对于下述的抗性:氨苄青霉素、博来霉素、氯霉素、庆大霉素、潮霉素、卡那霉素、林可霉素、杀稻瘟菌素、zeocin、氨甲蝶呤、草丁磷(phosphinothricin)、嘌呤霉素和四环素。测定报道基因的抑制的方法是本领域众所周知的,并且包括但不限于荧光法(例如荧光光谱法、荧光激活细胞分选(FACS)、荧光显微镜检查)、抗生素抗性测定。还可以使用选择标记的组合。为了使用标记的组合,可以这样克隆HSV-tk基因,使得它在靶向DNA外(需要时,另一种选择标记可以置于相反侧面上)。在将DNA构建体引入待靶向的细胞内时,细胞可以在合适抗生素上进行选择。选择标记还可以用于阴性选择。阴性选择标记一般杀死它们在其中表达的细胞,因为表达本身是毒性的或产生导致毒性代谢产物的催化剂,例如单纯疱疹病毒I型胸苷激酶(HSV-tk)或白喉毒素A。一般地,阴性选择标记这样掺入靶向载体内,从而使得它在精确重组事件后丧失。类似地,常规选择标记例如GFP可以用于使用例如FACS分选的阴性选择。缺失可以是至少约50bp,更通常是至少约100bp,并且一般不超过约20kbp,其中缺失通常可以包括编码区的至少部分,包括一个或多个外显子的部分、一个或多个内含子的部分,并且可以包括或不包括侧接非编码区的部分,特别是5'非编码区(转录调节区)。因此,同源区域可以延伸超过编码区进入5'非编码区内,或可替代地进入3'非编码区内。插入片段可以一般不超过10kbp,通常不超过5kbp,一般是至少50bp,更通常至少200bp。一个或多个同源性区域可以包括提供移码或改变关键氨基酸的突变,其中突变可以进一步灭活靶基因,或突变可以校正功能失调的等位基因等。通常,突变可以是精细改变,不超过约5%的同源侧接序列或甚至单个核苷酸变化例如在外显子的活性位点中的点突变。当需要基因的突变时,标记基因可以插入内含子内,以便在转录后从靶基因中切除。在测定靶DNA序列的同源性程度中可以涉及多种考虑,例如靶基因座的大小、序列的可用性、在靶基因座上双交换事件的相对效率和靶序列与其他序列的相似性。靶向DNA可以包括其中DNA基本上同基因侧接所需序列修饰的序列,具有待修饰的基因组中的相应靶序列。基本上同基因的序列可以与相应靶序列(除所需序列修饰外)至少约95%、或至少约97%或至少约98%或至少约99%或在95-100%之间、97-98%、99.0-99.5%、99.6-99.9%或100%等同。在一个特定实施方案中,靶向DNA和靶DNA可以共享100%等同的至少约75、150或500个碱基对的DNA段。相应地,靶向DNA可以衍生自与待靶向的细胞系紧密相关的细胞;或靶向DNA可以衍生自与待靶向的细胞相同细胞系或动物的细胞。构建体可以依照本领域已知的方法进行制备,多个片段可以集合、引入合适载体内、克隆、分析且随后进一步处理,直至已获得所需构建体。可以对序列做出多种修饰,以允许限制性分析、切除、探针的鉴定等。需要时,可以引入沉默突变。在各个阶段时,可以采用限制性分析、测序、用聚合酶链反应的扩增、引物修复、体外诱变等。构建体可以使用细菌载体包括原核复制系统进行制备,例如可由大肠杆菌识别的起点,在每个阶段时,构建体可以进行克隆且分析。可以采用与用于插入的标记相同或不同的标记,所述标记可以在引入靶细胞内之前去除。含有构建体的载体已完成后,它可以进一步处理,例如通过细菌序列的缺失、线性化、在同源序列中引入短缺失。在最后处理后,构建体可以引入细胞内。可以用于允许DNA或RNA构建体进入宿主细胞内的技术包括磷酸钙/DNA共沉淀、DNA显微注射到核内、电穿孔、与完整细胞的细菌原生质体融合、转染、脂转染、感染、粒子轰击、精子介导的基因转移、或本领域技术人员已知的任何其他技术。DNA或RNA可以是单或双链,线性或环状,松弛或超螺旋的DNA。对于用于转染哺乳动物细胞的多种技术,参见例如,Keown等人,MethodsinEnzymology,第185卷,第527-537页(1990)。提供下述载体作为例子。细菌的:pBs、pQE-9(Qiagen)、phagescript、PsiXl74、pBluescriptSK、pBsKS、pNH8a、pNHl6a、pNHl8a、pNH46a(Stratagene);pTrc99A、pKK223-3、pKK233-3、pDR54O、pRIT5(Pharmacia)。真核的:pWLneo、pSv2cat、pOG44、pXT1、pSG(Stratagene)pSVK3、pBPv、pMSG、pSVL(Pharmiacia)。此外,可以使用任何其他质粒和载体,只要它们是在宿主中可复制和活的。本领域已知的载体和商购可得的那些(及其变体或衍生物)可以依照本发明进行改造,以包括一个或多个重组位点用于在本发明的方法中使用。此类载体可以得自例如VectorLaboratoriesInc.、Invitrogen、Promega、Novagen、NEB、Clontech、BoehringerMannheim、Pharmacia、EpiCenter、OriGenesTechnologiesInc.、Stratagene、PerkinElmer、Pharmingen和ResearchGenetics。其他目的载体包括真核表达载体例如pFastBac、pFastBacHT、pFastBacDUAL、pSFV和pTet-Splice(Invitrogen)、pEUK-C1、pPUR、pMAM、pMAMneo、pBI101、pBI12l、pDR2、pCMVEBNA和pYACneo(Clontech)、pSVK3、pSVL、pMSG、pCH110和pKK232-8(Pharmacia,Inc.)、p3’SS、pXT1、pSG5、pPbac、pMbac、pMC1neo和pOG44(Stratagene,Inc.)和pYES2、pAC360、pBlueBacHisA、B和C、pVL1392、pBlueBacIII、pCDM8、pcDNA1、pZeoSV、pcDNA3pREP4、pCEP4和pEBVHis(Invitrogen、Corp.),及其变体或衍生物。其他载体包括pUC18、pUC19、pBlueScript、pSPORT、粘粒、噬菌粒、YAC’s(酵母人工染色体)、BAC’s(细菌人工染色体)、P1(大肠埃希杆菌(Escherichiacoli)噬菌体)、pQE70、pQE60、pQE9(quagan)、pBS载体、PhageScript载体、BlueScript载体、pNH8A、pNH16A、pNH18A、pNH46A(Stratagene)、pcDNA3(Invitrogen)、pGEX、pTrsfus、pTrc99A、pET-5、pET-9、pKK223-3、pKK233-3、pDR540、pRIT5(Pharmacia)、pSPORT1、pSPORT2、pCMVSPORT2.0和pSY-SPORT1(Invitrogen),及其变体或衍生物。还可以使用病毒载体,例如慢病毒载体(参见例如,WO03/059923;Tiscornia等人PNAS100:1844-1848(2003))。另外的有利载体包括来自Invitrogen的pTrxFus、pThioHis、pLEX、pTrcHis、pTrcHis2、pRSET、pBlueBacHis2、pcDNA3.1/His、pcDNA3.1(-)/Myc-His、pSecTag、pEBVHis、pPIC9K、pPIC3.5K、pAO8lS、pPICZ、pPICZA、pPICZB、pPICZC、pGAPZA、pGAPZB、pGAPZC、pBlueBac4.5、pBlueBacHis2、pMelBac、pSinRep5、pSinHis、pIND、pIND(SP1)、pVgRXR、pcDNA2.l、pYES2、pZErOl.l、pZErO-2.l、pCR-Blunt、pSE280、pSE380、pSE420、pVL1392、pVL1393、pCDM8、pcDNA1.1、pcDNA1.1/Amp、pcDNA3.1、pcDNA3.1/Zeo、pSe、SV2、pRc/CMV2、pRc/RSV、pREP4、pREP7、pREP8、pREP9、pREP10、pCEP4、pEBVHis、pCR3.1、pCR2.1、pCR3.1-Uni和pCRBac;来自Pharmacia的λExCell、λgt11、pTrc99A、pKK223-3、pGEX-1λT、pGEX-2T、pGEX-2TK、pGEX-4T-1、pGEX-4T-2、pGEX-4T-3、pGEX-3X、pGEX-5X-1、pGEX-5X-2、pGEX-5X-3、pEZZ18、pRIT2T、pMC1871、pSVK3、pSVL、pMSG、pCH110、pKK232-8、pSL1180、pNEO和pUC4K;来自Novagen的pSCREEN-1b(+)、pT7Blue(R)、pT7Blue-2、pCITE-4abc(+)、pOCUS-2、pTAg、pET-32L1C、pET-30LIC、pBAC-2cpLIC、pBACgus-2cpLIC、pT7Blue-2LIC、pT7Blue-2、λSCREEN-1、λBlueSTAR、pET-3abcd、pET-7abc、pET9abcd、pET11abcd、pETl2abc、pET-14b、pET-15b、pET-16b、pET-17b-pET-l7xb、pET-19b、pET-20b(+)、pET-21abcd(+)、pET-22b(+)、pET-23abcd(+)、pET-24abcd(+)、pET-25b(+)、pET-26b(+)、pET-27b(+)、pET-28abc(+)、pET-29abc(+)、pET-30abc(+)、pET-31b(+)、pET-32abc(+)、pET-33b(+)、pBAC-1、pBACgus-1、pBAC4x-1、pBACgus4x-1、pBAC-3cp、pBACgus-2cp、pBACsurf-1、plg、Signalplg、pYX、SelectaVecta-Neo、SelectaVecta-Hyg和SelectaVecta-Gpt;来自Clontech的pLexA、pB42AD、pGBT9、pAS2-1、pGAD424、pACT2、pGADGL、pGADGH、pGAD10、pGilda、pEZM3、pEGFP、pEGFP-1、pEGFP-N、pEGFP-C、pEBFP、pGFPuv、pGFP、p6xHis-GFP、pSEAP2-Basic、pSEAP2-Contral、pSEAP2-Promoter、pSEAP2-Enhancer、pβgal-Basic、pβgal-Control、pβgal-Promoter、pβgal-Enhancer、pCMV、pTet-Off、pTet-On、pTK-Hyg、pRetro-Off、pRetro-On、pIRES1neo、pIRES1hyg、pLXSN、pLNCX、pLAPSN、pMAMneo、pMAMneo-CAT、pMAMneo-LUC、pPUR、pSV2neo、pYEX4T-1/2/3、pYEX-S1、pBacPAK-His、pBacPAK8/9、pAcUW31、BacPAK6、pTriplEx、λgt10、λgt11、pWE15和λTriplEx;来自Stratagene的LambdaZAPII、pBK-CMV、pBK-RSV、pBluescriptIIKS+/-、pBluescriptIISK+/-、pAD-GAL4、pBD-GAL4Cam、pSurfscript、LambdaFIXII、LambdaDASH、LambdaEMBL3、LambdaEMBL4、SuperCos、pCR-ScrigtAmp、pCR-ScriptCam、pCR-ScriptDirect、pBS+/-、pBCKS+/-、pBCSK+/-、Phagescript、pCAL-n-EK、pCAL-n、pCAL-c、pCAL-kc、pET-3abcd、pET-11abcd、pSPUTK、pESP-l、pCMVLacI、pOPRSVI/MCS、pOPI3CAT,pXT1、pSG5、pPbac、pMbac、pMC1neo、pMC1neoPolyA、pOG44、pOG45、pFRTβGAL、pNEOβGAL、pRS403、pRS404、pRS405、pRS406、pRS413、pRS414、pRS4l5和pRS4l6。另外的载体包括例如pPC86、pDBLeu、pDBTrp、pPC97、p2.5、pGAD1-3、pGAD10、pACt、pACT2、pGADGL、pGADGH、pAS2-1、pGAD424、pGBT8、pGBT9、pGAD-GAL4、pLexA、pBD-GAL4、pHISi、pHISi-1、placZi、pB42AD、pDG202、pJK202、pJG4-5、pNLexA、pYESTrp,及其变体或衍生物。启动子用于产生本发明的动物的载体构建体可以包括与序列可操作地连接的调节序列,包括例如启动子。大量合适载体和启动子是本领域技术人员已知的,并且是商购可得的。在具体实施方案中,本发明提供了在胰腺组织中表达转基因且特别是免疫调节剂或抗凝血剂转基因的动物、组织和细胞。为了将表达靶向特定组织,使用包括对于胰腺基因表达特异性的启动子的载体开发动物。在一个实施方案中,核酸构建体含有与待表达的转基因序列可操作地连接的调节序列。在一个实施方案中,调节序列可以是启动子序列。在一个实施方案中,启动子可以是可调节启动子。在此类系统中,药物例如可以用于调节肽是否在动物、组织或器官中表达。例如,当器官或组织是猪的部分时,表达可以被阻止,但一旦猪已移植至人一段时间,表达就被诱导,以克服细胞免疫应答。此外,表达水平可以通过可调节启动子系统控制,以确保受体的免疫系统的免疫抑制不出现。可调节启动子序列可以选自但不限于下述基因系统:可通过金属例如铜诱导的金属硫蛋白启动子(参见Lichtlen和Schaffner,SwissMedWkly.,2001,131(45-46):647-52);四环素调节的系统(参见Imhof等人,JGeneMed.,2000,2(2):107-16);蜕皮激素调节的系统(参见Saez等人,ProcNatlAcadSciUSA.,2000,97(26):14512-7);细胞色素P450诱导型启动子,例如CYP1A1启动子(参见Fujii-Kuriyama等人,FASEBJ.,1992,6(2):706-10);米非司酮可诱导的系统(参见Sirin和Park,Gene.,2003,323:67-77);香豆素激活的系统(参见Zhao等人,HumGeneTher.,2003,14(17):1619-29);大环内酯可诱导的系统(响应大环内酯抗生素例如雷帕霉素、红霉素、克林霉素和罗红霉素)(参见Weber等人,NatBiotechnol.,2002,20(9):901-7;Wang等人,MolTher.,2003,7(6):790-800);和乙醇诱导的系统(参见Garoosi等人,JExpBot.,2005,56(416):163542;Roberts等人,PlantPhysiol.,2005,138(3):1259-67);链阳性菌素可诱导的系统(参见Fussenegger等人,NatBiotechnol.,200018(11):1203-8);亲电体可诱导的系统(参见Zhu和Fahl,BiochemBiophysResCommun.,2001,289(1):212-9);和尼古丁可诱导的系统(参见Malphettes等人,NucleicAcidsRes.,2005,33(12):e107)。在特定实施方案中,启动子是组织特异性启动子,特别是在抗凝血剂或免疫抑制剂的表达中。组织特异性启动子最优选是胰腺特异性启动子(Edlund等人,Science,1985,230:912-916)。在一个实施方案中,组织特异性启动子是ins2(LomedicoP等人,Cell,1979,18:545;GenBankJ00747和J00748。在其他实施方案中,在核酸构建体中使用增强子元件,以促进转基因以组织特异性方式增加的表达。增强子是彻底改变基因转录的效率的外部元件(MolecularBiologyoftheGene,第4版,第708-710页,BenjaminCummingsPublishingCompany,MenloPark,CA1987)。在一个特定实施方案中,pdx-1增强子(也称为IPF-1、STF-1和IDX1(GerrishK等人,Mol.Endocrinol.,2004,18(3):533;Ohlsson等人,EMBOJ.1993Nov,12(11):4251-9;Leonard等人,Mol.Endocrinol.,1993,7(10):1275-83;Miller等人,EMBOJ.,1994,13(5):1145-56;Serup等人,ProcNatlAcadSciUSA.,1996,93(17):9015-20;Melloul等人,Diabetes.,2002,51Suppl3:S320-5;Glick等人,JBiolChem.,2000,275(3):2199-204;GenBankAF334615.))与ins2启动子组合使用,用于一种或多种转基因的胰腺特异性表达。在特定实施方案中,动物在与增强子元件组合的启动子的控制下表达转基因。在特定实施方案中,动物包括胰腺特异性启动子元件,例如胰岛素启动子,且进一步包括增强子元件。在某些实施方案中,增强子元件是PDX1。在具体实施方案中,动物、组织或细胞包括与PDX1增强子组合的RIP启动子。在其他实施方案中,启动子可以是遍在启动子。遍在启动子包括但不限于下述:病毒启动子如CMV、SV40。合适启动子还包括β-肌动蛋白启动子、γ-肌动蛋白启动子、GAPDH启动子、H2K、遍在蛋白和rosa启动子。转基因细胞的选择在某些情况下,转基因细胞具有其为靶向转基因插入或整合(即经由同源重组)到细胞基因组内的结果的遗传修饰。在某些情况下,转基因细胞具有其为非靶向(随机)整合到细胞基因组内的结果的遗传修饰。细胞可以在适当选择的培养基中生长,以鉴定提供合适整合的细胞。显示所需表型的那些细胞随后可以通过限制性分析、电泳、DNA分析、聚合酶链反应或本领域已知的另一种技术进一步分析。通过鉴定显示在靶基因位点的合适插入(或在非靶向应用中,其中随机整合技术已产生所需结果)的片段,可以鉴定其中已出现同源重组(或所需非靶向整合事件)以灭活或以其他方式修饰靶基因的细胞。选择标记基因的存在确定靶构建体整合到宿主基因组内。显示所需表型的那些细胞随后可以通过限制性分析、电泳、DNA分析、聚合酶链反应等进一步分析,以分析DNA,以便确定同源或非同源重组是否出现。这可以通过下述进行测定:采用关于插入片段的探针,并且随后当此类缺失引入时,就延伸超过构建体的侧翼区的基因的存在测序侧接插入片段的5’和3’区域或鉴定缺失的存在。还可以使用与在构建体内的序列互补且与在构建体外和在靶基因座上的序列互补的引物。如果同源重组已出现,那么以这种方式,可以仅获得具有在互补链中存在的2种引物的DNA双链体。例如,通过证实引物序列或预期大小序列的存在,支持同源重组的出现。用于筛选同源重组事件的聚合酶链反应在Kim和Smithies,(1988)NucleicAcidsRes.16:8887-8903;和Joyner等人(1989)Nature338:153-156中描述。得自第一轮靶向(或来自非靶向(随机)整合到所需位置内)的细胞系可能对于整合的等位基因是杂合的。其中2个等位基因都被修饰的纯合性可以以许多方式达到。一种方法是生长其中一个拷贝已被修饰的大量细胞,且随后使用不同选择标记对这些细胞实施另一轮靶向(或来自非靶向(随机)整合)。可替代地,纯合子可以通过育种对于经修饰的等位基因杂合的动物获得。在某些情况下,可以希望具有2个不同修饰的等位基因。这可以通过基因靶向(或随机整合)的序贯循环或通过育种杂合子来达到,所述杂合子各自携带所需经修饰的等位基因之一。在特定实施方案中,动物的至少一个元件通过选择突变等位基因中自发出现的突变驱动,特别是为了开发纯合动物。在特定实施方案中,通过暴露于极高水平的选择试剂,选择技术用于获得来自杂合细胞的同源敲除细胞。此类选择可以例如通过使用抗生素例如遗传霉素(G418)。已转染或以其他方式接受合适载体的细胞随后可以经由遗传型或表型分析进行选择或鉴定。在一个实施方案中,细胞进行转染,在适当选择的培养基中生长,以鉴定含有整合的载体的细胞。选择标记基因的存在指出在经转染的细胞中转基因构建体的存在。显示所需表型的那些细胞随后可以通过限制性分析、电泳、DNA分析、聚合酶链反应等进一步分析,以分析DNA,以便证实一种或多种转基因整合到宿主细胞的基因组内。还可以使用与一种或多种转基因序列互补的引物。用于筛选同源重组和随机整合事件的聚合酶链反应是本领域已知的,参见例如,Kim和Smithies,NucleicAcidsRes.16:8887-8903,1988;和Joyner等人,Nature338:153-156,1989。通过Thomas和Capecchi,同上,1987;Nicholas和Berg(1983),TeratocarcinomaStemCell,编辑Siver,Martin和Strikland(ColdSpringHarborLab.,ColdSpringHarbor,N.Y.(第469-497页);和Linney和Donerly,Cell35:693-699,1983,突变型多瘤增强子和胸苷激酶启动子以驱动新霉素基因的特异性组合已显示在胚胎干细胞和EC细胞中是活跃的。已经历同源重组的细胞可以通过许多方法进行鉴定。在一个实施方案中,选择方法可以检测针对细胞的免疫应答的不存在,例如通过人抗gal抗体。在其他实施方案中,选择方法可以包括评估当暴露于细胞或组织时,人血液中的凝血水平。经由抗生素抗性的选择已最通常地用于筛选。这种方法可以检测到在靶向载体上抗性基因的存在,但不直接指出整合是靶向重组事件还是随机整合。可替代地,标记可以是荧光标记基因例如GFP或RFP,或经由细胞分选或FACs分析在细胞表面上可检测的基因。特定技术例如多聚腺苷酸和启动子陷阱技术增加靶向事件的概率,但再次不给出已达到所需表型的直接证据。此外,阴性形式的选择可以用于选择靶向整合;在这些情况下,关于对于细胞致命的因子(例如Tk或白喉A毒素)的基因以这样的方式插入,使得仅靶向事件允许细胞避免死亡。通过这些方法选择的细胞随后可以就基因破坏、载体整合和最后基因耗尽进行测定。在这些情况下,因为选择基于靶向载体整合而不是在改变的表型上的检测,所以可以检测到仅靶向敲除,而不是点突变、基因重排或平截或其他此类修饰。表征可以进一步通过下述技术完成,包括但不限于:PCR分析、DNA印迹分析、RNA印迹分析、特异性凝集素结合测定和/或测序分析。还可以完成表型表征,包括通过在多种测定中抗小鼠抗体的结合,所述测定包括免疫荧光、免疫细胞化学、ELISA测定、流式细胞术、蛋白质印迹、通过RT-PCR就细胞中的RNA转录的测试。在其他实施方案中,GTKO动物或细胞含有另外的遗传修饰。遗传修饰可以包括超过仅同源靶向,但还可以包括外源基因的随机整合,任何种类的基因的突变、缺失和插入。通过进一步遗传修饰得自本文描述的转基因细胞和动物的细胞,或通过使本文描述的动物与已进一步遗传修饰的动物育种,可以做出另外的遗传修饰。此类动物可以进行修饰,以消除αGT基因、CMP-Neu5Ac羟化酶基因(参见例如,美国专利号7,368,284)、iGb3合酶基因(参见例如,美国专利公开号2005/0155095)、和/或Forssman合酶基因(参见例如,美国专利公开号2006/0068479)的至少一个等位基因的表达。在另外的实施方案中,本文描述的动物还可以含有遗传修饰,以表达岩藻糖基转移酶、唾液酸转移酶和/或葡萄糖转移酶家族的任何成员。为了达到这些另外的遗传修饰,在一个实施方案中,细胞可以进行修饰,以含有多重遗传修饰。在其他实施方案中,动物可以一起育种,以达到多重遗传修饰。在一个具体实施方案中,根据本文描述的过程、序列和/或构建体产生的,缺乏功能免疫球蛋白表达的动物例如猪可以与缺乏αGT的表达的动物例如猪育种(例如,如WO04/028243中所述)。在另一个实施方案中,负责异种移植物排斥的另外基因的表达可以被消除或减少。此类基因包括但不限于CMP-NEUAc羟化酶基因、isoGloboside3合酶基因和Forssman合酶基因。此外,还可以在本发明的动物和组织中表达负责补体介导的裂解的抑制,编码补体相关蛋白质的基因或cDNA。此类基因包括但不限于CD59、DAF(CD55)和CD46(参见例如,WO99/53042;Chen等人Xenotransplantation,第6卷Issue3第194页-1999年8月,其描述了表达CD59/DAF转基因的猪;CostaC等人,Xenotransplantation.2002January;9(1):45-57,其描述了表达人CD59和H-转移酶的转基因猪;ZhaoL等人;DiamondLE等人Transplantation.2001Jan.15;71(1):132-42,其描述了人CD46转基因猪)。另外的修饰可以包括化合物的表达,例如下调通过细胞的细胞粘附分子表达的抗体,例如名称为“Suppressionofxenograftrejectionbydownregulationofacelladhesionmolecules”的WO00/31126中所述,和其中例如通过给器官受体施用来自异基因供体生物的可溶形式的CTLA-4阻止通过信号2的共刺激的化合物,例如如名称为“ImmunosuppressionbyblockingTcellco-stimulationsignal2(B7/CD28interaction)”的WO99/57266中所述。核转移本文描述的改造的转基因动物例如有蹄动物或猪可以使用本领域已知的任何合适技术产生。这些技术包括但不限于显微注射(例如原核的)、精子介导的基因转移、卵子或受精卵的电穿孔、和/或核移植。在特定实施方案中,精子介导的基因转移可以用于产生本文描述的遗传修饰的有蹄动物。本文描述为插入转基因的方法和组合物可以用于经由本文描述或本领域已知的任何技术遗传修饰精细胞。经由人工受精、卵胞浆内精子注射或任何其他已知技术,遗传修饰的精子随后可以用于使雌性受体受孕。在一个实施方案中,精子和/或精子头可以与外源核酸一起温育足够的时间段。足够的时间段包括例如约30秒-约5分钟、一般约45秒-约3分钟、更一般约1分钟-约2分钟。精细胞作为用于基因转移的载体的潜在用途首先由Brackeff等人,Proc.,Natl.Acad.Sci.USA68:353-357(1971)建议。这随后为在卵母细胞由精子体外受精后产生转基因小鼠和猪的报道,所述精子已通过裸露DNA温育(参见例如,Lavitrano等人,Cell57:717-723(1989)和Gandolfi等人JournalofReproductionandFertilityAbstractSeries4,10(1989)),尽管其他实验室不能重复这些实验(参见例如,Brinster等人Cell59:239-241(1989)和Gavora等人,CanadianJournalofAnimalScience71:287-291(1991))。从那以后,成功的精子介导的基因转移已在鸡(参见例如,Nakanishi和Iritani,Mol.Reprod.Dev.36:258-261(1993));小鼠(参见例如,Maione,Mol.Reprod.Dev.59:406(1998));和猪(参见例如,Lavitrano等人Transplant.Proc.29:3508-3509(1997);Lavitrano等人,Proc.Natl.Acad.Sci.USA99:14230-5(2002);Lavitrano等人,Mol.Reprod.Dev.64-284-91(2003))中达到。类似技术也在2002年4月23日授权的美国专利号6,376,743;2001年11月22日公开的美国专利公开号20010044937和2002年8月8日公开的20020108132中描述。在某些实施方案中,卵胞浆内精子注射可以用于产生本文描述的遗传修饰的有蹄动物。这可以通过下述完成:将外源核酸和精子共插入未受精卵母细胞的细胞质内,以形成转基因受精的卵母细胞,且允许转基因受精的卵母细胞发育成转基因胚胎,并且需要时发育成活后代。精子可以是膜破坏的精子头或去膜精子头。共插入步骤可以包括使精子与外源核酸预温育足够时间段的子步骤,例如约30秒-约5分钟、一般约45秒-约3分钟、更一般约1分钟-约2分钟。精子和外源核酸共插入卵母细胞内可以经由显微注射。与精子混合的外源核酸可以含有超过一种转基因,以产生如本文描述的对于超过一种转基因是转基因的胚胎。卵胞浆内精子注射可以通过本领域已知的任何技术完成,参见例如,美国专利号6,376,743。本领域已知的任何另外技术可以用于将转基因引入动物内。此类技术包括但不限于原核显微注射(参见例如,Hoppe,P.C.和Wagner,T.E.,1989,美国专利号4,873,191);逆转录病毒介导的基因转移到种系内(参见例如,VanderPutten等人,1985,Proc.Natl.Acad.Sci.,USA82:6148-6152);在胚胎干细胞中的基因靶向(参见例如,Thompson等人,1989,Cell56:313-321;Wheeler,M.B.,1994,WO94/26884);胚胎的电穿孔(参见例如,Lo,1983,MolCell.Biol.3:1803-1814);细胞枪;转染;转导;逆转录病毒感染;腺病毒感染;腺伴随病毒感染;脂质体介导的基因转移;裸露DNA转移;和精子介导的基因转移(参见例如,Lavitrano等人,1989,Cell57:717-723);等。关于此类技术的综述,参见例如,Gordon,1989,TransgenicAnithals,Intl.Rev.Cytol.115:171-229。在特定实施方案中,CTLA4和/或CTLA4-Ig融合基因在有蹄动物中的表达可以经由这些技术完成。在一个实施方案中,编码转基因的构建体的显微注射可以用于产生转基因动物。在一个实施方案中,核酸构建体或载体可以显微注射到受精卵的原核内。在一个实施方案中,构建体或载体可以注射到受精卵的雄性原核内。在另一个实施方案中,载体或构建体可以注射到受精卵的雌性原核内。在一个进一步的实施方案中,构建体或载体可以经由精子介导的基因转移进行注射。转基因构建体或载体的显微注射可以包括下述步骤:供体雌性的超排卵;卵的手术取出,卵的受精;转基因转录单位注射到胚胎的原核内;和转基因胚胎引入假孕宿主母亲的生殖道内,其通常具有相同物种。参见例如,美国专利号4,873,191,Brinster等人1985.PNAS82:4438;Hogan等人,in“ManipulatingtheMouseEmbryo:ALaboratoryManual”.ColdSpringHarborLaboratory,ColdSpringHarbor,N.Y.,1986.Robertson,1987,inRobertson,编辑“TeratocarcinomasandEmbryonicStemCellsaPracticalApproach”IRLPress,Evnsham.Oxford,England.Pedersen等人,1990.“TransgenicTechniquesinMice--AVideoGuide”,ColdSpringHarborLaboratory,ColdSpringHarbor,N.Y。转基因猪照常规通过转基因构建体或载体显微注射到猪胚胎内产生。在一个实施方案中,转基因的存在可以通过下述进行检测:从来自每个小猪的尾部的组织中分离基因组DNA,且用转基因特异性探针对约5微克这种基因组DNA实施核酸杂交分析。在一个特定实施方案中,转基因动物可以根据本领域技术人员已知的任何方法产生,例如如Bleck等人,J.Anim.Sci.,76:3072[1998]中公开的;以及美国专利号6,872,868;6,066,725;5,523,226;5,453,457;4,873,191;4,736,866;和/或PCT公开号WO/9907829中描述的。在一个实施方案中,原核显微注射方法可以包括例如如本文公开的,将本发明的含至少约50、100、200、300、400或500个拷贝的转基因构建体或载体与选择的启动子连接,并且随后外源DNA可以通过精制玻璃针注射到受精卵内。在一个实施方案中,DNA可以注射到受精卵的雄性原核内。猪受精卵是不透明的并且核结构的显现可以是困难的。在一个实施方案中,猪受精卵的原核或核可以在离心例如以15000g共3mm后显现。原核的注射可以在放大下和使用显微注射仪器执行。受精卵可以通过钝圆容纳吸管保持,并且透明带、质膜和原核包膜可以通过注射吸管穿透。钝圆容纳吸管可以具有小直径,例如约50um。注射吸管可以具有比容纳吸管更小的直径,例如约15um。DNA整合在复制过程中因为宿主DNA的修复功能出现。根据本领域技术人员已知的任何技术,含有外源DNA的这些卵随后可以植入替身母亲内用于胚胎的孕育。在某些实施方案中,原核显微注射可以对受精后12小时的受精卵执行。此类基因的摄取可以延迟数个细胞周期。这个的后果是取决于摄取的细胞周期,仅某些细胞谱系可以携带转基因,导致镶嵌后代。需要时,镶嵌动物可以进行育种,以形成真正的种系转基因动物。在其他实施方案中,含有转基因的有蹄动物细胞例如猪科细胞可以用作供体细胞,以提供核用于核转移到去核卵母细胞内,以产生克隆的转基因动物。在一个实施方案中,有蹄动物细胞无需表达转基因蛋白质,以便用作供体细胞用于核转移。在一个实施方案中,猪科细胞可以进行改造,以表达来自含有启动子的核酸构建体或载体的转基因。可替代地,猪科细胞可以进行改造,以通过同源重组在内源启动子的控制下表达转基因。在一个实施方案中,转基因核酸序列可以在组织特异性启动子、组织特异性增强子或两者的控制下插入基因组内。在另一个实施方案中,转基因核酸序列可以在遍在启动子的控制下插入基因组内。在特定实施方案中,提供了靶向载体,其设计为允许在体细胞中的靶向同源重组。这些靶向载体可以转化到哺乳动物细胞内,以经由同源重组靶向目的内源基因。在一个实施方案中,靶向构建体将转基因核苷酸序列和选择标记基因插入内源基因内,以便与上游序列一起在读码框中且产生活性融合蛋白。使用本发明的方法,细胞可以用构建体进行转化,并且借助于选择标记进行选择,且随后筛选重组体的存在。本发明提供了经由体细胞核转移用于克隆含有特定转基因的有蹄动物例如猪的方法。一般而言,猪可以通过包含下述步骤的核转移过程产生:获得所需分化的猪细胞以用作供体核的来源;从猪中获得卵母细胞;去核所述卵母细胞;例如通过输注或注射,将所需分化的细胞或细胞核转移到去核卵母细胞内,以形成核转移(NT)单位;激活所得到的NT单位;且将所述培养的NT单位转移至宿主猪,从而使得NT单位发育成胎儿。核转移技术或核移植技术是本领域已知的(参见例如,Dai等人NatureBiotechnology20:251-255;Polejaeva等人Nature407:86-90(2000);Campbell等人,Theriogenology68Suppl1:S214-31(2007);Vajta等人,ReprodFertilDev19(2):403-23(2007);Campbell等人(1995)Theriogenology,43:181;Collas等人(1994)Mol.ReportDev.,38:264-267;Keefer等人(1994)Biol.Reprod.,50:935-939;Sims等人(1993)Proc.Natl.Acad.Sci.,USA,90:6143-6147;WO94/26884;WO94/24274和WO90/03432,美国专利号4,944,384、5,057,420、WO97/07669、WO97/07668、WO98/30683、WO00/22098、WO004217、WO00/51424、WO03/055302、WO03/005810、美国专利号6,147,276、6,215,041、6,235,969、6,252,133、6,258,998、5,945,577、6,525,243、6,548,741和Phelps等人(Science299:411-414(2003))。已修饰为含有本发明的转基因的供体细胞核转移至受体猪科卵母细胞。这种方法的使用不限于特定供体细胞类型。供体细胞可以如Wilmut等人(1997)Nature385:810;Campbell等人(1996)Nature380:64-66;或Cibelli等人(1998)Science280:1256-1258中所述。原则上可以采用可以成功地用于核转移中具有正常核型的所有细胞,包括胚胎、胎儿和成体体细胞。胎儿成纤维细胞是特别有用类别的供体细胞。核转移的一般合适方法在下述中描述:Campbell等人(1995)Theriogenology43:181,Collas等人(1994)Mol.Reprod.Dev.38:264-267,Keefer等人(1994)Biol.Reprod.50:935-939,Sims等人(1993)Proc.Nat’l.Acad.Sci.USA90:6143-6147,WO-A-9426884,WO-A-9424274,WO-A-9807841,WO-A-9003432,美国专利号4,994,384和美国专利号5,057,420,Campbell等人,(2007)Theriogenology68Suppl1,S214-231,Vatja等人,(2007)ReprodFertilDev19,403-423)。还可以使用分化或至少部分分化的供体细胞。供体细胞还可以但无需在培养中且可以是静止的。静止的核供体细胞是可以诱导为进入静止或在体内以静止状态存在的细胞。现有技术方法也已在克隆程序中使用胚胎细胞类型(参见例如,Campbell等人(1996)Nature,380:64-68)和Stice等人(1996)Biol.Reprod.,2054:100-110)。在一个特定实施方案中,成纤维细胞例如猪科成纤维细胞可以遗传修饰为含有目的转基因。用于分离卵母细胞的方法是本领域众所周知的。基本上,这可以包含从猪的卵巢或生殖道中分离卵母细胞。猪卵母细胞的可容易获得来源是屠宰场材料。对于技术例如基因工程、核转移和克隆的组合,在这些细胞可以用作受体细胞用于核转移前,并且在它们可以通过精细胞受精以发育成胚胎前,卵母细胞一般必须在体外成熟。这个过程一般需要收集来自哺乳动物卵巢的未成熟(前期I)卵母细胞,例如在屠宰场获得的牛卵巢,且在受精或去核前在成熟培养基中使卵母细胞成熟,直至卵母细胞达到中期II阶段,在牛卵母细胞的情况下,这一般在吸出后约18-24小时出现,并且在猪的情况下,一般在约35-55小时出现。这个时间段称为成熟期”。中期II阶段卵母细胞可以是受体卵母细胞,在这个阶段时,认为卵母细胞可以是或足够“激活”,以处理引入的核,如受精精子一样。已在体内成熟的中期II阶段卵母细胞已成功地用于核转移技术中。基本上,在动情期发作后或在人绒毛膜促性腺激素(hCG)或相似激素注射后35–48或39-41小时,可以从非超排卵或超排卵的猪手术收集成熟的中期II卵母细胞。在固定时间成熟期后,卵母细胞可以是去核的。在去核前,卵母细胞可以被取出,并且在去除卵丘细胞前,置于合适培养基例如含有1毫克/毫升玻璃酸酶的HECM或TCM199中。条带状卵母细胞随后可以就极体进行筛选,并且如通过极体的存在测定的,所选中期II卵母细胞随后用于核转移。随后去核。去核可以通过例如美国专利号4,994,384中所述的已知方法执行。例如,中期II卵母细胞可以置于含有7-10微克/毫升细胞松弛素B的HECM中,用于立即去核,或可以置于合适培养基中,例如胚胎培养基例如CR1aa加上10%动情期牛血清,且随后去核例如不超过24小时后或16-18小时后。去核可以使用微量吸管显微手术完成,以去除极体和邻近细胞质。随后可以筛选卵母细胞,以鉴定已成功去核的那些。筛选卵母细胞的一种方法是在合适保留培养基中用3-10微克/毫升33342Hoechst染料染色卵母细胞,且随后在小于10秒的紫外线照射下显现卵母细胞。已成功去核的卵母细胞随后可以置于合适培养基例如CRlaa加上10%血清中。与去核卵母细胞相同物种的单一哺乳动物细胞随后可以转移到用于产生NT单位的去核卵母细胞的卵周隙内。根据本领域已知的方法,哺乳动物细胞和去核卵母细胞可以用于产生NT单位。例如,细胞可以通过电融合进行融合。电融合通过提供电脉冲完成,所述电脉冲足以引起质膜的瞬时分解。质膜的这种分解是极短的,因为膜快速重新形成。因此,如果2个邻近膜被诱导分解,且在重新形成后,脂质双层掺和,那么小通道可以在2个细胞之间打开。由于此类小开口的热力学不稳定性,它扩大直至2个细胞变成一个。参见例如,通过Prather等人的美国专利号4,997,384。可以使用多种电融合介质,包括例如蔗糖、甘露醇、山梨糖醇和磷酸盐缓冲溶液。例如,融合培养基可以包含甘露醇的280毫摩尔(mM)溶液,含有0.05mMMgCl2和0.001mMCaCl2(Walker等人,CloningandStemCells.2002;4(2):105-12)。融合还可以使用仙台病毒作为融合剂完成(Graham,WisterInot.Symp.Monogr.,9,19,1969)。此外,核可以直接注射到卵母细胞内而不是使用电穿孔融合。参见例如,Collas和Barnes,(1994)Mol.Reprod.Dev.,38:264-267。在融合后,所得到的融合的NT单位随后置于合适培养基例如CRlaa培养基中,直至激活。一般地,激活可以在其后不久实现,例如对于牛NT,小于24小时后或约4-9小时后,且对于猪NT,1-4小时后。NT单位可以通过已知方法激活。此类方法包括例如在亚生理学温度培养NT单位,本质上通过对于NT单位应用冷,或实际上冷温度休克。这可以通过在室温培养NT单位最方便地完成,所述室温相对于胚胎通常暴露于其的生理学温度条件是冷的。可替代地,激活可以通过已知激活试剂的应用达到。例如,在受精过程中卵母细胞通过精子的穿透已显示激活开端(prelusion)卵母细胞,以在核转移后获得更大数目的活妊娠和多个遗传等同的小牛。此外,处理例如电和化学休克可以用于在融合后激活NT胚胎。参见例如,给予Susko-Parrish等人的美国专利号5,496,720。另外,通过同时或序贯增加在卵母细胞中的二价阳离子水平,和减少在卵母细胞中的细胞蛋白质磷酸化,可以实现激活。这一般可以通过将二价阳离子引入卵母细胞细胞质内实现,例如镁、锶、钡或钙,例如以离子载体的形式。增加二价阳离子水平的其他方法包括电休克的使用、用乙醇处理和用螯合的(caged)螯合剂处理。磷酸化可以通过已知方法减少,例如通过加入激酶抑制剂,例如丝氨酸-酪氨酸激酶抑制剂,例如6-二甲基-氨基嘌呤、星形孢子素、2-氨基嘌呤和鞘氨醇。可替代地,细胞蛋白质的磷酸化可以通过将磷酸酶例如磷酸酶2A和磷酸酶2B引入卵母细胞内得到抑制。激活的NT单位随后可以进行培养,直至它们达到合适大小用于转移至受体雌性,或可替代地,它们可以立即转移至受体雌性。适合于胚胎培养和成熟的培养基是本领域众所周知的。可以用于胚胎培养和维持的已知培养基的例子包括Ham’sF-10+10%胎牛血清(FCS)、组织培养基-199(TCM-199)+10%胎牛血清、Tyrodes-白蛋白-乳酸盐-丙酮酸盐(TALP)、达尔贝科氏磷酸盐缓冲盐水(PBS)、Eagle’sWhitten’s培养基、PZM、NCSU23和NCSU37。参见YoshiokaK,SuzukiC,TanakaA,AnasIM,IwamuraS.BiolReprod.(2002)January;66(1):112-9和PettersRM,WellsKD.JReprodFertilSuppl.1993;48:61-73。然后,可以将一个或多个培养的NT单位洗涤且随后置于在孔板中含有的合适培养基中,所述孔板可以任选含有合适的汇合滋养层。合适的滋养层包括例如成纤维细胞和上皮细胞。NT单位在滋养层上培养,直至NT单位达到适合于转移至受体雌性的大小,或用于获得可以用于产生细胞集落的细胞。NT单位可以培养直至至少约2–400个细胞、约4–128个细胞、或至少约50个细胞。可替代地,NT单位可以立即转移至受体雌性。在本发明中用于胚胎转移和受体动物管理的方法是在胚胎转移工业中使用的标准程序。同步转移对于本发明的成功是重要的,即NT胚胎的阶段与受体雌性的动情周期同步。参见例如,Siedel,G.E.,Jr.(1981)“CriticalreviewofembryotransferprocedureswithcattleinFertilizationandEmbryonicDevelopmentinVitro,L.Mastroianni,Jr.和J.D.Biggers,编辑,PlenumPress,NewYork,N.Y.,第323页。猪科胚胎转移可以根据本领域已知的方法进行。关于参考文献,参见Youngs等人“FactorsInfluencingtheSuccessofEmbryoTransferinthePig,”Theriogenology(2002)56:1311-1320。岛相关细胞的产生胰腺是脊椎动物的消化和内分泌系统中的腺体器官。它是产生几种重要激素包括胰岛素、胰高血糖素和生长抑制素的内分泌腺,以及分泌含有消化酶的胰液的外分泌腺,其通到小肠。胰腺主体由胰腺外分泌细胞及其结合的管组成。在这种外分泌组织内包埋的是大约一百万个细胞小簇,称为郎格罕氏岛,这是胰腺的内分泌细胞且分泌胰岛素、胰高血糖素和几种其他激素。人胰腺含有约1百万个郎格罕氏岛。存在遍及器官分布的小球形细胞簇。它们在大小中相当大地不同,范围从数十个细胞到数千个细胞。“岛细胞”包括在郎格罕氏岛中发现的细胞类型的集合组。它们包含使用标准染色技术可以相对难以区分的A、B、C、D和PP细胞。α细胞分泌胰高血糖素(增加血液中的葡萄糖),β细胞分泌胰岛素(降低血液中的葡萄糖),δ细胞分泌生长抑制素(调节/停止α和β细胞),并且PP细胞分泌胰腺多肽。在一个实施方案中,遗传改变的猪用作胰腺组织的供体,包括胰岛和/或岛细胞。胰腺组织或衍生自此类组织的细胞可以包含胰岛细胞、或岛或岛-细胞簇。在特定实施方案中,细胞是胰岛。在更特定的实施方案中,细胞是胰腺β细胞。在特定实施方案中,细胞是产生胰岛素的。在再进一步的实施方案中,细胞是岛样细胞。岛细胞簇可以包括α、β、δ、PP或ε细胞中的任何一种或多种。一般地,产生胰高血糖素的α细胞构成天然胰腺中约15-20%的总岛细胞,产生胰岛素和糊精的β细胞构成天然胰腺中约65-80%的岛细胞,产生生长抑制素的δ细胞构成天然胰腺中约3-10%的总岛细胞,产生胰腺多肽的PP细胞构成天然胰腺中约3-5%的总岛细胞,并且产生饥饿素的ε细胞构成天然胰腺中<1%的总岛细胞(参见Elayat等人(1995).J.Anat.186:629-37)。http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1167020/。供体猪可以在任何发育阶段,包括但不限于胎儿、新生儿、幼体和成体。在某些实施方案中,岛细胞从成体猪科转基因动物中分离。在可替代实施方案中,岛细胞从胎儿或新生儿猪科转基因动物中分离(参见例如Mandel(1999)J.Mol.Med.77:155-60;Cardona等人(2006)Nat.Med.12:304-6)。供体猪可以处于10、9、8、7、6、5、4、3、2或1岁年龄。在一个实施方案中,岛细胞从处于6岁年龄的转基因猪中分离。在另一个实施方案中,岛细胞从处于3岁年龄的转基因猪中分离。供体猪可以是0-2岁、2-4岁、4-6岁、6-8岁或8-10岁之间的任何年龄。在某些情况下,供体猪大于10岁。在另一个实施方案中,岛细胞从新生儿到2岁大的转基因猪中分离。在一个实施方案中,岛细胞从胎儿到2岁大的转基因猪中分离。在一个特定实施方案中,岛细胞从6月龄到2岁大的转基因猪中分离,并且在一个更特定的实施方案中,从7月龄到1岁大的转基因猪。在一个实施方案中,岛细胞从2-3岁大的转基因猪中分离。在某些情况下,供体猪小于0岁(即胎儿或胚胎)。新生儿岛比成体岛在分离后更强壮和一致,并且对氧化性应激更有抗性,具有显著的生长潜力(可能来自初生岛干细胞亚群),从而使得它们具有在移植和移入后在移植位点繁殖的能力。它们具有这样的缺点,它们可以花费4-6周足够成熟,从而使得它们产生显著水平的胰岛素,但这通过用外源胰岛素处理对于新生儿岛成熟足够的时期克服。新生儿岛的存活和功能移入可以通过测量胰腺特异性c肽水平进行测定,这容易与任何潜在内源c肽区分。成体猪科岛可以根据对于人岛描述且对于猪进一步最佳化的方法的修饰进行分离(Toso,2000;Yonekawa,2005),如先前描述的(Bottino,2002,2004;Balamurugan,2003,2005)。纯度可以在岛样品的双硫腙染色后进行评估,并且表示为岛/整个组织的百分比(Balamurugan,2005)。在移植前,岛可以培养1-3天,以便耗尽污染性外分泌组织的制剂。在Tx前,可以计数胰岛,并且通过双重荧光钙黄绿素-AM和碘化丙啶染色评价活力(Lorenzo,1994)。推荐岛细胞活力在所有制剂中是>75%,并且纯度是>80%岛/整个组织。岛的功能性质包括动态灌注和活力可以在Tx前在体外进行测定(Balamurugan,2006)。在某些实施方案中,转基因猪科岛细胞在体外培养,以扩增、成熟和/或纯化它们,从而使得它们适合于移植。在特定实施方案中,供体转基因胰腺组织是手术取出的。在手术取出后,将供体胰腺转移至洁净室用于在冷塑料容器中在50ml管中进一步加工,所述管含有冷Hanks’平衡盐溶液(HBSS),伴随0.2%人血清白蛋白(HSA)的添加。来自每个供体的血样送往病毒学测试和弓形体属血清学。需要时,来自每个器官的样品保持在-80℃冰箱中用于未来测试。经由由Ricordi等人(1990)证明的程序,尽管伴随某些修饰,岛细胞可以通过切碎的胰腺的标准胶原酶消化进行分离。使用无菌技术,用LiberaseTM(配制用于啮齿类动物胰腺的快速解离和健康、完整和功能郎格罕氏岛的最大限度回收的纯化酶混合物,其中关于这些酶的靶底物并未完全鉴定,但假定是胶原和非胶原蛋白质,其包含胰腺腺泡组织的细胞间基质)(1.5mg/ml)扩张腺,修剪过量脂肪、血管和结缔组织,切碎且在37摄氏度在振荡水浴中在120rpm消化15分钟。使用与LiberaseTM溶液混合的利多卡因达到消化,以避免在消化过程中的细胞损害。在消化过程后,使细胞经过无菌400mm网目进入无菌烧杯内。第二个消化过程用于任何未消化的组织。可替代地,可以使用Vitacyte胶原酶MA(7.5Wunsch单位/克胰腺组织)和VitacyteBP蛋白酶(0.13mg/克胰腺组织)。在特定实施方案中,使用LiberaseTM(例如;来自Roche在新西兰中起源的)而不是胶原酶(参见“ImprovedPigIsletYieldandPost-CultureRecoveryUsingLiberaseP1PurifiedEnzymeBlend”,TJCavanagh等人TransplantationProceedings30,367(1998)和“SignificantProgressInPorcineIsletsMassIsolationUtilizingLiberaseTMHIForEnzymaticLow-TemperaturePancreasDigestion”,H.Brandhorst等人Transplantation第68卷,355-361No.3,1999年8月15日)。将消化的组织洗涤3次,并且种植到细胞培养基RPMI1640内,向所述细胞培养基中加入2%人血清白蛋白(HSA)、10mmol/L烟酰胺和抗生素(Ciproxin)。为了排除组织的任何污染,对分离后和装入胶囊前的细胞培养样品采取质量控制程序。分离后3天,细胞培养通过认可实验室就微生物污染进行测试。关于猪内源逆转录病毒(PERV)的测试可以例如在VirologyLaboratory,AucklandHospital进行。岛得率经由细胞的双硫腙(DTZ)染色进行测定。双硫腙是选择性染色在郎格罕氏岛中的锌的锌螯合剂和活体外染剂,产生独特的红色外观。岛细胞的活力可以使用吖啶橙和碘化丙啶进行测定。吖啶橙是容易通过所有细胞膜以染色细胞质和核的荧光染剂。在暴露于紫外(UV)光后在核和细胞质中的亮绿荧光指示完整活细胞。相反,碘化丙啶是不能通过完整膜的荧光染剂。当暴露于LIV光时,它发出亮红荧光,并且碘化丙啶在细胞核中的存在指出严重损害或死细胞。通过使其暴露于低和高浓度的葡萄糖和茶碱,固定葡萄糖刺激(SGS)用于评价胰岛的体外功能。体外胰岛素分泌能力的测定对游离岛(在培养中3天后)和在其后续装入胶囊后进行。当使用未成熟的猪科岛时,可以使用IgF-1(人胰岛素样生长因子I),以便诱导未成熟细胞成熟至其胰岛素产生形式。IgF-1是介导生长的有力促有丝分裂生长因子,促进出生后的生长激素活性。IgF-1和IgF-2在许多细胞类型中表达,且可以具有内分泌、自分泌和旁分泌功能。优选形式的IgF-1是IgF-1的氨基末端三肽甘氨酸-脯氨酸-谷氨酸(GPE)。在移植前,通过其纯化岛的过程对于这些高度专门化组织是创伤性的。此类创伤可以诱导坏死或凋亡。在本发明中可以使用现有技术中已知的制备且将岛装入胶囊的任何方法。这些技术包括个别岛的装入微胶囊,或多个岛/胰腺组织的装入大胶囊。这些的例子包括下述:给予Scharp等人的美国专利7,427,415公开了将生物学材料装入胶囊的方法,其包括步骤:将包括第一种缓冲液的溶液加入生物学材料中;使生物学材料离心,以形成团块化的生物学材料;去除上清液;将包括与细胞吸附材料缀合的光敏引发剂染料的溶液加入团块化的生物学材料中;用包括与细胞吸附材料缀合的光敏引发剂染料的溶液重悬浮且温育团块化的生物学材料有效时间量;离心混合物;去除包括与细胞吸附材料缀合的光敏引发剂染料的溶液;用包括第二种缓冲液的第二种溶液重悬浮团块化的生物学材料;离心且去除第二种缓冲液;用光活性聚合物溶液重悬浮且混合生物学材料;且用能源照射由光活性聚合物溶液重悬浮的生物学材料,以形成装入胶囊的生物学材料。优选地,装入胶囊的生物学材料是PEG共形包被的岛同种异体移植物。其他程序已确保零热缺血(与大多数人岛制剂的数小时比较),已涉及烟酰胺的使用,以确保成功的体外外植体,已涉及与胶原酶或Liberase的最低限度温育时间,已涉及快速非创伤性装入胶囊的技术,已涉及IgF-1(或其GPE三肽)的使用、麻醉剂例如利多卡因的使用、和抗生素例如ciproproxin的使用等。给予Elliott等人的美国专利7,122,177公开了用于将胰岛装入胶囊的方法。用于这种程序的海藻酸钠从原始材料来源(海藻)中提取且以粉末超纯形式制备。无菌海藻酸钠溶液(1.6%)随后在DiatranzIsletTransplantCentre用于制造装入胶囊的岛。一般地,每次装入胶囊涉及将岛和合适的海藻酸盐溶液(通常为海藻酸钠)呈递给相容阳离子来源,从而使岛诱陷到阳离子-海藻酸盐凝胶(通常为钙-海藻酸盐凝胶)中。装入胶囊程序涉及将岛和海藻酸钠溶液(1.6%w/w)的混合物通过小滴生成针挤出到胶凝阳离子(氯化钙)浴内。在钙-海藻酸盐凝胶中诱陷的岛随后由带正电的多聚-L-鸟氨酸,随后为海藻酸盐(0.05%)的外壳包被。海藻酸盐的中心核随后通过加入柠檬酸钠液化。大多数胶囊含有3个岛且具有300-400um的直径。在诱陷岛的海藻酸盐液化后,将“胶囊”洗涤且再次用海藻酸盐包被,所述海藻酸盐中和在多聚-L-鸟氨酸包被上的任何残留变化,并且当整个胶囊移植时,阻止多聚-L-鸟氨酸与组织的直接接触。装入胶囊的岛保持在细胞培养中,且随后在移植前检查污染、胰岛素释放和活力。它们仅在质量控制测试是阴性时准许用于移植。给予Opara的美国专利6,303,355公开了处理分离的活细胞的方法,其通过首先在含有下述至少一种(或其组合)的培养基中培养细胞:抗氧化剂、抗细胞因子、抗内毒素或抗生素。细胞随后在生物相容性微胶囊中装入微胶囊,所述微胶囊含有水凝胶核和半透性外膜,以提供在其中含有活细胞的微胶囊。给予Cochrum等人的美国专利5,578,314公开了用于产生由多层包被进行包被的功能细胞和组织移植物的方法,所述多层包被是具有一致最低限度厚度的纯化海藻酸盐凝胶。这种方法可以经得住在宿主内的机械、化学或免疫破坏,不引发损害移植物功能的致纤维化反应,且提供一致和可控制厚度的包被,以允许营养素以及分泌和废弃产物的游离穿透性。一致包被具有约20-200um的厚度,这将消除对于移植物的功能性破坏的致纤维化和/或免疫反应,且提供生物学组织核的基本上完全覆盖,从而允许这些细胞或组织的成功长期移植。Cochrum等人陈述其方法是独特的,因为不需要通过多聚赖氨酸和其他多聚氨基酸或多聚阳离子的首先和后续包被的稳定。该方法允许任选形成晕圈(halo)层,提供一致地覆盖生物学组织的暴露区域在内部和外部包被之间的中间层。关于岛细胞分离的进一步指导可以在下述参考文献中发现:Qi等人,Humanpancreaticisletisolation:PartI:digestionandcollectionofpancreatictissueandPartII:purificationandcultureofhumanislets,JVisExp,2009年5月27日。还可以使用细胞移植物在免疫分离膜装置例如TheraCyte装入大胶囊装置中的装入胶囊(参见Rafael等人(2000)CellTranspl.9:107-13)。另一种技术是如Valdes(1998)“BiologicalEncapsulationasaNewModelforPreservationofIsletsofLangerhans”TransplantationProceed30:481中所述的“Valdez胶囊”。海藻酸盐层还可以用于装入胶囊,与β细胞包埋可以的一样。在涉及海藻酸盐层的产生的技术中,岛层作为通过胶凝高度纯化的海藻酸盐和郎格罕氏岛构成的薄平面生物人工内分泌胰腺提供。无细胞的海藻酸盐层形成对于装入胶囊的细胞的宿主排斥的一致免疫保护屏障,其中组织通过来自邻近宿主组织的被动扩散滋养(参见Stors等人(2006)Ann.NYAc.Sci.944:252-266)。转基因岛还可以与其他细胞类型共移植,例如睾丸支持细胞或干细胞,特别包括间充质干细胞(参见OsirisInc.http://www.osiristx.com/)。处理方法本文描述的本发明涵盖治疗或预防糖尿病或前驱糖尿病的方法。该方法包括但不限于将来自本文描述的供体动物的一种或多种胰岛细胞施用于有此需要的宿主。该方法可以是移植,或在某些情况下,异种移植。供体动物可以是猪科的。宿主可以是灵长类动物,例如非人灵长类动物,包括但不限于猴。宿主可以是人,且在某些情况下,具有糖尿病或前驱糖尿病的人。本发明的一个方法是异种移植的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,灵长类动物需要减少的外源胰岛素或不需要外源胰岛素。在另一个实施方案中,在移植后,灵长类动物需要减少水平的外源胰岛素或不需要外源胰岛素。一般理解在移植后指在血糖量正常状态发展后的时间段(这可以花费例如约4或12周)。在移植后,灵长类动物可能需要比在移植前需要的那种少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%的胰岛素。在移植后,灵长类动物可能需要比在移植前需要的那种少约5%-约25%的胰岛素。在移植后,灵长类动物可能需要比在移植前需要的那种少约25%-约50%的胰岛素。在移植后,灵长类动物可能需要比在移植前需要的那种少约50%-约75%的胰岛素。在移植后,灵长类动物可能需要比在移植前需要的那种少约75%-约100%的胰岛素。在移植后,灵长类动物可能需要小于0.6、0.5、0.4、0.3、0.2、0.1、0.05或0.01单位的外源胰岛素/千克(kg)/天。在一个实施方案中,在移植后,灵长类动物可能需要小于约0.01–约0.1单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,灵长类动物可能需要小于约0.1–约0.25单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,灵长类动物需要小于约0.25–约0.5单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,灵长类动物需要小于约0.5–约0.6单位的外源胰岛素/千克(kg)/天的任何数目。在一个实施方案中,在移植后,灵长类动物需要小于4单位的胰岛素/天。在一个实施方案中,在移植后,灵长类动物需要小于2单位的胰岛素/天。在一个实施方案中,在移植后,灵长类动物不需要外源胰岛素。在一个实施方案中,在移植后,灵长类动物需要小于1IU/kg/天的胰岛素。在另一个特定实施方案中,灵长类动物需要小于0.50IU/kg/天。本发明的方法还包括异种移植的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,灵长类动物需要最低限度的或不需要免疫抑制治疗。减少的或无免疫抑制治疗包括但不限于,与由其他方法需要的那种比较,一种或多种免疫抑制药物/试剂的剂量中的减少(或完全消除);与由其他方法需要的那种比较,一种或多种免疫抑制药物/试剂的类型数目中的减少(或完全消除);与由其他方法需要的那种比较,免疫抑制处理的持续时间中的减少(或完全消除);和/或与由其他方法需要的那种比较,维持免疫抑制中的减少(或完全消除)。本发明的方法还包括异种移植的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,其中与其他方法比较,IEQ/kg(胰岛当量/kg)需求是减少的。由此处描述的新发明需要的IEQ/kg可以是但不限于低于约100,000;90,000;80,000;70,000;60,000;50,000;40,000;30,000;20,000;10,000或5,000。由此处描述的新发明需要的IEQ/kg可以是约5,000-约10,000;约10,000-约15,000;约15,000-约20,000;约20,000-约25,000;约25,000-约30,000;约30,000-约35,000;约35,000-约40,000;约40,000-约45,000;约45,000-约50,000;约50,000-约55,000;约55,000-约60,000;约60,000-约65,000;约65,000-约70,000;约70,000-约75,000;约75,000-约80,000;约80,000-约85,000;约85,000-约90,000;约90,000-约95,000;约95,000-约100,000之间。在一个实施方案中,IEQ/kg低于100,000。在一个实施方案中,IEQ/kg低于50,000。在一个实施方案中,IEQ/kg低于25,000。在一个实施方案中,IEQ/kg低于10,000。本发明的方法还包括治疗或预防糖尿病的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,灵长类动物具有一些或所有功能性移植的岛。当与移植前的水平比较时或当与使用其他方法达到的水平比较时,移植的灵长类动物具有更多功能性移植的岛。岛可以使用本领域技术人员已知的任何定义表征为功能的,包括但不限于产生胰岛素的能力、减少宿主的外源胰岛素需求的能力,和/或产生供体类型C肽的能力。在一个实施方案中,岛功能性定义为大于0.3ng/dl的基础或刺激的猪科C肽。在一个实施方案中,岛功能性定义为与大于50%减少的外源胰岛素需要组合的可检测的C肽,其中所述C肽由移植的材料产生。本发明的方法还包括治疗或预防糖尿病的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,灵长类动物的空腹和非空腹血糖水平维持在正常水平。这些正常水平可以维持任何时间段,包括但不限于在移植后至少约3、6、12、24或36个月。在一个实施方案中,正常水平应维持至少3个月。在另一个实施方案中,正常水平应维持至少6个月。在另一个实施方案中,正常水平应维持至少12个月。关于灵长类动物包括但不限于人和猴的空腹和非空腹血糖水平是本领域技术人员已知的。在一个特定实施方案中,可以维持约70–约100mg/dL(3.9-5.5mmol/L)的FBG。在另一个特定实施方案中,NFBG可以维持在小于约200mg/dL。在某些情况下,当随机测试(不考虑空腹或非空腹状态)且求平均值时,葡萄糖的正常水平在约70-130mg/dl或3.9-7.2mmol/l之间。在某些情况下,在禁食后,葡萄糖的正常水平是约65-70mg/dl之间。在特定实施方案中,在移植后的葡萄糖水平维持在大致小于约200mg/dl、175mg/dl、150mg/dl、125mg/dl、100mg/dl、75mg/dl或50mg/dl。在一个实施方案中,在移植后和在过夜禁食后的葡萄糖水平低于140mg/dl,并且这个禁食后水平达到对于至少1个月至少1次/周。在一个实施方案中,在移植后的平均葡萄糖水平(早晨和晚间水平的平均值)是约2-5mmol/l或约3-4mmol/l之间。在一个实施方案中,在移植后,灵长类动物具有足够的升糖控制。在一个实施方案中,在移植后,糖化血红蛋白水平小于约8%、7%、6%、5%、4%或3%。在一个特定实施方案中,在移植后的糖化血红蛋白水平小于6.5%。本发明的方法还包括治疗或预防糖尿病的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,灵长类动物成功地通过静脉内葡萄糖耐量测试。测试可以在移植后任何时间执行,例如但不限于在移植后1、3、6和/或12个月时。在某些情况下,如果在不存在宿主(例如灵长类动物)C肽的显著应答的情况下,证实对于以供体(例如猪科)C肽形式的葡萄糖的显著应答,那么测试的结果是成功的。本发明的方法还包括治疗或预防糖尿病的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,灵长类动物成功地通过精氨酸刺激测试。测试可以在移植后任何时间执行,例如但不限于在移植后1、3、6和/或12个月时。在某些情况下,如果在不存在宿主(例如灵长类动物)C肽的显著应答的情况下,证实对于以供体(例如猪科)C肽形式的葡萄糖的显著应答,那么测试的结果是成功的。本发明的方法还包括异种移植的方法,其中将本文提供的转基因胰腺组织或细胞移植到灵长类动物内,并且在移植后,供体C肽水平是可检测的。在某些情况下,供体C肽水平是猪科的,并且在某些情况下,猪科C肽水平是约0.2-约1.0之间、约0.2-约0.75之间、约0.2-约0.65之间、约0.2-约0.55、约0.2-约0.45之间或约0.2-约0.35ng/ml之间。在移植后的供体猪科水平可以是约0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9或1.0ng/ml。在某些实施方案中,供体猪科水平大于1.0ng/ml。在某些实施方案中,供体猪科水平大于零。在某些实施方案中,供体猪科C肽水平是约0.5ng/ml。本发明的方法还包括治疗或预防糖尿病的方法,其中在转基因胰腺组织或细胞移植后,进行宿主灵长类动物的组织学分析。在某些情况下,在尸检后天然胰腺的组织学分析指出减少的胰岛素阳性β细胞,或在一个非限制性例子中,无胰岛素阳性β细胞。在这些情况下或在其中未检查天然胰腺的其他情况下,岛移植的肝或其他部位的组织学检查指出多个活的胰岛素阳性细胞。本发明的方法还包括治疗或预防糖尿病的方法,其中在转基因胰腺组织或细胞移植后,存在与移植程序、免疫抑制方案、耐受诱导方案和/或岛的装入胶囊相关的并非众多或严重的威胁生命的并发症。本发明的方法还包括治疗或预防糖尿病的方法,其中在转基因胰腺组织或细胞移植后,重复移植。移植可以在任何一个灵长类动物中执行2次、3次或更多次。移植可以以规律间隔进行,以维持足够的胰岛素水平。移植可以每年发生一次。移植可以每年发生2次。移植可以每年发生3次。移植可以每年发生超过3次。移植可以经过多年在不同时间发生。当与在相同灵长类动物中执行的其他移植比较时,任何一次移植的参数包括但不限于手术程序、递送方法、使用的供体组织和/或细胞、使用的免疫抑制方案等,可以是不同或相同的。在某些实施方案中,该方法减少对于宿主施用抗炎剂的需要。在其他实施方案中,该方法减少对于宿主施用抗凝血剂的需要。在特定实施方案中,该方法减少对于宿主施用免疫抑制试剂的需要。在某些实施方案中,在胰岛细胞施用后,宿主施用抗炎剂小于30天、或小于20天、或小于10天、或小于5天、或小于4天、或小于3天、或小于2天、或小于1天。在某些实施方案中,在胰岛细胞施用后,宿主施用抗凝血剂小于30天、或小于20天、或小于10天、或小于5天、或小于4天、或小于3天、或小于2天、或小于1天。在某些实施方案中,在胰岛细胞施用后,宿主施用免疫抑制试剂小于30天、或小于20天、或小于10天、或小于5天、或小于4天、或小于3天、或小于2天、或小于1天。在移植时,受体(宿主)可以是部分或完全免疫抑制的或完全不是。在移植时间前、过程中和/或后可以使用的免疫抑制试剂/药物是本领域技术人员已知的任何,并且包括但不限于MMF(霉酚酸酯(Cellcept))、ATG(抗胸腺细胞球蛋白)、抗CD154(CD40L)、阿仑珠单抗(Campath)、CTLA4-Ig(阿巴西普/Orencia)、贝拉西普(LEA29Y)、西罗莫司(Rapimune)、他克莫司(Prograf)、达克珠单抗(Zenapax)、巴利昔单抗(Simulect)、英夫利昔单抗(Remicade)、环孢素、脱氧精胍菌素、可溶性补体受体1、眼镜蛇蛇毒、甲泼尼龙、FTY720、依维莫司、抗CD154-Ab、来氟米特、抗IL-2R-Ab、雷帕霉素和人抗CD154单克隆抗体。一种或超过一种免疫抑制试剂/药物可以一起或序贯使用。一种或超过一种免疫抑制试剂/药物可以用于诱导治疗或用于维持治疗。相同或不同药物可以在诱导和维持阶段过程中使用。在一个实施方案中,达克珠单抗(Zenapax)用于诱导治疗,并且他克莫司(Prograf)和西罗莫司(Rapimune)用于维持治疗。在另一个实施方案中,达克珠单抗(Zenapax)用于诱导治疗,并且低剂量他克莫司(Prograf)和低剂量西罗莫司(Rapimune)用于维持治疗。在一个实施方案中,阿仑珠单抗(Campath)用于诱导治疗。参见Teuteberg等人,AmJTransplantation,10(2):382-388.2010;vanderWindt等人,2009,Am.J.Transplantation9(12):2716-2726.2009,;Shapiro,TheScientist,20(5):43.2006;Shapiro等人,NEnglJMed.355:1318-1330.2006。免疫抑制还可以使用非药物方案来达到,包括但不限于全身照射、胸腺照射和完全和/或部分脾切除术。这些技术还可以与一种或多种免疫抑制药物/试剂组合使用。转基因胰岛细胞可以使用本领域已知的任何方法进行移植,包括但不限于经由受体生物的门静脉、在肾包膜下、进入胸锁乳突肌内、腹膜内、在胃粘膜下层中、在睾丸中或在脾脏中引入(参见Rood等人,CellTransplantation,15:89-104.2006;Dufrane和Gianello,Transplantation,86:753-760.2008;Hering等人,NatureMedicine,publishedonline19February2006;vanderWindt等人,CellTransplant.2008;17(9):1005-14),并且它们还可以与睾丸支持细胞组合移植,所述睾丸支持细胞暗示在岛同种异体移植物中提供免疫抑制效应(Yin等人,2009Transplantation.2009Aug15;88(3):339-45)。在一个实施方案中,提供了异种移植的方法,以将本文提供的胰腺细胞移植到灵长类动物内,其中岛通过门静脉内输注进行施用。在一个实施方案中,提供了异种移植的方法,以将本文提供的胰腺细胞移植到灵长类动物内,其中岛经由腹膜内间隔、肾包膜、肾囊、网膜或经由胰腺床输注进行施用。本发明的方法还包括异种移植的方法,其中岛是装入胶囊的。岛可以是装入微胶囊的、装入大胶囊的或两者的组合。所有或一些岛可以不是装入胶囊的。用于产生胶囊的材料可以是本领域技术人员已知的任何,包括但不限于硝酸纤维素、海藻酸盐、丙烯腈、琼脂和聚四氟乙烯。胶囊可以是可渗透或半渗透性的。提供了允许移入的足够时间(例如1周、3周等),并且使用本领域技术人员已知的任何技术测定成功的移入。这些技术可以包括但不限于供体C肽水平的评价、组织学研究、静脉内葡萄糖耐量测试、外源胰岛素需求测试、精氨酸刺激测试、胰高血糖素刺激测试、IEQ/kg(胰岛当量/kg)需求的测试、关于血糖量正常在受体中的持久性的测试、免疫抑制需求的测试、和关于移植的岛的功能性的测试(参见Rood等人,CellTransplantation,15:89-104.2006;Rood等人,Transplantation,83:202-210.2007;Dufrane和Gianello,Transplantation,86:753-760.2008;vanderWindt等人,2009,Am.J.Transplantation,9(12):2716-2726.2009)。一种或多种技术可以用于测定移入是否是成功的。成功的移入可以指的是相对于无治疗,或在某些实施方案中,相对于用于移植的其他方法(即,移入比当使用用于移植的其他方法/组织时更成功)。在某些情况下,成功的移入通过供体C肽水平的评价进行测定。当使用猪科动物、组织、细胞时,在一个实施方案中,当猪科C肽水平是约0.2-1.0(ng/ml)之间,或更具体而言,约0.2-0.65(ng/ml)之间时,移入可以视为成功的(参见Cooper和Casu,Xenotransplantation,16:229-238.2009;Rood等人,CellTransplantation,15:89-104.2006)。在另一个实施方案中,使用IEQ/kg(胰岛当量/kg)需求的测试。在这个实施方案中,相对于使用用于移植的其他方法/组织需要的那种,需要更少的IEQ/kg。在某些情况下,IEQ需求可以低于约50,000IEQ/kg的新生儿猪质量,或低于约25,000IEQ/kg的成体猪质量(Dufrane和Gianello,Transplantation,86:753-760.2008)。在某些情况下,IEQ需求可以低于约100,000IEQ/kg的成体猪质量。达到具有更低IEQ/kg水平的血糖调节可以是成功的移入的一个指示。在某些情况下,血糖量正常在受体(宿主)中的持久性是成功的移入的标志。在移植后一段时间对外源胰岛素的延长的降低(或无)依赖性是成功的移入的一个指示。这个时间段可以是3个月、6个月、1年或超过1年。它可以在第一次移植后或可以由后续移植进行测量。在某些情况下,成功的移入通过对于免疫抑制的减少需要进行举例说明。对于免疫抑制的这种减少需要可以包括降低一种或多种免疫抑制药物/试剂的剂量、需要的免疫抑制药物/试剂的类型数目中的减少、免疫抑制的更短持续时间、和/或更低或无维持免疫抑制。在一个实施方案中,成功的移入可以通过测试关于移植组织的功能性(部分或完全)进行评价。这可以包括检测与外源胰岛素需要中的大于50%减少组合的供体C肽(例如猪科C肽)。在另一个例子中,移植组织的功能性可以定义为大于0.3ng/dl的基础或刺激的C肽。关于岛细胞移植的进一步指导可以在下述参考文献中发现:Bertuzzi等人,CurMolMed,6(4):369-74.June2006;Ricordi等人,Diabetes,35:649.1986;Korsgren等人,Transplantation,45:509.1988;Dufrane等人,Xenotransplantation,13(3):204-14.May2006;Toso等人,CellTransplantation,9:297.2000;Cozzi和Bosio,CurrOpinOrganTransplant,13(2):155-8.April2008;Bottino和Cooper,Xenotransplantation,15(2):104-6.March2008。需要糖尿病治疗或预防的宿主可以是鉴定为具有糖尿病、前驱糖尿病或糖尿病相关病的宿主。宿主可以患有:增加的口渴或饥饿,口干燥,尿频,无法解释的重量减轻,疲劳,视力模糊,头痛,意识丧失(罕见),伤口或切口愈合缓慢,皮肤瘙痒,频繁的酵母菌感染,近期重量增长,颈部、腋窝和腹股沟的厚深色皮肤变化,称为黑棘皮症,手足麻木和麻刺感,视力降低,阳痿。前驱糖尿病也称为“葡萄糖耐量受损”是具有更少症状但在个人发展更严重的2型糖尿病前几乎始终存在的健康状况。在美国超过20岁的超过50,000,000人具有前驱糖尿病,其血糖水平高于正常,但并非足够高以分类为糖尿病。为了测定前驱糖尿病,使用2个血液测试之一–空腹血糖(FPG)测试和口服葡萄糖耐量测试(OGTT)。在FPG血液测试过程中,血糖水平在禁食8小时后进行测量。在FPG测试中,100mg/dL-125mg/dL的测量指示前驱糖尿病,并且在2次或更多次测试时大于126mg/dL指示糖尿病。在OGTT测试过程中,血糖在禁食后和随后再次在饮用含有大量葡萄糖的饮料后2小时进行测量。在OGTT测试中,140mg/dL-199mg/dL的测量指示前驱糖尿病,并且大于200mg/dL的测量指示糖尿病。实施例实施例1:岛特异性表达载体构建哺乳动物表达载体pCI-Neo(Promega)作为用于胰岛特异性表达盒的背景进行缝合(sewed)。这种载体通过含有噬菌体f1区的1967碱基对(bp)片段的Cla1切除、SV40增强子和早期启动子、SV40最低限度复制起点和新霉素磷酸转移酶基因进行修饰。此外,当使用限制性酶BglII和HindIII将胰岛素-II启动子插入这种载体内时,切除CMV立即早期增强子/启动子。通过比较由大鼠胰岛素II基因CDS上游的近端序列扩增的2个克隆序列,做出充当用于胰腺特异性表达载体的启动子元件的序列选择。这些扩增的产物在长度中从497bp到767bp不同;最短的扩增产物最紧密对应于在文献中先前使用的那种。为了确定哪个启动子序列扩增引物是最佳选择,将关于GFP的cDNA引入每个启动子序列下游,并且这些测试载体用于转染β-TC-6小鼠胰腺胰岛素瘤细胞。执行FACS分析,以测试在受感染细胞中的转基因(GFP)表达。分析指出最长的扩增引物(767bp)导致更佳的GFP表达;因此,用于产生岛特异性表达的所有载体含有这个最长启动子元件。通过PCR扩增大鼠胰岛素II基因编码区5′的767bp区域,其使用纯化的高分子量大鼠DNA作为模板、PFxDNA聚合酶(Invitrogen)和引物:(SEQIDNo.1)pins2bg15’:gacgagatctaccaaatcaggaacagaaagagtc(SEQIDNo.2)pins2hd3’:tatcaagcttacctgcttgctgatggtttccgac这个片段在用于产生具有转基因的胰腺特异性表达的猪和小鼠的所有载体中充当启动子。通过用限制性酶BgIII和HindIII消化,将作为BgIII/HindIII片段的这个大鼠胰岛素II(rIns2)启动子区插入ClaI缺失的pCIneo载体内,所述限制性酶同时去除来自pCIneo的CMV增强子启动子(765bpfrag)。通过PCR扩增鼠PDX-1基因远端增强子(483bp),其使用纯化的高分子量小鼠DNA作为模板、PFxDNA聚合酶和引物:(SEQIDNo.3)muPDXbg15’:actgagatcttctagagagttcttctgtttgcta(SEQIDNo.4)muPDXbam3’:gctcggatccttaaaggtaaatgaattttatata将作为BglII/BamHI片段的鼠PDX-1增强子插入BglII限制位点中的rInsII启动子的5′,以制备中间pInsII载体。将多重鸡β-珠蛋白绝缘子片段插入载体内侧接增强子/启动子/转基因位点的位置上。通过PCR扩增鸡β-珠蛋白绝缘子(227bp),其使用含有绝缘子序列的内部载体、PFxDNA聚合酶和引物:(SEQIDNo.5)珠蛋白Cla5’:attaatcgatgggacagcccccccccaaag(SEQIDNo.6)珠蛋白Xba3’:atattctagattttccccgtatccccccaggtgt(SEQIDNo.7)珠蛋白Spe5’:attaactagtgggacagcccccccccaaag(SEQIDNo.8)珠蛋白Cla3’:atatatcgatttttccccgtatccccccaggtgt由这种扩增生成ClaI/XbaI绝缘子片段和SpeI/ClaI绝缘子片段,并且在3-片段连接中引入含有鼠PDX-1增强子的pInsII载体的3′末端上的ClaI位点内。在这个位点上引入总共4个绝缘子片段。通过用ClaI消化切除来自含有4个3′绝缘子片段(上文)的载体的一对绝缘子片段制备用于盒的5′末端的绝缘子,用DNA聚合酶I大(Klenow)片段使这个ClaI片段变平,并且将这个变成平端的片段插入rInsII载体中变平的BglII位点内,所述rInsII载体已含有启动子、增强子和3′侧面绝缘子。这个基础载体称为pREV788,并且用于转基因的所有后续引入用于胰岛特异性表达。含有所引入转基因的载体显示于图1中。在下述实施例中利用的载体是:pREV788:岛特异性载体盒含有大鼠胰岛素II启动子,伴随侧接鸡β-珠蛋白绝缘子和鼠PDX-1增强子。提供具有上游嵌合体内含子和下游SV40pA信号的多克隆位点(MCS)用于转基因插入和表达。pREV790:将含有与编码人CD4的结构域3和4以及C末端序列的cDNA融合的人TFPIcDNA的1841bpXhol/Notl片段插入Xho1/Not1消化的载体盒内。pREV792:将含有经由弹性接头与人IgG1的铰链CH2和CH3区融合的猪科CTLA4细胞外区域cDNA的1637bpSall/Not1片段插入Sa11/Not1消化的载体盒内。pREV835:将含有人CD39cDNA的1609bpXhol/Xhol片段插入Xho1消化的载体盒内。关于pCTLA4-Ig和TFPI的序列部分衍生自美国专利号7,432,344和6,423,316中所述的序列。将这些载体转染到2个不同的原代猪科胎儿细胞系内(参见实施例3)。细胞系183-6-6从雄性胎儿中分离,所述雄性胎儿是基因型纯合的GTKO且对于CD46是杂合转基因的。细胞系227-3从雌性猪(耳活组织检查)中分离,所述雌性猪是纯合的GTKO且对于CD46是杂合转基因的。产生转基因小鼠,以测试胰腺表达载体,具有TFPI作为引入的转基因。随后,产生了具有CD39的证实胰腺表达的猪(例如猪320-2),并且产生了胎儿(548/A3)且随后再克隆,以产生已证实pCTLA4-Ig和TFPI转基因的胰腺表达的猪(例如猪347-3)。在下述实施例中体现的猪都在纯合GTKO和CD46转基因的遗传背景上产生(使用的细胞系是183-6-6或227-3)。因此,这些所得到的猪的基因组具有与异种移植相关的3–4个遗传修饰,其中这些修饰中的至少一个导致在胰腺中特异性地转基因表达用于在岛移植中的效用。实施例2:具有胰腺特异性表达载体pREV790的TFPI转基因小鼠的产生受精卵阶段的小鼠胚胎得自与B6C3F1雄性交配的B6C3F1雌性(HarlanSpragueDawley,Dublin,VA)。44–48小时后,雌性用7.5IUPMSG(腹膜内,Calbiochem,SanDiego,CA)和5.0IUHcg(腹膜内,Intervet,Millsboro,DE)进行超排卵。收集受精卵且通过标准方法(Hogan等人,1994)在FHM(SpecialtyMedia,Lavallette,NJ)中处理。体外胚胎培养在KSOM培养基(专门培养基)中在37℃伴随在加湿空气中的5.0%CO2完成。使用先前描述的方法(Page等人,1995TransgenicRes.4:12-17),执行pREV790构建体的原核显微注射。注射的胚胎在体外培养过夜,在这时将它们从KSOM中取出且置于FHM内。使用已知技术(Hogan等人,ManipulatingtheMouseEmbryo,第2版,2004),将活的二细胞胚胎转移到假孕ICR小鼠(HarlanSpragueDawley)的输卵管内,并且允许自然分娩其幼崽。在21天龄时,使幼崽断奶,产生性欲且通过趾刻鉴定。收集尾部尖端活组织检查用于基因型分析。显微注射120个受精卵,87个培养过夜,并且76个所得到的二细胞胚胎移植到假孕受体内。出生了19只幼崽,其中4只通过PCR和DNA分析筛选,并且发现对于pREV790构建体是转基因的(21%转基因比率)。这个转基因比率在使用显微注射技术的正常预期范围内。实施例3:用于核转移的细胞系制备细胞系的分离:2个细胞系(183-6-6和227-3)用作用于转染的遗传背景,以加入另外的转基因,并且最终用于核转移以生成猪。通过GTKO猪(Dai等人,(2002)Naturebiotechnology20,251-255;Phelps等人,Science,(2003)299:411-414),与遍在表达hCD46转基因猪系(Loveland等人,Xenotransplantation,2004,11:171:183)的育种产生2个细胞系。2个细胞系通过基因型和表型证实为纯合的GTKO和hCD46转基因的。如下制备细胞系用于在NT中使用:在妊娠第36天时从胎儿183-6-6中分离胎儿成纤维细胞细胞系。使用弯曲的手术镊,缓慢地将胎儿通过60-网目金属筛磨碎,以便不生成过量热。随后将细胞悬液团块化,并且重悬浮于含有20%胎牛血清和抗生素-抗真菌剂的DMEM(Invitrogen)中。将细胞培养3天,且冷冻保存。从来自耳穿刺的48天龄猪(227-3)中分离耳成纤维细胞细胞系。耳穿刺用200标准乙醇(proofethanol)洗涤,随后用PBS洗涤。组织用手术剪切碎且在冷冻保存前培养12天。在妊娠第73天时收集胎儿548/A3,并且分离胰腺样品用于表达分析(实施例6-7)。此外,分离胎儿细胞(如上所述)且作为空白对照用于以后再克隆(实施例4)。用于转染的质粒片段制备:通过用AatII和AhdI(NewEnglandBiolabs)的限制性酶消化制备pREV790质粒片段用于转染。通过用AseI和AatII(NewEnglandBiolabs)消化制备pREV792。通过消化生成的质粒片段在1%低熔点琼脂糖凝胶(Cambrex)上分离,以去除质粒主链。切除含转基因的目的盒片段,且在2体积的1X琼脂糖酶缓冲液中在冰上温育2次共15分钟。在去除缓冲液后,凝胶在65℃熔化10分钟。在42℃10分钟后,使1uL琼脂糖酶(NewEnglandBiolabs)/100uL凝胶熔化,且在42℃温育最低限度1小时。将3M乙酸钠的十分之一体积加入凝胶熔化物中,并且在冰上温育15分钟。在4℃以15000rpm离心15分钟分离任何未消化的琼脂糖。将2体积的100%乙醇加入上清液中,并且离心用于使DNA片段团块化。在37℃干燥前,70%乙醇用于洗涤团块。将团块重悬浮于TE中。转染、选择、集落收获用于筛选:用pREV790(Pdx-rInsII-hTFPI)、pREV792(Pdx-rInsII-pCTLA4-Ig)和pREV828(嘌呤霉素选择标记基因载体)转染来自猪227-3的猪科耳成纤维细胞。将约5百万细胞与3μg每种转基因载体和.5μg选择标记选择一起共电穿孔。转染后48小时,在以约25,000细胞/皿的密度的20x10cm皿中伴随0.5mg/ml的抗生素嘌呤霉素(InvivoGen,SanDiego,CA)添加选择转染的细胞。在嘌呤霉素选择起始后72小时更换培养基。在选择起始后7天收获集落。收获70个嘌呤霉素抗性集落,并且进一步培养3天。70个集落中的45个生长且分成2个样品:一个用于PCR分析且一个用于扩增。关于pREV790和pREV792的PCR分析如实施例5中所述执行。合并37个双重PCR阳性集落,并且冷冻保存用于在核转移中的未来使用。使用与pREV828和pREV792组合的pREV835(Pdx-rInsII-CD39)载体,应用类似程序共转染、选择和集落收获,除在这种情况下使用细胞系183-6-6用于转染之外。实施例4:通过核转移(NT)产生多转基因猪多种方法可以用于产生本发明的多转基因猪。下述是一个例子,其中使用的供体细胞(系227-3和系183-6-6)是遗传背景纯合的GTKO(缺乏αGT的任何功能),并且对于CD46也是转基因的(并且在胰腺中表达CD46;图7)。在用于NT前,如实施例3中所述,将供体细胞转染,选择且就pREV790、pREV792和/或pREV835载体阳性进行筛选。在某些情况下,在其在NT中使用前,将都对于一种或多种转基因筛选阳性的、转染且选择的细胞的多个集落合并在一起。关于NT的供体细胞(胎儿或成体成纤维细胞)在补充有10-20%胎牛血清和0-4ng/ml碱性成纤维细胞生长因子的达尔贝科改良伊格尔培养基(DMEM,Gibco,目录#11995-065)中,在加湿温箱中在用氮平衡的5%O2、5%CO2下在37℃培养。对于培养,在核转移程序前,将细胞以合适的稀释度种植3-7天,从而使得在核转移前24-48小时细胞将达到汇合。核转移当天时,在胚胎重建中使用前约30-45分钟,通过使用胰蛋白酶-EDTA(Gibco,目录#25300-054)收获供体细胞,在合适保留培养基(例如Hepes缓冲的M199,Gibco目录#12350-039)中制备单细胞悬液。使用本领域众所周知的方法(参见例如,Polejaeva等人,(2000)Nature407,86-90,Dai等人,(2002)Naturebiotechnology20,251-255,Campbell等人,(2007)Theriogenology68Suppl1,S214-231,Vatja等人,(2007)ReprodFertilDev19,403-423),对体外成熟的卵母细胞(DesotoBiosciences,Christiansburg,VA)执行NT程序。使用ECM2001ElectrocellManipulator(BTXInc.,SanDiego),执行重建卵母细胞的电融合和激活。融合且激活的核转移胚胎在培养中在磷酸盐缓冲NCSU-23培养基(JRprodFertilSuppl.1993;48:61-73)中在38.5℃保持1-4小时,并且随后转移至动情期同步的受体小母猪的输卵管。通过混合到其饲料内的18-20mgMatrix(Altrenogest,Hoechst,Warren,NJ)的经口施用,杂交育种的小母猪(大白猪/Duroc/Landrace)(280-400磅)作为受体动物同步。将Matrix饲养连续14天。在最后一次Regu-Mate处理后105小时,肌内施用人绒毛膜促性腺激素(hCG,1000单位;IntervetAmerica,Millsboro,DE)。在hCG注射后22-26小时,通过腹中线剖腹术执行胚胎转移。在转移后第10和13天时,使用孕马血清促性腺激素(PMSG,1000IU)和hCG(500IU)用于维持妊娠。转移后28天,妊娠经由超声波检查术加以证实。其后在每周基础上监控妊娠。所有小猪经由自然分娩出生。使用183-6-6细胞的核转移导致迄今为止出生的3窝小猪,所述183-6-6细胞是嘌呤霉素选择且对于pREV792和pREV835转基因筛选阳性的;某些小猪对于pREV792和pREV835转基因是基因型阳性的。这些小猪之一#320-2用于表型分析(参见实施例7)。从小猪320-2中分离的成纤维细胞随后用于核转移(再克隆)且已出生窝和活后代。使用227-3细胞的核转移导致胎儿548/A3的产生,所述227-3细胞是嘌呤霉素选择且对于pREV790和pREV792转基因筛选阳性的,所述胎儿548/A3对于pREV790和pREV792转基因以及来自亲本细胞系的GTKO和CD46遗传修饰是基因分型阳性的。从胎儿548/A3中分离的细胞用于再克隆且迄今为止已产生7窝(参见表1)。来自一窝的小猪347-3用于实施例6-7中的表型分析。所有这些再克隆的小猪证实为具有与548/A3胎儿相同的基因型,即它们对于pREV790(TFPI)和pREV792(pCTLA4-Ig)转基因(胰腺特异性表达)是转基因的,并且另外是CD46转基因的和GTKO(由于用于转染的细胞系的遗传背景;227-3)。就我们所知,这是已产生的包含超过3种遗传修饰的第一批猪。表1.由胎儿548/A3再克隆的小猪窝窝ID编号出生的小猪(#)活的小猪*(#)34231346213475536722371223752238422总计1815*活的小猪是出生活着且活了至少24小时的小猪。某些小猪在各个年龄时实施安乐死用于分析转基因表达或用于其他调查研究。这些动物中的2个目前饲养用于育种。实施例5:通过PCR和DNA印迹分析的细胞和转基因动物的基因分型基因型分析:从经转染的细胞、以及待测试的每只小鼠或小猪的血样或组织样品中提取基因组DNA。简言之,组织样品在60℃在振荡温箱中裂解过夜,使用约1ml裂解液(50mMTrispH8.0、0.15MNaCl、0.01MEDTA、1%SDS、25%高氯酸钠和1%β-巯基乙醇利蛋白酶K)/175mg组织。在酚/氯仿提取后,用异丙醇沉淀DNA。用RNA酶(1mg/ml)+RNA酶T1(1000U/μl)在37℃将再溶解的DNA处理1小时,伴随蛋白酶K(20mg/ml)在55℃1小时,用酚/氯仿提取,沉淀且重悬浮于Tris乙二胺四乙酸(EDTA)中。使用用于哺乳动物血液的DNA分离试剂盒(RocheDiagnosticsIndianapolis,IN),从全血样品中分离DNA。对于DNA印迹分析,用合适的限制性酶(下文详述)消化约10μgDNA并且在1%琼脂糖凝胶上分离。在电泳后,将DNA转移至尼龙膜,并且用3′末端地高辛配基标记的探针(下文探针序列)探测。使用化学发光底物系统(RocheDiagnostics,Indianapolis,IN)检测条带。pREV790-TFPI通过PCR测定整合的pREV790构建体的存在,其使用靶向从大鼠胰岛素II启动子延伸到TFPI编码序列的5′区域内的1000bp片段的引物790.5L和790.5R。(SEQIDNo.9)790.5L:agcaaagtccaggggtcag(SEQIDNo.10)790.5R:gaaatctggcttttcttgttgc通过DNA印迹分析证实整合的pREV790构建体的存在,其使用BamHI消化物且用探针TFPI5’/3’探测。(SEQIDNo.11)TFPI5’/3’探针序列:GGATTGTGTCGTGCCAATGAGAACAGATTCTACTACAATTCAGTCATTGGGAAATGCCGCCCATTTAAGTACAGTGGATGTGGGGGAAATGAAAACAATTTTACTTCCAAACAAGAATGTCTGAGGGCATGTAAAAAAGGTTTCATCCAAAGAATATCAAAAGGAGGCCTAATTAAAACCAAAAGAAAAAGAAAGAAGCAGAGAGTGAAAATAGCATATGAAGAAATTTTTGTTAAAAATATcTGcAgGAACCAGAAGAAGGTGGAaTTCAAAATAGACATCGTGGTGCTAGCTTTCCAGAAGGCCTCCAGCATAGTCTATAAGAAAGAGGGGGAACAGGTGGAGTTCTCCTTCCCACTCGCCTTTACAGTTGAAAAGCTGACGGGCAGTGGCGAGCTGTGGTGGCAGGCGGAGAGGGCTTCCTCCTCCAAGTCTTGGATCACCTTTGACCTGAAGAACAAGGAAGTGTCTGTAAAACGGGTTACCCAGGACCCTAAGCTCCAGATGGGCAAGAApREV792-pCTLA4-Ig通过PCR测定整合的pREV792构建体的存在,其使用靶向从大鼠胰岛素II启动子延伸到CTLA4编码序列的5′区域内的473bp片段的引物(792.s和792.a)。这些引物的序列是:(SEQIDNo.12)792.s:cgctgtgggctcttctcttacat(SEQIDNo.13)792.a:gagcaagccatggctaagctta通过DNA印迹分析证实整合的pREV792构建体的存在,其使用BamHI消化物且用探针792.s1792/a2265探测。(SEQIDNo.14)792s1792/a2265探针序列:CGCTGTGGGCTCTTCTCTTACATGTACCTTTTGCTAGCCTCAACCCTGACTATCTTCCAGGTCATTGTTCCAACaagcttTATTGCGGTAGTTTATCACAGTTAAATTGCTAACGCAGTCAGTGCTTCTGACACAACAGTCTCGAACTTAAGCTGCAGTGACTCTCTTAAGGTAGCCTTGCAGAAGTTGGTCGTGAGGCACTGGGCAGGTAAGTATCAAGGTTACAAGACAGGTTTAAGGAGACCAATAGAAACTGGGCTTGTCGAGACAGAGAAGACTCTTGCGTTTCTGATAGGCACCTATTGGTCTTACTGACATCCACTTTGCCTTTCTCTCCACAGGTGTCCACTCCCAGTTCAATTACAGCTCTTAAGGCTAGAGTACTTAATACGACTCACTATAGGCTAGCCTCGAGAATTCACGCGTGGTACCTCTAGAgtcgacGGTATCGATAAGCTTAGCCATGGCTTGCTCpRE’V835-CD39通过PCR测定整合的pREV835构建体的存在,其使用靶向在CD39编码区内的584bp片段的引物CD39R3和CD39L3。(SEQIDNo.15)CD39R3:CATAGAGGCGAAATTGCAGAG(SEQIDNo.16)CD39L3:AGTATGGGATTGTGCTGGATG通过DNA印迹分析证实整合的pREV835构建体的存在,基使用Sad消化物且用探针CD39L3/R3探测。(SEQIDNo.17)CD39L3/R3探针序列:AGTATGGGATTGTGCTGGATGCGGGTTCTTCTCACACAAGTTTATACATCTATAAGTGGCCAGCAGAAAAGGAGAATGACACAGGCGTGGTGCATCAAGTAGAAGAATGCAGGGTTAAAGGTCCTGGAATCTCAAAATTTGTTCAGAAAGTAAATGAAATAGGCATTTACCTGACTGATTGCATGGAAAGAGCTAGGGAAGTGATTCCAAGGTCCCAGCACCAAGAGACACCCGTTTACCTGGGAGCCACGGCAGGCATGCGGTTGCTCAGGATGGAAAGTGAAGAGTTGGCAGACAGGGTTCTGGATGTGGTGGAGAGGAGCCTCAGCAACTACCCCTTTGACTTCCAGGGTGCCAGGATCATTACTGGCCAAGAGGAAGGTGCCTATGGCTGGATTACTATCAACTATCTGCTGGGCAAATTCAGTCAGAAAACAAGGTGGTTCAGCATAGTCCCATATGAAACCAATAATCAGGAAACCTTTGGAGCTTTGGACCTTGGGGGAGCCTCTACACAAGTCACTTTTGTACCCCAAAACCAGACTATCGAGTCCCCAGATAATGCTCTGCAATTTCGCCTCTATG实施例6:来自转基因猪的组织的表型分析(pCTLA4-Ig)关于pCTLA4-Ig表达的蛋白质印迹:通过在蛋白酶抑制剂(ThermoScientific,Rockford,II)的存在下的匀浆化,随后加入SDS(1%终浓度)且离心以去除残留细胞碎片,制备组织利细胞裂解产物。用双金鸡宁酸(BCA)蛋白质测定试剂盒(Pierce,Rockford,IL)测定蛋白质浓度。在4-12%BisTrisSDS梯度凝胶(Invitrogen,Carlsbad,CA)上分级分离热变性和β-巯基乙醇还原的样品(10-20~g样品)。重组人CTLA4-Ig/Fc(R&DSystems,Minneapolis,MN)用作标准对照蛋白质。在电泳后,将蛋白质转移至硝酸纤维素,用Memcode蛋白质染剂(ThermoScientific)染色用于总蛋白质显现,并且用酪蛋白-封闭缓冲液(Sigma-Aldrich.,St.Louis,MO)封闭。封闭的膜在兔抗人IgGl-辣根过氧化物酶(HRP)(TheBindingSite,SanDiego,CA)中温育,所述酶识别pCTLA4-Ig的人IgGl重链区。用SuperSignalWestPico化学发光底物(ThermoScientific)和摄影成像检测免疫反应性条带。通过蛋白质印迹,胎儿548/A3和来自548/A3细胞的再克隆的小猪(小猪347-3)显示在胰腺中特异性地56kDapCTLA4-Ig蛋白质的表达(图2)。实施例7:在胰腺中表达转基因的动物的表型分析组织学和免疫荧光:取出小鼠或猪胰腺,并且在10%福尔马林中固定且在OCT(ElectronMicroscopySciences,Hatfield,PA)的块中冷冻。福尔马林固定的组织在石蜡中封闭,并且以5μm切割用于由苏木精与伊红染色(H+E)的染色。使用标准程序执行H和E染色。冷冻切片在低温恒温器(cryostat)上以5μm切割,并且用兔抗人TFPI(多克隆的,AmericanDiagnostica,Stamford,CT,#4901)、绵羊抗人IgG1(多克隆的,TheBindingSite,Birmingham,UK,#AUOO6)、小鼠抗人CD46(克隆O.N.137,mIgG2a,U.S.Biological,Swampscott,MA)、小鼠抗人CD39(克隆BU6I,mIgG1,Ancell,Bayport,MN)或小鼠抗大鼠胰岛素/胰岛素原(克隆D3E7,mIgG1,Serotec,Oxford,UK)染色。对于兔IgG(JacksonImmunoResearch,WestGrove,PA)、绵羊IgG(Jackson)、小鼠IgG2a(克隆MRCOX-34,Serotec)和小鼠IgG1(克隆MOPC-31C,BDPharmingen,SanJose,CA)分别运行同种型对照。使用3步程序执行免疫荧光(IF)染色。将冷冻切片干燥且在冷丙酮(Sigma,St.Louis,MO)中固定,随后为抗生物素蛋白-生物素封闭(Invitrogen,Carlsbad,CA)。还包括二次Ab宿主物种血清封闭步骤(10%驴血清,Jackson)。初次Ab在PBS中稀释,并且温育在室温在加湿室中执行1小时。使用的二次Ab是生物素化的驴抗(兔、绵羊或小鼠)IgG共45分钟,并且使用的三次Ab是荧光素缀合的链霉抗生物素蛋白共30分钟(Jackson)。将载玻片在步骤之间在PBS中洗涤,使用22x30mm盖玻片(VWR,WestChester,PA)盖上盖玻片,并且使用具有DAPI的Slowfade(Invitrogen)保存。使用在Provis显微镜上的OlympusDP71照相机获得代表性组织学和IF照片,并且使用DP控制器软件(Olympus,CenterValley,PA)用200x的放大率进行分析。结果:pREV790(TFPI)转基因小鼠:1岁大的小鼠具有极佳成簇的岛,如代表性H+E组织学中显示的。这些小鼠以岛特异性方式表达hTFPI,染色与胰岛素那种相似的方式局限化(图3)。hTFPI染色比胰岛素更强烈,指出使用目前描述的系统的有效岛特异性表达。pREV790/pREV792转基因猪:胎儿548/A3的特征在于在妊娠73天时的组织学(图4)。小猪347-3(548/A3的再克隆)在约2.5月龄时进行表征(图5)。将β细胞分散且在胎儿胰腺中扩散,这可以在代表性照片中见到。关于hTFPI和pCTLA4-Ig(hIgGIAb)的染色模式类似于胰岛素。染色对于hTFPI和pCTLA4-Ig比胰岛素更强烈。在2.5月龄时,小猪347-3具有更多发育的岛簇,并且显示在其中的强烈染色。小猪347-3中的岛特异性表达对于hTFPI更强烈,对于pCTLA4-Ig略微更不强烈,并且对于胰岛素更不强烈。pREV835(CD39)转基因小猪:在~3.5月龄时,小猪320-2具有完全发育的岛簇,并且显示在其中对于CD39的强烈染色。在320-2中对于hCD39的岛特异性表达比对于胰岛素更强烈,如先前小鼠和猪例子中显示的(图6)。实施例8:转基因小鼠和猪岛的岛分离和体外凝血测定使用本领域已知的实验室方案,可以分离、培养且在体外就凝血(凝血时间)测试猪和鼠胰岛,其例子在此处提供。用于岛分离和培养的溶液:25%Ficoll母液:33.3gFicoll400,Type400,Sigma#F-4375100mlHBSS/Hepes伴随搅拌和低热混合在一起,直至Ficoll变成溶液。无菌过滤。贮存于40℃。由25%溶液制备梯度。对于50ml:25%FicollHBSS/Hepes23%溶液=46ml4ml20.5%溶液=41ml9ml11%溶液=22ml28ml充分混合在一起。贮存于40℃。HBSS/Hepes:含钙和镁的500mlHBSS10mlHepes1M充分混合在一起。贮存于40℃。HBSS/BSA:含钙和镁的500mlHBSS10mlHepes1M2.5gBSA级分V在加入BSA后无菌过滤。充分混合在一起。贮存于40℃。胶原酶:1.95mg胶原酶V型Sigma#C-92631mlHBSS/Hepes轻轻混合。太多搅动将破坏酶作用。保持在40℃。溶液最好新鲜使用,但如果保持在40℃,那么可以使用最多3天。溶液随着它老化变得更弱,并且还可以是冷冻的,但在解冻后活性更少。鼠岛培养基:500mlRPMI164050ml胎牛血清(热灭活的)10mlHepes1M5ml青霉素/链霉素(10,000U/10,000mg/ml)5mlL-谷氨酰胺(200mM)500ul2-巯基乙醇50mM(原液:在55m1PBS中0.2ml)无菌过滤且贮存于40℃。小鼠岛分离方案:在收获胰腺前立即处死小鼠。在无菌条件下在通风橱中执行收获和分离程序。执行剖腹术且拉动皮肤和体壁向后朝向头。肝将针对横膈膜向后反映。定位普通胆汁且流动至与肠的连接点。将夹子置于十二指肠周围和胆管末端上,以禁止从胆管到肠内的流动。用冷胶原酶溶液填充3ml或5ml注射器并且附着30G针。将针沿着柄弯曲约一半以形成90度角。将针插入胆管内,接近于肝,其中针指向肠。尽可能快地将针滑动到胆管内,而不进一步损害管(无其他穿刺)。将胶原酶注射到胰腺内,直至它完全扩张。起初仅注射一点,确保它不渗透到肠内。如果是,那么重新调整夹子。取决于动物的大小,膨胀可能需要2-5ml胶原酶。在胰腺膨胀后,去除针和夹子。通过从附着组织和管撕裂且切断而取出胰腺。对于最大限度得率,取出整个胰腺。在冷胶原酶溶液中洗涤切除的胰腺,随后置于25cm2烧瓶中,并且保持在冰上直至收获所有其他胰腺。不超过4个胰腺置于一个烧瓶中。在温育前将另外1-2ml置于烧瓶中。将烧瓶在37℃温育18-20分钟,无振荡。在温育后,将烧瓶急剧振荡约10秒或直至组织是同质的。通过将10ml冷HBSS-BSA加入烧瓶中停止酶的作用。替换盖子且将烧瓶再次急剧振荡又2-3秒。将组织浆倾倒入50ml圆锥管内且用HBSS-BSA填充至50ml。混合,随后允许重力沉降5分钟。完成这点以去除并非岛的组织的精细颗粒。岛是大的且将无离心地落到底部。去除上清液,而不扰乱松散沉降的团块。通过吸取或振荡混合团块且再次洗涤。重复洗涤步骤2-5次直至上清液相对澄清。洗涤的量取决于使用的组织大小。在第二次或第三次洗涤过程中,通过使组织经过线20目筛可以去除大块未消化的组织。在最后一次洗涤后,以5mlHBSS-BSA/胰腺的比率重悬浮团块。将消化的组织分开且置于17X100mm(14m1)圆底聚苯乙烯管内。不超过2个胰腺置于管内。将管以1000RPM轻轻离心1分钟,以使组织团块化。从团块中尽可能多地去除上清液,以便不稀释Ficoll梯度。将4ml25%Ficoll溶液加入管中,并且通过涡旋5-10秒重悬浮组织。覆盖其余Ficoll梯度(各2ml),从23%开始,20.5%且最后11%。不扰乱或混合层或界面。将管以1800RPM离心10分钟。在离心后,岛主要处于在11-20.5%层之间和在20.5-23%之间的界面上。分开获得所有层和界面,并且将它们置于15ml圆锥管内。在弃去前针对岛检查每一个层。用HBSS-BSA将层洗涤1次。以1000RPM离心1分钟。通过吸管去除上清液。在完全培养基中再一次洗涤且允许重力沉降3-5分钟。通过吸管去除上清液。不扰乱松散的团块。收集留在管中的那些且置于60mm非组织培养无菌培养皿中。岛现在预备精选且计数。用胶原酶的猪胰腺消化:制备胶原酶(LiberasePI或CollagenaseP,Roche)。用1mg/胶原酶/ml制备HBSS的溶液。保持在冰上直至预备使用。在使用前,将它加温至24℃。对于成体猪的整个胰腺,补足500ml溶液。1.在冰上的无菌桶上,从胰腺中清除结缔组织、脂肪、血液。2.从冰中取出器官。3.定位胰管(如果使用整个胰腺),然后通过管注射胶原酶。可替代地,对于部分器官样品或如果管无法定位,那么将胶原酶直接注射到实质中。4.注射可以持续最多5分钟。5.将器官切割成小片(各1/2英寸),且置于具有更多预加温的胶原酶(足以覆盖整个小片)的烧杯内。6.置于37℃水浴中且继续用手振荡。7.在数分钟后,组织开始解散。整个小片可以不消化。避免释放细胞的过消化,因此在振荡10分钟后,如果溶液变得混浊,那么开始用吸管回收游离细胞,且将细胞转移至具有含有血清(5%)的丰富冷RPMI溶液的瓶或烧杯(在冰上)。8.继续温消化直至收集足够细胞,但不使组织暴露于温胶原酶长于30分钟。9.在冷RPMI+血清中洗涤细胞数次,以去除胶原酶。10.以1000RPM离心3分钟。11.为了获得分离的岛,运行ficoll梯度。12.对于小量组织团块,使用50ml圆锥管。13.制备下述的密度梯度:原液1.132,层1.108、1.096、1.037。14.在底部装载在10ml原液Ficoll中分散的2ml团块。在顶上8ml1.108、8ml1.096、8ml1.037和5mlHBSS。15.以800g或2000rpm离心20分钟。16.岛应在第二个和第三个界面上,但为了确保检查其他层。17.非常充分地洗掉ficoll(以1200rpm至少3次洗涤共3分钟,伴随RPMI+血清),随后根据需要培养或固定细胞。用于体外凝血(凝血时间)测定的方案:材料-CMRL-1066培养基(Gibco/Invitrogen,Carlsbad,CA),37℃-在37℃的温箱振荡器-未经处理的聚苯乙烯24孔板-吸管-1mL注射器-Vacutainer组:针,橡皮圈-乙醇交换-辅助带-用于废料的容器-定时器方法-在37℃将100个精选岛置于200uLCMRL培养基中/孔-在37℃在仅具有血液的对照孔中铺板200uLCMRL培养基-将200uL新鲜抽取的人血液加入每个孔中-通过振荡板轻轻混合且将板置于温箱振荡器中-就凝血时间观察实验使用方法例如上文详述的那些分离岛。正常野生型(WT)小鼠或猪岛用作对照。还由TFPI转基因小鼠系(pREV790;参见实施例2)制备岛。TFPI转基因猪岛得自实施例4中所述的548/A3猪系。将岛与新鲜分离的人血液混合,并且对于血块形成测定凝血时间。关于暴露于人血液的转基因小鼠和猪岛的体外凝血时间(以分钟表示)显示于下表2中:样品实验1实验2对照(人血液-无岛)28.27>30.00小鼠(pREV790)猪(pREV790/pREV792)*野生型岛8.054.30转基因岛10.246.12*取样的猪也是GTKO和CD46转基因的。转基因在岛中的表达导致在小鼠岛中凝血时间的33%增加,和在猪岛中凝血时间的38%增加。实施例9:在非人灵长类动物(NHP)移植中转基因猪科岛异种移植物的体内功能性的测定在NHP中糖尿病的诱导和免疫抑制:在非人灵长类动物模型中,使用如适合于食蟹猴的近期开发的链脲霉素方案可以化学诱导糖尿病,并且使用胰岛素和灵长类动物特异性和猪科特异性C肽测定(Rood等人2006,Casu等人2008,Bottino等人2009),可以监控糖尿病状态和供体岛存活/功能。具有与人抗CD154mAB相似活性的、共刺激封闭药物人CTLA4Ig可以与ATG诱导治疗和具有MMF的维持治疗组合使用。CTLA4-Ig目前是CD154mAB的潜在替代物,所述CD154mAB已由一个团体用于猪至非人灵长类动物岛Tx(Cardona等人,2006)。这种CTLA4Ig(Orencia)可以以12.5-25mg/kg以与抗CD154mAb一样的时间间隔(第-1、0、4、7、10、14、19天和每周,以维持谷水平>300ng/ml)对于STZ诱导的糖尿病猴静脉内施用。与ATG和MMF组合的这个给药方案在初步研究中证实足以阻止狒狒中的致敏作用,所述狒狒接受GTKO猪动脉移植物(Ezzelarab等人,准备中的手稿)。概括地,用于岛移植的NHP的免疫抑制可以如下:诱导:·抗胸腺细胞球蛋白(ATG)1-10mg/kg静脉内x2(第-3和-1天),以在第0天时减少T细胞计数至<500细胞/mm3。维持:·霉酚酸酯(MMF)50-100mg/kg/天口服,以维持12小时全血谷水平在3-6ug/ml·在第-1、0、4、7、10、14天时且随后每周CTLA4-Ig25mg/kg静脉内。猪科岛制备和移植:在从麻醉的猪供体中取出胰腺后不久执行猪岛分离。使用由Ricordi描述的半自动化方法的修改获得猪科岛,其中使用设计用于猪的特异性胶原酶掺和物、较低的消化温度、酶的轻轻注射和基本上无机械振荡(Bottino等人,2007)。通过在细胞加工机器(COBE29911)上在不连续梯度上(Bottino等人,2007,2009)的离心达到岛的纯化。对于每个岛批次评估分离的岛的功能性质和活力。在不存在自身免疫1型糖尿病的非人灵长类动物模型的情况下,通过链脲霉素(STZ,链佐星,125-150mg/kg)的静脉内注射诱导高血糖症。插入猴的颈动脉和颈静脉中,并且与栓系系统连接的血管线,允许容易接近药物递送和血液抽取,并且允许在糖尿病诱导后的最佳静脉内胰岛素施用。在链脲霉素施用前和后执行静脉内葡萄糖耐量测试(IVGTT)和精氨酸刺激测试(AST),以证实糖尿病状态,并且在移植后,以评估对于促分泌素的移植物应答。在移植当天时,在补充有10%热灭活的胎牛血清、10mM烟酰胺、2mM谷氨酰胺和Pen-Strepto的CMRL-1066培养基中过夜培养后,计数岛,重悬浮于含有4mg右旋糖酐硫酸盐的CMRL中,以阻止凝血,并且经过5-10分钟的时期通过重力注射到门静脉中。在岛输注后1和2小时后,测量猪科C肽释放,岛细胞破坏的指示剂,并且峰指示由于IBMIR的起始岛细胞丧失程度。由先前实验产生的历史数据可以用于评估转基因阻止早期岛丧失的能力。使用彼此不交叉反应的特异性猪科和人抗体测定血清C肽浓度,使得能够区分在异种移植后的内源和移植物胰岛素产生(Casu等人2008)。来自IBMIR的岛的早期丧失可以通过下述进行监控:(i)在前24小时内C肽水平的测量(作为岛破坏的标记),(ii)血糖水平,(iii)Tx后的外源胰岛素需求(作为维持血糖量正常状态中移植成功的指示剂),(iv)在肝中众多活的岛(胰岛素阳性的)的存在,和(v)在尸检后在组织学检查时移植物的细胞浸润程度。实施例10:在糖尿病猴中CD46转基因猪岛的体内功能为了测定CD46表达细胞用于治疗灵长类动物中的糖尿病的效用,如实施例9中所述在食蟹猴中化学诱导糖尿病。通过来自携带hCD46转基因(在其内源启动子控制下的小基因)的祖先系的远交衍生hCD46+猪岛供体。通过分析的所有组织和分离的岛的免疫荧光显微镜检查观察遍在hCD46表达(Loveland等人,Xenotransplantation,2004,11:171:183)。如实施例9中所述,在9只猴受体中诱导并且证实糖尿病。组A受体(n=4)用野生型猪科岛(n=2)或从GTKO猪中分离的岛(n=2)进行移植,数目为85,000-100,000IEQ/kg体重。组B受体(n=5)接受相等数目的来自hCD46+猪的岛。2个组B动物在49和91天后分别进行再移植。免疫抑制对于2个组是等同的,并且由用于诱导的抗胸腺细胞球蛋白、抗CD154单克隆抗体和霉酚酸酯(MMF)组成。跟踪猴直到移植物功能丧失,或直到移植后3个月,除对于允许>1年随访的一个B组动物外。通过与大于50%减少的外源胰岛素需要组合的可检测的猪科C肽测定的,在所有猴中达到功能猪科岛存活。在组A中,岛存活持续7、20、31和46天。在组B中,hCD46+岛的使用分别显著延长功能猪科岛存活至完全3个月或超过随访的年(时序检验P=0.0042)。移植后每周禁食猪科C肽水平在前45天过程中对于组A和B是可比较的(1.10±0.41与1.19±0.88ng/mL比较,斯氏t检验P=0.860)。在45天后,C肽阳性仅在组B受体中维持在0.87±0.41ng/mL。胰岛素非依赖性在4只组A猴中的3只中分别达到5、17和36天的时期。5只组B猴中的4只变得胰岛素非依赖性分别87、91、92和>396天。在胰岛素非依赖性时间过程中,空腹血糖值得到良好控制(组A:91±18mg/dL;组B:112±22mg/dL,斯氏t检验P=0.250)。猴无一恢复内源β细胞功能。移植后肝的组织学评估揭示在组B动物中许多活的猪科岛。T细胞浸润得到成功阻止。抗Gal和/或抗非Gal抗体的血清水平在组A中不增加,组B猴也不增加,在再移植后也不增加。然而,通过组A肝的组织学分析在移入的岛上可见IgM、IgG和C4d,但仅至组B肝中在岛上的最低程度。具有CD46作为唯一的转基因,仍需要大的岛剂量(75,000-100,000IEQ/kg),并且仍存在与hCD46异种移植物相关的显著早期移植物丧失。此外,利用的外源免疫抑制方案不顺应在人患者中的使用(参见vanderWindt等人,Am.J.Transplantation,9(12):2716-2726.2009)。实施例11:pCTLA4-Ig表达猪的表型尽管已建议pCTLA4-Ig表达动物的开发,但这些动物是严重无免疫应答的。发现使用CAG增强子/启动子遍在表达CTLA4-Ig的猪具有无免疫应答的表型,并且在一般的畜牧业环境中不是活的。通过电穿孔用线性化pCTLA4-Ig构建体与pgkpuromycinr或pgkncomycinr载体的10:l比率,共转染来自WT或GTKO猪的原代胎儿成纤维细胞(源自Landrace/Duroc/LargeWhite杂交)。在48小时时,将细胞以100-500细胞/cm2的浓度种植到48孔板中,并且用250μg/mlG418(GibcoBRL,GrandIsland,NY)或0.5μg/ml嘌呤霉素(InvivoGen,SanDiego,CA)选择。通过聚合酶链反应(PCR)就pCTLA4-Ig转基因筛选所选择的克隆,并且合并阳性克隆(8个具有WT背景,70个具有GTKO背景),并且用于核转移。如上所述对这些细胞实施核转移。动物在隔离屋中产崽,以使对于病原体的暴露降到最低,并且在出生时开始接受含有四环素的饲料(110g/kg饲料)且继续直到安乐死时。pCTLA4-Ig表达经由蛋白质印迹和免疫荧光进行评价,显示强表达。pCTLA4-Ig的血清浓度高,范围为约380-1,600μg/ml血清。pCTLA4-Ig转基因猪和非转基因同窝出生仔畜看起来健康约2个月的时期。在那个点时,转基因小猪开始显示病的体征,包括发热、全身不适、异常毛发生长,和在某些情况下,皮肤病灶。在已由母猪(其母亲)断奶且养在全群婴儿室(whole-herdnursery)中的WT/pCTLA4-Ig猪中,这些病是急性的,并且在症状变得明显后,死亡快速产生。到10-11周龄时,大多数转基因猪屈服于病或需要安乐死。这些窝中的非转基因同窝出生仔畜保持健康。组织学分析指出,如果没有预防处理,与其非转基因同窝出生仔畜比较,转基因猪具有低白血细胞(WBC)计数,范围为正常值的53%-71%。总淋巴细胞计数在这些动物中也是正常以下的,范围为正常值的14%-61%。在纯合GTKO背景上产生的CAG-pCTLA4-Ig转基因猪发展更慢性的病,并且尽管抗生素治疗,这些猪的健康继续恶化,并且在约10周龄时,对这些猪中的最后一只实施安乐死。与其CTLA4-转基因同胞一起饲养的4个非转基因同窝出生仔畜保持健康和活力(参见Phelps等人Xenotransplantation,16(6):477-485.2009)。实施例12.含有5种遗传修饰(GTKO、CD46和胰岛特异性TFPI、CTLA4-Ig和CD39)的猪的产生。执行来自胎儿548/A3(遗传修饰:纯合GTKO/CD46/TFPI/CTLA4-Ig)的细胞的转染,以加入pREV835(CD39)转基因。使用类似于实施例3中所述那些的程序,用pREV835转基因转染胎儿成纤维细胞。使用实施例5中所述的程序,收获99个集落并且就pREV835转基因的存在筛选。合并来自10个阳性集落的细胞并且制备用于在核转移中使用。使用合并的pREV835阳性细胞作为核供体且遵循实施例4中所述的程序,执行核转移。将胚胎转移至4只受体小母猪,并且建立2个妊娠。出生10只小猪;这些猪中的4只是出生活的。基因型分析指出4只活出生猪中的3只含有pREV835(CD39)转基因,加上来自548/A3系(GTKO/CD46/TFPI/CTLA4-Ig)的4种遗传修饰。就我们所知,这是已产生的包含超过4种遗传修饰的第一批猪。实施例13.当多转基因猪自然育种时,多转基因猪的生殖力和多重转基因至后代的稳定传递和共分离。雌性猪347-2(使用548/A3供体细胞通过NT产生的猪)与纯合的GTKO雄性猪的自然育种导致正常妊娠和出生11只小猪的窝,从而证实这种多转基因动物的生殖力。这些猪中的5只是出生活的。出生活的猪中的2只携带由其母兽(dam)传递的2个另外岛特异性(548/A3系)转基因(TFPI和CTLA4-Ig),以及亲本细胞系固有的GTKO和CD46遗传修饰。其他3个后代仅对于GTKO和CD46是阳性的。下表概括347-2后代的基因型(通过DNA分析测定的)。DNA分析指出对于TFPI转基因的所有动物对于CTLA4Ig也是转基因的;这暗示TFPI和CTLA4-Ig转基因在猪科基因组中共整合,在减数分裂过程中共分离,并且经由育种一起传递。通过育种548A3系产生的所得到的后代一起携带2个岛特异性转基因,或不携带任一岛特异性转基因。后代动物417-4的荧光原位杂交(FISH)分析正在进行中,以进一步分析这种共整合。在这个分析中,关于CTLA4Ig和TFPI的探针将用不同荧光标记进行标记,并且与染色体DNA杂交。2个探针在单个基因座上的杂交将指出这些转基因共整合且将在未来的猪代中一起继承。动物417-4同样饲养用于未来育种。实施例14.CD39阳性猪科岛细胞的ATP酶功能测定来自猪390-1的猪科岛的分离:胰腺组织得自动物390-1,实施例12中产生的具有5种遗传修饰的猪。将胰腺修剪掉脂肪且用冷HBSS+0.5mg/ml胶原酶P(RocheAppliedScience,Indianapolis,IN)注射。将胰腺加温至37℃共30分钟。随后将它置于冷HBSS中,并且使用镊子将器官拨开。分散的组织通过网筛(30目)运行,以去除大片组织。使用OptiprepTM(Axis-Shield,Oslo,Norway)方案纯化胰岛。将组织团块重悬浮于20mlRPMI和10mlOptiprep工作溶液(终浓度1.1g/ml)中。覆盖8ml1.085OptiprepTM,随后为10mlRPMI。将管以500xg在4℃旋转5分钟。取出顶部界面中存在的岛,并且染色样品以证实岛的存在。将岛在96孔板中在用于ATP酶测定的制备物中铺板。对390-1岛的ATP酶测定:CD39是催化ATP和ADP至AMP(从而释放磷酸盐)的细胞外酶。因此,测量磷酸盐释放的ATP酶生色测定(QuantiChromTMATPase/GTPaseAssayKit,BioAssaySystems(Hayward,CA)用于测定猪科岛中CD39转基因的功能性,其与从野生型猪中分离的岛比较。来自具有CD39的高水平遍在表达的猪(动物325.1)的胎儿成纤维细胞用作阳性对照。将细胞稀释以提供在96孔板的一行孔中的汇合,其中在第二行孔中1:10稀释。所有细胞接受用Tris缓冲盐水(TBS)的一次洗涤。将细胞冷冻过夜,解冻,并且合并6个汇合孔的内容物,并且悬浮于100ulTBS的终体积中。将这个体积分裂(50ul/ea)到2个1.5mlEppendorf管内。向每个管中加入:90ul2X样品稀释剂1.8ul100mMATP(终浓度1mM)或H2O38.2ulH2O。使反应混合物伴随振荡在37℃温育30分钟,并且随后以8000rpm离心。将10ul上清液与190ulH2O(1:20稀释度)混合。将80ul体积的这种稀释液加入96孔板上的第一行孔中。对于从1:20到1:2560的稀释度,沿着孔列向下进行2倍连续稀释。制备磷酸盐稀释物(0-50uM)且加入板中,以充当标准曲线。将来自ATP酶试剂盒的孔雀绿试剂(200ul)加入每个孔中,并且将板在室温温育45分钟。执行在OD620的读数,并且根据磷酸盐标准曲线通过内插法测定释放磷酸盐的浓度。如图8中所示,来自猪390-1的岛具有比野生型岛更高水平的释放磷酸盐,指出所表达的CD39转基因的功能性。实施例15.来自多转基因猪的胰腺组织的免疫荧光。在约3月龄时,从猪390-1(基因型:GTKO、CD46、TFPI、CTLA4-Ig和CD39转基因的)中收集胰腺组织的样品,并且如实施例7中所述通过IF进行表型表征。对于胰腺中的所有转基因蛋白质存在强烈染色:CD46、TFPI、CTLA4-Ig和CD39(图9);显著地在岛细胞组分中。还显示了在检查的组织中岛的胰岛素染色。TFPI、CTLA4-Ig和CD39的表达是岛特异性的,并且在测试的其他组织/器官中不可见(未显示)。所有同种型对照染色阴性(未显示)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1