猫儿屎的离体培养方法与流程
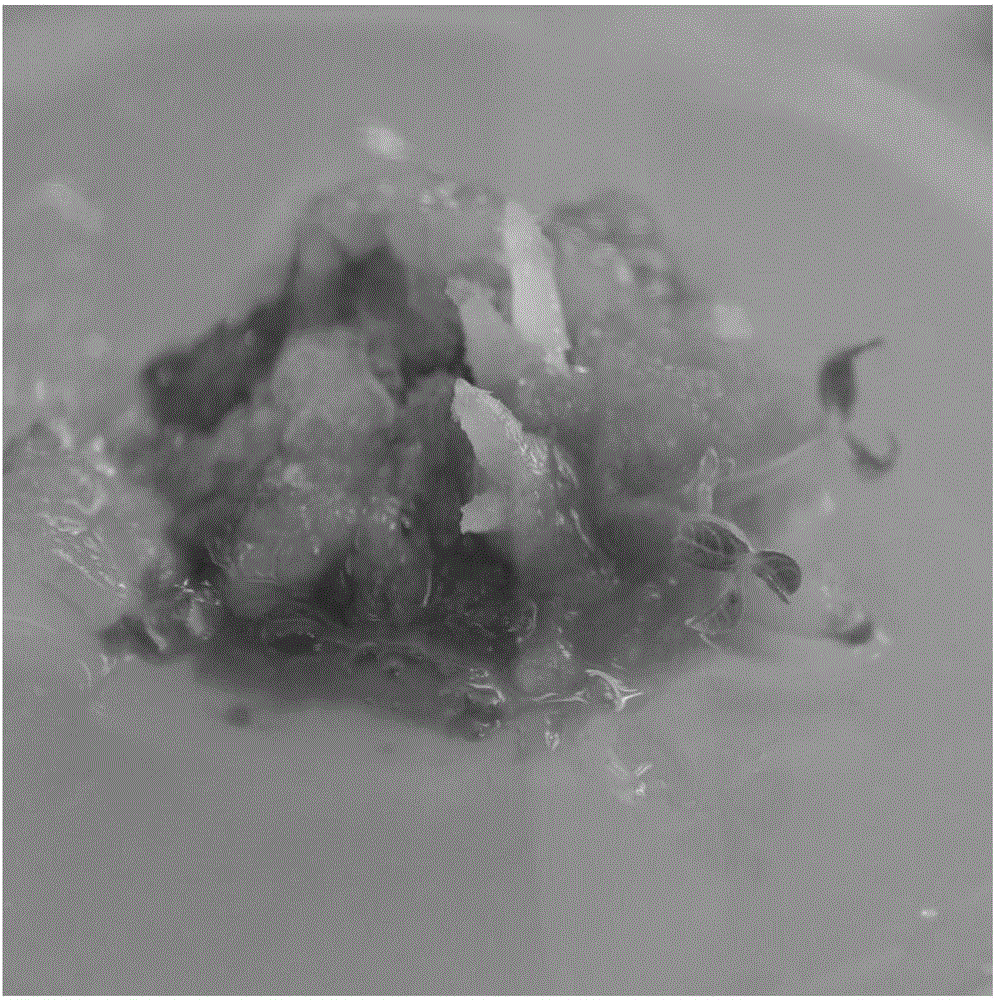
本发明涉及一种猫儿屎的离体培养方法。
背景技术:
猫儿屎(Decaisnea insignis(Griff.)Hook.f.et Thoms.)是木通科(Lardizabalaceae)猫儿屎属(Decaisnea)直立落叶灌木,广泛分布于我国西南部至中部地区,生长于海拔900-3600米的山坡灌丛或沟谷杂木林下阴湿处(应俊生等,2001)。猫儿屎又名猫屎瓜,来自于其果实成熟后,为蓝紫色长条状,稍弯曲,形似猫屎(侯运和等,2011)。
猫儿屎的果实为浆果,含有丰富的汁液,富含糖分,维生素和矿质营养等,可以作为水果食用,也可以用于生产果汁、酒和制糖;果皮中含有大量的橡胶成分,其比例可达10%-20%,可以用于橡胶产品的生产(侯运和等,2010),在今天石油资源日益枯竭的情况下,猫儿屎可视为非常珍贵的一种野生橡胶植物。猫儿屎种子中富含丰富的油脂,比例大约为18%-22%,出油率与棉籽相近,且油脂成分内含有大量的不饱和脂肪酸(刘继瑞等,2011),符合目前人们追求天然健康产品的理念,在开发药用植物油和保健品方面具有很大潜力(孙翔宇等2012),是一种具有很高经济效益的野生油料树种。猫儿屎的根部和果实可以入药,其味甘、辛,性平,有清肺止咳,祛风除湿,润燥的功能,主要用于治疗肺结核、咳嗽、阴痒和疝气等症(胡正海等,1991),通过小鼠体内实验表明猫儿屎茎中含有的多种化合物具有抗肿瘤的作用(孔杰,1996),可见猫儿屎具有很高的药用价值。猫儿屎树的花期和果期均长达4个月,在4-7月份开花,7-10月为结果期,花为淡绿色,果为蓝色或蓝紫色,在园林中具有很高的欣赏性(班荔等,2014)。此外,猫儿屎的叶片和果实也是神农架川金丝猴的主要食源植物之一(铁军等,2011)。
猫儿屎自身的适应能力极强,抗病虫害的能力也很突出,在其生长过程中,其根部发达,相互缠绕,地上的枝叶和茎生长茂盛,覆盖面积大,利于防止水土流失和土壤沙漠化(侯运和等,2011)。猫儿屎目前是我国尚未被开发利用的野生树种,可作为食用果树、药用果树和观赏用树种,潜在价值巨大,因此猫儿屎的引种栽培和推广利用的意义极其重大。
猫儿屎主要通过扦插、压条和分株等方式无性繁殖,母树植株受野生资源的分布和数量限制难以大规模繁育;猫儿屎种子种皮富含油脂,发芽慢且不整齐,发芽率低,采用有性繁殖方法存在实生苗生长周期长,出苗率不稳定等缺陷,无法满足生产和市场的需求。因此,探索快速繁殖猫儿屎的有效途径成为亟待解决的问题。组织培养具有需要材料量少、繁殖快、不受季节影响等特点,是快速繁殖木本植物一个重要方法。近年来,对于猫儿屎的组织培养研究仅有实生无菌苗、腋芽做外植体诱导不定芽发生(杨敬天等2009;郭邦利2013),分析了培养基的种类、植物生长调节剂的组合和配比对腋芽和不定芽的诱导影响,但繁殖系数较低。基于上述问题,迫切需要通过外植体、植物生长调节剂、基本培养基和培养条件的筛选,建立稳定高频发生猫儿屎的不定芽再生和快繁体系,提高其繁殖系数,为猫儿屎的种质资源保存、规模化繁殖、推广利用及生物技术育种提供良好的实验平台。
技术实现要素:
本发明的一个目的是解决至少上述问题和/或缺陷,并提供至少后面将说明的优点。
本发明再有一个目的是提供一种猫儿屎的离体培养方法。
为此,本发明提供的技术方案为:
一种猫儿屎的离体培养方法,包括:以未成熟果实的种胚作为外植体,依次经过愈伤组织的诱导、不定芽分化诱导、不定芽增殖培养和生根诱导培养获得猫儿屎再生植株。
优选的是,所述的猫儿屎的离体培养方法中,在进行愈伤组织的诱导之前,还包括:
外植体的灭菌:取猫儿屎幼嫩果实,首先在每100ml含6-10滴的洗洁净液中浸泡20-30min后刷洗表面,之后用水冲洗1-2h,然后在无菌环境中先用75%的酒精灭菌处理幼嫩果实30-60s,之后用每100ml含3-4滴土温40的0.1%HgCl2溶液对其灭菌15min,再用无菌水清洗4-6次,每次1-3min,最后取出幼嫩种子,挤出幼嫩种胚,使用无菌水漂洗所述幼嫩种胚后获得外植体。
优选的是,所述的猫儿屎的离体培养方法中,所述愈伤组织组织的诱导中,将所述外植体置于愈伤组织诱导培养基进行诱导32天得到愈伤组织,所述愈伤组织诱导培养基包含:MS、0.1-2.0mg/L的6-糠基氨基嘌呤和0.5-4.0mg/L的2,4-二氯苯氧乙酸。
优选的是,所述的猫儿屎的离体培养方法中,所述不定芽分化诱导中,将愈伤组织诱导培养得到的愈伤组织置于分化培养基上诱导30天产生不定芽,所述分化培养基包含:MS、0.1-2.0mg/L的6-苄基嘌呤(6-BA)和0.01-0.5mg/L的α-萘乙酸。
优选的是,所述的猫儿屎的离体培养方法中,所述不定芽增殖培养中,将不定芽分化诱导中得到的不定芽置于增殖培养基中诱导产生不定芽增殖15-30天,该增殖培养基包含:1/2MS、2.0-3.0mg/L的6-苄基嘌呤和0.2-1.0mg/L的α-萘乙酸。
优选的是,所述的猫儿屎的离体培养方法中,所述生根诱导培养中,将不定芽增殖培养中产生的不定芽置于生根诱导培养基上诱导生根,得到猫儿屎再生植株,所述生根诱导培养基包含:1/2MS和0.3-0.9mg/L咧哚丁酸或1/2MS和0.3-0.9mg/L的α-萘乙酸。
优选的是,所述的猫儿屎的离体培养方法中,所述愈伤组织的诱导、不定芽分化诱导、不定芽增殖培养和生根诱导培养中,培养条件为:温度25±2℃,光照时间16h/天,光照强度2000lux。
优选的是,所述的猫儿屎的离体培养方法中,在所述生根诱导培养获得猫儿屎再生植株之后还包括:
炼苗:将长至5-8cm高的猫儿屎再生植株于室外20-25℃下炼苗5-7天。
优选的是,所述的猫儿屎的离体培养方法中,在所述炼苗之后还包括:移栽:将炼苗之后的猫儿屎再生植株移栽入河沙和腐质土的混合基质中进行培养,河沙和腐质土的混合比例为0.5-1:1。
优选的是,所述的猫儿屎的离体培养方法中,所述未成熟果实为90天果龄的果实。
本发明至少包括以下有益效果:
本发明提供了资源植物猫儿屎的一种离体培养方法。该方法是以幼嫩种胚作为外植体,通过不定芽诱导途径得到再生植株。以幼嫩种胚作为外植体进行离体再生的优势在于诱导分化能力强,长期继代培养过程不易退化。本发明所述方法可高频率地诱导出大量的猫儿屎丛生不定芽,经过生根后再生植株移栽成活率高,可达98%。本发明为提高猫儿屎的繁殖系数、为该物种的种质保存及其推广应用奠定了良好的基础,应用前景广阔。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明所述猫儿屎的幼嫩种胚诱导的初始愈伤组织的照片;
图2为本发明所述猫儿屎的继代增殖的愈伤组织的照片;
图3为本发明所述猫儿屎的愈伤组织分化的丛生芽的照片;
图4为本发明所述猫儿屎的不定芽增殖获得较大幼苗的照片;
图5为本发明所述猫儿屎较大幼苗的健壮根系的照片;
图6为本发明所述移栽成活的猫儿屎幼苗的照片。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。
本发明提供一种猫儿屎的离体培养方法,包括:以未成熟果实的种胚作为外植体,依次经过愈伤组织的诱导、不定芽分化诱导、不定芽增殖培养和生根诱导培养获得猫儿屎再生植株。
在本发明的其中一个实施例中,作为优选,在进行愈伤组织的诱导之前,还包括:
外植体的灭菌:取猫儿屎幼嫩果实,首先在每100ml含6-10滴的洗洁净液中浸泡20-30min后刷洗表面,之后用水冲洗1-2h,然后在无菌环境中先用75%的酒精灭菌处理幼嫩果实30-60s,之后用每100ml含3-4滴土温40的0.1%HgCl2溶液对其灭菌15min,再用无菌水清洗4-6次,每次1-3min,最后取出幼嫩种子,挤出幼嫩种胚,使用无菌水漂洗所述幼嫩种胚后获得外植体。因为猫儿屎的果皮富含橡胶且腺点较多,表面容易粘结过多的灰尘,且不容易清洗。所以,在清洗的时候加入微量的洗洁净可以有效去除果皮粘结的灰尘,确保幼嫩果实更加洁净,为幼嫩种胚剥取和无菌培养提供基础。所述洗洁净为市售的普通无磷洗洁净即可。
在本发明的其中一个实施例中,作为优选,所述愈伤组织组织的诱导中,将所述外植体置于愈伤组织诱导培养基进行诱导32天得到愈伤组织,所述愈伤组织诱导培养基包含:MS、0.1-2.0mg/L的6-糠基氨基嘌呤和0.5-4.0mg/L的2,4-二氯苯氧乙酸。
在本发明的其中一个实施例中,作为优选,所述不定芽分化诱导中,将愈伤组织诱导培养得到的愈伤组织置于分化培养基上诱导30天产生不定芽,所述分化培养基包含:MS、0.1-2.0mg/L的6-苄基嘌呤(6-BA)和0.01-0.5mg/L的α-萘乙酸。
在本发明的其中一个实施例中,作为优选,所述不定芽增殖培养中,将不定芽分化诱导中得到的不定芽置于增殖培养基中诱导产生不定芽增殖15-30天,该增殖培养基包含:1/2MS、2.0-3.0mg/L的6-苄基嘌呤和0.2-1.0mg/L的α-萘乙酸。
在本发明的其中一个实施例中,作为优选,所述生根诱导培养中,将不定芽增殖培养中产生的不定芽置于生根诱导培养基上诱导生根,得到猫儿屎再生植株,所述生根诱导培养基包含:1/2MS和0.3-0.9mg/L咧哚丁酸或1/2MS和0.3-0.9mg/L的α-萘乙酸。
在本发明的其中一个实施例中,作为优选,所述愈伤组织的诱导、不定芽分化诱导、不定芽增殖培养和生根诱导培养中,培养条件为:温度25±2℃,光照时间16h/天,光照强度2000lux。
在本发明的其中一个实施例中,作为优选,在所述生根诱导培养获得猫儿屎再生植株之后还包括:
炼苗:将长至5-8cm高的猫儿屎再生植株于室外20-25℃下炼苗5-7天。
在本发明的其中一个实施例中,作为优选,在所述炼苗之后还包括:移栽:将炼苗之后的猫儿屎再生植株移栽入河沙和腐质土的混合基质中进行培养,河沙和腐质土的混合比例为0.5-1:1。
在本发明的其中一个实施例中,作为优选,所述未成熟果实为90天果龄的果实。
在本发明的其中一个实施例中,本发明所述猫儿屎的离体培养方法具体包括以下步骤:
⑴外植体灭菌:
选取猫儿屎幼嫩果实,在浓度例如为每100ml含6-10滴的洗洁净液中浸泡20-30min后刷洗表面,然后用自来水冲1-2h备用。超净工作台内对幼嫩果实先用75%的酒精灭菌处理30-60s,用每100ml含3-4滴土温40的0.1%HgCl2溶液灭菌15min,用无菌水清洗4-6次,每次1-3min。戴无菌手套剥取果实内幼嫩种子,挤出幼嫩种胚,无菌水漂洗后作为外植体接种。所述洗洁净为市售的普通无磷洗洁净即可。
⑵愈伤组织的诱导:以灭菌处理后未成熟果实中幼嫩种胚为外植体,将其置于愈伤组织诱导培养基上诱导愈伤组织;在温度25±2℃,光照时间16h/天,光照强度2000Lux的条件下培养32天。所述愈伤组织诱导培养基是在MS培养基的基础上添加了6-糠基氨基嘌呤(KT)和2,4-二氯苯氧乙酸(2,4-D);其中6-糠基氨基嘌呤(KT)的浓度为0.1-2.0mg/L,优选为0.1mg/L,2,4-二氯苯氧乙酸(2,4-D)的浓度为0.5-4.0mg/L,优选为2.0mg/L。
⑶不定芽分化培养:将所述愈伤诱导培养获得的愈伤组织接种到不定芽分化培养基上,在温度25±2℃,光照时间16h/天,光照强度2000lux的条件下进行培养30天。所述不定芽分化培养基为:在MS培养基的基础上添加了6-苄基腺嘌呤(6-BA)和α-萘乙酸(NAA)。所述分化培养基中6-苄基腺嘌呤的浓度为0.1-2.0mg/L,优选为2.0mg/L,α-萘乙酸的浓度为0.01-0.5mg/L,优选为0.5mg/L;
⑷不定芽增殖培养:将所述分化培养步骤获得的不定芽幼苗剪切成单芽点小茎段,接种在不定芽增殖培养基中,在温度25±2℃,光照时间16h/天,光照强度2000lux的条件下进行培养15-30天。所述不定芽增殖培养基为:在1/2MS基本培养基的基础上添加了6-苄基腺嘌呤(6-BA)和α-萘乙酸(NAA)。所述增殖培养基中6-苄基腺嘌呤的浓度为2.0-3.0mg/L,优选为3.0mg/L,α-萘乙酸的浓度为0..2-1.0mg/L,优选为0.5mg/L;
⑸生根培养和植株再生:将健壮不定芽分离出单株置于生根培养基上诱导生根,在温度25±2℃,光照时间16h/天,光照强度2000lux的条件下进行培养15-30天。所述生根培养基为添加了浓度为0.3-0.9mg/L的咧哚丁酸(IBA)或α-萘乙酸(NAA),优选为0.6mg/L的α-萘乙酸;
⑹炼苗和移栽:将步骤⑸中经生根培养后得到的再生植株进行移栽方法为:待再生植株长至5-8cm高、根系密集健壮时,移出培养室后逐渐打开封口膜,使再生植株与自然空气接触,在20-25℃下炼苗5-7天即可移栽。将经过炼苗的再生植株移栽到河沙和腐质土的混合基质中栽植,混合基质中沙土和腐质土的比例为0.5-1:1。移至温室栽培管理,移栽成活率可达98%。
实施例1、猫儿屎的离体培养
MS基本培养基:可参照文献(Murashige T,Skoog F.A revised medium for rapid grouth and bioassays with tobacco tissue cultures.Physiol.Plant,1962,15:473-497)配制。
本发明所述猫儿屎的离体培养方法,包括以下步骤:
(1)幼嫩果实外植体的灭菌
取猫儿屎幼嫩果实,在浓度为每100ml含6-10滴的洗洁净液中浸泡30min后刷洗表面,然后用自来水冲2h,置于超净工作台内对幼嫩果实先用75%的酒精浸泡60s,随后用每100ml含4滴土温40的0.1%HgCl2溶液灭菌15min,用无菌水清洗5次。戴无菌手套剥取果实内幼嫩种子,挤出幼嫩种胚,无菌水漂洗后作为外植体接种。
(2)愈伤组织的诱导
优选的愈伤组织诱导培养基是在MS基本培养基的基础上添加了0.1mg/L的KT和2.0mg/L的2,4-D。
以步骤⑴幼嫩种胚为外植体,将其接种于上述愈伤组织诱导培养基上,例如每个培养皿中接种15粒,每个组合接种10个培养皿,在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导愈伤组织。
如图1所示,外植体接种7天后,胚根和子叶开始愈伤化,培养30天后形成大块淡绿色愈伤组织,诱导率可达92%。在继代增殖培养过程中,少数愈伤组织有零星不定芽分化产生(图2)。
⑶不定芽分化诱导培养
优选的分化培养基是在MS基本培养基的基础上添加了2.0mg/L的6-BA和0.5mg/L的NAA。
将步骤⑵中诱导30天愈伤组织转接入上述培养基上进行不定芽分化诱导培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,愈伤组织表面分化大量不定芽(图3)。
⑷不定芽增殖培养
优选的不定芽增殖培养基是在1/2MS基本培养基的基础上添加了3.0mg/L的6-BA和0.5mg/L的NAA。
将步骤⑶中获得4-7cm高的较大幼苗剪切成单芽点小茎段(带1-2片叶),每个幼苗平均可剪切成3段,插于增殖培养基中培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,小茎段基部增殖产生丛生不定芽,每个茎段平均可增殖产生5个不定芽,则每个幼苗平均增殖产生15个不定芽,即繁殖系数可达15(图4)。
⑸生根培养和植株再生
优选的生根培养基是在1/2MS培养基(包含的大量元素为MS基本培养基全量的1/2)的基础上添加了0.6mg/L的NAA。
将步骤⑷获得的丛生不定芽分离出单株转接到生根培养基上在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导生根。生根培养7天左右不定芽基部逐渐长出白色嫩根,15d左右不定根长度达到1cm左右,经过30d左右的培养,不定根可长达4-6cm,形成健壮密集根系(图5),获得完整再生植株,生根率可达95%。
⑹炼苗和移栽
将步骤⑸中经生根培养后得到的再生植株进行移栽方法为:待再生植株长至5-8cm高、根系密集健壮时,移出培养室后逐渐打开封口膜,使再生植株与自然空气接触,在20-25℃下炼苗5-7天即可移栽。将经过炼苗的再生植株移栽到0.5-1:1比例的河沙和腐质土混合基质中,移至温室栽培管理,成活率可达98%(图6)。
实施例2、猫儿屎的离体培养
MS基本培养基:可参照文献(Murashige T,Skoog F.Arevised medium for rapid grouth and bioassays with tobacco tissue cultures.Physiol.Plant,1962,15:473-497)配制。
本发明所述猫儿屎的离体培养方法,包括以下步骤:
⑴幼嫩果实外植体的灭菌
取猫儿屎幼嫩果实,在浓度为每100ml含4-8滴的洗洁净液中浸泡20min后刷洗表面,然后用自来水冲1h,置于超净工作台内对幼嫩果实先用70%的酒精浸泡40s,随后用每100ml含3滴土温40的0.1%HgCl2溶液灭菌15min,用无菌水清洗4次。戴无菌手套剥取果实内幼嫩种子,挤出幼嫩种胚,无菌水漂洗后作为外植体接种。
⑵愈伤组织的诱导
愈伤组织诱导培养基是在MS基本培养基的基础上添加了1.0mg/L的KT和1.0mg/L的2,4-D。
以步骤⑴幼嫩种胚为外植体,将其接种于上述愈伤组织诱导培养基上,例如每个培养皿中接种15粒,每个组合接种10个培养皿,在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导愈伤组织。
外植体接种7天后,胚根和子叶开始愈伤化(图),培养30天后形成大块淡绿色愈伤组织,诱导率可达86%。在继代增殖培养过程中,少数愈伤组织有零星不定芽分化产生(图2)。
(3)不定芽分化诱导培养
分化培养基是在MS基本培养基的基础上添加了2.0mg/L的6-BA和0.1mg/L的NAA。
将步骤⑵中诱导30天愈伤组织转接入上述培养基上进行不定芽分化诱导培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,愈伤组织表面分化大量不定芽(图3)。
(4)不定芽增殖培养
不定芽增殖培养基是在1/2MS基本培养基的基础上添加了3.0mg/L的6-BA和1.0mg/L的NAA。
将步骤⑶中获得4-7cm高的较大幼苗剪切成单芽点小茎段(带1-2片叶),每个幼苗可切成3段,置于增殖培养基中培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,小茎段基部增殖产生丛生不定芽,每个茎段平均可增殖产生4个不定芽,则每个幼苗平均增殖产生12个不定芽,即繁殖系数可达12(图4)。
(5)生根培养和植株再生
生根培养基是在1/2MS培养基(包含的大量元素为MS基本培养基全量的1/2)的基础上添加了0.6mg/L的IBA。
将步骤(4)获得的丛生不定芽分离出单株转接到生根培养基上在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导生根。生根培养15d左右不定根长度达到1cm左右,经过30d左右的培养,不定根可长达4-6cm,形成健壮密集根系(图5),获得完整再生植株,生根率可达90%。
(6)炼苗和移栽
将步骤(5)中经生根培养后得到的再生植株进行移栽方法为:待再生植株长至6-8cm高、根系密集健壮时,移出培养室后逐渐打开封口膜,使再生植株与自然空气接触,在20-25℃下炼苗5-7天即可移栽。将经过炼苗的再生植株移栽到0.5-1:1比例的河沙和腐质土混合基质中,移至温室栽培管理,成活率可达95%(图6)。
实施例3、猫儿屎的离体培养
MS基本培养基:可参照文献(Murashige T,Skoog F.Arevised medium for rapid grouth and bioassays with tobacco tissue cultures.Physiol.Plant,1962,15:473-497)配制。
本发明所述猫儿屎的离体培养方法,包括以下步骤:
(1)幼嫩果实外植体的灭菌
取猫儿屎幼嫩果实,在浓度为每100ml含6-10滴的洗洁净液中浸泡30min后刷洗表面,然后用自来水冲2h,置于超净工作台内对幼嫩果实先用75%的酒精浸泡60s,随后用每100ml含5滴土温40的0.1%HgCl2溶液灭菌15min,用无菌水清洗5次。戴无菌手套剥取果实内幼嫩种子,挤出幼嫩种胚,无菌水漂洗后作为外植体接种。
(2)愈伤组织的诱导
优选的愈伤组织诱导培养基是在MS基本培养基的基础上添加了1.0mg/L的KT和3.0mg/L的2,4-D。
以步骤⑴幼嫩种胚为外植体,将其接种于上述愈伤组织诱导培养基上,例如每个培养皿中接种15粒,每个组合接种10个培养皿,在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导愈伤组织。
如图1所示,外植体接种7天后,胚根和子叶开始愈伤化,培养30天后形成大块淡绿色愈伤组织,诱导率可达92%。在继代增殖培养过程中,少数愈伤组织有零星不定芽分化产生(图2)。
⑶不定芽分化诱导培养
优选的分化培养基是在MS基本培养基的基础上添加了1.0mg/L的6-BA和0.01mg/L的NAA。
将步骤⑵中诱导30天愈伤组织转接入上述培养基上进行不定芽分化诱导培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,愈伤组织表面分化大量不定芽(图3)。
⑷不定芽增殖培养
优选的不定芽增殖培养基是在1/2MS基本培养基的基础上添加了2.0mg/L的6-BA和0.2mg/L的NAA。
将步骤⑶中获得4-7cm高的较大幼苗剪切成单芽点小茎段(带1-2片叶),每个幼苗平均可剪切成3段,插于增殖培养基中培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,小茎段基部增殖产生丛生不定芽,每个茎段平均可增殖产生5个不定芽,则每个幼苗平均增殖产生15个不定芽,即繁殖系数可达15(图4)。
⑸生根培养和植株再生
优选的生根培养基是在1/2MS培养基(包含的大量元素为MS基本培养基全量的1/2)的基础上添加了0.3mg/L的NAA。
将步骤⑷获得的丛生不定芽分离出单株转接到生根培养基上在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导生根。生根培养7天左右不定芽基部逐渐长出白色嫩根,15d左右不定根长度达到1cm左右,经过30d左右的培养,不定根可长达4-6cm,形成健壮密集根系(图5),获得完整再生植株,生根率可达95%。
⑹炼苗和移栽
将步骤⑸中经生根培养后得到的再生植株进行移栽方法为:待再生植株长至5-8cm高、根系密集健壮时,移出培养室后逐渐打开封口膜,使再生植株与自然空气接触,在20-25℃下炼苗5-7天即可移栽。将经过炼苗的再生植株移栽到0.5-1:1比例的河沙和腐质土混合基质中,移至温室栽培管理,成活率可达98%(图6)。
实施例4、猫儿屎的离体培养
MS基本培养基:可参照文献(Murashige T,Skoog F.Arevised medium for rapid grouth and bioassays with tobacco tissue cultures.Physiol.Plant,1962,15:473-497)配制。
本发明所述猫儿屎的离体培养方法,包括以下步骤:
⑴幼嫩果实外植体的灭菌
取猫儿屎幼嫩果实,在浓度为每100ml含4-8滴的洗洁净液中浸泡20min后刷洗表面,然后用自来水冲1h,置于超净工作台内对幼嫩果实先用70%的酒精浸泡40s,随后用每100ml含3滴土温40的0.1%HgCl2溶液灭菌15min,用无菌水清洗4次。戴无菌手套剥取果实内幼嫩种子,挤出幼嫩种胚,无菌水漂洗后作为外植体接种。
⑵愈伤组织的诱导
愈伤组织诱导培养基是在MS基本培养基的基础上添加了1.0mg/L的KT和4.0mg/L的2,4-D。
以步骤⑴幼嫩种胚为外植体,将其接种于上述愈伤组织诱导培养基上,例如每个培养皿中接种15粒,每个组合接种10个培养皿,在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导愈伤组织。
外植体接种7天后,胚根和子叶开始愈伤化(图),培养30天后形成大块淡绿色愈伤组织,诱导率可达86%。在继代增殖培养过程中,少数愈伤组织有零星不定芽分化产生(图2)。
(3)不定芽分化诱导培养
分化培养基是在MS基本培养基的基础上添加了2.0mg/L的6-BA和0.1mg/L的NAA。
将步骤⑵中诱导30天愈伤组织转接入上述培养基上进行不定芽分化诱导培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,愈伤组织表面分化大量不定芽(图3)。
(4)不定芽增殖培养
不定芽增殖培养基是在1/2MS基本培养基的基础上添加了3.0mg/L的6-BA和1.0mg/L的NAA。
将步骤⑶中获得4-7cm高的较大幼苗剪切成单芽点小茎段(带1-2片叶),每个幼苗可切成3段,置于增殖培养基中培养,在温度25±2℃,光照时间16h/天,光照强度2000lux下培养30天后,小茎段基部增殖产生丛生不定芽,每个茎段平均可增殖产生4个不定芽,则每个幼苗平均增殖产生12个不定芽,即繁殖系数可达12(图4)。
(5)生根培养和植株再生
生根培养基是在1/2MS培养基(包含的大量元素为MS基本培养基全量的1/2)的基础上添加了0.9mg/L的IBA。
将步骤(4)获得的丛生不定芽分离出单株转接到生根培养基上在温度25±2℃,光照时间16h/天,光照强度2000Lux下诱导生根。生根培养15d左右不定根长度达到1cm左右,经过30d左右的培养,不定根可长达4-6cm,形成健壮密集根系(图5),获得完整再生植株,生根率可达90%。
(6)炼苗和移栽
将步骤(5)中经生根培养后得到的再生植株进行移栽方法为:待再生植株长至6-8cm高、根系密集健壮时,移出培养室后逐渐打开封口膜,使再生植株与自然空气接触,在20-25℃下炼苗5-7天即可移栽。将经过炼苗的再生植株移栽到0.5-1:1比例的河沙和腐质土混合基质中,移至温室栽培管理,成活率可达95%(图6)。
这里说明的模块数量和处理规模是用来简化本发明的说明的。对本发明的猫儿屎的离体培养方法的应用、修改和变化对本领域的技术人员来说是显而易见的。
如上所述,根据本发明,由于以幼嫩种胚作为外植体进行离体再生,因此具有长期继代培养且过程不易退化的效果。本发明为提高猫儿屎的繁殖系数、为该物种的种质保存及其推广应用奠定了良好的基础,应用前景广阔。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
- 还没有人留言评论。精彩留言会获得点赞!