一种降低冷冻保存卵母细胞冻融后细胞器损伤的方法与流程
本发明涉及一种降低冷冻保存细胞冻融后细胞器损伤的方法。
背景技术:
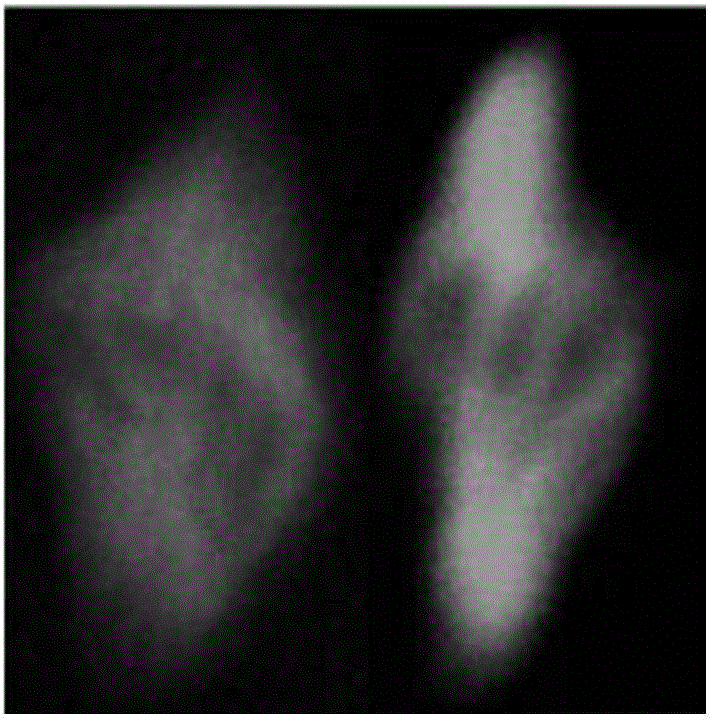
:哺乳动物卵母细胞的超低温保存,是指在超低温(-196℃)条件下抑制细胞内一切新陈代谢活动,并使细胞被长期保存,之后按一定方式解冻,又能恢复其受精、卵裂等发育潜能的一种保存技术。玻璃化冷冻法因使用高浓度的冷冻保护液在液氮中能形成类似玻璃状稳定而透明的非晶体化固体物质状态而得名。因为冷冻液在液氮中形成的是一种非晶体物质状态,因而避免了慢速冷冻过程中细胞所遭受的机械损伤,同时不需要昂贵的程序降温仪,简化了步骤,节省了时间,逐渐成为胚胎和卵母细胞冷冻的趋势。然而,高浓度冷冻保护剂对细胞有较大的化学毒性,且产生渗透压应激。研究表明,卵母细胞暴露于高渗溶液中增加卵母细胞纺锤体、染色体异常比例,线粒体分布异常(Hotamisligiletal.,1996),从而降低卵母细胞受精后的发育能力。技术实现要素:本发明是为了解决现有高浓度冷冻保护剂对细胞有较大的化学毒性,导致卵母细胞纺锤体、染色体异常比例增加,线粒体分布异常的问题,而提供的一种降低冷冻保存卵母细胞冻融后细胞器损伤的方法。本发明降低冷冻保存卵母细胞冻融后细胞器损伤的方法,其中用甜菜碱作为卵母细胞冷冻保存的细胞器保护剂。将甜菜碱加入平衡液、冷冻液、解冻液和基础液。一种降低冷冻保存卵母细胞冻融后细胞器损伤的方法:一、冷冻:GV期卵母细胞在500μl平衡液中平衡3分钟后移入冷冻液中,迅速将3~5个卵丘卵母细胞复合体(COCs)转移到冷冻环上,再投入液氮;二、解冻:液氮冷冻的卵母细胞先在解冻液Ⅰ中静置3分钟后转入解冻液Ⅱ中静置3分钟,再移入基础液中静置3分钟。本发明甜菜碱用于保护超低温(-196℃)条件下冷冻保存的卵母细胞的细胞器。在甜菜碱的保护下超低温冷冻保存的卵母细胞的纺锤体正常率达50%以上、染色体正常率达48%以上,线粒体排布正常率达56%以上。附图说明图1是卵母细胞正常纺锤体和染色体的分布图。图2是卵母细胞异常纺锤体和染色体的分布图。图3是卵母细胞正常线粒体分布图。图4是卵母细胞异常线粒体分布图。具体实施方式本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。具体实施方式一:本实施方式一种降低冷冻保存卵母细胞冻融后细胞器损伤的方法,其中用甜菜碱作为卵母细胞冷冻保存的细胞器保护剂。具体实施方式二:本实施方式与具体实施方式一的不同点是:将甜菜碱加入平衡液、冷冻液、解冻液和基础液。其它步骤及参数与实施方式一相同。具体实施方式三:本实施方式与具体实施方式二的不同点是:解冻液包括解冻液Ⅰ和解冻液Ⅱ。其它步骤及参数与实施方式二相同。具体实施方式四:本实施方式与具体实施方式二或三的不同点是:甜菜碱在平衡液、冷冻液、解冻液和基础液中的浓度为0.2~1mmol/L。其它步骤及参数与实施方式二或三相同。具体实施方式五:本实施方式与具体实施方式二或三的不同点是:甜菜碱在平衡液、冷冻液、解冻液和基础液中的浓度为0.5mmol/L。其它步骤及参数与实施方式二或三相同。具体实施方式六:本实施方式与具体实施方式一至五之一的不同点是:甜菜碱在卵母细胞冷冻保存领域的应用:一、冷冻:GV期卵母细胞在500μl平衡液中平衡3分钟后移入冷冻液中,迅速将3~5个卵丘卵母细胞复合体转移到冷冻环上,再投入液氮;二、解冻:液氮冷冻的卵母细胞先在解冻液Ⅰ中静置3分钟后转入解冻液Ⅱ中静置3分钟,再移入基础液中静置3分钟。其它步骤及参数与实施方式一至五之一相同。本实施方式步骤二解冻过程均在37℃下进行。具体实施方式七:本实施方式与具体实施方式六的不同点是:基础液为添加了血清和甜菜碱的基础培养液,基础液中血清的体积浓度为10%、甜菜碱的浓度为0.5mmol/L;平衡液为基础液+7.5%v/v乙二醇+7.5%v/vDMSO+0.25M海藻糖;冷冻液为基础液+15%v/v乙二醇+15%v/vDMSO;解冻液Ⅰ为基础液+1M海藻糖;解冻液Ⅱ为基础液+0.5M海藻糖。其它步骤及参数与实施方式六相同。本实施方式中基础培养液为DMEM培养液、TCM199培养液、M16培养液或MEM培养液;血清为小牛血清、胎牛血清或新生牛血清。实施例1一、冷冻:小鼠GV期卵母细胞在500μl平衡液中平衡3分钟后移入冷冻液中,迅速将3~5个COCs转移到冷冻环上,再投入液氮;二、解冻:液氮冷冻的卵母细胞先在解冻液Ⅰ中静置3分钟后转入解冻液Ⅱ中静置3分钟,再移入基础液中静置3分钟,解冻过程均在37℃下进行。三、卵母细胞体外成熟:卵母细胞体外成熟液的配制:TCM199培养液(购自GIBCO公司)中加入5ml胎牛血清和5000IU青霉素及5000μg链霉素,轻微搅拌混匀,再加入FSH2.5IU、LH2.5IU、17β-雌二醇50μg、丙酮酸钠1.21mg和EGF500ng,轻轻混匀,静置2~3小时后,用0.22μm的过滤器抽滤消毒后,分装到1.5ml离心管中,4℃下储存,备用。卵母细胞体外成熟培养:将步骤二解冻的小鼠GV期卵母细胞放入37℃预热2小时的卵母细胞体外成熟培养液中,然后置于CO2体积浓度为5%的环境内成熟培养14小时或24小时;本实施例中基础液为添加了胎牛血清和甜菜碱的MEM培养液,基础液中胎牛血清的体积浓度为10%、甜菜碱的浓度为0.5mmol/L;平衡液为基础液+7.5%v/v乙二醇+7.5%v/vDMSO+0.25M海藻糖;冷冻液为基础液+15%v/v乙二醇+15%v/vDMSO;解冻液Ⅰ为基础液+1M海藻糖;解冻液Ⅱ为基础液+0.5M海藻糖。图1是卵母细胞正常纺锤体和染色体的分布图,图2是卵母细胞异常纺锤体和染色体的分布图。图3是卵母细胞正常线粒体分布图,图4是卵母细胞异常线粒体分布图。实施例2与实施例1的区别在于基础液为添加了胎牛血清和甜菜碱的M16培养液。实施例3与实施例1的区别在于基础液为仅添加了胎牛血清的基本培养液(不含甜菜碱)。实验线粒体分布检测:将各实施例步骤三中体外成熟的卵母细胞脱去卵丘细胞,将卵母细胞置于包含200μMMitotrackerRed(MitotrackerRedFM;MolecularProbes,Eugene,OR,USA)中37℃条件下孵育30分钟,清洗过后固定于4%的多聚甲醛中20分钟,之后用PBS清洗三次,转移到0.5%TritonX-100中20分钟,转移到DAPI中,压片观察,实验结果如表1所示。纺锤体组装和染色体排布检测:将各实施例步骤三中体外成熟的卵母细胞脱去卵丘细胞后,固定于4%多聚甲醛中60分钟,PBS清洗3次后,转移到穿透液中(PBS加5%FBS和0.01%TritonX-100),4℃过夜;之后用anti-a-tubulin(带有FITC)单克隆抗体(1:500稀释)孵育60分钟。PBS洗涤后转移到DAPI中,压片观察,实验结果如表2所示。表1玻璃化冷冻保存后线粒体正常和异常比例正常(%)异常(%)实施例156.243.8实施例248.351.7实施例339.460.6表2玻璃化冷冻保存后纺锤体和染色体正常和异常比例实验结果证明本发明甜菜碱的应用可以提高冷冻保存卵母细胞的纺锤体排布正常率、染色体正常排布率、线粒体分布正常比例。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1