一种利用水杨酸进行杂交鹅掌楸体胚发生的方法与流程
本发明属于组培苗
技术领域:
,具体涉及一种利用水杨酸(SA)进行杂交鹅掌楸体胚发生的方法。
背景技术:
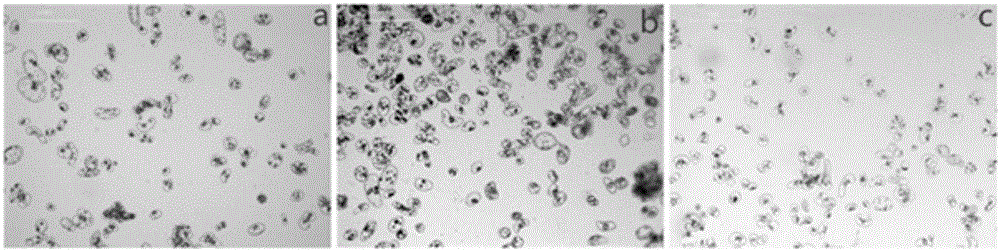
:近年来,人们不断地加大对植物体细胞胚胎发生的研究,使其在几十年内得到了快速的发展,并取得很大的成果。由于体细胞诱导产生的体胚具备发生数量多、生长速度快、结构完整、繁殖效率高等特点,使体胚发生技术成为植物快速繁殖的有效手段,有利于保存优良的林木品种、缩短优良品种培育时间、加快产业化的发展等,在林业的发展中具有重要意义。植物体细胞胚胎发生是细胞工程中植株再生的有效途径,它可以在一些植物尤其是木本植物生长繁殖周期较长,或者有的植物种子难以萌发中发挥巨大作用。体胚发生主要分为诱导胚性愈伤组织的形成和体胚的形态建成。第一阶段选择外植体,选取未成熟胚、根、茎、叶、花器官等组织诱导形成胚性愈伤组织;第二阶段诱导胚性愈伤组织分化形成体细胞胚。胚性细胞经过一系列的发育形成球形胚,最终形成子叶胚,子叶胚再经进一步培养形成完整的植株。植物直接的体细胞胚胎发生是在外植体包括器官、组织、细胞等直接发育分化成体细胞胚。而间接体胚发生是外植体形成愈伤愈伤组织后进一步发育成体细胞胚,或者形成胚性愈伤组织后经过悬浮培养后形成体细胞胚。林木体细胞胚胎研究起源于20世纪70年代Rao等对檀香的体细胞胚胎发生的研究。尽管大部分木本植物的体胚发生存在一定难度,但几十年的努力,木本植物通过体胚发生形成再生植株已经达到二百种以上,还有一些用材树种的体胚发生的研究也取得新进展。马尾松、火炬松等部分裸子植物的体细胞胚胎发生体系已经较成熟,能够组织培养技术实现植株再生。陈金慧等首次成功建立杂交鹅掌楸体细胞胚胎发生体系,并进一步诱导出体胚苗,加快杂交鹅掌楸的产业化发展。体胚发生时,外界因素诱导内部发生变化或内部自身因素使调控基因表达,从而完成植物体胚的发生。其主要的影响因素有:外植体选择、基因型、培养基的选择、环境条件、生长调节物质等。其中植物激素在体胚发生中起到不可替代的作用。1)基因型与外植体的选择只要是活的植物组织或器官都可作为组织培养的材料。体胚发生会因外植体的状态、类型、基因型等因素的不同而存在很大差异。在进行组织培养过程中,选择的外植体器官分化程度低并且生理状态较好,可以大大提升体胚发生诱导率。因此在进行组织诱导时,通常选择生理状态好、品质优良的材料,可以加大植物体胚诱导的成功率。由于植物基因型的不同,使得体细胞胚诱导时在激素的使用、培养条件等方面都存在差异。不同基因型的体细胞胚诱导效率存在较大差异,有可能是因为不同基因型的最佳培养条件不同。黄璐等诱导胚性愈伤组织和体胚发生时,发现不同基因型的体胚诱导率存在差异。2)培养基的选择通常培养基主要由碳水化合物、氮源、无机盐、维生素等成分组成,每个组成部分都起到重要作用。其中氮源对体细胞胚胎发生有较大的影响。崔凯荣等在培养基中加不同比例的硝态氮及氨态氮诱导枸杞体胚发生时,发现当培养基中只加氨态氮不加硝态氮时,枸杞体细胞胚胎发生诱导率最高。3)环境条件通常暗培养环境下有利于木本植物胚性愈伤组织的诱导,待体胚进行成熟培养时则需要光照,光照也有利于降低畸形率。虽然黑暗与光照条件下都可以诱导胚性愈伤组织,但在光照条件下诱导产生的胚性愈伤组织可能会褐化或者体胚再生频率不高。陈金慧等在研究杂交鹅掌楸体细胞胚胎发生时,发现暗环境有利于胚性愈伤组织生长和体胚发生,体胚发生后及时移至光照条件下培养,有利于体胚发育和植株再生。温度也是影响体胚发生的重要因素。高温或低温都有可能影响胚性愈伤组织的体胚发生能力。陈小鹏在黄瓜的体胚发生研究中发现高温会导致体胚数量减少,降低体胚诱导率。张宇等在研究水曲柳的体胚发生中,发现低温处理后能够促进体胚同步化。4)外源激素在体胚发生中的作用植物激素在一定浓度下能够调控植物生理反应,在生长发育、成熟衰老等方面发挥最重要作用。在植物体胚发生过程中植物激素的选择是至关重要的。植物体胚发生所需要的植物激素及含量是不同的,即使同种植物在诱导体胚发生中的不同阶段所需植物激素也是不同的。从大多数的报道看,生长素是体细胞胚分裂所必需的,可促使内源生长素的增加,进而促进细胞分裂和内源激素平衡,最终促使细胞进入胚胎状态。对大多数植物来说,除了生长素,体胚发生还需要细胞分裂素。6-BA(细胞分裂素)有利于愈伤组织的形成。KT则有助于改善愈伤组织的质量。近年有研究发现TDZ活性更高,已经诱导出体胚,如花生的体胚诱导。许多研究都证实ABA在许多植物体胚的不同阶段都一定的促进作用。对一些植物的ABA突变体进行研究,发现在植物体胚成熟阶段ABA发挥重要功能,有利于体细胞胚胎后期的发育。许多植物的体胚诱导过程中ABA都能够刺激体细胞胚成熟,能够有效提高体胚发生率。由于树种特性的不同,一些植物在体细胞胚胎发生中添加外源ABA不利于体胚发生或者抑制体胚发生,如火炬松、白云松等。水杨酸(salicylicacid,SA)是植物体内普遍存在的一种简单的小分子酚类化合物,化学名称为“邻羟基苯甲酸”,是肉桂酸的衍生物。它是从柳树皮分离出的活性成分。1938年RaffaelePiria将这组有效组分命名为水杨酸。1992年,Raskin提出可以把SA看成是一种新的植物内源激素。20世纪60年代后,人们开始发现SA在植物中具有重要的生理作用。在植物生长发育过程中,SA能有效的调控植物的发育、成熟和衰老。并且在一些逆境环境中,如干旱、盐碱、重金属、低温等条件下,它能有效的减缓这些非生物胁迫。研究发现包括水稻、大豆、大麦等作物在内的34种植物叶片和生殖器官含有水杨酸,含量大于1μg/g鲜重,说明它在植物界中是普遍存在的。SA以游离态和结合态两种形式存在于植物体内。游离态SA呈晶状体,结合态SA是由SA于核苷、糖脂、甲基或氨基酸结合形成的,易溶于极性有机溶剂,微溶于水,饱和水溶液的pH呈酸性其值为2.4。水杨酸作为一种新型植物激素,可调节植物生理反应,在植物生长、发育和抗性等方面具有重要影响。近年来,对水杨酸的抗性研究较多,其他领域的研究较少,尤其是在植物组织或细胞离体培养条件下促进细胞生长分化,诱导体胚发生等方面作用鲜见报道。技术实现要素:发明目的:针对现有技术中存在的不足,本发明的目的是提供一种利用水杨酸进行杂交鹅掌楸体胚发生的方法,提高体胚诱导率、发育的同步性,提高杂交鹅掌楸体细胞工程种苗繁育的效益。技术方案:为了实现上述发明目的,本发明采用的技术方案为:一种利用水杨酸进行杂交鹅掌楸体胚发生的方法,包括杂交鹅掌楸悬浮系的建立、液体单细胞的获得及过渡、诱导杂交鹅掌楸体胚的发生步骤,在诱导杂交鹅掌楸体胚的发生时,在培养基中同时添加水杨酸和ABA,或单独添加水杨酸。所述的水杨酸的用量为0.01~1.25mg/Lmol/L,ABA的用量为2mg/L。所述的培养基为液体培养基或固体培养基。所述的杂交鹅掌楸的基因型为C38、C138、243012、253010。所述的杂交鹅掌楸的基因型为C138,培养基配方为3/4MS+SA0.25mg/L或3/4MS+ABA2.0mg/L+SA0.05mg/L。所述的杂交鹅掌楸的基因型为243012,培养基配方为3/4MS+ABA2.0mg/L+SA0.05mg/L。所述的杂交鹅掌楸的基因型为253010,培养基配方为3/4MS+ABA2.0mg/L+SA0.05mg/L或3/4MS+ABA2.0mg/L+SA0.25mg/L。所述的水杨酸的用量为0.05~0.25mg/L。有益效果:与现有技术相比,本发明的利用水杨酸进行杂交鹅掌楸体胚发生的方法,在杂交鹅掌楸体细胞胚胎发生过程中,加入植物生长调节剂SA有效提高提高体胚诱导率,在体细胞发育过程中有效降低其畸形率的产生,提高杂交鹅掌楸细胞工程的育种质量。在生长过程中,可以提高体胚再生植株的抗逆境胁迫能力,提高杂交鹅掌楸体细胞工程种苗繁育的效益,促进杂交鹅掌楸体胚再生植株的规模化应用,提高林业大规模生产效益,降低后期管理非生物胁迫成本。附图说明图1是不同基因型诱导率差异性结果图;图2是显微镜下的单细胞图;图中,a为C138,b为243012,c为253010;图3是c138在不同培养基上体胚发育情况图;图4是243012在不同培养基上体胚发育情况图;图5是253010在不同培养基上体胚发育情况图;图6是C138在不同培养基上体胚发育情况图;图7是243012在不同培养基上体胚发育情况图;图8是253010在不同培养基上体胚发育情况图;图9是不同基因型在不同培养基上体胚发育结果图;图A.253010在1号培养基,图B.243012在1号培养基,图C.c138在1号培养基,图D.253010在7号培养基,图E.243012在7号培养基,图F.c138在7号培养基,图G.253010在7号培养基光照后,图H.243012在7号培养基光照后,图I.c138在7号培养基光照后;图10是不同基因型在显微镜下观察结果图;A图为253010,A-1为其放大图,B图为243012,B-1为其放大图,C图为C138,C-1为其放大图。具体实施方式下面结合具体实施例,对本发明做进一步的说明。以下实施例中使用的供试材料选用本申请人的课题组于2012年及2013年期间选配的杂交鹅掌楸优良组合,由未成熟胚诱导成的愈伤组织材料,具体诱导方法参见文献[陈金慧.杂交鹅掌楸体细胞胚胎发生研究[D].南京:南京林业大学,2003.]。基因型分别为253010、c38、c138、243012。水杨酸母液的配置:采用的水杨酸购自Sigma公司化学纯级产品,呈粉末状,纯度大于95%。取所需重量的SA用无水乙醇助溶,再加水定容配制成0.1mg/mL的母液备用。以下实施例中,数据统计与分析:30d后统计不同培养基上体胚个数,体胚状态,用EXCEL软件进行方差分析。将愈伤状态分为黄色紧密型、褐色紧密型、白色粗糙型、白色圆滑型,根据愈伤状态来确定培养基的优与差。体胚发生率(%)=体胚发生总数/观察细胞数(团);体胚成熟率(%)=成熟胚总数/观察细胞数(团);畸形胚发生率(%)=畸形胚总数/观察细胞数(团);实施例11、杂交鹅掌楸悬浮系的建立将胚性愈伤组织转接到愈伤组织250mL液体培养基上震荡培养,培养环境为暗培养,24℃,摇床转速为96rpm。每种基因型愈伤组织接种3瓶,按照1:9的比例配置悬浮细胞培养物,每个三角瓶悬浮细胞和培养液混合后体积为50mL。材料继代周期为7天,继代2次后,进行细胞过筛。通过400目的单细胞经液体调整培养基震荡培养1d,培养基为3/4MS+NAA0.2mg/L+KT0.5mg/L+BA0.2mg/L+ABA1.0mg/L+VC5.0mg/L,糖50g/L,水解酪蛋白0.5mg/L,培养环境为暗培养,24℃,摇床转速为96rpm。2、液体培养基进行体胚的诱导在显微镜下观察过度培养2天的液体悬浮细胞,根据其浓度以及细胞状态进行体胚的初步诱导。用移液枪吸取2mL液体悬浮细胞,均匀的铺在添加不同浓度SA(表1)固体培养基上,利用体式显微镜等观察不同胚期状态,统计出胚日期及体胚苗生长势。每个浓度处理6皿,3个实验重复。表1SA添加浓度培养基号ABA(mg/L)SA(mg/L)10022.00300.01400.05500.25601.2572.00.0182.00.0592.00.25102.01.25其中琼脂6.8g/L,水解酪蛋白0.2g/L,蔗糖30g/L,pH5.7-5.8。在很多情况下,基因型是影响体胚发育的一个关键因素,不同的基因型诱导结果存在明显的差异。本实施例统计了基因型为c38,c138,253010,243012共四个杂交鹅掌楸胚性愈伤组织诱导率,求取不同平均值,结果如表2和图1所示。表2SA对不同基因型杂交鹅掌楸体胚发生影响由表2和图1看出,SA对不同基因型杂交鹅掌楸体胚发生存在明显的差异。在这4个基因型中,体胚诱导率较高的基因型是243012、c138,这两个基因型的诱导率均达到60%以上,而且愈伤组织状态也较好。其次是253010,体胚诱导率达到55%,但是愈伤状态不稳定。最后,c38的体胚诱导率最低,愈伤状态最差,颗粒较粗糙,颜色泛白。因此,在本阶段试验中可以得出结论,243012和c138这两个基因型较好。利用方差分析法对不同基因型体胚诱导率进行差异性显著分析,结果如表3所示。表3不同基因型诱导差异性显著分析结果注:SS表示离均差平方和,代表数据的总变异;MS表示平均的离均差平方和;F表示方差分析求出的统计量;P就是P值,根据F值而得。crit表示F值的标准,即F值大于crit时表示差异有统计学意义,P值小于0.05。由表3差异性显著分析可以看出,P值小于0.05,达到了显著型水平。说明基因型对体胚诱导率存在有着重要因素。实施例21)经液体悬浮培养过度后,在显微镜下观察不同基因型液体细胞状态,如图2所示。选择基因型C138的杂交鹅掌楸悬浮细胞进行培养。用移液枪吸取2mL铺在不同浓度的SA体胚诱导培养基上(SA浓度为编号1:0mg/L,编号2:0.01mg/L,编号3:0.05mg/L,编号4:0.25mg/L,编号5:1.25mg/L),在28天后在显微镜下观察和统计体胚发育数量,45天后统计体胚苗的数量,统计结果如表4所示。表4基因型为C138在不同培养基上体胚诱导情况注:+生长差,++生长一般;+++生长好;++++生长较好;+++++生长最好,下同。由表4看出,在培养基中添加不同浓度的SA,结果显示,诱导率均高于对照组,不同培养基体胚发育情况如图3所示。在不添加任何激素的基本培养基上,基因型为C138的杂交鹅掌楸体胚诱导率为0,当在基本培养基中添加SA时,其体胚诱导率明显上升,并随着浓度的上升,诱导率也随之提高。但是,当SA浓度高于0.25mg/L时,体胚诱导率开始下降。从表格中可以看出,该基因型在4号培养基中诱导率(3/4MS+SA0.25mg/L)最高,达到了60.2%,生长势最好。成熟率与其它培养基相比,均高出4%-8%左右,但是畸形率差别不大,均在8%左右。因此单一SA对C138体胚诱导的最佳浓度是0.25mg/L。2)用移液枪吸取2mL基因型为243012的液体悬浮细胞,均匀的铺在不同浓度的不同浓度的SA体胚诱导培养基上(SA浓度为编号1:0mg/L,编号2:0.01mg/L,编号3:0.05mg/L,编号4:0.25mg/L,编号5:1.25mg/L),在28天后在显微镜下观察和统计体胚发育数量,45天后统计体胚苗的数量,不同培养基体胚发育情况如图4所示,统计结果如表5所示:表5基因型为243012在不同培养基上体胚诱导情况由表5看出,基因型为243012的杂交鹅掌楸在单一SA处理后体胚诱导情况与基因型为C138的杂交鹅掌楸体胚诱导情况相似,其诱导率均高于正对照,即不加任何激素的3/4MS基本培养基。当随着SA浓度的上升,其体胚诱导率也随之提高。在此次试验中发现,诱导率最高的培养基依旧是4号培养基(3/4MS+SA0.25mg/L),诱导率达到了60%,生长势较高。从上表中明显看出,当SA浓度达到1.25mg/L时,体胚诱导率明显下降,比1号培养基(SA0.01mg/L)低了5.4%,比4号培养基(SA0.25mg/L)低了9%。说明该基因型在高浓度的SA条件下对体胚发生有一定的抑制作用。3)用移液枪吸取2mL基因型为253010的液体悬浮细胞,均匀的铺在不同浓度不同浓度的SA体胚诱导培养基上(SA浓度为编号1:0mg/L,编号2:0.01mg/L,编号3:0.05mg/L,编号4:0.25mg/L,编号5:1.25mg/L),在28天后在显微镜下观察和统计体胚发育数量,45天后统计体胚苗的数量,不同培养基体胚发育情况如5所示,统计结果如表6所示。表6基因型为253010在不同培养基上体胚诱导情况由表6可以看出,基因型为253010杂交鹅掌楸在4号培养基(SA0.25mg/L)上体胚诱导率最高,为51.9%。该基因型在不同浓度的SA诱导培养基上,体胚发生率随着SA浓度的提高而上升,但与前两组基因型相比,该基因型的诱导率偏低,在50%左右,体胚成熟率在40%左右。并且不同浓度间的差异性不大,成熟率变化幅度在2%-3%之间,生长势较均一,但与对照组相比,其诱导率为较高。与前2组相比较,当SA浓度超过0.25mg/L时,此时体胚发生率没有明显的下降,只下降了0.5%。4)用移液枪吸取2mL基因型为C138的液体悬浮细胞,均匀的铺在不同浓度的SA和ABA的体胚诱导培养基上(激素配比浓度为编号1:ABA2.0mg/L+SA0.0mg/L,编号2:ABA2.0mg/L+SA0.01mg/L,编号3:ABA2.0mg/L+SA0.05mg/L,编号4:ABA2.0mg/L+SA0.25mg/L,编号5:ABA2.0mg/L+SA1.25mg/L),在28天后在显微镜下观察和统计体胚发育数量,45天后统计体胚苗的数量,体胚发育情况如图6所示,统计结果如表7所示。表7基因型为C138在不同培养基上体胚诱导情况由表7可以看出,分别选择浓度为ABA2.0mg/L与不同浓度的SA进行体细胞胚胎诱导,结果显示,该基因型在3号培养基(SA0.05mg/L)时,诱导率最高,为57.8%,成熟率为54.3%,畸形率为3.4%。其次为4号培养基(SA0.25mg/L),诱导率与3号培养基仅相差0.2%。根据表中数据显示,在SA与ABA配合培养基上,体胚诱导率随着SA浓度的上升而上升。当SA为0.01mg/L时,体胚诱导率高出对照组5.9%,说明SA对体胚诱导有着明显的效果。但是当浓度达到1.25mg/L时,体胚诱导率明显下降,且低于对照,比对照组低了5%左右。从畸形率发现,对照组畸形率为7.2%,当在ABA的培养基上添加SA后,畸形率显著下降,均在3%-4%左右,可见ABA与SA组合后,有利于抑制畸形胚的萌发。5)用移液枪吸取2mL基因型为243012的液体悬浮细胞,均匀的铺在不同浓度的SA和ABA的体胚诱导培养基上(激素配比浓度为编号1:ABA2.0mg/L+SA0.0mg/L,编号2:ABA2.0mg/L+SA0.01mg/L,编号3:ABA2.0mg/L+SA0.05mg/L,编号4:ABA2.0mg/L+SA0.25mg/L,编号5:ABA2.0mg/L+SA1.25mg/L),在28天后在显微镜下观察和统计体胚发育数量,45天后统计体胚苗的数量,体胚发育情况如图7所示,统计结果如表8所示。表8基因型为243012在不同培养基上体胚诱导情况由表8所示,在不同浓度SA与2.0mg/LABA的组合培养基上,数据结果显示,体胚发生率随之SA浓度的上升而提高。当SA浓度为0.05mg/L时,体胚诱导率最高,生长势较好,此时体胚发生率为62.6%,成熟率为59.5%,畸形率为3.1%。与C138基因型相似的是,当浓度提高到0.25mg/L时,诱导率有所下降,但是不是很明显,仅低于3号培养基1.6%。但是当浓度继续提高至1.25mg/L时,体胚诱导率直线下降,比4号培养基下降了12%,同时,比对照组实验低了3%。猜测高浓度的SA与ABA相结合后,对体胚发生具有抑制作用。从畸形率,可以看出,对照组畸形率较高,为6.2%,当添加不同浓度的SA后,畸形率明显下降,畸形率均在3%左右。可见SA与ABA组合使用时,能有效的抑制畸形胚的发生。5)用移液枪吸取2mL基因型为253010的液体悬浮细胞,均匀的铺在不同浓度的SA和ABA的体胚诱导培养基上(激素配比浓度为编号1:ABA2.0mg/L+SA0.0mg/L,编号2:ABA2.0mg/L+SA0.01mg/L,编号3:ABA2.0mg/L+SA0.05mg/L,编号4:ABA2.0mg/L+SA0.25mg/L,编号5:ABA2.0mg/L+SA1.25mg/L),在28天后在显微镜下观察和统计体胚发育数量,45天后统计体胚苗的数量,体胚发育情况如图8所示,统计结果如表9所示。表9基因型为253010在不同培养基上体胚诱导情况由表9所示,该基因型与前2组基因型相比,诱导率偏低,均在45%-53%左右。与前两组实验相似的是体胚诱导率随着SA浓度的上升而提高,但是当浓度达到1.25mg/L时,体胚诱导率明显下降。在结果中,可以发现有2组培养基配方均达到了52.6%,分别是3号培养(SA0.05mg/L)和4号培养基(SA0.25mg/L)。但是当SA浓度为0.05mg/L时的体胚成熟率比SA浓度为0.25mg/L时高出1.4%;并且在畸形率上,当SA0.05mg/L时的畸形率比SA0.25mg/L的畸形率低1.4%。因此,为了能高效的培育出优良的体胚苗,应选择3号培养基为最佳培养基,即3/4MS+ABA2.0mg/L+SA0.05mg/L。畸形率的结果表明,在不添加SA的培养基上,畸形率较高,达到了9.1%,当添加SA后,畸形率开始下降,在5%-7%左右,比前两个基因型的畸形率要高。实施例3将杂交鹅掌楸愈伤组织直接转接到添加不同浓度的SA固体培养基上,每皿接5个细胞块,每个浓度接种6皿。初代培养环境为暗培养,待愈伤组织长出胚型结构后,调整光照环境,改为光培养16h,暗培养8h,温度为24℃。具体添加浓度如表10所示。表10SA添加浓度其中琼脂8.0g/L,水解乳蛋白0.5g/L,活性炭4.0g/L,蔗糖40g/L,pH5.7-5.8。分别将基因型为C138、243012、253010杂交鹅掌楸愈伤组织转接于添加不同浓度的SA固体培养基上(表10),培养28天后,未见有明显的体胚出现,但是在继代两次后,愈伤组织上开始出现胚性组织,在体视显微镜下观察统计体胚数量和发育情况。结果如表11、12和13所示。表11基因型为C138在不同培养基上体胚发育情况表12基因型为243012在不同培养基上体胚发育情况表13基因型为253010在不同培养基上体胚发育情况如表11、12、13所示,这三个基因型的杂交鹅掌楸在这几个不同培养基上,出胚最多的培养基为7号培养基,即3/4MS+SA0.05mg/L。虽然在添加SA的培养基上均能成功诱导出体胚,但是不同浓度的SA诱导率有明显的差异,随着SA的浓度的提高,出胚率也随之上升。C138随着SA的浓度从0.01mg/L到0.05mg/L,体胚诱导率从11%提高到了30%;243012随着SA的浓度从0.01mg/L到0.05mg/L,体胚诱导率从15%提高到了47.5%从;253010随着SA的浓度从0.01mg/L到0.05mg/L,体胚诱导率从5%提高到了95%。从整个结果可以看出,基因型为C138和243012的杂交鹅掌楸出胚率较低,而基因型为253010的出胚率较高,最高值达到95%,同时,在不添加任何激素的培养基上,该基因型也能出胚。从愈伤组织状态来看,253010的状态最佳,均为黄色,颗粒较小。在高浓度的SA条件下,虽有褐色愈伤组织出现,但是不影响出胚率。而其余两个基因型愈伤组织状态均有颗粒粗糙,细胞含水量较多的情况如图9,10所示。从出胚时间来看,在不添加SA的诱导培养基上,不管是哪种基因型,其出胚时间普遍较晚,要到80d左右,最好的基因型253010也要到40d左右才能出胚,但是在后期添加不同浓度的SA后,出胚时间开始提前。当SA浓度为0.01mg/L时,C138和243012在57d后就能出胚,而253010出胚时间较早,在30天左右就能出胚。数据结果显示,随着SA浓度的提高,不同基因型出胚时间也随之提前。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1