一种经人参提取物FQR1诱导的DC‑CIK细胞的冻存方法与流程
本发明属于医药生物技术领域,具体涉及fqr1诱导的dc-cik细胞的冻存方法。
背景技术:
随着经济的快速发展,人类赖以生存的环境承受着巨大压力。近年来,环境问题日益严重,伴随着肿瘤患者如井喷之势急剧增加,因此,如何治疗肿瘤疾病并提升肿瘤患者的幸福指数已成为社会各界研究的重点。
肿瘤细胞的生物治疗是除化学治疗、放射治疗和手术治疗以外新兴、具有显著疗效的肿瘤治疗模式,是一种自体免疫细胞抗癌的新型治疗方法。
dc-cik细胞是自体dc细胞和cik细胞共同培养后生成的异质细胞群。通过申请号为201510708335.3的发明专利,我们可以看出经人参提取物fqr1诱导的dc-cik细胞可进一步提高dc-cik细胞的杀瘤活性。但是,dc-cik细胞的不足之处在于,制作成本高、制作周期长和冻存后细胞活性降低等,严重影响其使用范围。
现有的冷存方法主要包括两种,第一种方法是将含有目的细胞悬液的冻存管,放置入程序冻存盒,-70℃放置12小时后转入液氮中保存;第二种方法是将含目的细胞悬液的冻存管-20℃放置2小时后,转入-70℃放置12小时,最后将其转入液氮中保存。但现有的冷存方法,存有冻存时间长、复苏后细胞活性低等缺陷。
为此,亟待研发出一种经人参提取物fqr1诱导的dc-cik细胞的冻存方法,提高复苏后的细胞活性,具有重大的现实意义。
技术实现要素:
本发明目的是提供一种经人参提取物fqr1诱导的dc-cik细胞的冻存方法。
本发明的冷冻方法为:将经人参提取物fqr1诱导的dc-cik细胞悬液与冻存液混合,采用程控降温仪降温后置于液氮中保存。
其中,程控降温仪参数是:4℃~-20℃,1℃/每分钟;-20℃等待20min;-20℃~-40℃,4℃/每分钟;-40℃等待30min;-40℃~-80℃,8℃/每分钟;-80℃等待2h;在液氮中保存的时间是180天。
其中,冻存液的配制:淋巴细胞无血清培养基中加入二甲基亚砜,其配比是9:1(v/v)。
其中,淋巴细胞无血清培养基,具体名称为
本发明的的冻存方法作为dc-cik细胞的保存中的应用。
本发明与用常规冻存的dc-cik细胞相比,本发明的冻存方法具有冻存时间短、复苏时间短和复苏后细胞活性高等优点,会极大的增加dc-cik细胞的应用范围,具有很重要的现实意义。同时,本发明冷存过程,操作简单,容易控制,不仅有效的节约时间,而且大大降低成本。
本发明的冻存方法,可长效高活性保存dc-cik细胞180天。利用本发明公开的冻存流程冻存dc-cik细胞,复苏后的细胞存活率达98%以上,且保持优异的增值率和杀伤活性。
附图说明
图1为实施例中冻存前和冻存后dc-cik细胞的细胞增殖曲线
图2为实施例中冻存前和复苏后dc-cik细胞的细胞毒性比较
具体实施方式
以下实施例仅为帮助本领域技术人员更好地理解本发明,但不以任何方式限制本发明。
《实施例1》人参提取物fqr1的制备
取生晒参500g,高速组织捣碎机粉碎,加入10倍量10mmph7.4的tris-hcl(0.15mnacl)缓冲液充分搅拌后,4℃搅拌浸提12h。6000rpm离心30min,收集上清液。向沉淀中再次加入10倍量的10mmph7.4的tris-hcl(0.15mnacl)进行二次浸提,离心后收集上清液,合并两次的上清液。向上清液中加入固体硫酸铵至终浓度为80%,搅拌均匀后4℃静置过夜离心,沉淀用蒸馏水洗涤3次后冻干。将冻干样品放入透析袋中,4℃透析过夜后冻干。冻干品即为人参提取物fqr1。
《实施例2》dc-cik细胞的制备
患者准备:根据免疫细胞dc-cik治疗的适应症和禁忌症,选择适合该治疗的肿瘤患者,告知该治疗所涉及的各种相关信息和注意事项,获得患者及家属的理解和配合;
签署知情同意书;检测血常规;
外周血动员:采血前24小时皮下注射gm-csf150ug;
外周血采集:病人采血前应清淡饮食,无菌抽取肿瘤患者外周血50ml,肝素钠抗凝并充分混匀,避免凝血;
自体血浆制备:室温2000rpm离心沉淀10min,收集适量的上层血浆,放于玻璃瓶中并于-20℃下冻存,待自体血浆完全冻结后,放置于-80℃低温冰箱中冻存备用;
fqr1诱导的dc-cik细胞的培养:细胞沉淀物用生理盐水稀释混匀至原体积,轻轻加到淋巴细胞分离液(购置于ge公司)表面,2500rpm离心20min;用一次性塑料巴氏小心收集淋巴细胞分离液表层细胞,移至50ml一次性离心管中,加入生理盐水至50ml,混匀,室温1500rpm离心沉淀10min,弃上清,沉淀物用生理盐水再次悬浮混匀,室温1300rpm离心7min,弃上清;细胞沉淀物用rpmi1640培养液(购置于美国gibco公司)调整细胞密度为(4~6)×106个/ml,置于37℃、5%co2,饱和湿度的二氧化碳培养箱中培养2小时;收集非贴壁细胞,用含10%胎牛血清的rpmi1640培养液调整细胞密度为(1~2)×106个/ml,进行体外诱导,在含浓度为10ug/ml的人参提取物fqr1、1000u/mlrhifn-γ的完全培养基中悬浮培养24小时后,加入rhil-1α100u/ml、鼠抗人cd3mcab50ng/ml、rhil-21000u/ml,继续培养,以后隔天更换新鲜培养液一次,补充rhil-2,细胞密度维持在(1~2)×106个/ml;将贴壁细胞接种于6孔培养板,加入含rhil-4500u/ml、rhgm-csf100ng/ml、fqr110ug/ml的rpmi1640培养液,置于37℃、5%co2,饱和湿度的二氧化碳培养箱中培养,隔日半量换液,适时补充培养基及细胞因子;在培养第6天,加入终浓度为100ng/ml的rhtnf-α;分别收获cik、cd细胞,计数后1:5的比例混合后,体外培养5天,获得dc-cik细胞。
《实施例3》冻存液的配制
冻存液的制备方法:在淋巴细胞无血清培养基中加入自体血浆和二甲基亚砜,使自体血浆的浓度为1%,二甲基亚砜的浓度为10%。
《实施例4》dc-cik细胞的冻存
dc-cik细胞分组冻存
1、用实施例3中的冻存液悬浮实施例2中的dc-cik细胞,得到1×107个细胞/ml的细胞悬液,分装入冻存管中,每个冻存管中吸入1ml的细胞悬液;
2、将步骤1中的冻存管,放入程控降温仪的冻存盒中进行冻存,随后取出冻存管迅速放置于液氮中;
3、步骤2中,程控降温仪的设定参数是:4℃~-20℃,1℃/每分钟;-20℃等待20min;-20℃~-40℃,4℃/每分钟;-40℃等待30min;-40℃~-80℃,8℃/每分钟;-80℃等待2h。
《实施例5》dc-cik细胞的复苏
1、取出冻存于-80℃的自体血浆,放置于4℃解冻,然后2000rpm离心5分钟,取上清液备用;
2、迅速取出冻存于液氮中的冻存管,立即放置于37~40℃的水浴中,振荡使其冻融,用生理盐水洗涤冻存管中的dc-cik细胞;
3、将步骤二中的细胞悬液接种到含有rhil-1α100u/ml、cd3mcab50ng/ml、rhil-21000u/ml、rhil-4500u/ml、rhgm-csf100ng/ml、rhtnf-α100ng/ml和fqr110ug/ml的rpmi1640培养液,置于37℃、5%co2,饱和湿度的二氧化碳培养箱中培养24小时,即完成dc-cik细胞复苏的目的。
《实施例6》复苏后dc-cik细胞的存活率检测
按实施例5中的操作步骤,取步骤3中的细胞,用台盼蓝拒染法计算复苏后细胞存活率,每组设三个平行对照。结果如表1所示。
表1复苏后dc-cik细胞的存活率(%,x±s,n=3)
《实施例7》不同冻存流程冻存的dc-cik细胞的存活率检测
1、用实施例3中的冻存液悬浮实施例2中的dc-cik细胞,得到1×107个细胞/ml的细胞悬液,分装入冻存管中,每个冻存管中吸入1ml的细胞悬液;
2、将步骤1中的冻存管,按照不同冻存流程进行冻存,随后转入液氮中保存;
3、步骤2中,所述的冻存流程包括以下三个:
冻存流程一:即利用程控降温仪进行冻存,程控降温仪的设定参数是:4℃~-20℃,1℃/每分钟;-20℃等待20min;-20℃~-40℃,4℃/每分钟;-40℃等待30min;-40℃~-80℃,8℃/每分钟;-80℃等待2h;
冻存流程二:将含有目的细胞悬液的冻存管,放置入程序冻存盒,-70℃放置12小时后转入液氮中保存;
冻存流程三:将含目的细胞悬液的冻存管-20℃放置2小时后,转入-70℃放置12小时,最后将其转入液氮中保存。
4、按照实施例6中的方法,对用三种流冻存程分别保存的细胞进行复苏并计算其存活率。结果如表2所示,利用本发明提供的冻存流程冻存后的细胞,其复苏后存活率优于利用其它两种冻存流程冻存的细胞。
《实施例8》dc-cik细胞的细胞增殖测定
1、实施例5的步骤3中,从接种dc-cik细胞开始计时,每24小时取样计数细胞数,并绘制细胞增殖曲线,每次取样设三个平行组;
2、将冻存前的dc-cik细胞接种于含有1rhil-1α100u/ml、cd3mcab50ng/ml、rhil-21000u/ml、rhil-4500u/ml、rhgm-csf100ng/ml、rhtnf-α100ng/ml和fqr110ug/ml的rpmi1640培养液,置于37℃、5%co2,饱和湿度的二氧化碳培养箱中培养,每24小时取样计数细胞数,并绘制细胞增殖曲线,每次取样设三个平行组。结果如图1所示。
表2三种不同冻存流程冻存的dc-cik细胞的存活率(%,x±s,n=3)
《实施例9》dc-cik细胞的细胞表型检测
1、将复苏后培养七天的dc-cik细胞调整浓度为1×106个/ml,各取100ul加入falcon管中,依次加入pe-cd1α、pe-cd86、fitc-cd80、fitc-cd83、fitc-hladr单抗及同型对照igg1/igg1和fitc标记的鼠抗人cd3+cd8+与cd3+cd56+及同型对照各20ul,混匀,在4℃暗室反应30min后,pbs洗涤2次,上流式细胞仪检测。
2、取实施例7步骤3中培养七天的dc-cik细胞,按照步骤1的操作,对其细胞表型进行检测。结果如表3所示。
表3冻存前和冻存后dc-cik细胞的细胞表型流式检测结果(%,x±s,n=3)
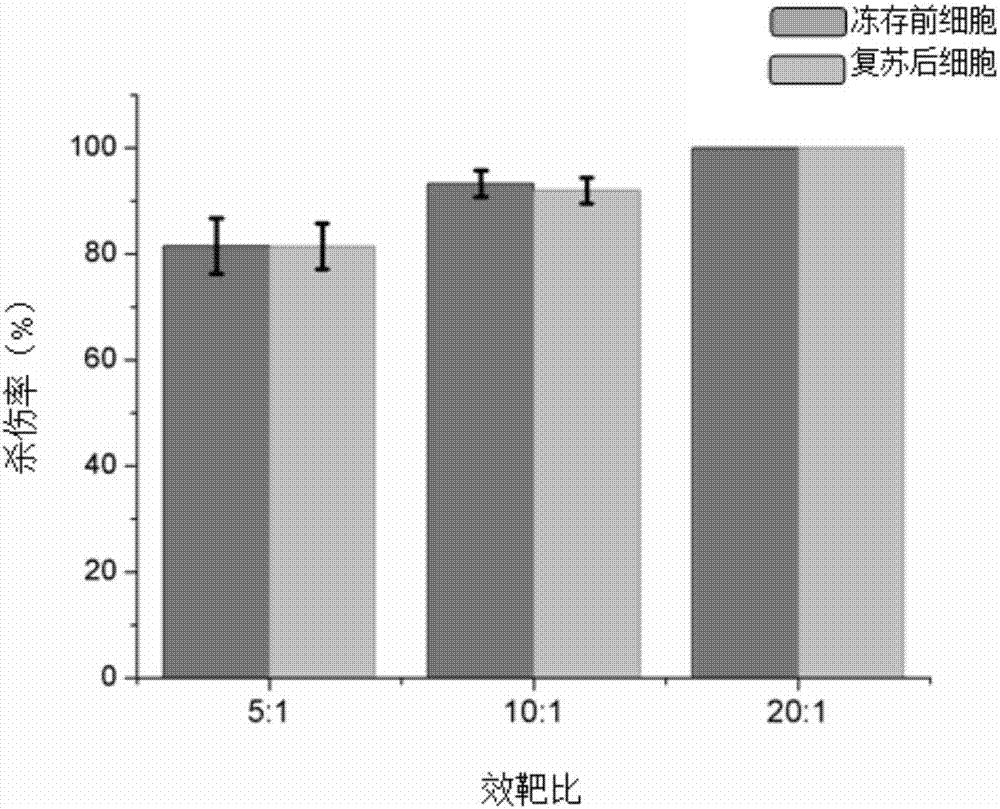
《实施例10》dc-cik细胞的细胞毒性测定
1、收集冻存前和复苏后的dc-cik细胞;
2、利用mtt比色法,以k562细胞(购置于中国医学科学院基础医学研究所细胞中心)为靶细胞,检测效应细胞(冻存前和复苏后的dc-cik细胞)的杀伤活力。
将冻存前、复苏后的dc-cik细胞细胞浓度调整为0.5×106个/ml,1×106个/ml,2×106个/ml作为效应细胞,同时取k652细胞作为靶细胞,调整细胞浓度为1×105个/ml,,效靶比为5:1,10:1和20:1,在96孔反应板加入效应细胞和靶细胞各100ul/孔,同时设靶细胞、效应细胞对照孔,均设3个平行孔,对照孔为单纯靶细胞100ul+100ulrpmi1640培养液和单纯效应细胞(dc-cik细胞)100ul+100ulrpmi1640培养液,置于37℃、5%co2(v/v)培养箱中培养24小时。培养后用mtt比色法检测其杀瘤活性。结果如图2所示。
- 还没有人留言评论。精彩留言会获得点赞!