丛枝菌根真菌在促进降香黄檀生长中应用的制作方法
本发明涉及土壤微生物学、植物抗逆性及植物营养领域,特别涉及丛枝菌根真菌在促进降香黄檀生长中应用。
背景技术:
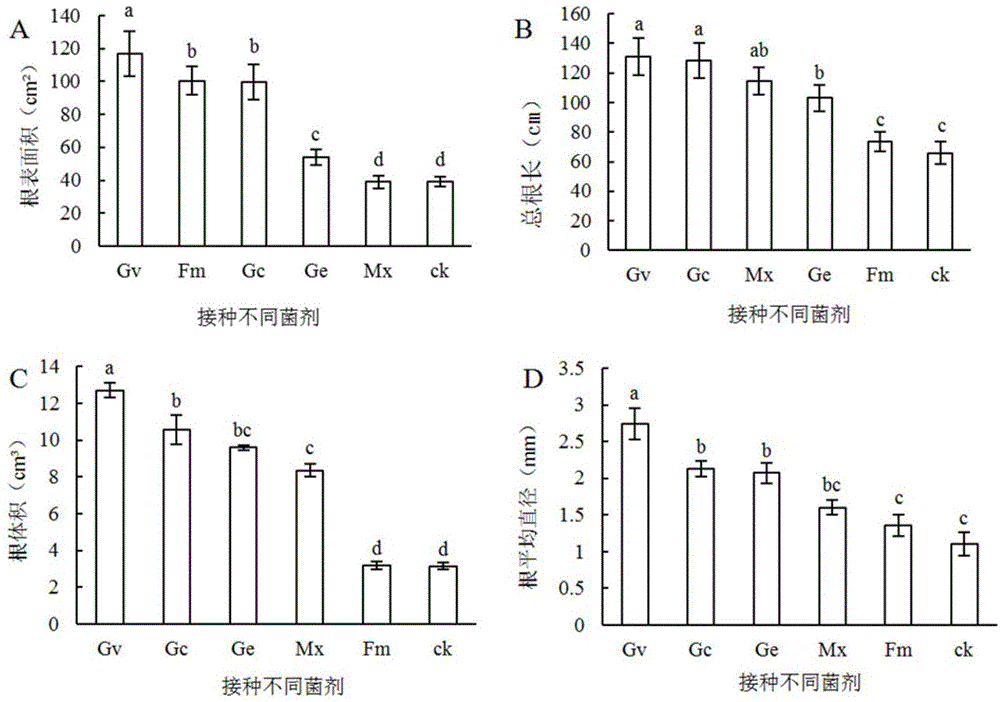
:降香黄檀(dalbergiaodoriferat.chen)又名花梨、花梨木、黄花梨、香红木、花榈木、香枝,为蝶形花科常绿半落叶乔木,属于国家二级保护植物,也是我国特有的热带珍贵树种。是我国5属8类34种珍贵红木品种之一。木材材质坚硬,光泽油润,香气持久,精加工后切片花纹美观,干燥后不变形、不开裂,是制作贵重家具和雕刻精美工艺品的上等材料。同时其也具有较高的经济价值、药用价值,但由于其心材生长时间较长,难以满足社会需要,加之人类过度的开发利用,长期的人为砍伐,导致其野外资源也十分匮乏。周雪刚等(周雪刚,庄雪影,吴永彬.降香黄檀幼苗接种am真菌效应研究[j].林业实用技术,2012(8):6-8.)、莫惠芝等(莫惠芝,洪文君,何妙坤,等.几种amf菌剂对降香黄檀幼苗菌根效应的比较研究[j].福建林业科技,2014(3):22-26.)和刘子嘉等(刘子嘉,罗静,刘福妹,等.am真菌对降香黄檀幼苗生长的影响[j].中国城市林业,2015,13(3):35-38.)研究通过接种amf(丛枝菌根真菌)对降香黄檀的生长及营养吸收、菌根化效应的研究,探讨苗木与菌根共生机理,结果表明降香黄檀幼苗对amf具有较强的依赖性。且接种amf对苗木有显著的促生作用。陆俊锟等(陆俊锟,徐大平,杨曾奖,等.慢生根瘤菌dg的分离、鉴定及其与降香黄檀的共生关系[j].应用与环境生物学报,2011,17(3):379-383.)、徐睿等(徐睿,刘君昂,周国英,等.降香黄檀-檀香根际土壤高效解磷细菌的分离筛选与鉴定[j].热带作物学报,2015,36(2):281-288.)和徐睿等(徐睿,刘君昂,罗娜,等.降香黄檀根际固氮菌分离鉴定及菌群活性研究[j].土壤通报,2015(5):1121-1126.)针对降香黄檀的固氮能力,开展降香黄檀根瘤菌及高效解磷菌的筛选、专用生物复合肥研制,研究促进其苗期生长与结瘤的最佳施肥组合。因此,降香黄檀菌根研究一直是关注热点,但关于降香黄檀菌根化苗木的筛选、菌根化幼苗适生性研究的报道则相对较少。经文献查找,尚未检索到有关降香黄檀与丛枝菌根共生公开报道的文献。利用微生物调节植物的生长,对植物的抗逆性方面也具有较为开阔的应用前景。对降香黄檀资源的保护、开发和利用提供有效的途径,具有重要的经济、社会和生态效益,因此也是近年来的研究热点。技术实现要素:本发明的目的在于克服现有技术的缺点与不足,提供丛枝菌根真菌在促进降香黄檀生长中应用。本发明的目的通过下述技术方案实现:丛枝菌根真菌在促进降香黄檀生长中应用,所述的丛枝菌根真菌为地表球囊霉、幼套近明球囊霉和混合多种amf菌剂中的至少一种。所述的丛枝菌根真菌优选为地表球囊霉。所述的地表球囊霉为地表球囊霉[glomusversiforme(karsten)bench]。所述的幼套近明球囊霉为幼套近明球囊霉[glomusetunicatum(beckerandgerdemann)]。所述的丛枝菌根真菌的接种量为50±0.55g/株。所述的丛枝菌根真菌在促进降香黄檀生长中应用,为将丛枝菌根真菌接种到降香黄檀幼苗上;或将丛枝菌根真菌与基质混合后,得到含有真菌的基质,再将降香黄檀幼苗移栽到含有真菌的基质中。所述的基质为黄心土、河沙和泥炭藓土;优选为黄心土、河沙和泥炭藓土按体积比为2:1:1混合得到的基质。所述的降香黄檀幼苗为三个月至一年生的降香黄檀幼苗;优选为通过如下方法获得:将降香黄檀种子剥开种皮,然后放入60℃温水中并加入高锰酸钾进行消毒,再用水清洗干净后用清水浸泡,播种、培育,得到降香黄檀幼苗。所述的消毒为采用质量分数0.5‰的高锰酸钾进行消毒;优选为采用质量分数0.5‰的高锰酸钾消毒30分钟。所述的浸泡的时间优选为8小时。所述的播种为将种子播种到用质量分数5‰高锰酸钾消毒后的沙床中。所述的培育的时间优选为3个月至1年;更优选为3个月。丛枝菌根真菌在制备促进降香黄檀生长的生物菌剂中的应用,所述的丛枝菌根真菌为地表球囊霉、幼套近明球囊霉和混合多种amf菌剂中的至少一种。所述的丛枝菌根真菌优选为地表球囊霉。一种降香黄檀促生菌剂,所述的促生菌剂为地表球囊霉、幼套近明球囊霉和混合多种amf菌剂中的至少一种。所述的促生菌剂优选为地表球囊霉。本发明相对于现有技术具有如下的优点及效果:1、本发明提供了一种与降香黄檀共生,且能够提高幼苗的生长量及生物量、光合作用、叶绿素荧光等指标的丛枝菌根真菌筛选方法,为建立降香黄檀菌根化育苗技术,降香黄檀壮苗产业化发展提供技术支撑。2、本发明在播种苗正常生长三个月后开始接种,其中接种包括苏格兰球囊霉、地表球囊霉、摩西斗管囊霉、幼套近明球囊霉、混合菌剂等五种不同菌剂。3、本发明应用人工接种技术,通过植物根系与土壤微生物之间的相互促进作用,探究降香黄檀适生菌剂的筛选,通过菌根化育苗技术促进降香黄檀幼苗根系与菌根真菌共生互利,提高其生长。附图说明图1是不同amf菌剂下降香黄檀幼苗根系情况的比较结果图(图中小写字母不同者表示不同菌剂下同一个处理差异达到显著,p<0.05);其中,图a为根表面积的比较;图b为总根长的比较;图c为根体积的比较;图d为根平均直径的比较。图2是不同amf菌剂对降香黄檀幼苗光合指标的影响图(图中小写字母不同者表示不同菌剂下同一个处理差异达到显著,p<0.05.);其中,图a为净光合速率(pn值)的比较;图b为气孔导度(cond值)的比较,图c为胞间co2浓度(ci值)的比较;图d为蒸腾速率(tr值)的比较。图3是接种三个月后5种菌剂的菌根侵染形态图;其中,图a为侵染点(放大倍数:400×);图b为amf泡囊(400×);图c和d为amf菌丝、泡囊、丛枝(200×)。图4是gv组菌根侵染形态图;其中,图a和b均为侵染菌丝(a:100×;b:400×)。图5是gc组菌根侵染形态图;其中,图a和b均为侵染菌丝(a:200×;b:400×)。图6是fm组菌根侵染形态图;其中,图a和b均为侵染菌丝(a:100×;b:200×)。图7是ge组菌根侵染形态图;其中,图a和b均为侵染菌丝(a:100×;b:100×)。图8是mx组菌根侵染形态图;其中,图a和b均为mx组菌根侵染情况(a:400×;b:200×)。图9是未接菌(ck)组菌根侵染形态图;其中,图a和b分别均为ck组菌根侵染情况(a:100×;b:400×)。图10是接种5种菌剂苗木生长情况图;其中,图a为ck组与gv组的比较(图中左边3株为ck组,右边3株为gv组);图b为gc组与ck组的比较(图中左边3株为gc组,右边3株为ck组);图c为gv组与mx组的比较(图中左边3株为gv组,右边3株为mx组);图d为ge组与mx组的比较(图中左边3株为ge组,右边3株为mx组);图e为gc组与ge组的比较(图中左边3株为gc组,右边3株为ge组);图f为gc组与mx组的比较(图中左边5株为gc组,右边3株为mx组);图g为ck组、gc组与ge组的比较(图中左边3株为ck组,中间3株为gc组,右边3株为ge组);图h为gc组、ge组与gv组的比较(图中左边3株为gc组,中间3株为ge组,右边3株为gv组)。图11为接种5种菌剂苗木根瘤生长情况图;其中,图a为mx组的苗木根瘤生长情况;图b为fm组的苗木根瘤生长情况;图c为gc组的苗木根瘤生长情况;图d为gv组的苗木根瘤生长情况;图e为ge组的苗木根瘤生长情况;图f为ck组的苗木根瘤生长情况。具体实施方式下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。下列实施例中未注明具体条件的实验方法,通常按照常规条件。下述实施例中所使用的各原材料以及试剂,除特别指出的以外,均可由市售获得。实施例1一种促进降香黄檀生长的丛枝菌根真菌筛选方法,包括如下步骤:对30d生降香黄檀播种幼苗接种五种不同丛枝菌根真菌,接种前测定降香黄檀播种幼苗的苗高为22.72±1.78cm,地径为3.21±0.26cm。1.实验材料实验苗木:降香黄檀种子采摘后,剥开种皮,种子用60℃温水加入终浓度为质量分数5‰的高锰酸钾消毒30分钟,清水清洗2次,洗净后清水浸泡8小时。播种前温棚中沙床提前用质量分数为5‰高锰酸钾消毒,播种后待种子发芽,一个月后装袋处理。2017年1月开始播种,待其长出2片真叶后装袋,于2017年4月9开始移苗施菌。2.实验菌剂本发明中的菌种均购自中国林业科学研究院热带林业科学研究所,苏格兰球囊霉[glomuscaledonium(nicol.andgerd.)trappe&gerd],简称gc;地表球囊霉[glomusversiforme(karsten)bench],简称gv;摩西斗管囊霉[funneliformismosseae(t.h.nicolson&gerd.)c.walkeranda.schüβler)],简称fm;幼套近明球囊霉[glomusetunicatum(beckerandgerdemann)],简称ge;混合多种amf菌剂,简称mx。3.盆栽基质供试基质黄心土(来自广州某大学的树木园)、市购所得河沙及购买的泥炭藓土(荷兰进口泥炭藓土,广州成硕药品有限公司)基质,按体积比2:1:1的比例混合而成,充分搅拌后碾碎,过2mm筛后装袋,在高压蒸汽灭菌锅中进行灭菌2h,灭菌温度126℃,将灭菌后的混合基质风干冷却后备用,灭菌后测得土壤理化性质(表1)。表1盆栽试验土壤基本养分含量4.接种方法袋装苗营养杯采用18cm×18cm规格,每盘接种50g上述菌种。每盆营养杯中分别接种gv、gc、ge、fm、mx,以不接种菌为对照(ck),实验共6个处理组,每处理组设15个重复,共有实验苗90盆。具体步骤如下:先在两层营养袋中装入1/3高度的灭菌后的混合基质,然后分别均匀地撒一层约50g上述五种菌后,又撒上一层灭菌后的混合基质至盆高的3/4处,将幼苗种植于其上,覆上一层灭菌后的混合基质,最后表层覆盖50g的蛭石(蛭石提前放置酒精中清洗、晾干),以防止水分蒸发过快。对照组不添加任何菌剂,在营养袋中加入等量的50g灭菌后的混合基质,以控制变量一致。每盆装试验基质500g,移植后将接菌苗木置于温室中常规管护。5测定方法:5.1苗高和地径的测定使用直尺测量苗木苗高(cm),使用游标卡尺测量苗木地径(mm)。5.2生物量的测定采用105℃恒温烘干法。采取植物全株,将植株各部分用清水冲洗干净,晾干,装入信封,然后放入恒温干燥箱先进行105℃杀青处理15min再在80℃下烘干至恒重,记下干重读数即干物质量,并计算根冠比(地下部分生物量与地上部分生物量的比值)。5.3根系形态特征值测定为防止脱落根系被水冲走,选取苗木完整的根系样品放置100目筛用清水小心冲洗掉根系表面的泥土。采用epsonperfectionv700photo根系扫描仪采集根系样品图像,用win-rhizo2007c分析软件,测定全根系形态特征,包括根系总根长、根系表面积、根系体积和根系平均直径等根构型参数。5.4菌根侵染率的测定参照phillipsandhayman(1970),以侵染根段占总根段的百分比为菌根侵染率,取部分新鲜根部样品固定于faa溶液中(37%甲醛-冰醋酸-50%乙醇溶液,体积比为9:0.5:0.5)用于检测菌根侵染率。具体方法:先将根部的固定液(faa溶液)清洗干净,浸泡在10%(w/w)的koh溶液中,90℃水浴加热,直至根样变成无色透明。将透明根段取出,用流动的清水轻轻清洗,然后用1%(w/w)的盐酸酸化15min,并用酸性品红或锥虫蓝乳酸甘油(锥虫蓝:0.12g,乳酸40ml;甘油80ml;蒸馏水:80ml)染色过夜,将根部剪成2cm长的根段,在显微镜下10倍物镜观察,用十字交叉法计算菌根侵染率。侵染率的计算公式为:侵染率=侵染根段长度/根段总长度×100%。菌根依赖性(%)=处理组植株的干重/对照组干重*100菌根依赖性<200%,为弱依赖性;200%<菌根依赖性<300%,为中等依赖性;菌根依赖性>300%,为强依赖性(弓明钦,2000)。5.5光合特性指标测定选择苗木的功能叶(具体为从顶芽往下数第5~6轮的叶子)用li-6400便携式光合作用分析系统(美国)于上午9:00~11:30进行测定,测定过程中使用li-6400-2b红蓝光源,光强设置为1200μmol·m-2·s-1,叶温设定30~35℃,相对湿度60%左右,大气co2浓度400μmol·m-2·s-1,具体包括:叶片的净光合速率(pn)、胞间co2浓度(ci)、气孔导度(cond)和蒸腾速率(tr)等指标。6.实验结果本发明以降香黄檀为实验材料,运用人工接种技术,通过植物根系与土壤微生物之间的相互促进作用,探究降香黄檀幼苗与菌剂的适应性研究,为降香黄檀育苗技术提供理论与技术的支撑。接种生长90d(三个月)后开展菌根侵染率检测实验,各处理组菌根侵染率比较结果如表2所示。对接种5种菌剂降香黄檀盆栽幼苗生长180d后开展光合、根系特征等实验,结果如表3和4所示。表2降香黄檀幼苗接种生长三个月后各处理组菌根侵染率比较菌种gvgcgemxfmck菌根侵染率/%55.53±1.51a52.5±1.45a33.3±2.46ab32.56±3.11ab24.51±1.68b8.61±0.94c注:表中每列不同小写字母表示处理间差异显著(p<0.05)。表3不同菌种对降香黄檀幼苗净生长量、生物量及根冠比的影响比较菌种苗高净生长量/cm地径净生长量/mm干物质量/g根冠比菌根依赖度gc30.78±1.51a4.58±0.54a8.86±1.19a0.33±0.05ab5.61±0.37agv25.99±0.84a3.74±0.27a8.01±0.33a0.27±0.09ab5.07±0.48age20.37±1.34ab3.54±0.21a5.91±0.58b0.35±0.12ab3.74±0.25bmx18.25±2.34ab3.72±0.24a5.93±0.27b0.40±0.13a3.75±0.18bfm15.11±0.98b2.88±0.31ab4.10±0.25b0.31±0.05ab2.60±0.32cck11.60±1.11b2.85±0.29ab1.58±0.14c0.21±0.03b1.00±0.11d注:表中每列不同小写字母表示处理间差异显著(p<0.05)。表4各接菌组9项生长指标的隶属函数数值比较表2的结果显示,5种菌剂均能与降香黄檀幼苗形成菌根侵染,侵染率的高低为gv>gc>ge>mx>fm>ck。接种gc、gv组苗木的侵染率分别为55.53±1.51%,52.5±1.45%,显著高于其他3种菌剂。表3和表4的结果显示,接种amf处理组的苗高和地径净生长量、根系总长、根体积、根表面积、平均直径均大于未接种组;同时,接种amf对幼苗光合响应的变化也有显著性影响,接种处理的pn值(净光合速率)、cond值(气孔导度)、ci值(胞间co2浓度)、tr值(蒸腾速率)均高于未接种组,5种amf对降香黄檀幼苗的生长均具有促进作用,其中接种gc、gv组作用更为明显(图1和2)。接种三个月后5种菌剂的菌根侵染形态图如图3~9所示,苗木生长情况如图10所示,根瘤生长情况如图11所示。讨论与结论本发明中接种amf(丛枝菌根真菌)菌剂的降香黄檀幼苗植株的形态建成和生长也具有非常明显的正向效应,如生长量的显著提高、生物量的增大、根系的生长,渗透调节物质含量的增加等,从而促进植物根系对养分和水分的最大吸收,提高光合效率。但不同amf菌剂对降香黄檀幼苗的生长促进作用大小不一,接种gv、gc组的植株生长指标均高于其他菌剂,可能是因为菌剂与植物的适应性不一,是由于植物与amf之间存在一定的功能亲和性,不同植物、不同amf菌剂的亲和性不同。另外,虽然菌根对宿主植物没严格的专一性,但amf与植物根系还是存在一定的相互选择性。本发明的目的是筛选与降香黄檀幼苗最佳菌种,在amf实际生长应用研究中发现,菌剂-植物-生长存在一定的选择,所以筛选能适应一定生态条件而且能与宿主植物根系形成最佳组合的高效amf菌剂。对此本发明中,比较5种菌剂的菌根侵染率,发现不同amf对宿主植物的侵染规律大体相近,但存在一定差异。接种gc、gv组与降香黄檀的菌根侵染率及对苗木的生长促进作用、生物量的积累、根系总长、根表面积、平均直径、根体积及净光合速率、气孔导度效果在不同程度上优于其他几种菌剂。综合看来,接种gc组与降香黄檀组合效果最佳,其次为接种gv组。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1