钩藤发根的高效诱导和培养方法与流程
本发明涉及组织培养领域,具体涉及钩藤发根的高效诱导和培养方法。
背景技术:
钩藤(uncariarhynchophylla)是贵州省地道药材,种植面积广,需求量高,功能清血平肝,息风定惊,用于风热头痛,感冒压惊,惊痛抽搐等症。其药效活性成分为钩藤碱和异构藤碱,有降血压作用,能有效控制多种心血管疾病,广泛应用于医学临床,生产上其含量高低已作为评价钩藤药材品质优劣的标准。近年受心血管的高频率患发,使得市场上对钩藤的应用量及需求量明显上升,实现对钩藤优质品种的选育及钩藤中有效次生代谢物的大规模工业化生产势具有重要的产业意义。
发根是发根农杆菌将自身pri质粒上rol基因整合进植物基因组后诱导细胞产生的分支丰富的毛状根组织,拥有无激素自主生长、生长速度快,无向地性,遗传稳定等特点。同时发根具有和母体植物相同的代谢途径,并往往能合成比母体植物更高水平的次生代谢物。很多药用植物都建立了发根培养体系,用于大规模获取有价值的天然代谢产物,包括银杏、颠茄、丹参、甘草和朱砂根等。发根的诱导本质上是一种农杆菌介导的转基因过程,诱导过程简便,不需要复杂的植物再生程序,且易于培养,借助于t-dna可携带外源基因整合入植物基因组,所以发根也作为一种高效稳定的遗传转化体系,大量用于外源基因的功能分析,在功能基因组研究中成为一种高效的工具,
钩藤目前还未建立植株的遗传转化体系,所以发根的高效诱导对于钩藤活性成分合成的分子机制研究也意义重大。
吴顺等报道了钩藤发根的诱导,但是诱导效率经优化后也仅为54%(吴顺等,钩藤毛状根的诱导及其钩藤碱含量的测定,北方园艺,2019)。该方法用于获取发根培养尚可,但如作为外源基因的遗传转化体系,则会由于筛选压的加入使转基因发根阳性率急剧下降。因此,亟需建立最适于钩藤发根生长和活性成分积累的培养基,建立了高效的发根诱导和培养体系。
技术实现要素:
有鉴于此,本发明的目的在于提供一种钩藤发根的高效诱导和培养方法,为转化外源基因的遗传转化奠定基础。
为达到上述目的,本发明提供如下技术方案:
1、钩藤发根的高效诱导和培养方法,包括如下步骤:将活化的发根农杆菌c58c1用于浸染经预培养的钩藤外植体,然后接种于共培养的培养基上暗培养3d,然后转移至发根诱导培养基上诱导培养。
优选的,所述预培养为将钩藤的叶或茎剪出伤口接种于预培培养基上暗培养5天,所述预培培养基为wpm+2mg·l-12,4-d+0.5mg·l-16-ba+3g·l-1蔗糖+7.2‰琼脂,ph为5.8-6.0。
优选的,所述共培养的培养基为wpm+400mg·l-1头孢克肟+30g·l-1蔗糖+7.2‰琼脂。
优选的,所述浸染为将活化的c58c1加入含有浓度为100μmol·l-1乙酰丁香酮的wpm液体培养基使其悬浮,28℃、200r/min摇床中活化培养30min,使发根农杆菌适应wpm培养基;调整菌液od600=0.6,然后将预培养的外植体置于活化的菌液中,使发根农杆菌浸染外植体7-8min,倒去菌液,将外植体置于滤纸上,将外植体表面的水分吸干。
优选的,所述诱导培养为25℃培养20d,每5d更换一次wpm固体培养基。
优选的,所述诱导培养基为wpm+400mg·l-1头孢克肟+30g·l-1蔗糖+7.2‰琼脂。
本发明的有益效果在于:本发明提供了钩藤发根的高效诱导和培养方法,通过选择合适的农杆菌和培养基,提高了钩藤发根的诱导效率,为外源基因的遗传转化奠定了基础。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
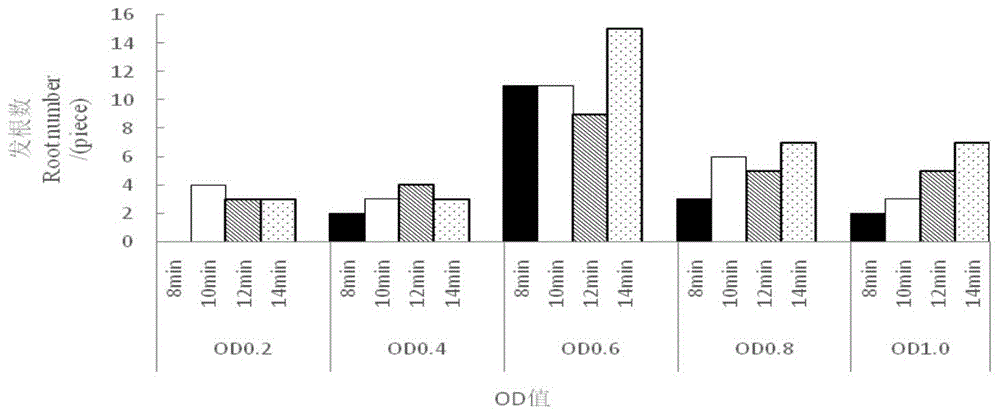
图1为不同浓度、不同时间的发根数。
图2为不同外植体钩藤发根(a.茎;b.嫩叶;c.老叶)。
图3为钩藤毛状根基因组pcr扩增(m:dl2000;1:c58c1农杆菌rolb阳性对照;2:c58c1农杆菌rolc阳性对照;3:钩藤组培苗根rolb阴性对照;4:钩藤组培苗根rolc阴性对照;5、6:钩藤发根rolb实验组;7、8:钩藤发根rolc实验组)。
图4为不同培养基30d扩大培养。
图5为钩藤碱和异钩藤碱的hplc色谱图(a.标准品;b.样品)。
图6为不同培养基中钩藤碱和异钩藤碱含量。
图7为不同培养基中生物碱的产量。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
本发明中钩藤(uncariarhynchophylla)种子采于黔东南州丹寨县昌昊金煌有限公司中药材种植基地,在wpm培养基上进行无菌萌发并继代保存无菌苗。发根农杆菌c58c1(pria4)保存于贵州大学生化实验室。
实施例1、钩藤发根的高效诱导和培养方法
钩藤发根的高效诱导和培养方法,包括如下步骤:
(1)发根农杆菌c58c1的活化
取超低温冰箱中保存的发根农杆菌c58c1划线于yep固体培养基上(yep+40mg·l-1利福平+7.2‰琼脂),28℃,培养24-48h,挑取单菌落接种于50ml选择培养基(yep+40mg·l-1利福平),28℃,200r/min摇床培养24h进行第一次活化,之后按照1:50的比例将1ml一活菌液接种于50ml上述选择培养基中,28℃,200r·min-1摇床进行第二次活化培养,测定菌液od600=0.4-0.6,收集菌液。
(2)菌液浓度及浸染时间的确定
将活化农杆菌用生理盐水稀释成5个浓度梯度,其od600值分别为0.2、0.4、0.6、0.8、1.0,将叶片浸泡在不同浓度菌液中,将浸泡的时间设置为8min、10min、12min、14min,用滤纸吸干后接种至共转化培养基,每个浓度每个时间接种40片,观察统计转化情况,结果如图1所示。结果显示,不同菌液浓度与不同浸染时间对毛状根诱导率的影响不同。浓度过低,农杆菌的数量少,发根数低,浓度过高,发根数较低。时间过短,农杆菌浸染外植体不充分,发根数低。当农杆菌的浓度od600=0.6,时间为14min时,农杆菌的发根数较高。
(3)预培养
取钩藤无菌苗,选择枝叶丰富的无菌苗(含老、嫩叶、茎),在超净工作台上将叶片剪成大约2cm2大小的老叶130片、嫩叶110片和大约1cm长的茎25段。接种于预培培养基上(wpm+2mg·l-12,4-d+0.5mg·l-16-ba+3g·l-1蔗糖+7.2‰琼脂,ph为5.8-6.0),暗培养5d,
(4)发根农杆菌诱导浸染
将完成二次活化的发根农杆菌离心,弃上清,加入50ml含有乙酰丁香酮(100μmol·l-1)的wpm液体培养基使其悬浮,确保发根农杆菌的全部收集及除去菌液中的其他成分,28℃,200r/min摇床中活化培养30min,使发根农杆菌适应wpm培养基。测定od值确保发根农杆菌的浓度保持在od600=0.6。将预培养的叶片及茎外植体置于活化的菌液中,使发根农杆菌浸染外植体7-8min,倒去菌液,将外植体置于滤纸上,尽可能的将其表面的水分吸干。吸干水分的外植体接种于的共培养的培养基上(wpm+100μmol·l-1乙酰丁香酮+30g·l-1蔗糖+7.2‰琼脂),28℃暗培养3d。完成共培养后,立即将外植体转接到wpm固体培养基上(wpm+400mg·l-1头孢克肟+30g·l-1蔗糖+7.2‰琼脂),25゜c培养20d,每5d更换一次wpm固体培养基,并记录发根数和统计发根诱导率,结果如表1和图2。20d后剪下钩藤毛状根置于无激素的wpm液体培养基中。
毛状根诱导率(%)=产生毛状根的外植体数/总外植体数×100%
表1、不同外植体诱导产生发根的情况
结果显示,钩藤茎、嫩叶和老叶3种外植体经发根农杆菌c58c1(pria4)浸染后,在暗培养条件下均在第5天开始产生发根,15天后发根诱导率达到平衡和最高值。诱导20天左右的发根生长较旺盛,适合从母体分离后单独培养。不同的钩藤外植体其发根诱导率各不相同,嫩叶的诱导率最高,达到91.8%,且根系较为粗壮白嫩、分支能力强(图2,b)。老叶诱导的发根形态与嫩叶类似,生长活力较旺盛,但是诱导率相对最低,仅80%(图2,c)。茎的诱导率达到84.0%,但是发根生长速率较慢,分枝少,不适合放大培养(图2,a)。综合来看,嫩叶是钩藤发根诱导的最佳外植体。
(5)毛状根的分子检测
发根的产生是由于发根农杆菌中pria4质粒上的rol基因整合进植物基因组所致,所以可通过pcr扩增法检测钩藤发根dna中是否含有rol基因来确证诱导出的是否为发根。参考sds法提取未处理毛状根的基因组dna,pcr检测发根中是否有rolb、rolc基因整合。rolb基因正向引物rolb-f:5'-gctcttgcagtgctagattt-3'(sqeidno.1),反向引物rolb-r:5'-gaaggtgcaagctacctctc-3'(sqeidno.2);rolc基因正向引物rolc-f:5'-ctcctgacatcaaactcgtc-3'(sqeidno.3),反向引物rolc-r:5'-tgcttcgagttatgggtaca-3'(sqeidno.4)。反应条件为95℃预变性5分钟,94℃变性30s,56.2℃退火30s,72℃延伸1min,33个循环,72℃后延伸2min。
检测结果如图3所示。结果显示,诱导的钩藤发根中能检测出明亮的与阳性对照对应的700bprolb条带和400bprolc条带,而钩藤组培苗根中未检出任何条带。以上结果表明rol基因已整合进钩藤发根,发根各种区别于自然根的表型由rol基因表达所致。
(6)不同培养基中毛状根扩大培养及钩藤碱含量的检测
将分子检测过的毛状根转入无激素的wpm液体培养基中进行扩培用于后续培养基筛选接种,25℃,120r·min-1振荡培养30d。将扩培的毛状根分别置于1/2ms、ms、n6、white、b5和wpm液体培养基中。基本过程为:配置以上培养基各300ml置于锥形瓶中,在各锥形瓶中放15根左右(平均每根长4cm)的扩大培养的毛状根,尽量保证各锥形瓶中的毛状根长度,粗细一致。将处理好的毛状根置于摇床中,120r·min-1,25゜c条件下继续培养30d后取样(图4),统计结果如表2所示。培养30天后,发根在不同培养基中形态和生物量呈现明显的差异,如图4。ms和1/2ms中新生发根呈丝状、淡黄白色、较柔软且含水量大,而b5、wpm、n6和white中发根呈珊瑚状、黄褐色、分支度高且质地较脆硬。从生物量上来看,发根干重从高到低依次是b5、1/2ms、wpm、ms、n6、white,最高的b5培养基中,每瓶发根干重平均可达0.591g,而最低的white培养基中仅0.191g。
表2、不同培养基培养的发根干重
钩藤发根中钩藤碱及异钩藤碱含量的提取和检测采用张智仙hplc方法。取钩藤毛状根粉末0.1g,加入5ml70%甲醇,超声洗涤1h(频率为40khz,分两次进行,每次30min),后用甲醇补足重量,在4゜c水箱中过夜,8000rpm离心5min,使用针管吸取上清液后,使用0.22μm孔径的滤膜过滤两次,作为待测溶液。hplc色谱条件为:色谱柱:agilentzorbaxsb-c18(4.6mm×250mm,5μm);流动相:甲醇-0.1%氨水(70:30,v/v)等度洗脱;流速:1.0ml·min-1;柱温:30℃,进样体积10μl,检测波长245nm。
结果显示,钩藤碱的保留时间约为10.16min,异钩藤碱的保留时间约为6.99min(图5)。所有培养的钩藤发根中,都能检测出钩藤碱和异钩藤碱两种药效成分,且钩藤碱都是优势生物碱,其含量是异钩藤碱的1.5倍(ms)到6.6倍(white)。white培养的钩藤发根中钩藤碱含量最高(1.086mg·g-1),其次是b5(0.859mg·g-1),再次是wpm、1/2ms和n6,ms中最低,white是ms的4.6倍。异构体碱含量变化相对稳定,ms最低为0.155mg·g-1,b5和1/2ms最高,均为0.225mg·g-1左右(如图6)。
结合发根生物量和生物碱含量,综合比较了每瓶中生物碱的产量,如图7。无论是钩藤碱、异钩藤碱还是总生物碱,b5培养基均是最高的,分别为0.506mg、0.160mg和0.760mg;1/2ms其次,三者分别比b5低了51%、27%和38%;white和wpm其次,均不及b5的一半。n6与ms培养基中两种生物碱产量最低,总产量不及b5的1/5。以上结果表明,c5851诱导的钩藤发根具有合成钩藤碱和异钩藤碱的能力,b5培养基最适于钩藤发根的生长和活性成分积累。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
序列表
<110>贵州大学
<120>钩藤发根的高效诱导和培养方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
gctcttgcagtgctagattt20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
gaaggtgcaagctacctctc20
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctcctgacatcaaactcgtc20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
tgcttcgagttatgggtaca20
- 还没有人留言评论。精彩留言会获得点赞!