从番麻叶片中提取天然抑菌物质的方法、提取物及其应用与流程
本发明属于天然抑菌物质的提取领域,特别涉及一种从番麻叶片中提取天然抑菌物质的方法,由该方法获得的天然抑菌物质提取物,以及该天然抑菌物质提取物在采摘后果蔬防病保鲜中的应用。
背景技术:
番麻(Agave sisalana Perrine)为龙舌兰科(Agavaceae)龙舌兰属植物,是亚热带特有的多年硬质纤维作物。番麻具有喜温、耐旱的特点,适于热带亚热带地区栽培,主产于墨西哥、巴西和坦桑尼亚等国,在我国热带亚热带地区的海南、广东、广西、云南、福建等省区均有商业化栽培。
番麻叶片呈剑形,硬而狭长,叶片一般长为100~140cm,宽13~15cm,灰绿色至蓝绿色。番麻叶片内含丰富的纤维,纤维细胞呈长形结构,细胞腔大而长,壁厚,具有纤维长,色泽洁白,质地坚韧,富有弹性,拉力强,耐摩擦,耐酸碱,耐腐蚀,不易打滑等特点,广泛应用于渔业、航海、工矿、运输、油田等行业,以及用于编织剑麻地毯、剑麻布、过滤器、工艺品等。
由于番麻叶片中果胶、皂苷等含量较高,目前已有研究利用番麻提取皂苷、果胶等的研究,但在针对其中天然抑菌物质的提取及其在采摘后果蔬的病害防治和保鲜方面的应用未有报道。
技术实现要素:
本发明的目的在于提供一种从番麻叶片中提取天然抑菌物质的方法,通过超声波提取与大孔树脂吸附、反相硅胶柱和正相硅胶柱等多步分离提纯步骤及相应的梯度洗脱相结合,可获得活性高的天然抑菌物质。
根据本发明的一个方面,提供一种从番麻叶片中提取天然抑菌物质的方 法,包括以下步骤:将番麻叶片在55±2℃下烘干后,进行粉碎;按所述番麻叶片的质量g与提取溶剂体积ml之比为1:10~15向粉碎后的番麻叶片加入色谱级95%乙醇,在35~45℃下超声波水浴浸提2~5h,得到乙醇提取液;将所述乙醇提取液离心分离,收集上清液;依次重复所述浸提和离心分离步骤至少2次,合并所述上清液,并在50±2℃下旋转蒸干,得到第一浸膏;将所述第一浸膏用水配置成料液浓度为200mg/ml的混悬药液,然后通过大孔吸附树脂的吸附柱;用第一洗脱液将所述吸附柱洗脱至流液无色,重复该洗脱步骤3次,且所述第一洗脱液依次使用水、45v/v%乙醇水溶液和60v/v%乙醇水溶液,收集60v/v%乙醇水溶液的洗脱液,并在50±2℃条件下旋转蒸干得到第二浸膏;将所述第二浸膏用甲醇溶解后通过十八烷基反相硅胶柱;用第二洗脱液将所述十八烷基反相硅胶柱洗脱至流液无色,重复该洗脱步骤2次,且所述第二洗脱液依次使用50v/v%甲醇水溶液、90v/v%甲醇水溶液,收集90v/v%甲醇水溶液的洗脱液,并旋转蒸干得到第三浸膏;将所述第三浸膏溶解于甲醇中,再通过正相硅胶柱;以及用第三洗脱液将所述正相硅胶柱洗脱至流液无色,重复该洗脱步骤2次,且所述第三洗脱液依次使用体积比为25:1、15:1的氯仿-甲醇溶液,收集体积比为15:1的氯仿-甲醇溶液的洗脱液,并进行真空冷冻干燥,得到天然抑菌物质粉末。
优选地,所述天然抑菌物质包括三萜皂苷类物质。
根据本发明的一个实施方式,所述大孔吸附树脂为D101型大孔树脂。
根据本发明的另一个实施方式,所述第一洗脱液的流速为5±0.5mL/min。
根据本发明的又一个实施方式,所述真空冷冻干燥的时间为12~18h,温度为-45±2℃,真空度为12±1Pa。
根据本发明的另一方面,提供一种由上述方法获得的天然抑菌物质提取物。
根据本发明的又一方面,提供上述天然抑菌物质提取物在采摘后果蔬防病保鲜中的应用。
优选地,所述天然抑菌物质提取物与基于所述天然抑菌物质提取物质量的0.05%的吐温80结合使用。
根据本发明的上述提取方法,采用了超声波提取与多步分离提纯步骤以及相应的梯度洗脱步骤相结合,对番麻叶片中天然抑菌物质具有高选择性,从而实现了高提取率和高纯度。所获得的提取物中天然抑菌物质活性成分含量高,活性强。
根据上述方法提取的天然抑菌物质可用于采摘后果蔬的保鲜和防病。
根据本发明,提供了一种从番麻叶片中提取天然抑菌物质的方法,同时为采摘后果蔬的病害防治提供绿色健康的材料。本发明所用的方法操作简单,实用性高,原料也可以用番麻生产过程中产生的废弃物麻渣,降低生产成本。该提取物在果蔬采后保鲜过程中具有较好的应用价值。
附图说明
图1为根据本发明实施例1和2获得的天然抑菌物质的高效液相色谱图;
图2为根据本发明实施例1和2获得的天然抑菌物质的核磁碳谱;
图3为根据本发明实施例1和2获得的天然抑菌物质的核磁氢谱;
图4为根据对比例1的提取物的高效液相色谱图。
图5为根据对比例2的提取物的高效液相色谱图。
具体实施方式
根据本发明的一个实施方式,提供一种从番麻叶片中提取天然抑菌物质的方法,包括以下步骤:将番麻叶片在55±2℃下烘干后,进行粉碎;按番麻叶片的质量g与提取溶剂体积ml之比为1:10~15向粉碎后的番麻叶片加入色谱级95%乙醇,在35~45℃下超声波水浴浸提2~5h,得到乙醇提取液;将乙醇提取液离心分离,收集上清液;依次重复所述浸提和离心分离步骤至少2次,合并所述上清液,并在50±2℃下旋转蒸干,得到第一浸膏;将第一浸膏用水配置成料液浓度为200mg/ml的混悬药液,然后通过大孔吸 附树脂的吸附柱;用第一洗脱液将吸附柱洗脱至流液无色,重复该洗脱步骤3次,且第一洗脱液依次使用水、45v/v%乙醇水溶液和60v/v%乙醇水溶液,收集60v/v%乙醇水溶液的洗脱液,并在50±2℃条件下旋转蒸干得到第二浸膏;将第二浸膏用甲醇溶解后通过十八烷基反相硅胶柱;用第二洗脱液将所述十八烷基反相硅胶柱洗脱至流液无色,重复该洗脱步骤2次,且第二洗脱液依次使用50v/v%甲醇水溶液、90v/v%甲醇水溶液,收集90v/v%甲醇水溶液的洗脱液,并旋转蒸干得到第三浸膏;将第三浸膏溶解于甲醇中,再通过正相硅胶柱;以及用第三洗脱液将所述正相硅胶柱洗脱至流液无色,重复该洗脱步骤2次,且所述第三洗脱液依次使用体积比为25:1、15:1的氯仿-甲醇溶液,收集体积比为15:1的氯仿-甲醇溶液的洗脱液,并进行真空冷冻干燥,得到天然抑菌物质粉末。
优选地,上述天然抑菌物质可包括三萜皂苷类物质,优选为三萜皂苷类物质。
在上述大孔树脂吸附和洗脱步骤中,上述大孔吸附树脂可为D101型大孔树脂,并可利用本领域的常规方法将该大孔吸附树脂装柱。优选地,D101型大孔树脂可采用湿法装柱,保留液面。上述混悬药液优选以流速为5±0.5mL/min通过吸附柱。具体地,在混悬药液完全吸附在吸附柱上之后,先用水冲洗柱体,直到流液无色。再换用45v/v%乙醇水溶液洗脱,洗到流液无色;最后再换用60v/v%乙醇水溶液洗脱,例如洗脱8~10倍柱体积(BV)。
进一步地,上述第一洗脱液的流速可为5±0.5mL/min。上述第一洗脱液依次使用水、45v/v%乙醇水溶液和60v/v%乙醇水溶液,使得洗脱液极性逐渐增强,洗脱能力逐渐增强,从而在前两次洗脱过程中充分去除提取物中的不是所需的其它成分,并在60v/v%乙醇水溶液洗脱过程中提高目标抑菌物质(例如三萜皂苷类化合物)的纯度和提取效率。
在第二浸膏甲醇溶液通过十八烷基反相硅胶(ODS)柱,并利用第二洗脱液洗脱至流液无色的步骤中,先用50v/v%甲醇水溶液洗脱,以除去第二浸膏中含有的杂质,再用90v/v%甲醇水溶液洗脱,能提高抑菌物质的洗脱 效率和收率。
具体地,在ODS柱上,第二浸膏中极性越大疏水性越小的成分越不易与非极性的固定相结合,因此先被洗脱出来。当甲醇水溶液浓度在50v/v%以下时,被洗脱的成分主要为杂质,而在90v/v%甲醇水溶液洗脱时,才能得到抑菌性能突出的提取物。
优选地,将第二浸膏甲醇溶液通过ODS柱(优选50μm粒径),湿法上样,上样量为0.5倍柱体积,0.45μm滤膜过滤后注入柱体积为150ml的ODS-C18反相硅胶柱。然后,用水-甲醇体系梯度洗脱,即先用50v/v%甲醇水溶液洗脱至无色,再换用90v/v%甲醇水溶液洗脱8~10倍柱体积,收集90%甲醇水溶液的洗脱液,进行旋转蒸干得第三浸膏。
类似地,在第三浸膏溶于甲醇中,再通过正相硅胶柱用第三洗脱溶液洗脱的步骤中,第三洗脱液先使用25:1(v/v)氯仿甲醇溶液,以除去第三浸膏中含有的杂质,再使用15:1(v/v)氯仿甲醇溶液,以提高抑菌物质的洗脱效率和收率。
本发明人发现,当上述氯仿甲醇溶液的体积比为25:1以上时,例如为40:1或30:1,洗脱的目标产物非常少,并且产物不纯;当上述氯仿甲醇溶液的体积比为15:1以下时,洗脱的目标产物很少,并且产物不纯。
优选地,在将第三浸膏溶解于甲醇中,并通过正相硅胶柱的步骤中,例如,加入与第三浸膏质量比为1:1.2的300~400目层析硅胶拌匀、减压旋干。预先称取样品质量8~10倍的500~800目的硅胶,采用体积比为50:1的氯仿-甲醇溶液湿法装柱,再将拌好的样品硅胶装入层析柱内,用氯仿甲醇溶液(25:1,v/v)洗脱至无色后,换用氯仿甲醇溶液(15:1v/v)洗脱,并收集氯仿甲醇溶液(15:1,v/v)的洗脱液。
上述真空冷冻干燥步骤可用常规方法和条件进行。例如,上述真空冷冻干燥的时间为12~18h,温度为-45±2℃,真空度为12±1Pa。
根据本发明的一个优选实施方式,提供一种从番麻叶片中提取天然抑菌物质的方法,包括如下步骤:
(1)粉碎:将洗干净的番麻叶片裁剪成2×2cm的小块,在55±2℃的恒温烘箱中烘干,用粉碎机粉碎至粉末状;
(2)超声波提取:以色谱级95%乙醇为提取溶剂在35~45℃下超声波水浴浸提2~5h,其中番麻叶粉末与色谱级乙醇的用量比为每1g粉末使用10~15ml的色谱级乙醇,得乙醇提取液;
(3)离心分离:提取液经离心机在6000r/min离心20min,分离出上清液,弃去沉淀物;
(4)依次重复以上提取和离心步骤至少2次,并合并所得上清液,并在50±2℃条件下旋转蒸干,得到粗提物的第一浸膏;
(5)吸附柱分离:将上述第一浸膏用水配置成料液浓度为200mg/ml的混悬药液,同时将大孔吸附树脂(D101)采用湿法装柱,保留液面,将混悬的药液通过吸附柱,以流速为5±0.5mL/min过吸附柱;吸附完全后用水再次冲洗柱体,直到流液无色;换用45v/v%乙醇水以5±0.5mL/min的流速洗脱,洗到流液无色后,换用60v/v%乙醇水以5±0.5mL/min的流速洗脱8~10BV,收集60v/v%乙醇水的洗脱液,并在50±2℃条件下旋转蒸干溶剂得第二浸膏;
(6)反相硅胶柱分离:将上述(5)所得的第二浸膏用甲醇溶解后过ODS柱(50μm粒径);湿法上样,上样量0.5倍柱体积,0.45μm滤膜过滤后注入柱体积为150ml的ODS-C18反相硅胶柱,用水-甲醇体系梯度洗脱,先用50v/v%甲醇水溶液洗脱至无色,然后换用90v/v%甲醇水溶液洗脱8~10BV,收集90v/v%甲醇水溶液的洗脱液,进行旋转蒸干得第三浸膏;
(7)正相硅胶柱分离:将上述(6)所得第三浸膏用甲醇溶解过正相硅胶柱,加入与第三浸膏质量比为1:1.2(w/w)的300~400目层析硅胶拌匀、减压旋干;预先称取样品质量8~10倍的500~800目的硅胶,采用体积比为50:1的氯仿-甲醇混合溶剂湿法装柱,再将拌好的样品硅胶装入层析柱内,用氯仿甲醇(25:1,v/v)洗脱至无色后,换用氯仿甲醇(15:1,v/v)洗脱8~10BV,并收集氯仿甲醇(15:1,v/v)的洗脱液;
(8)真空冷冻干燥:将(7)步骤收集的洗脱液冷却后在真空下进行冷冻干燥,即得天然抑菌物质粉末,其中该真空冷冻干燥的时间为12~18h,冷冻干燥的温度为-45±2℃,真空度为12±1Pa。
通过根据本发明的方法获得的天然抑菌物质可用于采摘后蔬果的保鲜和病害防治。优选地,上述天然抑菌物质与吐温80结合使用,且吐温80的用量为所述天然抑菌物质质量的0.05%。
实施例1
(1)将在55±2℃下干燥并粉碎的番麻叶片粉末10g和色谱级95%乙醇100ml置于烧杯中,封口,用漩涡仪混匀,然后进行超声波水浴浸提,控制超声波水浴温度为38±2℃,超声时间为4h,得乙醇提取液;
(2)将乙醇提取液冷却后经离心分离,设置离心转速为6000rpm,离心20min,分离出上清液;
(3)依次重复两次上述浸提和离心分离步骤,合并上清液;
(4)将上述合并的上清液在48℃条件下旋转蒸发得到第一浸膏1.96g;
(5)将上述第一浸膏用水溶解至浓度为200mg/ml的混悬药液,过大孔树脂柱(D101),待样品完全吸附后,用水再次冲洗柱体,直到流液无色。换用45v/v%乙醇水溶液以5±0.5mL/min的流速洗脱,洗到流液无色后,换用60v/v%乙醇水溶液以5±0.5mL/min的流速洗脱8BV,收集60v/v%乙醇水溶液的洗脱液,并旋转蒸干得到第二浸膏;
(6)将上述(5)所得的第二浸膏用甲醇溶解后过反相ODS柱,用50v/v%甲醇水溶液洗脱至无色后,换用90v/v%甲醇水溶液洗脱9BV,收集90v/v%甲醇水溶液的洗脱液,进行旋转蒸干得到第三浸膏;
(7)将上述(6)所得的第三浸膏用甲醇溶解后过正相硅胶柱,用氯仿甲醇溶液(25:1,v/v)洗脱至无色后,换用氯仿甲醇溶液(15:1,v/v)洗脱8BV,并收集氯仿甲醇溶液(15:1,v/v)的洗脱液;
(8)真空冷冻干燥:将(7)步骤收集的洗脱液冷却后在真空下进行冷 冻干燥,真空冷冻干燥的时间为16h,冷冻干燥的温度为-45±2℃,真空度为12±1Pa,即得粉状天然抑菌活性物质0.40g,得率4.10%。
实施例2
(1)将在55±2℃下干燥并粉碎的番麻叶片10g和色谱级95%乙醇140ml置于烧杯中,封口,漩涡仪混匀,然后进行超声波水浴提取,控制超声波水浴温度为42±2℃,超声时间为3h,得乙醇提取液;
(2)将乙醇提取液冷却后经离心分离,设置离心转速为6000rpm,离心20min,分离出上清液;
(3)依次重复两次上述浸提和离心分离步骤,合并上清液;
(4)将上述合并的上清液在50±2℃条件下旋转蒸发得到第一浸膏2.06g;
(5)将上述第一浸膏用水溶解为200mg/ml的混悬药液,过大孔树脂柱(D101),待样品完全吸附后,用水再次冲洗柱体,直到流液无色。换用45v/v%乙醇水溶液以5±0.5mL/min的流速洗脱,洗到流液无色后,换用60v/v%乙醇水溶液以5±0.5mL/min的流速洗脱9BV,收集60v/v%乙醇水溶液的洗脱液,并旋转蒸干得到第二浸膏;
(6)将上述(5)所得的第二浸膏用甲醇溶解后过反相ODS柱,用50v/v%甲醇水溶液洗脱至无色后,换用90v/v%甲醇水溶液洗脱10BV,收集90v/v%甲醇水溶液的洗脱液,进行旋转蒸干得到第三浸膏;
(7)将上述(6)所得第三浸膏用甲醇溶解后再次过正相硅胶柱,用氯仿甲醇(25:1,v/v)洗脱至无色后,换用氯仿甲醇溶液(15:1,v/v)洗脱9BV,并收集氯仿甲醇溶液(15:1)的洗脱液;
(8)真空冷冻干燥:将(7)步骤收集的洗脱液冷却后在真空下进行冷冻干燥,真空冷冻干燥的时间为16h,冷冻干燥的温度为-45±2℃,真空度为12±1Pa。即得粉状天然抑菌活性物质0.46g,得率4.6%。
对比例1
(1)将干燥并粉碎的番麻叶片10g和色谱级95%乙醇140ml置于烧杯 中,封口,漩涡仪混匀,然后进行超声波水浴提取,控制超声波水浴温度为42±2℃,超声时间为3h,得乙醇提取液;
(2)将乙醇提取液冷却后经离心分离,设置离心转速为6000rpm,离心20min,分离出上清液;
(3)依次重复两次上述浸提和离心分离步骤,合并上清液;
(4)将上述合并的上清液在50±2℃条件下旋转蒸发得到第一浸膏2.06g;
(5)将上述第一浸膏用水溶解为200mg/ml的混悬药液,过大孔树脂柱(D101),待样品完全吸附后,用水再次冲洗柱体,直到流液无色。换用50v/v%乙醇水溶液以5±0.5mL/min的流速洗脱,洗到流液无色后,换用60v/v%乙醇水溶液以5±0.5mL/min的流速洗脱9BV,收集60v/v%乙醇水溶液的洗脱液,并旋转蒸干得到第二浸膏;
(6)将上述(5)所得的第二浸膏用甲醇溶解后通过反相ODS柱,用65v/v%甲醇水溶液洗脱至无色后,换用90v/v%甲醇水溶液洗脱10BV,收集90v/v%甲醇水溶液的洗脱液,进行旋转蒸干得到第三浸膏;
(7)将上述(6)所得第三浸膏用甲醇溶解后再次过正相硅胶柱,用氯仿甲醇溶液(20:1,v/v)洗脱至无色后,换用氯仿甲醇溶液(15:1,v/v)洗脱9BV,并收集氯仿甲醇溶液(15:1,v/v)的洗脱液;
(8)真空冷冻干燥:将(7)步骤收集的洗脱液冷却后在真空下进行冷冻干燥,所述真空冷冻干燥的时间为16h,冷冻干燥的温度为-45±2℃,真空度为12±1Pa。即得粉状提取物0.31g,得率3.1%。
对比例2
(1)将干燥并粉碎的番麻叶片10g和色谱级95%乙醇140ml置于烧杯中,封口,漩涡仪混匀,然后进行超声波水浴提取,控制超声波水浴温度为42±2℃,超声时间为3h,得乙醇提取液;
(2)将提取液冷却后经离心分离,设置离心转速为6000rpm,离心20min,分离出上清液;
(3)依次重复一次上述浸提和离心分离步骤,合并上清液;
(4)将上述合并的上清液在50±2℃条件下旋转蒸发得到第一浸膏2.06g;
(5)将上述第一浸膏用水溶解为200mg/ml的混悬药液,过大孔树脂柱(D101),待样品完全吸附后,用水再次冲洗柱体,直到流液无色。换用35v/v%乙醇水溶液以5±0.5mL/min的流速洗脱,洗到流液无色后,换用60v/v%乙醇水溶液以5±0.5mL/min的流速洗脱9BV,收集60v/v%乙醇水溶液的洗脱液,并旋转蒸干得到第二浸膏;
(6)将上述(5)所得的第二浸膏用甲醇溶解后通过反相ODS柱,用40v/v%甲醇水溶液洗脱至无色后,换用90v/v%甲醇水溶液洗脱10BV,收集90v/v%甲醇水溶液的洗脱液,进行旋转蒸干得到第三浸膏;
(7)将上述(6)所得第三浸膏用甲醇溶解后再次过正相硅胶柱,用氯仿-甲醇溶液(35:1,v/v)洗脱至无色后,换用氯仿-甲醇溶液(15:1,v/v)洗脱9BV,并收集氯仿-甲醇溶液(15:1,v/v)的洗脱液;
(8)真空冷冻干燥:将(7)步骤收集的洗脱液冷却后在真空下进行冷冻干燥,所述真空冷冻干燥的时间为16h,冷冻干燥的温度为-45±2℃,真空度为12±1Pa。即得粉状提取物0.59g,得率5.9%。
天然抑菌物质的表征
采用高效液相色谱对实施例2制得的天然抑菌物质粉末进行成分分析。高效液相色谱(Agilent 1200)的测试条件如下:
色谱柱:HIQ Sil C18V反相柱(250mm×4.6mm I.D.,5μm)
流动相:乙腈(A)-水溶液(B),50/50(v/v)
等度洗脱条件:50%(A)
流速:1mL/min
柱温:30℃
检测器:蒸发光散射检测器
进样量:10μL。
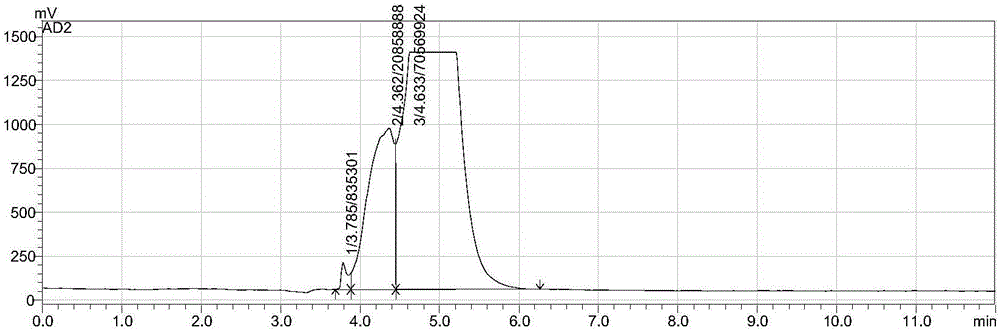
以上测试结果示于图1中。
同时,对实施例2制得的天然抑菌物质粉末进行核磁氢谱和核磁碳谱测定,结果分别示于图2和图3中。
由图1至图3的谱图可明显看出,根据实施例2得到的天然抑菌物质主要为三萜皂苷类物质。
同样,采用高效液相色谱分别对对比例1和2制得的粉状提取物进行成分分析。高效液相色谱(Agilent 1200)的测试条件如下:
色谱柱:HIQ Sil C18V反相柱(250mm×4.6mm I.D.,5μm)
流动相:乙腈(A)-水溶液(B),80/20(v/v)
等度洗脱条件:80%(A)
流速:1mL/min
柱温:30℃
检测器:蒸发光散射检测器
进样量:10μL。
上测试结果示于图4、图5中。由图4、图5的谱图可明显看出,根据对比例1和对比例2得到的粉状提取物含有较多杂质,且三萜皂苷类物质的特征峰也不明显。由此可知,对比例1的提取条件不能有效地提取三萜皂苷类物质。
由实施例1和2以及对比例1和2的提取物分析可知,根据本发明的提取方法中对大孔树脂吸附分离、负相硅胶柱和正相硅胶柱的分离过程采用了特定的梯度洗脱方式,由此对番麻叶片中的三萜皂苷类抑菌活性物质具有特定的提取选择性。而对比例1和2尽管采用了相同类型的大孔树脂吸附柱、负相硅胶柱和正相硅胶柱,但采用了不同的洗脱方案,由此不能有效提取三萜皂苷类物质。
抑菌能力及保鲜效果的验证
将以上实施例1和2得到的粉状天然抑菌物质进行混合后作为样品,并 对其测定抑菌能力及其对蔬果采摘后的保鲜效果。
抑菌能力试验
测试菌株:香蕉炭疽病菌、辣椒炭疽病菌和黄瓜枯萎病菌。
天然抑菌物质溶液的配制:将根据上述实施例1和2提取所得的天然抑菌物质混合物用0.1%的无菌吐温80配成浓度为8mg/L的溶液。
抑菌效果的测定:将马铃薯葡萄糖琼脂(PDA)培养基经过高温灭菌后,降温至60℃,加入上述配制的天然抑菌物质溶液,制成8mg/L、4mg/L的含抑菌物质的培养基。在超净台上将该培养基分装到玻璃平皿,每平皿约15~20ml,将其冷却凝固。用打孔器将培养至5天的测试病原菌打菌饼(直径0.6cm),接至培养皿中央。设空白对照。将这些培养皿一起放入28℃培养箱中恒温培养,至第5天时,用十字交叉法对抑菌效果进行测量。
以上测试结果表明,当根据本发明的天然抑菌物质的使用浓度为8mg/L时,对三种测试病原菌的抑制率达到了100%,即病原菌没有生长;当其使用浓度为4mg/L时,对香蕉炭疽菌的抑制率为86.42%,辣椒炭疽菌的抑制率为82.14%,对黄瓜枯萎病菌的抑制率为72.18%。
蔬果采后保鲜效果试验
取待贮藏的香蕉、辣椒、黄瓜各10kg,分别用上述配置好的8mg/L的天然抑菌物质溶液50ml均匀喷施于表面,通风自然晾干,再将104cfu/ml的香蕉炭疽菌、辣椒炭疽菌以及黄瓜枯萎病菌孢子悬浮液50ml分别喷施于香蕉、辣椒、黄瓜表面,晾干,置于室温下贮藏。设对照以无菌水代替抑菌物质溶液。贮藏第5天时,测定发病率。
结果表明:香蕉处理组发病率为15.0%,对照组发病率为100%;辣椒 处理组发病率为11.69%,对照组为96.14%;黄瓜处理组发病率为20.46%,对照组为86.47%。
由此可见,样品具有很强的抑菌作用,且抑菌谱较广。
综上所述,由根据本发明的提取方法制得的天然抑菌物质可用于果蔬的采后防病保鲜,同时对人体安全无害。
- 还没有人留言评论。精彩留言会获得点赞!