水溶性β‑葡聚糖在对虾养殖中的应用的制作方法
本发明涉及养殖饲料的技术领域,特别是水溶性β-葡聚糖在对虾养殖中的应用。
背景技术:
随着国内生活水平的提高,加上现在人们对饮食注重营养和保健,还有国内的旅游业越来越火爆对餐饮业也是非常好的机遇,国内对对虾及海产品的需求量将不断增大,市场前景广阔。因此如何加快对虾及海产品快速健康成长已经成为海产品养殖急需中解决的重要问题,采用β-普沙β-葡聚糖饲养对虾,能够促进其生长,减少对虾的死亡率和发病率;缩短饲养时间。
技术实现要素:
本发明的目的在于克服现有技术的缺点,提供水溶性β-葡聚糖在对虾养殖中的应用。
本发明的目的通过以下技术方案来实现:水溶性β-葡聚糖在对虾养殖中的应用,所述水溶性β-葡聚糖为普沙β-葡聚糖,是土壤杆菌agrobacteriumsp.zx09的一种发酵产物,普沙β-葡聚糖在对虾饲料中的有效添加量为47~1500mg/kg。
所述普沙β-葡聚糖在对虾饲料中的有效添加量为47mg/kg。
所述普沙β-葡聚糖在对虾饲料中的有效添加量为94mg/kg。
所述普沙β-葡聚糖在对虾饲料中的有效添加量为188mg/kg。
所述普沙β-葡聚糖在对虾饲料中的有效添加量为375mg/kg。
所述普沙β-葡聚糖在对虾饲料中的有效添加量为750mg/kg。
所述普沙β-葡聚糖在对虾饲料中的有效添加量为1500mg/kg。
所述普沙β-葡聚糖提高对虾生长性能、养分消化以及肠道健康。
所述普沙β-葡聚糖促进对虾血液生理生化及免疫功。
本发明具有以下优点:本发明的普沙β-葡聚糖促进对虾血液生理生化及免疫功,同时提高对虾生长性能、养分消化以及肠道健康。
附图说明
图1为凡纳滨对虾肠道扫描电镜结果图;
图2为凡纳滨对虾肝胰脏透射电镜结果图;
图3为rank-abundance曲线;
图4为样品构成稀释曲线;
图5为shannon-wiener曲线;
图6为各组别微生物门的构成柱状图;
图7为各组别微生物属的构成柱状图。
具体实施方式
下面对本发明做进一步的描述,本发明的保护范围不局限于以下所述:
水溶性β-葡聚糖在对虾养殖中的应用,所述水溶性β-葡聚糖为普沙β-葡聚糖,是土壤杆菌agrobacteriumsp.zx09的一种发酵产物,普沙β-葡聚糖在对虾饲料中的有效添加量为47~1500mg/kg。
实施例一:所述普沙β-葡聚糖在对虾饲料中的有效添加量为47mg/kg。实施例二:所述普沙β-葡聚糖在对虾饲料中的有效添加量为94mg/kg。实施例三:所述普沙β-葡聚糖在对虾饲料中的有效添加量为188mg/kg。实施例四:所述普沙β-葡聚糖在对虾饲料中的有效添加量为375mg/kg。实施例五:所述普沙β-葡聚糖在对虾饲料中的有效添加量为750mg/kg。实施例六:所述普沙β-葡聚糖在对虾饲料中的有效添加量为1500mg/kg。实施例七:所述普沙β-葡聚糖提高对虾生长性能、养分消化以及肠道健康。实施例八:所述普沙β-葡聚糖促进对虾血液生理生化及免疫功。
试验证明普沙β-葡聚糖对对虾健康的影响:
s1、选取数个初始体重为0.98±0.02g,来自同一批次,体质健康,大小一致的凡纳滨对虾;
s2、试验基础饲料包括蛋白源、淀粉源和脂质,将试验基础饲料等分为8个组,分别为p1、p2、p3、p4、p5、p6、p7和p8,其中p1为未添加β-普沙β-葡聚糖的对照组,在p2、p3、p4、p5、p6和p7中分别添加47、94、188、375、750、1500mg/kgβ-普沙β-葡聚糖,并在p8中添加β-普沙β-葡聚糖酵母产品4700mg/kg;
s3、养殖试验:将步骤s1中的凡纳滨对虾养殖于室内水泥池中,投喂商业饲料驯养2周后转入正式养殖试验鱼缸,经驯养的幼虾饥饿24h后,选取大小一致、健康无病的幼虾2400尾,随机分入48个缸中,总共8组,每组6个缸,每缸50尾,向第1组到第8组缸中依次投喂p1~p8的食料,进行为期10周的养殖试验,试验虾养殖期间分别在6:00、12:00和18:00投喂三次,第一周日投喂量为幼虾体重的6%~9%,以投喂后3小时内吃完为度;随着虾的生长,逐渐加大投喂量,早晚投喂量约为总投喂量的70%;
s4、消化率试验:饲料中加y2o3作为外源指示剂,从正式试验第7周开始,每天于18:00投喂饲料3小时后排污,次日6:00前采用虹吸法收集缸内粪便,粪便经沉淀、过滤、收集后分装于密封袋中,随后置于-20℃冰柜中保存备用,将收集到的粪样烘干过筛,干法消化后用电感耦合等离子体原子发射光谱仪测定y2o3含量;
s5、试验取样:养殖试验开始前,选取30尾大小一致的初始虾称重后保存于-20℃的冰柜中,用于体成分分析,当10周养殖结束时,将试验虾饥饿24h后用ms-222麻醉,取前30尾逐个称重,剩余虾称总重后倒回缸中,投喂饲料,待虾肠道充满食糜后取样,用锡箔纸包好放入冻存管,液氮保存,用于检测肠道微生物;取称重的虾取3~5尾用于全虾体组成分析,其它虾进行心脏取血,血液静置2h,将血液用离心机8000r/min离心15min,离心后取上清,保存于-20℃冰箱中;待取血后取虾内脏团,在冰盘上进行剖解,将肝胰脏、胃、肠道依次分离出;将肝胰脏称重,将肠道分段为中肠和后肠;随机取3尾虾的肝胰脏切块,切块大小为1mm3,中肠切取3mm放入装有戊二醛的2ml离心管中保存,分别用于后期进行透射与扫描电镜拍片;
s6、生长指标和饲料指标的计算:
s6(1)、生长指标计算:
成活率(sr,%)=试验结束虾尾数/试验初虾尾数×100%;
增重率(wgr,%)=(虾末均重–虾初均重)/虾初均重×100%;
特定生长率(sgr,%/d)=[ln(虾末均重)-ln(虾初均重)]/试验天数×100%;
体肥满度(cf,g/cm3)=虾末均重/体长3×100%;
肝体指数(hsi,%)=肝胰脏重/虾末均重×100%;
s6(2)、饲料指标计算:
摄食率(fr,%bw/d)=饲料消耗干重×100/[(初始重+末体重)/2]/试验天数;
饲料系数(fcr)=摄入饲料干重/体增重;
饲料干物质表观消化率(%)=(1-饲料指示剂含量/粪指示剂含量)×100%;
饲料某营养成分表观消化率(%)=[1-(饲料指示剂含量/粪便指示剂含量)x(粪便中该成分含量/饲料中该成分含量)]x100%;
蛋白质效率(per)=体增重/蛋白摄入量;
s7、样品分析:
s7(1)、凯氏定氮法测定样品中粗蛋白含量;
s7(2)、索氏抽提法测定样品中粗脂肪含量;
s7(3)、电感耦合等离子体原子发射光谱法测定样品中y2o3含量;
s7(4)、分光光度法测定样品中磷含量;
s7(5)、氨基酸组成及含量测定,包括饲料原料、试验饲料、试验鱼样品以及鱼粪便中的氨基酸组成及含量;;
s7(6)、生化指标及消化酶的测定,采用酶联免疫法检测:血清总蛋白、白蛋白、葡萄糖、甘油三酯、总胆固醇、尿素氮、肌酐、总胆红素含量,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶、酸性磷酸酶、总超氧化物歧化酶、总抗氧化能力、过氧化氢酶、丙二醛、酚氧化酶、溶菌酶、谷胱甘肽过氧化物酶活力;还要检测肝胰脏:碱性磷酸酶、酸性磷酸酶、总超氧化物歧化酶、总抗氧化能力、过氧化氢酶、丙二醛、酚氧化酶、溶菌酶、谷胱甘肽过氧化物酶活力;肝胰脏、胃和中肠的胰蛋白酶、脂肪酶、淀粉酶活力;
s7(7)、肠道扫描电镜与肝胰脏透射电镜切片的制作和观察,进行16srdna测序,检测微生物多样性;肠道样品经过固定、漂洗、脱水、临界点干燥处理,在扫描电镜中观察、拍片
s7(8)、肠道微生物区系测定与分析:
s8、试验数据处理:试验所有统计分析采用spss20.0软件进行,数据结果均以平均数±标准差表示,对数据进行单因子方差分析后,采用duncan多重比较检验均值的差异显著性,显著性水平p采用0.05。
所述蛋白源为鱼粉、豆粕、花生粕、酵母、虾壳粉或鸡肉粉,所述淀粉源为小麦粉,所述脂质为鱼油或豆油。
所述试验基础饲料为经粉碎过80目筛选,并经混合均匀后用饲料制粒机制成直径1.5mm、长度2.5-4.0mm的颗粒饲料,颗粒饲料经20min蒸汽熟化并在空调24℃抽湿和风扇鼓风条件下72h干燥后置于-20℃冰柜中保存备用。
所述试验鱼缸为圆柱形玻璃纤维缸,缸内水盐度26~29g/l;ph7.6~7.8;溶氧浓度≥5.0mg/l;氨氮浓度<0.1mg/l;水温保持在26~29℃范围内,海水经过沉淀、沙滤、消毒处理后,分别从上端流入48只缸中,含颗粒物的尾水每天定期从底部中央排出。
试验结构如下:
1、普沙β-葡聚糖对凡纳滨对虾生长性能的影响
经过10周的饲养试验,饲料中添加β-普沙β-葡聚糖对凡纳滨对虾的增重率、特定生长率均有促进作用,如下表所示:
β-普沙β-葡聚糖对凡纳滨对虾生长性能的影响(n=6)
其中,p4组增重率和特定生长率显著高于对照组p1(p<0.05),其余组与对照组无显著性差异(p>0.05)。各组间凡纳滨对虾的成活率、肝体指数、肥满度均无显著差异(p>0.05)。
2、普沙β-葡聚糖对凡纳滨对虾饲料利用效率的影响
如下表所示,饲料中添加-普沙β-葡聚糖的含量显著影响饲料系数和蛋白质效率(p<0.05),对摄食率无显著影响(p>0.05)。p4组饲料系数显著低于对照组(p<0.05)。此外,p6组蛋白质效率显著高于对照组(p<0.05)。
普沙β-葡聚糖对凡纳滨对虾饲料利用效果的影响(n=6)
3、普沙β-葡聚糖对凡纳滨对虾饲料主要营养物质表观消化率的影响
如下表所示,饲料中添加普沙β-葡聚糖对凡纳滨对虾对饲料干物质、粗蛋白、粗脂肪的表观消化率均无显著性影响(p>0.05)。
β-普沙β-葡聚糖对凡纳滨对虾饲料主要营养物质表观消化率的影响(n=6)
4、普沙β-葡聚糖对凡纳滨对虾全虾与肌肉组成的影响:如下表所示,饲料中β-普沙β-葡聚糖含量对凡纳滨对虾全虾、肌肉主要营养组成均未见显著性影响(p>0.05)。
普沙β-葡聚糖对凡纳滨对虾全虾与肌肉组成的影响(n=6)
5、普沙β-葡聚糖对凡纳滨对虾胃、中肠与肝胰脏消化酶活性的影响
如下表所示,其中,胃、中肠的各指标组间无显著性差异(p>0.05)。肝胰脏中,p6、p7、p8组的淀粉酶活性显著高于对照组(p<0.05),脂肪酶和胰蛋白酶的活性各组间无显著性差异(p>0.05)。普沙β-葡聚糖对凡纳滨对虾胃、中肠与肝胰脏消化酶活性的影响(n=6)。
β-葡聚糖对凡纳滨对虾胃、中肠与肝胰脏消化酶活性的影响(n=6)
6、普沙β-葡聚糖对凡纳滨对虾主要血清生理生化指标的影响;如下表所示,其中p5组的白蛋白含量显著高于p8组。其余指标各组间无显著性差异。
β-葡聚糖对凡纳滨对虾血清主要生理生化指标的影响(n=6)
7、普沙β-葡聚糖对凡纳滨对虾部分血清免疫与抗氧化指标的影响
如小表所示,其中p4、p8组的总超氧化物歧化酶活性显著高于对照组。p3组的酚氧化物酶活性显著高于p8组。其余指标各组间无显著性差异。
β-葡聚糖对凡纳滨对虾部分血清免疫与抗氧化指标的影响(n=6)
8、普沙β-葡聚糖对凡纳滨对虾肝胰脏部分免疫与抗氧化指标的影响
其中p6组的丙二醛含量显著低于对照组;p4、p5组的碱性磷酸酶活性显著高于p8组。其余指标各组问无显著性差异。
β-葡聚糖对凡纳滨对虾肝胰脏部分免疫与抗氧化指标的影响(n=6)
9、普沙β-葡聚糖对凡纳滨对虾肠道和肝胰脏组织学的影响
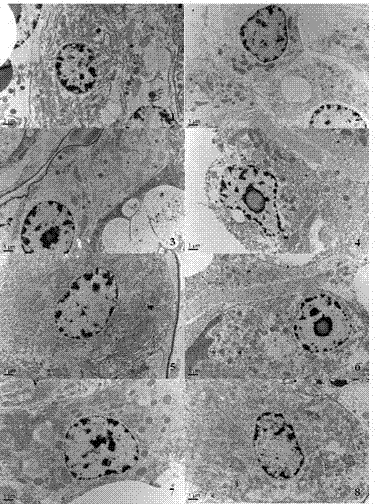
凡纳滨对虾肠道扫描电镜结果见图1。各组间中肠绒毛形态和褶皱均正常,未见有明显差异与损伤。凡纳滨对虾肝胰脏透射电镜结果见图2。各组间肝胰脏细胞均正常,未见有明显差异与损伤。细胞核膜、核仁均完整,内质网、线粒体、高尔基体等细胞器均正常,未见有明显差异与损伤。
10、普沙β-葡聚糖凡纳滨对虾肠道微生物
如图3所示,rank-abundance曲线用于同时解释样品多样性的两个方面,即样品所含物种的丰富程度和均匀程度。图3中横坐标代表物种排序的数量;纵坐标代表观测到的相对丰度。样本曲线的延伸终点的横坐标位置为该样本的物种数量,曲线快速陡然下降表明样本中的优势菌群所占比例很高,多样性较低。
图4为样品构成稀释曲线,曲线表明:当测序数量达到8000时,曲线趋于平坦表明测序已趋于饱和,增加测序数据无法再找到更多的out。
图5为shannon-wiener曲线,其中曲线的最高点shannon指数在5~7之间,表示样品多样性趋势
从shannon指数显示如下表,各组之间微生物多样性指数均存在显著性差异(p<0.05)。其中,p8>p1>p4>p5。
虾肠道微生物多样性指数(n=6)
由图6看出微生物构成中变形杆菌门(proteobacteria)为优势菌、拟杆菌门(bacteroidetes)为次优势菌。另外还有部分放线菌门(actinobacteria)和硬壁菌门(firmicutes)的细菌和少数其他种类细菌。各组间虾肠道微生物群落优势菌组成差异不明显。从属的级别来看各组之间微生物构成有很大差异(图7)。p4组的虾肠道微生物群落优势菌为octadecabacter,p1、p5和p8组的虾肠道微生物群落优势菌为弧菌属(vibrio)。普沙β-葡聚糖能增加凡纳滨对虾肠道的微生物多样性,保持肠道菌群平衡。
- 还没有人留言评论。精彩留言会获得点赞!