氧化的磷脂的制剂和剂型的制作方法与工艺
和
背景技术:
本发明涉及药理学领域,且更具体地,但是非排它地,涉及氧化的磷脂的新口服剂型。以前已经描述,氧化的磷脂(oxidizedphospholipid)可用于治疗医学病症,例如,心血管疾病、脑血管疾病和炎性疾病和障碍。本发明的受让人的国际专利申请号PCT/IL2004/000453(公开号WO04/106486)描述了用于预防和治疗与内源性氧化的脂质有关的炎症的氧化的脂质。一种示例性的这样的化合物被描述为和称为CI-201(1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱;在本领域中也称作VB-201。发现VB-201是口服活性药物,可用于治疗炎症性障碍诸如动脉粥样硬化、银屑病、多发性硬化、类风湿性关节炎和炎性肠病。本发明的受让人的国际专利申请号PCT/IL01/01080(公开号WO02/41827)描述了用于预防和治疗动脉粥样硬化和相关疾病的氧化的脂质。其它背景技术包括:国际专利申请号PCT/IL05/000735(公开号WO06/006161)、PCT/IL02/00005(公开号WO02/053092)和PCT/IL08/000013(公开号WO08/084472),它们也都属于本发明的受让人。所有上面引用的专利公开都通过引用并入,如同在本文中完整阐述。近年来,考虑到VB-201的有前途的治疗效果,进行了临床研究以便评价口服施用的VB-201的毒性、效力和药代动力学参数。得到的结果表明,每天80mgVB-201或更低的日剂量是安全的、良好耐受的,可有效地抑制炎症性过程,高百分比的VB-201被吸收进血流中,并且当每天1次地施用VB-201时,VB-201的血浆浓度是相对稳定的,并且描述在2011年1月5日提交的国际专利申请PCT/IL2011/000008中,其通过引用并入,如同在本文中完整地阐述。考虑到氧化的磷脂(例如,VB-201)的潜在治疗效果,产生了对含有氧化的磷脂(诸如VB-201)作为活性成分的工业上和药学上适用的制剂的需求。
技术实现要素:
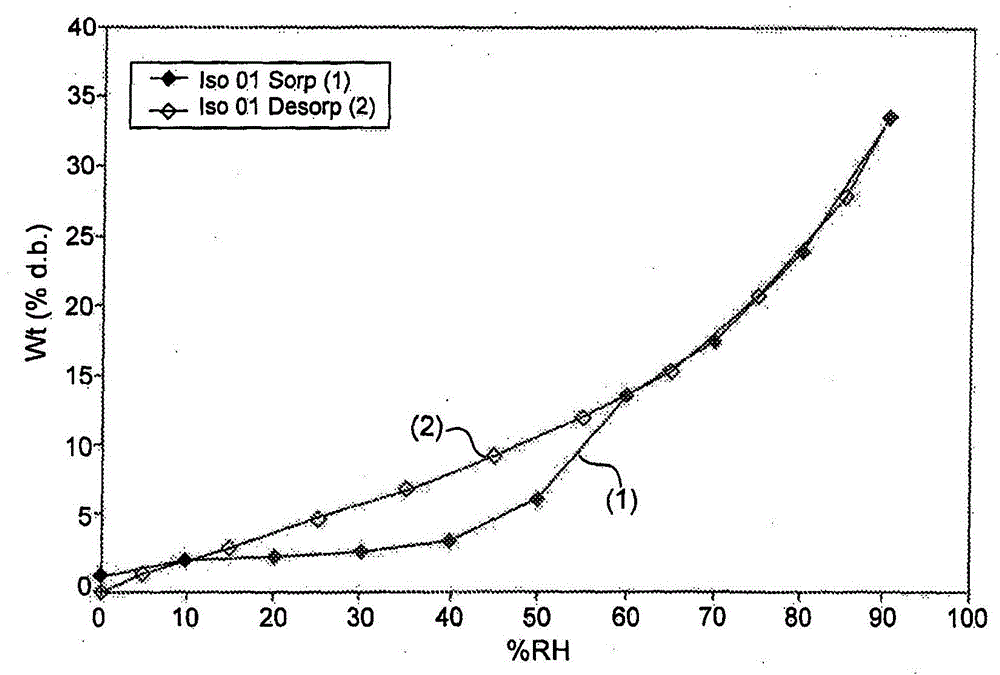
本文提供了药物组合物,其包含具有如本文中所述的结构(参见,例如,式(I)、(II)和(III))的氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和热软化载体。这些组合物可用作液体填充组合物,其可以放入药用容器诸如胶囊(例如,硬壳明胶胶囊)中。发明人已经发现,本文的有些氧化的磷脂倾向于为粘附性的(即,粘性的)和任选地吸湿的。这些物理性能可能源自在相对低温(例如,在约25-30℃)发生相变。所以,这些氧化的磷脂难以配制成传统的剂型,诸如片剂或用液体组合物填充的胶囊剂(capsules)。一种示例性的氧化的磷脂是1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱(VB-201)。胶囊剂构成药物和健康食物产品的主要剂型之一。生产液体填充胶囊剂的方法通常伴有不同的困难。例如,在可以与软胶囊结合使用的胶囊填充组合物中,活性成分需要以溶解状态处于溶剂混合物中。得到药学活性物质的适当溶液可能是挑战性的。经常不可能将药学活性物质溶解在足够小体积的溶剂中以产生从经济学和患者接受性的角度而言适当大小的胶囊剂。此外,溶剂、载体或媒介物本身必须具有足够的溶剂化能力以溶解期望的量的药学活性物质从而产生合理浓度的溶液,并且同时不会水解、溶解胶囊壳或使胶囊壳脱色。此外,所述填充组合物作为整体必须与胶囊材料在化学上相容,并在其被包囊以后避免所述材料的降解,以及是惰性的或减少与活性成分的不利化学相互作用。必须不会显著损害活性成分的生物活性。因此,当在考虑活性成分的化学性质的同时平衡所有这些特征时,会带来开发挑战。发明人已经发现,含有在液体载体中的氧化的磷脂的胶囊不是足够稳定的(例如,发生渗漏和劈裂)。预见到液体填充硬胶囊技术会克服与生产商业上可行的氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)制剂有关的重大挑战。硬胶囊通常由明胶、羟丙基甲基纤维素(HPMC)或其它合适的材料制成,且在为特定目的而建造的高速填充机上填充。可以给胶囊填充诸如粉末、颗粒、团粒、其它胶囊、液体、半固体或热固性材料等物质。发现了液体填充硬胶囊技术适合用于氧化的磷脂的制剂。进行实验来将氧化的磷脂配制成含有热软化载体的液体填充组合物。例如,在较高的温度,例如,高于60℃,所述药物组合物是足够液态的(可流动的),以将所述组合物填充进药用容器诸如胶囊中。在冷却后,所述组合物充分固化以保持同质性(homogeneity)并防止容器(例如,胶囊)的渗漏和破裂。在冷却后,固化的填充组合物会形成胶囊剂的固体或半固体基质。令人惊奇地,发明人已经进一步揭示,可以如下显著改善药物组合物、填充组合物和随后含有氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的胶囊剂批次的同质性:将氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与抗粘剂混合,例如,在使氧化的磷脂与熔化的热软化载体接触之前。例如,惊人的是,使用几乎没有或根本没有溶解性(例如,在熔化的热软化载体中)的抗粘剂增加最终制剂的同质性,通常因为预期这样的添加会降低液体填充组合物的同质性(例如,通过沉降和/或凝固)。因此,在一些实施方案中,上述药物组合物进一步包含抗粘剂。例如,通过与抗粘剂一起研磨或碾磨氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219),例如,以形成粉末掺合物,可以进一步增加药物组合物的同质性。在一些实施方案中,在使所述氧化的磷脂与所述热软化载体接触之前,将氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与抗粘剂混合(例如,一起碾磨)。例如,就氧化的磷脂在最终组合物中的空间分布而言,与抗粘剂一起碾磨氧化的磷脂增加固化的药物组合物的同质性。发明人已经进一步发现,触变剂(thixotropicagent)向药物组合物(即,液体填充组合物)中的添加会进一步增加最终制剂的上述同质性。因而,在根据任意上述实施方案的一些实施例中,所述药物组合物进一步包含触变剂或胶凝剂。例如,将触变剂或胶凝剂加入所述药物组合物中增加所述组合物的粘度,并进一步增加所述药物组合物的同质性,例如,通过防止在冷却后在组合物固化之前的成分分离。触变剂在本文的药物组合物中是特别有用的,例如,因为在填充和最终冷却之前,当搅拌停止并将组合物静置时,它们可以造成所述组合物变成“凝胶状”。在已经将所述组合物填充进胶囊中以后,触变剂也可能实现所述组合物的更快速固化,由此提高同质性。根据本发明的一些实施方案,提供了一种液体填充胶囊剂,其包含氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和固体或半固体基质,所述基质包含热软化载体。根据本发明的其它实施方案提供了一种液体填充胶囊剂,其包含氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和固体或半固体基质,所述基质包含热软化载体和抗粘剂。根据本发明的其它实施方案提供了一种液体填充胶囊剂,其包含氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和固体或半固体基质,所述基质包含热软化载体、抗粘剂和触变剂。根据本发明的一些实施方案,所述胶囊剂包含选自以下的壳材料:明胶、普鲁兰(pullulan)、淀粉和羟丙基甲基纤维素(HPMC)。根据本发明的一些实施方案,所述壳材料包含明胶。根据本发明的一些实施方案,提供了一种液体填充胶囊剂,其包含1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱(VB-201)和固体或半固体基质,所述基质包含热软化载体。根据本发明的一些实施方案,所述热软化载体具有在约40℃至约100℃范围内的熔点。根据本发明的一些实施方案,所述热软化载体选自:聚亚烷基二醇、聚亚烷基二醇衍生物和蜡。可以将油加入热软化载体中。根据本发明的一些实施方案,所述聚亚烷基二醇选自:聚乙二醇、聚丙二醇、及其共聚物。根据本发明的一些实施方案,所述热软化载体是泊洛沙姆。根据本发明的一些实施方案,所述泊洛沙姆具有在约2000至约18000道尔顿的范围内的分子量。根据本发明的一些实施方案,所述泊洛沙姆具有在约7000至约10000道尔顿的范围内的分子量。根据本发明的一些实施方案,所述泊洛沙姆包含约40至约90重量%聚乙二醇。根据本发明的一些实施方案,所述泊洛沙姆是泊洛沙姆188。根据本发明的一些实施方案,所述热软化载体是聚乙二醇。根据本发明的一些实施方案,所述聚乙二醇具有在约1500至约8000道尔顿的范围内的分子量。根据本发明的一些实施方案,所述聚乙二醇具有约6000道尔顿的分子量。根据本发明的一些实施方案,所述抗粘剂是滑石。根据本发明的一些实施方案,抗粘剂的量与VB-201的量之比是在约1:5至5:1(例如,约1:4至5:1、约1:4至约1:1或约1:3至约5:1)的范围内。根据本发明的一些实施方案,所述药物组合物或基质中的抗粘剂的浓度是在约1至约30重量%的范围内。根据本发明的一些实施方案,所述胶囊剂的药物组合物或基质进一步包含触变剂和/或胶凝剂。根据本发明的一些实施方案,所述药物组合物或基质包含触变剂。根据本发明的一些实施方案,所述触变剂是蒸气沉积二氧化硅(fumedsilica)。根据本发明的一些实施方案,所述药物组合物或基质中的触变剂的浓度是在约0.25重量%至约10重量%的范围内。根据本发明的一些实施方案,所述胶囊剂包含约1mg至约100mgVB-201。根据本发明的一些实施方案,所述胶囊剂包含约20mg至约80mgVB-201。根据本发明的一些实施方案,所述胶囊剂包含20mgVB-201。根据本发明的一些实施方案,所述胶囊剂包含40mgVB-201。根据本发明的一些实施方案,所述胶囊剂包含80mgVB-201。根据本发明的一些实施方案,所述胶囊是0号胶囊。本文进一步提供了一种用于生产药物组合物的方法,所述药物组合物包含氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和热软化载体。所述方法包括:加热热软化载体至高于所述热软化载体的熔点的温度,和使所述氧化的磷脂与所述热软化载体接触,由此得到所述药物组合物。所述方法可以进一步包括:使氧化的磷脂与抗粘剂接触(例如,混合或碾磨),例如,在使所述氧化的磷脂与所述热软化载体接触之前。所述方法可以进一步包括:将所述热软化载体与触变剂混合,例如,在使所述氧化的磷脂与所述热软化载体接触之前。本文进一步提供了一种用于生产包含1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱(VB-201)的液体填充胶囊剂的方法,所述方法包括:用包含VB-201和热软化载体的液体填充组合物填充胶囊壳,由此生产所述胶囊剂。根据本文的一些实施方案,提供了一种用于生产包含VB-201的液体填充组合物的方法,所述方法包括:在高于室温的温度将VB-201与热软化载体混合,由此得到所述液体填充组合物。根据本发明的一些实施方案,提供了通过上述的用于生产液体填充胶囊剂的方法制备的液体填充胶囊剂。根据本发明的一些实施方案,在高于室温的温度进行所述填充,并且所述液体组合物在冷却至室温以后形成固体或半固体基质。根据本发明的一些实施方案,所述方法进一步包括:将VB-201与载体混合,由此得到包含VB-201的组合物。根据本发明的一些实施方案,所述方法进一步包括:在将VB-201与载体混合之前,将VB-201与抗粘剂混合。根据本发明的一些实施方案,以在约1:5至约5:1(例如,约1:4至约1:1、或约1:3至约5:1)范围内的比例,将抗粘剂与VB-201混合。根据本发明的一些实施方案,所述组合物中的抗粘剂的终浓度是在1-30重量%的范围内。根据本发明的一些实施方案,所述方法进一步包括:将触变剂和/或胶凝剂与载体和VB-201混合。根据本发明的一些实施方案,所述方法进一步包括:将触变剂与载体和VB-201混合。根据本发明的一些实施方案,所述方法进一步包括:将所述液体填充组合物与触变剂和/或胶凝剂混合。根据本发明的一些实施方案,所述方法进一步包括:将所述液体填充组合物与触变剂混合。根据本发明的一些实施方案,加入触变剂,使得所述组合物中的触变剂的终浓度是在0.25重量%至10重量%的范围内。根据本发明的一些实施方案,所述载体具有在40℃至100℃范围内的熔点,并且在高于(above)熔点进行所述混合。根据本发明的一些实施方案,所述胶囊剂是用于治疗炎性疾病或障碍。根据本文的一些实施方案,提供了一种治疗炎性疾病或障碍的方法,所述方法包括:给有此需要的受试者施用本文描述的药物组合物或胶囊剂。根据本发明的一些实施方案,所述炎性疾病或障碍与内源性氧化的脂质有关。根据本发明的一些实施方案,所述炎性疾病或障碍选自:特发性炎性疾病或障碍、慢性炎性疾病或障碍、急性炎性疾病或障碍、自身免疫疾病或障碍、传染性的疾病或障碍、炎性的恶性疾病或障碍、炎性的移植相关的疾病或障碍、炎性的变性疾病或障碍、超敏反应相关的疾病或障碍、炎性的心血管疾病或障碍、炎性的脑血管疾病或障碍、外周血管疾病或障碍、炎性的腺性疾病(inflammatoryglandulardiease)或障碍、炎性的胃肠道疾病或障碍、炎性的皮肤疾病或障碍、炎性的肝脏疾病或障碍、炎性的神经学疾病或障碍、炎性的肌肉-骨骼疾病或障碍、炎性的肾脏疾病或障碍、炎性的生殖疾病或障碍、炎性的全身性疾病或障碍、炎性的结缔组织疾病或障碍、炎性的肿瘤、坏死、炎性的植入物相关的疾病或障碍、炎性的衰老过程、免疫缺陷疾病或障碍、增殖性疾病(proliferativedisease)或障碍和炎性的肺疾病或障碍。根据本发明的一些实施方案,所述疾病或障碍选自:银屑病、类风湿性关节炎、多发性硬化、炎性肠病、动脉粥样硬化和动脉炎症。在其它实施方案中,本文提供了一种包含VB-201的药物制剂,其中所述制剂当以约40mgVB-201的单次口服剂量口服施用给人受试者时提供约1,000ng/mL至约1,600ng/mL的VB-201的平均最大血浆浓度(Cmax)和约5小时至约10小时的达到VB-201的平均最大血浆浓度的中位时间(mediantime)(Tmax)。除非另有定义,本文所用的所有技术和/或科学术语具有与本发明所属领域普通技术人员公知的相同含义。尽管在本发明的实施方案的实践或试验中可以使用与本文所述的那些类似的或等效的方法和材料,下面描述了示例性的方法和/或材料。在相矛盾的情况下,以本专利说明书(包括定义)为准。另外,材料、方法和实施例仅是示例性的,不是限制性的。附图说明本文仅通过实施例并参考附图描述本发明的一些实施方案。现在具体地参考附图的细节,应当强调的是,显示的细节仅仅作为实例,为了示例性地讨论本发明的实施方案。在这方面,结合附图所做出的说明,使得本领域技术人员显而易见如何实践本发明的实施方案。图1A和1B的图显示了通过比重测定蒸汽吸着(sorption)分析确定的在不同相对湿度时VB-201对水的摄取。图1A呈现的动力学数据显示了随着时间而变化的摄取重量百分比(Wt(%d.b.))和相对湿度(RH(%))。图1B显示了在吸着(Iso01Sorp)和解吸(Iso01Desorp)过程中,随着相对湿度而变化的摄取重量百分比的平衡值;图2的图显示了88mgVB-201的等温量热法的结果;图3的图显示了262mgLauroglycolFCC的等温量热法的结果;图4的图显示了与262mgLauroglycolFCC混合的88mgVB-201的等温量热法的结果,显示了随着时间而变化的功率;图5是以10℃/分钟的速率加热(实线)和然后冷却(虚线)VB-201所得到的示差扫描量热法温度记录器;图6的图显示了以10℃/分钟的速率加热VB-201以后得到的VB-201的重量减轻曲线;图7的图显示了在1、10和30Hz使用0.05mm的最大位移和2℃/分钟的加热速率,随着温度而变化的VB-201的储能模量(storagemodulus);和图8的图显示了在1、10和30Hz使用0.05mm的最大位移和2℃/分钟的加热速率,随着温度而变化的VB-201的阻尼参数(tanδ)。图9的图显示了在VB-201的单次40mg口服剂量(作为实施例13的制剂10和实施例11的制剂4施用给人受试者)以后的VB-201的血浆浓度(ng/mL)。具体实施方式参考附图及附图说明,可以更好地理解本发明的原理和应用。在详细解释本发明的至少一个实施方案之前,应当理解,本发明的应用不限于在以下描述中叙述的或在实施例中例证的细节。本发明能够具有其它实施方案,或者能够以各种方式实施或进行。另外,应当理解,本文所用的短语和术语仅用于描述目的,不应认为是限制性的。本发明的发明人已经大量努力付诸识别和克服将氧化的磷脂(诸如VB-201)配制成单元剂型(unitdosageform)所遇到的许多障碍,所述单元剂型是方便施用的,可以以低成本容易地生产,且是安全的、持久的和可靠的。在实施例部分中描述了几个障碍的识别和解决方案。VB-201(在本文中和在本领域中也称作CI-201)已经在炎性病症的不同体外模型和体内动物模型中表现出作为治疗活性剂的巨大希望。VB-201目前正在进行用于治疗不同炎性病症的II期临床试验。在促进使用VB-201和其它氧化的磷脂的治疗的尝试中,本发明的发明人已经为这样的化合物设计了合适的制剂和单元剂型。现在参考附图,图1A和1B表明,有些氧化的磷脂(诸如VB-201)是吸湿的,并从环境中吸收大量的水,特别是在40%或更高的相对湿度。图2显示了等温量热法数据,所述数据指示,当暴露于周围环境时,VB-201发生转变。图3和4显示了等温量热法数据,所述数据指示,LauroglycolFCC(一种非极性溶剂)没有发生这样的转变,且能够阻止溶解于其中的VB-201发生这样的转变。图2-4确认了上述VB-201是吸湿的发现,并提示,通过提供非水性环境可以阻止VB-201对水的吸收。图5显示了示差扫描量热法数据,所述数据指示,当加热至高于约25℃时,VB-201发生相变。图6表明,观察到的转变与从VB-201样品中除去挥发性化合物无关。图7表明,当将VB-201加热至约30℃时,VB-201的储能模量显著下降。图8表明,当加热VB-201时,VB-201的阻尼参数(tanδ)在约25℃达到峰值,并且阻尼参数达到峰值时的温度取决于振荡频率。图5-8指示,VB-201在约25-30℃的温度范围内发生相变。在图7和8中呈现的数据提示,所述转变是玻璃化转变。这些结果确认了以下肉眼观察结果:VB-201在25-30℃变成粘性的和粘合的。因为本文的有些氧化的磷脂(例如,VB-201)在室温是粘性的和粘合的,将这些物质(例如,VB-201)配制成常规口服固体剂型(例如片剂或粉末掺合物胶囊剂)是不可行的,即,对于大规模生产而言。因此,进行了开发增溶的药物(其保持液体)的液体填充胶囊剂或熔化的载体(其在冷却后变成固体或半固体)的液体填充胶囊剂的研究。如在下面的实施例部分中呈现的实验结果所述,一种示例性的氧化的磷脂VB-201在液体载体中是稳定的,但是这样的制剂会导致含有在液体载体中的VB-201的胶囊的渗漏和破裂。VB-201的吸湿性质可能引起液体制剂填充的胶囊的不稳定性。如在本文中进一步描述的,如下防止前述渗漏和破裂:通过用熔化的载体(热软化载体)进行液体填充来包囊氧化的磷脂(例如,VB-201),所述载体在室温固化以形成固体基质。但是,胶囊剂中的VB-201含量的均匀度不是最佳的。在大量实验以后,本发明的发明人已经发现,当将氧化的磷脂(例如,VB-201)与熔化的载体混合时,有些氧化的磷脂(例如VB-201)的粘稠度和粘着性会导致胶囊剂均匀度的下降。氧化的磷脂(例如,VB-201)的粘稠度和粘着性也使得通过固体填充(例如,使用粉末化的VB-201)来包囊氧化的磷脂(例如,VB-201)成为次优选的包囊方法。如在实施例部分中进一步证实的,本发明的发明人已经设计了新方法来克服氧化的磷脂(例如,VB-201)的粘稠度和粘着性,由此允许生产以高均匀度为特征的氧化的磷脂(例如,VB-201)制剂。在一些实施例中,改进的制剂是具有固体或半固体基质的胶囊剂。所述基质会减少氧化的磷脂(例如,VB-201)的水吸收,由此防止吸收的不良作用,诸如破裂和渗漏。药物组合物因此,本文提供了药物组合物(例如,液体填充组合物),其包含作为活性药物成分(例如,VB-201、VB-208、VB-221或VB-219)的氧化的磷脂和如本文中所述的热软化载体。本文描述了可用在上述药物组合物中的氧化的磷脂和热软化载体。在一个实施例中,所述药物组合物适合填充进药用容器诸如胶囊(例如,液体填充硬壳胶囊)中;例如,在加热以产生液体组合物之后。在一些实施方案中,本文提供了药物组合物(例如,液体填充组合物),其包含作为活性药物成分(例如,VB-201、VB-208、VB-221或VB-219)的氧化的磷脂、如本文中所述的热软化载体和如本文中所述的抗粘剂。在其它实施方案中,本文提供了药物组合物(例如,液体填充组合物),其包含作为活性药物成分(例如,VB-201、VB-208、VB-221或VB-219)的氧化的磷脂、如本文中所述的热软化载体、如本文中所述的抗粘剂和如本文中所述的触变剂。因而,在一些实施方案中本文提供了一种药物组合物,其包含VB-201和热软化载体。本文中公开了示例性的热软化载体。在其它实施方案中,本文提供了一种药物组合物,其包含VB-201、热软化载体和抗粘剂。本文描述了示例性的热软化载体和抗粘剂。预见到公开的热软化载体和抗粘剂的任意组合。在其它实施方案中,本文提供了一种药物组合物,其包含VB-201、热软化载体、抗粘剂和触变剂。本文描述了示例性的热软化载体、抗粘剂和触变剂。预见到公开的热软化载体、抗粘剂和触变剂的任意组合。在一些实施方案中,本文提供了一种药物组合物,其包含:热软化载体;触变剂,其浓度为所述热软化载体和所述触变剂的组合重量的约0.25重量%至约10重量%;氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219),例如,其浓度为所述药物组合物的总重量的约0.1重量%至约25重量%;和抗粘剂,抗粘剂:氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比为约1:5至约5:1。在一些实施方案中,本文提供了一种药物组合物,其包含:热软化载体;触变剂,其浓度为所述热软化载体和所述触变剂的组合重量的约0.5重量%至约5重量%(例如,约1重量%至约3重量%);氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219),例如,其浓度为所述药物组合物的总重量的约4重量%至约18重量%;和抗粘剂,抗粘剂:氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比为约1:4至约2:1。液体填充胶囊剂在一些实施方案中,本文提供了一种制剂,例如,液体填充胶囊剂,其包含固体或半固体基质和氧化的磷脂,其中所述基质包含如本文中所述的热软化载体。所述液体填充胶囊剂可以进一步包括如本文中所述的抗粘剂和任选的如本文中所述的触变剂。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:热软化载体(例如,泊洛沙姆188);约1mg至约100mg(例如,约20mg至约80mg)氧化的磷脂(例如,VB-201);抗粘剂,其重量比为约1:5至5:1(抗粘剂:氧化的磷脂(例如,VB-201);和触变剂(例如,蒸汽二氧化硅(fumedsilicondioxide)),其浓度为所述热软化载体和所述触变剂的组合重量的约0.25重量%至约10重量%(例如,1重量%至约3重量%)。根据本文的其它实施方案,提供了一种液体填充胶囊剂,其包含:热软化载体(例如,泊洛沙姆188);约1mg至约100mg(例如,约20mg至约80mg)VB-201;滑石,其重量比为约1:5至5:1(滑石:VB-201);和触变剂(例如,蒸汽二氧化硅),其浓度为所述热软化载体和所述触变剂的组合重量的约0.5重量%至约5重量%(例如,约1重量%至约3重量%)。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:热软化载体,其选自泊洛沙姆(例如,泊洛沙姆188)和具有分子量约6000至约8000的聚乙二醇;约1mg至约100mg(例如,约20mg至约80mg)VB-201;滑石,其重量比为约1:4至约1:1(滑石:VB-201);和触变剂(例如,蒸汽二氧化硅),其浓度为所述热软化载体和所述触变剂的组合重量的约0.5重量%至约5重量%(例如,约1重量%至约3重量%)。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:热软化载体,其选自泊洛沙姆(例如,泊洛沙姆188)和具有分子量约6000至约8000的聚乙二醇;约20mg至约100mg(例如,约20mg至约80mg)VB-201;滑石,其重量比为约1:4至约1:1(滑石:VB-201);和触变剂(例如,蒸汽二氧化硅),其浓度为所述热软化载体和所述触变剂的组合重量的约1重量%至约3重量%。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含约400mg至约600mg固体或半固体基质,所述基质由以下物质组成:约20mg至约100mg(例如,约20mg至约80mg)VB-201;约5mg至约100mg(例如,约10mg至约80mg)抗粘剂(例如,滑石);约2mg至约20mg(例如,约4mg至约12mg)触变剂(例如,蒸汽二氧化硅);和余量为热软化载体。所述热软化载体可以选自例如泊洛沙姆(例如,泊洛沙姆188)和具有分子量约6000至约8000的聚乙二醇。根据一些实施方案,提供了一种液体填充胶囊剂,其包含胶囊壳和填充组合物(基质),所述填充组合物包含:热软化载体;氧化的磷脂,其浓度为约0.1重量%至约25重量%;抗粘剂,抗粘剂:氧化的磷脂的重量比为约1:5至约5:1;和触变剂,其浓度为所述热软化载体和所述触变剂的组合重量的约0.25重量%至约10重量%。根据一些实施方案,提供了一种液体填充胶囊剂,其包含胶囊壳和填充组合物(基质),所述填充组合物包含:热软化载体;VB-201,其浓度为约0.1重量%至约25重量%;抗粘剂,抗粘剂:VB-201的重量比为约1:5至约5:1;和触变剂,其浓度为所述热软化载体和所述触变剂的组合重量的约0.25重量%至约10重量%。根据一些实施方案,提供了一种液体填充胶囊剂,其包含胶囊壳和填充组合物(基质),所述填充组合物包含:热软化载体;VB-201,其浓度为约4重量%至约25重量%;抗粘剂,抗粘剂:VB-201的重量比为约1:4至约2:1;和触变剂,其浓度为热软化载体和触变剂的组合重量的约1重量%至约5重量%。任选地,所述胶囊剂包含约400mg至约600mg含有上述成分的填充组合物。任选地,所述胶囊剂包含约440mg至约600mg含有上述成分的填充组合物。任选地,所述胶囊剂包含约440mg至约480mg含有上述成分的填充组合物。任选地,所述胶囊剂大约包含约560mg至约600mg含有上述成分的填充组合物。在根据任意上述实施方案的一些实施例中,所述胶囊剂中的热软化载体和触变剂(如果存在的话)的总重量是约400mg。在一些实施方案中,这样的胶囊剂包含约1mg至约100mg氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)。在一些实施方案中,抗粘剂(例如,滑石)与VB-201的比例为1:1,使得所述胶囊剂包含,例如,各自20mg的VB-201和抗粘剂、各自40mg的VB-201和抗粘剂、各自80mg的VB-201和抗粘剂、或各自100mg的VB-201和抗粘剂。在一些实施方案中,所述胶囊剂包含20mgVB-201、20mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,440mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含40mgVB-201、40mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,480mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含80mgVB-201、80mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,560mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含100mgVB-201、100mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,600mg填充组合物/胶囊剂)。在其它实施方案中,抗粘剂(例如,滑石)与VB-201的比例为1:2,使得所述胶囊剂包含,例如,20mgVB-201和10mg抗粘剂、40mgVB-201和20mg抗粘剂、60mgVB-201和30mg抗粘剂、80mgVB-201和40mg抗粘剂、或100mgVB-201和50mg抗粘剂。在一些实施方案中,所述胶囊剂包含20mgVB-201、10mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,430mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含40mgVB-201、20mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,460mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含60mgVB-201、30mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,490mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含80mgVB-201、40mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,520mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含100mgVB-201、50mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,550mg填充组合物/胶囊剂)。在其它实施方案中,抗粘剂(例如,滑石)与VB-201的比例为1:4,使得所述胶囊剂包含,例如,20mgVB-201和5mg抗粘剂、40mgVB-201和10mg抗粘剂、60mgVB-201和15mg抗粘剂、80mgVB-201和20mg抗粘剂、或100mgVB-201和25mg抗粘剂。在一些实施方案中,所述胶囊剂包含20mgVB-201、5mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,425mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含40mgVB-201、10mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,450mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含60mgVB-201、15mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,475mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含80mgVB-201、20mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,500mg填充组合物/胶囊剂)。在其它实施方案中,所述胶囊剂包含100mgVB-201、25mg抗粘剂(例如,滑石)和400mg热软化载体+触变剂(例如,525mg填充组合物/胶囊剂)。在根据任意上述实施方案的一个实施例中,所述载体是泊洛沙姆(例如,泊洛沙姆188)。任选地,所述载体是具有约6000(例如,±10%)的分子量的聚乙二醇。在胶囊剂包含约400mg热软化载体和触变剂的实施方案中,所述胶囊剂包含,例如,每个胶囊剂20mgVB-201、20mg抗粘剂和总计440mg填充组合物;每个胶囊剂40mgVB-201、40mg抗粘剂和480mg填充组合物;或每个胶囊剂80mgVB-201、80mg抗粘剂和560mg填充组合物。任选地,所述载体是泊洛沙姆(例如,泊洛沙姆188)。任选地,所述载体是具有6000(±10%)的分子量的聚乙二醇。所述400mg热软化载体+触变剂可以由例如12mg触变剂+388mg载体、10mg触变剂+390mg载体、或4mg触变剂+396mg热软化载体组成。所述触变剂任选地是所述触变剂和所述热软化载体的组合重量的约1至约5重量%,例如,约1重量%至约3重量%、约2重量%至约3重量%、或约2.5重量%至约3重量%触变剂(例如,蒸气沉积二氧化硅)。例如,所述填充组合物可以含有12mg触变剂和388mg热软化载体、10mg触变剂和390mg热软化载体、9mg触变剂和351mg热软化载体、或7mg触变剂和273mg热软化载体。在其它实施例中,所述填充组合物可以含有9mg触变剂和391mg热软化载体、8mg触变剂和392mg热软化载体、7mg触变剂和393热软化载体、6mg触变剂和394mg热软化载体、5mg触变剂和395mg热软化载体、4mg触变剂和396mg热软化载体、或3mg触变剂和397mg热软化载体。在一些实施方案中,所述热软化载体是聚乙二醇载体,且所述填充组合物包含约2.5重量%的触变剂(例如,蒸气沉积二氧化硅),例如,390mg聚乙二醇载体(例如,PEG6000)+10mg触变剂。在其它实施方案中,所述填充组合物包含聚乙二醇载体(例如,PEG6000)和约1重量%触变剂(例如,蒸气沉积二氧化硅),例如,396mg载体+4mg触变剂。在一些实施方案中,所述热软化载体是泊洛沙姆(例如,泊洛沙姆188),且所述填充组合物包含约3重量%触变剂(例如,蒸气沉积二氧化硅),例如,388mg载体+12mg触变剂,在一些实施方案中,所述热软化载体是泊洛沙姆(例如,泊洛沙姆188),且所述填充组合物包含约1重量%触变剂(例如,蒸气沉积二氧化硅),例如,396mg热软化载体和4mg触变剂。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:VB-201,其浓度范围为0.1重量%至25重量%;抗粘剂,抗粘剂:VB-201的重量比范围为1:3至5:1;触变剂,其浓度范围为0.25重量%至10重量%;和余量为热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:约20mg至约100mgVB-201;5mg至约100mg抗粘剂;2mg至约12mg触变剂;和388mg至约398mg热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:20mgVB-201;20mg抗粘剂;12mg触变剂;和388mg热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:20mgVB-201;20mg滑石;12mg蒸气沉积二氧化硅;和388mg泊洛沙姆188。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:40mgVB-201;40mg抗粘剂;12mg触变剂;和388mg热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:40mgVB-201;40mg滑石;12mg蒸汽二氧化硅;和388mg泊洛沙姆。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:40mgVB-201;40mg滑石;12mg蒸汽二氧化硅;和388mg泊洛沙姆188。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:40mgVB-201;10mg抗粘剂;4mg触变剂;和396mg热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:40mgVB-201;10mg滑石;4mg蒸汽二氧化硅;和396mg泊洛沙姆。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:40mgVB-201;10mg滑石;4mg蒸汽二氧化硅;和396mg泊洛沙姆188。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:60mgVB-201;15mg抗粘剂;4mg触变剂;和396mg热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:60mgVB-201;15mg滑石;4mg蒸汽二氧化硅;和396mg泊洛沙姆。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:60mgVB-201;15mg滑石;4mg蒸汽二氧化硅;和396mg泊洛沙姆188。根据本发明的一些实施方案,提供了一种液体填充胶囊剂,其包含:80mgVB-201;80mg抗粘剂;12mg触变剂;和388mg热软化载体。根据本发明的一些实施方案,提供了一种液体填充胶囊剂,其包含:80mgVB-201;80mg滑石;12mg蒸气沉积二氧化硅;和388mg泊洛沙姆188。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:80mgVB-201;20mg抗粘剂;4mg触变剂;和396mg热软化载体。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:80mgVB-201;20mg滑石;4mg蒸汽二氧化硅;和396mg泊洛沙姆。根据本文的一些实施方案,提供了一种液体填充胶囊剂,其包含:80mgVB-201;20mg滑石;4mg蒸汽二氧化硅;和396mg泊洛沙姆188。在其它实施方案中,本文提供了一种胶囊剂,其包含VB-201和热软化载体。液体填充组合物所述液体填充组合物是适合填充进药用容器(例如,液体填充胶囊)中的本文的药物组合物。根据本文的一些实施方案,提供了一种液体填充组合物,其包含VB-201、VB-208、VB-219和/或VB-221、和如本文中所述的热软化载体、和任选的如本文中所述的抗粘剂、触变剂和/或胶凝剂中的一种或多种。任选地,所述液体填充组合物仅在高于室温(即,高于25℃)的温度是液体。根据本文的其它实施方案,提供了一种液体填充组合物,其包含VB-201和如本文中所述的热软化载体、和任选的如本文中所述的抗粘剂、触变剂和/或胶凝剂中的一种或多种。任选地,所述液体填充组合物仅在高于室温(即,高于25℃)的温度是液体。本文中在药物组合物的背景下描述了液体填充组合物的各种成分的量、比例和浓度。本文中也描述了用于混合各种成分以得到液体填充组合物的方法和操作。提供药代动力学参数的制剂在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax)。在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax)。在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供这样的血浆浓度时间曲线:其平均曲线下面积(AUC∞)范围为约45,000至约70,000ngh/mL,例如,约50,000至约65,000ngh/mL、或约55,000至约60,000ngh/mL。在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供在约32小时至约42小时之间(例如,在约35小时至约40小时之间、或在约36小时至约38小时之间、或约37小时)的平均终末半衰期(t1/2)。在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax)和约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax)。在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供:约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax),约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax),和在约45,000至约70,000ngh/mL(例如,约50,000至约65,000ngh/mL、或约55,000至约60,000ngh/mL)范围内的平均曲线下面积(AUC∞)。在一些实施方案中,当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,根据本文描述的任意实施方案的药物组合物或液体填充胶囊剂提供:约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax),约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax),在约45,000至约70,000ngh/mL(例如,约50,000至约65,000ngh/mL、或约55,000至约60,000ngh/mL)范围内的平均曲线下面积(AUC∞),和在约32小时至约42小时之间(例如,在约35小时至约40小时之间、或在约36小时至约38小时之间、或约37小时)的平均终末半衰期(t1/2)。在一些实施方案中,本文提供了一种VB-201制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax)。在一些实施方案中,本文提供了一种VB-201制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时提供约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax)。在一些实施方案中,本文提供了一种VB-201制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供这样的血浆浓度时间曲线:其具有在约45,000至约70,000ngh/mL(例如,约50,000至约65,000ngh/mL、或约55,000至约60,000ngh/mL)范围内的平均曲线下面积(AUC∞)。在一些实施方案中,本文提供了一种VB-201制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供在约32小时至约42小时之间(例如,在约35小时至约40小时之间、或在约36小时至约38小时之间、或约37小时)的平均终末半衰期(t1/2)。在一些实施方案中,本文提供了一种制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax)和约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax)。在一些实施方案中,本文提供了一种制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供:约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax),约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax),和具有在约45,000至约70,000ngh/mL(例如,约50,000至约65,000ngh/mL、或约55,000至约60,000ngh/mL)范围内的平均曲线下面积(AUC∞)的血浆浓度时间曲线。在其它实施方案中,本文提供了一种包含VB-201的药物制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供:约1,000ng/mL至约1,600ng/mL(例如,约1,100ng/mL至约1,500ng/mL、或约1,200ng/mL至约1,400ng/mL、或约1,200ng/mL至约1,300ng/mL)的VB-201的平均最大血浆浓度(Cmax),约5小时至约10小时(例如,约5小时至约7.5小时、或约6小时至约6.5小时)的达到VB-201的平均最大血浆浓度的中位时间(Tmax),具有在约45,000至约70,000ngh/mL(例如,约50,000至约65,000ngh/mL、或约55,000至约60,000ngh/mL)范围内的平均曲线下面积(AUC∞)的血浆浓度时间曲线,和在约32小时至约42小时之间(例如,在约35小时至约40小时之间、或在约36小时至约38小时之间、或约37小时)的平均终末半衰期(t1/2)。在其它实施方案中,本文提供了一种包含VB-201的药物制剂,其中所述制剂当口服施用给人受试者(例如,以约40mgVB-201的单次口服剂量)时,提供下述具有指定标准差(SD)的Cmax、Tmax、AUC和t1/2的平均值:Cmax(ng/mL):1289.74(SD:232.25)Tmax(h):6.00(平均值)(5.00-10.00)AUCT(ng·h/mL):53200(SD:12500)AUC∞(ng·h/mL):57500(SD:12000)t1/2(h):37.4(SD:4.98)Cmax(ng/mL):1298.08(SD:230.97)Tmax(h):6.50(平均值)(5.00-9.00)AUCT(ng·h/mL):55000(SD:13900)AUC∞(ng·h/mL):58900(SD:14500)t1/2(h):37.2(SD:6.07)在一些实施例中,根据任意上述实施方案,所述VB-201制剂选自本文描述的液体填充胶囊制剂(例如,含有约40mgVB-201的液体填充胶囊剂)。在根据任意上述实施方案的一些实施例中,所述制剂选自实施例13的制剂10、实施例11的制剂4和实施例12的制剂7。在一些实施方案中,如在实施例15中所述测量上述的药代动力学参数。氧化的磷脂在一些实施方案中,可用在本文的制剂、药物组合物、液体填充组合物、胶囊剂和方法中的活性药物成分包括至少一种氧化的磷脂。所述氧化的磷脂可以以在室温(即,25℃)至少某种程度的粘着性或粘稠度为特征。在根据本文描述的任意实施方案的一个实施例中,所述氧化的磷脂具有根据式(I)的结构:在式(I)中,R1是C10-C30直链或支链烷基。在一些实施例中,R1是C12-C30直链或支链烷基。在一些实施例中,R1是C14-C30直链或支链烷基。在其它实施例中,R1是C12-C25直链或支链烷基。在其它实施例中,R1是C12-C20直链或支链烷基。在其它实施例中,R1是C14-C20直链或支链烷基。在其它实施例中,R1是C16-C20直链或支链烷基。在其它实施例中,R1选自:十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、顺式-9-十六烯基和(2-辛基)十二烷基。在其它实施例中,R1是支链C10-C30烷基。在另一个实施例中,R1是支链C12-C20烷基。在另一个实施例中,式(I)中的R1是十六烷基(-C16H33)。在式(I)中,R3选自:磷酸乙醇胺、磷酸胆碱、硫代磷脂酰胆碱、磷酸乙醇胺-N-戊二酸和磷酸丝氨酸。在一个实施例中,R3选自:磷酸乙醇胺和磷酸胆碱。在一些实施方案中R3是磷酸胆碱。式(I)中的R5是选自H、负电荷和C1-C6直链或支链烷基的成员。在一些实施例中,R5是C1-C4直链或支链烷基。在其它实施例中,R5选自H、负电荷、甲基和乙基。在一些实施例中,R5选自H和负电荷。在其它实施例中,式(I)中的R5是H。在其它实施例中,式(I)中的R5是甲基。在式(I)中,X1是C2-C6亚烷基。在一些实施例中,X1是C3-C6亚烷基。在其它实施例中,X1是C3、C4、C5或C6亚烷基。在其它实施例中,X1是C4或C5亚烷基。在其它实施例中,式(I)中的X1是C4亚烷基(-CH2-CH2-CH2-CH2-)。在一些实施例中,式(I)中的R3是磷酸胆碱,且所述氧化的磷脂具有根据式(II)的结构:其中R1、R5和X1如关于式(I)所定义。在式(II)的一个实施例中,R1选自:十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、顺式-9-十六烯基和(2-辛基)十二烷基。在另一个实施例中,式(II)中的R1是十六烷基(-C16H33)。在式(II)的另一个实施例中,X1是C4或C5亚烷基。在另一个实施例中,式(II)中的X1是C4亚烷基(-CH2-CH2-CH2-CH2-)。在式(II)的一个实施例中,R5是H、负电荷或甲基。在式(II)的另一个实施例中,R1选自:十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、顺式-9-十六烯基和(2-辛基)十二烷基、X1是C4或C5亚烷基,且R5是H、负电荷或甲基。在其它实施例中,式(II)中的X1是C4亚烷基(-CH2-CH2-CH2-CH2-),且所述氧化的磷脂具有根据式(III)的结构:其中R1和R5如关于式(I)所定义。在式(III)的一个实施例中,R1选自:十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、顺式-9-十六烯基和(2-辛基)十二烷基。在式(III)的另一个实施例中,R5是H、负电荷或甲基。在式(III)的另一个实施例中,R5是H或负电荷。在式(III)的另一个实施例中,R1选自:十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、顺式-9-十六烯基和(2-辛基)十二烷基,且R5是H、负电荷或甲基。在另一个实施例中,式(III)中的R1是十六烷基(-C16H33)。在另一个实施例中,式(III)中的R1是十六烷基(-C16H33),且R5是H、负电荷或甲基。式(I)、(II)和(III)的结构意图包括所有立体异构体及其混合物。在一些实施方案中,所述氧化的磷脂是具有下式的VB-201[1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱]:在一些实施方案中,所述氧化的磷脂是具有下式的VB-208[1-十六烷基-2-(4'-甲基-羧基丁基)-甘油-3-磷酸胆碱]:在一些实施方案中,所述氧化的磷脂是具有下式的VB-219[1-二十烷基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱]:在一些实施方案中,所述氧化的磷脂是具有下式的VB-221[1-(2'-辛基)十二烷基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱]:根据本发明的实施方案的VB-201可以是1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱的手性对映异构体,即,(R)-对映异构体((R)-1-十六烷基-2-(4’-羧基丁基)-sn-甘油-3-磷酸胆碱)或(S)-对映异构体((S)-1-十六烷基-2-(4’-羧基丁基)-甘油-3-磷酸胆碱),或它们的混合物(例如,外消旋体)。根据示例性实施方案,VB-201是(R)-1-十六烷基-2-(4’-羧基丁基)-sn-甘油-3-磷酸胆碱。在一些实施方案中,本文的组合物包括超过一种氧化的磷脂,例如,2种、3种或更多种氧化的磷脂,其各自独立地选自本文描述的那些。胶囊剂本文使用的一般术语“胶囊”或“胶囊剂”意图包括适合于口服的任意合适的囊状容器或盒子(case),例如,适合用于与液体填充组合物结合使用的那些。术语“胶囊”包括具有由软和/或硬材料组成的壳的胶囊,所述材料诸如明胶、淀粉、纤维素、纤维素衍生物(例如,羟丙基甲基纤维素)、水胶体、树胶(gum)、角叉菜胶或可以用于包囊液体组合物和被动物摄入的任意其它天然的或合成的材料。任选地,所述壳材料是明胶和/或羟丙基甲基纤维素。在任选的实施方案中,所述壳材料是明胶。术语“胶囊剂”意图包括多种胶囊形状和大小,且无意将该剂型限制至特定类型或形状。预见到任意商购可得的胶囊壳或壳材料。在一些实施方案中,所述胶囊是0号胶囊。在一些实施方案中,所述胶囊是1号胶囊。在一些实施方案中,所述胶囊是2号胶囊。在一些实施方案中,所述胶囊是3号胶囊。也预见到其它胶囊尺寸。可以配制胶囊剂例如用于口服施用或作为栓剂。根据示例性实施方案,配制胶囊剂用于口服施用。因此,根据本实施方案,胶囊剂由基质和壳组成,所述基质含有在其中的药学活性成分(例如,VB-201、VB-208、VB-221或VB-219),和包囊所述基质的所述壳。在一些实施方案中,所述胶囊剂是液体填充胶囊剂。术语“液体填充胶囊剂”表示在包囊过程中用液体填充组合物填充的胶囊剂。应当理解,在包囊以后,所述填充组合物不需要保持液态,并且术语“液体填充”因此不一定指示最终的胶囊剂含有任何液体。在一个实施例中,所述液体填充胶囊剂是硬壳胶囊剂(例如,硬壳明胶胶囊剂)。在一些实施方案中,包含活性药物成分(例如,VB-201、VB-208、VB-221或VB-219)的液体填充胶囊剂是在含有活性成分的基质(例如,药学上可接受的载体)内的增溶形式。在一些实施方案中,所述液体填充胶囊剂使得,含有活性药物成分(例如,VB-201、VB-208、VB-221或VB-219)的基质是固体或半固体。短语“固体或半固体基质”在本文中表示,在室温(例如,25℃)为固体或半固体的基质。术语“半固体”包括凝胶和非常粘稠的物质,例如,特征在于至少约50,000厘泊和任选地至少约200,000厘泊的粘度的物质。通常,所述固体或半固体基质由液体填充组合物的组分形成(例如,通过冷却)。应当理解,包含固体或半固体基质的胶囊剂可抗渗漏,因为固体或半固体基质不容易从胶囊渗漏。不受任何特定理论约束,还认为固体或半固体基质会如下防止胶囊的破裂和胶囊内容物的渗漏:使氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与水分隔离,由此防止氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)从环境(例如,从胶囊壳)吸收水分,所述吸收水分会促进破裂。载体本文使用的术语“载体”表示一种物质或多种物质的混合物,任选地为一种惰性物质,加入其以促进胶囊剂的制备和氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的施用。在一些实施方案中,所述载体是药学上可接受的载体。在本文中,短语“药学上可接受的载体”描述这样的载体或稀释剂:其不会造成对受试者的显著刺激,且不会废除活性药物成分(例如,VB-201、VB-208、VB-221或VB-219)的生物活性和性能。所述载体包括热软化载体,且可以包括额外组分,诸如其它赋形剂、稀释剂、着色剂等。热软化载体本文使用的术语“热软化载体”表示,在加热至高于室温的温度以后变软(例如,流体)的载体。热软化载体在不损伤活性药物成分(例如,通过氧化)或热软化载体自身的温度变软。在加热以后的软化可以以相变(例如,固体至液体转变)为特征或不以相变为特征(例如,无定形物的软化)。热软化是可逆的,使得软化的载体在冷却回室温以后变得更硬。在一些实施方案中,所述热软化载体是2种或更多种试剂的混合物。所述热软化载体会促进液体填充组合物的制备和在所述热软化载体变软的温度用所述液体填充组合物填充胶囊,以及在冷却(例如,冷却至室温)后固体或半固体基质的形成。在一个实施例中,所述热软化载体在低于35℃或低于30℃(例如,在室温,即,25℃)的温度为固体或半固体。在一个实施例中,所述热软化载体是不吸湿的。所述热软化载体是药学上可接受的载体。所述热软化载体任选地在不超过约150℃的温度和任选地在不超过约100℃的温度或90℃变软。在一些实施方案中,所述热软化载体具有在约40℃至约100℃范围内的熔点。任选地,所述熔点是在约50℃至约80℃的范围内。在其它实施例中,所述热软化载体的熔点是约50℃至约70℃,或约50℃至约60℃,和任选地在约55℃至约65℃的范围内。因此,在这样的温度,所述热软化载体发生从硬材料至软材料的转化,反之亦然。在一个实施例中,在高于它的熔点的温度的热软化载体是足够软的,以将所述载体填充进胶囊(例如,硬明胶胶囊)中。热软化载体的例子包括蜡类、泊洛沙姆(例如,泊洛沙姆188)、聚乙二醇甘油酯、高分子量PEG(例如,PEG6000或PEG8000)、甘油单油酸酯或单硬脂酸酯、氢化的或部分地氢化的甘油酯(例如,氢化棕榈仁油或氢化棉籽油))、GeluciresTM和硬脂肪诸如蜂蜡。其它示例性的热软化载体包括SoftisanTM和十六烷-1-醇。所述热软化载体可以是聚亚烷基二醇。在一个实施例中,所述聚亚烷基二醇具有高分子量,例如,足以使聚亚烷基二醇载体为不吸湿的分子量(例如,具有至少约1000道尔顿或至少约1500道尔顿的分子量的聚亚烷基二醇)。在一个实施例中,所述聚亚烷基二醇具有至少约2000道尔顿的分子量。在另一个实施例中,所述聚亚烷基二醇具有至少约3000道尔顿的分子量。在另一个实施例中,所述聚亚烷基二醇具有至少约4000道尔顿的分子量。在另一个实施例中,所述聚亚烷基二醇具有至少约5000道尔顿的分子量。在另一个实施例中,所述聚亚烷基二醇具有至少约6000道尔顿的分子量。应当理解,与本文描述的聚亚烷基二醇有关的分子量意图代表根据这类化合物的常用命名法的平均分子量。合适的聚亚烷基二醇包括、但不限于,聚乙二醇、聚丙二醇及其共聚物,诸如泊洛沙姆(例如,泊洛沙姆188、237、338和407)。在一些实施方案中,所述聚亚烷基二醇是泊洛沙姆。因此,在一些实施方案中,所述热软化载体是泊洛沙姆。泊洛沙姆是三段式聚亚烷基二醇,其包含中央的聚丙二醇链(其是相对疏水的)和侧接的2个聚乙二醇链(其是相对亲水的)。疏水链和亲水链的这种组合提供具有表面活性剂性能的泊洛沙姆。通常通过泊洛沙姆的聚丙二醇核心的分子量和聚乙二醇相对于聚丙二醇的比例来表征泊洛沙姆。通常如下描述这些参数:用三位数字表征泊洛沙姆,其中前2位数当乘以100时给出聚丙二醇核心的分子量(按道尔顿计),而最后一位数当乘以10时给出聚乙二醇的百分比。因而,例如,泊洛沙姆188具有分子量为1800道尔顿的聚丙二醇核心,且是80%聚乙二醇(且因而具有大约9000道尔顿的总分子量),而泊洛沙姆407具有分子量为4000道尔顿的聚丙二醇核心,且是70%聚乙二醇(且因而具有大约13000道尔顿的总分子量)。根据一些实施方案,所述泊洛沙姆具有在约2000至约18000道尔顿的范围内的分子量。任选地,所述泊洛沙姆具有在约4000-15000道尔顿、和任选地约6000至约12000道尔顿的范围内的分子量。在示例性实施方案中,所述泊洛沙姆的分子量是在约7000至约10000道尔顿的范围内。在其它实施例中,所述泊洛沙姆具有分子量约4000至约18,000道尔顿、约6000至约18,000道尔顿、约6000至约14,000道尔顿、或约8000至约10,000道尔顿。在一个实施例中,所述泊洛沙姆具有约9000道尔顿的分子量。根据一些实施方案,所述泊洛沙姆的聚丙烯(polypropylene)核心具有在约1000至约5000道尔顿的范围内的分子量。任选地,所述泊洛沙姆的聚丙烯核心具有在约1200至约2400道尔顿、和任选地约1500至约2100道尔顿的范围内的分子量。在示例性实施方案中,所述泊洛沙姆的聚丙烯核心的分子量是约1800道尔顿。根据一些实施方案,所述泊洛沙姆包含至少约20重量%的聚乙二醇,任选地至少约30重量%、任选地至少约40重量%、任选地至少约50重量%、任选地至少约60重量%、任选地至少约70重量%、和任选地至少约80重量%的聚乙二醇。在一些实施方案中,所述泊洛沙姆中的聚乙二醇的比例是在以下的范围内:40-90重量%,任选地50-90重量%,任选地60-90重量%、和任选地70-90重量%。在示例性实施方案中,所述泊洛沙姆包含约80重量%聚乙二醇。泊洛沙姆188是一种示例性的泊洛沙姆。因此,在一些实施方案中,所述热软化载体是泊洛沙姆188。在一些实施方案中,所述热软化载体是聚乙二醇。任选地,所述聚乙二醇具有在以下范围内的分子量:约1500至约10,000道尔顿,或约1500至约8000道尔顿,任选地约4000至约8000道尔顿,和任选地约5000至约7000道尔顿。在示例性实施方案中,所述聚乙二醇具有约6000道尔顿的分子量。在一个实施例中,所述聚乙二醇具有至少约2000道尔顿的分子量。在另一个实施例中,所述聚乙二醇具有至少约3000道尔顿的分子量。在另一个实施例中,所述聚乙二醇具有至少约4000道尔顿的分子量。在另一个实施例中,所述聚乙二醇具有至少约5000道尔顿的分子量。在另一个实施例中,所述聚乙二醇具有至少约6000道尔顿的分子量。在一个实施方案中,所述热软化载体选自PEG6000、泊洛沙姆188和它们的组合。本文使用的短语“聚(亚烷基二醇)”或“聚亚烷基二醇”包括共有下述通式的聚醚聚合物家族:-O-[(CR2)m-O-]n-,其中每个R独立地是氢或烷基,m代表每个亚烷基二醇单元中的聚合物主链的碳原子的数目,且n代表重复单元的数目。例如,当m=2且R是氢时,所述聚合物被称作聚乙二醇。当m=3且R是氢时,或当m=2且每个单元中的一个R是甲基(且其它R基团为氢)时,所述聚合物被称作聚丙二醇。在一些实施方案中,m是大于1的整数(例如,m=2,3,4,等)。任选地,m在聚(亚烷基二醇)链的单元之间变化。例如,聚(亚烷基二醇)链可以包含连接到一起的乙二醇和丙二醇单元。所述热软化载体还可以是聚亚烷基二醇衍生物。短语“聚亚烷基二醇衍生物”在本文中表示如本文中定义的聚亚烷基二醇,其中至少一部分(例如,1-50%)经过修饰,从而包括如本文中定义的除了亚烷基二醇以外的基团。在一些实施方案中,聚亚烷基二醇衍生物是在其一个或两个末端处经过修饰从而包括额外基团的聚亚烷基二醇。适合用在本发明的实施方案背景下的示例性的聚亚烷基二醇衍生物包括、但不限于,聚亚烷基二醇甘油酯,诸如GeluciresTM(例如,Gelucire40/01TM))和生育酚聚乙二醇琥珀酸酯。所述热软化载体还可以包含一种油、或一种或多种油的组合。许多用于治疗用途的、适合用作热软化载体的油是本领域已知的。例子包括,但不限于,脂肪酸的酯,诸如甘油三酯和二醇(例如,丙二醇)的二酯。可以将其它油加入热软化载体中以降低/细调粘度,例如,分馏的椰子油或大豆油。如在本文的实施例部分中例证的,热软化载体在液体填充胶囊剂中的应用会防止胶囊的破裂和渗漏,但是与用于填充胶囊的液体填充组合物的非同质性有关。抗粘剂如在上文中另外描述的和在下面的实施例部分中例证的,本发明的发明人已经令人惊讶地发现,通过将氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与抗粘剂混合,可以显著提高含有氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的胶囊剂批次的同质性。因此,根据本发明的一些实施方案,所述固体或半固体基质进一步包含抗粘剂。应当理解,迄今既没有提示也没有实践在胶囊剂的液体填充组合物中包含抗粘剂。另外应当理解,通常,当利用液体填充技术进行包囊时,不会发生粘着的问题。本文使用的短语“抗粘剂”表示这样的试剂:其减小物质(例如,VB-201、VB-208、VB-221或VB-219)的颗粒之间的粘结力和/或这样的颗粒对固体表面(例如,容器和/或包囊机的固体表面)的粘着。例如,由抗粘剂造成的粘结力的减小大于通过单纯添加试剂来稀释物质造成的粘结力的减小。任选地,所述抗粘剂是在胶囊剂的其它组分(例如,所述热软化载体)中几乎没有或根本没有溶解度的物质(例如,固体,诸如粉末)。所述抗粘剂可以如下起作用:通过粘着于氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219),例如,VB-201、VB-208、VB-221或VB-219,由此形成例如颗粒和/或粉末颗粒。所以,减小氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)对其它表面(例如,其它VB-201颗粒和/或粉末颗粒、容器和/或包囊机的表面)的粘着。应当理解,使用几乎没有或根本没有溶解度的物质增加在液体填充组合物中的同质性的用途是新的和惊人的,因为不溶物通常会增加在液体中的不匀一性(例如,通过沉降、凝固),且因此不会预见到会增加同质性。不受限于任何特定理论,认为所述抗粘剂导致粘着于所述抗粘剂的氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的颗粒和/或粉末颗粒的均匀分散体的形成。抗粘剂的例子包括、但不限于:滑石、硬脂酸镁、纤维素(例如,微晶纤维素)、纤维素衍生物(例如,羟丙基甲基纤维素(HPMC))、乳糖、明胶、海藻酸盐(alginates)、氢氧化铝、氧化镁、粘土、绿坡缕石、皂粘土、角叉菜胶、共聚维酮(copovidone)、锂蒙脱石、聚甲基丙烯酸酯(polymethacrylates)、多库酯钠、赤藓醇、聚维酮、交联羧甲纤维素钠、葡聚糖结合剂、淀粉、氧化铁、高岭土、硅酸盐(例如,硅酸镁铝)、玉米粉、糖、碳酸钙、碳酸镁、磷酸钙、硫酸钙、碳酸氢盐(例如,碳酸氢钾或碳酸氢钠)、柠檬酸盐(例如,柠檬酸钾)和二氧化钛。如在实施例部分中例证的,滑石是有效的抗粘剂的一个例子。在一个实施例中,例如,在药物组合物(即,液体填充组合物)中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是在约1:5至约5:1(抗粘剂:氧化的磷脂)的范围内。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是在约1:4至约5:1、约1:3至约5:1、约1:2至约5:1、或约1:1至约5:1的范围内。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:5至约4:1、约1:5至约3:1、约1:5至约2:1、或约1:5至约1:1。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:4至约4:1、约1:4至约3:1、约1:4至约2:1、或约1:4至约1:1。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:3至约4:1、约1:3至约3:1、约1:3至约2:1、或约1:3至约1:1。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:2至约4:1、约1:2至约3:1、约1:2至约2:1、或约1:2至约1:1、或约1:2至约1.5:1。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是在约1:1至约5:1、约1:1至约4:1、约1:1至约3:1、约1:1至约2:1、或约1:1至约1.5:1的范围内。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:1。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:2。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:3。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:4。在其它实施例中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:5。因而,抗粘剂:氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)比例可以是,例如,约1:5、1:4、1:3、1:2、1:1、1:1.2、1:1.4、1:1.5、1:1.6、1:1.8、1.2:1、1.4:1、1.5:1、1.6:1、1.8:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1、或5:1。也预见到其它比例值。在根据任意上述实施方案的一个实施例中,所述抗粘剂是滑石。在另一个实施例中,根据任意上述实施方案,所述抗粘剂是滑石,且所述氧化的磷脂是VB-201。例如,将所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与等量的滑石(1:1重量比)一起碾磨。在另一个实施例中,以约1:2、约1:3、约1:4或约1:5的滑石:氧化的磷脂重量比,将所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与滑石一起碾磨。在其它实施例中,以约2:1、约3:1或约4:1的滑石:氧化的磷脂重量比,将所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与滑石一起碾磨。发明人已经认识到,所述抗粘剂与所述氧化的磷脂的重量比对同质性(即,足够的剂量含量均匀度)(例如,就所述氧化的磷脂在热软化载体或最终组合物中的分布而言)和/或最终制剂的长期稳定性具有影响。因此,在一些实施方案中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:1或更低(例如,1:2或更低、或1:3或更低)。在其它实施方案中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9或约1:2。在一些实施方案中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的重量比是约1:2或更低。在其它实施方案中,所述抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的比例是至少约1:1、至少约2:1、至少约3:1、至少约4:1、或至少约5:1。例如,在VB-201的情况下,至少约1:2(例如,至少约1:1)的比例与令人满意的剂量含量均匀度有关。任选地,所述胶囊剂中的抗粘剂的量与VB-201的量的比例是在以下范围内:1:3至5:1(抗粘剂:VB-201),和任选地1:2至3:1。因而,抗粘剂:VB-201比例可以是,例如,1:3、1:2、1:1.5、1:1.2、1:1、1.2:1、1.5:1、2:1、2.5:1、3:1、4:1或5:1。也预见到其它比例值。在示例性实施方案中,所述抗粘剂与VB-201的比例是约1:1。在本文中,抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的比例是指重量比。在一些实施方案中,所述药物组合物(即,基质)中的抗粘剂的浓度是在以下范围内:约1至约50重量%,约1至约40重量%,或约1至约30重量%,任选地约2至约25重量%,和任选地约3至约20重量%。这样的抗粘剂百分比可以任选地对应于如本文中所述的抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的比例。在一些实施方案中,所述药物组合物(即,基质)中的抗粘剂的浓度是在以下范围内:约2至约20重量%,约2至约15重量%,约2至约10重量%,或约2至约5重量%。在其它实施方案中,所述药物组合物(即,胶囊剂的基质)中的抗粘剂的浓度是在以下范围内:约1至约20重量%,约1至约10重量%,或约1至约5重量%。在一些实施方案中,所述药物组合物(即,基质)中的抗粘剂的浓度是在以下范围内:约5至约40重量%,约5至约30重量%,约5至约20重量%,或约5至约15重量%。在其它实施方案中,所述药物组合物(即,胶囊剂的基质)中的抗粘剂的浓度是在约7至约15重量%的范围内。滑石在根据任意上述实施方案的一个实施例中,所述抗粘剂是滑石。可以使用任意药用级或食品级滑石(例如,滑石粉(powderedtalc))。可以用在药物组合物、液体填充组合物、胶囊剂和本文中的其它实施方案中的示例性的滑石等级公开在:Dawoodbhai等人,“PharmaceuticalandCosmeticUsesofTalc,”DrugDevelopmentandIndustrialPharmacy,16(16):2409-2429(1990);和Dawoodbhai等人,“GlidantsandLubricantPropertiesofSeveralTypesofTalcs,”DrugDevelopmentandIndustrialPharmacy,13(13):2441-2467(1987),它们中的每一篇通过引用整体并入本文。在一些实施例中,所述滑石是滑石粉。在一些实施例中,所述滑石是美国药典级。在其它实施例中,所述滑石是滑石粉且是美国药典级。触变剂在一些实施方案中,本文的药物组合物或胶囊剂进一步包括触变剂(在本文中也被称作thixotrop)、胶凝剂或它们的组合。在一些实施方案中,本文的药物组合物或胶囊剂进一步包括触变剂。如在下面的实施例部分中例证的,在胶囊剂中包含触变剂(例如,蒸气沉积二氧化硅)产生具有更大的氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)含量均匀度的胶囊剂。不受任何特定理论约束,认为填充组合物的粘度的增加(其由触变剂造成)阻止在形成固体或半固体基质之前填充组合物的成分(例如,VB-201、VB-208、VB-221或VB-219和/或滑石)与载体的分离,由此增加填充组合物的同质性。因此,根据一些实施方案,所述基质进一步包含增加通过加热而软化的热软化载体(例如,熔化的载体)的粘度的试剂,诸如触变剂和/或胶凝剂。在一个实施例中,所述触变剂和/或胶凝剂能够在制备填充组合物的温度(例如,在填充进胶囊中之前加热填充组合物的温度(例如,所述试剂在这样的温度应当不会分解))增加药物组合物(即,填充组合物)的粘度。本文使用的“胶凝剂”表示,当加入液体中时形成凝胶的试剂。本文使用的“触变剂”表示,当加入液体中时增加液体的粘度的试剂。如本领域已知的,“触变性”是粘稠液体(例如,凝胶)的可逆性能,所述液体当遭受剪应力诸如摇动或搅拌或以其它方式搅乱时会液化。含有触变剂的粘稠液体会表现出触变性,其中粘度在应力(例如,搅拌、加热和/或施加剪切力)下降低。因此,通过搅拌可以容易地混合液体填充组合物(例如,载体、VB-201、触变剂和/或抗粘剂)中的成分,因为粘度在搅拌过程中降低,而由于粘度在搅拌停止时增加,故填充组合物仍然对组分的分离是相对抗性的。适合用在本实施方案的背景下的触变剂的例子包括、但不限于:蒸气沉积二氧化硅(可作为例如和产品得到)、硅藻土、树胶(例如,黄原胶、瓜尔胶、槐豆胶、海藻酸盐)、纤维素衍生物(例如,羟丙基甲基纤维素)、淀粉、聚合物(例如,聚乙烯醇、聚丙烯酸酯、疏水地修饰的聚丙烯酸酯)、乳化剂和粘土衍生物(例如,胺处理过的硅酸镁铝、皂粘土胶体硅酸、白蒙脱石粘土和漂白土、绿坡缕石、云母、合成的层状硅酸镁(syntheticmagnesiumphyllosilicates)(锂藻土)、层状硅酸盐(layeredsilicates)、改性的蒙脱石、锂蒙脱石和海泡石。任选地,所述触变剂包含蒸气沉积二氧化硅和/或绿坡缕石。除非另外指出,否则相对于热软化载体和触变剂的组合重量来确定药物组合物(即,液体填充组合物或胶囊剂的基质)中的触变剂的浓度。例如,在2.5重量%的触变剂,所述药物组合物可以含有10mg触变剂和390mg热软化载体(10/400=2.5%)。在一些实施方案中,所述触变剂的浓度是约0.1重量%至约10重量%、或约0.25-10重量%、或约0.5重量%至约5重量%、或约0.5重量%至约4重量%、或约0.5重量%至约3重量%、或约1重量%至约10重量%、或约1重量%至约5重量%、或约1重量%至约4重量%、或约1重量%至约3重量%、任选地约2重量%至约3重量%。在根据任意上述实施方案的一个实施例中,所述触变剂是与热软化剂不同的物质(即,所述触变剂在化学上不同于热软化剂)。在另一个实施例中,根据任意上述实施方案,所述触变剂是与抗粘剂不同的物质(即,所述触变剂在化学上不同于抗粘剂)。在其它实施例中,根据任意上述实施方案,所述触变剂是与热软化剂和抗粘剂不同的物质(即,所述触变剂在化学上不同于热软化剂和抗粘剂)。单元剂型本文的药物组合物或填充组合物可以用于生产包含特定量的活性成分的单元剂型(例如,胶囊剂)。在一些实施方案中,本文提供了包含约1mg至约100mg活性药物成分的单元剂型。活性药物成分选自本文描述的氧化的磷脂和它们的组合。因此,在一些实施方案中,本文提供了包含约1mg至约100mg氧化的磷脂(例如,VB-201、VB-208、VB-219、或VB-221)、或约10mg至约100mg氧化的磷脂、或约20mg至约100mg氧化的磷脂、或约20mg至约80mg氧化的磷脂的单元剂型。在根据任意上述实施方案的一个实施例中,活性药物成分是VB-201。因此,在一些实施方案中,本文提供了包含约1mg至约100mgVB-201、或约10mg至约100mgVB-201、或约20mg至约100mgVB-201、或约20mg至约80mgVB-201的单元剂型。在一些实施方案中,所述单元剂型是胶囊剂。因此,在一些实施方案中,如本文中所述的胶囊剂包含约1mg至约100mg氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)/胶囊、或约10mg至约100mg氧化的磷脂/胶囊、或约20mg至约100mg氧化的磷脂/胶囊、或约20mg至约80mg氧化的磷脂/胶囊。根据一些实施方案,如本文中所述的胶囊剂包含约1mg至约100mgVB-201/胶囊、或约10mg至约100mgVB-201/胶囊、或约20mg至约80mgVB-201/胶囊。根据本文的其它实施方案,如本文中所述的胶囊剂包含约20mg氧化的磷脂。在一些实施方案中,如本文中所述的胶囊剂包含约20mgVB-201。根据其它实施方案,如本文中所述的胶囊剂包含约40mg氧化的磷脂。在一些实施方案中,如本文中所述的胶囊剂包含约40mgVB-201。根据其它实施方案,如本文中所述的胶囊剂包含约80mg氧化的磷脂。在一些实施方案中,如本文中所述的胶囊剂包含约80mgVB-201。根据一些实施方案,如本文中所述的胶囊剂包含约100mg氧化的磷脂。在一些实施方案中,如本文中所述的胶囊剂包含约100mgVB-201。也预见到含有更高量的氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)(例如,约110mg、约120mg、约130mg、约140mg、约150mg或约200mg)的胶囊剂。但是,应当指出,更高量的氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)可能需要更大的胶囊。根据一些实施方案,如本文中所述的胶囊剂包含占填充组合物或基质的总重量的约0.1重量%至约25重量%的氧化的磷脂,且任选地约1重量%至约25重量%。在一些实施方案中,胶囊剂包含占填充组合物或基质的总重量的约2重量%至约23重量%的氧化的磷脂。在其它实施方案中,胶囊剂包含占填充组合物或基质的总重量的约4重量%至约18重量%的氧化的磷脂。在其它实施方案中,胶囊剂包含占填充组合物或基质的总重量的约4重量%至约5重量%的氧化的磷脂。在其它实施方案中,胶囊剂包含占填充组合物或基质的总重量的约8重量%至约9重量%的氧化的磷脂。在其它实施方案中,胶囊剂包含占填充组合物或基质的总重量的约14重量%至约17重量%的氧化的磷脂。根据一些实施方案,相对于填充组合物或基质的总重量,如本文中所述的胶囊剂包含约0.1重量%至约25重量%的VB-201、和任选地约1重量%至约25重量%的VB-201。在一些实施方案中,胶囊剂包含在填充组合物或基质中的约2重量%至约23重量%的VB-201。在其它实施方案中,胶囊剂包含在填充组合物或基质中的约4重量%至约18重量%的VB-201。在一些实施方案中,胶囊剂包含氧化的磷脂,其浓度为填充组合物的总重量的约4.5重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约4.5重量%。在一些实施方案中,胶囊剂包含氧化的磷脂,其浓度为填充组合物的总重量的约8重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约8重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约9重量%。在一些实施方案中,胶囊剂包含氧化的磷脂,其浓度为填充组合物的总重量的约14重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约14重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约17重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约18重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约23重量%。在一些实施方案中,胶囊剂包含VB-201,其浓度为填充组合物的总重量的约28重量%。组合物的其它组分本文描述的药物组合物、填充组合物或胶囊剂基质可以任选地进一步包括额外化学组分,包括、但不限于,赋形剂、润滑剂、缓冲剂、抗细菌剂、填充剂(例如甘露醇)、抗氧化剂(例如,抗坏血酸或亚硫酸氢钠)等。在本文中,术语“赋形剂”表示加入药物组合物中以进一步促进活性成分的施用的惰性物质。这些或其它成分可以被包含在胶囊的壳中。如在下面的实施例部分中例证的,可以给胶囊涂布包衣(例如,肠溶包衣)。预见到本领域已知的任意这样的包衣。适合用于形成包衣的材料包括、但不限于:(例如,AMB)和它们可以单独使用或联合使用以形成肠溶包衣。用于配制和施用药物的示例性赋形剂和技术可以参见“Remington’sPharmaceuticalSciences”MackPublishingCo.,Easton,PA,最新版,其通过引用整体并入本文。方法如在实施例部分中例证的,发明人已经开发了一种用于包囊氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的方法,所述方法提供具有优良含量均匀度且在贮存以后不会劣化(例如,通过渗漏或破裂)的液体填充胶囊剂。因而,在一些实施方案中,本文提供了一种用于生产药物组合物的方法,所述药物组合物包含热软化载体和具有根据式(I)的结构的氧化的磷脂:其中R1、R3、R5和X1如上文关于式(I)所定义。所述方法包括:将所述热软化载体加热至高于所述热软化载体的熔点的温度,和使所述氧化的磷脂与所述热软化载体接触,由此得到所述药物组合物。在上述方法中有用的氧化的磷脂选自本文描述的那些。在一些实施方案中,上述方法中的氧化的磷脂可以具有如上文中所述的根据式(II)或式(III)的结构。在一个实施例中,所述氧化的磷脂是VB-201。在上述方法中有用的热软化载体选自本文描述的那些。在根据任意上述实施方案的一些实施例中,所述热软化载体具有约40℃至约100℃的熔点。在其它实施例中,根据任意上述实施方案,所述热软化载体选自聚亚烷基二醇、聚亚烷基二醇衍生物和蜡。在根据任意上述实施方案的一些实施例中,所述热软化载体是选自以下的成员:聚乙二醇、聚丙二醇、及其共聚物。在其它实施例中,根据任意上述实施方案,所述热软化载体是泊洛沙姆。在其它实施例中,根据任意上述实施方案,所述泊洛沙姆具有约2000至约18000道尔顿的分子量。在其它实施例中,所述泊洛沙姆具有约7000至约10000道尔顿的分子量。在其它实施例中,所述泊洛沙姆包含约40至约90重量%的聚乙二醇。在其它实施例中,所述泊洛沙姆是泊洛沙姆188(即,LutrolF68)。在其它实施例中,根据任意上述实施方案,所述热软化载体是聚乙二醇,例如,具有分子量约1500至约8000道尔顿、或约6000道尔顿的聚乙二醇。在一些实施方案中,上述方法进一步包括:将所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与抗粘剂一起碾磨、研磨或混合,例如,在使所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与所述热软化载体接触之前。在上述方法中有用的抗粘剂可以是本领域已知的任意抗粘剂,且可以选自本文描述的那些。在根据上述实施方案的一些实施例中,所述抗粘剂选自滑石、硬脂酸镁、纤维素、纤维素衍生物、乳糖、明胶、海藻酸盐、氢氧化铝、氧化镁、粘土、绿坡缕石、皂粘土、角叉菜胶、共聚维酮、锂蒙脱石、聚甲基丙烯酸酯、多库酯钠、赤藓醇、聚维酮、交联羧甲纤维素钠、葡聚糖结合剂、淀粉、氧化铁、高岭土、硅酸盐、玉米粉、糖、碳酸钙、碳酸镁、磷酸钙、硫酸钙、碳酸氢盐、柠檬酸盐和二氧化钛。在根据任意上述实施方案的一些实施例中,所述抗粘剂是滑石。在根据任意上述实施方案的一些实施例中,以本文中所述的重量比(参见“抗粘剂”部分),例如,约1:5至约5:1、约1:4至约2:1、或约1:4至约1:1,将所述抗粘剂与所述氧化的磷脂一起碾磨。在一些实施例中,所述药物组合物中的抗粘剂的终浓度是约1至约30重量%。本文描述了其它示例性的抗粘剂:氧化的磷脂重量比。在根据任意上述实施方案的一些实施例中,上述方法进一步包括:将所述热软化载体与触变剂、胶凝剂或它们的组合相混合。在根据任意上述实施方案的一些实施例中,上述方法进一步包括:将所述热软化载体与触变剂相混合;例如,在使所述热软化载体与所述氧化的磷脂接触之前。在根据任意上述实施方案的一些实施例中,所述触变剂是蒸汽二氧化硅(也被称作蒸气沉积二氧化硅)。在根据任意上述实施方案的一些实施例中,所述触变剂是Aerosil200。在根据任意上述实施方案的一些实施例中,所述触变剂的浓度(相对于热软化载体和触变剂的组合重量)是约0.25重量%至约10重量%。本文描述了其它有用的重量百分比。在一些实施方案中,上述方法进一步包括:将所述药物组合物填充进胶囊壳中,由此形成胶囊剂。在一些实施例中,在高于所述热软化载体的熔点的温度进行所述填充,并且在冷却至低于所述热软化载体的熔点以后,所述药物组合物形成固体或半固体基质。在一些实施例中,所述胶囊剂包含选自以下的壳材料:明胶、普鲁兰、淀粉和羟丙基甲基纤维素(HPMC)。在其它实施例中,所述壳材料是明胶。在根据上述方法的任意上述实施方案的一个实施例中,所述氧化的磷脂是VB-201。在一些实施方案中,本文提供了通过上述方法或其实施方案和实施例中的任一个制备的液体填充胶囊剂。根据本文的其它实施方案提供了生产包含氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的液体填充组合物的方法,所述方法包括:在本文中所述的高于室温的温度,使所述氧化的磷脂(例如VB-201)与热软化载体(例如,如本文中所述的载体)接触(例如,混合)。任选地,所述方法进一步包括:加入抗粘剂。例如,所述方法可以进一步包括:将所述氧化的磷脂与抗粘剂一起混合(例如,碾磨),例如,在使所述氧化的磷脂与所述热软化载体接触之前。所述方法可以进一步包括:加入触变剂。例如,所述方法可以进一步包括:将所述热软化载体与触变剂、胶凝剂或它们的组合混合,例如,在使所述氧化的磷脂(例如,其已经与抗粘剂一起碾磨)与所述热软化载体接触之前。根据一些实施方案,本文提供了一种生产包含氧化的磷脂(例如,VB-201)的液体填充胶囊剂的方法。在一个实施方案中,所述方法包括:用液体填充组合物(例如,如本文中所述的组合物)填充胶囊壳,所述液体填充组合物包含氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和如本文中所述的热软化载体(例如,本文描述的聚亚烷基二醇)。任选地,在高于室温的温度(例如,至少40℃、至少50℃、至少60℃)进行所述填充,且所述液体填充组合物在冷却至室温以后形成固体或半固体基质。在根据任意上述实施方案的一些实施例中,所述胶囊壳任选地包含明胶、HPMC、普鲁兰、淀粉和/或本文描述的任意壳材料。在一些实施方案中,所述方法进一步包括:使所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)(例如,造粒的VB-201或粉末化的VB-201)与所述热软化载体接触(例如,混合),以得到液体填充组合物。任选地,在将氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与热软化载体混合之前,加热所述热软化载体,从而软化所述载体(例如,通过熔化)。在一些实施方案中,所述方法进一步包括:在使所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与所述热软化载体接触(例如,混合)之前,将所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与抗粘剂(例如,如本文中所述的抗粘剂)一起混合(例如,碾磨或研磨)。可以以本文描述的任意重量比,例如以约1:3至约5:1抗粘剂:氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的比例,混合所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和所述抗粘剂。任选地,所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和所述抗粘剂是呈粉末形式,并混合以形成粉末掺合物,或者一起碾磨以形成粉末掺合物。根据本领域已知的任意合适方法,可以完成所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和所述抗粘剂的混合。任选地,通过选择的方法执行混合,从而提供均匀的混合物(例如,均匀的粉末掺合物)。在一种示例性的方法中,将所述氧化的磷脂(例如VB-201)和所述抗粘剂一起研磨或碾磨以形成均匀的粉末掺合物。在根据任意上述实施方案的一些实施例中,使用适合使被研磨的物质的潜在温度增加最小化的碾磨机/研磨机,研磨或碾磨所述氧化的磷脂(例如VB-201)和所述抗粘剂。合适的机器包括刀片式研磨机,诸如以快速旋转的刀片(例如,在全速时约9000rpm)的原理工作的那些。一种示例性的碾磨机是Fitzpatrick碾磨机。理想地,给碾磨机配备输出筛网或筛子,用于截留研磨过程的任意超尺寸的残余物。所述筛子可以具有不同的网目大小。在根据任意上述实施方案的一些实施例中,所述筛子具有约20目至约80目、或约30目至约80目、或约40目至约80目、或约40目至约60目、或约50目。然后以提供所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和/或抗粘剂在填充组合物中的期望浓度(例如,本文描述的浓度)的量,使所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)和所述抗粘剂的混合物与所述热软化载体(例如,熔化的载体)接触或组合(例如,加入到后者中)以形成组合物。可替换地,将所述抗粘剂与所述热软化载体组合(例如,加入到后者中)从而形成混合物,然后将所述氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)与所述混合物组合(例如,加入到后者中)。任选地,所述组合物中的抗粘剂的终浓度是在以下范围内:约1至约30重量%,任选地约2至约25重量%,和任选地约3至约20重量%。抗粘剂的这样的百分比可以任选地对应于本文描述的抗粘剂与氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的比例。根据任选的实施方案,所述方法进一步包括:将触变凝胶和/或胶凝剂(例如,本文描述的试剂)加入到填充组合物的其它成分中,使得所述填充组合物包含触变凝胶和/或胶凝剂。可以在所述方法的任意阶段,例如,在使VB-201与载体混合之前,在使VB-201与载体混合的同时,和/或在使VB-201与载体混合之后,将触变凝胶和/或胶凝剂与VB-201和/或与载体混合。在一个示例性实施方案中,在使VB-201与载体混合之前,将触变凝胶和/或胶凝剂加入到载体中。任选地,将触变剂加入到所述组合物中,以得到如本文中所述的触变剂的终浓度,例如,在0.25重量%至10重量%范围内的触变剂的终浓度。可以以特定量和比例混合填充组合物的成分(例如,VB-201、载体、抗粘剂、触变凝胶和/或胶凝剂),从而得到适合用于填充胶囊的填充组合物,其具有本文描述的成分的任意最终量和/或浓度。利用本领域已知的任意技术,包括,例如,高剪切混合器、平桨混合器、掺合机、带形掺合机、双锥体掺合机、行星式混合器、静态混合器和声处理,可以混合各成分。根据本文的其它实施方案,提供了根据本文描述的方法(例如,使用如本文中所述的液体填充组合物)制备的液体填充胶囊剂。胶囊的填充根据本领域已知的任意方法,可以用填充组合物填充胶囊和包囊所述组合物以得到如本文中所述的胶囊剂。硬壳胶囊剂的不同设计是本领域已知的,且可以用在本发明的实施方案中。相关领域的技术人员会知道用于填充任意给定设计的胶囊的技术。下面描述了一种示例性的得到胶囊剂的方法。通常在“预锁定的(prelocked)”条件下将空胶囊供应给填充机,其中胶囊体具有与其松松连接的帽。通常,在帽或体的匹配表面中提供一系列环或突出物,它们使得所述帽能够松松地连接至所述体,使得所述帽和体在贮存过程中被保持在一起,但是使得所述帽能够在填充胶囊之前被取下。已经填充胶囊以后,将所述帽复位并强迫它超过预锁定位置进入完全锁定位置。可替换地,设计其它类型的胶囊填充机来接收胶囊体和帽的分开供给。胶囊在填充以后被高速封闭,并且,尽管大多数在它们的帽或体设计中具有某种形式的排气口,但是在正常的填充速度时,这可能不会完全有效地消除空气或其它气体在胶囊内的捕集,由此使经过填充的胶囊处于增压状态(例如高达1巴),直到压力与外界平衡。在胶囊的封闭过程中,将帽配合在体上面,并向上推所述体,直到它锁住帽。所述帽是紧密配合的,且通常是体长度的大约一半,所以在锁定之前它向下朝胶囊体移动较大的距离。这在捕集和增压胶囊中具有活塞的作用。多余的气体通常穿过帽和体之间的间隙逸出,并且可以在该区域提供排气口以便促进多余压力的逸出。可替换地,胶囊可以利用特别紧密的锁定机构而不是排气口(例如,如在Capsugel胶囊中)。在一些实施方案中,通过在帽和体之间的连接部周围施加聚合物溶液带,使胶囊具有带。所述聚合物溶液任选地是与胶囊帽和/或体相同的聚合物在其溶剂中的溶液。形成带是特别合适的,例如,用于提供光滑的胶囊表面进行涂布,这会阻止胶囊的帽和体之间的移动(这会中断涂布)。在用熔化的液体(其在施用之前固化为固态)填充胶囊的情况下,任选地在使胶囊中的固态处于预定形状(例如,栓形)的条件下进行填充。预定形状可以增强其中含有的药学活性剂的释放特性的预测性。包装和试剂盒任选地,将胶囊剂包装在包装材料中,并在包装材料内部或表面上标识用于治疗疾病或障碍,例如,炎性疾病或障碍。如果需要的话,根据本实施方案的胶囊剂可以存在于包装或分配器装置中,例如FDA(美国食品和药品管理局)批准的试剂盒,所述装置可含有一个或多个含有氧化的磷脂(例如,VB-201、VB-208、VB-221或VB-219)的胶囊剂。所述包装或分配器装置可以包括例如金属箔或塑料箔,例如但不限于泡罩包装。所述包装或分配器装置可以带有给药说明书。所述包装也可带有与容器结合在一起的说明书(notice),其形式符合管理药品的生产、使用或销售的政府部门的规定,该说明书反映出政府部门对用于人用的组合物形式的批准。例如,这样的说明书可以是美国食品和药品管理局关于处方药批准的标签,或者可以是批准的产品插页。也可以制备胶囊剂,其放置在合适的容器中,并且贴有用于治疗本文定义的炎性疾病或障碍的标签。治疗方法根据一些实施方案,本文描述的药物组合物、填充组合物和胶囊剂是用于治疗炎性疾病或障碍。本文进一步提供了一种治疗炎性疾病或障碍的方法,所述方法包括:给有此需要的受试者施用(例如,口服地)本文的药物组合物,即,包含氧化的磷脂(例如,VB-201、VB-208、VB-219或VB-221)、热软化载体和任选的如本文中所述的抗粘剂的药物组合物。本文进一步提供了一种治疗炎性疾病或障碍的方法,所述方法包括:给有此需要的受试者施用(例如,口服地)如本文中所述的包含氧化的磷脂(例如,VB-201、VB-208、VB-219或VB-221)的胶囊剂。根据任选的实施方案,所述炎性疾病或障碍是与内源性氧化的脂质有关的炎性疾病或障碍。本文使用的短语“内源性氧化的脂质”是指,作为炎性过程和其它细胞或体液介导的过程的结果,在体内存在的或形成的一种或多种氧化的脂质。氧化的低密度脂蛋白(氧化的-LDL)是与炎性疾病或障碍有关的内源性氧化的脂质的实例。根据本发明的示例性实施方案的炎性疾病或障碍包括:银屑病(例如,斑块状银屑病)、类风湿性关节炎和动脉粥样硬化和相关病症,诸如血管炎症,即,动脉的炎症(例如,颈动脉炎症和/或主动脉炎症)。根据本发明的示例性实施方案的炎性疾病或障碍的其它实例包括:多发性硬化和炎性肠病(例如,慢性炎性肠病)。根据本发明的实施方案的代表性的炎性疾病和障碍包括,例如,特发性炎性疾病或障碍、慢性炎性疾病或障碍、急性炎性疾病或障碍、自身免疫疾病或障碍、传染性疾病或障碍、炎性的恶性疾病或障碍、炎性的移植相关的疾病或障碍、炎性的变性疾病或障碍、超敏反应相关的疾病或障碍、炎性的心血管疾病或障碍、炎性的脑血管疾病或障碍、外周血管疾病或障碍、炎性的腺性疾病或障碍、炎性的胃肠道疾病或障碍、炎性的皮肤疾病或障碍、炎性的肝脏疾病或障碍、炎性的神经学疾病或障碍、炎性的肌肉-骨骼疾病或障碍、炎性的肾脏疾病或障碍、炎性的生殖疾病或障碍、炎性的全身性疾病或障碍、炎性的结缔组织疾病或障碍、炎性的肿瘤、坏死、炎性的植入物相关的疾病或障碍、炎性的衰老过程、免疫缺陷疾病或障碍、增殖性疾病和障碍和炎性的肺疾病或障碍,如下文详述。超敏反应的非限制性实例包括:I型超敏反应、II型超敏反应、III型超敏反应、IV型超敏反应、速发型超敏反应、抗体介导的超敏反应、免疫复合物介导的超敏反应、T淋巴细胞介导的超敏反应、迟发型超敏反应、辅助T淋巴细胞介导的超敏反应、细胞毒性T淋巴细胞介导的超敏反应、TH1淋巴细胞介导的超敏反应和TH2淋巴细胞介导的超敏反应。炎性心血管疾病或障碍的非限制性实例包括:阻塞性疾病或障碍、动脉粥样硬化、心脏瓣膜病、狭窄、再狭窄、支架内狭窄、心肌梗塞、冠状动脉病、急性冠状综合征、充血性心力衰竭、心绞痛、心肌局部缺血、血栓形成、韦格纳肉芽肿病(Wegener’sgranulomatosis)、高安动脉炎(Takayasu′sarteritis)、川崎综合征、抗因子VIII自身免疫性疾病或障碍、坏死性小血管脉管炎、显微镜下多血管炎、Churg和Strauss综合征(ChurgandStrausssyndrome)、微量免疫(pauci-immune)局灶性坏死性肾小球性肾炎、新月体性肾小球性肾炎、抗磷脂综合征、抗体诱发的心力衰竭、血小板减少性紫癜、自身免疫性溶血性贫血、心肌自身免疫、Chagas氏疾病或障碍和抗辅助T淋巴细胞自身免疫。狭窄是血管的阻塞性疾病,通常是由动脉粥样化斑块和增加的血小板活性所致,最主要影响冠状血管。再狭窄是通常狭窄血管阻塞减少后的进行性再阻塞。在血管开放需要支架的机械支持的情况下,可发生支架内狭窄,重新阻塞经治疗的血管。脑血管疾病或障碍的非限制性实例包括:中风、脑血管炎症、脑出血和脊椎动脉功能不全(vertebralarterialinsufficiency)。外周血管疾病或障碍的非限制性实例包括:坏疽、糖尿病性血管病、缺血性肠病、血栓形成、糖尿病性视网膜病和糖尿病性肾病。自身免疫性疾病或障碍的非限制性实例包括:由免疫应答(例如针对自身抗原等的自身抗体或细胞介导的免疫)引起的所有疾病。代表性实例是慢性类风湿性关节炎、幼年型类风湿性关节炎、系统性红斑狼疮、硬皮病、混合性结缔组织病、结节性多动脉炎、多肌炎/皮肌炎、干燥综合征、白塞病、多发性硬化、自身免疫性糖尿病、桥本病、银屑病、原发性粘液性水肿、恶性贫血、重症肌无力、慢性活动性肝炎、自身免疫性溶血性贫血、特发性血小板减少性紫癜、葡萄膜炎、脉管炎(vasculitides)和肝素诱发的血小板减少症。炎性腺性疾病或障碍的非限制性实例包括:胰腺疾病或障碍、I型糖尿病、甲状腺疾病或障碍、格雷夫斯病、甲状腺炎、自发性自身免疫性甲状腺炎、桥本甲状腺炎、特发性粘液性水肿、卵巢自身免疫、自身免疫性抗精子不育症、自身免疫性前列腺炎和I型自身免疫性多腺综合征。炎性的胃肠道疾病或障碍的非限制性实例包括:结肠炎、回肠炎、克罗恩氏病、慢性炎性肠病、炎性肠综合征、炎性肠病、乳糜泻、溃疡性结肠炎、溃疡、皮肤溃疡、褥疮、胃溃疡、消化性溃疡、口腔溃疡、鼻咽溃疡、食管溃疡、十二指肠溃疡和胃肠溃疡。炎性皮肤疾病或障碍的非限制性实例包括:痤疮、自身免疫性大疱性皮肤病、寻常型天疱疮、大疱性类天疱疮、落叶型天疱疮、接触性皮炎和药疹。炎性肝脏疾病或障碍的非限制性实例包括:自身免疫性肝炎、肝硬化和胆汁性肝硬化。炎性神经学疾病或障碍的非限制性实例包括:多发性硬化、阿尔茨海默氏病、帕金森病、重症肌无力、运动神经病、格-巴二氏综合征、自身免疫性神经病、朗-爱二氏肌无力综合征、副肿瘤性神经学疾病或障碍、副肿瘤性小脑萎缩、非副肿瘤性僵体综合征、进行性小脑萎缩、罗斯默森脑炎(Rasmussen’sencephalitis)、肌萎缩性侧索硬化、小舞蹈病(Sydehamchorea)、抽动秽语综合征、自身免疫性多内分泌腺病、免疫异常性神经病、获得性神经性肌强直、多关节弯曲、亨廷顿病、AIDS相关的痴呆、肌萎缩性侧索硬化(AML)、多发性硬化、中风、炎性视网膜病或障碍、炎性眼病或障碍、视神经炎、海绵状脑病、偏头痛、头痛、丛集性头痛和僵体综合征。炎性结缔组织疾病或障碍的非限制性实例包括:自身免疫性肌炎、原发性干燥综合征、平滑肌自身免疫性疾病或障碍、肌炎、腱炎、韧带炎、软骨炎、关节炎症、滑膜炎、腕管综合征、关节炎、类风湿性关节炎、骨关节炎、强直性脊柱炎、骨骼炎、自身免疫性耳部疾病或障碍和内耳自身免疫性疾病或障碍。炎性肾脏疾病或障碍的非限制性实例包括:自身免疫性间质性肾炎和/或肾癌。炎性的生殖性疾病或障碍的非限制性实例包括:习惯性流产、卵巢囊肿或月经相关的疾病或障碍。炎性的全身性疾病或障碍的非限制性实例包括:系统性红斑狼疮、系统性硬化症、脓毒性休克、中毒性休克综合征和恶病质。传染性疾病或障碍的非限制性实例包括:慢性传染性疾病或障碍、亚急性传染性疾病或障碍、急性传染性疾病或障碍、病毒性疾病或障碍、细菌性疾病或障碍、原生动物性疾病或障碍、寄生虫性疾病或障碍、真菌性疾病或障碍、支原体性疾病或障碍、坏疽、脓毒病、朊病毒性疾病或障碍、流感、肺结核、疟疾、获得性免疫缺陷综合征和严重急性呼吸综合征。炎性的移植相关的疾病或障碍的非限制性实例包括:移植物排斥、慢性移植物排斥、亚急性移植物排斥、急性移植物排斥、过急移植物排斥和移植物抗宿主疾病或障碍。示例性的植入物包括:假体性植入物、乳房植入物、硅酮植入物、牙植入物、阴茎植入物、心脏植入物、人造关节、骨折修复装置、骨置换植入物、药物递送植入物、导管、起搏器、人造心脏、人造心脏瓣膜、药物释放植入物、电极和呼吸器插管。炎性肿瘤的非限制性实例包括:恶性肿瘤、良性肿瘤、实体瘤、转移瘤和非实体瘤。炎性的肺疾病或障碍的非限制性实例包括:哮喘、变应性哮喘、肺气肿、慢性阻塞性肺疾病或障碍、结节病和支气管炎。增殖性疾病或障碍的一个实例是癌症。在根据任意上述实施方案的一些实施例中,与除了如本文中所述的氧化的磷脂以外的另一种活性药学试剂伴随地,将本文的药物组合物或本文的胶囊剂施用给受试者(共同治疗)。例如,与抑制素伴随地将本文的药物组合物或胶囊剂施用给受试者(即,在给所述受试者施用氧化的磷脂时,所述受试者接受抑制素疗法)。在一个实施方案中,在单独的剂型中施用抑制素。可以在与抑制素相同的天时间或在不同的天时间施用氧化的磷脂。其它定义本文使用的术语“约”是指±10%。术语“包含”、“包括”、“具有”和它们的变化形式是指“包括但不限于”。术语“由……组成”是指“包括且不限于”。词语“示例性的”在本文中用于表示“充当一个实施例、实例或例证”。被描述为“示例性的”任意实施方案不一定解释为,与其它实施方案相比优选的或有利的,和/或排除来自其它实施方案的特征的并入。词语“任选地”在本文中用于表示“在一些实施方案中提供,且在其它实施方案中不提供”。本发明的任意具体实施方案可以包括多个“任选的”特征,除非这样的特征相矛盾。除非上下文另外清楚地指明,本文使用的单数形式“一个”、“一种”和“所述”包括复数所指。例如,术语“一种化合物”或“至少一种化合物”可以包括多种化合物,包括它们的混合物。在本申请中,本发明的不同实施方案可以以范围形式呈现。应当理解,范围形式的描述仅仅是为了方便和简洁,不应当理解为对本发明范围的硬性限制。因此,范围的描述应当视作具有具体公开的所有可能的子范围以及在该范围内的单个数值。例如,诸如从1至6的范围的描述,应当视作具有诸如从1至3、从1至4、从1至5、从2至4、从2至6、从3至6等具体公开的子范围以及诸如1、2、3、4、5和6等在该范围内的单个数值。无论范围的宽度,这同样适用。每当在本文中指示数值范围时,意在包括在指示范围内的任意引用的数值(分数或整数)。短语“范围是(第一个指示数字)至(第二个指示数字)/范围在(第一个指示数字)和(第二个指示数字)之间”和“范围是(第一个指示数字)至(第二个指示数字)/范围从(第一个指示数字)至(第二个指示数字)”在本文中互换使用,意在包括第一个和第二个指示数字和其间的所有分数和整数数值。本文使用的术语“方法”是指完成给定任务的方式、手段、技术和程序,包括、但不限于,化学、药理学、生物学、生化和医学领域的从业人员已知的那些方式、手段、技术和程序或可以从已知的方式、手段、技术和程序容易地开发出的那些。本文使用的术语“治疗”包括消除、基本上抑制、减缓或逆转病症的进展,基本上改善病症的临床或美学症状,或基本上预防病症的临床或美学症状的出现。除非另有说明,否则本文使用的术语“烷基”是指,具有指定的碳原子数目的直链或支链烃基(例如,C1-C10是指1-10个碳原子)。在本申请的上下文中,例如,就式(I)、(II)和(III)中的变量R1而言,烷基通常具有1-30个碳原子,例如具有10-30个碳原子,12-30个碳原子,或14-30个碳原子。其它示例性的烷基具有14-20个碳原子。示例性的烷基包括十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、顺式-9-十六烯基和(2-辛基)十二烷基。在其它实施例中,例如,就式(I)、(II)和(III)中的变量R5而言,所述烷基是具有1-10个碳原子、1-8个碳原子、1-6个碳原子或1-4个碳原子的“低级烷基”基团。“低级烷基”残基的例子包括、但不限于:甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基,以及例如正戊基、正己基、正庚基和正辛基的同系物和异构体。术语“烷基”包括二价和多价残基。例如,在适当时,例如,当所述式指示烷基是二价的时,术语“烷基”包括“亚烷基”。术语“烷基”包括如本文中定义的“烯基”和“炔基”。术语“亚烷基”是指二价(二残基)烷基,其中烷基在本文中定义。通常,“亚烷基”基团具有1-30个碳原子。碳原子的数目的其它示例性范围是关于“烷基”描述的那些。“亚烷基”的例子是亚丁基(-CH2CH2CH2CH2-),但不限于此。术语“烯基”表示具有2-30个碳原子和至少一个双键的直链或支链烃基。碳原子数目的其它示例性范围是关于“烷基”描述的那些。典型的“烯基”基团具有12-30个碳原子和至少一个双键。在一个实施方案中,“烯基”基团具有14-30个碳原子或14-20个碳原子和至少一个双键。一个示例性的“烯基”基团是顺式-9-十六烯基。具有2-10、2-8、2-6或2-4个碳原子的示例性的“低级烯基”基团包括乙烯基、2-丙烯基、1-丁-3-烯基、巴豆基、2-(丁二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、2-异戊烯基、1-戊-3-烯基、1-己-5-烯基等。术语“炔基”表示具有2-30个碳原子和至少一个三键的直链或支链、不饱和的或多不饱和的烃基。碳原子数目的其它示例性范围是关于“烷基”描述的那些。在本申请的上下文中,“炔基”基团通常具有12-30个碳原子和至少一个三键。在本文的一些实施例中,“炔基”基团具有12-20个碳原子和至少一个三键。“炔基”基团可以额外包括一个或多个双键。其它“炔基”基团是具有2-10个碳原子(例如,2-6个碳原子)的“低级炔基”基团,其包括丙-1-炔基、丙-2-炔基(即,炔丙基)、乙炔基和3-丁炔基。应当理解,为了清楚的目的,在分开的实施方案的上下文中描述的本发明的某些特征同样可以在单个实施方案中组合提供。相反,为了简洁,在单个实施方案的上下文中描述的本发明的各种特征也可以分开地或以任何合适的亚组合的形式提供,或在适合本发明的任意其它所述实施方案时提供。在不同实施方案的上下文中描述的某些特征不应当视作那些实施方案的必要特征,除非该实施方案在没有那些元素时不可实现。上文描述的和在下面的权利要求书部分中要求保护的本发明的不同实施方案和方面,可以得到下述实施例的实验支持。实施例现在参考下述实施例,所述实施例与以上的描述一起以非限制性方式例证本发明的一些实施方案。材料和方法材料:得自Colorcon;明胶得自DGStoess;LauroglycolFCC得自Gattefosse;硬脂酸镁得自Procter&Gamble;AMB得自Colorcon;PEG6000得自BASF;泊洛沙姆188(F68)得自BASF;0号明胶胶囊剂得自Qualicaps和Capsugel;滑石(PhEur)得自Fluka;生育酚聚乙二醇琥珀酸酯(TPGS)得自EastmanChemicalCo.;TWEEN80得自和VB-201得自Cordenpharma(以前的Genzyme)。比重测定蒸汽吸着:使用IGAsorpMoistureSorptionAnalyser(HidenAnalytical),分析吸着。将VB-201的样品小心地放在仪器的超微量天平上,并在干燥氮气(<0.1%相对湿度)的气流(250标准立方厘米/分钟)中干燥,直到已经达到平衡。然后将样品暴露于下述水相对湿度分布:10%、20%、30%、40%、50%、60%、70%、80%和90%相对湿度,从而允许在每个步骤处达到平衡(99.5%步骤完成)。继续研究3天的时段。从每个步骤的平衡质量值计算吸着等温线。等温量热法:新鲜制备88mgVB-201、262mgLauroglycolFCC、和88mgVB-201与262mgLauroglycolFCC组合的样品,并立即加载进量热仪(TAM,ThermometricAB,瑞典),然后允许所述装置在25℃平衡30分钟的时段。使用指定的软件包Digitam4.1,每15秒收集数据持续24小时的时段。使用含有350mg水的样品作为参照。使用绘图软件包Origin(MicrocalSoftwareInc.,USA)进行数据分析。使用电置换方法校准量热仪,并用300μW的放大器范围运行。示差扫描量热法(DSC):将大约5mg样品置于铝DSC盘中,并用针孔盖密封。将样品加载进保持在10℃的Pyris1示差扫描量热仪(PerkinElmer)中,然后冷却至-20℃。平衡以后,以10℃/分钟的速率,将样品从-20℃加热至100℃,在100℃保持1分钟,并以20℃/分钟的速率从100℃冷却至-20℃。在温度循环过程中,以20ml/分钟的流速,用氮气净化样品以防止氧化。在分析之前,对量热仪进行温度校准,并使用铟参比标准品进行热流校准。热重量分析法(TGA):将大约5-10mg样品置于铂盘中,并加载进保持在环境温度的TGA1热重量分析仪中。然后以10℃/分钟的速率,将样品从5℃加热至300℃,同时监测样品的重量。以20ml/分钟的流速,使用氮气净化样品,以防止加热后氧化。在分析之前,对仪器使用alumel参比标准品进行温度校准,并使用100mg校准重量进行重量校准。粉末袋(powder-pocket)动态机械分析:动态机械分析(DMA)测量随着温度而变化的样品的机械性能。使固体样品遭受振荡应力,所述振荡应力在样品内产生振荡应变。测量施加的力以及产生的位移的振幅和相位。大多数材料表现出粘弹性,使得振荡应变比施加的振荡应力滞后相位差δ。模量(力或应力与变形或应变之比)因而具有同相分量(其对应于弹性响应且被定义为储能模量)以及非同相粘稠分量(被定义为损耗模量)。损耗模量与储能模量之比等于阻尼参数tanδ,后者与每个循环的消散的机械能(主要随着加热)与储备的机械能之比成比例。粉末袋DMA允许通过将粉末保持在薄钢板之间来分析粉末。使用PerkinElmerDMA8000仪器进行实验。将大约50mg样品粉末装载进金属袋,将其封闭以形成大约0.4mm的被包装在袋中的粉末的薄夹心。然后将袋直接夹在仪器中,一个末端进入刚性框架中,另一个末端连接至移动驱动轴。用于在软件中确定力数据的实验几何形状是使用单频率变形模式在单个悬臂梁弯曲中的矩形横截面。使袋发生弯曲振荡运动进入和离开平面,从而造成在袋的2个平板之间的粉末的水平剪切。以2℃/分钟的速率,将样品从-20℃加热至50℃。使用优化过的实验条件,即,在1Hz、10Hz和30Hz频率下0.05mm的动态位移。然后从测量的动态位移振幅计算模量。使用铟的熔点(156.6℃)校准仪器的温度,并根据生产商的说明书通过将大约100克的已知重量放在驱动轴上来校准仪器的力。概述:通过公开的操作(参见,例如,美国专利申请号11/650,973),合成地制备VB-201,通过在减压下蒸发从溶剂干燥,并烘干。得到蜡状固体材料,其在室温18-22℃会容易地破碎和粉化。将VB-201进一步表征为高度吸湿的。API(活性药物成分)的这些物理化学性质提示,常规口服不能开发固体剂型(例如片剂或粉末掺合物胶囊剂)。因此,进行了开发增溶的药物的液体填充胶囊剂(其保持为液态)或在冷却后变成固体的熔化的载体的液体填充胶囊剂的研究。下述实施例描述了用于开发VB-201的合适口服剂型的途径。实施例1使用LauroglycolFCC载体将VB-201包囊在明胶胶囊中试验了VB-201在LauroglycolFCC(丙二醇月桂酸酯)中的溶解度,并发现为至少255mg/克。还发现VB-201在LauroglycolFCC中稳定超过66天的时程(数据未显示)。基于这些结果。认为LauroglycolFCC是VB-201的合适液体载体。为了试验VB-201在明胶胶囊中的稳定性,给0号胶囊填充255mg/克的在LauroglycolFCC中的VB-201,然后密封。将胶囊剂贮存在下述贮存条件下:a)在4℃的环境相对湿度;b)在室温的65%相对湿度;和c)在40℃的75%相对湿度。如在表1中所示,与在没有胶囊存在下关于在LauroglycolFCC中的VB-201得到的结果相比,胶囊剂中的VB-201含量下降。为了确定VB-201是否以造成VB-201难以分析的方式与明胶相互作用,从明胶胶囊剂提取VB-201以便回收与明胶相互作用的任何VB-201。在24天或59天以后,从贮存取出胶囊剂。如在下面表1中所示,当通过胶囊剂提取来测定VB-201时,即使在4℃在环境相对湿度或在室温在65%相对湿度贮存59天以后,没有观察到VB-201的显著损失。在40℃在75%相对湿度贮存的胶囊剂的VB-201含量下降了大约20%。表1:通过取样未密封的胶囊剂和通过从胶囊剂提取VB-201确定的VB-201在明胶胶囊中的稳定性上述结果提示,VB-201在贮存期间会与明胶胶囊相互作用,但是当胶囊分解时会回收VB-201。因此,当胶囊在肠中分解时,VB-201可用于吸收。然后以更大的规模包囊VB-201。在大约40℃的温度,将VB-201溶解在LauroglycolFCC中。然后使用Bosch1500L填充机在类似地稍微升高的温度将溶液包囊在明胶胶囊中。然后在QualisealS100封带机上用明胶给胶囊封带。制备了含有5、20、25和100mgVB-201的胶囊剂。也制备了含有LauroglycolFCC、不含VB-201的安慰剂胶囊剂。然后在减压下对胶囊剂进行渗漏试验,且在适当时,转移用于在ManestyAccelacota包衣机中的(一种药用肠溶衣制剂)涂布。AMB(一种水汽屏障底衣)底层以防止水汽穿过涂层迁移,所述迁移会在溶出试验中软化和扭曲胶囊。在用肠溶衣涂布之前注意到在胶囊中形成渗漏。将渗漏源鉴别为胶囊的渐进性破裂,这能够导致胶囊中的所有VB-201的损失。在有包衣的胶囊剂中或在无包衣的安慰剂胶囊剂(即,不含VB-201)中没有观察到破裂。上述结果指示,可以将VB-201包囊在液体填充明胶胶囊中,但是VB-201会造成无包衣的明胶胶囊的破裂。实施例2VB-201的吸湿性检查了VB-201的物理性能,以便理解VB-201造成明胶胶囊破裂(如在实施例1中所述)的机制。通过将VB-201悬浮于0.1MHCl水溶液(pH1)或50mM磷酸盐缓冲液(pH5和7)中,确定VB-201的水溶解度。在最初的手工混合以后,通过涡旋和浴声处理进一步混合制品,以尝试实现药物的溶解。使用光学显微术检查不溶物质的存在。使用该方法,确定了VB-201在每个试验的pH值的溶解度超过225mg/克。因而,VB-201是相对水溶性的。通过比重测定蒸汽吸着分析(如在材料和方法部分中所述),确定VB-201对水分的吸收。如在图1A和1B中所示,当将VB-201暴露于0%相对湿度时,观察到轻微的重量减轻。该结果指示,VB-201含有一些吸收的水。如在图1A和1B中进一步指示的,VB-201的重量随着相对湿度逐渐增加至40%而轻微增加(大约3.5%),随后所述重量随着相对湿度增加超过40%(特别是在40%至60%相对湿度的范围内)而较大增加(>30%)。这些结果提示,在40%至60%的相对湿度在VB-201中发生相变,形成水合状态或形成过饱和溶液。如在图1B中进一步显示的,吸着和解吸曲线在60%至90%相对湿度范围内是类似的,而在0%至60%相对湿度范围内,在所述曲线之间存在显著差异(滞后)。这些结果提示,在60%和90%相对湿度之间,水被简单地吸收进结构主体中,没有与样品的化学相互作用(物理吸附),而在0%和60%相对湿度之间,存在更强烈地结合的水物质从样品的吸着和解吸。上述结果进一步指示,VB-201是高度吸湿的。只要相对湿度维持在40%以下,VB-201就吸湿性而言是物理上稳定的。大于40%的相对湿度会导致过饱和溶液的形成,VB-201可能潮解。由于高度吸湿的物质即使当溶解在疏水油相(例如,LauroglycolFCC)中时也可以潜在地从外部环境吸收水,吸湿性可以影响制剂和/或胶囊剂的稳定性,特别当使用软明胶胶囊时。明胶胶囊为稳定时的相对湿度范围位于35%和65%之间,而VB-201在该范围是高度吸湿的。由于几乎所有的化学或物理过程伴有热变化,也使用等温量热法(如在材料和方法部分中所述)检查了VB-201和LauroglycolFCC(单独地和组合地)。初步结果显示在图2、3和4中。如在图2中所示,VB-201在前11小时内表现出大约-6μW的吸热信号。该结果指示VB-201的不稳定性。如在图3和4中所示,对于LauroglycolFCC(图3)或对于LauroglycolFCC+VB-201(图4),没有观察到显著的信号。这些结果指示,VB-201发生变化,但是LauroglycolFCC会阻止该变化。结果与以下机制一致:其中VB-201吸收水分而LauroglycolFCC排斥水分,由此限制VB-201的吸收。上述结果与在实施例1中描述的VB-201和明胶之间的相互作用一起提示,如在实施例1中描述的VB-201-相关的明胶胶囊破裂和随后的渗漏是由于VB-201的吸湿性质。实施例3使用固体载体将VB-201包囊在明胶胶囊中为了提供更稳定的含有VB-201的明胶胶囊剂,通过将VB-201加入到熔化的赋形剂中,将VB-201掺入具有低熔点的固体赋形剂中。预期固体制剂是有利的,因为不可能渗漏,VB-201被固定化,且因此防止与明胶壳壁的相互作用,并限制VB-201对水的吸收。为了促进HPLC分析,选择几乎没有紫外吸收且水溶性的赋形剂。进一步选择赋形剂从而得到FDA批准。基于前述标准,选择PEG6000(具有6000道尔顿分子量的聚乙二醇)和TPGS(生育酚聚乙二醇琥珀酸酯)作为合适的赋形剂,并进行试验以确定哪种赋形剂提供最好稳定性。TPGS的熔点是约40℃,PEG6000的熔点是约60℃。以在TPGS和PEG6000中的20%(w/w)VB-201,制备二元混合物,所述浓度匹配在100mg剂量单位中的VB-201浓度。在油浴中熔化赋形剂,并在高剪切混合下将研磨的VB-201掺入混合物中。通过目检,观察到两种掺合物形成均匀的混合物。将赋形剂(不含VB-201)和二元混合物的样品在密封的琥珀色玻璃瓶中在40℃+75%相对湿度或在5℃贮存4周。还使用大约500mg混合物填充从2个生产商(Shionogi和Capsugel)中的任一个得到的0号明胶胶囊,并将胶囊剂封带,然后在上述的条件下贮存。1周以后,尽管观察到渗漏且几乎所有的胶囊是易碎的,但是用基于TPGS的制剂填充的胶囊没有表现出破裂或变形。但是,即使在4周以后,除了没有表现出破裂或变形以外,用基于PEG6000的制剂填充的胶囊也没有表现出渗漏或脆变。基于该结果,选择PEG6000作为用于后续试验的赋形剂。实施例4VB-201和PEG6000载体的机器包囊通过机器包囊,大规模(12,000-24,000粒)制备含有25mg或100mgVB-201的VB-201明胶胶囊剂。在Schweizer混合器中在65℃熔化PEG6000,然后在氮气下掺入VB-201,其为在小规模刀片式掺合机中生产的粉末。使用平桨搅拌和全速高剪切混合,混合该混合物。将混合物脱气并转移至Bosch全规模填充机的被加热的漏斗,在此处在65℃的目标温度包囊制剂。然后如在实施例1中所述,将胶囊封带,并用肠溶包衣涂布。使用与上述那些类似的操作,以更小的规模(3,400粒)制备含有5、10或25mgVB-201的额外胶囊剂批次。将VB-201掺入不锈容器内的熔化的PEG6000中,用刮勺混合,然后使用小试规模高剪切混合器分散。然后将混合物脱气和如上所述包囊,但是不给胶囊封带或涂布。高剪切混合后,所述混合物通过目检似乎不具有任何不匀一性,尽管观察到它们具有“壁纸糊(wallpaperpaste)”稠度。另外,VB-201在掺入后变成粘性的,且一些块在穿过高剪切头前需要用刮勺来分散。为了试验VB-201含量的准确度和均匀度,测定VB-201含量,并将结果总结在下面的表2中。表2:含有PEG6000载体的胶囊剂的VB-201含量和均匀度如在表2中所示,所有批次的平均VB-201含量接近目标的100%。但是,在有些批次中的含量均匀度是相对较低的。由于胶囊剂具有均匀的重量,相对较低的均匀度指示,在混合物中存在不匀一性。假定不匀一性由于粘稠块(其在将VB-201加入到熔化的PEG6000中时形成)而存在于混合物中。因此进行了小试规模试验,其中将VB-201在加入到PEG6000中之前与PEG6000一起研磨,以便将VB-201容易地掺入PEG6000中。将1份研磨的VB-201与1、2或3份研磨的PEG6000在室温组合,以形成自由流动的粉末掺合物。这些掺合物会极大地增加VB-201掺入熔化的PEG6000中的容易度,并且选择2:1的PEG6000:VB-201比例作为进一步试验的最佳折中。然后如下制备胶囊剂批次(3,400粒胶囊):将VB-201/PEG6000掺合物掺入不锈容器内的熔化的PEG6000中,用刮勺混合,然后使用小试规模高剪切混合器分散。然后将混合物脱气和如上所述包囊。不给胶囊涂布肠溶包衣。VB-201的掺入得到显著改善,在掺入以后没有形成粘稠的块。在混合以后不会看到不匀一性,并且使用该混合物在65℃填充胶囊没有任何困难。为了试验VB-201含量的准确度和均匀度,测定了VB-201含量,结果总结在下面的表3中。表3:从与PEG6000一起研磨的VB-201制备的胶囊剂的VB-201含量和均匀度如在表3中所示,所有批次中的平均VB-201含量接近目标的100%,但是含量均匀度较差。实施例5VB-201和PEG6000载体的手工包囊为了提高同质性,在不使用机器填充的情况下制备含有10mgVB-201的胶囊剂,其中物质可以与混合物分离、粘着和/或从其滤出。使用在实施例4中描述的操作,从含有1份VB-201和2份PEG6000的掺合物制备混合物。然后使用塑料一次性注射器在65℃的温度手工填充胶囊,物质从高剪切头的出口出来。将所有胶囊单个地填充至目标重量,目标VB-201含量为10mg。为了试验VB-201含量的准确度和均匀度,测定VB-201含量。平均VB-201含量为目标含量(10mg)的89.41%,且VB-201含量的范围为目标含量的56.21%至102.23%。因而,平均VB-201含量远低于目标,且结果指示差同质性不是由于机器填充本身。实施例6温度对VB-201在PEG6000中的溶解度的影响为了进一步增强VB-201胶囊剂的均匀度,研究了温度对VB-201在PEG6000中的溶解度的影响,从而确定溶出度/沉淀是否会促成差同质性。在65℃,将9块饼状的未研磨的VB-201浸没在熔化的PEG6000中,并使用平桨混合器缓慢地搅拌。将混合物在该温度保持大约2小时,用肉眼检查VB-201的溶出状态,然后取3个液体PEG6000样品用于分析。然后使温度升高10℃,并重复所述方法。在10℃步骤中重复所述方法,直到混合物达到105℃的最终温度。整个过程持续30小时。30小时以后且在105℃的温度,PEG6000已经缓慢地变成浅黄色(在空气中长时间加热PEG6000所常见的),仍然没有显著可见的VB-201溶出或VB-201块的尺寸的减小。取最终的分析样品以后,从熔化物取出VB-201块,从PEG6000干燥,并称重。记录的重量(32克)指示,当考虑一些PEG6000向固体VB-201的粘着时,与最初重量(25克)相比没有显著变化。取出固体VB-201以后,使PEG6000从105℃冷却至65℃。不存在来自混合物的物质的沉淀。PEG6000样品的化学分析表明,不存在可检测的VB-201,从而指示VB-201浓度小于大约0.5mg/克。上述结果指示,VB-201在熔化的PEG6000中具有可忽略的溶解度或没有溶解度,并且溶出/沉淀机制不是观察到的可变同质性的原因。然后观察到,在28-30℃的温度,在使用或从包容袋取出之前,固体VB-201从易碎的固体转化成橡胶状有弹性的粘性材料。通过包囊和取出剩余的混合物以后的仔细检查进一步观察到,填充机漏斗和Schweizer混合器的壁表现出在表面上的浅凹形成。所述壁的该外观提示,颗粒留在壁上,尽管没有看到离散颗粒。尽管所述混合物看起来是几乎透明的,PEG6000和VB-201的折射率可能是足够类似的,所以颗粒不可见。另外,观察到高剪切头具有留在它的出口槽周围的物质框(rims),这是不常见的现象。上述观察结果指示,当将VB-201加入到熔化的PEG6000中时,由于需要的熔化的PEG6000的高温(至少65℃),所述VB-201变成软的和粘性的,并且VB-201是足够软的,以便从高剪切头挤出,而不是分散。所述混合物然后以与2种不混溶的液体类似的方式来表现。混合物的差同质性可能由熔化的PEG6000中的VB-201的团聚、附着和/或分离造成。从示差扫描量热法和动态机械分析得到的结果证实了在约28-30℃的温度VB-201从易碎的固体(诸如自由流动的粉末)转化成橡胶状有弹性的粘性材料的观察结果。如在材料和方法部分中所述,对固体VB-201进行慢扫描示差扫描量热法。如在图5中所示,当将VB-201加热至约25℃时,发生吸热转变。如在本文中进一步证实的,在适当更低的温度冷却期间,发生对应的转变。在冷却过程中的较低转变温度提示VB-201的过冷。为了确定观察到的转变是否是由于挥发性化合物的除去,如在材料和方法部分中所述进行热重量分析法。如在图6中所示,当将VB-201加热至约25℃时,没有观察到显著的重量减轻。这些结果指示,当加热至约25℃时,发生VB-201的相变,并且观察到的转变不是由于挥发性化合物的除去。如在材料和方法部分中所述,进行固体VB-201的粉末袋动态机械分析(DMA)。如在图7中所示,在加热到0℃以上以后,VB-201的储能模量逐渐下降。所述下降在约30℃突然结束。这些发现指示,在加热到0℃以上以后,VB-201随着VB-201开始发生相变而逐渐软化,并且所述相变在约30℃结束。如在图8中所示,在加热到0℃以上以后,VB-201的tanδ值逐渐增,然后在高于约25℃的温度突然下降。如在本文中进一步证实的,tanδ为最大值时的温度随着振荡频率增加而增加。上述结果与无定形物的玻璃化转变(Tg)相一致,所述无定形物通常表现为储能模量的阶梯样下降(当加热样品穿过Tg时)和在tanδ中的大峰。tanδ为最大值时的温度的频率依赖性指示,所述相变不是晶体至液体转变,因为这样的转变是热力学驱动的且因此与频率依赖性无关。但是,玻璃化转变是动力学且因此可能是频率依赖性的。上述示差扫描量热法和动态机械分析结果指示,VB-201在约25℃发生相变,从而证实了以下肉眼观察结果:VB-201在高于约25℃的温度转化成橡胶状有弹性的粘性材料。实施例7VB-201与添加剂和PEG6000载体的混合为了鉴别能够包被VB-201颗粒和防止它们在混合物中粘结到一起的物质,在与熔化的PEG6000混合之前,将研磨的VB-201在室温与不同的添加剂组合。试验了下述组合:2.5克研磨的VB-201,其用1克LauroglycolFCC润湿;2.5克研磨的VB-201,其用1克TWEEN80润湿;2.5克VB-201,其与5克PEG6000一起研磨,然后用1克LauroglycolFCC润湿;2.5克VB-201,其与5克PEG6000一起研磨,然后用1克TWEEN80润湿;2.5克VB-201,其与0.3克硬脂酸镁一起研磨;2.5克VB-201,其与0.3克硬脂酸镁和5克PEG6000一起研磨;1份VB-201,其与3份滑石和2份PEG2000一起研磨;1份VB-201,其与3份滑石一起研磨;1份VB-201,其与2份滑石一起研磨;1份VB-201,其与1份滑石一起研磨;1份VB-201,其与0.5份滑石一起研磨;和1份VB-201,其与0.25份滑石一起研磨。LauroglycolFCC或TWEEN80(有或没有PEG6000)的添加产生了粘性物质,而硬脂酸镁或滑石(有或没有PEG6000)的添加产生了自由流动的粉末。然后将组合的物质放在密封的琥珀色玻璃罐中,并在40℃放在稳定性柜中。在40℃保持1小时以后,所有组合表现为粘性的和/或熔化的,除了包括滑石的组合以外,该组合保持自由流动,即使在40℃贮存数小时(通常过夜)以后,尽管1份VB-201/0.25份滑石混合物在40℃保持24小时以后附聚。将含有LauroglycolFCC、TWEEN80或硬脂酸镁的混合物加入到50克在65℃熔化的PEG6000中并进行高剪切混合。然后样品保持在65℃的温度并脱气,然后肉眼检查。在所有样品中,VB-201在表面处形成团,且存在块。所述样品不进一步使用。在类似的试验中,使用刮勺将所有含滑石的粉末(其在40℃是自由流动的)掺入熔化的PEG6000(在65℃)中。不使用高剪切混合,因为粉末容易地分配在PEG6000中,且似乎形成均匀的混合物。在将20mgVB-201掺入420mg总质量中的浓度,制备所有混合物。在65℃保持过夜以后,滑石缓慢地沉降在底部的稠层中。通过简单搅拌可容易地重新分散滑石。在静置后不存在位于PEG6000的表面上的VB-201的迹象,在容器壁上没有观察到VB-201的颗粒,所述混合物也不具有用以前制备的不含滑石的VB-201/PEG6000混合物所见的“壁纸糊”外观。VB-201/滑石组合表现为缓慢地沉降至PEG6000的底部,尽管不含滑石的VB-201在相同条件下升高。这指示,与VB-201粘着的滑石会增加VB-201/滑石组合的平均密度至高于PEG6000的密度。使用上述的混合物手工地填充胶囊。分析使用含有1:1比例的VB-201/滑石的粉末制备的胶囊剂的含量。这些胶囊剂中的平均VB-201含量为目标的100.39%(范围:97.04-103.49%),具有2.38%的相对标准差。这些结果指示,以至少0.5:1的滑石:VB-201的比例与滑石混合的VB-201粉末会促进具有期望量的VB-201和具有胶囊之间的高均匀度的胶囊剂的制备。实施例8用滑石和PEG6000制备的VB-201胶囊剂随时间的均匀度使用在实施例7中描述的滑石的掺入,制备2个5kg工业级批次的VB-201胶囊剂。通过与滑石一起研磨VB-201,以1:0.5的VB-201:滑石的比例掺入滑石。将研磨的混合物加入到在70℃熔化的PEG6000中,并使用低剪切混合进行混合,随后在低速度(混合器读出为50)在控制温度的20lSchweizer混合器上高剪切混合10分钟。将混合物脱气并使用Bosch1500L填充机在漏斗中平桨混合(中等速度)下进行包囊。在持续超过30分钟的第一批工业级填充中,在运行开始、中间和结束处采取分析胶囊样品。填充机速度为30,300粒胶囊/小时/漏斗。对于每种样品,分析10粒胶囊的VB-201含量和填充均匀度。结果显示在下面的表4中:表4:使用1:0.5的VB-201:滑石比例在PEG6000中制备的胶囊剂的VB-201含量和均匀度(第一批)如在表4中所示,对于得自运行开始和中间的胶囊剂而言,该批中的胶囊剂的含量和均匀度是相对良好的,在运行结束之前,VB-201含量的均匀度和准确度已经显著劣化。这些结果提示,VB-201分离并开始沉降在漏斗中,从而向漏斗的中间部分中增加额外的VB-201和从漏斗的上层中消耗VB-201。从运行的中间开始使用在中间部分中富集的混合物(其具有高VB-201含量)填充胶囊,并从运行结束使用上层中被消耗的(depleted)混合物(其具有低VB-201含量)来填充胶囊。为了证实这些结果,如下制备第二工业批次:将在所述批中生产的胶囊剂细分成2组3个子批,共得到6个子批。另外,提供额外的搅拌来确定这是否会消除或减少VB-201的明显分离。对于每组的3个子批,给填充机漏斗装填在上文中描述的混合物的一半,并给胶囊填充1个含有在开始时制备的胶囊剂的子批、1个含有在中间时制备的胶囊剂的子批和1个含有在结束时制备的胶囊剂的子批。将剩余的混合物在搅拌下保留在Schweizer混合器中。使用漏斗中的几乎所有的混合物制备第一组3个子批(编号子批1-3)以后,将剩余的一半混合物从混合器转移至漏斗,并用于使用本文中关于第一组3个子批描述的相同方法制备第二组3个子批(编号子批4-6)。对于两组,将剧烈平桨混合(最大实际速度)施加于机器漏斗。稍微降低第二组的混合速度,因为用于第一组的速度似乎过于剧烈,以致于轻微阻碍混合物向填充泵中的流动(重量必须随着漏斗排空而连续增加)。70分钟时段以后,填充了该批的所有胶囊。但是,该时间段的大部分是由于第二半混合物向漏斗中的转移。然后将填充机速度稍微降低至18,000粒胶囊/小时/漏斗。收集在第二组子批结束以后剩余的最终渣滓,并命名为子批7。对于每个子批,分析10粒胶囊的VB-201含量和填充均匀度。结果显示在下面的表5中:表5:使用1:0.5的VB-201:滑石比例在PEG6000中制备的胶囊剂的VB-201含量和均匀度(第二批)如在表5中所示,第二批表现出与第一批类似的趋势。得自第一组的前2个子批(子批1和2)表现出接近目标的VB-201含量,具有相对良好的均匀度,而最后一个子批(子批3)表现出降低的VB-201含量,具有低含量均匀度。类似地,第二组子批在第一个子批(子批4)中具有高VB-201含量和中等的含量均匀度,中间子批表现出接近目标的VB-201含量,具有优良的均匀度,且第三个子批具有降低的VB-201含量和低含量均匀度。但是,第二组劣于第一组,因为子批4表现出比对应的子批1显著更差的准确度和含量均匀度,且子批6的低含量和均匀度甚至低于对应的子批3。如在表5中进一步显示的,最后一批渣滓(子批7)表现出非常高的VB-201含量。上述结果指示,VB-201含量的准确度和均匀度随着在机器漏斗中的混合物所消耗的时间而降低(例如,子批3和6劣于子批1、2、4和5)。上述结果进一步指示,VB-201含量的准确度和均匀度随着在混合器中的混合物所消耗的时间而降低(例如,子批7劣于子批4-6,所述子批4-6作为整体劣于子批1-3)。因而,上述结果提示,VB-201含量的准确度和均匀度随着时间而降低,不论在该时间中如何处理混合物。实施例9用滑石和PEG6000制备的均匀大规模批次的VB-201胶囊剂如在实施例8中所示的结果指示,胶囊剂的VB-201含量的准确度和均匀度在胶囊剂的制备过程中随时间而下降,为了满足药典标准,设计下述包囊过程。简而言之,用在上文中描述的含滑石的混合物快速地填充胶囊,并首先将每批胶囊剂分成要分析的子批。仅保留令人满意的子批,然后组合以提供用于释放的批次。使用这些操作,制备了含有20mgVB-201和40mgVB-201的胶囊剂。使用刀片式小试规模研磨机,将VB-201与等重量的滑石一起研磨。将研磨的混合物加入到在70℃熔化的PEG6000中,并如在实施例8中所述混合、脱气和包囊。使用小量混合物(适合用于20mg或40mg剂量单位)来设定填充重量,并将填充机泵送至干燥,然后转移所有混合物,并在不停止的情况下全速运行机器(30,600转/小时/泵),直到所有材料被包囊。将产物收集在10个子批中,每个子批大约1000粒胶囊。对于20mg和40mg剂量单位,填充分别消耗21和23分钟。20mg和40mg剂量单位的批次大小的目标为11,400粒胶囊,具有5-5.5kg标称混合物量。从每个子批取10粒胶囊样品,并分析VB-201含量和填充均匀度。同意的试验标准为,分析每个第二子批直到子批失败。然后试验在失败的子批前面紧邻的子批。将发现不可接受的第一子批之前的所有可接受的子批组合,以产生用于进一步释放试验的批次。子批试验的结果显示在下面的表6中。对于20mg胶囊剂,批次L1值为5.3,对于40mg胶囊剂,则为3.7(接受值为L1≤15)。表6:20mg和40mgVB-201的目标剂量单位的分批子批的胶囊剂的VB-201含量和均匀度如在表6中所示,如上所述制备的批次产生了令人满意的产物,在所有拒绝、废物和质量控制取样以后,得到了这样的工业批次:其导致7746粒含有20mgVB-201的胶囊和8732粒含有40mgVB-201的胶囊的可用性。使用双泵操作以类似的收率重复该方法,由此得到具有类似产物质量的大2倍的批次大小。实施例10用PEG6000、滑石和触变剂包囊VB-201如在实施例8中所述,用于包囊的VB-201/PEG6000混合物的质量随时间而下降,可能是由于VB-201的分离。为了通过增加粘度和由此减慢分离过程而提高混合物同质性,将触变剂加入混合物中。使用蒸气沉积二氧化硅作为触变剂。在熔化的PEG6000与2.5%200蒸气沉积二氧化硅(“Aerosil200”)的混合物中,从含有等量的VB-201和滑石的混合物,制备含有20mg、40mg或80mgVB-201的胶囊剂。在Schweizer混合器中在70±2℃加热PEG6000。将蒸气沉积二氧化硅加入到熔化的PEG6000中,并通过高剪切混合进行掺入。然后将混合物脱气。以1:1比例(按重量计)研磨VB-201和滑石,直到得到均匀的粉末混合物。将粉末混合物快速地转移进混合器,并用刮勺彻底搅拌,以润湿和分散粉末。然后使用平桨混合器搅拌混合物,直到所有物质显得均匀分布,然后用高剪切混合器搅拌,直到混合物显得均匀。然后将混合物脱气。然后将混合物转移至Bosch1500L填充机的漏斗进行包囊。在包囊过程中,将混合物保持在70±2℃的恒定温度。给Capsugel0号胶囊填充混合物。每个胶囊含有10mg蒸气沉积二氧化硅、390mgPEG6000、指定量的VB-201(20、40或80mg)和等量的滑石。如此制备含有指定成分的下述组合物:制剂1:20mgVB-201;20mg滑石;10mgAerosil200;390mgPEG6000。制剂2:40mgVB-201;40mg滑石;10mgAerosil200;390mgPEG6000。制剂3:80mgVB-201;80mg滑石;10mgAerosil200;390mgPEG6000。分析每2个子批中的一个。对于每个试验的子批,取6粒胶囊用于分析。40mgVB-201胶囊剂的分析结果显示在下面的表7中。包囊持续大约6小时。表7:用滑石和触变剂制备的胶囊剂中的VB-201含量(目标的百分比)和相对标准差(RSD)如在表7中所示,平均VB-201含量非常接近目标量(目标的99.84%),具有高均匀度(RSD=2.5%)。如在本文中进一步证实的,在制备过程的6小时时程内,均匀度几乎没有变化。这些结果指示,触变剂可有效地在包囊期间稳定混合物和增加得到的胶囊剂的均匀度。实施例11用泊洛沙姆188、滑石和触变剂包囊VB-201在PEG中的过氧化物杂质可能潜在地造成明胶交联,这可能导致成品的溶出性能的衰退。因此,研究了泊洛沙姆作为PEG的替代载体的用途。如在实施例10中所述,使用热软化载体、滑石(作为抗粘剂)和蒸气沉积二氧化硅(作为触变剂),但是使用泊洛沙姆188(F68)替代PEG6000作为热软化载体,包囊VB-201。在熔化的泊洛沙姆188与3%200蒸气沉积二氧化硅的混合物中,从含有等量的VB-201和滑石的混合物制备含有20mg、40mg或80mgVB-201的胶囊剂。将蒸气沉积二氧化硅与熔化的泊洛沙姆188混合。以1:1比例(按重量计)研磨VB-201和滑石,直到得到均匀的粉末混合物。然后包囊混合物,使得每粒胶囊含有12mg蒸气沉积二氧化硅、388mg泊洛沙姆188、指定量的VB-201和等量的滑石。VB-201药物产品制备过程的一个示例性流程图显示在下面:从而制备下述制剂:制剂4:40mgVB-201+40mg滑石、12mgAerosil200和388mg泊洛沙姆188。制剂5:20mgVB-201+20mg滑石、12mgAerosil200和388mg泊洛沙姆188。制剂6:80mgVB-201+80mg滑石、12mgAerosil200和388mg泊洛沙姆188。将每种上述组合物加入到0号白明胶胶囊中。根据欧洲药典第2.9.40章,确定10粒含有40mgVB-201的胶囊的均匀度。所述10粒单独胶囊含有VB-201的目标量的105.3%、102.8%、103.1%、106.5%、102.1%、107.9%、102.2%、103.0%、106.1%和102.0%。平均VB-201含量为目标量的104.08%(RSD=2.05%;L1值=7.71)。这些结果指示制备的胶囊剂的高均匀度。实施例12用泊洛沙姆188、滑石和触变剂包囊VB-201如在实施例11中所述,使用泊洛沙姆188(作为热软化载体)、滑石(作为抗粘剂)和蒸气沉积二氧化硅(作为触变剂),但是使用减少的量的滑石和Aerosil200,包囊VB-201。在熔化的泊洛沙姆188和约1%的200蒸气沉积二氧化硅的混合物中,从含有滑石和VB-201的混合物(滑石:VB-201的重量比为约1:4),制备含有40mg、60mg或80mgVB-201的胶囊剂。如此制备下述制剂:制剂7:40mgVB-201+10mg滑石、4mgAerosil200和396mg泊洛沙姆188。制剂8:60mgVB-201+15mg滑石、4mgAerosil200和396mg泊洛沙姆188。制剂9:80mgVB-201+20mg滑石、4mgAerosil200和396mg泊洛沙姆188。将每种上述组合物加入到0号白明胶胶囊中。实施例13用PEG6000和滑石(不含触变剂)包囊VB-201如在实施例10中所述,用PEG6000作为热软化载体,但是不加入触变剂,配制VB-201。从含有等量的VB-201和滑石(在熔化的PEG6000的混合物中)的混合物,制备下述含有40mgVB-201的制剂:制剂10:40mgVB-201;40mg滑石;400mgPEG6000。将上述组合物加入到0号白明胶胶囊中。以类似的方式可以制备下述制剂:制剂11:20mgVB-201;20mg滑石;400mgPEG6000。制剂12:60mgVB-201;60mg滑石;400mgPEG6000。制剂13:80mgVB-201;80mg滑石;400mgPEG6000。可以将上述组合物加入到0号白明胶胶囊中。实施例14用泊洛沙姆188、滑石和触变剂包囊氧化的磷脂如本文中关于VB-201所述,可以配制在结构上与VB-201相关的其它化合物。根据本文可以配制的示例性化合物描述在国际专利申请公开WO2010/052718中,其公开内容通过引用整体并入本文。例如,用这些化合物中的一种或多种替代VB-201,使用在实施例10-13中描述的操作和制剂,可以包囊下述化合物。例如,使用泊洛沙姆188(作为热软化载体)、滑石(作为抗粘剂)和蒸气沉积二氧化硅(作为触变剂),例如,如在实施例11和12中所述,可以包囊以下类似物中的每一种:1-十六烷基-2-(4'-甲基羧基丁基)-甘油-3-磷酸乙醇胺;1-十六烷基-2-(4'-甲基羧基丁基)-甘油-3-磷酸胆碱(VB-208);1-十六烷基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺(VB-202);1-十六烷基-2-(3'-羧基丙基)-甘油-3-磷酸乙醇胺(VB-206);1-十六烷基-2-(3'-羧基丙基)-甘油-3-磷酸胆碱(VB-205);1-十六烷基-2-(6'-羧基己烷基)-甘油-3-磷酸胆碱(VB-203);1-十二基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(VB-209);1-十六烷基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺-N-戊二酸(VB-210);1-(15'-羧基十五烷基)-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(VB-213);1-(15'-羧基十五烷基)-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺(VB-214);1-十八烷基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(VB-215);1-十八烷基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺(VB-216);1-十六烷基-2-(2'-羧基乙基)-甘油-3-磷酸胆碱(VB-217);1-S-十六烷基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(1-S-VB-201);1-S-十六烷基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺(1-S-VB-202);1-(顺式-9-十六烯基)-2-(4'-羧基丁基)-甘油-3-磷酸胆碱;1-辛基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(VB-207);1-辛基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺;1-二十烷基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(VB-219);1-二十烷基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺(VB-220);1-(2'-辛基)十二烷基-2-(4'-羧基丁基)-甘油-3-磷酸胆碱(VB-221);1-(2'-辛基)十二烷基-2-(4'-羧基丁基)-甘油-3-磷酸乙醇胺(VB-222);和1-十六烷基-2-(4'-羧基丁基)-甘油-3-磷酸丝氨酸(VB-223)。实施例15得自制剂10和4的VB-201的药代动力学(PK)数据使用2种不同的VB-201制剂(实施例13的制剂10和实施例11的制剂4),进行药代动力学研究。对于每种制剂,将40mgVB-201的单次口服剂量施用给26位人受试者,并在给药后测量每位受试者的VB-201血浆浓度144小时的时段。如在图9中所示,给人受试者施用制剂10和制剂4以后,VB-201的平均血浆浓度在类似的时间(中位Tmax:6-6.5h)和在类似的浓度(平均Cmax:1,290-1,298ng/mL)达到峰值。在吸收后/分布后的相中,VB-201的血浆浓度以类似的单指数形式下降(在图9中没有明确显示)。施用2种制剂以后的平均终末半衰期(t1/2)为约37小时。在所有受试者中,VB-201血浆浓度高于测定的定量限至少96小时。总之,由施用任一种制剂引起的血浆药代动力学在量级方面和在计算的参数的受试者之间的变异性方面是非常类似的。相对生物利用度Fr(制剂4相对于制剂10的AUC∞比率)和制剂4相对于制剂10的Cmax比率分别为103%和102%,并且这些PK参数比率二者表现出类似的受试者之间变化(即,16-20%)。当作为制剂10和制剂4施用时,VB-201的40-mg单次口服剂量的生物等效的统计评价结果显示在下面的表8中:表8VB-201Cmax和AUC参数的几何平均比率的90%置信区间(CI)的总结a表示为中位值和范围。b表示为调和平均值和基于刀切方差的假标准差。NA=不适用。表9呈现了VB-201的40-mg单次口服剂量以后,制剂4和制剂10之间的生物等效的统计评价结果。对于Cmax、AUCT和AUC∞,几何平均比率的90%置信限是在80%至125%的可接受的生物等效性范围内,从而指示制剂4是与制剂10生物等效的。这3个单独分析中的每一个的统计能力大于99%。表9VB-201Cmax和AUC参数的几何平均比率(GMR)的90%置信区间(CI)的总结(a)制剂4(试验)和制剂10(参照)的几何平均比率;表示为百分比。(b)制剂B(试验)和制剂A(参照)之间的自然对数转化参数的试验差异的p-值。(c)表示为百分比。还关于Tmax(使用Wilcoxon符号秩检验)和关于终末速率常数(λz,使用配对t检验),执行制剂10和4之间的差异的统计检验。如在下面的表10中所示,这些PK参数中的任一个不存在制剂相关的统计差异。表10VB-201终末速率常数(λz)和达到最大观察血浆浓度的时间(Tmax)的统计对比a处理之间的统计推论。注:通过配对t检验在统计上评价了λz,并通过Wilcoxon符号秩检验在统计上评价了Tmax,将二者的显著性设定在≤0.05。虽然已经结合本发明的具体实施方案描述了本发明,但是显而易见,许多替代方案、修改和变化对于本领域技术人员而言是显而易见的。因此,本发明意图包括属于所附权利要求书的精神和宽范围内的所有这样的替代方案、修改和变化。本说明书中提及的所有出版物、专利和专利申请都通过引用整体并入本说明书中,其程度如同具体地且单独地指明每篇单独的出版物、专利或专利申请通过引用并入本文中一样。另外,在本申请中对任何参考文献的引用或标识不应解释为承认:这样的参考文献可作为本发明的现有技术来获取。就使用部分标题的情况而言,它们不应解释为必然限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1