一种中药制剂及其制备与应用的制作方法
本发明涉及一种中药组合物,特别涉及一种中药组合物及其在制备治疗慢性再生障碍性贫血药物中的应用。(二)
背景技术:
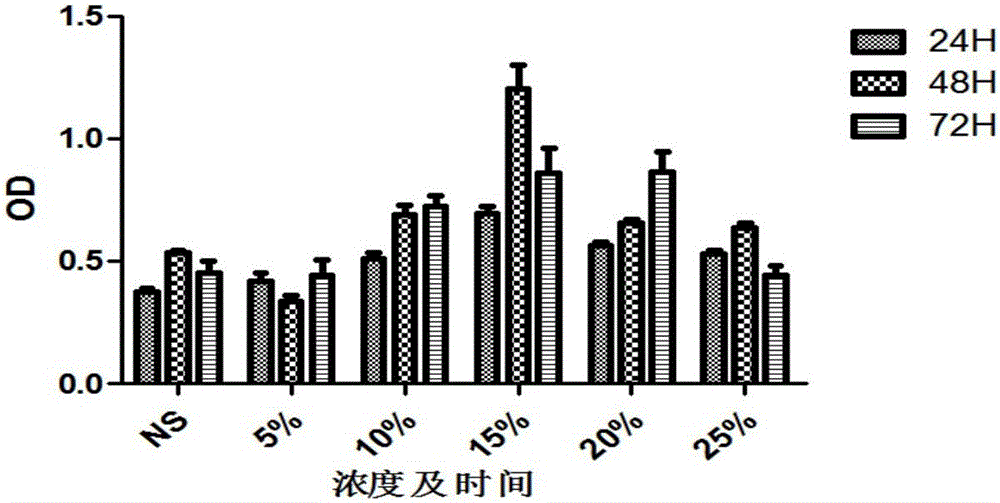
:再生障碍性贫血(aplasticanemia,AA)属于骨髓造血功能衰竭性疾病,临床表现为贫血、出血及感染,其中慢性再障约占到80%。目前围绕慢性再障的主要治疗方案主要包括免疫抑制剂(如:环孢霉素)及雄激素刺激造血,部分患者因长期用药带来的经济负担及药物毒副反应而中止治疗,导致疾病反复,总体预后较差,患者生活质量低下。中医药在AA中的应用已有50余年历史,在调节免疫、刺激造血、减轻药物毒副反应、改善生活质量等方面具有明确的优势。目前临床上没有明确治疗再障有效的特异性中成药,常规应用补肾及刺激造血的相关中成药,如生血合剂、右归丸等,具有一定的辅助治疗作用。中医临床围绕再障主要还是“从肾论治”,然而缺少大样本的临床数据及实验数据支撑,并且部分患者在药物起效后期无法进一步获得疗效的提升,处于疗效的瓶颈期。肾主骨生髓,再障中医病名“髓劳”,临床以肾阳虚证多见,并且慢性再障病程长,病情缠绵,伴有气血亏虚,劳血动血,故常合并血滞脉内或血留脉外,导致“瘀证”内生。本发明涉及一种治疗慢性再生障碍性贫血的中药复方,由熟地、生地、肉桂、丹参、当归、菟丝子、仙灵脾、补骨脂、太子参、制首乌、赤芍、茯苓、山药、白术、甘草组成,在“从肾论治”的基础上联合活血化瘀药味,具有补肾填精,活血益气的功效,并进行了相关临床及基础研究,明确了“补肾活血方”的作用优势及可能的疗效机制。目前未有该复方及其制剂在慢性再障中的应用报道。(三)技术实现要素:本发明目的是提供一种中药组合物及其在制备治疗慢性再生障碍性贫血药物中的应用,有望进一步提高慢性再障临床治疗效果的中药组合物。本发明采用的技术方案是:本发明提供一种中药制剂,所述中药制剂由如下质量配比的原料制成:熟地10~30份、生地10~30份、肉桂3~6份、丹参10~20份、当归10~20份、菟丝子10~20份、补骨脂10~20份、仙灵脾10~20份、太子参9~30份、制何首乌10~15份、赤芍8~15份、丹皮9~15份、茯苓9~15份、白术9~15份、山药15~30份和甘草3~6份。进一步,优选所述中药制剂由如下质量配比的原料制成:熟地15~20份、生地15~20份、肉桂3~4份、丹参10~15份、当归10~15份、菟丝子10~15份、补骨脂15~20份、仙灵脾15~20份、太子参20~30份、制何首乌10~15份、赤芍8~10份、丹皮9~12份、茯苓10~12份、白术9~12份、山药20~30份和甘草3~6份。更进一步,优选所述中药制剂由如下质量配比的原料制成:熟地20份、生地15份、肉桂4份、丹参10份、当归10份、菟丝子15份、补骨脂20份、仙灵脾20份、太子参30份、制何首乌10份、赤芍10份、丹皮9份、茯苓10份、白术12份、山药30份和甘草3份。本发明所述中药制剂为配方量原料用水煎煮后的滤液经干燥制成。本发明还提供一种所述中药制剂的制备方法,所述方法为:按配方量,将各原料混合,加入3~5倍重量的水,浸泡1小时,水煎煮沸30分钟后,一次过滤,获得一次滤液和一次滤饼;一次滤饼加入各原料3~5倍重量的水,继续水煎煮沸15分钟,二次过滤,获得二次滤液和二次滤饼,合并一次滤液和二次滤液,浓缩成浸膏,获得所述中药制剂。此外,本发明还提供一种所述中药制剂在制备治疗慢性再生障碍性贫血药物中的应用。所述的药物为片剂、颗粒剂、胶囊剂或口服液。慢性再障起病缓慢,临床除面色苍白、心悸气短、头晕乏力主症外,尚可见潮热盗汗、口渴思饮、舌边尖红少津、脉细数之“阴虚”证,或形寒肢冷、食少便溏、舌体胖大边齿痕、苔白滑、脉沉弱之“阳虚”证。“肾藏精,精生髓,髓生骨…精足则髓足”(《医精经义》),又“精者,血之所成也”(《诸病源候论》),可见肾作为先天本元,是髓骨、精血化生之源,是慢性再障发病的本脏所在。“五脏之伤,穷必及肾”。肾元久虚则无以煦养周身脏腑,气血无以生化,形成恶性循环。故临床治疗多宗“从肾论治”。此外,脾胃为后天之本,肾精有藏,必赖于后天水谷精微不断充实之。脾为中脏,调周身气血,沟通上下,是为枢。根于肾,兼治脾,是为正治。慢性再障病程漫长,病情迁延反复,“久病必虚”、“久病必瘀”;且其人脾胃虚弱,痰湿自生,血不循经,溢于脉外即为瘀;痰瘀交阻,碍于髓骨,则令疾病进展,是谓“旧血不去,新血不生”。针对慢性再障上述的疾病特点和发病机制,本发明涉及的中药制剂在单纯“从肾论治”的基础上,突出了活血益气的价值。其中,熟地、生地、肉桂、丹参、当归温肾填精、活血养血为君药,菟丝子、仙灵脾、补骨脂、太子参、制首乌、赤芍为臣药,君臣共奏肾虚阴阳双补、益气活血之功。茯苓、山药、白术健脾化湿为佐药,甘草调和诸药为使药。与现有技术相比,本发明有益效果主要体现在:本发明中药制剂用于治疗慢生障碍性贫血,能在原单纯补肾的基础上进一步提高疾病的临床疗效,能有效改善血象,尤其促进血小板计数的提高,同时能有效调节机体免疫功能再平衡、提高生活质量;体外研究表明,该中药制剂的含药血清能促进AA患者骨髓间充质干细胞(MSCs)的增殖,通过激活SDF-1/CXCR4-PI3K/AKT信号通路有效促进再障MSCs功能的恢复。动物研究同样表明该方能有效上调小鼠MSCsVEGF、SDF-1、CXCR4、Akt的mRNA表达,改善造血微环境。(四)附图说明图1不同浓度含药血清作用时间OD值比较柱形图。图2药物干预下各组细胞因子比较柱形图;A:SDF-1阳性对照组B:空白对照组;C:中药组,D:中药+Akt抑制剂+PI3K抑制剂+CXCR4抑制剂组;E:中药+Akt抑制剂+PI3K抑制剂;F:中药+Akt抑制剂。图3各组上清液中VEGFmRNA的相对表达量;A:SDF-1阳性对照组B:空白对照组;C:中药组,D:中药+Akt抑制剂+PI3K抑制剂+CXCR4抑制剂组;E:中药+Akt抑制剂+PI3K抑制剂;F:中药+Akt抑制剂。(五)具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:本发明实施例所用药材按照《中国药典》2015版采集制备。实施例1中药制剂1中药组合物306g,配方:熟地30份、生地30份、肉桂6份、丹参20份、当归20份、菟丝子20份、补骨脂20份、仙灵脾20份、太子参30份、制何首乌15份、赤芍15份、丹皮15份、茯苓15份、白术15份、山药30份、甘草6份。中药组合物制备方法:按配方量,将各原料混合,加入3~5倍重量的水,浸泡1小时,水煎煮沸30分钟后,留取中药煎液。药渣再加等量水,继续水煎煮沸15分钟,去除药渣,合并中药煎液,减压浓缩成浸膏,获得中药制剂160g。实施例2:中药制剂2中药组合物218g,配方:熟地20份、生地15份、肉桂4份、丹参10份、当归10份、菟丝子15份、补骨脂20份、仙灵脾20份、太子参30份、制何首乌10份、赤芍10份、丹皮9份、茯苓10份、白术12份、山药30份、甘草3份。中药组合物制备方法:按配方量,将各原料混合,加入3~5倍重量的水,浸泡1小时,水煎煮沸30分钟后,留取中药煎液。药渣再加等量水,继续水煎煮沸15分钟,去除药渣,合并中药煎液,减压浓缩成浸膏,获得中药制剂160g。实施例3:中药制剂3中药组合物145g,配方:熟地10份、生地10份、肉桂3份、丹参10份、当归10份、菟丝子10份、补骨脂10份、仙灵脾10份、太子参9份、制何首乌10份、赤芍8份、丹皮9份、茯苓9份、白术9份、山药15份、甘草3份。中药组合物制备方法:按配方量,将各原料混合,加入3~5倍重量的水,浸泡1小时,水煎煮沸30分钟后,留取中药煎液。药渣再加等量水,继续水煎煮沸15分钟,去除药渣,合并中药煎液,减压浓缩成浸膏,获得中药制剂160g。实施例4(一)中药制剂对慢性再障患者的治疗作用及机制研究一、病例和方法1.纳入标准1.1西医诊断标准(参考张之南·《血液病诊断及疗效标准》第二版)符合再障诊断,并具有以下特征者:1)临床表现:发病较急性再障缓慢,贫血、感染、出血相对较轻。2)血象:血红蛋白下降速度较慢,网织红细胞、中性粒细胞及血小板降低,但达不到急性再障的程度。3)骨髓象:三系或两系减少,至少一个部位增生不良,入增生活跃,则淋巴细胞相对增多,巨核细胞明显减少;骨髓小粒中,非造血细胞(如脂肪细胞)增加。4)病程中如病情恶化,临床、血象及骨髓象与急性再障相同,则称重型再障Ⅱ型。1.2“肾阳虚”中医诊断依据证候特点:面色晄白,形寒肢冷,唇甲色淡,气短懒言,腰酸腿软,食少便溏,出血色淡,舌胖大苔白边有齿痕,脉沉弱。1.3入选标准和排除标准1.3.1纳入病例标准:凡符合以上西医诊断标准者,且排除慢性再障-重型再障Ⅱ型,同时符合中医“肾阳虚”证型诊断,在满足下列4点,即可纳入临床治疗研究。纳入符合“肾阴虚”的患者,用于比较与入组“肾阳虚”患者在内分泌相关指标的差异,不涉及疗效观察。1)能除外其他引起全血细胞减少的疾病,如骨髓增生异常综合征、骨髓纤维化、急性造血功能停滞、阵发性睡眠性血红蛋白尿症、急性白血病、恶性组织细胞增多症等;2)一般抗贫血药物治疗无效;3)自愿服用中药治疗,纳入前应签署知情同意书;4)能随访,依从性好可纳入实验病例。1.3.2排除标准:1)妊娠或哺乳期妇女;2)有心、肝、肾,糖尿病等严重原发性疾病,精神病患者;3)合并严重不可控制的感染;4)同时合并有未治愈的第二种血液病或其他恶性疾病;5)中医证型较复杂,多型混杂者。1.3.3剔除标准1)凡不符合纳入标准,资料不全,依从性差的患者;2)发生不良反应者应进行不良反应的统计;3)治疗时间不足3个月者。1.病例来源研究选取2009.11-2012.4期间收治的符合病例入选标准的“肾阳虚型”慢性再生障碍性贫血患者,随机分为“单纯补肾组”和“补肾活血”治疗组,选取健康体检作为正常对照组。3.治疗方法3.1中医辨病/辨证论治1)单纯补肾组治则:温肾壮阳处方:熟地15g、肉桂3g、淡附片4g、补骨脂12g、仙灵脾8g、仙茅8g、鹿角胶10g(烊化)、杜仲12g、山萸肉15g、淮山药15g、枸杞15g、制首乌12g、黄精15g。上述各胃药加入3~5倍重量的水,浸泡1小时,水煎煮沸30分钟后,留取中药煎液。药渣再加等量水,继续水煎煮沸15分钟,去除药渣,合并中药煎液,浓缩至约160ml,生药量为0.9g/ml,分二次服用,每次80ml。补肾活血组治则:温肾壮阳,活血益髓处方:实施例2制备的中药制剂,每天二次服用,每次80ml。3.2西医基础治疗1)雄激素:安雄每次80mgbid,每天两次;康力龙每次1-2片,一天两次;达那唑每次1片,一天两次;十一酸睾丸酮每次250mg-500mg肌注,半月1次,从中选取1~2种雄激素;2)环孢霉素:CSA,3~5mg/Kg·d,一天分两次口服,维持治疗6个月以上。3.3支持治疗主要包括成份输血、预防感染和抗感染治疗。1)血红蛋白<75g/L;血红蛋白<80g/L的高龄患者有明显贫血症状,可考虑红细胞悬液输注;2)PLT<5.0×109/L(无出血危险因子)或PLT<20.0×109/L(有明显出血倾向,或存在出血危险因子),给予血小板悬液输注及对症止血治疗;控制感染应选用对致病菌敏感的抗生素治疗。4.治疗周期患者入组,给予西药常规基础免疫抑制及对症支持治疗,同时给予相应中药辨病/辨证治疗,共治疗6个月。5.检测标本采集5.1血液标本收集采集患者治疗前及治疗后3个月、6个月静脉血各10ml,室温静置30分钟,3000r/min离心10分钟,分离血清置于-70℃冰箱中备检,另取30例健康体检者作为正常对照。“肾阴虚”患者仅采集治疗期血样标本。5.2骨髓标本收集留取部分慢性再障患者骨髓液,肝素抗凝后,Ficoll液分离提取单个核细胞,进而传代分离培养骨髓间质细胞,进行后续相关中药血清学体外基础研究。6.主要实验仪器及试剂1)200流式荧光仪(Luminex,美国)2)微量移液器(eppendorf,德国)3)酶标仪(DG3022A,中国)4)全自动免疫分析仪(ARCHITECTi2000SR,雅培)5)倒置生物显微镜(COIC-XDS-1B,中国)6)倒置荧光显微镜(OLYMPUS-IX71,日本)7)人淋巴细胞分离液(Ficoll液)(天津灏洋生物,中国)8)CD4、CD8、CD8-FITC/PE/PC5、CD40L-PE-CY5、CD69-FITC、CD22-FITC、CD40-FITC、Fas(CD95)FITC、Fas-LBio、CD19-PE、CD3-PerCP等单克隆抗体(BDPharMingen,美国)9)荧光标记的小鼠抗人CD31-FITC、CD49d-PE、CD44-FITC、CD106-PE以及同型对照(BioLegend,美国)10)VEGF试剂盒(R&Dsystem,美国)11)IFN-γ、TNF-α、IL-2、IL-4、IL-10流式抗体(R&Dsystem,美国)12)人糖皮质激素受体试剂盒、人雄激素受体试剂盒(Rapidbiolab公司,美国)13)IsotypeMouseIgG1-Bio、IsotypeMouseIgG1-FITC、IsotypeMouseIgG1-PE、IsotypeMouseIgG1-PE-cy5、IsotypeMouseIgG2a-PE、IsotypeMouseIgG2a-FITC、IsotypeMouseIgG2a-PE-cy5(BDPharMingen,美国)7.观察指标及评价方法7.1临床研究部分及评价方法1)临床指标观察①一般体检项目;②血、尿、便常规:治疗前后进行血、尿、粪常规化验检查;③心、肝肾功能:治疗前后进行心电图、肝功能(GPT)肾功能(BUN,Cr);④CsA血浓度;⑤药物的毒副反应。2)疗效观察①患者治疗前后血象、骨髓象变化;②中医证候。3)临床实验室指标观察①流式细胞仪检测T细胞亚群:CD3+CD4+T细胞、CD3+CD8+T细胞、Th1细胞(CD4+IFN-γ+)、Th2细胞(CD4+IL-4+)占外周血淋巴细胞中的比例;②血清或骨髓单个核细胞培养上清的IFN-γ、TNF-α水平;③检测治疗前后血清血管内皮生长因子(VEGF)。7.2疗效评价方法1)西医疗效评定:参照《血液病诊断及疗效标准》第二版①基本治愈:贫血和出血症状消失。血红蛋白男性达120g/L,女性达100g/L,白细胞达4×109/L,血小板达80×109/L,随访一年以上未复发。②缓解:贫血和出血症状消失,血红蛋白男性达120g/L,女性达100g/L,白细胞达3.5×109/L,血小板也有一定程度的增加,随访3个月病情稳定或继续进步。③明显进步:贫血和出血症状明显好转,不输血,血红蛋白较治疗前1个月内常见值增长30g/L以上,并能维持3个月。判定以上三项疗效标准者,均应3个月内不输血。④无效:经充分治疗后,症状、血象未达明显进步。2)中医证候疗效评分标准:参照《郑筱萸.中药新药临床研究指导原则.中国医药科技出版社.2002年.ISSN:9787506725811》。积分比=(治疗前总积分-治疗后总积分)/治疗前总积分×100%①临床痊愈:中医临床症状、体征消失或基本消失,积分比≥90%;②显效:中医临床症状、体征消失或基本消失,积分比<90%,≥70%;③有效:中医临床症状、体征有改善,积分比<70%,≥30%;④无效:中医临床症状、体征均无改善,甚或加重,积分比<30%。8.统计方法运用SPSS17.0统计软件包调取数据库资料,建立SPSS文件,并对资料进行统计分析。本课题的主要统计方法:计量资料用均数±标准差表示,应用T检验或非参数检验(期间采用非参数检验中的Shapiro-Wilk,W检验)对数据进行正态分布检验,如果数据服从正态分布可以进行独立样本t检验,如果不服从正态分布则进行非参数检验;计数资料应用χ2检验。二、结果1.病例基本信息研究期间收治符合病例入选标准且能完成6个月临床随访的“肾阳虚”慢性再战患者63例,其中男性35例,女性28例,中位年龄32(11-59)。(见表1)。表1慢性再生障碍性贫血患者基本信息分布注:患者性别、年龄等的分布情况基本一致,经统计学分析无显著性差异。2.肾阳虚患者疗效分析2.1血象变化结果显示,中药治疗能有效增加患者WBC计数,且在治疗6个月后存在显著性差异(P<0.05);Hb仅在单纯补肾法中治疗6个月后存在显著性差异(P<0.05);PLT仅在补肾活血法中6个月后存在显著性差异(P<0.05)。与单纯补肾组比较,同期补肾活血在升高WBC、PLT计数上具有显著性差异(P<0.05)。(见表2)表2患者治疗前后血象差值比较注:同一治法间,与治疗3个月计数差值比较,*P<0.05;不同治法同期比较,与单纯补肾组,+P<0.05.2.2西医疗效评估结果显示,不同中医治法联合西医治疗的西医疗效存在差异变化,以“补肾活血”为佳。但经多行多列卡方检验,组间χ2=0.717,P>0.05,不同中医治法间无明显统计学差异。(见表3)表3西医临床疗效评估注:χ2=0.717,P>0.05.2.3中医疗效评估结果显示,治疗6月后,两种中医治法在改善患者中医临床证候无统计学差异(χ2=03.308,P>0.05),但不同治法间存在差异变化,“补肾活血”>“单纯补肾”。(见表4,5)表4中医证候积分表5治疗6月中医疗效评估注:χ2=03.308,P>0.05.3.免疫抑制剂及雄激素毒副反应比较研究结果显示,两种中医治法联合西药免疫抑制剂治疗慢性再障均存在相关毒副反应,且各组间的发生率无显著性差异。(见表6)表6免疫抑制剂的毒副反应表注:各组在整个治疗过程中,均出现不同程度的不良反应,主要与使用免疫抑制剂有关,各组相比差异无有显著性(P<0.05)4.肾阳虚患者治疗前后免疫学指标变化4.1T细胞亚群比较“单纯补肾”及“补肾活血”法联合西药治疗CAA对CD3+细胞、CD3+CD4+细胞、Treg比例改善不明显(P>0.05)。两治疗组CD3+CD8+细胞百分比例均有一定下调,其中治疗后6个月CD3+CD8+与治疗前比较存在显著性差异(P<0.05);然而各组间同期比较无显著差异(P>0.05)。两组治疗后6个月CD4+/CD8+与治疗前相比显著上调(P<0.05),且治疗6月后,不同治法之间以“补肾活血法”上调的比例更高(P<0.05)。(见表7)表7各组治疗前后T细胞亚群变化注:与各组治疗前比较,*P<0.05;与其他两组同期比较,#P<0.05.4.2血清细胞因子水平比较CAA患者治疗前IL-2、IL-4、IL-6、IL-10、IFN-γ、TNF-α水平与正常对照组相比有显著差异(P<0.05)。两治疗组治疗前后IL-4、IL-6、IFN-γ水平均无显著性差异(P>0.05),而IL-2、TNF-α、IL-10水平两组治疗后3个月、治疗后6个月与治疗前相比差异显著(P<0.05)。治疗6月同期比较,“补肾活血”组TNF-α下降更为显著(P<0.05)。(见表8)表8各组治疗前后外周血细胞因子变化注:与正常对照比较,各组治疗期,*P<0.05,**P<0.01;与各组治疗前比较,+P<0.05;与其他两组同期比较,#P<0.05.(二)补肾活血法对再生障碍性贫血患者骨髓MSCs功能的影响一、实验材料和方法1.实验材料1.1实验动物与饲养环境6周龄SPF级荷兰兔,雄性,体重2-3Kg,饲养于浙江中医药大学动物实验研究中心屏障环境中【SYXK(浙)2008-0116】;饲喂普通饲料,自由饮食。环境温度:20~22℃,相对湿度:40%~60%。1.2药物中药处方:实施例2制备的中药制剂。1.3主要试剂MSCs专用培养液MSCM:美国Sciencell公司;PBS(杭州吉诺生物医药技术有限公司,批号13061002);TBD人外周血淋巴细胞分离液:天津灏洋生物有限公司;含0.02%EDTA的胰酶溶液:美国GIBCO公司;β-甘油磷酸钠、IBMX、地塞米松、吲哚美辛等:美国SIGMA公司;碱性磷酸酶(ALP)染色试剂盒:南京建成生物工程研究所;RNAisoPlus(总RNA提取试剂):大连Takara公司;逆转录试剂盒:大连Takara公司;荧光定量试剂盒:大连Takara公司;抗体鼠抗人CD44-FITC、CD29-FITC、CD34-PE、CD166-PE等:美国Biolegend公司。鼠抗SDF-1、CXCR4、PI3K、AKT、VEGF:美国CST;二抗:美国CST;抑制剂:AMD3100(CXCR4拮抗剂)、LY294002(PI3K抑制剂)、MK2206(Akt抑制剂):美国selleck公司。1.4主要溶液的配置(1)胎牛血清及补肾活血含药血清的灭活:接通水浴箱电源,调节温度控制钮,当温度计所示温度保持在56℃时,将血清瓶放入水浴箱中,定时30分钟;大瓶血清灭活后,0.22μm微孔滤膜过滤除菌,50ml离心管分装,-20℃保存备用。(2)PBS液的配制:取市售0.lpm过滤除菌的PBS(pH7.4)500ml,加入青霉素和链霉素,使两者的最终浓度均达到100U/ml,250ml瓶分装,封口,4℃冰箱冷藏备用。1.5主要仪器超净工作台:上海上净净化设备有限公司;5%C02恒温培养箱:美国Thermo公司;电热恒温水浴箱:北京长源实验设备厂;倒置荧光显微镜:日本OLYMPUS公司;蒸汽压力灭菌器:日本SANYO公司;台式冷冻多用离心机:美国Thermo公司;多功能全波长酶标仪:美国Thermo公司;流式细胞仪:美国BDFACSCantoII;细胞培养瓶培养板:Corning公司;移液器(1mL,200μL,20μL,2μL):Discovery。2.实验方法2.1血含药血清的制备将实施例1-3制备的中药制剂分别为组1-组3,组4为对照组。选清洁级雄性荷兰兔,2-3Kg。组1将实施例1方法制备的中药制剂570g加入30ml去离子水制成中药液300ml,取20ml(高剂量,相当于生药量1.9g/ml)中药液灌胃雄性荷兰兔;组2将实施例2制备的中药制剂392g加入100ml去离子水制成中药液300ml,取20ml(中剂量,生药量1.4g/ml)中药液灌胃雄性荷兰兔;组3将实施例3制备的中药制剂252g加入180ml去离子水制成中药液300ml,取20ml中药液灌胃雄性荷兰兔(低剂量,生药量0.9g/ml)。对照组每次灌胃生理盐水20ml,每天2次,共7天;组1-组3每次灌胃20ml,每天2次,共7天。从实验第4天起,每天对各兔在第二次灌胃2小时后耳静脉取10ml全血,后立即离心,每组得到约5ml血清。将4次血清混合后,每组共得到约20ml血清,置于水浴箱中56℃,30min灭活,0.22μm过滤器过滤除菌,分别获得含药血清(高、中、低剂量),分装至15ml离心管中,-20℃冷藏备用。2.2细胞系制备2.2.1健康供者入选标准取健康骨髓干细胞捐献者6例作为正常对照组,其中男3名,女3名,中位年龄29岁(23~48)。所有志愿者均知情同意,签署知情同意书。2.2.2再障患者入选标准选取2014年6月1日至2014年10月31日我院血液内科住院及门诊的再生障碍性贫血患者10例,其中男5例,女5例,中位年龄26岁(18~56),病例诊断均符合张之南主编《血液病诊断及疗效标准》(第三版)。所有病例均知情同意,签署知情同意书。2.2.3骨髓MSCs的分离和培养常规抽取健康供者或重型再障患者骨髓5ml-10ml,缓慢加入含有7ml人淋巴细胞离液(比重为1.077)的离心管中,1500转/分离心15min,吸取中间的环状乳白色单核细胞层,置PBS中洗涤3次,洗涤后将细胞用MSCs专用培养液接种于25cm2培养瓶中,在37℃、5%CO2细胞培养箱中培养,72h后首次换液以纯化细胞,以后每隔3d换液1次,待细胞融合率达80%以上时传代培养,传至3代备用。2.3细胞表面标志鉴定取传至第3代生长状况较好的细胞,用含0.02%EDTA的胰蛋白酶溶液消化,800转/分离心5min弃上清,加入1mlPBS,调整细胞浓度至2×105个细胞/管,800转/分离心5min弃上清,各样本中加入100μlPBS,轻弹混匀,加入抗体CD44-FITC、CD29-FITC、CD34-PE、CD166-PE各10ul,室温避光孵育30min,加入500μlPBS洗涤,800转/分离心5min弃上清,加入300μlPBS终止反应,轻弹混匀,流式细胞仪检测分析,结果见图1。2.4定向诱导MSCs向成骨细胞分化的方法与鉴定收集消化后细胞,按3000cells/cm2接种于6孔板,待多数细胞贴壁后,换用含10%FBS的高糖DMEM培养液,加入成骨诱导体系(终浓度):地塞米松0.1μmol/L、β-甘油磷酸钠10mmol/L、抗坏血酸磷酸盐50μmol/L,每3天全量换液,维持2-3周。用碱性磷酸酶试剂盒染色。碱性磷酸酶(AP)染色:未分化细胞染色为蓝/紫色,分化的细胞染色为无色,结果见图2。2.5MTT法测含药血清对MSCs增殖的影响取生长状态良好的第3代MSCs,以5×103个细胞/孔的密度接种于96孔板中,每孔200μl,设实验组与对照组。选取步骤2.1制备的含药血清,加入无血清DMEM培养液(血清终浓度分别为5%、10%、15%、20%、25%),对照组则加入空白对照组血清,每组5个复孔,分别37℃,5%CO2培养24h、48h、72h后,加入MTT溶液10μl/孔,5%CO2,37℃细胞培养箱内培养4h,取出96孔板,吸出MTT,加入二甲基亚砜(DMSO)150μl,置摇床上低速震荡10min,在酶标仪570nm波长处检测吸光度(OD)值。2.6实验分组及药物处理方法将经鉴定的MSCs适当条件下培育,传代至3代后,随机分为:(A)SDF-1诱导阳性对照组:常规培养MSCs细胞系,生长至80%融合后,换用无血清DMEM培养基,加入终浓度为100ng/mlSDF-1继续培养48h;(B)空白对照组:常规培养MSCs细胞系,生长至80%融合后,换用无血清DMEM培养基继续培养48h;(C)含药血清干预组:常规培养MSCs细胞系,生长至80%融合后,换用含有体积浓度15%含药血清(高、中、低剂量)的DMEM培养基,继续培养48h,分别为C1,C2,C3组;(D)含药血清干预组+AMD3100+LY294002+MK2206:常规培养MSCs细胞系,生长至80%融合,以1μg/mlAMD3100预处理2h、1μmol/LLY294002预处理4h、200μmol/LMK2206预处理6h后,含有15%含药血清(高、中、低剂量)的DMEM培养基继续培养48h,分别为D1,D2,D3组;(E)含药血清干预组+LY294002+MK2206:常规培养MSCs细胞系,生长至80%融合,以1μmol/LLY294002预处理4h、200μmol/LMK2206预处理6h后,含有15%含药血清(高、中、低剂量)的DMEM培养基继续培养48h,分别为E1,E2,E3组;(F)补肾活血含药血清干预组+MK2206:常规培养MSCs细胞系,生长至80%融合,以200μmol/LMK2206预处理6h后,含有15%含药血清(高、中、低剂量)的DMEM培养基继续培养48h,分别为F1,F2,F3组。2.6.1ELISA法测VEGF、PECAM-1、VCAM-1胰酶消化各组经相应药物处理备用的MSCs,收集细胞,3000r/min,10min离心,收集上清,按ELISA试剂盒说明书检测标准品及细胞上清液中VEGF、PECAM-1、VCAM-1的吸光度值(OD值),并绘制标准曲线,最终计算得各浓度处理后各细胞因子浓度。具体步骤如下:(1)按试剂说明配置Washingbuffer、Cytokinestandard、Biotinylatedantibody、Streptavidin-HRP等溶液;(2)各试剂使用前,将其充分混匀,且避免产生泡沫;(3)根据实验孔(空白和标准品)数量,确定所需的板条数目。样品(含标准品)和空白孔都应做复孔。为避免操作时间所致误差,每次实验板板条数不宜太多。(4)加样:标准品孔加入稀释后的Cytokinestandard,样品孔加入样品,空白对照孔加入DilutionbufferR(1×),各100μL/well。(5)加检测抗体:每孔快速而准确地加入50μL稀释后的Biotinylatedantibody。混匀,盖上封板膜,室温(18-25℃)孵育2h。(6)洗板:倒去孔内液体,每孔300μL加入1×washingbuffer;作用1min左右后弃去孔内液体,在干净滤纸上拍干,重复3次此操作过程。(7)加酶反应物:每孔内快速准确加入100μLStreptavidin-HRP,盖上封板膜,室温(18-25℃)孵育20min。(8)洗板:与步骤6方法相同。(9)显色:每孔快速加入100μLTMB显色液,室温(18-25℃)避光孵育5-30min之间,根据孔内颜色的深浅(深蓝色)来判定终止反应。通常显色在10-20min可以达到很好的效果。(10)终止反应:根据步骤9中标准孔显色效果,确定终止反应时间后,迅速加入Stopsolution100μL/well终止反应。(11)读板:终止反应后10分钟内,使用酶标仪双波长即检测波长(measurementwavelength)450nm,参考波长或校正波长(referencewavelength)610-630nm同时读板,读取OD值。2.6.2实时荧光定量PCR法测VEGFmRNA表达(1)细胞总RNA的提取①用细胞刮刮下细胞,PBS冲洗后1000rpm,离心5分钟,得到细胞沉淀;②倒掉PBS,并加入1ml的Trizol,剧烈震荡,室温放置5min;③加入0.2ml的氯仿,盖好后漩涡剧烈震荡15秒,室温放置2-3分钟,然后离心12,000rpm,15min,4℃。离心后分成三层,下面的红色为酚-氯仿相,一个中间层,一面是无色的水相。RNA只存在于水相中;④将上层水相转移到另一干净的EP管中,加入等体积的异丙醇,静置30mins,-20℃,然后离心12,000rpm,15min,4℃;⑤去上清,加入1ml75%乙醇水溶液洗涤RNA沉淀,振荡器混匀,离心7,500g,5min,4℃;⑥去上清,置真空或空气中5-10分钟,干燥RNA沉淀,(不能在真空中离心干燥)。注意不能将RNA沉淀完全干燥,这样会极大地降低它的溶解度;⑦根据沉淀的量加入适量的RNasefree水溶解RNA,分装RNA液,保留一管测定RNA浓度、纯度及用于逆转录,其余RNA保存于-70℃冰箱中。(2)cDNA的合成cDNA合成的操作步骤按TAKARA公司产品说明进行,具体方法如下:表9逆转录反应体系试剂使用量5×PrimeScriptBuffer(forRealTime)4μLPrimeScriptRTEnzymeMix11μLOligodTPrimer(50uM)1.5μLRandom6mers(100uM)1.5μLTotalRNA≤1μgRNaseFreedH2Oupto20μL将已加好的逆转录体系加入无RNase的PCR管内,设置逆转录条件为:37℃15min,85℃5s。cDNA放至-20℃冰箱保存,备用。(3)RealTimePCR检测操作按照TAKARA公司荧光定量试剂盒说明书进行,将cDNA用荧光定量PCR仪进行扩增,在冰上进行操作。按表格各组份配置逆转录反应液。表10实时荧光定量PCR反应体系(4)引物设计选取GAPDH为内参基因,打开引物管子前,12000rpm,4℃离心10min,再慢慢打开管盖,用DEPC水将引物配置成100μmol/L的贮存液,上下振荡10min,充分混匀,-20℃保存,用DEPC水将引物稀释成10μmol/L的工作液,进行PCR反应,引物序列如下:表11mRNA引物序列PCR扩增条件:95℃预变性30s;95℃变性5ec;60℃退火30s,循环40次。PCR产物分析:根据Ct值,通过2-△△Ct法计算各个基因的相对表达量。2.7数据统计学处理所有计量数据均采用表示,用SPSS19.0软件进行统计,采用ANOVA方差分析,方差齐性用LSD方法,方差不齐用Tamhane,sT2方法,P<0.05表示显著差异;图标绘制采用GraphPadPrism5.0软件。二、实验结果1.骨髓MSCs的鉴定1.1MSC表面抗原的检测结果提示:MSCs高表达间质细胞标记CD105(96.7%)、CD29(98.4%)、CD73(99.6%)、CD166(61.2%),不表达造血细胞标记CD34(0.2%)、CD45(2.4%)、HLA-DR(1.4%),CD44(0.1%),如图1。1.2不同浓度含药血清对MSCs细胞增殖的影响结果表明,不同浓度的补肾活血含药血清对MSCs的增殖促进作用有差异。与生理盐水组相比较,含药血清作用24h无明显差异;而在作用48h后增殖作用最强(P<0.05),尤以15%的血清浓度下的细胞增殖最明显,但在作用72h后OD值无明显增加,表明细胞增殖无时间依赖性。而25%的浓度OD值有所下降,表明高浓度的血清对细胞增长具有抑制作用。据此结果,我们选取15%的补肾活血含药血清浓度作用48h行进一步研究。表12不同浓度含药血清对细胞增殖作用比较(x±s,n=5)注:与正常对照组比较:*P<0.05。2.ELISA(VEGF、PECAM-1、VCAM-1)结果依据说明书要求绘制各细胞因子标准曲线图,根据ELISA标准孔的结果作半对数曲线,并行相关性检验,得出回归方程,其中Y轴为细胞因子标准浓度,X轴为检测OD值。各细胞因子具体回归方程及R2值见表13。表13各细胞因子标准曲线方程与B组相比,A、C组中VEGF、PECAM-1、VCAM-1细胞因子表达水平均升高(P<0.05);与C组相比,D、E、F组VEGF、PECAM-1、VCAM-1细胞因子表达减少(P<0.05),尤以D组明显减少(P<0.05)。F组与C组相比,PECAM-1表达差异无显著性差异(P>0.05)。C、D、E、F各亚组间无显著性差异。具体结果见表14和图2。表14各组上清液中细胞因子比较(n=3)注:(1)A:SDF-1阳性对照组,B:空白对照组;C:中药组,D:中药+Akt抑制剂+PI3K抑制剂+CXCR4抑制剂组;E:中药+Akt抑制剂+PI3K抑制剂;F:中药+Akt抑制剂;C、D、E、F组按照中药组方不同,分为高中低三个剂量的亚组。(2)与空白对照组比较:*P<0.05;与中药干预组比较:#P<0.053.RT-PCR中VEGFmRNA表达量各组的上清液的VEGF基因扩增良好,引物特异性好,见表15。与B组相比,A、C组VEGFmRNA表达量升高(P<0.05),而A、C两组间无明显差异(P>0.05);E、F组VEGFmRNA表达与空白对照组相比无显著增加(P>0.05);与C组相比,D、E、F组的VEGFmRNA表达均有下调(P<0.05),尤以D组有显著下降(P<0.05);E组与F组相比无显著性差异(P>0.05)。C、D、E、F各亚组间无显著性差异。表15各组上清液中VEGFmRNA表达(n=3)与空白对照组比较:*P<0.05;与含药血清组(C1~C3组)比较:#P<0.05;与阳性对照组比较:△P<0.05。(三)补肾活血法对再生障碍性贫血小鼠造血功能和骨髓MSCs功能的影响一)实验材料与方法1.实验动物Balb/c小鼠(雌性)6-8周龄,92只,16~20g。DBA/2小鼠(雌性)6-14周龄,6只,18~20g。均购于上海斯莱克实验动物有限责任公司。2.实验药品中药为实施例2制备的中药制剂,生药量1.4g/ml。AMD3100(CXCR4拮抗剂)(美国selleck公司)、LY294002(PI3K抑制剂)(美国selleck公司)、MK2206(Akt抑制剂)(美国selleck公司)、环孢素(NovartisPharmaSteinAG)3.实验器材(1)试剂盒:RT-PCR(TaKaRa试剂盒RR047A)、SP-9001(中杉金桥)、DAB(中杉金桥)等(2)主要仪器SteponeplusPCR仪(ABI美国生物应用系统公司)、-20℃低温冰箱、显微镜(日本奥林巴斯BX51T-PHD-J11)、CMOS(日本奥林巴斯)、切片机(德国莱卡RM2015)、HD-330型摊片机(湖北慧达仪器有限公司)、干燥箱(日本三洋MIR-153型)、全自动血细胞分析仪(BeckmanCoulterGen.S)、LDZ5-2型低速自动平衡离心机、微量移液器、小试管、离心管、玻璃器皿、EDTA管、注射器、灌胃针、电子天平、解剖刀等。4.实验方法(1)建立免疫介导型再生障碍性贫血(AA)小鼠模型选用Balb/c小鼠80只,用免疫介导法建立AA模型。实验前期完善了免疫介导小鼠再障模型的造模流程,目前能稳定可靠的重复免疫介导小鼠再障模型的制作,造模成功后的再障小鼠其血三系一直低下,观察至造模后4-6周,发现其血三系在造模后的第四周有恢复迹象,为动物实验打好了基础工作。具体造模方法:将Balb/c小鼠(16-20g)固定在大小合适的容器内,互不干扰。以源皮距100cm,距床高3.7cm的位置,全身照射。6.0Gy的60Co-γ射线,剂量率1.0Gy/min,照射360秒,误差±5%。取DBA/2小鼠(6-14周龄)6只,断颈处死,用75%酒精浸泡消毒5分钟。用镊子把小鼠的毛翻起来,使酒精直接与皮肤接触,把毛内的微生物杀死。开腹前需要把腹部切口周围的毛剪去。无菌环境下取出小鼠胸腺,加RPMI-1640培养液清洗,用剪刀将胸腺反复剪切成糊状,轻轻研磨后用200目铜网过滤,无菌NS洗涤2遍,成为单细胞悬液。取1滴苔盼蓝滴入玻片上鉴定淋巴细胞活性在95%以上。经血细胞计数板计数后,用NS配成浓度为5×106细胞/ml(1*106个/0.2ml)浓度放入无菌玻璃瓶中备用,瓶口及瓶盖均至酒精灯消毒,无菌纱布包扎封口。在60Co-γ射线照射后4小时内经Balb/c小鼠尾静脉注入上述细胞悬液0.2ml/只。饲养于无菌环境下,每日观察小鼠活动、进食、毛发等情况。7天左右小鼠眼眶取血,血常规可见白细胞、血红蛋白、血小板等均有不同程度下降,以白细胞、血小板为著,提示造模成功。(2)实验分组及给药方法将造模成功的72只小鼠随机分为6组:(A)模型对照组12只,PBS0.2ml/d,腹腔注射;(B)环孢素对照组12只,环孢素0.2ml/d(0.5mg/ml),腹腔注射;(C)中药组12只,0.2ml/d,灌胃;PBS0.2ml/d,腹腔注射;(D)中药+AMD3100组(CXCR4拮抗剂)12只,中药0.2ml/d,灌胃;AMD31000.2ml/qod(5mg/kg)腹腔注射;(E)中药+AMD3100(CXCR4拮抗剂)+LY294002(PI3K抑制剂)组12只,中药0.2ml/d,灌胃;AMD31000.1ml/qod(5mg/kg),LY2940020.1ml/qod(10mg/kg)腹腔注射;(F)中药+AMD3100(CXCR4拮抗剂)+LY294002(PI3K抑制剂)+MK2206(Akt抑制剂)组12只,中药0.2ml/d,灌胃;AMD31000.1ml/qod(5mg/kg),LY2940020.1ml/qod(10mg/kg),MK22060.1ml/qod(5mg/kg)腹腔注射。(G)正常组12只,生理盐水0.2ml/d灌胃,同时给予0.1ml生理盐水腹腔注射。(3)观察指标及测定记药物干预为d0,于d1(辐照后7天)将全部Balb/c小鼠眼眶取血3-5滴。经血细胞计数仪测血常规。分别于d6、d12、d18将全部或所剩Balb/c小鼠眼眶取3-5滴全血装入EDTA管测血常规,并随机每次向每组取小鼠3只,每组至少共9只,眼眶取血致死,全血装至1.5mlEP管经离心机离心后留取血清。将小鼠在无菌条件下解剖,取脾脏、左右股骨头等标本。具体流程如下:a、提前对超净工作台进行紫外线照射1小时进行消毒,戴口罩及无菌手套;b、将小鼠尸体用75%酒精浸泡在烧杯中5min;用镊子把小鼠的毛翻起来,让酒精直接与皮肤接触,把毛内的微生物杀死。开腹前需要把腹部切口周围的毛剪去;c、无菌取出小鼠脾脏、左右股骨头放入备好的培养皿中,加少量NS除去血污及表面粘附的结缔组织;d、将脾脏装入大小适中的无菌容器内,并放入氮液内保存。将左测股骨头经RPMI-1640培养液冲洗后,计数有核细胞个数。右侧股骨头放入装有福尔马林试剂的EP管备用(病理切片)。分别于治疗后d1、d6、d12、d18观察。①一般状态观察:每天观察有无倦怠、纳差、竖毛、出血、腹泻等表现。②外周血细胞常规检测:分别于治疗后d6、d12、d18用镊子小鼠眼眶取血,用血细胞分析仪检测小鼠Hb、WBC和Plt。③骨髓有核细胞计数:在无菌环境下取各组小鼠的左侧股骨,使用RPMI-1640培养液冲洗,将冲洗后的骨髓液装入离心管,加入红细胞裂解液吹打混匀,放入离心机离心洗涤,分离出单个核细胞,再加入一定量的PBS制成单个核细胞混悬液,使用细胞计数器在显微镜下计数。④骨髓病理学检测:⑴脱蜡和水化;⑵抗原修复(采用高压热修复);⑶染色(SP法);⑷脱水,透明,封片,镜检。⑥实时荧光定量PCR法测定VEGF、SDF-1、CXCR4、Akt的mRNA表达水平:本RT-qPCR实时荧光定量实验,采用染料法(SYBRGreenI)进行相对定量分析,实验设计是按照ΔΔCt解析法来进行设计。A、细胞总RNA的提取a、取小鼠股骨骨髓细胞,PBS冲洗后1000rpm,离心5分钟,得到细胞沉淀;b、倒掉PBS,并加入1ml的Trizol,剧烈震荡,室温放置5min;c、加入0.2ml的氯仿,盖好后漩涡剧烈震荡15秒,室温放置2-3分钟,然后离心12,000rpm,15min,4℃。离心后分成三层,下面的红色为酚-氯仿相,一个中间层,一面是无色的水相。RNA只存在于水相中;d、将上层水相转移到另一干净的EP管中,加入等体积的异丙醇,静置30mins,-20℃,然后离心12,000rpm,15min,4℃;e、去上清,加入1ml75%乙醇洗涤RNA沉淀,振荡器混匀,离心7,500g,5min,4℃;f、去上清,置真空或空气中5-10分钟,干燥RNA沉淀,(不能在真空中离心干燥)。注意不能将RNA沉淀完全干燥,这样会极大地降低它的溶解度;g、根据沉淀的量加入适量的RNasefree水溶解RNA,分装RNA液,保留一管测定RNA浓度、纯度及用于逆转录,其余RNA保存于-70℃冰箱中。将已加好的逆转录体系加入无RNase的PCR管内,设置逆转录条件为:37℃15min,85℃5s。cDNA放至-20℃冰箱保存,备用。B、引物设计引物由TAKARA公司设计合成并质量检验:表16mRNA引物序列PCR扩增条件:95℃预变性30s;95℃变性5s;60℃退火30s,循环40次。PCR产物分析:根据Ct值,通过2-△△Ct法计算各个基因的相对表达量。二)统计方法建立SPSS数据库,数据采用SPSS17.0统计软件处理。实验结果采用表示,所有资料进行正态性检验:符合正态分布者,采用单因素方差分析,不符合正态分布者,采用秩和检验。当P<0.05时,认为组间数据有显著性差异,有统计学意义。三)实验结果1.小鼠一般情况一般状态观察:每天观察小鼠精神状态、体重、纳食、毛发、是否出血、大便质量等表现。免疫介入2-3天后(在造模后,辐照3天),小鼠逐渐出现怠倦、竖毛无光泽、纳差、体重下降等症状,并逐渐加重。后随着中药介入时间的不同,小鼠上述症状表现与时间长短成反比(详见表17)。表17小鼠造模前后一般情况变化(出现症状只数/总只数)2.血常规分别于药物治疗后第1、6、12、18天小鼠眼眶取血进行血常规测定。结果显示,急性再障小鼠血常规的白细胞、血红蛋白、血小板计数比正常对照组减少,以白细胞、血小板减少明显。经过补肾活血中药的介入,可以明显提高急性再障小鼠血常规中白细胞、血红蛋白、血小板计数,随着中药介入的时间的增加,小鼠血细胞计数与正常值越接近。d1,A、B、C、D、E、F各组间无明显差异(p>0.05),与G组相比,各组间血三系不同程度下降,有统计学意义(p<0.05);d6,d12,d18数据显示各组间有显著性差异(p<0.05),与A组相比,B、C组血三系明显升高(p<0.05),D、E、F组血三系变化无明显差异(p>0.05);与B组相比,C组血三系变化无明显差异(p>0.05)。具体见表18、表19、表20、表21。表18治疗后d1血常规变化注:与正常组相比,带*表示P<0.05。表19治疗后d6血常规变化注:与模型对照组相比,带*表示P<0.05。表20治疗后d12血常规变化注:与模型对照组相比,带*表示P<0.05。表21治疗后d18血常规变化注:与模型对照组相比,带*表示P<0.05。3.骨髓有核细胞计数药物治疗后第6、12、18天,予无菌环境下取各组小鼠左侧股骨行有核细胞计数。各组骨髓有核细胞计数见下表:表22骨髓有核细胞变化(104个/HP,)注:与模型对照组相比,*表示P<0.05。与环孢素组相比,△表示P<0.05。与正常组相比,#表示P<0.05。通过数据统计分析发现d6、d12、d18各组间骨髓有核细胞计数不全相同(P<0.05),有统计学意义。与G组相比,各组有核细胞均下降,有统计学意义。与A组比较,B、C组有核细胞数明显增多(P<0.05);d6,D、E、F组有核细胞数明显少于A组(P<0.05),d12、d18,D、E、F组与A组无显著性差异(P>0.05)。4.骨髓病理学检测药物治疗后d6、d12、d18予无菌环境下取各组小鼠右侧股骨行HE染色,做骨髓病理检测。从病理上看,G组小鼠骨髓象增生活跃,各系细胞增生良好,各阶段比例及形态正常,微血管面积正常。A、D、E、F组的小鼠骨髓增生明显减低,粒、红系及巨核细胞均不同程度减少,淋巴细胞、网状细胞及浆细胞等非造血细胞比例增高,含较多脂肪滴,微血管面积较少。B组及C组上述病理特征介于G组与A、D、E、F各组之间,提示补肾活血法对骨髓的造血环境及微血管面积的恢复起到一定的作用,间接反映补肾活血法对骨髓MSCs的血管新生功能起促进作用,且可能是通过SDF-1/CXCR4-PI3K/Akt信号通路起作用。见图3。5.实时荧光定量PCR法测定VEGF、SDF-1、CXCR4和Akt的mRNA表达水平正常组、模型组和各治疗组的骨髓MSCs的VEGF、SDF-1、CXCR4和Akt基因扩增良好,引物特异性好,详见表23。与G组相比,A、B、C、D、E、F各组的VEGFmRNA相对表达量明显下降(P<0.05),SDF-1、CXCR4、Akt的mRNA相对表达量均升高(P<0.05)。与A组相比,B、C组VEGF、SDF-1、CXCR4、Akt的mRNA表达量均升高(P<0.05),D、E、F组VEGFmRNA表达量无显著增加(P>0.05),而D、E、F组的SDF-1、CXCR4、Akt的mRNA表达量均有下调(P<0.05);与B组相比,C组VEGF、SDF-1、Akt的mRNA表达量无明显差异(P>0.05),而CXCR4mRNA表达量升高(P<0.05)。具体见表23。表23各组骨髓MSCs的VEGF、SDF-1、CXCR4和Akt的mRNA相对表达量注:与正常组相比:*表示P<0.05。与模型组相比:#表示P<0.05。与环孢素组相比:△表示P<0.05。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1