固溶体组合物及其在心血管疾病中的用途的制作方法
技术领域
本发明涉及固溶体组合物及其在心血管疾病中的用途。
背景技术:
脂质构成广泛的天然存在的疏水性或两亲性分子的群组,所述群组包括脂肪酸、甘油脂、甘油磷脂、鞘脂质、糖酯和聚酮化合物、甾醇脂质和戊脂。脂质的主要生物学功能包括能量存储、作为细胞膜的结构组分和作为重要的信号分子。考虑到这些基础作用,所有的细胞适应并依赖脂质。用于将脂质输送到细胞的一个过程设计载脂蛋白。载脂蛋白是结合到脂肪以形成脂蛋白的蛋白质,所述载脂蛋白用于是通过淋巴和循环系统输送脂质(包括甘油三酯和胆固醇)的介质。所述脂蛋白的脂质组分本身不溶于水。然而,因为其两亲性,载脂蛋白和其他两亲分子(例如,磷脂)可以包围脂类,从而产生本身是水溶性的脂蛋白颗粒,并因此可通过水基循环(即,血和淋巴等)进行循环。
存在五个主要群组的脂蛋白颗粒,并且颗粒中所含的载脂蛋白的脂蛋白密度和类型决定了颗粒的寿命及其对新陈代谢的影响。乳糜微粒是最大的脂蛋白颗粒,并且这些颗粒将甘油三酯从肠载送到肝脏、骨骼肌与脂肪组织。极低密度脂蛋白(VLDL)颗粒是由肝脏分泌的大型富含甘油三酯的脂蛋白,其将甘油三酯载送到脂肪组织和肌肉。第三组脂蛋白颗粒是中间密度脂蛋白(IDL)颗粒,即介于VLDL与低密度脂蛋白(IDL)之间的中间体。当脂蛋白脂酶从毛细血管中的VLDL颗粒中清除掉甘油三酯,然后将这些较小颗粒送回到循环中时,形成IDL颗粒。IDL颗粒已经失去它其大部分甘油三脂,但是其保留了胆固醇酯。一些IDL颗粒被肝脏迅速吸收;其他留在循环系统中,在其中经历进一步的甘油三酯水解,并且被转化成LDL。LDL颗粒将胆固醇从肝脏载送到体内细胞,其中这些颗粒与LDL受体进行结合,所述颗粒随后经由网格蛋白凹点以囊泡形式被内吞。在网格蛋白包衣脱落之后,囊泡最终将LDL传递给胆固醇酯水解于其中的溶酶体。最后一组脂蛋白颗粒为高密度脂蛋白(HDL)颗粒,其从身体组织中收集胆固醇并且将其带回肝脏。
高水平的脂类(例如,胆固醇)和/或高水平的脂蛋白颗粒(例如,VLDL、IDL和/或LDL)对于心血管系统可造成有害影响。例如,作为胆固醇的主要胞外载体,LDL在细胞功能和代谢途径调节方面发挥重要的生理作用。细胞具有复杂的反馈机制,其确保胆固醇的充足供应但防止其在血液中过度积聚。然而,在例如高血脂症、氧化应激和/或遗传病症的病理状态下,LDL的特定组分发生氧化或者改性,后果是通过此类改性的LDL输送的胆固醇会偏离其生理目标并且在血液中积聚。
这种积累的一个效应是大量的胆固醇和/或LDL变得嵌在血管壁,通过这种方法引起炎症反应。响应这种炎症,血单核细胞粘附到内皮上,迁移到内皮下空间,并向巨噬细胞分化。巨噬细胞依次通过吞噬经由清除剂受体(这不同于LDL受体)吞没胆固醇沉积以及改性的LDL。然而,由巨噬细胞介导的自适应机制并不足以处理不受控的胆固醇和/或病理条件下可见的LDL沉积。结果是,类脂的巨噬细胞转变成具有M1表型的“泡沫细胞”或“泡沫状细胞”。在血管壁中的胆固醇/LDL沉积以及随之而来的泡沫细胞-介导促炎性反应导致动脉粥样硬化的发展。若不进行治疗,这种脂质积聚和促炎性反应导致病变的发展,这最终导致心血管疾病。
高胆固醇/血液中的LDL积聚的另外一个效应是形成LDL聚集物或LDL附聚物。由于具有高分子量,LDL附聚物以类似于通过类似病毒或者细菌的病原体引起的方式启动炎症性反应。所述炎症性反应引发聚集物被巨噬细胞摄取和炎症诱导分子的释放,聚集物被巨噬细胞摄取将这些细胞变换成具有M1表型的泡沫细胞。再一次,若不作处理,脂质积累和促炎性反应可以导致心血管疾病。
通过控制血液中脂质和/或脂蛋白的水平来治疗心血管疾病的尝试取得有限的成功。例如,虽然他汀类药物的施用缓解了一些个体的心血管危险性,但这些治疗性化合物并不减少甘油三酯含量。因而,在展现有害高水平甘油三酯的具有心血管风险的人群中,可以施用称为贝特类药物的另一个种类的治疗性化合物。然而,虽然降低甘油三脂和LDL水平,贝特类药物不影响HDL的水平,HDL为已知可免于心血管疾病的脂蛋白颗粒。最后,涉及他汀类药物和贝特类药物的组合治疗,虽然有效,但大幅增加肌病和横纹肌溶解的风险,且因此仅可以在非常密切的医疗监护下进行。鉴于这些问题,因此,显然需要用于心血管疾病(包括那些与高脂质和/或脂蛋白水平相关联的心血管疾病)的用途和治疗的改进化合物和组合物。
技术实现要素:
本说明书公开固溶体药物组合物。本文所公开的药物组合物可按照实质上产生脂质辅助剂传递系统的方式制备,所述传递系统能够使治疗性化合物具有活性,从而调节脂质和/或脂蛋白的传递方式,以更有效地治疗心血管疾病。
本说明书的方面部分地公开了包括治疗性化合物和一种或多种室温固体脂质的固溶体药物组合物。本文所公开的固溶体药物组合物可进一步包括一种或多种室温液体脂质、一种或多种稳定剂、一种或多种中和剂或其任意的组合。治疗性化合物可以具有使脂质水平正常化的活性。
本说明书的其他方面部分地公开了一种制备本文所公开的固溶体药物组合物的方法。本文所公开的方法包括以下步骤:a)使本文所公开的治疗性化合物与一种或多种室温液体脂质在允许所述治疗性化合物溶解于脂质的条件下接触;以及b)使化合物/脂质溶液与一种或多种室温固体脂质在允许固溶体组合物形成的条件下接触。在此方法的方面中,应用加热将治疗性化合物溶解入一种或多种室温液体脂质来形成溶液。在此方法的其他方面中,步骤(a)包括:在允许所述治疗性化合物溶解于脂质的条件下,使本文所公开的治疗性化合物与一种或多种室温液体脂质和/或一种或多种稳定剂和/或一种或多种中和剂接触。
本说明书的其他方面公开了一种治疗患有心血管疾病的个体的方法,所述方法包括向需要的个体施用本文所公开的固溶体药物组合物的步骤,其中施用导致与心血管疾病相关联的症状减轻,从而治疗个体。
本说明书的其他方面公开了一种本文中所公开的固溶体药物组合物在用于治疗心血管疾病的药品的制造中的用途。
本说明书的其他方面公开了一种本文中所公开的用于治疗心血管疾病的固溶体药物组合物。
本说明书的其他方面公开了一种本文中所公开的固溶体药物组合物用于治疗心血管疾病的用途。
附图说明
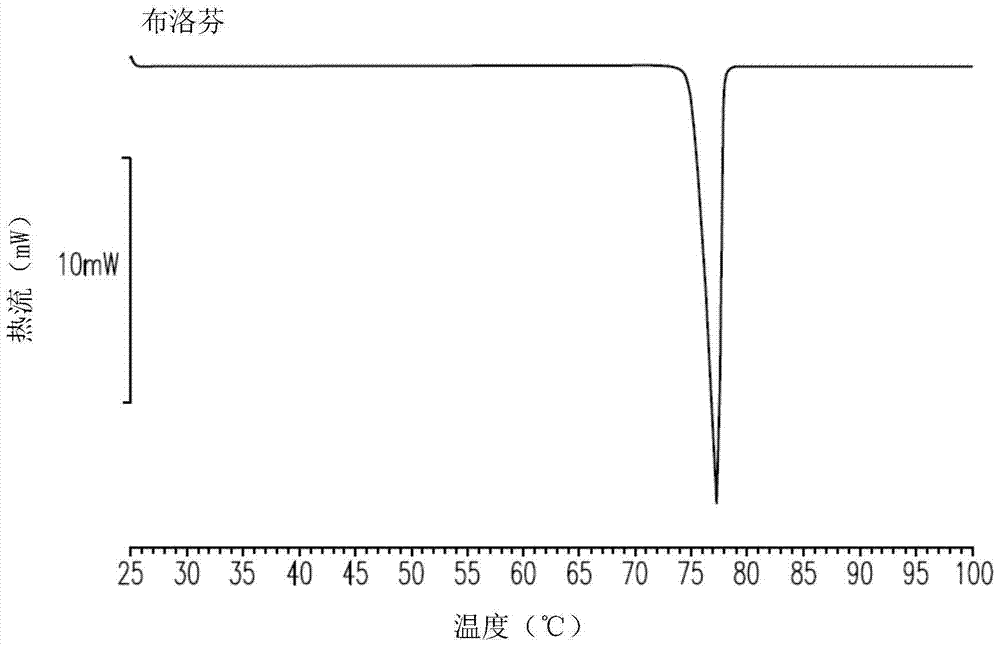
图1示出了包括布洛芬的本文中所公开的固溶体组合物的差示扫描量热计(DSC)曲线图。
图1A是布洛芬的DSC曲线图,只显示75℃至78℃的熔点范围;图1B是的DSC曲线图,只显示41℃至45℃的熔点范围;图1C是包括和PEG400的介质的DSC曲线图,显示32℃至38℃和41℃至45℃的熔点范围;图1D是布洛芬组合物LA35-1的DSC曲线图,显示32℃至44℃的熔点范围;图1E是布洛芬组合物LA35-2的DSC曲线图,显示32℃至43℃的熔点范围;图1F是布洛芬组合物LA35-1的DSC曲线图,显示32℃至42℃的熔点范围;图1G是布洛芬组合物LA35-1的DSC曲线图,显示32℃至38℃的熔点范围;图1H是布洛芬组合物LA35-1的DSC曲线图,显示32℃至42℃的熔点范围;
图2示出了蒿甲醚组合物LA 2-15-1的DSC曲线图,显示35℃至40℃的熔点范围。
图3示出了阿司匹林组合物LA 3-86-3的DSC曲线图,显示35℃至40℃的熔点范围。
图4示出了丹曲洛林组合物LA 3-104-2的DSC曲线图,显示34℃至39℃的熔点范围。
图5示出了双氯芬酸组合物LA 3-103的DSC曲线图,显示35℃至40℃的熔点范围。
图6示出了非诺贝特组合物LA 2-19的DSC曲线图,显示34℃至39℃的熔点范围。
图7示出了利多卡因组合物LA 3-101-2的DSC曲线图,显示34℃至40℃的熔点范围。
图8示出了萘丁美酮组合物LA 3-105-1的DSC曲线图,显示35℃至40℃的熔点范围。
图9示出了萘普生组合物LA 1-23-5的DSC曲线图,显示30℃至39℃的熔点范围。
图10示出了沙丁胺醇组合物LA 1的DSC曲线图,显示32℃至40℃的熔点范围。
图11示出了沙美特罗组合物LA 1-23-7的DSC曲线图,显示34℃至43℃的熔点范围。
图12示出了辛伐他汀组合物LA 3-83-3的DSC曲线图,显示32℃至43℃的熔点范围。
图13示出了替米沙坦组合物LA 1的DSC曲线图,显示34℃至43℃的熔点范围。
具体实施方式
本说明书公开了用于配制多种治疗性化合物的固溶体组合物。固溶体组合物是结晶固体,所述结晶固体包括溶剂原料基体(其在常温下可以是固体)和溶质,其中分子在固溶体中是以随机方式排列的并且未呈有序排列。本文所公开的固溶体药物组合物充当传递系统,所述传递系统使得本文所公开的治疗性化合物能够以更有效地使脂质水平正常化的方式更有效地传递或定向到细胞、组织、器官或身体部位。所述调节导致改进了心血管疾病的治疗。
例如,本文所公开的药物组合物可以促进本文所公开的治疗性化合物传递到巨噬细胞。巨噬细胞存在于两个基本路径的交叉路口处,是免疫系统也是脂类代谢中的主细胞。关于免疫系统,大多数病原体具有含脂质的表面组分,巨噬细胞可识别所述组分并接着吞噬病原体。一种可能获得这种选择性生物分布的机制在于本文所公开的药物组合物可以被设计成为利用乳糜微粒的活性。乳糜微粒是相对较大体脂蛋白颗粒,具有75nm到1,200nm的直径。包括甘油三酯(85-92%)、磷脂质(6-12%)、胆固醇(1-3%)和载脂蛋白(1-2%),乳糜微粒将膳食脂质从肠转运至身体的其他部位。乳糜微粒是脂蛋白的五种主要组分之一,其他的是VLDL、IDL、低密度脂蛋白(LDL)、高密度脂蛋白(LDL),其使得脂肪和胆固醇能够在血流的水基溶液中移动。
在消化过程中,脂肪酸和胆固醇在肠胃道中通过含有脂酶的胰液和胆盐乳化的作用下经过处理产生微胶粒。这些微胶粒使得作为游离脂肪酸的脂质通过称为肠上皮细胞的小肠表皮细胞吸收。一旦进入肠上皮细胞,甘油三酯和胆固醇被组合成初生的乳糜微粒。初生的乳糜微粒主要是由甘油三酯(85%)组成并含有一些胆固醇和胆固醇酯。主要的载脂蛋白组分是载脂蛋白B-48(APOB48)。这些初生的乳糜微粒通过胞吐作用从肠道细胞释放到乳糜管、起源于小肠绒毛中的淋巴管,然后在胸导管与左锁骨下静脉连通处分泌到血流中。
当在淋巴和血液循环中,乳糜微粒与HDL交换组分。所述HDL向初生的乳糜微粒提供载脂蛋白C-II(APOC2)和载脂蛋白E(APOE),并因此将其转变至成熟的乳糜微粒(通常简称为“乳糜微粒”)。APOC2是脂蛋白脂酶(LPL)活性的辅因子。一旦甘油三脂存储被分布,乳糜微粒将APOC2返回到HDL(但是保留APOE),因而成为乳糜微粒残余,现在仅仅30-50nm。APOB48和APOE对于识别在肝脏中用于胞吞作用和分解为脂蛋白(VLDL、LDL和HDL)的乳糜微粒残余是重要的。这些脂蛋白经感受态细胞(包含:例如,肝细胞、脂肪细胞和巨噬细胞)处理和存储。因此,在不希望受任何理论束缚的情况下,经过口服给药,本文所公开的药物组合物可以处理成胶束,同时在胃肠道中通过肠上皮细胞吸收,并且组合成初生乳糜微粒,保持与由肝脏吸收的乳糜微粒残留相关联,并最终装入存在于炎症组织的巨噬细胞中。
作为另一实例,本文所公开的药物组合物可以促进本文所公开的治疗性化合物传递到树突状细胞。实现本文所公开的药物组合物的选择性生物分布的一种可能机制可以是利用树突状细胞的内吞/吞噬活性。树突状细胞是形成部分哺乳动物免疫系统的免疫细胞。树突状细胞的主要功能是处理抗原材料并将其呈于免疫系统其他细胞的表面上。因而,树突状细胞的作用是作为在先天免疫和适应性免疫之间充当信使的抗原呈递细胞。树突状细胞存在于与外部环境接触的组织中,例如,皮肤(其中有称为朗格汉斯细胞的特化树突状细胞型)以及鼻、肺、胃和肠的内层。这些细胞以未成熟的状态在血液中被发现。一旦被激活,所述细胞迁徙到淋巴结,在此处其与T细胞和B细胞相互作用来启动和形成适应性免疫反应。已知树突状细胞内吞和吞噬脂质颗粒作为其环境监测和抗原呈递过程的一部分。在不希望受任何理论束缚的情况下,通过局部或吸入给药,本文所公开的药物组合物可以渗透到皮肤或鼻、肺、胃和肠的内层,通过树突状细胞内吞/吞噬,并最后装入发炎组织内存在的T细胞和/或B细胞。
除本文所公开的治疗性化合物的定向传递之外,本文所公开的固溶体药物组合物利用所使用的各种脂质的不同的熔点温度。通过控制加入的脂质的类型和数量,本文所公开的药物组合物可被制成在室温下基本为固体,但当达到体温时(例如在摄取之后)熔融。所得熔融组合物易于形成被肠吸收的胶束,组合成乳糜微粒,并最终由巨噬细胞吸收或由如上所述的树突细胞吸收。
本说明书的方面部分地公开一种固溶体组合物。本文所公开的固溶体组合物通常作为药学上可接受的组合物施用。如本文中所使用,术语“药学上可接受的”是指当施用给个体时不产生副作用、过敏反应或其他不利或不良反应的任何分子实体或组合物。如本文所使用,术语“药学上可接受的组合物”是与“药物组合物”同义,且表示活性成分(例如,本文所公开的任何治疗性化合物)的治疗有效浓度。本文所公开的药物组合物可用于医学和兽医学应用。药物组合物可以单独地施用给个体,或与其他补充性活性成分、药剂、药品或激素结合施用给个体。
为了影响本文所公开的治疗性化合物的药效,所述固溶体组合物必须具有三个特征。第一,用于所述固溶体组合物的至少一种脂质必须由至少一个脂肪酸构成,所述脂肪酸的碳链长度高于12且低于24,因此适于通过肠上皮细胞路径吸收。低于所述C12-C24链长的脂肪酸不形成脂质-药物基质,且因此所述药物通过正常吸收过程由人体吸收。虽然形成了脂质-药物基质,但高于所述C12-C24链长的脂肪酸,不能被吸收,并且药物从固溶体组合物浸出,并通过胃肠道从身体消除。
第二,治疗性化合物本身应当具有亲油性,以使其与C12-C24脂质形成固溶体基质。如下所论述,此亲油性可以是治疗性化合物(脂溶性药物制剂)所固有的,或可以使用在基质(游离酸/游离碱药物制剂、盐药物制剂和组合药物制剂)中有利于范围广泛的脂溶性药物的某些添加剂。
第三,治疗性化合物本身应当影响某种细胞类型的生物学,所述某种细胞类型通过固溶体组合物的脂质-辅助剂性质接触,并最终在体内循环。这样的构建体包含乳糜微粒、LDL微粒和HDL微粒。所接触的细胞类型可包含巨噬细胞、树突细胞及脂肪细胞和癌细胞。具有较高表面脂质含量的组织也可以优选地做为目标。这些组织包含神经组织和脑。
本说明书公开了四种一般类型的固溶体组合物,即脂溶性药物制剂、游离酸/游离碱药物制剂、盐药物制剂和组合药物制剂。使用脂溶性药物制剂配制的固溶体组合物只需要脂质组分以将本文所公开的治疗性化合物配制成固溶体组合物。在不希望受理论的限制的情况下,通常可以在加热下将脂溶性药物溶解于脂质中。在冷却后,据信,脂质组分和药物形成按其中脂质包住药物的方式组织成的脂质-药物基质。由于只存在疏水性相互作用,因此这些脂质-药物基质不存在产生固溶体组合物的有组织的对准(即,不会结晶成典型的固体形式)。
通常,具有约3.0或更高的logP的治疗性化合物适用于脂溶性药物制剂。非限制性的实例包括青蒿素,如蒿乙醚、蒿甲醚、青蒿素、青蒿酯和二氢青蒿素;贝特类药物,如苯扎贝特、环丙贝特、氯贝特、非诺贝特和吉非贝齐;以及他汀类药,如阿伐他汀、氟伐他汀、洛伐他丁、匹伐他汀、普伐他汀、罗苏伐他汀和辛伐他汀。
脂溶性药物制剂不使用或不需要表面活性剂。此外,脂溶性药物制剂不使用或不需要非基于脂质的溶剂。
使用游离酸/游离碱药物制剂配制的固溶体组合物除了脂质组分外还需要稳定剂以将本文所公开的治疗性化合物配制成固溶体组合物。具有游离酸或游离碱的治疗性化合物在加热下可溶解于脂质中,但在冷却到室温后将结晶以形成典型的固体组合物。发生这种现象的原因是由于这些混合物的热力学性质有利于较低能量的固相。为了产生固溶体组合物,必须添加稳定剂以稳定药物并防止其在冷却后转变成典型的固相。在不希望受理论限制的情况下,据信,稳定剂在脂质-药物基质形成后将其涂覆。这种涂覆阻碍基质之间的相互作用,从而防止形成固相组合物的结晶基质所必需的对准。如此,不会发生向固相的转变,并且形成固溶体组合物。因此,稳定剂是为到典型固相的热力学转变提供屏障或者将这种转变延长到其不会发生的程度的化合物。稳定剂的实例包括液体聚乙二醇、异山梨醇二甲醚、二乙二醇单乙醚(2-(2-乙氧乙氧基)乙醇)、一水合醇。
通常,具有约2.2至约3.0的logP的治疗性化合物可用于游离酸/游离碱药物制剂。非限制性实例包含非甾体类抗炎药(NSAID)和氨基苯甲酸的酯。NSAID包含水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸(昔康)衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂。氨基苯甲酸的酯包含阿米洛卡因、苯唑卡因、布大卡因、氨苯丁酯、氯普鲁卡因、二甲卡因、利多卡因、美普卡因、美布他明、美布卡因、俄妥卡因、丙胺卡因、丙氧卡因、普鲁卡因(奴佛卡因)、丙美卡因、利索卡因和丁卡因。
使用盐药物制剂配制的固溶组合物除了脂质组分外还需要中和剂以将本文所公开的治疗性化合物配制成固溶体组合物。治疗性化合物盐在加热下可溶于脂质,但在冷却到室温后将结晶形成典型的固体组合物。发生这种现象的原因是由于这些混合物的热力学性质有利于较低能量的固相。为了产生固溶体组合物,必须添加中和剂以中和治疗性化合物盐,以及防止其在冷却后转变成典型的固相。在不希望受理论限制的情况下,据信,中和剂消除了盐药物中的电荷的存在。这种中和阻碍基体之间的离子相互作用,从而防止形成固相组合物的结晶基质所必需的对准。如此,不会发生到固相的转变,并且形成固溶体组合物。因此,中和剂是为到典型固相的热力学转变提供屏障或将这种转变延长到其不会发生的程度的化合物。
中和剂包含用于碱式盐药物的脂肪酸和用于酸式盐药物的三乙醇胺。中和程度取决于添加到制剂的中和剂的量。对于完全的中和,添加一摩尔当量的中和剂到制剂中。对于部分中和,添加少于一摩尔当量。部分中和在生产缓释制剂方面是有利的。在给药后,一部分药物立即对身体适用(即时生物利用率),而另一部分的生物利用即时被延迟,直到通过中和剂中和。还可以过量添加中和剂,即,多余一摩尔当量。除了中和盐药物之外,过量中和剂也使得能够调整固溶体组合物的熔点。
通常,具有约2.2或更低的logP的治疗性化合物可用于盐药物制剂。非限制性实例包含如阿珠莫林和丹曲洛林的兰尼碱受体拮抗剂;血管紧张素Ⅱ受体拮抗剂,如阿齐沙坦、坎地沙坦、依普沙坦、厄贝沙坦、氯沙坦、奥美沙坦、替米沙坦以及缬沙坦。
固溶体组合物也可以包括脂溶性药物、游离酸/游离碱药物以及盐药物的不同组合。取决于所使用的药物,除脂质组分和药物之外,这些制剂还可以包含稳定剂、中和剂或两者。
本说明书的方面部分地公开一种治疗性化合物。治疗性化合物是在疾病的诊断、治愈、缓解、治疗或预防中提供药理学活性或其他直接作用的化合物,或者来影响人体或动物身体的结构或任何功能的化合物。本文中所公开的治疗性化合物可以药学上可接受的盐、溶剂化物或盐的溶剂化物(例如盐酸化物)的形式使用。此外,本文中所公开的治疗性化合物可以作为外消旋体或作为单独的对映体(包含R-对映体或S-对映体)而被提供。因此,本文中所公开的治疗性化合物可以仅包括R-对映体的治疗性化合物或仅包括S-对映体的治疗性化合物,或者包含R-对映体以及S-对映体两者的组合的治疗性化合物。本文所公开的治疗性化合物具有正常化脂质水平的活性。如本文所使用,术语“正常化脂质水平”是指减少与正常或无害水平相比有害地高的脂质或脂蛋白水平,或增加脂质或脂蛋白水平到对个体有益的水平,或二者兼有。例如,具有正常化脂质水平的活性的治疗性化合物可以减少与正常或无害水平相比有害地高的胆固醇和/或LDL,增加HDL到对个体有益的水平,或二者兼有。
脂质和脂蛋白异常在普通人群中是常见的,并由于其对动脉粥样硬化的影响,被认为是心血管疾病的可修改的危险因素。因为研究已展示更高水平的LDL颗粒促使健康问题和心血管疾病,所述LDL颗粒经常非正式地被称为“有害胆固醇”颗粒。这与HDL颗粒相反,HDL颗粒通常被称作“有益胆固醇”或“健康胆固醇”颗粒,因为较高的HDL水平与心血管的健康有关。高水平的HDL被认为通过充当LDL中过量甘油三酯的接收点来减少LDL水平。
在实施例中,本文所公开的治疗性化合物具有抗高脂血症活性。在此实施例的方面中,本文所公开的治疗性化合物具有能够减少VLDL、IDL、LDL,或其组合的水平的抗高脂血症活性。在此实施例的其他方面,本文所公开的治疗性化合物具有能够减少VLDL、IDL、LDL,或其组合的水平的抗高脂血症活性,减少例如至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、或至少95%。在此实施例的其他方面中,本文所公开的治疗性化合物具有能够以一定范围减少VLDL、IDL、LDL,或其组合的水平的抗高脂血症活性,减少例如,约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%、或约50%至约70%。
在另一个实施例中,本文所公开的治疗性化合物增加HDL的水平。在此实施例的方面中,本文所公开的治疗性化合物增加HDL的水平,增加例如,至少2%、至少3%、至少10%、至少12%、至少15%、至少17%、至少20%、至少22%、至少25%、至少27%、至少30%、至少32%、至少35%、至少37%、至少40%、至少42%、至少45%或至少47%。在此实施例的其他方面中,本文所公开的治疗性化合物以一个范围增加HDL的水平,增加例如,约2%至约100%、约10%至约50%、约15%至约50%、约20%至约50%、约25%至约50%、约30%至约50%、约35%至约50%、约40%至约50%、约2%至约45%、约10%至约45%、约15%至约45%、约20%至约45%、约25%至约45%、约30%至约45%、约35%至约45%、约2%至约40%、约10%至约40%、约15%至约40%、约20%至约40%、约25%至约40%、或约30%至约40%、约2%至约35%、约10%至约35%、约15%至约35%、约20%至约35%、或约25%至约35%。
当胆固醇和/或脂蛋白(如LDL)变成内嵌在血管壁时,可引起免疫反应,随后导致慢性炎症性反应。这样的慢性炎症最终可以削弱并损害血管,引起所述血管破裂。因而,调节脂质或脂蛋白的水平的一个后果是减少或去除慢性炎症。前列腺素介导局部炎症反应,并通过对前列腺素受体的作用参与所有炎症功能,并且介导包括趋化作用(巨噬细胞、中性粒细胞和嗜酸性粒细胞)、血管扩张和痛觉过敏的炎症信号转导。然而,PG介导的炎症反应是自限性的(自消退的)。主要的消退因子是一种叫做15dPGJ2的前列腺素,其为过氧化物酶增殖物激活受体γ(peroxisome proliferator-activator receptor gamma,PPAR-γ)信号转导的内源性激动剂。PPARγ信号转导通路1)诱导巨噬细胞M1的凋亡,从而降低Th1促炎性细胞因子的水平,并且2)促进单核细胞分化为巨噬细胞M2。巨噬细胞M2产生并释放Th2抗炎性细胞因子。
在实施例中,本文中所公开的治疗性化合物具有能够降低炎症诱导性前列腺素水平的抗炎活性。在此实施例的其他方面中,本文中所公开的治疗性化合物具有能够降低从感觉神经元释放的炎症诱导性前列腺素水平的抗炎活性,例如降低了至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。在此实施例的另外其他方面中,本文中所公开的治疗性化合物具有能够以一定范围降低从感觉神经元释放的炎症诱导性前列腺素的水平的抗炎活性,降低例如约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%、或约50%至约70%。
在另一个实施例中,本文中所公开的治疗性化合物具有与15dPGJ2基本上类似的抗炎活性。在此实施例的方面中,本文中所公开的治疗性化合物的抗炎活性是针对15dPGJ2所观察到的活性的例如至少5%、至少15%、至少25%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。在此实施例的其他方面中,本文中所公开的治疗性化合物的抗炎活性是在针对15dPGJ2所观察到的活性的例如约5%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约25%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约80%至约90%、约25%至约80%、约50%至约80%、约60%至约80%、约70%至约80%、约25%至约70%、约50%至约70%、约25%至约60%、约50%至约60%或约25%至约50%的范围内。
过氧化物酶体增殖物激活受体(PPAR)是一组核受体蛋白,其起调节基因表达的转录因子的作用。已知所有的PPAR与类视色素X受体(RXR)异型二聚化,并结合到靶基因的DNA上的特定区域,所述特定区域称为过氧化物酶体增殖物激素应答元件(PPRE)。PPAR在调节细胞分化、发育及代谢(碳水化合物、脂类、蛋白质)和高等生物的肿瘤发生中起到重要的作用。所述家族包含三个成员:PPAR-α、PPAR-γ和PPAR-δ(也称为PPAR-β)。PPAR-α在肝脏、肾、心脏、肌肉、脂肪组织以及其他组织中表达。PPAR-δ在许多组织中表达,但在脑、脂肪组织和皮肤中显著表达。PPAR-γ包含三种替换性剪接的形式,每种具有不同的表达模式。PPAR-γ1几乎在所有组织中表达,包括心脏、肌肉、结肠、肾、胰腺和脾脏。PPAR-γ2主要在脂肪组织中表达。PPAR-γ3在巨噬细胞、大肠和白色脂肪组织中表达。PPAR的内源性配体包括游离脂肪酸和类花生酸。PPAR-γ通过PGJ2(一种前列腺素)活化,而PPAR-α通过白三烯B4活化。
由肝脏进行的HDL颗粒的重新产生被认为是由PPAR信号通路的激活触发的。这样的通过正常的脂质吸收机制靶向涉及脂质处理(巨噬细胞,脂肪细胞和肝细胞)的细胞类型的PPAR激动剂,将选择性地增加有益HDL的水平并且因而正常化血脂谱以及治疗心血管疾病。
在实施例中,本文中所公开的治疗性化合物具有能够刺激所有PPAR信号转导通路的抗炎活性。这种治疗性化合物包括PPAR泛激动剂。在其他实施例中,本文中所公开的治疗性化合物具有能够刺激一种或两种PPAR信号转导通路的抗炎活性。这种治疗性化合物包括选择性PPAR激动剂。
在另一个实施例中,本文中所公开的治疗性化合物具有能够刺激PPAR-α信号转导通路的抗炎活性。在此实施例的方面中,本文中所公开的治疗性化合物刺激PPAR-α信号通路,例如至少5%、至少15%、至少25%、至少50%、至少60%、至少70%、至少80%、或至少90%。在此实施例的其他方面中,本文中所公开的治疗性化合物刺激PPAR-α信号通路在例如约5%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约25%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约80%至约90%、约25%至约80%、约50%至约80%、约60%至约80%、约70%至约80%、约25%至约70%、约50%至约70%、约25%至约60%、约50%至约60%或约25%至约50%的范围内。
在另一个实施例中,本文中所公开的治疗性化合物具有能够刺激PPAR-δ信号转导通路的抗炎活性。在此实施例的方面中,本文中所公开的治疗性化合物刺激PPAR-δ信号转导通路,例如至少5%、至少15%、至少25%、至少50%、至少60%、至少70%、至少80%或至少90%。在此实施例的其他方面中,本文中所公开的治疗性化合物刺激PPAR-δ信号转导通路,在例如约5%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约25%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约80%至约90%、约25%至约80%、约50%至约80%、约60%至约80%、约70%至约80%、约25%至约70%、约50%至约70%、约25%至约60%、约50%至约60%或约25%至约50%的范围内。
在另一个实施例中,本文中所公开的治疗性化合物具有能够刺激PPARγ信号转导通路的抗炎活性。本文中所公开的治疗性化合物可能够结合到PPAR-γ的所有异构体的,或者可能够选择性地结合到PPAR-γ1、PPAR-γ2、PPAR-γ3中任一者或其中两种的任意组合。在此实施例的方面中,本文中所公开的治疗性化合物刺激PPARγ信号转导通路,例如至少5%、至少15%、至少25%、至少50%、至少60%、至少70%、至少80%或至少90%。在此实施例的其他方面中,本文中所公开的治疗性化合物刺激PPARγ信号转导通路,在例如约5%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约25%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约80%至约90%、约25%至约80%、约50%至约80%、约60%至约80%、约70%至约80%、约25%至约70%、约50%至约70%、约25%至约60%、约50%至约60%或约25%至约50%的范围内。
巨噬细胞被活化并且极化为不同的表型,所述表型表达独特的细胞表面分子并分泌细胞因子和趋化因子的离散集合。经典的M1表型支持由细胞因子(例如白细胞介素-6(IL-6)、IL-12和IL-23)所驱动的促炎性Th1应答,而另一种M2表型通常支持由IL-10所驱动的抗炎过程。基于刺激的类型和表面分子和细胞因子的随后表达,M2细胞可以被进一步分成亚群:M2a、M2b和M2c。
在另一个实施例中,本文中所公开的治疗性化合物具有能够促进M1到M2的消退性表型变化的抗炎活性。在此实施例的方面中,本文中所公开的治疗性化合物具有能够诱导巨噬细胞M1凋亡的抗炎活性。在此实施例的另一个方面中,本文中所公开的治疗性化合物具有能够促进巨噬细胞M2分化的抗炎活性。在此实施例的另一个方面中,本文中所公开的治疗性化合物具有能够诱导巨噬细胞M1凋亡并且促进巨噬细胞M2分化的抗炎活性。
在另一个实施例中,本文中所公开的治疗性化合物具有能够调节Th1和Th2细胞因子的抗炎活性。在此实施例的一方面中,本文中所公开的治疗性化合物具有能够降低从Th1细胞所释放的γ-干扰素(IFNγ)、肿瘤坏死因子-α(TNF-α)、IL-12或其组合的水平的抗炎活性。在此实施例的其他方面中,本文中所公开的治疗性化合物具有能够降低从Th1细胞释放的IFNγ、TNF-α、IL-12或其组合的水平的抗炎活性,例如降低了至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%。在此实施例的另外其他方面中,本文中所公开的治疗性化合物具有能够以一定范围降低从Th1细胞释放的IFNγ、TNF-α、IL-12或其组合的水平的抗炎活性,降低例如约5%至约100%、约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%、或约50%至约70%。
在此实施例的另一个方面中,本文中所公开的治疗性化合物具有能够提高从Th2细胞所释放的IL-10的水平的抗炎活性。在此实施例的其他方面中,本文中所公开的治疗性化合物具有能够提高从Th2细胞所释放的IL-10的水平的抗炎活性,例如提高至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。在此实施例的另外其他方面中,本文中所公开的治疗性化合物具有能够以一定范围提高从Th2细胞所释放的IL-10的水平的抗炎活性,提高例如约5%至约100%、约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%或约50%至约70%。
在此实施例的另一个方面中,本文所公开的治疗性化合物具有能够降低从Th1细胞释放的IFNγ、TNF-α、IL-12或其组合的水平并提高从Th2细胞释放的IL-10的水平的抗炎活性。在此实施例的其他方面中,本文所公开的治疗性化合物具有抗炎活性,其能够降低从Th1细胞释放的IFNγ、TNF-α、IL-12或其组合的水平,降低例如至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%,并且能够提高从Th2细胞释放的IL-10的水平,提高例如至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。在此实施例的又一些其他方面中,本文所公开的治疗性化合物具有抗炎活性,其能够以一定范围降低从Th1细胞释放的IFNγ、TNF-α、IL-12或其组合的水平,降低例如约5%至约100%、约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%、或约50%至约70%,并且能够以一定范围提高从Th2细胞释放的IL-10的水平,提高例如约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%、或约50%至约70%。
在另一个实施例中,本文所公开的治疗性化合物具有能够降低炎症诱导分子水平的抗炎活性。在本实施例的方面中,本文所公开的治疗性化合物具有能够降低P物质(SP)、降钙素基因相关肽(CGRP)、谷氨酸盐或其组合水平的抗炎活性。在本实施例的其他方面中,本文所公开的治疗性化合物具有能够降低从感觉神经元释放出的SP、CGRP、谷氨酸盐或其组合水平的抗炎活性,降低例如至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。在本实施例的又一其他方面中,本文所公开的治疗性化合物具有能够在一定范围内降低从感觉神经元释放出的SP、CGRP、谷氨酸盐、或其组合水平的抗炎活性,例如,降低范围为约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约10%至约90%、约20%至约90%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约50%至约80%、或约60%至约80%、约10%至约70%、约20%至约70%、约30%至约70%、约40%至约70%、或约50%至约70%。
本文中所公开的治疗性化合物可具有指示所述化合物可溶于有机溶剂中的log P值。如本文中所使用,术语“log P值”指的是化合物的分配系数(P)的对数(以10为底),并且是亲脂性的量度。通常,P被定义为平衡时非离子化化合物在两种不混溶溶剂的混合物的两相中的浓度的比率。因此,log P=Log10(P),其中P=[不混溶溶剂1中的溶质]/[不混溶溶剂2中的溶质]。至于有机相和水相,化合物的log P值对于任何给定对的水性溶剂和有机溶剂是恒定的,并且其值可以通过本领域技术人员已知的几种相划分方法(包括例如摇瓶分析法、HPLC分析法和两种不混溶电解质溶液之间界面分析法(ITIES))中的一种凭经验确定。
在此实施例的方面中,本文中所公开的治疗性化合物可以具有指示所述化合物基本可溶于有机溶剂中的log P值。在此实施例的方面中,本文中所公开的治疗性化合物可以具有指示所述化合物例如至少50%溶于有机溶剂中、至少60%溶于有机溶剂中、至少70%溶于有机溶剂中、至少80%溶于有机溶剂中、或至少90%溶于有机溶剂中的log P值。在此实施例的方面中,本文中所公开的治疗性化合物可以具有指示所述化合物为例如约50%至约100%溶于有机溶剂中、约60%至约100%溶于有机溶剂中、约70%至约100%溶于有机溶剂中、约80%至约100%溶于有机溶剂中、或约90%至约100%溶于有机溶剂中的log P值。
在此实施例的方面中,本文中所公开的治疗性化合物可以具有例如大于1.1、大于1.2、大于1.4、大于1.6、大于1.8、大于2.0、大于2.2、大于2.4、大于2.6、大于2.8、大于3.0、大于3.2、大于3.4、或大于3.6的log P值。在此实施例的其他方面中,本文中所公开的治疗性化合物可以具有在例如1.8和4.0之间、2.0和4.0之间、2.1和4.0之间、2.2和4.0之间、或2.3和4.0之间、2.4和4.0之间、2.5和4.0之间、2.6和4.0之间、或2.8和4.0之间的范围内的log P值。在此实施例的其他方面中,本文中所公开的治疗性化合物可以具有在例如3.0和4.0之间、或3.1和4.0之间、3.2和4.0之间、3.3和4.0之间、或3.4和4.0之间、3.5和4.0之间、或3.6和4.0之间的范围内的log P值。在此实施例的另外其他方面中,本文中所公开的治疗性化合物可以具有在例如2.0和2.5之间、2.0和2.7之间、2.0和3.0之间、或2.2和2.5之间的范围内的log P值。
本文中所公开的治疗性化合物可以具有疏水性的极性表面面积。如本文中所使用,术语“极性表面面积”指的是化合物的结构中所有极性原子上的表面总和,并且是疏水性的量度。通常,这些极性原子包括例如氧、氮以及其连结的氢原子。在此实施例的方面中,本文中所公开的治疗性化合物可以具有例如小于8.0nm2、小于7.0nm2、小于6.0nm2、小于5.0nm2、小于4.0nm2、或小于3.0nm2的极性表面面积。在此实施例的其他方面中,本文中所公开的治疗性化合物可以具有在例如3.0nm2和6.5nm2之间、3.0nm2和6.0nm2之间、3.0nm2和5.5nm2之间、3.0nm2和5.0nm2之间、3.0nm2和4.5nm2之间、3.5nm2和6.5nm2之间、3.5nm2和6.0nm2之间、3.5nm2和5.5nm2之间、3.5nm2和5.0nm2之间、3.5nm2和4.5nm2之间、4.0nm2和6.5nm2之间、4.0nm2和6.0nm2之间、4.0nm2和5.5nm2、或4.0nm2和5.0nm2之间、4.0nm2和4.5nm2之间、或4.5nm2和5.5nm2之间的范围内的极性表面面积。在此实施例的另外其他方面中,本文中所公开的治疗性化合物可以具有在例如2.0nm2和6.5nm2之间、2.0nm2和6.0nm2之间、2.0nm2和5.5nm2之间、2.0nm2和5.0nm2之间、2.0nm2和4.5nm2之间、2.5nm2和6.5nm2之间、2.5nm2和6.0nm2之间、2.5nm2和5.5nm2之间、2.5nm2和5.0nm2或2.5nm2和4.5nm2之间的范围内的极性表面面积。
本文中所公开的治疗性化合物可以是非甾体类抗炎药(NSAID)。NSAID是具有镇痛、抗炎和解热属性的一大组治疗性化合物。NSAID通过阻断环加氧酶来减轻炎症。NSAID包括但不限于醋氯芬酸、阿西美辛、阿克他利、氨克酚酸、阿明洛芬、氨芬酸、阿洛普令、氨基比林、安特非宁、阿司匹林、阿扎丙宗、贝诺酯、苯恶洛芬、苄达明、布替布芬、塞来昔布、氯西诺嗪、水杨酸胆碱、奥芬那君、右旋酮洛芬、双氯芬酸、二氟尼柳、依莫法宗、甲嘧啶唑;依托度酸、依托昔布、苯氯布宗、联苯乙酸、芬布芬、芬氯酸、氟比洛芬、格拉非宁、水杨酸羟乙酯、布洛芬、吲哚美辛、吲哚洛芬、酮洛芬、酮咯酸、乳酰基氨基苯乙醚、氯索洛芬、芦米考昔、甲灭酸、美洛昔康、安乃近、甲嗪酸、莫非保松、莫苯唑酸、萘丁美酮、萘普生、烟胺比林、尼氟酸、奥沙美辛、非那西丁、哌保松、普拉洛芬、异丙安替比林、丙喹酮、丙替嗪酸、罗非昔布、水杨酰胺、双水杨酯、舒林酸、舒洛芬、噻拉米特、氨苄噻吡酯、托芬那酸、伐地昔布和佐美酸。
根据其化学结构或作用机制,可以将NSAID进行分类。NSAID的非限制性实例包括水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂和选择性环加氧酶2(COX 2)抑制剂。NSAID可以是洛芬(profen)。合适的水杨酸衍生物NSAID的实例包括但不限于乙酰水杨酸(阿司匹林)、二氟尼柳和双水杨酯。合适的对氨基苯酚衍生物NSAID的实例包括但不限于扑热息痛和非那西汀。合适的丙酸衍生物NSAID的实例包括但不限于阿明洛芬、苯恶洛芬、右旋酮洛芬、非诺洛芬、氟比洛芬、布洛芬、引哚洛芬、酮洛芬、氯索洛芬、萘普生、奥沙普秦、普拉洛芬和舒洛芬。合适的乙酸衍生物NSAID的实例包括但不限于醋氯芬酸、阿西美辛、阿克他利、氨克酚酸、氨芬酸、奥芬那君、双氯芬酸、依托度酸、联苯乙酸、芬氯酸、吲哚美辛、酮咯酸、甲嗪酸、莫苯唑酸、萘丁美酮、萘普生、奥沙美辛、舒林酸和佐美酸。合适的烯醇酸(昔康)衍生物NSAID的实例包括但不限于屈昔康、伊索昔康、氯诺昔康、美洛昔康、吡罗昔康和替诺昔康。合适的芬那酸衍生物NSAID的实例包括但不限于氟芬那酸、甲芬那酸、甲氯芬那酸和托芬那酸。合适的选择性COX-2抑制剂的实例包括但不限于塞来昔布、依托昔布、非罗考昔、鲁米昔布、美洛昔康、扑热息痛(对乙酰氨基酚)、帕瑞昔布、罗非昔布和伐地昔布。
本文所公开的治疗性化合物可以是PPARα激动剂。合适的PPARα激动剂的实例包括但不限于匹立尼酸(WY 14643)、GW6471和贝特类药物。
本文所公开的治疗性化合物可以是PPARβ/δ激动剂。合适的PPARβ/δ激动剂的实例包括但不限于十四烷基硫代乙酸(TTA)、GSK0660、GSK3787、GW501516(GW-501,516、GW1516、GSK-516和Endurobol)、GW0742和GW610742X。
本文所公开的治疗性化合物可以是PPARγ激动剂。合适的PPARγ激动剂的实例包括但不限于红曲霉素,四氢噻唑二酮(如罗西格列酮、吡格列酮和曲格列酮)以及T0070907。其他合适的PPARγ激动剂在Masson和Caumont-Bertrand的“PPAR激动剂化合物,制备和用途,PPAR Agonist Compounds,Preparation and Uses”(US2011/0195993)中描述,其通过全文引用的方式并入于此。
本文所公开的治疗性化合物可以是格列扎(Glitazar)(双重α和γPPAR激动剂)。合适的格列扎的实例包括但不限于阿格列扎、莫格列扎、萨格列扎和替格列扎。
本文所公开的治疗性化合物可以是免疫抑制药物。合适的免疫抑制药物的实例包括但不限于咪唑硫嘌呤和霉酚酸。
本文所公开的治疗性化合物可以是尿酸促排药物。合适的尿酸促排药物的实例包括但不限于苯溴马隆。
本文所公开的治疗性化合物可以是糖苷配基。合适的糖苷配基药物的实例包括而不限于四羟反式芪、赤松素、紫檀芪和白藜芦醇。
本文所公开的治疗性化合物可以是大麻二酚。合适的尿酸促排药物的实例包括但不限于植物性大麻素、内源性大麻素以及合成的大麻素。植物性大麻素包括四氢大麻酚(例如,δ-9-四氢大麻酚(Δ9-THC、THC)以及δ-8-四氢大麻酚(Δ8-THC))、大麻二酚、大麻酚、大麻萜酚、四氢次大麻酚、次大麻二酚以及大麻环萜酚。内源性大麻素包括花生四烯酸乙醇胺(花生四烯乙醇酰胺或AEA)、2-花生四烯酸甘油(2-AG)、2-花生四烯酸甘油醚(noladinether))、N-花生四烯酸多巴胺(NADA)、花生四烯酰乙醇胺(OAE)以及溶血磷脂酰肌醇(LPI)。合成的大麻素包括卓那比醇(屈大麻酚)、纳比隆(大麻隆)、四氢大麻酚、利莫那班(SR141716)、JWH-018、JWH-073、CP-55940、二甲庚基吡喃、HU-210、HU-331、SR144528、WIN 55,212-2、JWH-133、左南曲朵(Nantrodolum)以及AM-2201。
本文所公开的治疗性化合物可以是核受体结合剂。合适的核受体结合剂的实例包括但不限于视黄酸受体(RAR)结合剂、类视黄醇X受体(RXR)结合剂、肝脏X受体(LXR)结合剂以及维生素D结合剂。
本文所公开的治疗性化合物可以是血管紧张素Ⅱ受体拮抗剂。合适的血管紧张素Ⅱ受体拮抗剂的实例包括但不限于阿齐沙坦、坎地沙坦、依普沙坦、厄贝沙坦、氯沙坦、奥美沙坦、替米沙坦以及缬沙坦。
本文所公开的治疗性化合物可以是乙酰基胆碱酯酶(ACE)抑制剂。合适的ACE抑制剂的实例包括但不限于含巯基试剂、含二羧酸盐试剂、含膦酸盐试剂、酪激肽以及乳激肽。含巯基试剂包括卡托普利(开博通)和佐芬普利。含二羧酸盐试剂包括依那普利(Vasotec/Renitec)、雷米普利(Altace/Prilace/Ramace/Ramiwin/Triatec/Tritace)、喹卜尼特(喹那普利)、培哚普利(Coversyl/Aceon)、赖诺普利(Listril/Lopril/Novatec/Prinivil//Zestril)、贝那普利(洛汀新)、咪达普利(Tanatril)、佐芬普利(Zofecard)以及群多普利(Mavik/Odrik/Gopten)。含膦酸盐试剂包括福辛普利(Fositen/Monopril)。
本文所公开的治疗性化合物可以是磷酸二酯酶抑制剂。合适的磷酸二酯酶抑制剂的实例包括但不限于,PDE 1选择性抑制剂、PDE 2选择性抑制剂、PDE 3选择性抑制剂、PDE 4选择性抑制剂、PDE 5选择性抑制剂以及PDE 10选择性抑制剂。PDE 1选择性抑制剂包括长春西汀。PDE 2选择性抑制剂包括BAY60-7550(2[(3,4-二甲氧苯基)甲基]-7[(1R)-1羟乙基]-4-苯基丁基]-5-甲基-咪唑并[5,1-f][1,2,4]三嗪-4(1H)-酮)、EHNA(赤型-9-(2-羟基-3壬基)腺嘌呤)、羟吲哚以及PDP(9-(6-苯基-2-氧代己-3-基)-2(3,4-二甲氧基苄溴)-嘌呤-6-酮)。PDE 3选择性抑制剂包括阿那格雷、西洛他唑、依诺西蒙、氨力农以及米利酮。PDE 4选择性抑制剂包括氢喹维林、异丁地特、木犀草素、松叶菊碱、吡拉米司特、罗氟司特以及咯利普兰。PDE 5选择性抑制剂包括阿伐那非、双嘧达莫、淫羊藿苷、4-甲基哌嗪、吡唑并嘧啶-7-1、西地那非、他达那非、乌地那非以及伐地那非。PDE 10选择性抑制剂包括婴粟碱。
本文所公开的治疗性化合物可以是贝特类药物。贝特类药物是具有脂质水平修改特性的一类两亲性羧酸。这些治疗性化合物用于一系列代谢失调。一种非限制性用途是作为抗高血脂剂,其可以降低例如甘油三酯和LDL的水平并增加HDL的水平。合适的贝特类药物的实例包括但不限于苯扎贝特、环丙贝特、氯贝特、吉非罗齐以及非诺贝特。
本文所公开的治疗性化合物可以是他汀类。他汀类药物(或羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂)是一类通过抑制HMG-CoA还原酶来用于降低低密度脂蛋白(LDL)水平和/或胆固醇水平的治疗性化合物,所述HMG-CoA还原酶在肝脏中的胆固醇的产生中起到中心作用。为了补偿降低的胆固醇可用性,肝脏的LDL受体的合成增加,导致增加了来自血液的LDL粒子的清除率。适当的他汀类的实例包括但不限于:阿伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、普伐他汀、罗苏伐他汀和辛伐他汀。
本文所公开的治疗性化合物可以是生育三烯酚。生育三烯酚是另一类HMG-CoA还原酶抑制剂并且可以通过诱导肝LDL受体上调和/或降低血浆LDL水平来降低LDL水平和/或胆固醇水平。适当的生育三烯酚的实例包括但不限于:γ-生育三烯酚和δ-生育三烯酚。
本文所公开的治疗性化合物可以是烟酸。烟酸是一类具有脂质水平修改特性的治疗性化合物。例如,烟酸可以通过有选择地抑制肝二酰基甘油酰基转移酶2来降低LDL,通过受体HM74和HM74A或GPR109A来减少甘油三酸酯合成和极低密度脂蛋白(VLDL)分泌。这些治疗性化合物用于一系列代谢失调。一种非限制性用途是作为抗高血脂剂,其中,所述抗高血脂剂可以抑制在脂肪组织中的脂肪分解。因为烟酸阻止了脂肪分解,这引起了在血液中的游离脂肪酸的减少,并且因此减少了肝脏分泌极低密度脂蛋白(VLDL)和胆固醇。通过降低VLDL水平,烟酸也可以增加血液中的HDL水平。适当的烟酸的实例包括但不限于:阿西莫司、烟酸、烟酰胺和维生素B3。
本文所公开的治疗性化合物可以是胆汁酸螯合剂。胆汁酸螯合剂(也称为树脂)是一类用于在胃肠道中结合胆汁的某些组分的治疗性化合物。所述胆汁酸螯合剂通过螯合胆汁酸并防止胆汁酸被肠道再吸收来破坏胆汁酸的肝肠循环。胆汁酸螯合剂对于通过螯合释放入肠的含有胆固醇的胆汁酸并且防止胆汁酸被肠再吸收来降低LDL和胆固醇特别有效。此外,胆汁酸螯合剂也可提高HDL水平。适当的胆汁酸螯合剂的实例包括但不限于:消胆胺、考来维仑和考来替泊。
本文所公开的治疗性化合物可以是胆固醇吸收抑制剂。胆固醇吸收抑制剂是一类抑制吸收来自肠的胆固醇的治疗性化合物。降低的胆固醇吸收导致在细胞的表面上LDL受体上调并且被摄入这些细胞的LDL-胆固醇增加,因此降低了在血浆中的LDL水平。适当的胆固醇吸收抑制剂的实例包括但不限于:依泽替米贝、植物甾醇、甾醇和甾烷醇。
本文所公开的治疗性化合物可以是脂肪吸收抑制剂。脂肪吸收抑制剂是一类抑制从肠道吸收脂肪的治疗性化合物。减少脂肪吸收会减少热量摄取。在一个方面,脂肪吸收抑制剂抑制胰脂酶,所述胰脂酶是分解肠内甘油三酯的酶。合适的脂肪吸收抑制剂的实例包括但不限于奥利司他。
本文所公开的治疗性化合物可以是交感神经兴奋胺。交感神经兴奋胺是一类模仿交感神经系统的递质效果的治疗性化合物,例如儿茶酚胺、肾上腺素(肾上腺素(adrenaline))、去甲肾上腺素(去甲肾上腺素(noradrenaline))和/或多巴胺。交感神经兴奋胺可以充当α-肾上腺素能激动剂、β-肾上腺素能激动剂、多巴胺能激动剂、单胺氧化酶(MAO)抑制剂以及COMT抑制剂。除此之外,这样的治疗性化合物可以用于治疗心脏骤停、低血压乃至延迟早产。合适的交感神经兴奋胺的实例包括但不限于:克仑特罗、沙丁胺醇、麻黄素、伪麻黄碱、甲基苯丙胺、苯丙胺、苯肾上腺素、异丙肾上腺素、多巴酚丁胺、哌醋甲酯、二甲磺酸赖右苯丙胺、去甲伪麻黄碱、卡西酮、甲卡西酮、可卡因、苄基哌嗪(BZP)、亚甲基二氧吡咯戊酮(MDPV)、4-甲米雷司、匹莫林、苯甲吗啉和六氢脱氧麻黄碱。α-肾上腺素能激动剂包括去氧肾上腺素、六氢脱氧麻黄碱和伪麻黄碱。β-肾上腺素能激动剂包括克仑特罗、多巴酚丁胺、麻黄碱、异丙基肾上腺素以及沙丁胺醇。多巴胺能/去甲肾上腺素能激动剂包括可卡因(DA/NE再摄取抑制剂)、二甲磺酸赖右苯丙胺(5HT/DA/NE再摄取抑制剂)、哌醋甲酯(DA/NE再摄取抑制剂)以及亚甲基二氧吡咯戊酮(DA/NE再摄取抑制剂)。神经递质释放剂包括安非他明(DA/NE释放剂)、苄基哌嗪(DA/NE释放剂)、去甲伪麻黄碱(DA/NE释放剂)、卡西酮(DA/NE释放剂)、甲基苯丙胺(DA/NE释放剂)、甲卡西酮(DA/NE释放剂)、4-甲米雷司(DA/NE释放剂)、佩默林、苯甲吗啉(DA/NE释放剂)以及苯乙胺(DA/NE释放剂)。
本文所公开的治疗性化合物可以是兰尼碱受体拮抗剂。兰尼碱受体拮抗剂的实例包括但不限于阿珠莫林和丹曲洛林。
本文所公开的治疗性化合物可以是抗癌药物。合适的抗癌药物的实例包括但不限于:烷基化剂、抗代谢物、植物碱和类萜、拓扑异构酶抑制剂和细胞毒性抗生素。烷基化剂包括卡铂、苯丁酸氮芥、顺铂、环磷酰胺、异环磷酰胺、奥沙利铂和氮芥。抗代谢物包括硫唑嘌呤和巯嘌呤。植物碱和类萜包括长春花生物碱(如长春新碱、长春花碱、长春瑞滨以及长春地辛)、鬼臼毒素(如依托泊苷和替尼泊苷)、紫杉醇(如多西紫杉醇和沃塔紫杉醇)。拓扑异构酶抑制剂包括如喜树碱的I型拓扑异构酶抑制剂,例如依喜替康、依立替康、勒托替康、拓扑替康、BNP 1350、CKD 602、DB 67(AR67)以及ST 1481)以及如表鬼臼毒素的Ⅱ型抑制物(例如安吖啶、依托泊苷、依托泊苷磷酸酯和替尼泊苷)。细胞毒性抗生素包括放线菌素(如放线菌素D、杆菌肽素、粘杆菌素(多粘菌素E)、以及多粘菌素B)、蒽二酮(如米托蒽醌和匹杉琼)、以及蒽环霉素(如博来霉素、阿霉素、道诺霉素、表阿霉素、伊达比星、丝裂霉素、普卡霉素和戊柔比星)。
本文所公开的治疗性化合物可以是二甲双胍、姜黄素、甘草次酸或6-姜烯酚。
本文所公开的治疗性化合物可以是抗生素。合适的交感神经兴奋胺的实例包括但不限于异烟肼、利福平、吡嗪酰胺和乙胺丁醇。
本文所公开的治疗性化合物可以是抗蠕虫药。合适的抗蠕虫药的实例包括但不限于:阿巴克丁、氨基乙腈(如莫奈太尔)、苯并咪唑、乙胺嗪、伊维菌素、左旋咪唑、氯硝柳胺、八缩酚酸肽(如艾莫德赛)、膦酸(美曲膦酯)、吡喹酮、螺吲哚(如得曲恩特)和苏拉明双羟萘酸噻嘧啶。苯并咪唑包括丙硫咪唑、芬苯达唑、氟苯达唑、甲苯咪唑、噻苯咪唑和三氯苯咪唑
本文所公开的治疗性化合物可以是抗疟药。合适的抗疟药的实例包括但不限于:阿莫地、青蒿素、阿托伐醌、氯喹、克林霉素、多西环素、盐酸氯氟、甲氟喹、伯胺喹、盐酸氯胍、乙胺嘧啶、奎宁和相关制剂(如奎尼马斯和奎尼丁、六羧基蒽二酮)以及磺胺(如磺胺多辛和乙酰磺胺甲氧嗪)。青蒿素包括蒿乙醚、蒿甲醚、青蒿素、青蒿酯以及二氢青蒿素。
本文所公开的治疗性化合物可以是抗高血脂剂。存在几类抗高血脂剂(也称为降血脂剂)。所述抗高血脂剂可以在其对胆固醇谱的影响和不良反应两方面不同。例如,一些可以降低密度脂蛋白(LDL),而其他的可以优选增加高密度脂蛋白(HDL)。临床上,试剂的选择将取决于个体的胆固醇谱、个体的心血管风险和/或个体的肝功能和肾功能。合适的抗高血脂剂的实例包括但不限于血管紧张素II受体拮抗剂、ACE抑制剂、磷酸二酯酶抑制剂、贝特类药物、他汀类药物、生育三烯酚、烟酸、胆酸螯合剂(树脂)、胆固醇吸收抑制剂、胰脂酶抑制剂和交感神经兴奋胺。
本文所公开的治疗性化合物可以是治疗性化合物的酯。相对于相同的治疗性化合物,治疗性化合物的酯增加logP值,但无酯修饰。可以(例如)通过治疗性化合物中存在的羧酸官能团或羟基官能团将酯基团与治疗化合物连接。治疗性化合物的酯可以具有增加的疏水性,并且因此可以溶解于减小体积的本文中所公开的溶剂中。在一些情况下,治疗性化合物的酯可以与本文中所公开的辅助剂直接组合,从而消除对溶剂的需要。在相同治疗性化合物的非酯化形式不混溶于本文中所公开的溶剂中的情况下,治疗性化合物物的酯使得能够制成本文中所公开的药物组合物。只要化合物与本文中所公开的脂质组合,还可以以更有效地抑制促炎性反应的方式来传递治疗性化合物的酯。在一个实施例中,为了形成治疗性化合物的乙基酯,可以将治疗性化合物与乙基酯反应。
本文所公开的固溶体药物组合物可以包括其量足以允许对个体进行常规给药的治疗性化合物。在此实施例的方面中,本文中所公开的药物组合物可以包括例如至少5mg、至少10mg、至少15mg、至少20mg、至少25mg、至少30mg、至少35mg、至少40mg、至少45mg、至少50mg、至少55mg、至少60mg、至少65mg、至少70mg、至少75mg、至少80mg、至少85mg、至少90mg、至少95mg或至少100mg的量的治疗性化合物。在此实施例的其他方面中,本文中所公开的药物组合物可以包含例如至少5mg、至少10mg、至少20mg、至少25mg、至少50mg、至少75mg、至少100mg、至少200mg、至少300mg、至少400mg、至少500mg、至少600mg、至少700mg、至少800mg、至少900mg、至少1000mg、至少1100mg、至少1200mg、至少1300mg、至少1400mg或至少1500mg的量的治疗性化合物。在此实施例的其他方面中,本文中所公开的药物组合物可以包括例如约5mg至约100mg、约10mg至约100mg、约50mg至约150mg、约100mg至约250mg、约150mg至约350mg、约250mg至约500mg、约350mg至约600mg、约500mg至约750mg、约600mg至约900mg、约750mg至约1000mg、约850mg至约1200mg、或约1000mg至约1500mg的量的治疗性化合物。在此实施例的另外其他方面中,本文所公开的药物组合物可以包括例如约10mg至约250mg、约10mg至约500mg、约10mg至约750mg、约10mg至约1000mg、约10mg至约1500mg、约50mg至约250mg、约50mg至约500mg、约50mg至约750mg、约50mg至约1000mg、约50mg至约1500mg、约100mg至约250mg、约100mg至约500mg、约100mg至约750mg、约100mg至约1000mg、约100mg至约1500mg、约200mg至约500mg、约200mg至约750mg、约200mg至约1000mg、约200mg至约1500mg、约5mg至约1500mg、约5mg至约1000mg、或约5mg至约250mg的量的治疗性化合物。
在此实施例的其他方面,本文所公开的药物组合物可包括治疗性组合物:,其量例如按重量计少于约90%、按重量计少于约80%、按重量计少于约70%、按重量计少于约65%、按重量计少于约60%、按重量计少于约55%、按重量计少于约50%、按重量计少于约45%、按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约15%、按重量计少于约10%、按重量计少于约5%或按重量计少于1%。在此实施例的其他方面,本文所公开的药物组合物可包括治疗性组合物,其量例如按重量计约1%至90%、按重量计约1%至80%、按重量计约1%至75%、按重量计约1%至70%、按重量计约1%至65%、按重量计约1%至60%、按重量计约1%至55%、按重量计约1%至50%、按重量计约1%至45%、按重量计约1%至40%、按重量计约1%至35%、按重量计约1%至30%、按重量计约1%至25%、按重量计约1%至20%、按重量计约1%至15%、按重量计约1%至10%、按重量计约1%至5%、按重量计约2%至50%、按重量计约2%至40%、按重量计约2%至30%、按重量计约2%至20%、按重量计约2%至10%、按重量计约4%至50%、按重量计约4%至40%、按重量计约4%至30%、按重量计约4%至20%、按重量计约4%至10%、按重量计约6%至50%、按重量计约6%至40%、按重量计约6%至30%、按重量计约6%至20%、按重量计约6%至10%、按重量计约8%至50%、按重量计约8%至40%、按重量计约8%至30%、按重量计约8%至20%、按重量计约8%至15%、或按重量计约8%至12%。
在此实施例的其他方面,本文所公开的药物组合物可包括治疗性化合物,其量例如按重量计约0.1%至约45%、按重量计约0.1%至约40%、按重量计约0.1%至约35%、按重量计约0.1%至约30%、按重量计约0.1%至约25%、按重量计约0.1%至约20%、按重量计约0.1%至约15%、按重量计约0.1%至约10%、按重量计约0.1%至约5%、按重量计约1%至约45%、按重量计约1%至约40%、按重量计约1%至约35%、按重量计约1%至约30%、按重量计约1%至约25%、按重量计约1%至约20%、按重量计约1%至约15%、按重量计约1%至约10%、按重量计约1%至约5%、按重量计约5%至约45%、按重量计约1%至约40%、按重量计约5%至约35%、按重量计约5%至约30%、按重量计约5%至约25%、按重量计约5%至约20%、按重量计约5%至约15%、按重量计约5%至约10%、按重量计约10%至约45%、按重量计约10%至约40%、按重量计约10%至约35%、按重量计约10%至约30%、按重量计约10%至约25%、按重量计约10%至约20%、按重量计约10%至约15%、按重量计约15%至约45%、按重量计约15%至约40%、按重量计约15%至约35%、按重量计约15%至约30%、按重量计约15%至约25%、按重量计约15%至约20%、按重量计约20%至约45%、按重量计约20%至约40%、按重量计约20%至约35%、按重量计约20%至约30%、按重量计约20%至约25%、按重量计约25%至约45%、按重量计约25%至约40%、按重量计约25%至约35%、或按重量计约25%至约30%。
本文中所公开的治疗性化合物在本文中所公开的药物组合物中的最终浓度可以是所需的任意浓度。在所述实施例的一方面,药物组合物中的治疗性化合物的最终浓度可以是治疗有效量。在所述实施例的其他方面,药物组合物中的治疗性化合物的最终浓度可以是例如至少0.00001mg/mL、至少0.0001mg/mL、至少0.001mg/mL、至少0.01mg/mL、至少0.1mg/mL、至少1mg/mL、至少10mg/mL、至少25mg/mL、至少50mg/mL、至少100mg/mL、至少200mg/mL、至少500mg/mL、至少700mg/mL、至少1000mg/mL、或至少1200mg/mL。在所述实施例的其他方面,溶液中本文所公开的治疗性化合物的浓度可以是例如至多1000mg/mL、至多1100mg/mL、至多1200mg/mL、至多1300mg/mL、至多1400mg/mL、至多1500mg/mL、至多2000mg/mL、至多2000mg/mL、或至多3000mg/mL。在所述实施例的其他方面,药物组合物中的治疗性化合物的最终浓度可以在例如约0.00001mg/mL至约3000mg/mL、约0.0001mg/mL至约3000mg/mL、约0.01mg/mL至约3000mg/mL、约0.1mg/mL至约3000mg/mL、约1mg/mL至约3000mg/mL、约250mg/mL至约3000mg/mL、约500mg/mL至约3000mg/mL、约750mg/mL至约3000mg/mL、约1000mg/mL至约3000mg/mL、约100mg/mL至约2000mg/mL、约250mg/mL至约2000mg/mL、约500mg/mL至约2000mg/mL、约750mg/mL至约2000mg/mL、约1000mg/mL至约2000mg/mL、约100mg/mL至约1500mg/mL、约250mg/mL至约1,500mg/mL、约500mg/mL至约1500mg/mL、约750mg/mL至约1500mg/mL、约1000mg/mL至约1500mg/mL、约100mg/mL至约1200mg/mL、约250mg/mL至约1200mg/mL、约500mg/mL至约1200mg/mL、约750mg/mL至约1200mg/mL、约1000mg/mL至约1200mg/mL、约100mg/mL至约1000mg/mL、约250mg/mL至约1000mg/mL、约500mg/mL至约1000mg/mL、约750mg/mL至约1000mg/mL、约100mg/mL至约750mg/mL、约250mg/mL至约750mg/mL、约500mg/mL至约750mg/mL、约100mg/mL至约500mg/mL、约250mg/mL至约500mg/mL、约0.00001mg/mL至约0.0001mg/mL、约0.00001mg/mL至约0.001mg/mL、约0.00001mg/mL至约0.01mg/mL、约0.00001mg/mL至约0.1mg/mL、约0.00001mg/mL至约1mg/mL、约0.001mg/mL至约0.01mg/mL、约0.001mg/mL至约0.1mg/mL、约0.001mg/mL至约1mg/mL、约0.001mg/mL至约10mg/mL、或约0.001mg/mL至约100mg/mL的范围内。
本说明书的多个方面部分地公开一种或多种脂质。脂质可以被广义地定义为疏水的或两亲性小分子。一些脂质的两亲性质使其能够在水性环境中形成例如囊、脂质体或膜的结构。脂质的非限制性实例包括脂肪酸、甘油脂、磷脂质、鞘脂、甾醇脂质、异戊烯醇脂、糖脂质和聚酮化合物。
可用于本文中所公开的药物组合物的脂质可以是药学上可接受的脂肪酸。脂肪酸包括具有长的无支链烃链的饱和的或不饱和的羧酸。这样的安排赋予脂肪酸极性亲水性末端和不溶于水的非极性疏水末端。大部分天然存在的脂肪酸具有偶数个碳原子、通常在4和24个碳原子之间的烃链,并且可以被连接到包含氧、卤素、氮和硫的官能基团。合成的或非天然的脂肪酸可以具有3和40之间任意数目的碳原子的烃链。当存在双键时,其可以是顺式或反式的几何结构,这显著地影响分子的分子构型。顺式双键引起脂肪酸链弯曲,链中双键越多,效果越明显。大部分天然存在的脂肪酸具有顺式构型,尽管反式构型在一些天然的部分氢化的脂肪和油中确实存在。脂肪酸的实例包括但不限于羊脂酸(8:0)、壬酸(9:0)、癸酸(10:0)、十一烷酸(11:0)、月桂酸(12:0)、十三烷酸(13:0)、肉豆蔻酸(14:0)、肉豆蔻脑酸(14:1)、十五烷酸(15:0)、棕榈酸(16:0)、棕榈油酸(16:1)、十六烷酸(16:1)、十七烷酸(17:0)、硬脂酸(18:0)、油酸(18:1)、反油酸(18:1)、异油酸(18:1)、亚油酸(18:2)、亚麻酸(18:2)、α-亚麻酸(18:3)、γ-亚麻酸(18:3)、十八碳四烯酸(18:4)、十九烷酸(19:0)、花生酸(20:0)、二十烷酸(20:1)、二高-γ-亚麻酸(20:3)、米德酸(20:3)、花生四烯酸(20:4)、二十碳五烯酸(20:5)、二十一烷酸(21:0)、山嵛酸(22:0)、芥酸(22:1)、二十二碳六烯酸(22:6)、二十三烷酸(23:0)、二十四烷酸(24:0)、神经酸(24:1)、二十五烷酸(25:0)、蜡酸(26:0)、二十七烷酸(27:0)、褐煤酸(28:0)、二十九烷酸(29:0)、蜂蜜酸(30:0)、三十一烷酸(31:0)、虫漆蜡酸(32:0)、叶虱酸(33:0)、格地酸(34:0)、蜡塑酸(35:0)和三十六烷酸(36:0)。
在实施例中,脂质可以是药学上可接受的饱和或不饱和脂肪酸。在此实施例的各方面中,饱和或不饱和脂肪酸包括例如至少8个、至少10个、至少12个、至少14个、至少16个、至少18个、至少20个、至少22个、至少24个、至少26个、至少28个、或至少30个碳原子。在此实施例的其他方面中,饱和或不饱和脂肪酸包括例如,4到24个碳原子、6到24个碳原子、8到24个碳原子、10到24个碳原子、12到24个碳原子、14到24个碳原子、或16到24个碳原子、4到22个碳原子、6到22个碳原子、8到22个碳原子、10到22个碳原子、12到22个碳原子、14到22个碳原子,或16到22个碳原子、4到20个碳原子、6到20个碳原子、8到20个碳原子、10到20个碳原子、12到20个碳原子、14到20个碳原子、或16到20个碳原子。如果是不饱和的,脂肪酸则可以具有例如1个或更多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个或者6个或更多个双键。
可用于本文中所公开的药物组合物的脂质可以是药学上可接受的硬脂。硬脂也称为“固体脂肪”、“室温固态脂质”或简而言之“脂肪”,其包括在正常室温(例如约20℃)下为固体的任何脂肪酸。脂肪由通常可溶于有机溶剂且通常不溶于水的多种化合物组成。药学上可接受的硬脂的混合物的实例包括但不限于一种或多种本文所公开的甘油脂的混合物、一种或多种本文所公开的二醇脂肪酸酯的混合物、多种本文所公开的聚醚脂肪酸酯的混合物和多种本文所公开的甘油酯的混合物。
可用于本文所公开的药物组合物中的固体脂肪可以是药学上可接受的甘油脂。甘油脂主要由单取代甘油,双取代甘油以及三取代甘油组成。甘油脂的其中一组是甘油酯,其中甘油的一个羟基,两个羟基或者三个羟基分别使用本文所公开的脂肪酸进行酯化,来分别生成甘油单酯,甘油二酯和甘油三酯。在这些化合物中,甘油的每一羟基可以通过相同脂肪酸或不同的脂肪酸进行酯化。此外,甘油酯可以进行乙酰化以产生乙酰化甘油单酯,乙酰化甘油二酯和乙酰化甘油三酯。在此实施例的各个方面中,甘油单酯可以包括饱和的或不饱和脂肪酸,其碳链长度为C12-C24。在此实施例的其他方面中,甘油二酯可以包括一种饱和或不饱和脂肪酸,其碳链长度为C12-C24,或两种饱和或不饱和脂肪酸,每种脂肪酸碳链长度为C12-C24。在此实施例的其他方面中,甘油三酯可以包括一种饱和或不饱和脂肪酸,其碳链长度为C12-C24,两种饱和或不饱和脂肪酸,每种脂肪酸碳链长度为C12-C24,或三种饱和或不饱和脂肪酸,每种脂肪酸碳链长度为C12-C24。
在此实施例的方面,药学上可接受的脂质的混合物包括甘油一脂、甘油二脂和/或甘油三脂的混合物,其具有例如约33℃、约34℃、约35℃、约36℃、约37℃、约38℃、约39℃、约40℃、约41℃、约42℃、约43℃、约44℃、约45℃、约46℃、约47℃、约48℃、约49℃、约50℃的熔点。在此实施例的方面中,药学上可接受的脂质的混合物包括甘油一脂、甘油二脂和/或甘油三脂的混合物,其具有例如约30℃至约44℃、约30℃至约45℃、约30℃至约46℃、约30℃至约47℃、约30℃至约48℃、约30℃至约49℃、约30℃至约50℃、约32℃至约44℃、约32℃至约45℃、约32℃至约46℃、约32℃至约47℃、约32℃至约48℃、约32℃至约49℃、约32℃至约50℃、约34℃至约44℃、约34℃至约45℃、约34℃至约46℃、约34℃至约47℃、约34℃至约48℃、约34℃至约49℃、约34℃至约50℃、约36℃至约44℃、约36℃至约45℃、约36℃至约46℃、约36℃至约47℃、约36℃至约48℃、约36℃至约49℃、约36℃至约50℃、约38℃至约44℃、约38℃至约45℃、约38℃至约46℃、约38℃至约47℃、约38℃至约48℃、约38℃至约49℃、约38℃至约50℃、约40℃至约44℃、约40℃至约45℃、约40℃至约46℃、约40℃至约47℃、约40℃至约48℃、约40℃至约49℃、约40℃至约50℃、约42℃至约44℃、约42℃至约45℃、约42℃至约46℃、约42℃至约47℃、约42℃至约48℃、约42℃至约49℃或约42℃至约50℃的熔点。
在本实施例的其他方面,药学上可接受的脂质的混合物包括具有(例如)约33℃、约34℃、约35℃、约36℃、约37℃、约38℃、约39℃、约40℃、约41℃、约42℃、约43℃、约44℃、约45℃、约46℃、约47℃、约48℃、约49℃、约50℃的熔点的PEG脂肪酸酯混合物。在本实施例的各方面,药物可接受的脂质的混合物包括具有(例如)约30℃至约44℃、约30℃至约45℃、约30℃至约46℃、约30℃至约47℃、约30℃至约48℃、约30℃至约49℃、约30℃至约50℃、约32℃至约44℃、约32℃至约45℃、约32℃至约46℃、约32℃至约47℃、约32℃至约48℃、约32℃至约49℃、约32℃至约50℃、约34℃至约44℃、约34℃至约45℃、约34℃至约46℃、约34℃至约47℃、约34℃至约48℃、约34℃至约49℃、约34℃至约50℃、约36℃至约44℃、约36℃至约45℃、约36℃至约46℃、约36℃至约47℃、约36℃至约48℃、约36℃至约49℃、约36℃至约50℃、约38℃至约44℃、约38℃至约45℃、约38℃至约46℃、约38℃至约47℃、约38℃至约48℃、约38℃至约49℃、约38℃至约50℃、约40℃至约44℃、约40℃至约45℃、约40℃至约46℃、约40℃至约47℃、约40℃至约48℃、约40℃至约49℃、约40℃至约50℃、约42℃至约44℃、约42℃至约45℃、约42℃至约46℃、约42℃至约47℃、约42℃至约48℃、约42℃至约49℃、约42℃至约50℃的熔点的PEG脂肪酸酯混合物。
在本实施例的其他方面,药学上可接受的脂质的混合物包括具有(例如)约33℃、约34℃、约35℃、约36℃、约37℃、约38℃、约39℃、约40℃、约41℃、约42℃、约43℃、约44℃、约45℃、约46℃、约47℃、约48℃、约49℃、约50℃的熔点的甘油单酯、甘油二酯、和/或甘油三酯及PEG脂肪酸酯的混合物。在本实施例的各个方面中,药学上可接受的脂质的混合物包括具有(例如)约30℃至约44℃、约30℃至约45℃、约30℃至约46℃、约30℃至约47℃、约30℃至约48℃、约30℃至约49℃、约30℃至约50℃、约32℃至约44℃、约32℃至约45℃、约32℃至约46℃、约32℃至约47℃、约32℃至约48℃、约32℃至约49℃、约32℃至约50℃、约34℃至约44℃、约34℃至约45℃、约34℃至约46℃、约34℃至约47℃、约34℃至约48℃、约34℃至约49℃、约34℃至约50℃、约36℃至约44℃、约36℃至约45℃、约36℃至约46℃、约36℃至约47℃、约36℃至约48℃、约36℃至约49℃、约36℃至约50℃、约38℃至约44℃、约38℃至约45℃、约38℃至约46℃、约38℃至约47℃、约38℃至约48℃、约38℃至约49℃、约38℃至约50℃、约40℃至约44℃、约40℃至约45℃、约40℃至约46℃、约40℃至约47℃、约40℃至约48℃、约40℃至约49℃、约40℃至约50℃、约42℃至约44℃、约42℃至约45℃、约42℃至约46℃、约42℃至约47℃、约42℃至约48℃、约42℃至约49℃、约42℃至约50℃的熔点的甘油单酯、甘油二酯、和/或甘油三酯及PEG脂肪酸酯的混合物。
本文所公开的固溶体药物组合物可以包含药学上可接受的室温固体脂质(硬脂),其量足以形成本文所公开的固溶体组合物。在本实施例的其他方面,本文所公开的药物组合物可以包括量为(例如)按重量计至少10%、按重量计至少20%、按重量计至少30%、按重量计至少35%、按重量计至少40%、按重量计至少45%、按重量计至少50%、按重量计至少55%、按重量计至少60%、按重量计至少65%、按重量计至少70%、按重量计至少75%、按重量计至少80%、按重量计至少85%、按重量计至少90%、按重量计至少95%、按重量计至少99%的药学上可接受的室温固体脂质(硬脂)。在本实施例的其他方面,本文所公开的药物组合物可以包括量为(例如)按重量计约30%至约99%、按重量计约35%至约99%、按重量计约40%至约99%、按重量计约45%至约99%、按重量计约50%至约99%、按重量计约30%至约98%、按重量计约35%至约98%、按重量计约40%至约98%、按重量计约45%至约98%、按重量计约50%至约98%、按重量计约30%至约95%、按重量计约35%至约95%、按重量计约40%至约95%、按重量计约45%至约95%或按重量计约50%至约95%的药学上可接受的室温固体脂质(硬脂)。在本实施例的又一其他方面,本文所公开的药物组合物可以包括量为(例如)按重量计约70%至约97%、按重量计约75%至约97%、按重量计约80%至约97%、按重量计约85%至约97%、按重量计约88%至约97%、按重量计约89%至约97%、按重量计约90%至约97%、按重量计约75%至约96%、按重量计约80%至约96%、按重量计约85%至约96%、按重量计约88%至约96%、按重量计约89%至约96%、按重量计约90%至约96%、按重量计约75%至约93%、按重量计约80%至约93%、按重量计约85%至约93%、按重量计约88%至约93%、按重量计约89%至约93%或按重量计约90%至约93%的药学上可接受的室温固体脂质(硬脂)。
市售的药学上可接受的甘油脂的混合物包括但不限于:可可油、PEG-6硬脂酸和乙二醇棕榈酸硬脂酸酯及PEG-32硬脂酸的混合物三鲸蜡硬脂醇聚醚-4-磷酸酯和乙二醇棕榈硬脂酸酯及二乙二醇棕榈硬脂酸酯的混合物单硬脂酸甘油酯和PEG-75硬脂酸的混合物鲸蜡醇与乙氧基化脂肪醇(鲸蜡醇-2-、硬脂醇聚醚-20)的混合物具有33℃左右熔点的饱和C10-C18甘油三酯的混合物具有39℃左右熔点的饱和C10-C18甘油三酯的混合物、具有43℃左右熔点的饱和C10-C18甘油三酯的混合物、单硬脂酸甘油酯40-55(I型)和甘油二酯的混合物(甘油单酯及甘油二酯)以及中链甘油三酯的混合物(亲脂WL1349)。
可用于本文中所公开的药物组合物中的硬脂可以是药物可接受的二元醇脂肪酸酯。药物可接受的二元醇脂肪酸酯可以是二元醇的单酯、二元醇的二酯或二元醇的三酯。二元醇脂肪酸酯包括但不限于:乙二醇脂肪酸酯、二乙二醇脂肪酸酯、丙二醇脂肪酸酯以及二丙烯脂肪酸酯。乙二醇脂肪酸酯的非限制性实例包括(例如)乙二醇辛酸酯、乙二醇壬酸酯、乙二醇癸酸酯、乙二醇十一酸酯、乙二醇十二酸酯、乙二醇十三酸酯、乙二醇十四酸酯、乙二醇十四酸醇酯、乙二醇十五环化酸酯、乙二醇棕榈酸酯、乙二醇棕榈油酸酯、乙二醇十六酸酯、乙二醇十七酸酯、乙二醇硬脂酸酯、乙二醇硬脂酸棕榈酸酯、乙二醇油酸酯、乙二醇反油酸酯、乙二醇疫酸酯(vaccinate)、乙二醇亚油酸酯、乙二醇反亚油酸酯、乙二醇α-亚麻酸酯、乙二醇γ-亚麻酸酯、乙二醇十八碳四烯酸酯、乙二醇十八醇辛癸酸酯、乙二醇双十八醇辛癸酸酯、二乙二醇辛酸酯、二乙二醇壬酸酯、二乙二醇癸酸酯、二乙二醇十一酸酯、二乙二醇十二酸酯、二乙二醇十三酸酯、二乙二醇十四酸酯、二乙二醇十四酸醇酯、二乙二醇十五环化酸酯、二乙二醇棕榈酸酯、二乙二醇棕榈油酸酯、二乙二醇十六酸酯、二乙二醇十七酸酯、二乙二醇硬脂酸酯、二乙二醇硬脂酸棕榈酸酯、二乙二醇油酸酯、二乙二醇反油酸酯、二乙二醇疫酸酯、二乙二醇亚油酸酯、二乙二醇反亚油酸酯、二乙二醇α-亚麻酸酯、二乙二醇γ-亚麻酸酯、二乙二醇十八碳四烯酸酯、二乙二醇十八醇辛癸酸酯、二乙二醇双十八醇辛癸酸酯、丙二醇辛酸酯、丙二醇壬酸酯、丙二醇癸酸酯、丙二醇十一酸酯、丙二醇十二酸酯、丙二醇十三酸酯、丙二醇十四酸酯、丙二醇十四酸醇酯、丙二醇十五环化酸酯、丙二醇棕榈酸酯、丙二醇棕榈油酸酯、丙二醇十六酸酯、丙二醇十七酸酯、丙二醇硬脂酸酯、丙二醇硬脂酸棕榈酸酯、丙二醇油酸酯、丙二醇反油酸酯、丙二醇疫酸酯、丙二醇亚油酸酯、丙二醇反亚油酸酯、丙二醇α-亚麻酸酯、丙二醇γ-亚麻酸酯、丙二醇十八碳四烯酸酯、丙二醇十八醇辛癸酸酯、丙二醇双十八醇辛癸酸酯、二丙二醇辛酸酯、二丙二醇壬酸酯、二丙二醇癸酸酯、二丙二醇十一酸酯、二丙二醇十二酸酯、二丙二醇十三酸酯、二丙二醇十四酸酯、二丙二醇十四酸醇酯、二丙二醇十五环化酸酯、二丙二醇棕榈酸酯、二丙二醇棕榈油酸酯、二丙二醇十六酸酯、二丙二醇十七酸酯、二丙二醇硬脂酸酯、二丙二醇硬脂酸棕榈酸酯、二丙二醇油酸酯、二丙二醇反油酸酯、二丙二醇疫酸酯、二丙二醇亚油酸酯、二丙二醇反亚油酸酯、二丙二醇α-亚麻酸酯、二丙二醇γ-亚麻酸酯、二丙二醇十八碳四烯酸酯、二丙二醇十八醇辛癸酸酯、二丙二醇双十八醇辛癸酸酯、或其任意组合。
市售的药学上可接受的乙二醇脂肪酸酯包括但不限于:丙二醇单硬脂酸棕榈酸酯丙二醇双十八醇辛癸酸酯丙二醇单十二酸酯(I型)丙二醇单十二酸酯(II型)丙二醇单辛酸酯(I型)以及丙二醇单辛酸酯(Ⅱ型)
用于本文所公开的药物组合物的硬脂可以是药学上可接受的聚醚脂肪酸酯。药学上可接受的聚醚脂肪酸酯可以是聚醚的单脂肪酸酯、聚醚的二脂肪酸酯或聚醚的三脂肪酸酯。聚醚脂肪酸酯包括但不限于PEG脂肪酸酯、PEG甘油基脂肪酸、PEG脂肪酸酯甘油酯、PPG脂肪酸酯、PPG甘油基脂肪酸以及PPG脂肪酸酯甘油酯。PEG或PPG的分子量可以是例如5-20,000。聚醚脂肪酸酯的非限制性实例包括(例如)PEG辛酸酯、PEG壬酸酯、PEG癸酸酯、PEG十一酸酯、PEG十二酸酯、PEG十三酸酯、PEG十四酸酯、PEG十四酸醇酯、PEG十五环化酸酯、PEG棕榈酸酯、PEG棕榈油酸酯、PEG十六酸酯、PEG十七酸酯、PEG硬脂酸酯、PEG硬脂酸棕榈酸酯、PEG油酸酯、PEG反式油酸酯、PEG疫酸酯、PEG亚油酸酯、PEG反亚油酸酯、PEGα-亚麻酸酯、PEGγ-亚麻酸酯、PEG十八碳四烯酸酯、PEG十八醇辛癸酸酯、PEG双十八醇辛癸酸酯、PEG甘油基辛酸酯、PEG甘油基壬酸酯、PEG甘油基癸酸酯、PEG甘油基十一酸酯、PEG甘油基十二酸酯、PEG甘油基十三酸酯、PEG甘油基十四酸酯、PEG甘油基十四酸醇酯、PEG甘油基十五环化酸酯、PEG甘油基棕榈酸酯、PEG甘油基棕榈油酸酯、PEG甘油基十六酸酯、PEG甘油基十七酸酯、PEG甘油基硬脂酸、PEG甘油基硬脂酸棕榈酸酯、PEG甘油基油酸酯、PEG甘油基反式油酸酯、PEG甘油基疫酸酯、PEG甘油基亚油酸酯、PEG甘油基反亚油酸酯、PEG甘油基α-亚麻酸酯、PEG甘油基γ-亚麻酸酯、PEG甘油基十八碳四烯酸酯、PEG甘油基十八醇辛癸酸酯、PEG甘油基双十八醇辛癸酸酯、辛酰基PEG甘油酯、壬酰基PEG甘油酯、辛酰基PEG甘油酯、壬酰基PEG甘油酯、辛酰基PEG甘油酯、十三酰基PEG甘油酯、肉豆蔻酰基PEG甘油酯、十三酰基PEG甘油酯、十五酰基PEG甘油酯、棕榈酰基PEG甘油酯、棕榈油酰基PEG甘油酯、十六酰基PEG甘油酯、十七酰基PEG甘油酯、硬脂酰基PEG甘油酯、硬脂酰棕榈酰基PEG甘油酯、油酰基PEG甘油酯、反式油酰基PEG甘油酯、疫酰基PEG甘油酯、亚油酰基PEG甘油酯、反亚油酰基PEG甘油酯、α-亚油酰基lPEG甘油酯、γ-亚油酰基PEG甘油酯、十八碳四烯酰基PEG甘油酯、十八醇辛癸酰基PEG甘油酯、双十八醇辛癸酰基PEG甘油酯、PPG辛酸酯、PPG壬酸酯、PPG癸酸酯、PPG十一酸酯、PPG十二酸酯、PPG十三酸酯、PPG十四酸酯、PPG十四酸酯、PPG十五环化酸酯、PPG棕榈酸酯、PPG棕榈油酸酯、PPG十六酸酯、PPG十七酸酯、PPG硬脂酸酯、PPG硬脂酸棕榈酸酯、PPG油酸酯、PPG反式油酸酯、PPG疫酸酯、PPG亚油酸酯、PPG反亚油酸酯、PPGα-亚麻酸酯、PPGγ-亚麻酸酯、PPG十八碳四烯酸酯、PPG十八醇辛癸酸酯、PPG双十八醇辛癸酸酯、PPG甘油基辛酸酯、PPG甘油基壬酸酯、PPG甘油基癸酸酯、PPG甘油基十一酸酯、PPG甘油基十二酸酯、PPG甘油基十三酸酯、PPG甘油基十四酸酯、PPG甘油基十四酸酯、PPG甘油基十五环化酸酯、PPG甘油基棕榈酸酯、PPG甘油基棕榈油酸酯、PPG甘油基十六酸酯、PPG甘油基十七酸酯、PPG甘油基硬脂酸酯、PPG甘油基硬脂酸棕榈酸酯、PPG甘油基油酸酯、PPG甘油基反式油酸酯、PPG甘油基疫酸酯、PPG甘油基亚油酸酯、PPG甘油基反亚油酸酯、PPG甘油基α-亚油酸酯、PPG甘油基γ-亚麻酸酯、PPG甘油基十八碳四烯酸酯、PPG甘油基十八醇辛癸酸酯、PPG甘油基双十八醇辛癸酸酯、辛酰基PPG甘油酯、壬酰基PPG甘油酯、辛酰基PPG甘油酯、十一酰基PPG甘油酯、十二酰基PPG甘油酯、十三酰基PPG甘油酯、肉豆蔻酰基PPG甘油酯、十四酰基PPG甘油酯、十五酰基PPG甘油酯、棕榈酰基PPG甘油酯、棕榈油酰基PPG甘油酯、十六酰基PPG甘油酯、十七酰基PPG甘油酯,硬脂酰PPG甘油酯、棕榈酸硬脂酰基PPG甘油酯、油酰PPG甘油酯、反式油酰基PPG甘油酯、疫酰基PPG甘油酯、亚油酰基PPG甘油酯、反亚油酰基PPG甘油酯、α-亚麻酰基PPG甘油酯、γ-亚麻酰基PPG甘油酯、十八碳四烯酰基PPG甘油酯、十八醇辛癸酰基PPG甘油酯、双十八醇辛癸酰基PPG甘油酯、或其任何组合。
市售的药学上可接受的聚醚脂肪酸酯包括但不限于:辛酸癸酸聚乙二醇-8甘油酯PEG-8蜂蜡月桂酰聚乙二醇-32甘油酯(GELUCIRE 44/14)、硬脂酸聚乙二醇-32甘油酯(GELUCIRE50.13)、亚油酸聚乙二醇-6甘油酯(M2125CS)、油酸聚乙二醇-6甘油酯(M1944CS),以及月桂酰聚乙二醇-6甘油酯(M2130CS)。
可用于本文所公开的药物组合物中的另一种脂质可以是药学上可接受的室温液体脂类。室温液体脂类也称为“液体脂肪”,其包括在正常室温(例如,20℃)下是液体的任何脂肪酸。室温液体脂类包括广泛的化合物,其一般可溶于有机溶剂,但通常不溶于水药学上可接受的室温液体脂质的混合物的实例包括但不限于:本文所公开的一种或多种脂肪酸的混合物、一种或多种部分水解的脂肪混合物,一种或多种部分氢化的脂肪混合物。
药学上可接受的室温液体脂质包括药学上可接受的部分氢化的脂肪。氢化的过程将氢原子添加到不饱和脂质,消除双键并且使其成为部分饱和脂质或者完全饱和脂质。部分氢化是化学性的而不是酶促的,其将一部分顺式异构体转变成反式不饱和脂质,而不是将前者完全氢化。在第一反应步骤中,添加一个氢原子,而另外一个配位不饱和碳原子相连到催化剂上。第二反应步骤是在剩余的碳原子上添加氢原子,生成饱和脂肪酸。第一反应步骤是可逆的,这样氢原子重新吸收到催化剂上并重新形成双键。只加入了一个氢原子的中间体不含有双键,且可以自由旋转。因而,双键可以重新形成为顺式或反式,其中反式是受欢迎的,而不用管初始材料如何。
本文所公开的固溶体药物组合物可以包括量足以溶解本文所公开的治疗性化合物的室温液体脂质。在本实施例的其他方面,本文所公开的药物组合物可包含室温液体脂质,其量(例如)按重量计少于约90%、按重量计少于约80%、按重量计少于约70%、按重量计少于约65%、按重量计少于约60%、按重量计少于约55%、按重量计少于约50%、按重量计少于约45%、按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约15%、按重量计少于约10%、按重量计少于约5%、或按重量计少于约1%。在本实施例的其他方面,本文所公开的药物组合物可以包含室温液体脂质,其量在例如按重量计约1%至90%、按重量计约1%至80%、按重量计约1%至70%、按重量计约1%至60%、按重量计约1%至50%、按重量计约1%至40%、按重量计约1%至30%、按重量计约1%至20%、按重量计约1%至10%、按重量计约2%至50%、按重量计约2%至40%、按重量计约2%至30%、按重量计约2%至20%、按重量计约2%至10%、按重量计约4%至50%、按重量计约4%至40%、按重量计约4%至30%、按重量计约4%至20%、按重量计约4%至10%、按重量计约6%至50%、按重量计约6%至40%、按重量计约6%至30%、按重量计约6%至20%、按重量计约6%至10%、按重量计约8%至50%、按重量计约8%至40%、按重量计约8%至30%、按重量计约8%至20%、按重量计约8%至15%、或按重量计约8%至12%的范围中。
药学上可接受的室温液体脂质的实例包括甘油单酸酯,其包括但不限于:甘油单肉豆蔻脑酸酯、甘油单棕榈油酸酯、甘油单顺-6-十六烯酸酯、甘油单油酸酯、甘油单反式油酸酯、甘油单异油酸酯、甘油单亚油酸酯、甘油单反亚油酸酯、甘油单亚麻酸酯、甘油单十八碳四烯酸酯、甘油单二十碳烯酸酯、甘油二十碳三烯酸酯、甘油单花生四烯酸酯、甘油单二十碳五烯酸酯、甘油单芥酸酯、甘油单二十二碳六烯酸酯以及甘油单二十四碳烯酸酯。
市售的药学上可接受的室温液体脂质包括但不限于:甘油二山嵛酸酯甘油山嵛酸酯(ATO)、甘油硬脂酸二棕榈酸酯(Biogapress Vegetal BM297ATO)、甘油二硬脂酸酯(I型)(5)以及甘油单亚油酸酯(MAISINETM35-1)。
本说明书的各个方面部分地公开了一种稳定剂。稳定剂是一种化合物,其与存在于本文所公开的治疗性化合物上的游离酸或碱相互作用以屏蔽电荷从而阻碍治疗性化合物/脂质基质之间的离子相互作用,这防止形成固相组合物的晶体基质所必需的对准。因此,稳定剂防止组合物向典型固相的热力学转变或将所述转变延长至其不会发生的程度。稳定剂的实例包括液体乙二醇聚会物、一元醇、异山梨醇二甲醚、以及二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇)
本文所公开的药物组合物可以包含量足以稳定存在于本文所公开的治疗性化合物中的游离酸或游离碱的稳定剂。在此实施例的其他方面,本文所公开的药物组合物可包含稳定剂,其量例如按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约19%、按重量计少于约18%、按重量计少于约17%、按重量计少于约16%、按重量计少于约15%、按重量计少于约14%、按重量计少于约13%、按重量计少于约12%、按重量计少于约11%、按重量计少于约10%、按重量计少于约9%、按重量计少于约8%、按重量计少于约7%、按重量计少于约6%、按重量计少于约5%、按重量计少于约4%、按重量计少于约3%、按重量计少于约2%、或少于约1%。在此实施例的其他方面,本文所公开的药物组合物可以以包含稳定剂,其量例如按重量计约1%至约5%、按重量计约1%至约7%、按重量计约1%至约10%、按重量计约1%至约12%、按重量计约1%至约15%、按重量计约1%至约18%、按重量计约1%至约20%、按重量计约2%至约5%、按重量计约2%至约7%、按重量计约2%至约10%、按重量计约2%至约12%、按重量计约2%至约15%、按重量计约2%至约18%、按重量计约2%至约20%、按重量计约3%至约5%、按重量计约3%至约7%、按重量计约3%至约10%、按重量计约3%至约12%、按重量计约3%至约15%、按重量计约3%至约18%、按重量计约3%至约20%、按重量计约4%至约5%、按重量计约4%至约7%、按重量计约4%至约10%、按重量计约4%至约12%、按重量计约4%至约15%、按重量计约4%至约18%、按重量计约4%至约20%、按重量计约5%至约7%、按重量计约5%至约10%、按重量计约5%至约12%、按重量计约5%至约15%、按重量计约5%至约18%、按重量计约5%至约20%、按重量计约6%至约7%、按重量计约6%至约10%、按重量计约6%至约12%、按重量计约6%至约15%、按重量计约6%至约18%、按重量计约6%至约20%、按重量计约7%至约10%、按重量计约7%至约12%、按重量计约7%至约15%、按重量计约7%至约18%、按重量计约7%至约20%、按重量计约8%至约10%、按重量计约8%至约12%、按重量计约8%至约15%、按重量计约8%至约18%、按重量计约8%至约20%、按重量计约9%至约10%、按重量计约9%至约12%、按重量计约9%至约15%、按重量计约9%至约18%、按重量计约9%至约20%、按重量计约10%至约12%、按重量计约10%至约15%、按重量计约10%至约18%或按重量计约10%至约20%。
本文所公开的稳定剂因其以不使大量溶质溶解的量使用而非溶剂。因此,本文所公开的固溶体组合物中所使用的稳定剂的量导致不超过85%的本文所公开的治疗性化合物的溶解。在此实施例的多个方面中,本文所公开的固溶体组合物中所使用的稳定剂的量导致例如不超过80%、不超过75%、不超过70%、不超过65%、不超过60%、不超过55%、不超过50%、不超过45%、不超过40%、不超过35%、不超过30%、不超过25%、不超过20%、不超过15%、不超过10%或不超过5%的本文所公开的治疗性化合物溶解。
在实施例中,乙二醇聚合物可包括药学上可接受的PEG聚合物。PEG聚合物也称为聚环氧乙烷(PEO)聚合物或聚氧乙烯(POE)聚合物,其可通过环氧乙烷的聚合来制备,并且可从100g/mol到10,000,000g/mol的大范围分子量的PEG聚合物中在市场上购得。具有低分子质量的PEG聚合物为液体或低熔点固体,而具有较高分子质量的PEG聚合物为固体。在此实施例的一个方面中,用作稳定剂的PEG聚合物是液体PEG聚合物。在此实施例的多个方面中,PEG聚合物具有例如不超过100g/mol、不超过200g/mol、不超过300g/mol、不超过400g/mol、不超过500g/mol、不超过600g/mol、不超过700g/mol、不超过800g/mol、不超过900g/mol或不超过1000g/mol的分子量。
PEG聚合物包括但不限于PEG100、PEG200、PEG300、PEG400、PEG500、PEG600、PEG700、PEG800、PEG900、PEG1000、PEG1100、PEG1200、PEG1300、PEG1400、PEG1500、PEG1600、PEG1700、PEG1800、PEG1900、PEG2000、PEG2100、PEG2200、PEG2300、PEG2400、PEG2500、PEG2600、PEG2700、PEG2800、PEG2900、PEG3000、PEG3250、PEG3350、PEG3500、PEG3750、PEG4000、PEG4250、PEG4500、PEG4750、PEG5000、PEG5500、PEG6000、PEG6500、PEG7000、PEG7500、PEG8000、PEG8500、PEG9000、PEG9500、PEG10000、PEG11000、PEG12000、PEG13000、PEG14000、PEG15000、PEG16000、PEG17000、PEG18000、PEG19000或PEG20000。
在另一个实施例中,乙二醇聚合物可以包括药学上可接受的聚丙二醇(PPG)聚合物。PPG聚合物也称为聚环氧丙烷(PPO)聚合物或聚氧化丙烯(POP)聚合物,其可以通过环氧丙烷的聚合来制备,并且可以从100g/mol到10,000,000g/mol大范围分子量的PPG聚合物在市场上购得。具有小分子质量的PPG聚合物为液体或低熔点固体,而具有较高分子质量的PPG聚合物为固体。在此实施例的一方面,用作稳定剂的PPG聚合物是液体PPG聚合物。在此实施例的多个方面,PPG聚合物具有例如不超过100g/mol、不超过200g/mol、不超过300g/mol、不超过400g/mol、不超过500g/mol、不超过600g/mol、不超过700g/mol、不超过800g/mol、不超过900g/mol或不超过1000g/mol的分子量。
PPG聚合物包括但不限于PPG 100、PPG 200、PPG 300、PPG 400、PPG 500、PPG 600、PPG 700、PPG 800、PPG 900、PPG 1000、PPG 1100、PPG 1200、PPG 1300、PPG 1400、PPG 1500、PPG 1600、PPG 1700、PPG 1800、PPG 1900、PPG 2000、PPG 2100、PPG 2200、PPG 2300、PPG 2400、PPG 2500、PPG 2600、PPG 2700、PPG 2800、PPG 2900、PPG 3000、PPG 3250、PPG 3350、PPG 3500、PPG 3750、PPG 4000、PPG 4250、PPG 4500、PPG 4750、PPG 5000、PPG 5500、PPG 6000、PPG 6500、PPG 7000、PPG 7500、PPG 8000、PPG 8500、PPG 9000、PPG 9500、PPG 10000、PPG 11000、PPG 12000、PPG 13000、PPG 14000、PPG 15000、PPG 16000、PPG 17000、PPG 18000、PPG 19000或PPG 20000。
一元醇也可以用作稳定剂。在此实施例的多个方面,一元醇可以是例如C2-4醇、C1-4醇、C1-5醇、C1-7醇、C1-10醇、C1-15醇或C1-20醇。一元醇的实例包括但不限于甲醇、乙醇、丙醇、丁醇、戊醇以及1-十六烷醇。
本说明书的多个方面部分地公开一种或多种中和剂。中和剂是一种化合物,其与本文所公开的治疗性化合物相互作用,是中和治疗性化合物溶解时所产生的离子电荷的盐,由此阻碍治疗性化合物/脂质基质之间的离子相互作用,这防止了形成固相组合物的晶体基质所必需的对准。因此,中和剂防止组合物向典型固相的热力学转变或者将这种转变延长到其不会发生的程度。中和剂的实例包括本文所公开的用于碱式盐药物的脂肪酸和用于酸式盐药物的乙酸钠或三乙醇胺。
使用的中和剂的量基于所要电荷中和的程度。对于完全的中和,将相对于治疗性化合物的一摩尔当量的中和剂添加到制剂中。对于部分中和,添加少于一摩尔当量。部分中和在生产缓释制剂方面是有利的。在给药后,治疗性化合物的一部分被立即对身体适用(即时生物利用率),同时另一部分的生物利用率被延迟直到治疗性化合物通过中和剂被中和。还可以过量添加中和剂,即,相对于治疗性化合物的超过一摩尔当量。除中和盐药物之外,过量中和剂也使得能够调整固溶体组合物的熔点。
在本实施例的各个方面,本文所公开的药物组合物可以包括以下量的中和剂,例如,至少5mg、至少10mg、至少15mg、至少20mg、至少25mg、至少30mg、至少35mg、至少40mg、至少45mg、至少50mg、至少55mg、至少60mg、至少65mg、至少70mg、至少75mg、至少80mg、至少85mg、至少90mg、至少95mg或至少100mg。在本实施例的其他方面,本文所公开的药物组合物可以包括以下量的中和剂,例如,至少5mg、至少10mg、至少20mg、至少25mg、至少50mg、至少75mg、至少100mg、至少200mg、至少300mg、至少400mg、至少500mg、至少600mg、至少700mg、至少800mg、至少900mg、至少1000mg、至少1100mg、至少1200mg、至少1300mg、至少1400mg或至少1500mg。在在本实施例的又一其他方面,本文所公开的药物组合物可以包括以下量的中和剂,例如,约5mg至约100mg、约10mg至约100mg、约50mg至约150mg、约100mg至约250mg、约150mg至约350mg、约250mg至约500mg、约350mg至约600mg、约500mg至约750mg、约600mg至约900mg、约750mg至约1000mg、约850mg至约1200mg或约1000mg至约1500mg。在本实施例的又一其他方面,本文所公开的药物组合物可包括以下量的中和剂,例如,约10mg至约250mg、约10mg至约500mg、约10mg至约750mg、约10mg至约1000mg、约10mg至约1500mg、约50mg至约250mg、约50mg至约500mg、约50mg至约750mg、约50mg至约1000mg、约50mg至约1500mg、约100mg至约250mg、约100mg至约500mg、约100mg至约750mg、约100mg至约1000mg、约100mg至约1500mg、约200mg至约500mg、约200mg至约750mg、约200mg至约1000mg、约200mg至约1500mg、约5mg至约1500mg、约5mg至约1000mg或约5mg至约250mg。
在本实施例的其他方面,本文所公开的药物组合物可以包括以下量的中和剂,例如,按重量计少于约90%、按重量计少于约80%、按重量计少于约70%、按重量计少于约65%、按重量计少于约60%、按重量计少于约55%、按重量计少于约50%、按重量计少于约45%、按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约15%、按重量计少于约10%、按重量计少于约5%或按重量计少于1%。在本实施例的其他方面,本文所公开的药物组合物可以包括以下量的中和剂,例如,按重量计约1%至90%、按重量计约1%至80%、按重量计约1%至75%、按重量计约1%至70%、按重量计约1%至65%、按重量计约1%至60%、按重量计约1%至55%、按重量计约1%至50%、按重量计约1%至45%、按重量计约1%至40%、按重量计约1%至35%、按重量计约1%至30%、按重量计约1%至25%、按重量计约1%至20%、按重量计约1%至15%、按重量计约1%至10%、按重量计约1%至5%、按重量计约2%至50%、按重量计约2%至40%、按重量计约2%至30%、按重量计约2%至20%、按重量计约2%至10%、按重量计约4%至50%、按重量计约4%至40%、按重量计约4%至30%、按重量计约4%至20%、按重量计约4%至10%、按重量计约6%至50%、按重量计约6%至40%、按重量计约6%至30%、按重量计约6%至20%、按重量计约6%至10%、按重量计约8%至50%、按重量计约8%至40%、按重量计约8%至30%、按重量计约8%至20%、按重量计约8%至15%、或按重量计约8%至12%。
在本实施例的其他方面中,本文所公开的药物组合物可包括以下量的中和剂:例如,按重量计约0.1%至约45%、按重量计约0.1%至约40%、按重量计约0.1%至约35%、按重量计约0.1%至约30%、按重量计约0.1%至约25%、按重量计约0.1%至约20%、按重量计约0.1%至约15%、按重量计约0.1%至约10%、按重量计约0.1%至约5%、按重量计约1%至约45%、按重量计约1%至约40%、按重量计约1%至约35%、按重量计约1%至约30%、按重量计约1%至约25%、按重量计约1%至约20%、按重量计约1%至约15%、按重量计约1%至约10%、按重量计约1%至约5%、按重量计约5%至约45%、按重量计约5%至约40%、按重量计约5%至约35%、按重量计约5%至约30%、按重量计约5%至约25%、按重量计约5%至约20%、按重量计约5%至约15%、按重量计约5%至约10%、按重量计约10%至约45%、按重量计约10%至约40%、按重量计约10%至约35%、按重量计约10%至约30%、按重量计约10%至约25%、按重量计约10%至约20%、按重量计约10%至约15%、按重量计约15%至约45%、按重量计约15%至约40%、按重量计约15%至约35%、按重量计约15%至约30%、按重量计约15%至约25%、按重量计约15%至约20%、按重量计约20%至约45%、按重量计约20%至约40%、按重量计约20%至约35%、按重量计约20%至约30%、按重量计约20%至约25%、按重量计约25%至约45%、按重量计约25%至约40%、按重量计约25%至约35%、或按重量计约25%至约30%。
可选地,本文所公开的药物组合物可包括药学上可接受的介质,所述介质有利于将活性成分处理成药学上可接受的组合物。如本文所用的,术语“药理学上可接受的载体”与“药理学载体”同义,且表示给药时基本无长期或永久有害作用并包含例如“药理学上可接受的介质、稳定剂、稀释剂、添加剂、辅助剂或赋形剂”的术语的任何载体。所述载体通常与活性化合物混合、或允许稀释或围封活性化合物,并且可为固体、半固体或液体试剂。应理解,活性成分可在所要载体或稀释剂中可溶或可作为悬浮剂传递。可使用各种药学上可接受的载体中的任一者,其包括但不限于:水介质,例如,水、盐水、甘氨酸、透明质酸等;固体载体,例如,甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖、碳酸镁等;溶剂;分散介质;包衣;抗细菌剂和抗真菌剂;等渗剂和吸收延迟剂;或任何其他非活性成分。药理学上可接受的载体的选择可取决于给药模式。除非任何药理学上可接受的载体与活性成分不相容,否则可以考虑将其用于药物上可接受的组合物。这些药物载体的特定用途的非限制性实例可发现于以下各者中:《药物剂型和药物传递系统》(Pharmaceutical Dosage Forms and Drug Delivery Systems)(Howard C.Ansel等人编辑,Lippincott Williams&Wilkins出版社,1999年第7版);REMINGTON:药物科学与实践(THE SCIENCE AND PRACTICE OF PHARMACY)(Alfonso R.Gennaro编辑,Lippincott,Williams&Wilkins,2000年第20版);Goodman&Gilman的治疗学的药理学基础(The Pharmacological Basis of Therapeutics)(Joel G.Hardman等人编辑,McGraw-Hill Professional出版社,2001年第10版);和药用赋形剂手册(Handbook of Pharmaceutical Excipients)(Raymond C.Rowe等人,APhA Publications,2003年第4版)。这些协议是常规程序,并且任何修改都在本领域普通技术人员的范围中并来自本文的教示。
本文所公开的药物组合物可选地包括,但不限于其他药学上可接受的组分(或药物组分),包括但不限于:缓冲剂、防腐剂、张力调节剂、盐、抗氧化剂、渗透压调节剂、生理物质、药理物质、填充剂、乳化剂、润湿剂、甜味剂或调味剂等等。各种缓冲剂和调节pH的手段可用于制备本文所公开的药物组合物,前提是得到的制剂是药学上可接受的。这类缓冲液包括但不限于:乙酸盐缓冲剂、柠檬酸盐缓冲剂、磷酸盐缓冲剂、中性缓冲盐水、磷酸盐缓冲盐水和硼酸盐缓冲剂。应当理解,酸或碱可按需要用于调节组合物的pH值。药学上可接受的抗氧化剂包括但不限于:焦亚硫酸钠、硫代硫酸钠、乙酰半胱氨酸、丁基化的羟基苯甲醚和丁基化的羟基甲苯。有用的防腐剂包括但不限于:苯扎氯胺、氯丁醇、硫柳汞、乙酸苯汞、硝酸苯汞、稳定化氧氯组合物和螯合剂,例如,DTPA或DTPA-双酰胺、钙DTPA和CaNaDTPA-双酰胺。用于药物组合物的张力调节剂包括但不限于:盐(例如,氯化钠、氯化钾)、甘露醇或甘油及其他药学上可接受的张力调节剂。所述药物组合物可作为盐的提供,并且能与许多酸(包括但不限于:盐酸、硫酸、醋酸、乳酸、酒石酸、苹果酸、琥珀酸等)形成盐。盐倾向于比对应的游离碱形式更溶于水或其他质子溶剂。应当理解,药理学领域已知的这些和其他物质可包括在药物组合物中。
在实施例中,本文所公开的药物组合物在室温下是固体。在本实施例的各方面,本文所公开的药物组合物可以在以下温度下调配成固体,例如,约35℃或更低、约34℃或更低、约33℃或更低、约32℃或更低、约31℃或更低、约30℃或更低、约29℃或更低、约28℃或更低、约27℃或更低、约26℃或更低、约25℃或更低、约24℃或更低、约23℃或更低、约22℃或更低、约21℃或更低、约20℃或更低、约19℃或更低、约18℃或更低、约17℃或更低、约16℃或更低、约15℃或更低、约14℃或更低、约13℃或更低、约12℃或更低、约11℃或更低、约10℃或更低、约9℃或更低、约8℃或更低、约7℃或更低、约6℃或更低、约5℃或更低、约4℃或更低、约3℃或更低、约2℃或更低、约1℃或更低、或约0℃或更低。
在本实施例的其他方面,公开的药物组合物具有以下熔点温度,例如,5℃或更高、10℃或更高、15℃或更高、16℃或更高、17℃或更高、18℃或更高、19℃或更高、20℃或更高、21℃或更高、22℃或更高、23℃或更高、24℃或更高、25℃或更高、26℃或更高、27℃或更高、28℃或更高、29℃或更高、30℃或更高、31℃或更高、32℃或更高、33℃或更高、34℃或更高、35℃或更高、36℃或更高、或37℃或更高。在本实施例的其他方面,公开的药物组合物具有在以下范围中的熔点范围,例如,约5℃至约24℃、约10℃至约24℃、约22℃至约24℃、约23℃至约25℃、约24℃至约26℃、约25℃至约27℃、约26℃至约28℃、约27℃至约29℃、约28℃至约30℃、约29℃至约31℃、约30℃至约32℃、约31℃至约33℃、约32℃至约34℃、约33℃至约35℃、约34℃至约36℃、或约35℃至约37℃。在本实施例的其他方面,公开的药物组合物具有在以下范围中的熔点温度,例如,约22℃至约26℃、约24℃至约28℃、约26℃至约30℃、约28℃至约32℃、约30℃至约34℃、约32℃至约36℃、或约34℃至约38℃。
本发明的各方面部分地公开了制备本文所公开的固溶体药物组合物的方法。在一个实施例中,本文所公开的方法包括以下步骤:a)将本文所公开的治疗性化合物与一种或多种室温液体脂质在允许治疗性化合物溶于一种或多种脂质的条件下接触;以及b)将化合物/脂质溶液与本文所公开的一种或多种室温固体脂质在允许形成固溶体组合物的条件下接触。
在一个实施例中,本文所公开的方法包括以下步骤:a)将本文所公开的治疗性化合物与一种或多种室温液体脂质和一种或多种稳定剂在允许治疗性化合物溶于一种或多种脂质中的条件下接触;以及b)将化合物/脂质溶液与本文所公开的一种或多种室温固体脂质在允许形成固溶体组合物的条件下接触。
在一个实施例中,本文公开的方法包括以下步骤:a)将本文所公开的治疗性化合物与一种或多种室温液体脂质和一种或多种稳定剂在允许治疗性化合物溶于一种或多种脂质中的条件下接触;以及b)将化合物/脂质溶液与本文所公开的一种或多种室温固体脂质在允许形成固溶体组合物的条件下接触。
在一个实施例中,本文所公开的方法包括以下步骤:a)将本文所公开的治疗性化合物与一种或多种室温液体脂质、一种或多种稳定剂以及一种或多种中和剂在允许治疗性化合物溶于一种或多种脂质中的条件下接触;以及b)将化合物/脂质溶液与本文所公开的一种或多种室温固体脂质在允许形成固溶体组合物的条件下接触。
本文所公开的方法在允许治疗性化合物溶解于其他化合物中的条件下进行。在本实施例的各方面,本文所公开的方法可以足以使治疗性化合物溶于一种或多种室温液体脂质、和/或一种或更多种稳定剂、和/或一种或多种中和剂中以形成溶液的温度下进行。在本实施例的其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至(例如)约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、或约75℃的温度。在本实施例的其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至(例如)至少40℃、至少45℃、至少50℃、至少55℃、至少60℃、至少65℃、至少70℃、或至少75℃的温度。在本实施例的又一其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至(例如)至多40℃、至多45℃、至多50℃、至多55℃、至多60℃、至多65℃、至多70℃、或至多75℃的温度。在本实施例的其他方面中,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至(例如)约40℃至约45℃、约40℃至约50℃、约40℃至约55℃、约40℃至约60℃、约40℃至约65℃、约40℃至约70℃、约40℃至约75℃、约45℃至约50℃、约45℃至约55℃、约45℃至约60℃、约45℃至约65℃、约45℃至约70℃、约45℃至约75℃、约50℃至约55℃、约50℃至约60℃、约50℃至约65℃、约50℃至约70℃、约50℃至约75℃、约55℃至约60℃、约55℃至约65℃、约55℃至约70℃、约55℃至约75℃、约60℃至约65℃、约60℃至约70℃、约60℃至约75℃、约65℃至约70℃、约65℃至约75℃、或约70℃至约75℃的温度。
在本实施例的其他方面,本文所公开的方法可在足以使得一种或多种室温固体脂质与包括治疗性化合物的溶液混合的温度下进行。在本实施例的其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至例如约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃或约75℃的温度以便与一种或多种室温固体脂质混合。在本实施例的又一其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至例如至少40℃、至少45℃、至少50℃、至少55℃、至少60℃、至少65℃、至少70℃或至少75℃的温度以便与一种或多种室温固体脂质混合。在本实施例的又一其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至例如至多40℃、至多45℃、至多50℃、至多55℃、至多60℃、至多65℃、至多70℃、或至多75℃的温度以便与一种或多种室温固体脂质混合。在本实施例的其他方面,本文所公开的方法包括将包括本文所公开的治疗性化合物的混合物加热至以下温度以便与一种或多种室温固体脂质混合,所述温度例如约40℃至约45℃、约40℃至约50℃、约40℃至约55℃、约40℃至约60℃、约40℃至约65℃、约40℃至约70℃、约40℃至约75℃、约45℃至约50℃、约45℃至约55℃、约45℃至约60℃、约45℃至约65℃、约45℃至约70℃、约45℃至约75℃、约50℃至约55℃、约50℃至约60℃、约50℃至约65℃、约50℃至约70℃、约50℃至约75℃、约55℃至约60℃、约55℃至约65℃、约55℃至约70℃、约55℃至约75℃、约60℃至约65℃、约60℃至约70℃、约60℃至约75℃、约65℃至约70℃、约65℃至约75℃或约70℃至约75℃。
本说明书的方面部分地公开了使本文所公开的治疗性化合物与一种或多种脂质接触。在本实施例的各方面,一种或多种脂质包括本文所公开的一、二、三、四或五种不同的脂质。在本实施例的其他方面,一种或多种脂质包括本文所公开的两种或更多种、三种或更多种、四种或更多种或者五种或更多种脂质。在此实施例的又一其他方面,一种或多种脂质包括本文所公开的约一至约五种不同的脂质、本文所公开的约二至约五种不同的脂质、本文所公开的约三至约五种不同的脂质、本文所公开的约一至约四种不同的脂质、本文所公开的约二至约四种不同的脂质、本文所公开的约二至约三种不同的脂质。
在本实施例的其他方面,一种或多种脂质包括一种或多种室温固态脂质和一种或多种室温液体脂质。在本实施例的各方面,一种或多种脂质包括本文所公开的一、二、三、四或五种不同硬脂和本文所公开的一、二、三、四或五种不同的室温液体脂质。在本实施例的其他方面,一种或多种脂质包括本文所公开的两种或更多种、三种或更多种、四种或更多种或者五种或更多种不同的室温固体脂质和本文所公开的两种或更多种、三种或更多种、四种或更多种或者五种或更多种不同的室温液体脂质。在在本实施例的又一其他方面,一种或多种脂质包括本文所公开的约一至约五种不同的硬脂、本文所公开的约二至约五种不同的室温固体脂质、本文所公开的约三至约五种不同的室温固体脂质、本文所公开的约一至约四种不同的室温固体脂质、本文所公开的约二至约四种不同的室温固体脂质、或本文所公开的约二至约三种不同的室温固体脂质、和本文所公开的约一至约五种不同的室温液体脂质、本文所公开的约二至约五种不同的室温液体脂质、本文所公开的约三至约五种不同的室温液体脂质、本文所公开的约一至约四种不同的室温液体脂质、本文所公开的约二至约四种不同的室温液体脂质、或本文所公开的约二至约三种不同的室温液体脂质。
在本实施例的各方面,本文所公开的方法可以按固体脂质与液体脂质的比率使用室温固体脂质和室温液体脂质,所述比率例如为至少1:1、至少2:1、至少3:1、至少4:1、至少5:1、至少6:1、至少7:1、至少8:1、至少9:1、至少10:1、至少15:1、至少20:1。在本施例的其他方面,本文所公开的方法可以按固体脂质与液体脂质的比率使用室温固体脂质和室温液体脂质,所述比率例如为约1:1至约20:1、约5:1至约20:1、约2:1至约15:1、约5:1至约15:1、约4:1至约12:1、或约6:1至约10:1。
在本实施例的各方面,本文所公开的方法可以按总固体脂质与总液体脂质的比率使用多个室温固体脂质和多个室温液体脂质,所述比率例如为至少1:1、至少2:1、至少3:1、至少4:1、至少5:1、至少6:1、至少7:1、至少8:1、至少9:1、至少10:1、至少15:1、或至少20:1。在本实施例的其他方面,本文所公开的方法可以按总固体脂质与总液体脂质的比率使用多个室温固体脂质和多个室温液体脂质,所述比率例如为约1:1至约20:1、约5:1至约20:1、约2:1至约15:1、约5:1至约15:1、约4:1至约12:1、或约6:1至约10:1。
使治疗性化合物和一种或多种脂质接触可以包括例如通过搅拌、倒置、超声处理、或涡流搅拌进行混合。所述混合可以进行例如至少1秒、至少5秒、至少10秒、至少20秒、至少30秒、至少45秒、至少60秒、或更多时间,直到治疗性化合物完全溶于脂质/乙二醇聚合物混合物。
本说明书的方面部分地公开了使化合物/脂质溶液与本文所公开的一种或多种乙二醇聚合物接触。
本文所公开的方法是在允许固溶体组合物固化的条件下进行。在本实施例的各方面,所述方法可以在足以使组合物冷却到溶液固化的温度下进行。
在某些实施例中,快速冷却步骤可用于在本文所公开的药物组合物形成之后降低其温度。例如,快速冷却步骤可用于在使用高于室温的温度允许治疗性化合物完全溶解于药学上可接受的溶剂中和/或允许包括治疗性化合物的溶液形成药物组合物的工艺中。在本实施例的各方面中,快速冷却步骤导致温度降低,例如,在20分钟内降低约30℃、在20分钟内降低约25℃、在20分钟内降低约20℃、在20分钟内降低约15℃、在15分钟内降低约30℃、在15分钟内降低约25℃、在15分钟内降低约20℃、在15分钟内降低约15℃、在10分钟内降低约30℃、在10分钟内降低约25℃、在10分钟内降低约20℃、在10分钟内降低约15°、在5分钟内降低约30℃、在5分钟内降低约25℃、在5分钟内降低约20℃、在5分钟内降低约15℃。在本实施例的其他方面中,快速冷却步骤导致温度降低,例如,在20分钟内降低约20℃至约30℃、在15分钟内降低约20℃至约30℃、在10分钟内降低约20℃至约30℃、在5分钟内降低约20℃至约30℃、在20分钟内降低约15℃至约25℃、在15分钟内降低约15℃至约25℃、在10分钟内降低约15℃至约25℃、在5分钟内降低约15℃至约25℃、在20分钟内降低约10℃至约20℃、在15分钟内降低约10℃至约20℃、在10分钟内降低约10℃至约20℃、或在5分钟内降低约10℃到约20℃。
在本实施例的其他方面中,快速冷却步骤导致温度降低,例如,约2.0℃/min、约1.9℃/min、约1.8℃/min、约1.7℃/min大、约1.6℃/min、约1.5℃/min、约1.4℃/min、约1.3℃/min、约1.2℃/min、约1.1℃/min、约1.0℃/min、约0.9℃/min、约0.8℃/min、约0.7℃/min、约0.6℃/min、约0.5℃/min、约0.4℃/min、约0.3℃/min、约0.2℃/min、或约0.1℃/min。在本实施例的方面中,快速冷却步骤导致温度降低,例如,约0.1℃至约0.4℃/min、约0.2℃至约0.6℃/min、约0.4℃至约0.8℃/min、约0.6℃至约1.0℃/min、约0.8℃至约1.2℃/min、约1.0℃至约1.4℃/min、约1.2℃至约1.6℃/min、约1.4℃至约1.8℃/min、约1.6℃至约2.0℃/min、约0.1℃至约0.5℃/min、约0.5℃至约1.0℃/min、约1.0℃至约1.5℃/min、约1.5℃至约2.0℃/min、约0.5℃至约1.5℃/min、或约1.0℃至约2.0℃/min。
本文公开的制剂导致脂质固溶体和治疗性化合物的形成。这些制剂不形成脂质体乳剂和/或微胶粒颗粒和/或其他类型的多相组合物。此外,这种制剂不需要亲水溶剂,例如,水或缓冲溶液。因此,本文所公开的药物组合物不需要用亲水溶剂配制。在实施例中,本文所公开的药物组合物不包括药学上可接受的亲水性溶剂。
在本文所公开的方法中使用的治疗性化合物、室温液体脂质、室温固体脂质(硬脂)、稳定剂和中和剂的量可以是所需的任意量。用于确定所使用的每一个组分的量的因素包括但不限于:药物组合物中所需的治疗性化合物的最终量、溶液中中的治疗性化合物的所需浓度、治疗性化合物的疏水性、治疗性化合物的疏油性、所要的药物组合物的最终量和用于生产固溶体药物组合物的条件。
在一个实施例中,药物组合物包括一种或多种治疗性化合物、室温固体脂质或硬脂、和一个或多个室温液体脂质,但是不包括药学上可接受的亲水溶剂。
在一个实施例中,药物组合物包括包括一种或多种治疗性化合物、一种或多种室温固体脂质或硬脂、一种或多种室温液体脂质、和一种或多种稳定剂,但是不包括药学上可接受的亲水溶剂。在本实施例的各个方面,固溶体药物组合物包括治疗性化合物、室温固体脂质或硬脂、室温液体脂质,和液体二元醇聚合物和/或一元醇,和/或异山梨醇二甲醚,和/或二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇),但是不包括药学上可接受的亲水性溶剂。在本实施例的其他方面,固溶体药物组合物包括治疗性化合物、甘油三酯混合物、甘油单酯混合液,和液体PEG聚合物和/或C1-C5一元醇,和/或异山梨醇二甲醚,和/或二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇),但是不包括药学上可接受的亲水性溶剂在本实施例的其他方面,药物组合物包括治疗性化合物、(Gattefosse)、(Gattefosse),和液体PEG聚合物和/或C1-C5一元醇、和/或异山梨醇二甲醚、和/或二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇),但是不包括药学上可接受的亲水性溶剂,所述是熔点在41℃至45℃之间并包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质),所述是甘油基单亚油酸酯。
在本实施例的各方面,固溶体组合物包括按重量计约1%到约55%的治疗性化合物、按重量计约40%到约90%的室温固体脂质或硬脂、按重量计约1%到约10%室温液体脂质和约1%到约5%的稳定剂。在本实施例的各方面,固溶体组合物包括按重量计约1%到约55%的治疗性化合物、按重量计约40%到约90%的室温固体脂质或硬脂、按重量计约1%到约10%的室温液体脂质,和约1%到约5%的液体二元醇聚合物和/或一元醇、和/或异山梨酯二甲醚、和/或二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇)。在本实施例的其他方面,固溶体组合物包括按重量计约5%到约50%的治疗性化合物、按重量计约40%到约70%的室温固体脂质或硬脂、按重量计约1%到约7%的室温液体脂质,和约1%到约3%的液体二元醇聚合物和/或一元醇、和/或异山梨酯二甲醚、和/或二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇)。
在一个实施例中,药物组合物包括一种或多种治疗性化合物、一种或多种室温固体脂质或硬脂、一种或多种室温液体脂质和一种或多种中和剂,但是不包括药学上可接受的亲水溶剂。在本实施例的其他方面,固溶体药物组合物包括治疗性化合物、室温固体脂质或硬脂、室温液体脂质以及脂肪酸,但是不包括药学上可接受的亲水性溶剂。在本实施例的其他方面,固溶体药物组合物包括治疗性化合物、甘油三酯混合物、甘油单酯混合物以及C16-C18脂肪酸,但是不包括药学上可接受的亲水性溶剂。在本实施例的其他方面,药物组合物包括治疗性化合物、(Gattefosse)、(Gattefosse)和硬脂酸,但是不包括药学上可接受的亲水性溶剂,所述是熔点在41℃至45℃之间并包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质),所述是甘油基单亚油酸酯。
在本实施例的各方面,固溶体组合物包括按重量计约1%到约55%的治疗性化合物、按重量计约30%到约70%的室温固体脂质或硬脂、按重量计约1%到约10%的室温液体脂质,和约1%到约55%的中和剂。在本实施例的其他方面,固溶体组合物包括按重量计约1%到约55%的治疗性化合物、按重量计约30%到约70%的室温固体脂质或硬脂、按重量计约1%到约10%的室温液体脂质,和约1%到约55%的脂肪酸。在本实施例的另外其他方面,固溶体组合物包括按重量计约5%到约50%的治疗性化合物、按重量计约30%到约60%的室温固体脂质或硬脂、按重量计约1%到约7%的室温液体脂质,和约5%到约50%的脂肪酸。
在本实施例的其他方面,固溶体药物组合物包括一种或多种治疗性化合物、一种或多种室温固体脂质或硬脂、一种或多种室温液体脂质和三乙醇胺,但不包括药学上可接受的亲水性溶剂。在本实施例的另外其他方面,固溶体药物组合物包括治疗性化合物、甘油三酯混合物、甘油单酯混合物以及三乙醇胺,但是不包括药学上可接受的亲水性溶剂。在本实施例的又一其他方面,药物组合物包括治疗性化合物、(Gattefosse)、(Gattefosse)和三乙醇胺,但是不包括药学上可接受的亲水性溶剂,所述是熔点在41℃至45℃之间并包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质),所述是甘油基单亚油酸酯。
在本实施例的各方面,固溶体组合物包括按重量计约1%到约55%的治疗性化合物、按重量计约30%到约70%的室温固体脂质或硬脂、按重量计约1%到约10%室温液体脂质和约1%到约55%的三乙醇胺。在本实施例的其他方面,固溶体组合物包括按重量计约5%到约50%的治疗性化合物、按重量计约30%到约60%的室温固体脂质或硬脂、按重量计约1%到约7%室温液体脂质,和约5%到约50%的三乙醇胺。
在一个实施例中,药物组合物包括一种或多种治疗性化合物、室温固体脂质或硬脂、一种或多种室温液体脂质、一种或多种稳定剂和一种或多种中和剂,但不包括药学上可接受的亲水性溶剂。
本说明书的方面部分地公开了一种治疗具有心血管疾病的个体的方法。在一个实施例中,所述方法包括向需要本文所公开的药物组合物的个体施给所述药物组合物的步骤,其中给药减轻了与心血管疾病相关联的症状,从而治疗所述个体。
本说明书的各方面部分地公开了一种治疗患有心血管疾病的个体的方法。如本文所使用,术语“治疗”是指减少或消除个体中心血管疾病的临床症状;或延迟或预防个体中心血管疾病的临床症状的发作。例如,术语“治疗”可指减少以心血管疾病为特征的疾病的症状,例如,减少至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、或至少100%。与心血管疾病相关联的实际症状是众所周知的,且能够由本领域一般技术人员通过考虑以下因素而确定,所述因素包括但不限于:心血管疾病的部位、心血管疾病的起因、心血管疾病的严重度,和/或心血管疾病对所述组织或器官的影响。本领域技术人员将知道与特殊类型的心血管疾病相关联的适当症状或指标,并将知道如何确定个体是否是如本文所公开的治疗的候选者。
心血管疾病是大量特异性疾病中的任一种,其影响心脏本身和/或血管系统,尤其是进入和离开心脏的静脉和动脉。已知和/或与心血管疾病相关联的原因包括但不限于:两个最小脂蛋白质LDL和HDL不健康的比例、高血脂症、升高的血糖水平、上限正常或高血压、Lp-PLA2、脂蛋白(a)和高半胱氨酸过多症。影响心脏的心血管病症的症状包括但不限于:胸痛或胸部不适、和一只或两只手臂、一个或两个肩、颈部、颚或后背疼痛、呼吸短促、眩晕、快速心跳、恶心、异常心跳、疲劳和/或心肌梗塞。影响脑的心血管病症的症状包括但不限于:面部、一或两只手臂或一条或两条腿突然的麻木或虚弱、突然精神错乱或讲话或言语理解故障,突然单眼或双眼视觉障碍、突然头晕,行走困难或者平衡或共济失调、和/或不明原因的突然严重头痛。影响一条或两条腿、骨盆,一只或两只手臂,和/或肩部的心血管疾病的症状包括但不限于:肌肉疼痛,肌肉痉挛,一只或两只腿和/或脚趾、一只或两只手和/或手指的冷感觉,和/或一只或两只腿和/或脚趾、一只或两只手和/或手指麻木或虚弱。
存在超过60类的心血管疾病,包括但不限于:高脂血症、冠心病、动脉粥样硬化、外周血管疾病、心肌病、炎症性心脏病、缺血性心脏病、充血性心力衰竭、高血压性心脏病、心脏瓣膜病、高血压、心肌梗塞、糖尿病心脏病、动脉瘤、栓塞、剥离(dissection)、假性动脉瘤、血管畸形、血管痣、血栓形成、静脉曲张和中风。
在一个实施例中,心血管疾病包括高脂血症。高脂血症(或高脂蛋白血症)指的是血液中脂质和/或脂蛋白水平的异常升高。当由特殊遗传基因异常引起时,高脂血症可以分类为家族性(或原发性),当由另一潜在病症导致时其可分类为获得性(或次生性),或当出于不明原因时其可分类为自发性的。高脂血症也可以基于哪一类型的脂质和/或脂蛋白被升高而进行分类。高脂血症的非限制性实例包括血脂异常、高胆固醇血症、高甘油酯血症、高甘油三酸酯血症、高脂蛋白血症、和高乳糜微粒血症、和混合型高脂血症。高脂蛋白血包括例如高脂蛋白血类型Ia、高脂蛋白血类型Ib、高脂蛋白血类型Ic、高脂蛋白血类型IIa、高脂蛋白血类型IIb、高脂蛋白血Ⅲ型、高脂蛋白血类型IV和高脂蛋白血类型V。
在另一个实施例中,心血管疾病包括冠心病。冠心病指的以所述冠状循环向心肌和周围组织的充足血流供给失败为特征的状况。通常由冠状动脉的狭窄或封闭所引起,例如,冠状动脉粥样硬化性心脏病、冠状动脉痉挛,和/或冠状动脉狭窄。胸痛和心肌梗死是冠心病的常见症状并是由冠心病所引起的状况。
在另一个实施例中,心血管疾病包括血管闭塞疾病(VOD)。VOD是指以血管阻塞为特征的状况。VOD包括但不限于:动脉粥样硬化、外周血管病和狭窄。
在此实施例的一方面中,VOD包含动脉粥样硬化。动脉粥样硬化是指以胆固醇和脂肪沉积物(称为斑块)在动脉内壁的累积为特征的状况。这些斑块可以通过物理上阻塞动脉或通过引起异常动脉音调和功能来限制流到心肌的血流。动脉粥样硬化斑块破裂是局部缺血的最常见的原因。
在本实施例的一方面,VOD包括周围血管疾病(PVD)。周围血管疾病(PVD),也称为周围动脉疾病(PAD)或外周动脉闭塞性疾病(PAOD),是指以不在冠状动脉、主动脉弓血管或脑内的大动脉阻塞为特征的状况。PVD可以起因于动脉粥样硬化、导致狭窄、栓塞或血栓形成的炎症性过程。其引起急性或慢性局部缺血。PVD还包括分类为微血管疾病的疾病子集,所述微血管疾病是由动脉偶发性变窄(例如,雷诺氏现象)或是由,动脉变宽(例如血管痉挛)所引起的。PVD的症状包括但不限于:疼痛、衰弱、麻木、或由于血流降低引起的肌肉痉挛、褥疮、伤口、或愈合缓慢或根本不愈合的溃疡、四肢发青或苍白、四肢发凉、受损肢体和趾毛发和指甲生长缓慢。约20%的轻度PAD患者可能是无症状的。
在另一个实施例中,心血管疾病包括心肌病。心肌病是指以心肌功能退化为特征的状况。症状和病症可以模拟几乎任何形式的那些心脏病,并包括胸痛和EKG异常情况。轻度心肌病经常无症状。更严重的情况与心力衰竭、心律失常、系统性栓塞和/或心脏性猝死相关联。心肌症可在功能上分类为涉及扩张、肥大或限制。
心肌病还可以分类为外因或者内因的。外因心肌病是指一种心肌病,其主要病理是心肌本身以外的。例如,外因心肌病可以由代谢/存储疾病、内分泌失调、神经肌肉疾病、营养失调、炎症、毒性(包括药物和乙醇)、局部缺血、和/或感染(包括丙型肝炎)引起。外因心肌病的非限制性实例包括:肢端肥大症、酒精性心肌病、淀粉样变性、美洲锥虫病、化疗、糖尿病心肌病、血色沉着症、高血压心肌病、甲状腺机能亢进、炎症性心肌病、缺血性心肌病、肌营养不良症、瓣膜性心肌病、继发系统性代谢心肌病、继发系统性营养疾病心肌病、冠心病和先天性心脏病。
内因型心肌病指的其中存在不是由可识别的外因所导致的心肌无力(即原因不明)的心肌病。内因型心肌病包括由于自身自发性质所导致的各种疾病状况,且可分类为遗传性、混合性或获得性。内因型心肌病的非限制实例包括扩张性心肌病(DCM)、肥大性心肌病(HCM或HOCM))、致心律失常性右心室心肌病(ARVC)、限制性心肌病(RCM)、致密化不全心肌病、孤立心肌致密化不全、线粒体肌病、应激性心肌病和莱夫勒(Loeffler)心内膜炎。
在另一个实施例中,心血管疾病包括脉管炎。脉管炎是由于白细胞游出和生成物损坏导致的一组具有血管壁炎症的不同的病症,所述血管包括淋巴管和如静脉(静脉炎)、动脉(动脉炎)和毛细血管的血管。所述炎症可以影响来自体内任何地方的任意尺寸的血管壁。其可以影响动脉和/或静脉。炎症可以是局灶性炎,意味着其影响血管内单个位置;或者其还可以广泛传播,其中炎症区域分散于特定器官或组织,乃至影响人体中一种以上的器官。脉管炎包括但不限于:伯格式病(血栓闭塞性血管炎)、脑血管炎(中枢神经系统脉管炎)、变应性肉芽肿(Churg-Strauss)动脉炎、冷球蛋白血症、原发性冷球蛋白性脉管炎、巨细胞动脉炎(颞动脉炎)、高尔夫球手脉管炎、亨-舍二氏紫癜、过敏性脉管炎(变应性脉管炎)、川崎病、微小多动脉炎/多脉管炎、结节性多动脉炎、风湿性多肌痛症(PMR)、类风湿性脉管炎、大动脉炎、血栓性静脉炎、韦格纳氏肉芽肿病和脉管炎继发性结缔组织疾病如系统性红斑狼疮(SLE)、类风湿关节炎(RA)、复发性多软骨炎、贝赛特氏症,或其他结缔组织疾病、继发性病毒性感染血管炎。
在另一个实施例中,心血管疾病包括一种炎症性心脏病。炎症性心脏病是指以在其周围的心肌和/或组织的发炎为特征的状况。炎症性心脏病的非限制实例包括心内膜炎、炎症性心肥大以及心肌炎。
在另一个实施例中,心血管疾病包括缺血性心脏病。缺血性心脏病或心肌局部缺血是指以通常由于冠状动脉狭窄或阻塞而使得心肌的血液供应减少为特征的状况。缺血性心脏病的症状包括在寒冷天气下或情绪情况下活动时胸痛、急性胸痛、急性冠脉综合症、不稳定型心绞痛、心肌梗死、心衰、呼吸困难或肢体肿胀。
在另一个实施例中,心血管疾病包括充血性心衰。充血性心衰或充血性心力衰竭是指特以并非起因于削弱心脏填充或泵送足够量的血液到身体中的能力的任何结构上或功能上的心脏疾病的心脏异常为特征的状况。
在另一个实施例中,心血管疾病包括高血压心脏病。高血压心脏病是指以高血压、特别是局部高血压为特征的状况。可以由高血压心脏病引起的状况包括但不限于左室肥大、冠心病、充血性心衰、高血压心肌病,以及心律失常。
在另一个实施例中,心血管疾病包括瓣膜性心脏病。瓣膜性心脏病是指以心脏的一个或多个瓣膜不起作用为特征的状况。可能受心脏瓣膜病影响的主要心脏瓣膜包括但不限于三尖瓣、右主动脉瓣、二尖瓣以及左主动脉瓣。
将组合物或化合物施用到个体。个体通常是人类。通常,任何候选进行常规的血管疾病治疗的个体,是进行本文所公开的心血管疾病治疗的候选者。术前评估通常包括除公开所有的相关风险和程序的利益的彻底的知情同意之外的常规的病史与身体检查。
本文所公开的药物组合物可包括治疗有效量的治疗性化合物。如本文中所使用,术语“有效量”与“治疗有效量”、“有效剂量”、“治疗有效剂量”同义,并且当关于治疗心血管疾病使用时是指达到理想治疗效果所必需的本文所公开的治疗性化合物的最小剂量,并包括足以减少与心血管疾病相关联的症状的剂量。本文所公开的治疗性化合物治疗心血管疾病的效力可以通过观察基于一种或多种临床症状的个体的改善和/或与所述条件相关联的生理指标来确定。心血管疾病的改善而且也可用同时治疗需求降低来表示。
本文所公开的施用给个体以用于治疗特定心血管疾病的治疗性化合物的有效量可以由本领域一般技术人员通过考虑以下因素确定,所述因素包括但不限于:心血管疾病的类型、心血管疾病的部位、心血管疾病的原因、心血管疾病的严重性、所需缓解程度、所需缓解持续时间、所用的特定的治疗性化合物、所用治疗性化合物的排出速度、所用治疗性化合物的药效学、组合物中所包括的其他化合物的性质、特定的制剂、特定的给药途径、病人的特定性质、病史和危险因子,例如,年龄、体重、总体健康等等或其任何结合。另外,当治疗性化合物反复使用时,治疗性化合物的有效量将另外取决于以下因素,所述因素包括但不限于:给药频率、治疗性化合物的半衰期或其任何结合。如本技术领域内的一般技术人员已知的,本文所公开的治疗性化合物的有效量可以在向人体施药之前通过体外测定和使用动物模型体内给药研究来推断。
在此实施例的方面,本文中所公开的治疗性化合物的治疗有效量减轻与心血管疾病相关联的症状,减轻了例如至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。在此实施例的其他方面中,本文所公开的治疗性化合物的治疗有效量减轻与心血管疾病相关联的症状,减轻了例如至多10%、至多15%、至多20%、至多25%、至多30%、至多35%、至多40%、至多45%、至多50%、至多55%、至多60%、至多65%、至多70%、至多75%、至多80%、至多85%、至多90%、至多95%或至多100%。在此实施例的又一其他方面中,本文所公开的治疗性化合物的治疗有效量减轻与心血管疾病相关联的症状,减轻了例如约10%至约100%、约10%至约90%、约10%至约80%、约10%至约70%、约10%至约60%、约10%至约50%、约10%至约40%、约20%至约100%、约20%至约90%、约20%至约80%、约20%至约20%、约20%至约60%、约20%至约50%、约20%至约40%、约30%至约100%、约30%至约90%、约30%至约80%、约30%至约70%、约30%至约60%,或约30%至约50%。
在此实施例的其他方面中,本文所公开的治疗性化合物的治疗有效量通常在约0.001mg/kg/天至约100mg/kg/天的范围中。在此实施例的方面中,本文所公开的治疗性化合物的有效量可以是例如至少0.001mg/kg/天、至少0.01mg/kg/天、至少0.1mg/kg/天、至少1.0mg/kg/天、至少5.0mg/kg/天、至少10mg/kg/天、至少15mg/kg/天、至少20mg/kg/天、至少25mg/kg/天、至少30mg/kg/天、至少35mg/kg/天、至少40mg/kg/天、至少45mg/kg/天,或至少50mg/kg/天。在此实施例的其他方面中,本文所公开的治疗性化合物的有效量可以在以下范围中,例如,约0.001mg/kg/天至约10mg/kg/天、约0.001mg/kg/天至约15mg/kg/天、约0.001mg/kg/天至约20mg/kg/天、约0.001mg/kg/天至约25mg/kg/天、约0.001mg/kg/天至约30mg/kg/天、约0.001mg/kg/天至约35mg/kg/天、约0.001mg/kg/天至约40mg/kg/天、约0.001mg/kg/天至约45mg/kg/天、约0.001mg/kg/天至约50mg/kg/天、约0.001mg/kg/天至约75mg/kg/天,或约0.001mg/kg/天至约100mg/kg/天。在此实施例的其他方面中,本文所公开的治疗性化合物的有效量可以在以下范围内,例如,约0.01mg/kg/天至约10mg/kg/天、约0.01mg/kg/天至约15mg/kg/天、约0.01mg/kg/天至约20mg/kg/天、约0.01mg/kg/天至约25mg/kg/天、约0.01mg/kg/天至约30mg/kg/天、约0.01mg/kg/天至约35mg/kg/天、约0.01mg/kg/天至约40mg/kg/天、约0.01mg/kg/天至约45mg/kg/天、约0.01mg/kg/天至约50mg/kg/天、约0.01mg/kg/天至约75mg/kg/天,或约0.01mg/kg/天至约100mg/kg/天。在此实施例的其他方面中,本文所公开的治疗性化合物的有效量可以在以下范围内,例如,约0.1mg/kg/天至约10mg/kg/天、约0.1mg/kg/天至约15mg/kg/天、约0.1mg/kg/天至约20mg/kg/天、约0.1mg/kg/天至约25mg/kg/天、约0.1mg/kg/天至约30mg/kg/天、约0.1mg/kg/天至约35mg/kg/天、约0.1mg/kg/天至约40mg/kg/天、约0.1mg/kg/天至约45mg/kg/天、约0.1mg/kg/天至约50mg/kg/天、约0.1mg/kg/天至约75mg/kg/天,或约0.1mg/kg/天至约100mg/kg/天。
在本实施例的其他方面,本文所公开的治疗性化合物的有效量可以在以下范围中,例如,约1mg/kg/天至约10mg/kg/天、约1mg/kg/天至约15mg/kg/天、约1mg/kg/天至约20mg/kg/、约1mg/kg/天至约25mg/kg/天、约1mg/kg/天至约30mg/kg/天、约1mg/kg/天至约35mg/kg/天、约1mg/kg/天至约40mg/kg/天、约1mg/kg/天至约45mg/kg/天、约1mg/kg/天至约50mg/kg/天、约1mg/kg/天至约75mg/kg/天、或约1mg/kg/天至约100mg/kg/天。在本实施例的其他方面,本文所公开的治疗性化合物的有效量可以在以下范围中,例如,约5mg/kg/天至约10mg/kg/天、约5mg/kg/天至约15mg/kg/天、约5mg/kg/天至约20mg/kg/天、约5mg/kg/天至约25mg/kg/天、约5mg/kg/天至约30mg/kg/天、约5mg/kg/天至约35mg/kg/天、约5mg/kg/天至约40mg/kg/天、约5mg/kg/天至约45mg/kg/天、约5mg/kg/天至约50mg/kg/天、约5mg/kg/天至约75mg/kg/天、或约5mg/kg/天至约100mg/kg/天。
剂量可以是单一剂量或累积的(连续给药),并可由本领域技术人员容易地确定。例如,心血管疾病的治疗可以包括本文所公开的药物组合物的有效剂量的一次性施用。或者,心血管疾病的治疗可以包括药物组合物的有效剂量的在一定时间范围内的多次施用,例如,每天一次、每天两次、每天三次、隔几天一次或者每周一次。给药时间可以在个体与个体之间变化,这取决于个体症状的严重程度等因素。例如,可将本文所公开的药物组合物的有效剂量每日一次施给个体达不确定的时间段内,或者直到个体不再需要治疗。本领域中一般技术人员将认识到在治疗期间需要监视个体,且可相应调整所施用的本文所公开的药物组合物的有效量。
在一个实施例中,在给个体给药之后,包括本文所公开的治疗性化合物的药物组合物导致所述治疗性化合物的生物分布不同于包括在除了没有本文所公开的辅助剂的相同药物组合物中的所述治疗性化合物的生物分布。
在另一个实施例中,在向个体给药后,本文所公开的药物组合物的治疗性化合物被传递到巨噬细胞。巨噬细胞是被认为控制炎症反应所涉及的关键细胞类型之一。所得的存在于巨噬细胞中具有使脂质水平正常化的活性和/或抗炎活性的高水平的治疗性化合物导致对心血管疾病的临床上有效的治疗。在本实施例的一方面中,在对个体给药后,将本文所公开的药物组合物的治疗性化合物的治疗有效量优先传递到巨噬细胞。在本实施例的其他方面中,在对个体给药后,将本文所公开的药物组合物的治疗性化合物实质上传递到巨噬细胞。在本实施例的其他方面中,在对个体给药后,被传递到巨噬细胞的本文所公开的药物组合物的治疗性化合物的量为包含在所施给的药物组合物中的治疗性化合物的总量的(例如)至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。在本实施例的又一其他方面中,在对个体给药后,被传递至巨噬细胞的本文所公开的药物组合物的治疗性化合物的量是在包含在所给药的药物组合物内的治疗性化合物总量的以下范围中,例如,约5%至约100%、约10%至约100%、约15%至约100%、约20%至约100%、约25%至约100%、约30%至约100%、约35%至约100%、约40%至约100%、或约45%至约100%、约50%至约100%、约5%至约90%、约10%至约90%、约15%至约90%、约20%至约90%、约25%至约90%、约30%至约90%、约35%至约90%、约40%至约90%、约45%至约90%、约50%至约90%、约5%至约80%、约10%至约80%、约15%至约80%、约20%至约80%、约25%至约80%、约30%至约80%、约35%至约80%、约40%至约80%、约45%至约80%、约50%至约80%、约5%至约70%、约10%至约70%、约15%至约70%、约20%至约70%、约25%至约70%、约30%至约70%、约35%至约70%、约40%至约70%、约45%至约70%、或约50%到约70%。
在另一个实施例中,在对个体给药之后,本文所公开的药物组合物减轻了胃刺激。在此实施例的方面中,本文所公开的药物组合物显著地减轻了胃刺激。在又一个实施例中,在对个体给药之后,与除了没有药学上可接受的辅助剂的同样的本文所公开的药物组合物相比,本文所公开的药物组合物减轻了胃刺激。在此实施例的方面中,在对个体给药之后,与除了没有药学上可接受的辅助剂的同样的本文所公开的药物组合物相比,本文所公开的药物组合物显著地减轻了胃刺激。在此实施例的其他方面,本文所公开的药物组合物减轻了胃刺激,减轻了例如至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。在此实施例的其他方面中,本文所公开的药物组合物在一定范围内减轻了胃刺激,所述范围例如约5%至约100%、约10%至约100%、约15%至约100%、约20%至约100%、约25%至约100%、约30%至约100%、约35%至约100%、约40%至约100%、约45%至约100%、约50%至约100%、约5%至约90%、约10%至约90%、约15%至约90%、约20%至约90%、约25%至约90%、约30%至约90%、约35%至约90%、约40%至约90%、约45%至约90%、约50%至约90%、约5%至约80%、约10%至约80%、约15%至约80%、约20%至约80%、约25%至约80%、约30%至约80%、约35%至约80%、约40%至约80%、约45%至约80%、约50%至约80%、约5%至约70%、约10%至约70%、约15%至约70%、约20%至约70%、约25%至约70%、约30%至约70%、约35%至约70%、约40%至约70%、约45%至约70%、或约50%至约70%。
在另一个实施例中,在对个体施药后,本文所公开的药物组合物减轻了肠内刺激。在本实施例的一方面,本文所公开的药物组合物显著地减轻了肠内刺激。在另一个实施例中,在对个体施药后,与除了没有药学上可接受的辅助剂的同样的本文所公开的药物组合物相比,本文所公开的药物组合物减轻了肠内刺激。在本实施例的一方面,与除了没有药学上可接受的辅助剂的同样的本文所公开的药物组合物相比,本文所公开的药物组合物实质上减轻了肠内刺激。在本实施例的其他方面,与除了没有药学上可接受的辅助剂的同样的本文所公开的药物组合物相比,本文所公开的药物组合物减轻了肠内刺激例如至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或至少100%。在本实施例的其他方面,与除了没有药学上可接受的辅助剂的同样的本文所公开的药物组合物相比,本文所公开的药物组合物减轻了肠内刺激例如约5%至约100%、约10%至约100%、约15%至约100%、约20%至约100%、约25%至约100%、约30%至约100%、约35%至约100%、约40%至约100%、约45%至约100%、约50%至约100%、约5%至约90%、约10%至约90%、约15%至约90%、约20%至约90%、约25%至约90%、约30%至约90%、约35%至约90%、约40%至约90%、约45%至约90%、约50%至约90%、约5%至约80%、约10%至约80%、约15%至约80%、约20%至约80%、约25%至约80%、约30%至约80%、约35%至约80%、约40%至约80%、约45%至约80%、约50%至约80%、约5%至约70%、约10%至约70%、约15%至约70%、约20%至约70%、约25%至约70%、约30%至约70%、约35%至约70%、约40%至约70%、约45%至约70%、或约50%至约70%。
本文所公开的药物组合物与其他治疗性化合物结合也能被施用到个体,以增加治疗的整体治疗效果。使用多种化合物治疗适应症可以增加有益效果同时减少副作用的存在。
本发明的各方面也可以如下所述:
1、一种固溶体药物组合物,包括:a)治疗性化合物,其中治疗性化合物具有抗炎活性;b)室温固体脂质;和c)室温液体脂质。
2、根据实施例1所述的固溶体药物组合物,其中,所述组合物还包括稳定剂。
3、根据实施例1或2所述的固溶体药物组合物,其中,所述组合物还包括中和剂。
4、根据实施例1-3所述的固溶体药物组合物,其中,所述固溶体药物组合物不包括表面活性剂。
5、根据实施例1-4所述的固溶体药物组合物,其中,所述固溶体药物组合物不包括亲水性溶剂。
6、根据实施例1-5所述的药物组合物,其中,所述使脂质水平正常化的活性具有抗高脂血症活性。
7、根据实施例6所述的药物组合物,其中,所述抗高脂血症活性将VLDL、ILD、LDL或其组合的水平降低至少10%。
8、根据实施例7所述的药物组合物,其中,所述抗高脂血症活性将HDL的水平提高例如至少2%。
9、根据实施例1-8所述的药物组合物,其中,所述使脂质水平正常化的活性降低炎症诱导性前列腺素的水平。
10、根据实施例9所述的药物组合物,其中炎症诱发前列腺素的水平降低了至少10%。
11、根据实施例1-10所述的药物组合物,其中,所述使脂质水平正常化的活性刺激PPAR信号传导通路。
12、根据实施例11所述的药物组合物,其中PPAR信号传导通路被刺激至少10%。
13、根据实施例1-12所述的药物组合物,其中使脂质水平正常化的活性诱导巨噬细胞M1细胞的调亡,促进巨噬细胞M2细胞的分化,或者两者兼之。
14、根据实施例1-13所述的药物组合物,其中,所述使脂质水平正常化的活性降低Th1细胞所释放的干扰素γ(IFNγ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-12(IL-12)或其组合的水平,提高Th2细胞所释放的IL-10的水平,或者两者兼之。
15、根据实施例14所述的药物组合物,其中从Th1细胞释放的IFNγ、TNF-α、IL-12或其组合的所述水平降低了至少10%。
16、根据实施例14所述的药物组合物,其中从Th2细胞释放的IL-10的所述水平提高至少10%。
17、根据实施例1-16所述的药物组合物,其中,所述使脂质水平正常化的活性降低炎症诱导分子的水平。
18、根据实施例17所述的药物组合物,其中,所述炎症诱导分子包含P物质(SP)、降钙素基因相关肽(CGRP)、谷氨酸盐或其组合。
19、根据实施例1-18所述的固溶体药物组合物,其中,所述治疗性化合物具有3.0或更大的logP值。
20、根据实施例1-18所述的固溶体药物组合物,其中,所述治疗性化合物具有约2.2至约3.0的logP值。
21、根据实施例1-18所述的固溶体药物组合物,其中,所述治疗性化合物具有约2.0或更小的logP值。
22、根据实施例1-21所述的药物组合物,其中,所述治疗性化合物具有疏水性的极化表面面积。
23、根据实施例1-22所述的药物组合物,其中,所述治疗性化合物具有小于8.0nm2的极化表面面积。
24、根据实施例1-22所述的药物组合物,其中,所述治疗性化合物具有小于6.0nm2的极化表面面积。
25、根据实施例1-24所述的药物组合物,其中,所述治疗性化合物包含非甾体类抗炎药(NSAID)。
26、根据实施例25所述的药物组合物,其中,所述NSAID包含水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂或其组合。
27、根据实施例1-26所述的药物组合物,其中,所述治疗性化合物包括PPARα激动剂、PPARβ/δ激动剂、PPARγ激动剂或格列扎。
28、根据实施例1-27所述的药物组合物,其中,所述治疗性化合物包括免疫抑制药、尿酸促排药、糖苷配基或大麻二酚。
29、根据实施例1-28所述的药物组合物,其中,所述治疗性化合物包括兰尼碱(Ryanodine)受体拮抗剂。
30、根据实施例29所述的药物组合物,其中,所述兰尼碱受体拮抗剂是阿珠莫林或丹曲洛林。
31、根据实施例1-30所述的药物组合物,其中,所述治疗性化合物包括核受体结合剂。
32、根据实施例31所述的药物组合物,其中,所述核受体结合剂包括视黄酸受体(RAR)结合剂、类视黄醇X受体(RXR)结合剂、肝脏X受体(LXR)结合剂、维生素D结合剂或其组合。
33、根据实施例1-34所述的药物组合物,其中,所述治疗性化合物包括抗高血脂剂。
34、根据实施例33所述的药物组合物,其中,所述抗高血脂剂包括血管紧张素II受体拮抗剂、ACE抑制剂、磷酸二酯酶抑制药、贝特类药物、他汀类药物、生育三烯酚、烟酸、胆酸螯合剂(树脂)、胆固醇吸收抑制剂、胰脂酶抑制剂、交感神经兴奋胺或其组合。
35、根据实施例34所述的药物组合物,其中,所述血管紧张素II受体拮抗剂包括阿齐沙坦、坎地沙坦、依普沙坦、厄贝沙坦、氯沙坦、奥美沙坦、替米沙坦,以及缬沙坦。
36、根据实施例34所述的药物组合物,其中,所述ACE抑制剂包括含巯基试剂、含二羧酸盐试剂、含膦酸盐试剂、酪激肽以及乳激肽。
37、根据实施例34所述的药物组合物,其中,所述磷酸二酯酶抑制剂包括PDE 1选择性抑制剂、PDE 2选择性抑制剂、PDE 3选择性抑制剂、PDE 4选择性抑制剂、PDE 5选择性抑制剂或者PDE 10选择性抑制剂。
38、根据实施例34所述的药物组合物,其中,所述贝特类药物包括苯扎贝特、环丙贝特、氯贝特、吉非罗齐、非诺贝特,或其组合。
39、根据实施例34所述的药物组合物,其中,所述他汀类药物包括阿伐他汀、氟伐他汀、洛伐他汀、匹伐他汀、普伐他汀、罗苏伐他汀、辛伐他汀,或其组合。
40、根据实施例34所述的药物组合物,其中,所述烟酸包括阿西莫司、烟酸、烟酰胺、维生素B3,或其组合。
41、根据实施例34所述的药物组合物,其中,所述胆汁酸螯合剂包括消胆胺、考来维仑、考来替泊,或其组合。
42、根据实施例34所述的药物组合物,其中,所述胆固醇吸收抑制剂包括依泽替米贝、植物甾醇、甾醇、甾烷醇,或其组合。
43、根据实施例34所述的药物组合物,其中,所述脂肪吸收抑制剂包括奥利司他。
44、根据实施例34所述的药物组合物,其中,所述交感神经兴奋胺包括克仑特罗、沙丁胺醇、麻黄素、伪麻黄碱、甲基苯丙胺、苯丙胺、苯肾上腺素、异丙肾上腺素、多巴酚丁胺、呱醋甲酯、二甲磺酸赖右苯丙胺、去甲伪麻黄碱、卡西酮、甲卡西酮、可卡因、苄基哌嗪(BZP)、亚甲基二氧吡咯戊酮(MDPV)、4-甲米雷司、匹莫林、苯甲吗啉、六氢脱氧麻黄碱,或其组合。
45、根据实施例1-44所述的药物组合物,其中,所述治疗性化合物包括癌症药物。
46、根据实施例45所述的药物组合物,其中,所述癌症药物包括烷基化剂、抗代谢物、植物碱和类萜、拓扑异构酶抑制剂或细胞毒性抗生素。
47、根据实施例1-46所述的药物组合物,其中,所述治疗性化合物包括二甲双胍、姜黄素、甘草次酸,或6-姜烯粉。
48、根据实施例1-46所述的药物组合物,其中,所述治疗性化合物包括抗生素。
49、根据实施例48所述的药物组合物,其中,所述抗生素包括异烟肼、利福平、吡嗪酰胺、或乙胺丁醇。
50、根据实施例1-49所述的药物组合物,其中,所述治疗性化合物包括抗蠕虫药。
51、根据实施例50所述的药物组合物,其中,所述抗蠕虫药物包括阿巴克丁、氨基乙腈(如莫奈太尔)、苯并咪唑、乙胺嗪、伊维菌素、左旋咪唑、氯硝柳胺、八缩酚酸肽(如艾莫德赛)、磷酸(美曲膦酯)、吡喹酮、螺吲哚(如得曲恩特)或苏拉明双羟萘酸噻嘧啶。
52、根据实施例1-51所述的药物组合物,其中,所述治疗性化合物包括抗疟药。
53、根据实施例52所述的药物组合物,其中,所述抗疟药包括阿莫地、青蒿素、阿托伐醌、氯奎、克林霉素、多西环素、盐酸氯氟、甲氟喹、伯氨喹、盐酸氯胍、乙胺嘧啶、奎宁和相关药物(如奎尼马斯和奎尼丁、六羧基蒽二酮)以及磺胺(如磺胺多辛或乙酰磺胺甲氧嗪)。
54、根据实施例53所述的药物组合物,其中,所述青蒿素包括蒿乙醚、蒿甲醚、青蒿素、青蒿酯,或二氢青蒿素。
55、根据实施例1-54所述的药物组合物,其中,所述治疗性化合物包括治疗性化合物的酯。
56、根据实施例1-55所述的药物组合物,其中,所述治疗性化合物包括根据实施例33-54所述的治疗性化合物的酯。
57、根据实施例1-56所述的药物组合物,其中,所述治疗性化合物的量是按重量计少于约90%、按重量计少于约80%、按重量计少于约70%、按重量计少于约65%、按重量计少于约60%、按重量计少于约55%、按重量计少于约50%、按重量计少于约45%、按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约15%、按重量计少于约10%、按重量计少于约5%、或按重量计少于约1%或按重量计约1%至90%、按重量计约1%至80%、按重量计约1%至75%、按重量计约1%至70%、按重量计约1%至65%、按重量计约1%至60%、按重量计约1%至55%、按重量计约1%至50%、按重量计约1%至45%、按重量计约1%至40%、按重量计约1%至35%、按重量计约1%至30%、按重量计约1%至25%、按重量计约1%至20%、按重量计约1%至15%、按重量计约1%至10%、按重量计约1%至5%、按重量计约2%至50%、按重量计约2%至40%、按重量计约2%至30%、按重量计约2%至20%、按重量计约2%至10%、按重量计约4%至50%、按重量计约4%至40%、按重量计约4%至30%、按重量计约4%至20%、按重量计约4%至10%、按重量计约6%至50%、按重量计约6%至40%、按重量计约6%至30%、按重量计约6%至20%、按重量计约6%至10%、按重量计约8%至50%、按重量计约8%至40%、按重量计约8%至30%、按重量计约8%至20%、按重量计约8%至15%或按重量计约8%至12%。
58、根据实施例1-57所述的药物组合物,其中,所述治疗性化合物的量是按重量计约0.1%至约45%、按重量计约0.1%至约40%、按重量计约0.1%至约35%、按重量计约0.1%至约30%、按重量计约0.1%至约25%、按重量计约0.1%至约20%、按重量计约0.1%至约15%、按重量计约0.1%至约10%、按重量计约0.1%至约5%、按重量计约1%至约45%、按重量计约1%至约40%、按重量计约1%至约35%、按重量计约1%至约30%、按重量计约1%至约25%、按重量计约1%至约20%、按重量计约1%至约15%、按重量计约1%至约10%、按重量计约1%至约5%、按重量计约5%至约45%、按重量计约5%至约40%、按重量计约5%至约35%、按重量计约5%至约30%、按重量计约5%至约25%、按重量计约5%至约20%、按重量计约5%至约15%、按重量计约5%至约10%、按重量计约10%至约45%、按重量计约10%至约40%、按重量计约10%至约35%、按重量计约10%至约30%、按重量计约10%至约25%、按重量计约10%至约20%、按重量计约10%至约15%、按重量计约15%至约45%、按重量计约15%至约40%、按重量计约15%至约35%、按重量计约15%至约30%、按重量计约15%至约25%、按重量计约15%至约20%、按重量计约20%至约45%、按重量计约20%至约40%、按重量计约20%至约35%、按重量计约20%至约30%、按重量计约20%至约25%、按重量计约25%至约45%、按重量计约25%至约40%、按重量计约25%至约35%或按重量计约25%至约30%。
59、根据实施例1-58所述的药物组合物,其中,所述药学上可接受的室温固体脂质是药学上可以接受的甘油脂、药学上可接受的二醇脂肪酸酯、药学上可接受聚醚脂肪酸酯、药学上可接受的脂质的混合物或其任意组合。
60、根据实施例1-59所述的药物组合物,其中,所述药学上可接受的甘油脂是可可油、PEG-6硬脂酸和乙二醇硬脂酸棕榈酸酯及PEG-32硬脂酸的混合物三鲸蜡硬脂醇聚醚-4-磷酸酯和乙二醇棕榈硬脂酸酯及二乙二醇棕榈硬脂酸酯的混合物单硬脂酸甘油酯和PEG-75硬脂酸的混合物鲸蜡醇与乙氧基化脂肪醇(鲸蜡醇聚醚-2-、硬脂醇聚醚-20)的混合物具有33℃左右的熔点的饱和C10-C18甘油三酯的混合物具有39℃左右的熔点的饱和C10-C18甘油三酯的混合物具有43℃左右的熔点的饱和C10-C18甘油三酯的混合物单硬脂酸甘油酯40-55(I型)和甘油二酯的混合物(甘油单酯及甘油二酯)及中链甘油三酯的混合物(亲脂WL1349)。
61、根据实施例1-60所述的药物组合物,其中,所述药学上可接受的二醇脂肪酸酯是乙二醇脂肪酸酯、二乙二醇脂肪酸酯、丙二醇脂肪酸酯和二丙二醇脂肪酸酯、乙二醇辛酸酯、乙二醇壬酸酯、乙二醇癸酸酯、乙二醇十一酸酯、乙二醇十二酸酯、乙二醇三癸酸酯、乙二醇十四酸酯、乙二醇肉豆蔻油酸酯、乙二醇五癸酸酯、乙二醇棕榈酸酯、乙二醇棕榈油酸酯、乙二醇六癸烯酸酯、乙二醇十七酸酯、乙二醇硬脂酸酯、乙二醇棕榈硬脂酸酯、乙二醇油酸酯、乙二醇反油酸酯、乙二醇牛痘酯、乙二醇亚油酸酯、乙二醇反亚油酸酯、乙二醇α-亚麻酸酯、乙二醇γ-亚麻酸酯、乙二醇十八碳四烯酸酯、乙二醇辛酰癸酸酯、乙二醇二辛酰癸酸酯、二乙二醇辛酸酯、二乙二醇壬酸酯、二乙二醇癸酸酯、二乙二醇十一酸酯、二乙二醇十二酸酯、二乙二醇三癸酸酯、二乙二醇十四酸酯、二乙二醇肉豆蔻油酸酯、二乙二醇五癸酸酯、二乙二醇棕榈酸酯、二乙二醇棕榈油酸酯、二乙二醇六癸烯酸酯、二乙二醇十七酸酯、二乙二醇硬脂酸酯、二乙二醇棕榈硬脂酸酯、二乙二醇油酸酯、二乙二醇反油酸酯、二乙二醇牛痘酯、二乙二醇亚油酸酯、二乙二醇反亚油酸酯、二乙二醇α-亚麻酸酯、二乙二醇γ-亚麻酸酯、二乙二醇十八碳四烯酸酯、二乙二醇辛酰癸酸酯、二乙二醇二辛酰癸酸酯、丙二醇辛酸酯、丙二醇壬酸酯、丙二醇癸酸酯、丙二醇十一酸酯、丙二醇十二酸酯、丙二醇三癸酸酯、丙二醇十四酸酯、丙二醇肉豆蔻油酸酯、丙二醇五癸酸酯、丙二醇棕榈酸酯、丙二醇棕榈油酸酯、丙二醇六癸烯酸酯、丙二醇十七酸酯、丙二醇硬脂酸酯、丙二醇棕榈硬脂酸酯、丙二醇油酸酯、丙二醇反油酸酯、丙二醇牛痘酯、丙二醇亚油酸酯、丙二醇反亚油酸酯、丙二醇α-亚麻酸酯、丙二醇γ-亚麻酸酯、丙二醇十八碳四烯酸酯、丙二醇辛酰癸酸酯、丙二醇二辛酰癸酸酯、二丙二醇辛酸酯、二丙二醇壬酸酯、二丙二醇癸酸酯、二丙二醇十一酸酯、二丙二醇十二酸酯、二丙二醇三癸酸酯、二丙二醇十四酸酯、二丙二醇肉豆蔻油酸酯、二丙二醇五癸酸酯、二丙二醇棕榈酸酯、二丙二醇棕榈油酸酯、二丙二醇六癸烯酸酯、二丙二醇十七酸酯、二丙二醇硬脂酸酯、二丙二醇棕榈硬脂酸酯、二丙二醇油酸酯、二丙二醇反油酸酯、二丙二醇牛痘酯、二丙二醇亚油酸酯、二丙二醇反亚油酸酯、二丙二醇亚麻酸酯、二丙二醇γ-亚麻酸酯、二丙二醇十八碳四烯酸酯、二丙二醇辛酰癸酸酯、二丙二醇二辛酰癸酸酯、丙二醇单棕榈硬脂酸酯丙二醇二辛酰癸酸酯丙二醇单十二酸酯(I型)丙二醇单十二酸酯(Ⅱ型)丙二醇单辛酸酯(I型)丙二醇单辛酸酯(Ⅱ型)或其任意组合。
62、根据实施例1-61所述的药物组合物,其中,所述药学上可接受的聚醚脂肪酸酯是PEG脂肪酸酯、PEG甘油基脂肪酸、PEG脂肪酸酯甘油酯、PPG脂肪酸酯、PPG甘油基脂肪酸或PPG脂肪酸酯甘油酯。
63、根据实施例1-62所述的药物组合物,其中,所述药学上可接受的室温固体脂质的量足以形成固溶体组合物。
64、根据实施例1-63所述的药物组合物,其中,所述药学上可接受的室温固体脂质的量为按重量计至少10%、按重量计至少20%、按重量计至少30%、按重量计至少35%、按重量计至少40%、按重量计至少45%、按重量计至少50%、按重量计至少55%、按重量计至少60%、按重量计至少65%、按重量计至少70%、按重量计至少75%、按重量计至少80%、按重量计至少85%、按重量计至少90%、按重量计至少95%、或按重量计至少99%或按重量计约30%到约99%、按重量计约35%至约99%、按重量计约40%至约99%、按重量计约45%至约99%、按重量计约50%至约99%、按重量计约30%至约98%、按重量计约35%至约98%、按重量计约40%至约98%、按重量计约45%至约98%、按重量计约50%至约98%、按重量计约30%至约95%、按重量计约35%至约95%、按重量计约40%至约95%、按重量计约45%到约95%、或按重量计约50%到约95%或按重量计约70%到约97%、按重量计约75%至约97%、按重量计约80%至约97%、按重量计约85%至约97%、按重量计约88%至约97%、按重量计约89%至约97%、按重量计约90%至约97%、按重量计约75%至约96%、按重量计约80%至约96%、按重量计约85%至约96%、按重量计约88%至约96%、按重量计约89%至约96%、按重量计约90%至约96%、按重量计约75%至约93%、按重量计约80%至约93%、按重量计约85%至约93%、按重量计约88%至约93%、按重量计约89%到约93%、或按重量计约90%到约93%。
65、根据实施例1-64所述的药物组合物,其中,所述药学上可接受的室温液体脂质是甘油单酯。
66、根据实施例65所述的药物组合物,其中,所述甘油单酯是甘油单十四酸酯、甘油单棕榈油酸酯、甘油单顺-6-十六烯酸酯、甘油单油酸酯、甘油单反式油酸酯、甘油单异油酸酯、甘油单亚油酸酯、甘油单反亚油酸酯、甘油单亚麻酸酯、甘油单十八碳四烯酸酯、甘油单二十碳烯酸酯、甘油二十碳三烯酸酯、甘油单花生四烯酸酯、甘油单二十碳五烯酸酯、甘油单芥酸酯、甘油单二十二碳六烯酸、甘油单二十四碳烯酸酯、甘油二山嵛酸酯甘油山嵛酸酯(ATO)、甘油硬脂酸二棕榈酸酯(Biogapress Vegetal BM297ATO)、甘油二硬脂酸酯(I型)(ATO5)、甘油单亚油酸酯(MAISINETM35-1)。
67、根据实施例1-66所述的药物组合物,其中,所述药学上可接受的室温液体脂质的量足以溶解治疗性化合物。
68、根据实施例1-67所述的药物组合物,其中,所述药学上可接受的室温液体脂质的量按重量计少于约90%、按重量计少于约80%、按重量计少于约70%、按重量计少于约65%、按重量计少于约60%、按重量计少于约55%、按重量计少于约50%、按重量计少于约45%、按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约15%、按重量计少于约10%、按重量计少于约5%、或按重量计少于约1%、或按重量计约1%至90%、按重量计约1%至80%、按重量计约1%至70%、按重量计约1%至60%、按重量计约1%至50%、按重量计约1%至40%、按重量计约1%至30%、按重量计约1%至20%、按重量计约1%至10%、按重量计约2%至50%、按重量计约2%至40%、按重量计约2%至30%、按重量计约2%至20%、按重量计约2%至10%、按重量计约4%至50%、按重量计约4%至40%、按重量计约4%至30%、按重量计约4%至20%、按重量计约4%至10%、按重量计约6%至50%、按重量计约6%至40%、按重量计约6%至30%、按重量计约6%至20%、按重量计约6%至10%、按重量计约8%至50%、按重量计约8%至40%、按重量计约8%至30%、按重量计约8%至20%、按重量计约8%至15%、或按重量计约8%至12%。
69、根据实施例1-68所述的药物组合物,其中,所述稳定剂是液体二醇聚合物、一元醇、异山梨酯二甲醚、和二乙二醇单乙醚(2-(2-乙氧基乙氧基)乙醇)
70、根据实施例69所述的药物组合物,其中,所述液体二元醇聚合物是液体PEG聚合物和/或液体PPH聚合物。
71、根据实施例70所述的药物组合物,其中一元醇是乙醇、丙醇、丁醇、戊醇或1-十六烷醇。
72、根据实施例1-71所述的药物组合物,其中,所述药学上可接受的稳定剂的量足以使治疗性化合物中存在的游离酸或碱稳定。
73、根据实施例1-72所述的药物组合物,其中,所述药学上可接受的稳定剂的量按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约19%、按重量计少于约18%、按重量计少于约17%、按重量计少于约16%、按重量计少于约15%、按重量计少于约14%、按重量计少于约13%、按重量计少于约12%、按重量计少于约11%、按重量计少于约10%、按重量计少于约9%、按重量计少于约8%、按重量计少于约7%、按重量计少于约6%、按重量计少于约5%、按重量计少于约4%、按重量计少于约3%、按重量计少于约2%、或按重量计少于约1%、或按重量计约1%到约5%、按重量计约1%到约7%、按重量计约1%至约10%、按重量计约1%至约12%、按重量计约1%至约15%、按重量计约1%至约18%、按重量计约1%至约20%、按重量计约2%至约5%、按重量计约2%至约7%、按重量计约2%至约10%、按重量计约2%至约12%、按重量计约2%至约15%、按重量计约2%至约18%、按重量计约2%至约20%、按重量计约3%至约5%、按重量计约3%至约7%、按重量计约3%至约10%、按重量计约3%至约12%、按重量计约3%至约15%、按重量计约3%至约18%、按重量计约3%至约20%、按重量计约4%至约5%、按重量计约4%至约7%、按重量计约4%至约10%、按重量计约4%至约12%、按重量计约4%至约15%、按重量计约4%至约18%、按重量计约4%至约20%、按重量计约5%至约7%、按重量计约5%至约10%、按重量计约5%至约12%、按重量计约5%至约15%、按重量计约5%至约18%、按重量计约5%至约20%、按重量计约6%至约7%、按重量计约6%至约10%、按重量计约6%至约12%、按重量计约6%至约15%、按重量计约6%至约18%、按重量计约6%至约20%、按重量计约7%至约10%、按重量计约7%至约12%、按重量计约7%至约15%、按重量计约7%至约18%、按重量计约7%至约20%、按重量计约8%至约10%、按重量计约8%至约12%、按重量计约8%至约15%、按重量计约8%至约18%、按重量计约8%至约20%、按重量计约9%至约10%、按重量计约9%至约12%、按重量计约9%至约15%、按重量计约9%至约18%、按重量计约9%至约20%、按重量计约10%至约12%、按重量计约10%至约15%、按重量计约10%至约18%、或按重量计约10%至约20%。
74、根据实施例1-73所述的药物组合物,其中,所述药学上可接受的稳定剂不用作溶剂。
75、根据实施例1-74所述的药物组合物,其中,所述药学上可接受的稳定剂在治疗性化合物中的溶解不超过85%、不超过80%、不超过75%、不超过70%、不超过65%、不超过60%、不超过55%、不超过50%、不超过45%、不超过40%、不超过35%、不超过30%、不超过25%、不超过20%、不超过15%、不超过10%、或不超过5%。
76、根据实施例1-75所述的药物组合物,其中,所述药学上可接受的中和剂的量足以中和治疗性化合物溶解时产生的离子电荷。
77、根据实施例1-76所述的药物组合物,其中,所述药学上可接受的中和剂的量是相对于治疗性化合物一个摩尔当量。
78、根据实施例1-77所述的药物组合物,其中,所述药学上可接受的中和剂的量为相对于治疗性化合物小于一个摩尔当量。
79、根据实施例1-78所述的药物组合物,其中,所述药学上可接受的中和剂的量为相对于治疗性化合物多于一个摩尔当量。
80、根据实施例1-79所述的药物组合物,其中,所述中和剂的量按重量计少于约90%、按重量计少于约80%、按重量计少于约70%、按重量计少于约65%、按重量计少于约60%、按重量计少于约55%、按重量计少于约50%、按重量计少于约45%、按重量计少于约40%、按重量计少于约35%、按重量计少于约30%、按重量计少于约25%、按重量计少于约20%、按重量计少于约15%、按重量计少于约10%、按重量计少于约5%、或按重量计少于约1%或按重量计约1%至90%、按重量计约1%至80%、按重量计约1%至75%、按重量计约1%至70%、按重量计约1%至65%、按重量计约1%至60%、按重量计约1%至55%、按重量计约1%至50%、按重量计约1%至45%、按重量计约1%至40%、按重量计约1%至35%、按重量计约1%至30%、按重量计约1%至25%、按重量计约1%至20%、按重量计约1%至15%、按重量计约1%至10%、按重量计约1%至5%、按重量计约2%至50%、按重量计约2%至40%、按重量计约2%至30%、按重量计约2%至20%、按重量计约2%至10%、按重量计约4%至50%、按重量计约4%至40%、按重量计约4%至30%、按重量计约4%至20%、按重量计约4%至10%、按重量计约6%至50%、按重量计约6%至40%、按重量计约6%至30%、按重量计约6%至20%、按重量计约6%至10%、按重量计约8%至50%、按重量计约8%至40%、按重量计约8%至30%、按重量计约8%至20%、按重量计约8%至15%或按重量计约8%至12%。
81、根据实施例1-80所述的药物组合物,其中,所述中和剂的量按重量计约0.1%至约45%、按重量计约0.1%至约40%、按重量计约0.1%至约35%、按重量计约0.1%至约30%、按重量计约0.1%至约25%、按重量计约0.1%至约20%、按重量计约0.1%至约15%、按重量计约0.1%至约10%、按重量计约0.1%至约5%、按重量计约1%至约45%、按重量计约1%至约40%、按重量计约1%至约35%、按重量计约1%至约30%、按重量计约1%至约25%、按重量计约1%至约20%、按重量计约1%至约15%、按重量计约1%至约10%、按重量计约1%至约5%、按重量计约5%至约45%、按重量计约5%至约40%、按重量计约5%至约35%、按重量计约5%至约30%、按重量计约5%至约25%、按重量计约5%至约20%、按重量计约5%至约15%、按重量计约5%至约10%、按重量计约10%至约45%、按重量计约10%至约40%、按重量计约10%至约35%、按重量计约10%至约30%、按重量计约10%至约25%、按重量计约10%至约20%、按重量计约10%至约15%、按重量计约15%至约45%、按重量计约15%至约40%、按重量计约15%至约35%、按重量计约15%至约30%、按重量计约15%至约25%、按重量计约15%至约20%、按重量计约20%至约45%、按重量计约20%至约40%、按重量计约20%至约35%、按重量计约20%至约30%、按重量计约20%至约25%、按重量计约25%至约45%、按重量计约25%至约40%、按重量计约25%至约35%、或按重量计约25%至约30%。
82、一种治疗患有心血管疾病的个体的方法,所述方法包括以下步骤:根据实施例1-81向需要药物组合物的个体施用所述药物组合物,其中给药导致与心血管疾病相关联的症状减轻,从而治疗所述个体。
83、根据实施例1-81的药物组合物在制造用于治疗心血管疾病的药物中的用途。
84、根据实施例1-81的药物组合物在治疗心血管疾病中的用途。
85、根据实施例82所述的方法或根据实施例83或84所述的用途,其中心血管疾病是与高脂血症、冠心病、动脉粥样硬化、外周血管病、血管闭塞性疾病、心肌病、脉管炎、炎症性心脏病、缺血性心脏病、充血性心力衰竭、高血压性心脏病、心脏瓣膜病、高血压、心肌梗塞、糖尿病心肌病、动脉瘤、栓塞、剥离(dissection)、假性动脉瘤、血管畸形、血管痣、血栓形成、静脉曲张和中风相关联。
86、根据实施例85所述的方法或用途,其中高脂血症是血脂异常、高胆固醇血症、高甘油酯血症、高甘油三酸酯血症、高脂蛋白血症、或高乳糜微粒血症,和混合型高脂血症。
87、根据实施例86所述的方法或用途,其中高脂蛋白血症是Ia型高脂蛋白血症、Ib型高脂蛋白血症、Ic型高脂蛋白血症、IIa型高脂蛋白血症、IIb型高脂蛋白血症、III型高脂蛋白血症、IV型高脂蛋白血症、或V型高脂蛋白血症。
88、根据权利要求85所述的方法或用途,其中,所述血管闭塞疾病(VOD)是动脉粥样硬化症、外周血管病或狭窄。
89、根据权利要求85所述的方法或用途,其中,所述心肌病是外因性性心肌病或内因性心肌病。
90、根据权利要求89所述的方法或用途,其中,所述外因性心肌病是肢端肥大症、酒精性心肌病、淀粉样变性、美洲锥虫病、化疗、糖尿病性心肌病、血色沉着症、高血压心肌病、甲状腺机能亢进、炎症性心肌病、缺血性心肌病、肌营养不良症、瓣膜性心肌病、继发系统性代谢心肌病、继发系统性营养疾病心肌病、冠心病和先天性心脏病。
91、根据权利要求89所述的方法或用途,其中,所述内因性心肌病是扩张性心肌病(DCM)、肥厚性心肌病(HCM或HOCM))、致心律失常性右心室心肌病(ARVC)、限制性心肌病(RCM)、致密化不全心肌病、孤立性心室肌致密化不全、线粒体肌病、应激性心肌病和勒夫勒心内膜炎。
92、根据实施例85所述的方法或用途,其中,所述脉管炎是血栓闭塞性脉管炎、动脉炎、脑血管炎、变应性肉芽肿(Churg-Strauss)动脉炎、冷球蛋白血症、原发性冷球蛋白性脉管炎、巨细胞性动脉炎、高尔夫手脉管炎、亨-舍二氏紫癜、过敏性脉管炎、川崎病、静脉炎、微小多动脉炎/多脉管炎、多发性结节性动脉炎、风湿性多肌痛(PMR)、类风湿性脉管炎、大动脉炎、血栓性静脉炎、韦格纳氏肉芽肿病、或脉管炎继发性结缔组织病症、或脉管炎继发性病毒感染。
93、根据权利要求92所述的方法或用途,其中,所述继发于结缔组织病的血管炎是系统性红斑狼疮(SLE)、类风湿性关节炎(RA)、复发性多软骨炎、白塞氏病。
94、根据权利要求85所述的方法或用途,其中,所述炎性心脏病是心内膜炎、炎症性心肥大或心肌炎。
95、根据实施例82或85-94所述的方法或根据实施例83-94所述的用途,其中,在向个体给药后,根据实施例1-81所述的包括治疗性化合物的药物组合物使得治疗性化合物的生物分布不同于包括在除了不含有药学上可接受的辅助剂之外相同的药物组合物中的治疗性化合物的生物分布。
97、根据实施例82或85-96所述的方法或根据实施例83-96所述的用途,其中,在向个体给药后,根据实施例1-81所述的药物组合物与根据实施例1-81所述的除了不含有药学上可接受的辅助剂以外而相同的药物组合物相比,将肠道刺激减轻了至少5%。
98、根据实施例82或85-97所述的方法或根据实施例83-97所述的用途,其中,在向个体给药后,根据实施例1-81所述的药物组合物与根据实施例1-81所述的除了不含有药学上可接受的辅助剂以外而相同的药物组合物相比,将胃刺激减轻了至少5%。
实例
为有助于更完整地了解所公开的主题,以下非限制性实例仅是为了说明目的而提供的。这些实例不应解释成限制本说明书中描述的任何实施例,包括关于药物组合物、制备药物组合物的方法、或治疗异常脂质水平或与异常脂质水平相关联的疾病的方法或用途的实施例。
实例1
差示扫描量热法
本实例说明本文所公开的包含治疗性化合物的固溶体药物组合物的调配。
为了制备本文所公开的固溶体药物组合物,使用以下一般程序。除室温固体脂质之外,将所有的成分混合在一起。为了溶解治疗性化合物从而产生溶液,在搅拌下将此混合物加热到约50℃至约60℃的范围中的温度。然后将室温固体脂质添加到溶液中,并搅拌混合物直到混合。然后通过冷却到室温而允许混合物固化。表1中示出包含各种治疗性化合物的代表性制剂。
然后通过冷却到室温允许混合物固化。然后通过外观和通过差示扫描量热法(DSC)评估固化的组合物。
在使用DSC的分析过程中,观察到一般趋势,其中固化的带有混浊外观的制剂形成具有晶体结构的典型的固体组合物,而固化的带有澄清外观的制剂表明具有非晶结构的固溶体组合物。此外,然后将固化的带有澄清外观的组合物重新熔化,其外观无沉淀,表明固溶体组合物具有非晶结构。
使用可视外观和再熔化实验,评估大量制剂成为固溶体组合物的能力。未能形成固体的制剂或形成了具有混浊外观的固体的制剂未经进一步分析并被丢弃。类似地,如果固化的带有澄清外观的组合物重新熔化之后形成沉淀,那么制剂未经进一步分析并被丢弃。形成澄清固体的制剂随后也通过DSC来加以分析。
固化为具有澄清外观的代表性布洛芬制剂的数据示于图1中。DSC分析揭示单个组分展现出尖锐的明确界定的峰。例如,布洛芬拥有75℃到78℃的明确界定的熔点范围(图1A)。类似地,室温固体脂质或硬脂,如具有41℃到45℃的明确界定的熔点范围(图1B)。这些尖锐的明确界定的熔点温度范围指示出组合物在典型的固体转变阶段具有明确界定的晶体结构。和PEG 400在室温下是液体,并同样具有低于20℃的熔点。例如,具有约14℃至约16℃的熔点温度范围,且PEG 400具有约4℃至约8℃的熔点温度范围。
意外地,当包括室温固体脂质(硬脂)的介质,室温液体脂质和稳定剂通过DSC被检查时,出现了新的熔点温度峰。例如,除的41℃到45℃的峰之外,DSC分析识别了约32℃至约38℃的新的宽熔点温度范围(图1C)。此温度范围不同于单独的单个组分的温度范围:为41℃至45℃,为14℃至16℃,且PEG400为4℃至8℃。这些结果表明组合物的一部分形成为固溶体相而不是典型的固相。
令人惊奇地,包含具有此介质的治疗性化合物的制剂展现出宽的熔化范围,其熔点温度不同于单个组分(图1D至1H)。此外,没有检测到与单独的治疗性化合物或单独的硬脂相关的峰值。例如,布洛芬具有75℃到78℃的熔点温度范围,具有41℃到45℃的熔点温度范围,具有14℃到16℃的熔点温度范围,且PEG400具有4℃到8℃的熔点温度范围。然而,取决于使用的数量和比例,包括这些组分的制剂产生具有35℃到40℃的熔点的组合物。在独特的固体组分的典型混合阶段,每一个别的峰将消退,即布洛芬为75℃到78℃,为41℃到45℃。情况并非如此,这些峰一起消失。对于固化的组合物,单一的新的熔点峰的存在以及单个组分熔点峰的伴随消失,表明形成了治疗性化合物的新颖的固溶体结构和室温固体脂质(硬脂)。
实例2
包含蒿甲醚的固溶体药物组合物
本实例说明如何制成包含蒿甲醚的本文所公开的固溶体药物组合物。
为了使用蒿甲醚制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1.0g的(Gattefosse)以及约0.5mL的三丁酸甘油酯(作为室温液体脂质)添加到容器中并加热到约40℃至约50℃直到混合物的所有组分被混合,所述为熔点在41℃至45℃之间并包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。将约40mg的蒿甲醚天啊及到约0.8mL的所述并入的混合物中并搅拌直至溶解。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约35℃至约40℃的新的宽熔点温度范围(图2)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且蒿甲醚为86℃至90℃。三丁酸甘油酯在室温下为液体,并且同样具有低于20℃的熔点。这些结果表明形成了包含蒿甲醚的如本文所公开的固溶体制剂。
实例3
包含阿司匹林的固溶体药物组合物
本实例说明如何制成包含阿司匹林的本文所公开的固溶体药物组合物。
为了使用阿司匹林制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将大约120mg的阿司匹林和约0.5mL的异山梨醇二甲酯(作为稳定剂)添加到容器中并加热到约50℃至约60℃直到混合物的所有组分溶解。将约1.0g的(Gattefosse)添加到所述溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间并包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物然后被冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约35℃至约40℃的新的宽熔点温度范围(图3)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且阿斯匹林为138℃至140℃。异山梨醇二甲酯在室温下为液体,并同样具有低于20℃的熔点。这些结果表明形成了包含阿斯匹林的如本文所公开的固溶体制剂。
实施例4
包含丹曲洛林的固溶体药物组合物
本实例说明了如何制成包含丹曲洛林的本文所公开的固溶体药物组合物。
为了使用丹曲洛林制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约232.7mg的硬脂酸(作为中和剂)添加至容器中并且加热至约70℃至约75℃直至熔化。将约250.2mg的丹曲洛林钠盐和20mL的异山梨酯二甲酯(作为稳定剂)添加至熔化的硬脂酸并且搅拌直至实现均匀的稠度。将约20.02g的(Gattefosse)添加至此溶液并且搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,且通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约34℃至约39℃的新的宽熔点温度范围(图4)。此温度范围不同于单独的单个组分的温度范围:(Gattefosse)43/01为41℃至45℃,硬脂酸为70℃,以及丹曲洛林为279℃至280℃。异山梨酯二甲酯在室温下是液体,且同样具有低于20℃的熔点。这些结果表明形成了包含丹曲洛林的如本文所公开的固溶体制剂。
为了使用丹曲洛林制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约309.8mg的硬脂酸(作为中和剂)添加至容器中并且加热至约70℃至约75℃直至熔化。将约59.6mg丹曲洛林钠盐添加至熔化的硬脂酸并且搅拌直至实现均匀的稠度。添加0.75mL的异山梨醇二甲酯(作为稳定剂)并且搅拌混合物直至所有组分溶解。将约760.3g的(Gattefosse)添加至此溶液并且搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含丹曲洛林的如本文所公开的固溶体制剂。
为了使用丹曲洛林制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约250.2mg的硬脂酸(作为中和剂)添加至容器中并且加热至约70℃至约75℃直至熔化。将约50.3mg的丹曲洛林钠盐添加至熔化的硬脂酸并且搅拌直至实现均匀的稠度。添加5.0mL的异山梨醇二甲酯(作为稳定剂)并且搅拌混合物直至所有组分溶解。将约5.0g(Gattefosse)添加至此溶液并且搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含丹曲洛林的如本文所公开的固溶体制剂。
为了使用丹曲洛林制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约225.0mg的硬脂酸(作为中和剂)添加至容器中并且加热至约70℃至约75℃直至熔化。将约25.1mg的丹曲洛林钠盐添加至熔化的硬脂酸并且搅拌直至实现均匀的稠度。添加2.0mL的异山梨醇二甲酯(作为稳定剂)并且搅拌混合物直至所有组分溶解。将约2.07g的(Gattefosse)添加至此溶液并且搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含丹曲洛林的如本文所公开的固溶体制剂。
为了使用丹曲洛林制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约224.9m的硬脂酸(作为中和剂)添加到容器并加热至约70℃至约75℃直至熔化。将约25.1mg的丹曲林钠盐添加至熔化的硬脂酸并且搅拌直至获得均匀稠度。添加0.75mL的异山梨醇二甲酯(作为稳定剂)并且搅拌混合物直至所有组分溶解。将约304.1mg的(Gattefosse)添加至此溶液并且搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却至约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含丹曲洛林的如本文所公开的固溶体制剂。
实例5
包含双氯芬酸的固溶体药物组合物
本实例说明如何制成包含双氯芬酸的本文所公开的固溶体药物组合物。
为了使用双氯芬酸制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约119m的双氯芬酸、约1.0mL的(Gattefosse),以及约0.3mL的异山梨醇二甲酯(作为稳定剂)添加到容器中并加热至约50℃至约60℃直至混合物的所有组分溶解,所述为甘油单亚油酸酯(作为室温液体脂质)。将约1.0g的(Gattefosse)添加到此溶液并且搅拌直至被混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却至约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化为具有澄清的外观。另外,DSC分析指示约35℃至约40℃的新的宽熔点温度范围(图5)。此温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃,且双氯芬酸为157℃至158℃。和异山梨醇二甲酯在室温下是液体,并同样都具有低于20℃的溶点。这些结果表明形成了包含双氯芬酸的如本文所公开的固溶体制剂。
实例6
包含非诺贝特的固溶体药物组合物
本实例说明如何制备本文所公开的包含非诺贝特的固溶体药物组合物。
为了使用非诺贝特制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约400mg的非诺贝特和4.0g的(Gattefosse)添加到容器中并加热到约45℃至约55℃直至混合物的所有组分混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。将约0.76mL的异山梨醇二甲酯(作为稳定剂)添加到此混合物并搅拌直至混合。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约34℃至约39℃的新的宽熔点温度范围(图6)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且非诺贝特为80℃至85℃。异山梨酯二甲酯在室温下为液体,并且同样具有低于20℃的熔点。这些结果表明形成了本文所公开的包含非诺贝特的固溶体制剂。
实例7
包含吉非罗齐的固溶体药物组合物
本实例说明了如何制成包含吉非罗齐的本文所公开的固溶体药物组合物。
为了使用吉非罗齐制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1g的吉非罗齐、约0.9mL的(Gattefosse),以及约0.4ml PEG 400(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约1.9g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了本文所公开的包含吉非罗齐的固溶体制剂。
为了使用吉非罗齐制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1g吉非罗齐以及约7.5g可可油添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被混合,可可油为熔点在34℃至38℃之间并包含饱和C16-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含吉非罗齐的本文所公开的固溶体制剂。
实例8
包含布洛芬的固溶体药物组合物
本实例说明了如何制成包含布洛芬的本文所公开的固溶体药物组合物。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1g的布洛芬、约0.9mL的(Gattefosse),以及约0.4mL的PEG 400添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约1.9g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约32℃至约44℃的新的宽熔点温度范围(图1D)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且布洛芬为75℃至78℃。和PEG 400在室温下为液体,并且同样都具有低于20℃的熔点。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1g的布洛芬钠盐、约0.5mL的(Gattefosse)以及约0.4mL的PEG 400添加到容器中并加热到约50℃至约60℃,直到混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约2.3g的(Gattefosse)添加到所述溶液中并搅拌直到混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物然后被冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,并随后再加热到约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约32℃至约43℃的新的宽熔点温度范围(图1E)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且布洛芬为75℃至78℃。和PEG 400在室温下为液体,并且同样都具有低于20℃的熔点。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1g的布洛芬钠盐、约0.2mL的(Gattefosse)以及约0.4mL的PEG 400添加到容器中并加热到约50℃至约60℃,直到混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约2.6g的(Gattefosse)添加到所述溶液中并搅拌直到混合,为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物然后被冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,并随后再加热到约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析显示约32℃至约42℃的新的宽熔点温度范围(图1F)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且布洛芬为75℃至78℃。和PEG 400在室温下为液体,并且两者都具有低于20℃的熔点。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约5g布洛芬、约9.5mL的(Gattefosse),以及约0.4mL的PEG 400添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约4.0g的(Gattefosse)至此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约32℃至约38℃的新的宽熔点温度范围(图1G)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且布洛芬为75℃至78℃。和PEG 400在室温下为液体,并且同样都具有低于20℃的熔点。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约5g布洛芬、约6.5mL的(Gattefosse)以及约1.5mL的PEG 400添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约6.5g(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约32℃至约42℃的新的宽熔点温度范围(图1H)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且布洛芬为75℃至78℃。和PEG 400在室温下为液体,并且同样都具有低于20℃的熔点。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约1g布洛芬钠盐、约0.9mL的(Gattefosse)、约0.4mL的PEG 400以及约0.3mL的丙二醇添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约1.9g(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
为了使用布洛芬制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约5g布洛芬游离酸、约5g布洛芬钠盐、约8mL的(Gattefosse)、约3mL的PEG 400以及约1mL的丙二醇添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约19g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含布洛芬的本文所公开的固溶体制剂。
实例9
包含利多卡因的固溶体药物组合物
本实例说明了如何制成包含利多卡因的本文所公开的固溶体药物组合物。
为了使用利多卡因制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将200mg利多卡因和约2.0mL异山梨醇二甲酯(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解。将约8.8g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约34℃至约40℃的新的宽熔点温度范围(图7)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且利多卡因为66℃至69℃。异山梨酯二甲酯在室温下为液体,并且同样具有低于20℃的熔点。这些结果表明形成了包含利多卡因的本文所公开的固溶体制剂。
为了使用利多卡因制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将250.1mg的利多卡因碱和约1.74mL的异山梨醇二甲酯(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解。将约8.72g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
为了使用利多卡因制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将500.4mg的利多卡因碱和约1.74mL的异山梨醇二甲酯(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解。将约8.5g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
为了使用利多卡因制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将250.4mg的利多卡因碱和约0.87mL的异山梨醇二甲酯(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被混合。分开地,在搅拌下将250.1mg的丙胺卡因HCI碱、0.13mL的三乙醇胺(作为中和剂)和约0.87mL的异山梨醇二甲酯(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被混合。利多卡因和丙胺卡因的混合物合并在一起,并在搅拌下加热到约50℃至约60℃直至所有组分被溶解。将约8.49g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
实例10
包含萘丁美酮的固溶体药物组合物
本实例说明了如何制成包含萘丁美酮的本文所公开的固溶体药物组合物。
为了使用萘丁美酮制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将126mg的萘丁美酮和约0.5mL的(Gattefosse)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约1.0g的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约35℃至约40℃的新的宽熔点温度范围(图8)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且萘丁美酮为80℃至81℃。在室温下为液体,并且同样具有低于20℃的熔点。这些结果表明形成了包含萘丁美酮的本文所公开的固溶体制剂。
实例11
包含萘普生的固溶体药物组合物
本实例说明了如何制成包含萘普生的本文所公开的固溶体药物组合物。
为了使用萘普生制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约250.1mg的萘普生和约0.75mL的(Gattefosse)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约750.9mg的(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,并随后再加热至约40℃至约45℃以分装到模具内。将制剂固化成具有澄清的外观。这些结果表明形成了包含萘普生的本文所公开的固溶体制剂。
为了使用萘普生制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约650.5mg的萘普生和约1.2mL的(Gattefosse)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约1.234g的(Gattefosse)添加至此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约30℃至约39℃的新的宽熔点温度范围(图9)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃和萘普生为153℃至154℃。在室温下为液体,并且同样具有低于20℃的熔点。这些结果表明形成了包含萘普生的如本文所公开的固溶体配方。
实例12
包含己酮可可碱的固溶体药物组合物
本实例说明了如何制成包含己酮可可碱的本文所公开的固溶体药物组合物。
为了使用己酮可可碱制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约208mg的己酮可可碱、约1.0mL的(Gattefosse)和约0.2mL的异山梨酯二甲醚(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约1.0g的(Gattefosse)添加到此溶液中并搅拌直至混合,为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。将制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含己酮可可碱的如本文所公开的固溶体制剂。
实例13
包含沙丁胺醇的固溶体药物组合物
本实例说明了如何制成包含沙丁胺醇的本文所公开的固溶体药物组合物。
为了使用沙丁胺醇制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约61mg的沙丁胺醇、约0.6mL的(Gattefosse)、1.0mL的异山梨酯二甲醚(作为稳定剂)以及约1mL的无水乙醇(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约10g(Gattefosse)添加到此溶液中并搅拌直至混合,所述为熔点在41℃至45℃之间且包含饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约32℃至约40℃的新的宽熔点温度范围(图10)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且沙丁胺醇为157℃至158℃。异山梨醇二甲酯以及无水乙醇在室温下是液体,并且同样都具有低于20℃的熔点。这些结果表明形成了包括沙丁胺醇的本文所公开的固溶体制剂。
实例14
包括沙美特罗的固溶体药物组合物
本实例说明了如何制成包括沙美特罗的本文所公开的固溶体药物组合物。
为了使用沙美特罗制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约11mg的昔萘酸沙美特罗、约1.0mL的(Gattefosse),以及约1.0mL的无水乙醇(作为稳定剂)添加到容器中并加热到约50℃至约60℃直至混合物的所有组分被溶解,(Gattefosse)为甘油单亚油酸酯(作为室温液体脂质)。将约2.04g的(Gattefosse)添加到此溶液中并搅拌直至被混合,为熔点在41℃至45℃之间并包括饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约34℃至约43℃的新的宽熔点温度范围(图11)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃和沙美特罗为137℃至138℃。和无水乙醇在室温下为液体,并且同样都具有低于20℃的熔点。这些结果表明形成了包括沙美特罗的如本文所公开的固溶体制剂。
实例15
包含辛伐他汀的固溶体药物组合物
本实例说明了如何制成包含辛伐他汀的本文所公开的固溶体药物组合物。
为了使用辛伐他汀制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约200mg的辛伐他汀和约2.5mL的(Gattefosse)添加到容器并加热到约50℃至约60℃直至混合物的所有组分溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约5g的(Gattefosse)添加到此溶液中并搅拌直至被混合,为熔点在41℃至45℃之间并包括饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且随后再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约32℃至约42℃的新的宽熔点温度范围(图12)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且辛伐他汀为135℃至138℃。和无水乙醇在室温下为液体,并且同样两者都具有低于20℃的熔点。这些结果表明形成了包括辛伐他汀的如本文所公开的固溶体制剂。
实例16
包括替米沙坦的固溶体药物组合物
本实例说明了如何制成包括替米沙坦的如本文所公开的固溶体药物组合物。
为了使用替米沙坦制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约60.1mg的替米沙坦和约2.0mL的异山梨醇二甲醚(作为稳定剂)添加到容器并加热到约50℃至约60℃直到混合物的所有组分溶解。将约2.03g的(Gattefosse)添加到所述溶液中并搅拌直到被混合,为熔点在41℃至45℃之间并包括饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且接着再加热至约40℃至约45℃以分装到模具内。所述制剂固化为具有澄清外观并且经再熔化而不形成沉淀。这些结果表明形成了包含替米沙坦的如本文所公开的固溶体制剂。
为了使用替米沙坦制备本文所公开的固溶体药物组合物,执行以下方法。在搅拌下将约160.2mg的替米沙坦、约1.0mL的(Gattefosse)和约1.0mL无水乙醇(作为稳定剂)添加到容器中并加热到约50℃至约60℃直到混合物的所有组分溶解,为甘油单亚油酸酯(作为室温液体脂质)。将约2.03g的(Gattefosse),添加到所述溶液中并搅拌直到被混合,为熔点在41℃至45℃之间并包括饱和C10-C18甘油三酯的混合物的蜡状固体(作为室温固体脂质)。接着将加热的混合物冷却到约37℃至约40℃,并通过倒入模具中分成等份并冷却至室温。或者,可以将混合物冷却至室温,且接着再加热至约40℃至约45℃以分装到模具内。
将制剂固化成具有澄清的外观。另外,DSC分析指示约34℃至约43℃的新的宽熔点温度范围(图13)。这个温度范围不同于单独的单个组分的温度范围:(Gattefosse)为41℃至45℃且替米沙坦为261℃至263℃。和无水乙醇在室温下为液体,并且同样两者都具有低于20℃的熔点。这些结果表明形成了包括替米沙坦的如本文所公开的固溶体制剂。
实例17
巨噬细胞摄取实验
此实例说明本文所公开的固溶体药物组合物优选地将治疗性化合物靶向于免疫系统。
U937单核细胞细胞系的培养物在补充有10%胎牛血清(FCS)的RPMI-1640中生长直至细胞达到90%的汇合单层。然后用PMA处理这些细胞并在5%的二氧化碳下在37℃的培养箱内培养直到细胞分化成巨噬细胞。巨噬细胞的单层用新鲜培养基洗涤且然后加入3mL的以下测试溶液中的一种:A)如本文所公开的包括布洛芬、(Gattefosse)、(Gattefosse)和PEG 400的固溶体制剂;B)本文所公开的包括布洛芬、菜籽油和乙醇的液体制剂;C)布洛芬游离酸;和D)不含治疗性化合物的介质。在培育45分钟之后,移除测试溶液上清液并进行保存以用于分析,且随后将所述细胞在PBS中洗涤若干次并使用两个循环冷融使其裂解。通过HPLC测量测试溶液、测试溶液上清液和细胞裂解组分中所存在的治疗性化合物的浓度。使用以下公式计算由巨噬细胞所摄取的治疗性化合物的百分比:吸附的治疗性化合物%=100×(从细胞裂解物中回收的化合物质量)/(测试溶液中传递的化合物质量–从测试溶液上清液回收的化合物质量)。结果示于下表1。这些结果表明,相对于并非以此方法配制的组合物,使用本发明所请求的药物组合物的制剂,通过巨噬细胞对治疗性化合物的平均摄取量增加550%或更多。
实例18
用于肠黏膜糜烂的动物模型
为了评估本文所公开的药物组合物是否降低胃刺激,使用肠黏膜糜烂鼠类模型进行实验。
将Sprague-Dawley大鼠分成每组含有五只动物的七个实验组。在整夜禁食之后,这些动物用七种不同处理之一单独被挑战。A组是其中每只小鼠仅仅口服1%甲基纤维素/0.5%聚山梨醇酯80介质的对照组。B组是其中每只小鼠仅仅口服溶剂/辅助剂介质(强饲10%乙醇和90%亚麻籽油)的对照组。C组是其中每只小鼠口服150mg/kg的阿司匹林的对照组。D组是其中每只小鼠口服100mg/kg的悬浮在1%甲基纤维素/0.5%聚山梨醇酯80中的布洛芬的对照组。E组是其中向每只小鼠口施给本文所公开的药物组合物(BC1054-100)的实验组,所述药物组合物包括100mg/kg的布洛芬、10%乙醇和90%亚麻籽油。F组是其中每只小鼠口服100mg/kg的悬浮在1%甲基纤维素/0.5%聚山梨醇酯80中的布洛芬的对照组。G组是其中向每只小鼠施给本文所公开的药物组合物(BC1054-200)的实验组,所述药物组合物包括200mg/kg的布洛芬、10%乙醇和90%亚麻籽油。处理4小时后杀死动物,且检查胃的出血和粘膜侵蚀性损伤的严重程度。胃刺激如下评分:0,没有损伤;1,充血;2,一或二处轻微损伤;3,超过两处轻微损伤或严重损伤;及4,非常严重损伤。相对于设定为100%的C组(阿司匹林处理对照组),50%或更多的分数被视为胃刺激的阳性评分。
结果列于表4。与C组(阿司匹林处理对照组)所诱发的胃损伤的严重程度相比,D组(100mg/kg布洛芬处理对照组)和F组(200mg/kg布洛芬处理对照组)产生严重程度分别为75%和95%的胃损伤。然而,与C组(阿司匹林处理对照组)相关联的胃损伤的严重程度相比,E组(BC1054-100处理的实验组)和G组(BC1054-200处理的实验组)产生严重程度分别为20%和40%的胃损伤。这些结果表明:本文所公开的药物组合物降低治疗性化合物可以导致胃粘膜损伤和引起胃刺激的程度。
实例19
用于炎症性肠病的动物模型
为了评估本文所公开的药物组合物在治疗炎症性肠病方面的有效性,使用TBS诱发的结肠炎鼠科模型进行实验。
C57BI/6雄性小鼠(6-7周龄)被分成七个实验组,其中每组含有至少10只动物。在第0天,在B-G组小鼠中,在异氟烷麻醉下通过直肠内施用50%乙醇中的100μL的TNBS(4mg)诱导了结肠炎。从第一天到第五天,每天一次或三次按七种不同处理方式中的一种向动物给药。A组是其中每只小鼠仅仅口服乙醇介质的对照组。B组是其中每只小鼠仅仅口服1%的甲基纤维素介质的对照组。C组是其中每只小鼠仅仅口服溶剂/辅助剂介质(强饲10%乙醇和90%亚麻籽油)的对照组。D组是其中每只小鼠口服3mg/kg的泼尼松龙的对照组。E组是其中每只小鼠口服20mg/kg悬浮在1%甲基纤维素(1mL/kg)的布洛芬(无辅助剂)的对照组。F组是其中向每只小鼠施给本文所公开的药物组合物(BC1054-20)的实验组,所述药物组合物包括20mg/kg的布洛芬、10%乙醇和90%亚麻籽油。G组是其中向每只小鼠施给本文所公开的药物组合物(BC1054-30)的实验组,所述药物组合物包括30mg/kg的布洛芬、10%乙醇和90%亚麻籽油。每天给动物称重并且视觉评价腹泻和/或血便的存在。在第3天和第5天,使用视频内窥镜检查评估所有动物的结肠炎的严重程度,其中采集图像并通过不知情的观察者在如下所述0至4等级上对结肠炎的严重程度进行直观评分:0,正常;1,血管分布的损失;2,血管分布的损失和脆性;3,脆性和糜烂;及4,胃溃疡和出血。在第5天进行内窥镜检查之后,杀死动物并将结肠取出且测量其长度与重量。获得血清样品并将结肠固定在10%的福尔马林中。收集、称重额外结肠组织块被并在液氮中急速冷冻。
这些实验的结果示于表5。B组(TNBS处理对照组)显示了与A组(未经乙醇处理的对照组)比较时平均重量变化的统计上显著的差异,所有其他组比较显示平均重量改变没有差异。B组(TNBS处理对照组)显示与A组(未经乙醇处理的对照组)相比时,平均结肠长度的统计学上显著的减少。此外,D组(泼尼松龙处理对照组)、F组(BC1054-20处理实验组)和G组(BC1054-30处理实验组)均显示与B组(TNBS处理的对照组)相比,平均结肠长度统计学上显著的增加。虽然B组(TNBS处理对照组)显示了与A组(未经乙醇处理的对照组)比较时平均结肠重量的统计上显著的增加,但所有其他组比较显示平均结肠重量没有差异。对于内窥镜检查结肠炎评分,D组(泼尼松龙处理对照组)显示当与B组(TNBS处理对照组)相比时,在第3天和第5天平均结肠炎评分的统计学上显著的降低。以类似方式,F组(BC1054-20处理实验组)和G组(BC1054-30处理实验组)显示当与B组(TNBS处理对照组)相比时,在第5天,平均结肠炎评分统计学上的显著降低。这些结果表明本文所公开的药物组合物对治疗炎症性肠病是有效的。
实例20
用于全身性关节炎的动物模型
为了评估本文所公开的药物组合物在治疗关节炎方面的有效性,使用α-胶原蛋白抗体诱导节炎(ACAIA)鼠类模型进行实验,所述鼠类模型模拟如风湿性关节炎等的全身性关节炎。
雄性BALB/c小鼠被分成8组,每一组包含10个动物。为诱发关节炎症状,在研究期第0天(研究开始)来自所有8组的小鼠被用抗体溶液200μL静脉注射,所述抗体溶液包括2mg的四种α-胶原蛋白II单克隆抗体(ARTHRITOMABTM,MD Biosciences)的混合物,然后在研究期第3天腹膜内注射200μL的包含100μg脂多糖(LPS)的溶液。从第0-11天给药,每一组每天经历对照组或测试处理如下:1组小鼠(1M)用含有1%甲基纤维素的介质介质制剂进行口服治疗,每日给药三次;2组小鼠(2M)用含有10mg/kg依那西普(Wyeth)的阳性对照制剂进行腹膜内治疗,每日给药一次;3组小鼠(3M)用包括布洛芬和菜籽油的20mg/kg的测试液体制剂(BC1054 LF-RO)进行口服治疗,每日给药一次;4组小鼠(4M)用包括布洛芬和菜籽油的20mg/kg的测试液体制剂(BC1054LF-RO)进行口服治疗,每日给药三次;5组小鼠(5M)用包括布洛芬和甘油单亚油酸酯(Gattefosse)的20mg/kg的测试液体制剂(BC1054 LF-MA)进行口服治疗,每日给药三次;6组小鼠(6M)用包括布洛芬和可可油的20mg/kg测试固体制剂(BC1054 LF-TO)进行口服治疗,每日给药三次;7组小鼠(7M)用包括布洛芬的20mg/kg的对照制剂1进行口服治疗,每日给药三次;且8组小鼠(8M)用20mg/kg的测试固体制剂(BC1054 LF-GE)进行口服治疗,每日给药三次(表6),所述测试固体制剂包括布洛芬和熔点在37℃至41℃之间并包含饱和C10-C18甘油三酯混合物的蜡状固体(Gattefosse)。
给药剂量基于各个动物体重的假设计算,平均重量20g。100μL的固定体积施用于每只小鼠,除那些接阳性对照(2M)动物施用200μL。
在关节炎诱导之前不久,在研究日第0天和随后的研究日3-7、9、10和12天(研究结束),对所有小鼠进行关节炎的发展和临床检查进行监控。为了获取关节炎的发展,获得关节炎评分和脚爪厚度(体积描记法)测量。关节炎评分基于使用严重性递增次序0-4等级对关节炎反应的视觉评估,其中0级表示无关节炎反应;1级表示脚踝/手腕的轻度但明确的红胀或限定于单独脚趾的明显的红肿,而不考虑受影响的脚趾的数量;2级表示脚踝/手腕中度到重度红肿;3级表示包括脚趾的整个脚爪的红肿,;且4级表示四肢最大程度地红肿且多关节损伤。使用刻度卡钳(德国慕尼黑的克勒普林)测量刚好在足垫上方和跟骨下方的两只后脚爪的脚爪厚度。确定脚爪厚度测量值的平均数值,并在适当情况下应用ANOVA利用图基因果分析进行的数据分析,以确定治疗效果的显著性。
临床检查包括体重变化、皮肤、毛皮、眼、粘膜的状况,分泌物和排泄物的检出率(例如,腹泻),和自主活动(例如,流泪、流涎、立毛、瞳孔大小、不正常的呼吸模式)。还记录了步态、姿势以及对操作的响应的改变,以及奇特行为、震颤、抽搐、睡眠和昏迷的存在。研究结束时收集血清。
从第3天开始,所有组的关节炎发病率增加。在组1M中,动物发病率高峰在第7天,其中9/10的动物显示了关节炎反应,这种情况保持相对恒定直至研究结束。在依那西普处理组2M小鼠中,发病率在第6天达到峰值,有9/10的动物显示出征兆,但第12天却降到了1/10。在每日一次或每日三次接收BC1054 LS-RO的组3M和组4M的动物中,关节炎的最高发病率是在第7天(分别为9/10和7/10的动物),且在第12天两组均减少至4/10的小鼠。在接收BC1054 LS-MA的组5M的动物中,关节炎的发病率在第6天达到高峰,其中8/10的动物受影响,并且发病率在动物评分6和8之间波动直至研究结束。第6天,在接收BC1054 SF-TO的组6M的动物中,有9/10的动物出现关节炎,但是这也发生波动并且在第12天止于7/10。在布洛芬处理组7M中,在第6天记录到关节炎发病率的高峰,其中有8/10的动物受影响,并且这种情况保持相对恒定直到研究结束。接收BC1054 LS-GE的组8M的小鼠在第6天显示最高发病率,其中9/10的动物呈现出关节炎征兆,但在第12天减少至4/10。
与LPS给药相关联的临床症状在第3天LPS加强免疫后在所有组中出现。这些症状在第12天在所有组中消失。在此研究期间没有死亡发生,在介质处理介质组和测试项目处理组之间没有显著的体重差异。
表7中给出平均脚爪厚度的结果。第0天,组1M的动物(经介质处理介质)中的平均后脚爪厚度是1.72±0.01。第9天,厚度增加并达到峰值2.33±0.15,且第12天结束于2.17±0.11。在经依那西普处理组2M的小鼠中,第0天,平均后脚爪厚度从1.70±0.02开始。在第12天减少回1.77±0.02之前,这在第6天增加达到峰值1.96±0.05。第9、10和12天,与阳性对照小鼠相比,依那西普处理导致显著地减少了脚爪体积。在每日一次接收BC1054 LS-RO的组3M中,第0天,后脚爪厚度是1.71±0.02。第7天,所述组中的肿胀已经达到峰值1.96±0.05,之后保持相对恒定。在BC1054 LS-RO给药后,第6天和第9天平均脚爪肿胀明显减少。在每日三次接收BC1054 LS-RO的组4M中,平均后脚爪厚度在第10天增加到1.97±0.08(从第0天的1.70±0.03开始),从第10天开始,脚爪体积保持相对恒定,直到研究结束。每日三次BC1054 LS-RO导致与经介质处理的介质小鼠(组1M)相比,在第6、7和9天,平均脚爪厚度显著减少。用BC1054 LS-MA治疗的组5M小鼠在第7天(从第0天1.69±0.02到1.97±0.05)脚爪体积已经达到峰值,所述组与经介质介质处理的组1M动物相比,在第6天和第9天尺寸显著减少。用BC1054 LS-TO治疗的组6M动物,平均后脚爪厚度第0天从1.74±0.01开始。在第12天减少回1.94±0.06之前,这在第7天增加且达到峰值2.05±0.10。无显著差异记录在BC1054 LS-TO治疗的动物(组6M)和用介质对照物治疗的所述动物介质(组1M)之间。在接收布洛芬的组(组7M)中,第0天后爪厚度是1.71±0.02。第7天,所述组的肿胀在第12天减少到2.02±0.08之前已经达到峰值2.15±0.10。当所述组与介质介质对照组1M相比时,没有观察到显著差异。用BC1054 LS-GE治疗的组8M动物,表现后脚爪厚度轻微增加,从第0天1.72±0.02到第7天1.85±0.06,此情况保持相对恒定,结束于第12天1.77±0.03。在6、7、9、10和12天,与介质对照物介质(组1M)相比,BC1054 LS-GE的给药导致动物(组8M)的脚爪肿胀显著地减少。
鉴于上面的调查结果,在每日一次接收BC1054 LS-RO给药的组3M的动物、每日三次接收BC1054 LS-RO给药的组4M的动物、每日三次接收BC1054 LS-MA给药的组5M的动物,和每日三次接收BC1054SF-GE给药的组8M的动物中观察到显著的抗关节炎活性。
实例21
用于心血管疾病的治疗的病例研究
对诊断出血胆固醇过高(4.35mmol/L的LDL)49岁的男性施加本文所公开的药物组合物(BC1054),为期7天,所述药物组合物(BC1054)包括20mg/kg的布洛芬、10%的乙醇以及90%的亚麻籽油(600mg,每日两次)。在5天的治疗后,患者的LDL水平正常到3.89mmol/L。如最后一次检查所确定的,在BC1054给药停止后,正常的LDL水平持续了2个月。
向新近被诊断出血胆固醇过高(4.31mmol/L的LDL)的60岁男性给予一个疗程的本文所公开的药物组合物(BC1054)以将LDL水平降到正常范围内,所述药物组合物(BC1054)包括20mg/kg的布洛芬、10%的乙醇以及90%的亚麻籽油(1200mg,每日一次)。在经过5天治疗后,患者的LDL水平降低到3.36mmol/L。对患者进行一个月的跟踪观察,尽管没有进一步的BC1054给药,患者的LDL水平仍维持在正常范围内。
实例22
心血管疾病的治疗
一62岁的女性被诊断升高的胆固醇水平。医师确定升高的胆固醇水平是由于高胆固醇血症造成的。所述女性通过每日两次口服给药本文所公开的包括布洛芬的药物组合物来进行治疗。或者,所述女性通过每日三次口服给药本文所公开的包括PPAR-γ激动剂的药物组合物来进行治疗。或者,所述女性通过每日两次口服给药本文所公开的包括吉非贝齐的药物组合物来进行治疗。对所述妇女的情况进行监控,在治疗大约1个星期后,测试表明她血中的胆固醇水平降低。在一和三个月检查时,该妇女的血液胆固醇水平持续在正常范围。高胆固醇血症症状的减轻表明用本文所公开的一种药物组合物进行治疗是成功的。本文所公开的相似类型的口服给药的药物组合物将用于治疗其他形式的疾病,例如,高胆固醇血症、高甘油三酯血症、高甘油三脂血症、高乳糜微粒血症、联合高脂血症,或包括高脂蛋白血症在内的血脂蛋白过多是Ia型高脂蛋白血症、Ib型高脂蛋白血症、Ic型高脂蛋白血症、IIa型高脂蛋白血症、IIb型高脂蛋白血症、III型高脂蛋白血症、IV型高脂蛋白血症、V型高脂蛋白血症。以类似方式,所述治疗性化合物中的任一种(例如,NSAID,比如水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂;PPARγ激动剂、核受体粘合剂、或抗高血脂剂,比如贝特类药物、抑制素、生育三烯酚、烟酸、胆酸螯合剂、胆固醇吸收抑制剂、胰脂酶抑制剂,或交感神经兴奋胺)将配制成一种药物组合物并按照如上所述施用给患者。
一58岁男性是主诉胸痛、呼吸困难和头晕。医师确定呼吸困难是由动脉粥样硬化造成的。所述男性被给予包含布洛芬的本文所公开的药物组合物口服给药一天两次。或者,所述男性被给予包含PPAR-γ激动剂的本文所公开的药物组合物口服给药一天三次。或者,所述男性被给予包含吉非贝齐的本文所公开的药物组合物口服给药一天两次。对所述男子的状况进行监测,在经过约3周的治疗后该男子表示呼吸改善且未经受头晕。在一个月和三个月进行检查时,所述男性表示他仍然需要改善呼吸,无头晕和较近胸口疼痛。动脉粥样硬化症状的减轻表明用本文所公开的一种药物组合物进行治疗是成功的。本文所公开的相似的类型的口服药物组合物将用于治疗患有另一类型的血管闭塞疾病(例如,周围血管疾病或者狭窄)的患者。以类似方式,所述治疗性化合物中的任一种,(例如,NSAID,比如水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂;PPARγ激动剂;核受体粘合剂;或抗高血脂剂,比如贝特类药物、抑制素、生育三烯酚、烟酸、胆酸螯合剂、胆固醇吸收抑制剂、胰脂酶抑制剂,或交感神经兴奋胺)将配制成药物组合物并按照如上所述施用给患者。
一位酗酒的67岁男性抱怨胸部有压力,左肩麻木。医师确定压力和麻木是因为酒精性心肌病造成的。该名男子通过每日口服两次本文公开的包含布洛芬的一种药物组合物来进行治疗。或者,该名男子通过每日口服三次本文公开的包含PPAR-γ激动剂的药物组合物来进行治疗。或者,该名男子通过每日口服两次本文公开的包含吉非贝齐的一种药物组合物来进行治疗。对该名男子的状况进行观察,在经过约3周的治疗后该男子表示麻木症状得到减轻。在2个月和3个月的体检中,该名男子表示肩部感觉好转,最近也没有出现胸部压力的症状。酒精性心肌病症状减轻表明使用本文所公开的药物组合物进行治疗是成功的。本文公开的一种药物组合物的类似类型口服可以用来治疗患有如下疾病的患者:心肌病,比如肢端肥大症、酒精性心肌病、淀粉样变性、美洲锥虫病、化疗、糖尿病心肌病、血色沉着症、高血压心肌病、甲状腺机能亢进、炎症性心肌病、缺血性心肌病、肌营养不良症、瓣膜性心肌病、继发系统性代谢心肌病、继发系统性营养疾病心肌病、冠心病或先天性心脏病这类的外源性心肌病;或者内源性心肌病,例如扩张性心肌病(DCM)、肥大性心肌病(HCM或HOCM))、致心律失常性右心室心肌病(ARVC)、限制性心肌病(RCM)、心室致密化不全心肌病、孤立性心肌致密化不全、线粒体心肌病、应激性心肌病和Loeffler心内膜炎。以类似方式,所述治疗性化合物中的任一种(例如,NSAID,比如水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂;PPARγ激动剂;一种核受体结合剂;或抗血脂剂,比如贝特类药物、他汀类药物、生育三烯酚、烟酸、胆酸螯合剂、胆固醇吸收抑制剂、胰脂酶抑制剂,或交感神经兴奋胺)将配制成一种药物组合物并如上所述施用给患者。
一位73岁女性抱怨沿她的右腿向下出现肌肉痉挛和冷觉。医师判定症状是因为股动脉动脉炎造成的。该名女性通过每日口服两次本文公开的包含布洛芬的药物组合物来进行治疗。或者,该名女性通过每日口服三次本文公开的包含PPAR-γ激动剂的药物组合物来进行治疗。或者,该名女性通过每日口服两次本文公开的包含吉莫非齐的药物组合物来进行治疗。对该妇女的情况进行观察,在经过大约三星期治疗之后,该名女性表示腿上肌肉痉挛已经减轻,没有冷觉。在之后两月和三月进行的体检中,该名女性表示依然没有出现痉挛或者冷觉。动脉炎症状减轻表明使用本文所公开的药物组合物进行治疗是成功的。本文所公开的药物组合物的类似类型的口服被用于治疗患有另外一种类型的血管炎患者,所述血管炎例如血栓闭塞性脉管炎、动脉炎、脑血管炎、变应性肉芽肿性血管炎、冷球蛋白血症、原发性冷球蛋白血症性血管炎、巨细胞动脉炎、高尔夫球手脉管炎、亨-舍二氏紫癜、过敏性脉管炎、川崎病、静脉炎、微小多动脉炎/多血管炎、结节性多动脉炎、风湿性多肌痛(PMR)、类风湿性脉管炎、大动脉炎、血栓性静脉炎、韦格纳肉芽肿病、病毒感染继发血管炎、或者结缔组织病继发血管炎,包括系统性红斑狼疮(SLE)、类风湿性关节炎(RA)、复发性多软骨炎或者白塞病。以类似方式,所述治疗性化合物中的任一种(例如,NSAID,比如水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX1)抑制剂、选择性环加氧酶2(COX 2)抑制剂;PPARγ激动剂;核受体结合剂;或抗高血脂剂,比如贝特类药物、他汀类药物、生育三烯酚、烟酸、胆酸螯合剂、胆固醇吸收抑制剂、胰脂酶抑制剂,或交感神经兴奋胺)将配制成一种药物组合物并如上所述施用给患者。
一37岁男性诉说胸痛。医师确定疼痛是由于心内膜炎所致。该男性被给予包含布洛芬的本文所公开的药物组合物口服给药一天两次。或者,该男性被给予包含PPAR-激动剂的本文所公开的药物组合物口服给药一天三次。或者,该男性被给予包含吉非贝齐的本文所公开的药物组合物口服给药一天两次。对该名男子的状况进行监测,在经过约1周的治疗后该男子表示呼胸痛减轻。在一个月和三个月进行检查时,该男性表示他连续没有胸痛。心内膜炎症状的减轻表明用本文所公开的一种药物组合物进行治疗是成功的。本文所公开的相似的类型的口服的药物组合物将用于治疗患有另一类型的炎症性心脏疾病,所述炎症性心脏疾病例如,心脏肥大的炎症或心肌炎。以类似方式,所述治疗性化合物中的任一种(例如,NSAID,比如水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID,非选择性环加氧酶(COX)抑制剂、选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂;PPARγ激动剂;核受体粘合剂;或抗高血脂剂,比如贝特类药物、他汀类药物、生育三烯酚、烟酸、胆酸螯合剂、胆固醇吸收抑制剂、胰脂酶抑制剂,或交感神经兴奋胺)将配制成药物组合物并如上所述施用给患者。
一59岁女性主诉具有呼吸困难并被诊断患有高血压。医师确定其关节僵硬和膨胀是由高血压疾病造成的。该女性被给予包含布洛芬的本文所公开的药物组合物口服给药一天两次。或者,该女性被给予包含PPAR-γ激动剂的本文所公开的药物组合物口服给药一天三次。或者,该女性被给予包含吉非贝齐的本文所公开的药物组合物口服给药一天两次。该妇女的情况被监测,在治疗大约3星期之后,该妇女表明她的呼吸正在改善,她的血压在正常范围之内。在二个月和三个月检查时,妇女表明她继续正常地呼吸,她的血压在正常范围之内。高血压症状的减轻表明用本文所公开的一种药物组合物进行治疗是成功的。本文所公开的相似类型的口服给药的药物组合物将被用于治疗患有心血管疾病的患者,所述疾病例如,冠状心脏病、缺血性心脏病、充血性心力衰竭、高血压性心脏病、心脏瓣膜病、高血压、心肌梗塞、糖尿病性心脏、动脉瘤、栓塞、剥离(dissection)、假性动脉瘤、血管畸形、血管痣、血栓形成、静脉曲张和中风。以类似方式,所述治疗性化合物中的任一种(例如,NSAID,比如水杨酸衍生物NSAID、对氨基苯酚衍生物NSAID、丙酸衍生物NSAID、乙酸衍生物NSAID、烯醇酸衍生物NSAID、芬那酸衍生物NSAID、非选择性环加氧酶(COX)抑制剂,选择性环加氧酶1(COX 1)抑制剂、选择性环加氧酶2(COX 2)抑制剂;PPARγ激动剂;核受体粘合剂;或抗高血脂剂,比如贝特类药物、他汀类药物、生育三烯酚、烟酸、胆酸螯合剂、胆固醇吸收抑制剂、胰脂酶抑制剂,或交感神经兴奋胺)将配制成药物组合物并按照如上所述施用给患者。
最后,应理解的是,虽然通过参考具体的实施例突出说明了本说明书的各方面,但本领域技术人员将容易了解,这些公开的实施例仅说明本文所公开的主题的原理。因此,应理解的是,所公开的主题决不限于本文中描述的特定方法、协议和/或试剂等。因此,在不偏离本说明书的精神的情况下,可以根据本文的教示对所公开的主题进行修改或变动或进行替代性配置。最后,本文中所用的术语仅用于描述特定实施例的目的,且并不意图限制本发明的范围,本发明的范围仅由权利要求书限定。因此,本发明不限于精确地如所展示和描述的内容。
本文描述了本发明的某些实施例,包括发明人已知的进行本发明的最佳方式。当然,在阅读上述描述后,这些所述实施例的变更对于本领域的一般技术人员将是显而易见的。发明人希望熟练的技术人员适当地采用这类变更,并且发明人期望以与本文具体描述所不同的方式实践本发明。因此,如适用的法律所许可,本发明包括附加的权利要求书中所述的主题的所有修改和等效物。此外,除非本文另有说明或与上下文明显矛盾,本发明包括上述实施例在其所有可能变更中的任何组合。
本发明的替代实施例、要素或步骤的分组不应解释为限制性的。各组成员可被单独提到或请求保护,或与本文公开的其他组成员任意组合。预期由于便利和/或专利性的原因,一组的一个或多个成员可以被包括进一组中或从所述组中删除。当任何此类包括或删除发生时,说明书被视为含有经过修改的组,因此满足对所附权利要求书中所使用的全部马库什组的书面描述。
除非另有说明,否则本说明书和权利要求书中所使用的表示特性、项目、数量、参数、属性、术语等等的所有数字应理解为在所有情况下均由术语“约”所修饰。如本文所使用,术语“约”表示如此限定的特性、项目、数量、参数、属性或术语包括所陈述的特性、项目、数量、参数、属性或术语的值以上和以下的正或负10%的范围。因此,除非有相反的指示,否则本说明书和所附权利要求中的数字参数是可以改变的近似值。在绝非试图将等同原则的应用限制于权利要求书的范围的情况下,每个数字指示应当至少按照所报道的有效数字并采用常规的四舍五入技术来解释。虽然,阐述本发明广义范围的数字范围和值是近似值,但是在具体实例中阐述的数字范围和值尽可能精确地报告。然而,任何数字范围或值都固有地含有特定的误差,所述误差必然是由各自的测试测量中发现的标准偏差造成的。本文叙述的值的数字范围仅意图用作单独参考落入所述范围的每个单独的数值的简写方法。除非本文另有指示,否则数字范围的每个单独的值被并入到本说明书中,如同其单独在本文中叙述一样。
除非在本文另有说明或上下文明显矛盾,描述本发明(特别是在以下的权利要求书上下文中)的上下文中使用的术语“一”、“所述”和类似指示物被解释为涵盖单数和复数。本文所述的所有方法可以任何合适的次序进行,除非本文另有说明或者上下文明显矛盾。本文提供的任何以及所有实例,或示范性的语言(例如“例如”)的使用仅用来更好地诠释本发明,且并不限制另外所要求的本发明的范围。说明书中的任何语言不应解释为实践本发明所必需的任何非请求的要素。
本文公开的具体实施例可以在权利要求书中使用“由...组成”或“基本由...组成”的语言进一步限制。当在权利要求书中使用时,过渡术语“由...组成”,无论是提交申请时还是每次修改中添加的,都不包括没有在权利要求中指定的任何要素、步骤或成分。过渡术语“基本由...组成”将权利要求书的范围限定为指定的材料或步骤以及那些实质上不影响基本和新颖特性的材料和步骤。本发明所请求保护的实施例在本文中得以固有地或明确地描述并被启用。
所有的专利,专利公开案,以及本说明书中涉及和指定的其他出版物分别并明确地通过全文引用的方式并入本文中,以用于描述和公开例如可结合本发明使用的这些出版物中所述的组合物和方法论的目的。提供这些出版物仅仅因为其公开早于本申请案的申请日。由于在先发明或任何其他原因,本发明人无权提早这些公开的日期,不应所述将这一点视为本发明人的承认。有关日期的所有声明或有关这些文档的内容的陈述是基于申请人可获取的信息,并不构成对这些文档的日期或内容的正确性的任何承认。
- 还没有人留言评论。精彩留言会获得点赞!