一类葡萄糖醛酸转移酶UGT1A1的诱导剂及其应用的制作方法
本发明属医药技术领域,具体涉及一类葡萄糖醛酸转移酶UGT1A1的诱导剂及其应用。
背景技术:
胆红素是体内铁卟啉化合物的主要代谢产物,不溶于水,很难由肾脏排出,在体内过量蓄积可对大脑和神经系统引起不可逆的损害。当肝脏葡萄糖醛酸转移酶UGT1A1功能正常时,胆红素在肝细胞UGT1A1酶作用下,与葡萄糖醛酸结合,转变为水溶性的结合胆红素,由肾脏排出。遗传因素或后天因素均能引起UGT1A1酶活性的下降,从而影响胆红素的代谢清除,引发临床上的高胆红素血症。Gilbert(GS)综合征与Crigler-Najjar(CNS)综合征的发病机制均为遗传因素导致的UGTA1酶活性不足,造成血清中非结合胆红素升高。可见,UGT1A1活性差异在高胆红素血症发病中发挥关键作用,而开发UGT1A1酶的诱导剂对于治疗高胆红素血症具有非常重要的意义。
UGT1A1酶不仅能代谢清除内源毒物,也可以促进多种外源底物的代谢解毒。CPT-11是喜树碱的结构衍生物,通过抑制细胞内拓扑异构酶Ι的活性,抑制癌细胞生长,从而达到治疗肿瘤的作用。目前CPT-11单独或联合用药已作为转移性大肠癌的一线治疗方案,同时该药对多种实体肿瘤均有好的疗效【Lancet.2000;355:1041-7.】。虽然CPT-11在临床取得了令人满意的治疗效果,但是由其引发的严重不良反应成为不可回避的问题。CPT-11的毒副作用主要包括:迟发性腹泻与中性粒细胞减少【.Clinical Pharmacology&Therapeutics.2002;72:265-75.European journal of cancer.2010;46:1856-65.】。根据文献报道,CPT-11的这种剂量依赖性毒性与其活性代谢产物SN-38在人体内的蓄积有关,其中负责将SN-38 转化为无毒成分SN-38G的主要二相药物代谢酶UGT1A1的活性与其毒性发生密切关系。UGT1A1*28与UGT1A1*6这两个基因型已被报道能显著降低酶的活性,多个临床研究证实UGT1A1酶的这两个基因型与CPT-11引发的毒性具有统计相关性【The pharmacogenomics journal.2002;2:43-7.Drug Metabolism and Disposition.2009;37:272-6.】。而最新研究结果也显示,提高肠道中UGT1A1酶的活性能显著降低CPT-11引发的毒性【Proceedings of the National Academy of Sciences of the United States of America.2013;110:19143-8.】,这也为探索降低CPT-11毒副作用提供了新的思路。因此,开发出安全有效的UGT1A1酶诱导剂,用以降低CPT-11引发的毒副反应,显得尤为重要。
技术实现要素:
本发明的目的是提供一类新型葡萄糖醛酸转移酶UGT1A1的诱导剂及其应用,该类药物可显著提高UGT1A1的表达量与活性,进而用于治疗高胆红素血症或缓解CPT-11等抗肿瘤药物引发的毒副反应。
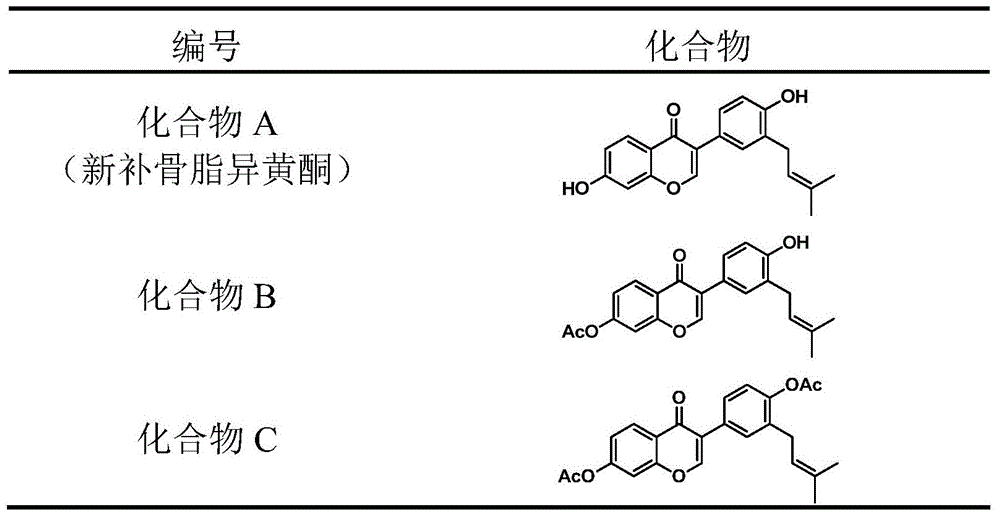
本发明提供的一类新型葡萄糖醛酸转移酶UGT1A1的诱导剂,具体为4’,7-二羟基-3’-异戊烯基异黄酮及其乙酰化衍生物,其通式结构式如下所示:
其中:R1、R2为—Ac或—H中的任意一种。
一类葡萄糖醛酸转移酶UGT1A1的诱导剂的应用,该类诱导剂可显著诱导 上调UGT1A1酶的表达与活性,进而增加机体对胆红素的代谢清除能力,降低其致毒反应。
一类葡萄糖醛酸转移酶UGT1A1的诱导剂的应用,该类诱导剂可通过诱导人肠道及肝脏体系的UGT1A1酶,加快CPT-11水解产物SN38的代谢清除,进而预防或减缓SN38产生的毒副效应。
一类含有葡萄糖醛酸转移酶UGT1A1的诱导剂的药物,该类药物可采用多种剂型,如普通片剂、缓释片、肠溶片、胶囊剂、滴丸、注射剂等剂型。
本发明所述UGT1A1强效诱导剂的应用,该类药物可通过诱导UGT1A1酶的表达,增强肝脏对胆红素的代谢,进而减缓或消除由于胆红素体内蓄积导致的高胆红素血症。由此可见,该类药物能治疗由UGT1A1活性不足引起的Gilbert综合征、Crigler-Najjar综合征。
本发明还提供了所述的UGT1A1酶诱导剂的另一个应用,所述的药物能诱导UGT1A1酶的表达与活性,提高其底物的代谢清除:该类诱导剂在与药物(UGT1A1酶的底物或其代谢产物为UGT1A1酶的底物)合用时,通过诱导人肠道及肝脏体系的UGT1A1酶,增加药物(UGT1A1酶的底物或其代谢产物为UGT1A1酶的底物)的肝肠代谢清除,减少其毒副效应。
本发明提供的4,7-二羟基-3’-异戊烯基异黄酮及其乙酰化衍生物在治疗高胆红素血症与提高其外源底物代谢清除方面的应用,该类药物可作为单体或药物组合物使用。
本发明涉及的UGT1A1酶诱导剂——4,7-二羟基-3’-异戊烯基异黄酮的乙酰化衍生物,可在肝肠组织被酯酶水解,在靶器官释放出4,7-二羟基-3’-异戊烯基异黄酮,避免首过效应,提高口服生物利用度。
本发明涉及的治疗高胆红素血症的药物具有如下优点:
1.活性强:该类药物对UGT1A1酶的诱导能力强,其对UGT1A1酶的诱导能力显著强于目前公认的阳性对照药物白杨素。
2.安全性高:该类药物大剂量小鼠整体给药后,未发现明显毒副作用,其LD50>2g/kg,属于相对安全的药物候选物。
3.膜通透性强:该类药物可被肠上皮细胞快速吸收,其还可快速穿透肝细胞进入细胞内作用靶点,其细胞膜通透性远高于阳性对照药物白杨素。
附图说明
图1 UGT1A1诱导剂4’,7-二羟基-3’-异戊烯基异黄酮及其乙酰化衍生物的结构式;
图2 UGT1A1诱导剂4’,7-二羟基-3’-异戊烯基异黄酮二乙酰的NMR谱图;
图3 4’,7-二羟基-3’-异戊烯基异黄酮诱导Caco-2细胞UGT1A1酶mRNA表达随时间的变化;
图4 4’,7-二羟基-3’-异戊烯基异黄酮诱导Caco-2细胞UGT1A1酶mRNA表达随浓度的变化;
图5 该类药物诱导Caco-2细胞UGT1A1酶活性的能力;
图6 该类药物的细胞毒性。
具体实施方式
下列实施例是为了进一步说明本发明,而不是要限制其范围。
实施例1
4’,7-二羟基-3’-异戊烯基异黄酮二乙酰衍生物的制备
称取4’,7-二羟基-3’-异戊烯基异黄酮(图1,化合物A)200mg溶于二氯甲烷 10mL中,加入三乙胺0.5mL,反应液冷却至0℃,缓慢滴加乙酰氯100μL。反应1h,TLC检测反应结束,缓慢加入水20mL,二氯甲烷30mL提取两次,合并有机相,水洗,无水硫酸钠干燥,过滤,滤液减压蒸干后得粗品。粗品4mL甲醇加热回流30min,冷却,过滤,收集滤饼,真空干燥后得4’,7-二羟基-3’-异戊烯基异黄酮二乙酰衍生物(图1,化合物C)230mg,白色固体,收率91%。其中4,7-二羟基-3’-异戊烯基异黄酮二乙酰的核磁谱图如图2所示。
1H NMR(400MHz,DMSO-d6)δ:1.69(s,6H,2CH3),2.31(s,3H,COCH3),2.34(s,3H,COCH3),3.23(d,J=4Hz,2H,CH2),5.20(t,J=8Hz,1H,CH=C),7.13(d,J=4Hz,1H,ArH),7.33(dd,J=8.8Hz,J=2Hz,1H,ArH),7.44(dd,J=8.4Hz,J=2Hz,1H,ArH),7.48(d,J=2Hz,1H,ArH),7.58(d,J=2Hz,,1H,ArH),8.19(d,J=8.4Hz,1H,ArH),8.55(s,1H,OCH=C);
ESI-MS:m/z 407.1为[M+H]+,445.1为[M+K]+。
实施例2
该类药物诱导UGT1A1酶mRNA表达的能力
将Caco-2接种于24孔板中,孵育24小时后将培养基更换为新鲜的含有4’,7-二羟基-3’-异戊烯基异黄酮的含药培养基,化合物终浓度为25μM。每天更换含药新鲜培养基,分别在培养12、24、48、72h后用RNA提取试剂收集细胞。按RNA提取试剂所附的操作流程提取总mRNA,并用反转录试剂盒将mRNA反转录成cDNA。随后用real-time PCR仪测定细胞中UGT1A1酶的mRNA表达水平。通过测定新补骨脂异黄酮随时间对UGT1A1酶表达的诱导能力(图3)可以看出4’,7-二羟基-3’-异戊烯基异黄酮对UGT1A1的诱导能力随诱导时间增加而增强。采用同样的技术考察诱导剂浓度对UGT1A1诱导能力的影响(图4),表明4’,7-二羟基-3’-异戊烯基异黄酮在0-50μM浓度范围内随诱导剂浓度增加,诱导 能力增强。另外,7-二羟基-3’-异戊烯基异黄酮的乙酰化衍生物对Caco-2细胞UGT1A1 mRNA诱导能力与7-二羟基-3’-异戊烯基异黄酮相当,25μM7-二羟基-3’-异戊烯基异黄酮单乙酰和7-二羟基-3’-异戊烯基异黄酮双乙酰与Caco-2细胞孵育72h,均能提高10倍左右的UGT1A1 mRNA表达。
实施例3
荧光探针法测定该类药物诱导UGT1A1酶活性的能力
Caco-2细胞接种于75cm2的培养瓶,培养至70%融合时,加入25μM 4’,7-二羟基-3’-异戊烯基异黄酮及其乙酰化衍生物,培养期间每天更换含药新鲜培养基,直到孵育3天。孵育结束后,用胰酶消化收集细胞,并用冰PBS清洗细胞3次。在细胞沉淀中加入含有1%cocktail蛋白酶抑制剂的PBS,置于冰上进行超声破碎,随后9000g离心20min,收集上清即为细胞S9成分,用以测定UGT1A1酶的活性。UGT1A1酶活性的测定流程如下:
(1)200微升体外代谢反应体系中,含有50mM Tris-Hcl缓冲液(PH=7.4),细胞S9的蛋白浓度为1mg/ml,Mgcl2为5mM,UGT1A1探针底物浓度为20μM,于37℃条件下震荡预孵5分钟;
(2)向反应体系中加入UDPG A(终浓度4mM),起始反应;于37℃条件下反应90分钟后,加入200μl的乙腈,剧烈震荡后,终止反应;
(3)采用高速冷冻离心机,在20000g的条件下,高速离心上述体系10分钟后,取上清,采用荧光酶标仪对水解代谢产物进行定量检测。结果(图5)表明4’,7-二羟基-3’-异戊烯基异黄酮及其乙酰化衍生物对UGT1A1酶活性的诱导能力强于对照药物白杨素。
实施例4
该类药物的透膜评估
该类药物的透膜评估采用经典的Caco-2细胞模型。将Caco-2细胞接种于Transwell,培养21天以后,利用电阻率仪测定跨膜电阻值(TEER)确定上皮细胞层紧密性和完整性后,即可用于药物的跨膜转运实验。在细胞层顶侧(绒毛面,A面)培养液中加入药液,同时在底侧(基底面,B面)加入1.5ml空白缓冲溶液,开始转运实验,分别在30min、60min、90min、120min在底侧取100μl药液,并同时补足100μl空白缓冲溶液。利用HPLC测定待测药物浓度。利用公式:Papp=ΔQ/(Δt·A·C0)计算药物的表观渗透系数(apparent permeability coefficients,Papp),其中ΔQ为Δt内的转运量,A为膜面积,C0为药物的初始浓度,根据算得的Papp值评价其透膜能力变化。结果显示,三个化合物都是高通透性的药物,证明该类药物可被肠上皮细胞快速吸收,其还可快速穿透肝、肠细胞进入细胞内作用靶点,其细胞膜通透性远高于阳性对照药物白杨素。
实施例5
该类药物的毒性评估
该类药物的细胞毒性评估采用标准的MTT方法。Caco-2细胞种植于96孔板,每孔10000个细胞。贴壁24h后,加入系列浓度的药物,对照组加入等浓度的DMSO,培养基中的DMSO浓度均保持为0.5%。加药孵育48小时后,弃去含药培养基,加入含有0.5mg/ml MTT的无血清培养基,37℃孵育4小时。孵育结束后,轻轻吸去培养基,每孔加入150μL DMSO,震荡混匀10分钟。酶标仪检测490nm下的吸收。结果如图6所示,该类药物为50μM时,Caco-2细胞的存活率大于95%,表明该化合物具有较好安全性。
选取昆明小鼠(购于大连医科大学实验动物中心),雌雄各半,体重19-22g。将小鼠随机分组,每组20只,雌雄各半。4’,7-二羟基-3’-异戊烯基异黄酮及其乙酰化衍生物混悬于0.5%CMC-Na中,浓度为1g/L。实验组包括药物不同剂量 组(50~2000mg/kg)以及0.5%CMC-Na空白对照组。连续观察给药后小鼠的行为状态直至14天,并于第14天对不同给药组小鼠进行大体解剖并观察内脏情况。高剂量组2.0g/kg和1.5g/kg给药组分别观察到7和3例死亡例,其他剂量组均无死亡例。对死亡个体进行解剖并未发现肝、肾等主要器官的明显病变。实验结果提示小鼠口服该类药物的LD50值大于2.0g/kg,属于轻度毒性级别。
- 还没有人留言评论。精彩留言会获得点赞!