用于治疗或预防代谢疾病的包含作为活性成分的来源于Akkermansiamuciniphila菌的胞外囊泡的组合物的制作方法
本发明涉及用于治疗、预防或缓解代谢疾病的包含作为活性成分的来源于Akkermansia muciniphila的胞外囊泡的药物组合物和食品组合物。
背景技术:
代谢疾病是由于体内代谢紊乱而发生的疾病的总称。代谢疾病通常是由碳水化合物、脂质、蛋白质、维生素、电解质、水等的失衡而引起的。代谢疾病的实例包括肥胖症、糖尿病、高脂血症、动脉硬化症、高血压等。其中,II型糖尿病是成年型发病糖尿病,其特征是胰岛素耐受性增加。当胰岛素受体数量下降时,胰岛素受体敏感性下降,或者产生激活细胞内糖原生成的第二信使的问题,对胰岛素的敏感性降低。因此,被称为非胰岛素依赖型糖尿病的II型糖尿病占糖尿病总数的85%至90%。
同时,近年来,已报导了原核细胞或真核细胞分泌胞外囊泡且分泌的囊泡实施多种功能。从细菌分泌的胞外囊泡已知包含脂多糖(LPS)和细菌来源的蛋白质,且诱发炎性疾病。然而,抑制由病原菌来源的囊泡引起的局部炎症反应的机制仍然是未知的。
此外,已报导了在多种分泌的物质、排泄物或来自人类或动物的组织灌洗液中发现了胞外囊泡,且存在于组织中的胞外囊泡已知反映了分泌所述囊泡的所述组织的状态,并能用于诊断疾病。
在大肠中,肠道菌群存在的数量是宿主细胞数量的大约10倍。Akkermansia muciniphila已知为生存于共生的哺乳动物(包括人类)大肠中的粘蛋白-降解革兰氏阴性菌,并且与糖尿病和肥胖症有关。而且,已知Akkermansia muciniphila本身恶化炎症性肠病。近年来,本发明人已报导了Akkermansia muciniphila分泌胞外囊泡,其能预防炎症性肠病(Kang CS et al.,Extracellular vesicles derived from Gut microbiota,especially Akkermansia muciniphila,protect the progression of dextran sulfate sodium-induced colitis;PLOS ONE 2013)。
同时,5'AMP-激活的蛋白激酶(AMPK)是在细胞内能量平衡中起重要作用的酶,并在肝、脑、肌肉、脂肪组织、胰腺等中表达。已知在激活AMPK时,在肝中的胆固醇合成和甘油三酯合成受到抑制,在肌肉中的脂肪酸氧化和葡萄糖摄取受到刺激,以及胰腺中的胰岛素分泌得到调控。而且,已知代谢疾病通过二甲双胍激活AMPK或者通过运动等而得到改善以使胰岛素耐受恢复,二甲双胍是一种用于糖尿病的治疗剂。
然而,没有研究发现表明可通过Akkermansia muciniphila-来源的胞外囊泡或者通过Akkermansia muciniphila本身缓解或治疗诸如肥胖症或糖尿病等的代谢疾病。
技术实现要素:
[技术问题]
本发明人发现从Akkermansia muciniphila分泌的胞外囊泡抑制由高脂肪饮食引起的肥胖症和糖尿病,并使胰岛素耐受恢复,其对于由高脂肪饮食诱导的糖尿病的发病原因是重要的,所有这些均发生在AMPK被激活之时。因此,本发明是基于这样的事实完成的。
因此,本发明的一个目的是提供一种使用Akkermansia muciniphila-来源的胞外囊泡治疗或预防诸如肥胖症、糖尿病、高脂血症、高血压等之类的代谢疾病的药物组合物和食品组合物。
[技术方案]
为实现这样的目的,本发明提供一种用于治疗或预防代谢疾病的包含作为活性成分的Akkermansia muciniphila-来源的胞外囊泡的药物组合物。
此外,本发明提供一种用于预防或缓解代谢疾病的包含Akkermansia muciniphila-来源的胞外囊泡的食品组合物。
此外,本发明提供用于预防或治疗代谢疾病的方法,其包括向受试者施用Akkermansia muciniphila-来源的胞外囊泡。
此外,本发明提供Akkermansia muciniphila-来源的胞外囊泡用于预防或治疗代谢疾病的用途。
在本发明的一实施方式中,所述胞外囊泡可天然或人工地从Akkermansia muciniphila分泌得到。
在本发明的另一实施方式中,所述胞外囊泡可具有的平均直径为20-300nm,优选50-200nm。
还在本发明的另一实施方式中,所述代谢疾病可选自肥胖症、糖尿病、高脂血症和高血压。
还在本发明的另一实施方式中,所述食品可以是通过添加Akkermansia muciniphila进行发酵制备得到的发酵食品。
[有益效果]
根据本发明的包含作为活性成分的Akkermansia muciniphila-来源的胞外囊泡的药物组合物可治疗和预防由高脂肪饮食诱导的诸如肥胖症、糖尿病、高脂血症、高血压等的代谢病。
此外,根据本发明的包含Akkermansia muciniphila-来源的胞外囊泡的发酵食品组合物可预防和缓解由高脂肪饮食诱导的诸如肥胖症、糖尿病、高脂血症、高血压等的代谢病。
附图说明
图1举例说明了通过电子显微镜观察从Akkermansia muciniphila的培养基分离得到的胞外囊泡得到的结果。
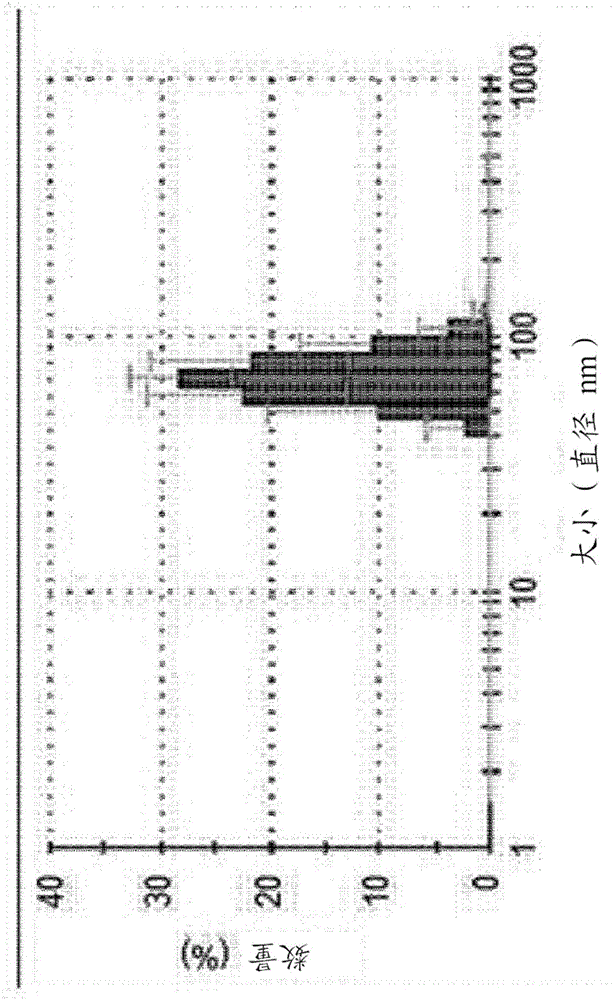
图2举例说明了通过光散射方法测量Akkermansia muciniphila-来源的胞外囊泡的平均直径所得到的结果。
图3举例说明了通过SDS-PAGE比较和评价Akkermansia muciniphila和Akkermansia muciniphila-来源的胞外囊泡的蛋白表达模式所得到的结果。
图4举例说明了表明以下的结果:在巨噬细胞经Akkermansia muciniphila-来源的胞外囊泡(EV)预处理时,LPS引起的促炎性细胞因子(IL-6)的分泌受到抑制。
图5举例说明了一种实验方案,其用于确认在Akkermansia muciniphila-来源的胞外囊泡(EV)被直接给药至由高脂肪饮食诱发的肥胖和糖尿病的小鼠模型的胃部之后对代谢疾病的治疗效果。
图6举例说明了通过观察在Akkermansia muciniphila-来源的胞外囊泡(Akk EV)被直接给药至由高脂肪饮食诱发的代谢疾病小鼠模型的胃部之后体重的变化所得到的结果。
图7举例说明了通过测量在Akkermansia muciniphila-来源的胞外囊泡(Akk EV)被直接给药至由高脂肪饮食诱发的代谢疾病小鼠模型的胃部之后在禁食时血浆葡萄糖水平所得到的结果。
图8举例说明了通过测量在Akkermansia muciniphila-来源的胞外囊泡(Akk EV)被直接给药至由高脂肪饮食诱发的代谢疾病小鼠模型的胃部之后在血液中胰岛素的浓度所得到的结果。
图9举例说明了通过测量在Akkermansia muciniphila-来源的胞外囊泡(Akk EV)被直接给药至由高脂肪饮食诱发的代谢疾病小鼠模型的胃部之后从所述躯体分离脾细胞然后用抗-CD3抗体和抗-CN28抗体刺激48小时所得到的上清液中IFN-γ和IL-17的浓度所得到的结果。
图10举例说明了通过确认在小鼠肌细胞经高脂肪酸处理以诱发胰岛素耐受之后受抑制的胰岛素信号转导是否被Akkermansia muciniphila-来源的胞外囊泡(Akk EV)恢复而得到的结果。
图11举例说明了通过比较和评价在Akkermansia muciniphila(细菌)和Akkermansia muciniphila-来源的胞外囊泡(EV)的每一种被直接给药至小鼠的胃部之后Akkermansia muciniphila(细菌)和Akkermansia muciniphila-来源的胞外囊泡(EV)的体内分布模式而得到的结果。
图12举例说明了通过在Akkermansia muciniphila(细菌)和Akkermansia muciniphila-来源的胞外囊泡(EV)的每一种被直接给药至小鼠的胃部之后12小时提取血液和多种器官(例如心脏、肺、肝、肾、脾、脂肪组织和肌肉),比较和评价Akkermansia muciniphila(细菌)和Akkermansia muciniphila-来源的胞外囊泡(EV)的体内分布模式所得到的结果。
图13举例说明了通过比较和评价在Akkermansia muciniphila(细菌)和Akkermansia muciniphila-来源的胞外囊泡(EV)的每一种被直接给药至小鼠的大肠之后Akkermansia muciniphila(细菌)和Akkermansia muciniphila-来源的胞外囊泡(EV)是否透过肠道屏障然后被吸收入组织而得到的结果。
图14举例说明了通过确认在Akkermansia muciniphila-来源的胞外囊泡(EV)被直接给药至小鼠的大肠之后胞外囊泡是否被吸收入肠道毛细血管所得到的结果。
图15举例说明了通过确认在体外Akkermansia muciniphila-来源的胞外囊泡(EV)被以不同的浓度(0.1、1和10μg/mL)给药至肌细胞之后60分钟AMPK激活而得到的结果。
图16举例说明了通过确认在体外Akkermansia muciniphila-来源的胞外囊泡(EV)被以1μg的剂量给药至肌细胞之后在不同时间点(10、20、30和60分钟)AMPK激活而得到的结果。
图17举例说明了通过确认在体外二甲双胍(一种AMPK信号抑制剂(化合物C))和大肠杆菌来源的胞外囊泡被分别给药至肌细胞之后AMPK激活而得到的结果。
图18举例说明了通过比较和评价在体外胰岛素、二甲双胍和Akkermansia muciniphila-来源的胞外囊泡(EV)被分别给药至肌细胞之后葡萄糖摄取的程度而得到的结果。
图19举例说明了通过比较和评价在体外胰岛素、二甲双胍和Akkermansia muciniphila-来源的胞外囊泡(EV)被分别给药至肌细胞之后GLUT4转运子(一种针对葡萄糖摄取的受体)的表达程度而得到的结果。
图20举例说明了通过确认在体外Akkermansia muciniphila-来源的胞外囊泡(EV)被给药至肌细胞之后AMPK信号抑制剂(化合物C)对葡萄糖摄取的作用所得到的结果。
具体实施方式
本发明涉及一种用于治疗、预防或缓解代谢疾病的包含作为活性成分的来源于肠道细菌(尤其是Akkermansia muciniphila)的胞外囊泡的药物/食品组合物。
本发明人已发现在Akkermansia muciniphila-来源的胞外囊泡(EV)被给药至由高脂肪饮食诱发的代谢疾病小鼠模型的胃部时,肥胖症被抑制,由脂肪酸诱发的胰岛素耐受被恢复,糖尿病表型被抑制,以及免疫功能得到增强。
此外,本发明人已发现Akkermansia muciniphila本身和Akkermansia muciniphila-来源的胞外囊泡的蛋白质表达模式彼此不同。
此外,通过将Akkermansia muciniphila本身和Akkermansia muciniphila-来源的胞外囊泡的体内吸收模式比较得到的结果,本发明人还发现胞外囊泡的体内吸收是显著优异的。
此外,本发明已发现在Akkermansia muciniphila-来源的胞外囊泡被给药至肌细胞时,通过AMPK激活促进肌细胞中葡萄糖摄取受体(GLUT4)的表达,从而增加了葡萄糖摄取。
在本说明书中,“代谢疾病”是指由于体内代谢紊乱而发生的疾病的总称。代谢疾病通常是由碳水化合物、脂质、蛋白质、维生素、电解质、水等的失衡而引起的。代谢疾病的代表性实例包括肥胖症、糖尿病、高脂血症、动脉硬化症等,所有这些疾病均由高脂肪饮食引起。
在本说明书中,“治疗或预防代谢疾病”包括减轻和缓解代谢疾病,以及改善症状,以及还包括降低获得代谢疾病的可能性。
在本说明书中,“Akkermansia muciniphila-来源的胞外囊泡”可以从Akkermansia muciniphila的培养基或用Akkermansia muciniphila发酵的食物分离得到。只要包含胞外囊泡,并不特别限制用于从Akkermansia muciniphila的培养基或用Akkermansia muciniphila发酵的食物分离胞外囊泡的方法。例如,可使用以下方法从细菌培养基或发酵的食物分离胞外囊泡:例如离心法,超离心法,用过滤器过滤,凝胶过滤色谱法,自由流电泳,毛细管电泳,使用聚合物分离,或这些方法的组合。此外,还可包括例如用于移除杂质的洗涤和浓缩所得到的的胞外囊泡之类的方法。
所述胞外囊泡包括天然或人工分泌的胞外囊泡。
通过所述方法分离得到的胞外囊泡可具有的平均直径为20-300nm,优选30-200nm。
在本发明的一实施方式中,用于治疗或预防代谢疾病的所述组合物可被制备成药物组合物。为了使用所述组合物用于治疗和预防,虽然可以将根据本发明的胞外囊泡本身给药,但是优选的是所述药物组合物包含所述胞外囊泡作为活性成分。
所述药物组合物包含所述经分离的胞外囊泡作为活性成分且可包含药学上可接受的载体。可通常在制剂中使用的药学上可接受的载体包括生理盐水、无菌水、林格氏溶液、缓冲盐水、环糊精、葡萄糖溶液、麦芽糊精溶液、甘油、乙醇、脂质体等,但是本发明不限于此。必要时,可进一步包括其它传统添加剂,例如抗氧化剂、缓冲剂等。而且,可进一步添加稀释剂、分散剂、表面活性剂、粘合剂、润滑剂等以将所述组合物制备成例如水溶液剂、悬浮剂、乳剂之类的可注射制剂,丸剂,胶囊,颗粒剂或片剂。合适的药学可接受的载体及其制备方法可优选参阅在Remington的文献(Remington's Pharmaceutical Science,Mack Publishing Company,Easton PA)中公开的根据一种组分的方法。虽然根据本发明的所述药物组合物不局限于配方,但是可被制备成注射剂、吸入剂、外用皮肤药等。
用于施用根据本发明的药物组合物的方法并未特别受到限制,但是根据期望的方法,该方法可包括非经肠给药,例如静脉给药、皮下给药、腹膜内给药、吸入给药、经皮施用或局部施用;或者口服给药。
剂量范围可根据患者的体重、年龄、性别和健康状况、饮食、给药的持续时间、给药模式、排泄率、疾病的严重程度等而有所不同。每日使用的剂量是指足够量的本发明的所述治疗物质,其被施用至需要治疗的受试者,从而减轻疾病。所述治疗物质的有效剂量可根据具体的化合物、疾病的状态和严重程度以及需要治疗且可通常由熟练的从业者确定的受试者而有所不同。作为非限制性实例,根据本发明的所述组合物的用于人体的剂量可根据患者的年龄、体重和性别、给药模式、健康状况和疾病的严重程度而有所不同。在体重为70kg的成人患者的情况下,可通常以0.01至1000mg/天的剂量、优选1至500mg/天的剂量施用所述组合物。在这种情况下,可在预定的时间间隔一天一次或若干次,进行分次给药。
在本发明的实施方式中,用于预防或减轻代谢疾病的所述组合物可被制备成食品组合物。在根据本发明的所述组合物被制备成食品组合物时,所述食品组合物可包括所述胞外囊泡作为活性成分,以及还可包括通常在食品生产中添加的成分,例如,蛋白质、碳水化合物、脂质、营养剂、调味剂和芳香剂。例如,当根据本发明的所述食品组合物被制备成饮料时,除了根据本发明的胞外囊泡之外还可进一步包括柠檬酸、高果糖玉米糖浆、糖、葡萄糖、醋酸、苹果酸、果汁等。
当根据本发明的所述组合物被制备成食品组合物时,可使用经发酵的食品本身,例如韩国泡菜。
在下文中,将描述本发明的示例性实施例,以促进理解本发明。然而,以下实施例应被认为仅是说明性的,且本发明的范围不局限于所述实施例。
实施例1.从Akkermansia muciniphila的培养基分离胞外囊泡
在厌氧培养室中的高压蒸汽处理的2L的脑心浸液培养基(BD237500)中培养Akkermansia muciniphila菌株(ATCC BAA-835)72小时,使得O.D值变成1.5,然后高速(10,000×g)离心培养基20分钟,得到不含沉淀细菌细胞团块的上清液。用0.45μm过滤器和0.22μm过滤器过滤所述上清液,从而得到使用所述QuixStand台式系统浓缩约14倍的培养基。在4℃超速离心(150,000×g)所述培养基2小时以得到团块,然后用无菌生理盐水(PBS)溶解所述团块,接着进行蛋白质定量分析。
实施例2.胞外囊泡的特性分析
为了确认通过实施例1的方法获得的所述物质是Akkermansia muciniphila-来源的胞外囊泡,通过JEM 1011电子显微镜(可商购自Jeol Ltd.,日本)观察蛋白质定量分析得到的50μg/ml的样本。结果如图1所示,可以看出Akkermansia muciniphila-来源的胞外囊泡是球形的。
此外,为了确认使用动态光散射(DLS)方法从Akkermansia muciniphila分离得到的胞外囊泡的大小,通过Zetasizer Nano ZS(可商购自Malvern Instruments Ltd,UK)测定50μg/ml的样本。结果如图2所示,可以看出Akkermansia muciniphila-来源的胞外囊泡的平均直径为20-300nm。
此外,为了确认从Akkermansia muciniphila分离得到的胞外囊泡的蛋白质表达模式,通过SDS-PAGE评价10μg/ml样本。结果如图3所示,可以看出Akkermansia muciniphila-来源的胞外囊泡(EV)的蛋白质表达模式不同于Akkermansia muciniphila(细菌)的蛋白质表达模式。
此外,为了评价从Akkermansia muciniphila分离得到的胞外囊泡的抗炎效果,在巨噬细胞经LPS(100ng/ml)处理之前已用胞外囊泡(1μg/ml)预处理之后,通过酶联免疫吸附测定法(ELISA)评价分泌的促炎性细胞因子。结果如图4所示,可以看出在所述巨噬细胞经Akkermansia muciniphila-来源的胞外囊泡预处理的情况下,LPS分泌的IL-6的量下降。
实施例3.Akkermansia muciniphila-来源的胞外囊泡在由高脂肪饮食诱发的肥胖症和糖尿病小鼠中的治疗效果
为了确认在实施例1中获得的Akkermansia muciniphila-来源的胞外囊泡是否抑制由高脂肪饮食诱发的肥胖症和糖尿病,进行如下实验。
以10μg/小鼠的剂量、每隔两天将在实施例1中得到的所述胞外囊泡施用至喂食2个月常规饮食(RD)的正常小鼠以及由于喂食2个月高脂肪饮食(HFD)而诱发的肥胖症和糖尿病小鼠模型中的每一只,持续3周(参见图5)。在这种情况下,使用一组仅喂食RD的小鼠以及一组喂食RD且施用胞外囊泡的小鼠作为阴性对照。
在通过测量在每隔两天施用胞外囊泡时的体重得到的结果中,如图6中所示,可以看出相比于仅喂食HFD的小鼠组(HFD),喂食HFD且施用胞外囊泡的小鼠组(HFD_Akk EV)在3周内体重并未增加。
此外,在通过测量在完成施用胞外囊泡之后禁食6小时时的血浆葡萄糖水平得到的结果中,如图7所示,可以看出相比于仅喂食HFD小鼠组(HFD-Akk EV),喂食HFD且施用胞外囊泡的小鼠组(HFD+Akk EV)的血浆葡萄糖水平降低。
此外,在通过测量在完成施用胞外囊泡之后24小时从小鼠心脏采集的血液中的胰岛素浓度得到的结果中,如图8所示,可以看出相比于仅喂食HFD的小鼠组(HFD-Akk EV),喂食HFD且施用胞外囊泡的小鼠组(HFD+Akk EV)的胰岛素浓度增加较多。
结果表明,Akkermansia muciniphila-来源的胞外囊泡有效地治疗由高脂肪饮食诱发的肥胖症和糖尿病。
实施例4.免疫功能调节作用
为了确认在实施例1中获得的Akkermansia muciniphila-来源的胞外囊泡是否影响免疫功能,进行如下实验。
在以与实施例3相同的方式完成施用胞外囊泡之后24小时从小鼠采集血液和脾脏。使用100μm和40μm细胞过滤器从采集自各小鼠组的脾脏组织提取免疫细胞。提取物经离心(400×g)五分钟,然后以5×105细胞/孔将计数的细胞接种至细胞培养板。此后,分别以1μg/mL和0.5μg/mL的浓度将刺激T细胞的共刺激分子(细胞因子分泌)的抗-CD3和抗-CD28添加至所述板,然后培养细胞48小时。
为了确认在完成培养之后在各组中促炎性细胞因子的分泌差异,将从所述细胞培养板收集的各组的上清液离心(400×g)5分钟,以除去存在上清液中的细胞,然后仅再次收集上清液。在通过ELISA确认收集的上清液中IFN-γ和IL-17的浓度得到的结果中,如图9所示,可以看出虽然在仅喂食HFD的小鼠组(HFD-Akk EV)中IFN-γ和IL-17的浓度升高,但是在施用Akkermansia muciniphila-来源的胞外囊泡的喂食HFD的小鼠组(HFD+AkkEV)中IFN-γ和IL-17的浓度降低。
诸如IFN-γ和IL-17之类的促炎性细胞因子的减少表明:由于肥胖症和糖尿病与炎症有关,因此其可能通过提高免疫功能治疗肥胖症和糖尿病。
实施例5.胰岛素耐受对信号转导抑制的影响
为了确认在实施例1中获得的Akkermansia muciniphila-来源的胞外囊泡是否使胰岛素耐受恢复,进行如下实验。
为了实施体外胰岛素耐受,用1mM脂肪酸(棕榈酸钠,SIGMA)和4%牛血清白蛋白(BSA)处理小鼠-来源的肌细胞(C2C12,ATCCCRL-1772)的培养基48小时。此后,以1μg/ml的浓度将Akkermansia muciniphila-来源的胞外囊泡添加至所述经处理的培养基,培养6小时,然后用2nM胰岛素处理,以确认细胞内信号转导。
在通过蛋白免疫印迹法确认在未经胰岛素处理的组和经胰岛素处理的组之间用作为细胞内胰岛素信号转导的重要指示物的磷酸化-胰岛素受体底物-1(p-IRS-1)的量的差别得到的结果中,如图10所示,可以看出在胞外囊泡处理的组中观察到p-IRS-1,表明由胰岛素耐受抑制的细胞内信号转导被恢复。
所示结果表明Akkermansia muciniphila-来源的胞外囊泡可以起到恢复肌细胞中由高脂肪酸诱发的胰岛素耐受,也就是恢复由胰岛素抑制的细胞内信号转导。
实施例6.细菌和细菌-来源的胞外囊泡的体内吸收、分布和排泄模式
为了比较和评价Akkermansia muciniphila和Akkermansia muciniphila-来源的胞外囊泡是否通过消化道被全身吸收,进行如下实验。
首先,PBS用作为对照组。用荧光标记的Akkermansia muciniphila和Akkermansia muciniphila-来源的胞外囊泡的每一种被以50μg的剂量施用至小鼠消化道,然后经过0分钟、5分钟、3小时、6小时和12小时之后采用荧光和和生物发光成像系统(体内成像系统(IVIS))测定荧光。结果如图11所示,可以看出所述细菌并未被全身吸收,而细菌-来源的胞外囊泡在施用后刚5分钟被全身吸收,通过泌尿器官排泄(这是在施用后3小时从膀胱中的强荧光观察到的),并且甚至在施用后12小时仍存在躯体中。
此外,为了确认在Akkermansia muciniphila-来源的胞外囊泡被全身吸收之后胞外囊泡透入各种器官的模式,在荧光标记的胞外囊泡已被以50μg的剂量施用至小鼠消化道之后12小时提取血液、心脏、肺、肝、肾、脾、脂肪组织和肌肉样本。在通过IVIS观察提取的组织样本中的荧光得到的结果中,如图12所示,可以看出在所述胞外囊泡已被施用至消化道之后12小时胞外囊泡分布于所有的血液和器官样本中。但是未观察到细菌本身的荧光。
此外,为了确认Akkermansia muciniphila-来源的胞外囊泡是否透过肠道屏障,Akkermansia muciniphila细菌和Akkermansia muciniphila-来源的胞外囊泡的每一种被以10μg的剂量施用至小鼠大肠10分钟。在通过通过免疫组织化学(IHC)检查所述经分离的大肠得到的结果中,如图13所示,可以看出所述细菌并未透过肠道屏障,而所述胞外囊泡透过肠道屏障以被吸收入所述组织。
此外,为了确认Akkermansia muciniphila-来源的胞外囊泡是否透过肠道屏障以被吸收入肠道毛细血管,以10μg的剂量施用荧光标记的胞外囊泡至小鼠大肠。在通过实时成像方法观察肠道毛细血管得到的结果中,如图14中所示,可以看出所述胞外囊泡被吸收入血管以迁移入血管。
实施例7.在肌细胞中Akkermansia muciniphila-来源的胞外囊泡对AMPK激活的影响
由于AMPK已知是在维持能量稳态中起重要作用的蛋白质,为了评价Akkermansia muciniphila-来源的胞外囊泡通过AMPK激活对肌细胞中葡萄糖代谢的影响,进行如下实验。
首先,为了基于浓度评价AMPK激活,其中在该种浓度下在体外进行采用Akkermansia muciniphila-来源的胞外囊泡的处理,用0、0.1、1和10μg/ml浓度的胞外囊泡处理肌细胞1小时。在通过蛋白免疫印迹法测定用作为AMPK信号转导中的重要指示物的磷酸化-5'AMP-活化蛋白激酶(pAMPK)和磷酸化-乙酰辅酶A羧化酶(pACC)的表达水平的差别得到的结果中,如图15所示,根据处理的胞外囊泡的浓度,pAMPK和pACC的表达增加,因此,可以看出AMPK被激活,具体取决于胞外囊泡的浓度。
此外,为了评价针对体外采用Akkermansia muciniphila-来源的胞外囊泡的处理随时间推移的AMPK激活,用胞外囊泡以10μg/ml的浓度处理肌细胞0、10、20、30和60分钟。在通过蛋白免疫印迹法测定在AMPK信号转导中用作为重要指示物的pAMPK和pACC的表达模式得到的结果中,如图16所示,可以看出所述pAMPK和pACC表达的增加起始于采用胞外囊泡处理之后10分钟,并持续60分钟。
同时,为了进一步比较并非来源于Akkermansia muciniphila而是来源于细菌的胞外囊泡对AMPK激活的影响,用大肠杆菌来源的胞外囊泡以10μg/ml的浓度处理肌细胞。在通过蛋白免疫印迹法测定在AMPK信号转导中用作为重要指示物的pAMPK和pACC的表达水平得到的结果中,如图17所示,可以看出pAMPK和pACC的表达水平显著下降,证明了AMPK信号转导受到抑制。另一方面,二甲双胍(用于糖尿病的治疗剂)增加所述AMPK信号转导,化合物C(AMPK信号转导抑制剂)减少AMPK信号转导。
实施例8.Akkermansia muciniphila-来源的胞外囊泡在肌细胞中对葡萄糖摄取的影响
为了评价Akkermansia muciniphila-来源的胞外囊泡在肌细胞中对葡萄糖摄取的影响,用10μg/ml的Akkermansia muciniphila-来源的胞外囊泡体外处理肌细胞1小时,并采用放射性同位素(2-[14C]脱氧葡萄糖)评价葡萄糖摄取。结果如图18所示,可以看出,相比于阴性对照(未处理(NT)),Akkermansia muciniphila-来源的胞外囊泡(EV)增加了在肌细胞中葡萄糖的摄取,其在一定程度上类似于在用胰岛素(10nm)或二甲双胍(50mM)处理肌细胞时葡萄糖摄取的增加。
此外,为了评价Akkermansia muciniphila-来源的胞外囊泡对肌细胞中葡萄糖转运蛋白(GLUT4转运子)的表达的影响,使用10μg/ml的Akkermansia muciniphila-来源的胞外囊泡体外处理肌细胞1小时,然后通过邻苯二胺(OPD)法测定细胞膜中GLUT4表达的程度。结果如图19所示,可以看出相比于阴性对照(未处理(NT)),通过Akkermansia muciniphila-来源的胞外囊泡(EV)增加了所述GLUT4表达,这在一定程度上类似于在用胰岛素(10nm)或二甲双胍(50mM)处理肌细胞时GLUT4表达的增加。
此外,为了评价通过Akkermansia muciniphila-来源的胞外囊泡增加的葡萄糖摄取是否被AMPK信号转导所抑制,用化合物C(AMPK信号转导抑制剂)预处理肌细胞,然后用10μg/ml的胞外囊泡处理1小时,接着使用放射性同位素(2-[14C]脱氧葡萄糖)评价所述葡萄糖摄取。结果如图20所示,可以看出通过Akkermansia muciniphila-来源的胞外囊泡增加的葡萄糖摄取被化合物C降低。这意味着通过Akkermansia muciniphila-来源的胞外囊泡的肌细胞中胰岛素耐受的改善与AMPK信号转导过程密切相关。
尽管在上文中已根据本发明的示例性实施方式描述了本发明,但是本领域技术人员应理解的是,在不背离所附权利要求书中描述的本发明的精神和范围的前提下,可进行各种修饰和变化。
- 还没有人留言评论。精彩留言会获得点赞!