对类风湿关节炎的治疗的制作方法
背景
类风湿关节炎(RA)是一种慢性炎症的以及破坏性的关节疾病,它影响了工业化世界中大约1%的人口。它对女人的影响比对男人的多大约3倍,并且通常在40-60岁之间发作。RA的特征在于滑膜的增生和炎症、滑液内的炎症、以及周围骨骼和软骨的渐进性破坏。它是一种痛苦的病症,可引起严重的残疾并最终影响一个人进行日常任务的能力。RA的影响在个体之间不同,但该疾病可以很迅速地进展,引起关节附近软骨和骨骼的肿胀和损坏。任一关节都可被影响,但常常是手、脚和腕。内部器官如肺、心脏和眼睛也可受影响。
RA的起因还是未知的,尽管研究已经阐明了潜藏于该疾病中的炎症性过程的一些方面。RA被认为是通过T细胞介导的抗原特异性过程启动和驱使的。简要地说,在易感的宿主体内的一种未识别的抗原的存在被认为启动了T细胞应答,该T细胞应答引起T细胞细胞因子的产生与随之发生的炎性细胞的募集,这些炎性细胞包括嗜中性细胞、巨噬细胞和B细胞。
许多促炎性和抗炎性细胞因子在患类风湿病的关节中产生。疾病进展、再活化和沉默是经由该关节内的细胞因子产生中的动力学变化介导的。具体地,TNF-α和IL-1被认为在RA的发病机理中起到关键作用。
GM-CSF是被认为是通过嗜中性细胞和巨噬细胞的活化、分化和存活而贡献于RA的发病机理的I型促炎细胞因子。在啮齿动物模型中的研究提出在RA的发展和进展中关于GM-CSF的一个中心的和非冗余的作用(坎贝尔·I.K.(CAMPBELL,I.K.)等人(1997)疾病研究年报(Annal Res Dis),56,364-368;比斯科夫·R.J.(BISCHOF,R.J.)等人(2000)临床与实验免疫学(Clin Exp Immunol),119,361-367;坎贝尔·I.K.(Campbell,I.K.)、里奇·M.J.(M.J.Rich)等人(1998)免疫学杂志(J Immunol),161(7):3639-44;汉密尔顿·J.A.(Hamilton,J.A.)(2002)免疫学趋势(Trends Immunol)23(8):403-8;杨·Y.H.(YANG,Y.H.)和汉密尔顿·J.A.(J.A.HAMILTON)(2001)关节炎与风湿病学(Arthritis Rheumatol)44,111-119)。例如,在小鼠的胶原诱导性关节炎(CIA)和单关节的关节炎模型中,给予鼠类抗GM-CSF单克隆抗体(mAb)显著地减轻了疾病严重性。在该CIA模型中,mAb治疗在治疗既定疾病的进展、组织病理学以及显著降低关节IL-1和TNF-α水平中是有效的。
马威利姆单抗(CAM-3001)是靶向GM-CSFR的α亚基(GM-CSFRα)的一种人类单克隆抗体。马威利姆单抗mAb的结构被描述于PCT公开WO/2007/110631中,其通过引用结合在此。在32个患有RA的受试者中进行的马威利姆单抗的1期单一上升静脉内剂量研究表明了足够的安全性和耐受性曲线,以及生物学活性的初始指示,如急性期反应体的正常化和在具有中等疾病活性的患者中28-关节评价疾病活性评分(DAS28)的可能降低(伯梅斯特(Burmester)等人,风湿病学年鉴(Annals of the RheumaticDiseases),70∶1542-1549,2011)。最近也完成了IIa期临床试验(参见,PCT公开号WO 2013/053767,其通过引用结合在此)。
RA的当前药物管理包括镇静剂治疗,尤其是镇痛药和非甾体抗炎药(NSAID),以及限制疾病严重性和进展的治疗,包括疾病调节药(DMARD)和生物制品。使用DMARD建立的RA的管理包括给予单一的DMARD,例如甲氨蝶呤、柳氮磺吡啶、羟基氯喹或来氟米特、以及它们的组合使用,例如甲氨蝶呤可以与柳氮磺吡啶和/或羟基氯喹组合。甲氨蝶呤是一种抗代谢药和抗叶酸剂,尽管它对RA的功效被认为是由于T细胞活化的抑制和黏附分子(ICAM-1)的表达(约翰斯顿(Johnston)等人,临床免疫学(Clin Immunol.)114(2):154-163,2005)。对于RA的生物试剂的临床使用主要涉及TNF-α的抑制剂。这些包括英利昔单抗(Remicade)、依那西普(Enbrel)、阿达木单抗(Humira)、培舍珠单抗(Cimzia)和戈利木单抗(Simponi)。英利昔单抗是通过静脉内输注给予,而其他四种是由患者在家里皮下注射的。还已经开发了一种抗白细胞介素1抑制剂,Kineret近来,抗B淋巴细胞药物利妥昔单抗(Mabthera或Rituxan)已经被批准用于治疗抗TNF疗法失败的RA患者。Mabthera是作为相隔14天的两次输注的一种初治给予的。经历了持续高达六个月的改善的那些患者可以进而进行重复输注。尽管有这些进展,RA代表了一个显著的未满足的医疗需要。虽然早期的诊断和治疗可以改善长期预后,但是目前RA尚不可治愈。需要改善的疗法以减少该疾病的严重性和进展,并改善患者的生活质量。
一种对RA被控制得如何好的测量是疾病活性评分(DAS)(弗朗桑(Fransen)和冯莱尔(van Riel)临床与实验风湿病学(Clin Exp Rheumatol)23:S93-S99,2005)。DAS是通过执业医师基于各种确认的疾病活性(包括RA的体征)的测量来计算的。DAS的减小反映疾病严重性的减小。DAS小于2.6指示疾病缓解。DAS在2.6和3.2之间指示低的疾病活性。DAS大于3.2指示疾病活性的增加,并且在此水平可以评估患者的疗法以确定疗法中的变化是否得以保证。DAS大于5.1指示严重的疾病活性。在计算DAS中的可变性可以包括评价患者不同数量的关节以及监测不同的血液组分。DAS28是疾病活性得分,其中身体中28个关节被评价以确定压痛关节数目以及肿胀关节数目(Prevoo等人,关节炎风湿病学(Arthritis Rheum)38:44-48,1995)。当DAS28计算包括测量C-反应蛋白(CRP)而不是红细胞沉降率(ESR)时,它被称为DAS28-CRP(斯莫伦(Smolen)等人,风湿病学(Rheumatology)42:244-257,2003;威尔斯·G(Wells G)等人,风湿性疾病年鉴(Annals of the Rheumatic Diseases)68:954-960,2009)。CRP被认为是比ESR更直接的炎症量度,并且对短期变化更敏感(库什纳(Kushner),关节炎风湿病学(Arthritis Rheum)34:1065-68,1991)。CRP产生与RA中的放射学进展有关(冯洛文·MA(van Leeuwen MA)等人,英国风湿病学杂志(Br J Rheumatol)32(suppl 3):9-13,1993)并且被考虑对测量RA疾病活性至少与ESR一样有效(马尔雅·RK(Mallya Rk)等人,风湿病学杂志(J Rheumatol)9:224-8,1982;乌尔夫·F.(Wolfe F.)风湿病学杂志(J Rheumatol)24:1477-85,1997)。
美国风湿病学会(ACR)在对RA进行分类上提出了一系列标准。常用的标准是ACR 1987修订标准(阿内特(Arnett)等人,关节炎风湿病学(Arthritis Rheum)31:315-324,1988)。根据ACR标准进行RA诊断需要患者满足最小数目的所列标准,如压痛关节计数或肿胀关节计数、硬挺度、疼痛、射线照相指示和血清类风湿因子测量。ACR 20、ACR 50和ACR 70是常用的测量以显示RA疗法的功效,尤其在临床试验中。ACR 20表示测量的ACR标准中20%的改善。类似的,ACR 50表示测量的ACR标准中50%的改善,并且ACR 70表示测量的ACR标准中70%的改善。
对RA患者中残疾的单独患者报告的测量是健康评估问卷残疾指数(HAQ-DI)。HAQ-DI得分表示在患者报告的进行日常任务的能力方面的身体机能,包括他们在进行活动中经受的困难水平。通过记录患者进行日常活动的能力,该HAQ-DI得分可以被用作对他们生活质量的一种测量。
概述
本披露提供了对于RA的治疗,以提供临床益处,包括减少DAS28-CRP和增加获得临床益处的患者的数目,如由ACR 20、ACR 50和ACR 70确定的。另外,本披露涉及改善RA患者的身体机能的方法和组合物,如通过HAQ-DI确定的。
在此报导的是来自2期临床试验的显著的阳性结果,其中RA患者接受抗GM-CSFRα抗体马威利姆单抗。在这一双盲试验中,将根据DAS28-CRP具有至少中等的疾病活性的并已经经受稳定剂量的甲氨蝶呤治疗的RA患者随机化到不同皮下剂量的马威利姆单抗或安慰剂组。在本研究中,在治疗期间或在12周继而进行的时期期间,在呼吸机能参数、机会性感染、严重的过敏反应或实验室异常上未观察到改变,指示良好的安全性特性。
马威利姆单抗是一种人类IgG4单克隆抗体,它被设计为通过靶向GM-CSFRα来调节巨噬细胞活化、分化和存活。它是GM-CSFRα的生物活性的有力的中和剂,并且不希望受理论约束,可以通过结合GM-CSFRα而对在RA患者的滑膜关节内的白细胞发挥治疗效果,导致减少的细胞存活和活化。WO 2007/110631报导马威利姆单抗和它的变体的分离和表征,这些变体共有高效能地中和GM-CSFRα的生物活性的能力。认为这些抗体的功能特性至少在部分上可归因于结合在人类GM-CSFRα的226至230位的一个Tyr-Leu-Asp-Phe-G1n基序,由此抑制GM-CSFRα和其配体GM-CSF之间的关联。
本披露的一个方面被吸引至治疗类风湿性关节炎的方法,包括给予有治疗需要的患者或患者群体一种包括马威利姆单抗的组合物。在某些实施例中,该包括马威利姆单抗的组合物以150mg马威利姆单抗的剂量给予。在某些实施例中,每两周给予150mg的马威利姆单抗。在某些实施例中,马威利姆单抗是通过口服、静脉内、或皮下给予而给予的。在某些实施例中,每两周经皮下给予150mg马威利姆单抗。在某些实施例中,该方法可以在这些患者的一个或多个中从基线降低DAS28-CRP超过1.7、超过1.8、超过1.9、超过2.0、或超过2.1。在某些实施例中,该方法可以改善至少20%的治疗功效(ACR20)、至少50%的治疗功效(ACR50)、或至少70%的治疗功效(ACR70),如通过1987年美国风湿病学会(ACR)标准在这些患者的一个或多个中确定的。当DAS28-CRP在这些患者的一个或多个中从基线降低超过1.7、超过1.8、或者超过1.9时,在某些实施例中,降低是在治疗开始的169天内,或者是在治疗开始的85天内。当DAS28-CRP在一个或多个治疗的患者中从基线降低超过2.0、或者超过2.1时,在某些实施例中,降低是在治疗开始的169天内。在某些实施例中,该方法可以在这些患者的一个或多个中实现至少20%的治疗功效(ACR20),如通过1987年美国风湿病学会(ACR)标准确定的。在ACR20被实现的情况下,在某些实施例中,它是在170天、169天、168天、或治疗开始后它们的任意整数天内实现的。ACR20可以在治疗开始的169天、85天、42天或14天内实现。在某些实施例中,该方法可以在这些患者的一个或多个中实现至少50%的治疗功效(ACR50),如通过1987年美国风湿病学会(ACR)标准确定的。在ACR50被实现的情况下,在某些实施例中,它是在治疗开始的169天、85天、42天、或14天内实现的。在某些实施例中,该方法可以在这些患者的一个或多个中实现至少70%的治疗功效(ACR70),如通过1987年美国风湿病学会(ACR)标准确定的。在ACR70被实现的情况下,在某些实施例中,它是在治疗开始的160天、80天、40天、或14天内实现的。ACR70可以在170天、169天、168天、或多达并包括14天的它们的任意整数天内实现。
某些实施例可以在这些患者的一个或多个中导致类风湿性关节炎症状缓解或缩短缓解开始的时间。在某些实施例中,类风湿关节炎症状的这样的缓解是在至少10%、至少15%、或至少20%的患者中。某些实施例可以在113天内在至少60%、或至少65%、或至少70%的患者中实现ACR20。某些实施例可以在113天内在至少15%、或至少20%、或至少25%的患者中实现ACR50。在一些实施例中,至少30%、或至少35%、或至少40%的患者在169天内实现了ACR50。在某些实施例中,至少10%、或至少13%的患者可以在113天内实现ACR70。在某些实施例中,在这些患者的一个或多个中ACR20、ACR50、或ACR70在治疗开始的85天内被实现。某些实施例可以在这些患者的一个或多个中改善身体机能,如通过HAQ-DI确定的。
本披露的某些方面被吸引至一种用于改善RA患者或RA患者群体的身体机能的方法,如通过HAQ-DI得分确定的,该方法包括给予有治疗需要的患者或患者群体包括马威利姆单抗的组合物,其中该组合物以150mg的剂量给予。在某些实施例中,每两周给予马威利姆单抗。在某些实施例中,马威利姆单抗是通过口服、静脉内、或皮下给予而给予的。在某些实施例中,该方法可以在这些患者的一个或多个中改善至少0.25的HAQ-DI得分。在某些实施例中,该方法可以在至少60%的患者中改善至少0.25的HAQ-DI得分。在某些实施例中,HAQ-DI的改善是在治疗开始的6周内实现的。
本披露的某些方面被吸引至一种在患者或患者群体中诱导RA缓解的方法,如通过小于2.6的DAS28-CRP所测定的,该方法包括给予有治疗需要的患者或患者群体包括马威利姆单抗的组合物,其中该组合物以150mg的剂量给予。在某些实施例中,每两周给予马威利姆单抗。在某些实施例中,马威利姆单抗是口服、静脉内、或皮下给予的。在某些实施例中,马威利姆单抗是以150mg给予的,每两周一次,通过皮下给予。在某些实施例中,缓解的开始是在治疗开始的170天内、或80天内、或40天内、或14天内实现的。在某些实施例中,缓解的开始是在治疗开始后170天、169天、168天、或它们的任意整数天内实现的。
在任何方面,该方法进一步包括给予另外的治疗剂。在某些实施例中,另外的治疗剂包括一种疾病调节抗风湿药(DMARD)。在某些实施例中,另外的治疗剂是甲氨蝶呤。在某些实施例中,甲氨蝶呤是以每周7.5至25mg的剂量给予的。在某些实施例中,在给予包括马威利姆单抗的组合物之前,将稳定剂量的甲氨蝶呤给予至少4周。在某些实施例中,该方法包括联合连续剂量的甲氨蝶呤将包括马威利姆单抗的组合物给予至患者。
在治疗之前,一个或多个患者可具有至少3.2的基线DAS28-CRP。在某些实施例中,一个或多个患者在治疗前具有大于5.1的基线DAS28-CRP。一个或多个患者可以在治疗之前对于类风湿因子和/或抗环瓜氨酸化肽(CCP)IgG抗体测试呈阳性。一个或多个患者可能不具有医学上显著的呼吸系统疾病。
本披露的某些方面被吸引至包括150mg马威利姆单抗的组合物。根据任何前述的方法,该组合物适合口服组合物、静脉内给予、或皮下给予来使用。在某些实施例中,该组合物包括150mg马威利姆单抗用于皮下给予。在某些实施例中,该组合物与甲氨蝶呤联合配制用于给予。
本披露的某些方面被吸引至治疗类风湿性关节炎的方法,该方法包括给予有治疗需要的患者或患者群体包括马威利姆单抗的组合物,其中该组合物以150mg马威利姆单抗的剂量通过皮下给予每两周一次给予,并且其中治疗可导致DAS28-CRP缓解的持续时间的增加。在某些实施例中,实现的DAS28-CRP缓解的持续时间在至少60%的患者中是至少60天。在某些实施例中,实现的DAS28-CRP缓解的持续时间在至少50%的患者中是至少80天。在某些实施例中,实现的DAS28-CRP缓解的持续时间在至少25%的患者中是至少130天。
待治疗的患者可患有RA,如根据1987ACR标准确定的。该患者可以在治疗之前对于类风湿因子(RF)和/或抗环瓜氨酸化肽(CCP)IgG抗体测试呈阳性。RF阳性和抗CCP抗体阳性状态证实RA的诊断。该患者可患有RA持续至少5年或至少7年的持续时间,例如在5和10年之间。
在某些实施例中,待用根据本披露的马威利姆单抗治疗的患者不患有呼吸道疾病。在给予马威利姆单抗之前可对患者进行测试以确认他们不患有医学上显著的呼吸道疾病,例如肺炎。针对呼吸道疾病的测试的方法包括胸部x光片以及通过肺呼吸量测定法以及一氧化碳弥散量(DLCO)来评价肺功能。在某些实施例中,患者也不患有临床上显著的慢性或复发性感染,如丙型肝炎或慢性活动性乙型肝炎感染。可以在此处所述的治疗之前针对这类感染对患者进行测试。
当在此参照“一个患者”说明治疗和临床益处时,应理解这可包括治疗一组患者。在某些实施例中,患者是成年人。患者可以是例如从18至80岁的年龄。
此处所述的这些方法中实现的临床益处可包括以下效果中的任一个或多个。
该临床益处可以是DAS28-CRP减少超过1.2。DAS28-CRP的减少可以在至少40%、至少50%或至少60%的治疗患者中实现。该临床益处可包括与未治疗的对照患者相比,增加了实现DAS28-CRP减少超过1.2的患者的比例。
该临床益处可包括RA的缓解。典型地,缓解是通过DAS28-CRP小于2.6定义的。缓解可以在至少10%的患者、或至少20%的患者中实现。与未用根据在此所述的治疗的患者相比,在此所述的治疗患者中开始缓解的时间可被减少。达到缓解的时间可被减少大约50%。
该临床益处可以是治疗功效改善至少20%、至少50%或至少70%,如通过1987ACR标准确定的,即,该临床益处可以是分别实现ACR20、ACR 50或ACR 70。在某些实施例中,该临床益处包括在至少40%、50%、60%或70%的患者中实现ACR 20。它可包括在至少20%或至少30%的患者中实现ACR 50。它可包括在至少5%、10%或15%的患者中实现ACR70。
对RA患者特别具有价值的临床益处的一个形式是他们执行日常活动的能力的改善。本披露的方法可包括改善患者自我评估的残疾,这由健康评估问卷(称为HAQ-DI)测量。包括为RA患者提供临床益处的方法(其中该临床益处包括改善RA患者的身体机能,如通过HAQ-DI确定的)、以及用于在这类方法中使用的组合物和试剂盒是本披露的所有方面。临床益处可包括改善RA患者的身体机能,如通过HAQ-DI确定的。在某些实施例中,在HAQ-DI的统计学上显著的改善是在开始根据本披露的治疗的十二周、十周、八周或六周内实现的,或在四周内实现的,或在二周内实现的。该改善可以是在HAQ-DI上至少0.25的改善,即在患者的HAQ-DI得分上减少0.25或更多。在某些实施例中,该改善是在HAQ-DI得分上至少改善0.30、0.40或0.45。改善总体上是参照用根据本披露的一种抑制剂治疗之前患者的基线平均HAQ-DI得分测量的。在治疗一组患者时,该改善可以在至少50%、至少60%或至少70%的治疗患者中观察到。
与未根据本披露治疗的患者相比,在治疗的患者中可更快地实现该临床益处。例如,根据本披露的用马威利姆单抗与甲氨蝶呤联合治疗的患者可比单独用甲氨蝶呤治疗的患者更快地实现临床益处。与单独用甲氨蝶呤治疗的患者相比,在使用联合治疗的患者中开始反应的时间或实现临床益处之前的治疗时期可被减少至少10%、至少20%、至少30%、至少40%或至少50%。在某些实施例中,该临床益处是在85天之内实现的。因此,例如,DAS28-CRP可以在85天之内被减少超过1.2。在某些实施例中,反应开始是在2周之内发生。因此,临床益处可以在用马威利姆单抗治疗14天之内实现。
可以在利用马威利姆单抗的治疗过程中和/或之后监测患者以评估临床益处的水平,例如通过测量DAS28-CRP和/或根据ACR标准确定临床益处和/或测量HAQ-DI。该方法可包括确定实现了该临床益处,例如DAS28-CRP的限定减少、和/或ACR 20、ACR 50或ACR 70的实现得以满足、和/或改善了HAQ-DI得分,如此处其他地方所讨论的。
在某些实施例中,该剂量是以14天的间隔(即在第1天、第15天、第29天等)给予。可替代地,剂量可以按28天的间隔给予。可能的剂量和给药的另外的详情在本文别处描述。该方法可包括将该马威利姆单抗给予该患者,以14天的间隔服药,持续至少85天的持续时间,尽管治疗在85天之后继续进行,并且患者可无限期的维持治疗(其条件是他们被适当地监测)。在某些实施例中,临床益处是在治疗第85天实现的,并且在某些实施例中是在治疗第14天实现的。在某些实施例中,临床益处是在根据本披露治疗仅一剂之后或仅两剂之后实现。
马威利姆单抗可以通过任何适合的方法给予。对于抗体给予的典型的方法是口服、皮下或静脉内递送。在某些实施例中,将包括马威利姆单抗的组合物配置用于皮下或静脉内给药。
治疗RA的方面可包括将一种组合物与一种或多种另外的治疗剂联合给予该患者,该组合物包括根据本披露的一种抑制剂。另外的治疗剂可包括以下各项的任何一种或多种:镇痛药;NSAID;甾体;用于‘RA治疗’的DMARD,如甲氨蝶呤、柳氮磺吡啶、羟化氯喹、来氟米特。生物的DMARD包括TNF-α抑制剂,例如英利昔单抗(Remicade)、依那西普(Enbrel)、阿达木单抗(Humira)、培舍珠单抗(Cimzia)、戈利木单抗(Simponi),IL-1抑制剂例如Kineret以及抗-B淋巴细胞剂例如利妥昔单抗、阿巴西普(Humira)或托珠单抗。
附图/图简要说明
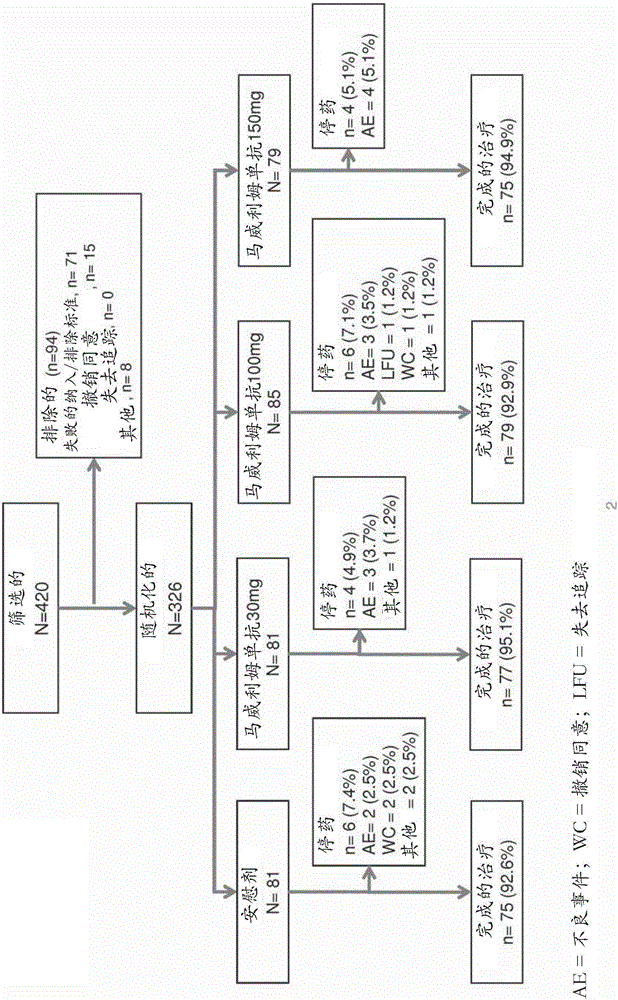
图1A显示了临床研究设计的概要。
图1B显示了30mg马威利姆单抗、100mg马威利姆单抗、150mg马威利姆单抗、和安慰剂组内患者的分布。
图2显示了从马威利姆单抗给药开始直到大约24周(第169天)的DAS28从基线调整的的平均变化(+/-SE)。
图3A显示了在第169天,30mg马威利姆单抗、100mg马威利姆单抗、150mg马威利姆单抗、和安慰剂治疗在实现ACR20、ACR50、和ACR70的比较。
图3B显示了用30mg马威利姆单抗、100mg马威利姆单抗、150mg马威利姆单抗、和安慰剂治疗的患者从治疗开始那天至第169天的ACR20的实现。
图3C显示了用30mg马威利姆单抗、100mg马威利姆单抗、150mg马威利姆单抗、和安慰剂治疗的患者从治疗开始那天至第169天的ACR50的实现。
图3D显示了用30mg马威利姆单抗、100mg马威利姆单抗、150mg马威利姆单抗、和安慰剂治疗的患者从治疗开始那天至第169天的ACR70的实现。
图4A显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的DAS28-CRP缓解(<2.6)率。
图4B显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中DAS28-CRP缓解的开始时间。
图4C显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中DAS28-CRP的持续时间。
图4D显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中DAS28-CRP低疾病活性的开始时间。
图4E显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中DAS28-CRP低疾病活性的持续时间。
图5A显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的HAQ-DI从基线(+/-SE)调整的平均变化。
图5B显示了在第169天,对于每个马威利姆单抗治疗组和安慰剂组在临床试验中HAQ-DI反应者(改善>=0.25)。
图6A显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的肿胀关节计数从基线(+/-SE)调整的平均变化。
图6B显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的压痛关节计数从基线(+/-SE)调整的平均变化。
图6C显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的患者整体评估从基线(+/-SE)调整的平均变化。
图6D显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的患者疼痛从基线(+/-SE)调整的平均变化。
图6E显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的医师整体评估从基线(+/-SE)调整的平均变化。
图6F显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中从治疗开始那天至第169天的CPR从基线(+/-SE)调整的平均变化。
图7A显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中在第169天的FACIT疲乏反应者(改善>=3)。
图7B显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中在第169天的身体健康总评(PCS)反应者(改善>=3.1)。
图7C显示了对于每个马威利姆单抗治疗组和安慰剂组在临床试验中在第169天的精神健康总评(MCS)反应者(改善>=3.8)。
图8显示了采用德民(Demin)纵向元分析的显示使用马威利姆单抗相比关键的竞争者治疗的临床试验数据。
图9A显示了日本受试者的临床研究设计的概要。
图9B显示了日本受试者研究的100mg马威利姆单抗、150mg马威利姆单抗、和安慰剂组内患者的分布。
图10显示了在健康的日本受试者中单一的SC马威利姆单抗剂量的平均药代动力学曲线(100mg和150mg)。
图11A显示了试验之间药代动力学结果的交叉研究比较。
图11B显示了试验之间药代动力学结果的交叉研究比较。
图11C显示了试验之间药代动力学结果的交叉研究比较。
图12A显示了在100mg马威利姆单抗下,在日本试验中观察到的受试者PK曲线落入了预测范围内。
图12B显示了在150mg马威利姆单抗下,在日本试验中观察到的受试者PK曲线落入了预测范围内。
图13A显示了具有小于正常下限(LLN)的值的受试者的嗜中性粒细胞曲线。
图13B显示了具有大于正常上限(ULN)的值的受试者的丙氨酸氨基转移酶(ALT)曲线。
详细说明
定义
应当指出的是,术语“一个/种(a或an)”实体是指一个/种或多个/种该实体;例如,“一种抗IL-5α抗体”应理解为代表一种或多种抗IL-5α抗体。因此,术语“一个”(或“一种”)、“一个或多个(一种或多种)”、以及“至少一个(至少一种)”在此可以互换地使用。
除非另外定义,否则在此所使用的所有技术和科学术语具有与本披露涉及的领域的普通技术人员通常所理解的相同的意义。例如,生物医学和分子生物学简明词典(Concise Dictionary of Biomedicine and Molecular Biology),佐裴秀(Juo,Pei-Show),第2版,2002年,CRC出版社(CRC Press);细胞与分子生物学词典,第3版,1999年,学术出版社(Academic Press);以及生物化学与分子生物学牛津词典,修订版,2000年,牛津大学出版社(Oxford University Press),为技术人员提供了在本披露中使用的许多术语的综合字典。
单位、前缀和符号均以它们的国际单位系统(SI)接受的形式表示。数值范围包括定义该范围的数字。除非另外指明,否则氨基酸序列以氨基到羧基的方向从左到右书写。在此提供的小标题不是本披露的不同方面或方面的限制,可以通过作为一个整体参考本说明书来获得这些方面。因此,通过以其全文参考说明书,更完全地定义了就在以下定义的术语。
如在此使用的术语“抗体”(或其片段、变体、或衍生物)是指能够结合至抗原的抗体的至少最小部分,例如,在由B细胞产生的典型抗体的情况下,至少重链(VH)的可变结构域和轻链(VL)的可变结构域。脊椎动物系统中的基础抗体结构相对较好理解。参见,例如,哈洛(Harlow)等人,抗体:实验室手册(Antibodies:A Laboratory Manual)(冷泉港实验室出版社(Cold Spring Harbor Laboratory Press),第2版,1988年)。
抗体或其抗原结合片段、变体或衍生物,包括但不限于多克隆抗体、单克隆抗体、人类抗体、人源化抗体或嵌合抗体、单链抗体、表位结合片段,例如Fab、Fab′和F(ab′)2、Fd、Fvs、单链Fvs(scFv)、单链抗体、二硫化物连接的Fvs(sdFv)、包括VL或VH域的片段、由Fab表达文库产生的片段。ScFv分子在本领域中是已知的并且描述于例如美国专利5,892,019之中。本披露涵盖的免疫球蛋白或抗体分子可以是免疫球蛋白分子的任何类型(例如IgG、IgE、IgM、IgD、IgA、以及IgY)、类别(例如IgG1、IgG2、IgG3、IgG4、IgA1、以及IgA2)或子类。
“特异性结合”一般是指抗体或其片段、变体或衍生物经由其抗原结合结构域来结合至表位,并且这种结合需要抗原结合结构域与表位之间有某种互补性。根据此定义,当与抗体将结合至随机、不相关的表位相比,该抗体更容易经由其抗原结合结构域来结合至表位时,该抗体被认为是“特异性地结合”至该表位。
如本文所用的术语“治疗(treat、treatment、或treatment of)”(例如,在短语“治疗患有类风湿性关节炎的患者”中)是指减少RA病理的可能性,减少RA症状的发生,例如在一定程度上受试者经历减少的不适和衰弱。例如,治疗可以是指,当向受试者给予时,疗法减轻RA介导的疾病症状、体征、或病因的能力。治疗还指缓和或减少至少一种临床症状和/或抑制或延迟病症的进展和/或预防或延迟疾病或疾患的发作。
“受试者”或“个体”或“动物”或“患者”或“哺乳动物”是指希望诊断、预后或治疗的任何受试者,特别是哺乳动物受试者。哺乳动物受试者包括人类、家畜、农畜、体育动物,以及动物园动物,包括如人类、非人类灵长类、狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、熊等。
马威利姆单抗(参见PCT公开号WO 2007/110631和PCT公开号WO 2013/053767,二者通过引用以其整体结合在此)是被设计来通过靶向GM-CSFRα来调节巨噬细胞的活化、分化和生存的人IgG4单克隆抗体。GM-CSFRα是对于粒细胞巨噬细胞集落刺激因子的受体的α链。除非上下文另外指明,此处对GM-CSF的提及是指人类或非人灵长类(例如猕猴)GM-CSF,一般地是人类的。GM-CSF正常结合至成熟GM-CSF受体α链的胞外域。这种结合是通过马威利姆单抗在体外和体内进行抑制。
配制品和给药
取决于所治疗的病症,马威利姆单抗可单独或与其他治疗联合,同时或顺序地给予。马威利姆单抗可与以下的一个或多个联合或除去以下这些来提供:NSAID(例如,cox抑制剂如Ciclofenac或塞来昔布和其他类似的cox2抑制剂),皮质类固醇(如强的松口服和/或肠胃外),以及DMARD如Humira(阿达木单抗)、甲氨喋呤、阿拉瓦、Enbrel(依那西普)、Remicade(英利昔单抗)、Kineret(阿那白滞素)、Rituxan(利妥昔单抗)、Orencia(阿巴西普)、金盐、抗疟药如抗疟药(例如,氯喹、羟化氯喹)、柳氮磺吡啶、d-青霉胺、环孢菌素A、环磷酰胺、硫唑嘌呤、来氟米特、培舍珠单抗(Cimzia)、托珠单抗和戈利木单抗(Simponi)。
马威利姆单抗可以给予到个体类风湿性关节炎(RA)患者,或给予到RA患者的群体。
该马威利姆单抗剂量可以是从每单次剂量30mg到每单次剂量至少150mg的任何剂量,例如,每单次剂量30mg、每单次剂量100mg、或每单次剂量150mg。单次剂量可以按1ml的体积配制用于皮下给予。治疗可以按14天的间隔给予8周、10周、12周、14周、18周、20周、22周、24周或更长时间。治疗可以继续以维持或进一步改善临床益处。
使用马威利姆单抗治疗的患者在给予该抑制剂之后的一个持续时期中可以继续从治疗的效果中获益,包括临床益处如减少的DAS28-CRP。在给予马威利姆单抗之后,例如给予至少三次常规剂量的马威利姆单抗之后,临床益处可被维持在相同水平,或在一些情况下维持在一个较低的但益处仍然显著的水平,持续至少一个月、至少两个月、或至少三个月的时期。因此,在一些实施例中,如此处提供的治疗RA的方法可容许一个或多个治疗间歇,而继续向该患者提供治疗益处,持续至少一个月、至少两个月、或至少三个月。
马威利姆单抗可以按药用组合物形式给予,该组合物可以包括至少一种除了单克隆抗体以外的组分。这样的药用组合物可以除了包含活性成分之外,还可以包括一种药学上可接受的赋形剂、载体、缓冲液、稳定剂或本领域普通技术人员熟知的其他材料。载体或其他材料的确切性质将取决于给予途径,该途径可以是口服、静脉内、或通过注射,例如皮下注射。液体药用组合物可包含液体载体,例如水、石油、动物或植物油、矿物油或合成油。可包含生理盐水溶液、葡萄糖或其他糖类溶液或二醇,例如乙二醇、丙二醇或聚乙二醇。对于静脉内注射,或病痛部位的注射,活性成分可处于肠胃外可接受的水性溶液形式,该水性溶液为无热原的并且具有合适pH、等渗性以及稳定性。本领域技术人员完全能够使用例如等渗媒介物,例如氯化钠注射液、林格氏注射液、乳酸盐林格氏注射液来制备合适溶液。可以包括防腐剂、稳定剂、缓冲液、抗氧化剂和/或其他添加剂。配制品可包括赋形剂或赋形剂的组合,例如:糖、氨基酸和表面活性剂。液体配制品可包括广泛范围的抗体浓度和pH。马威利姆单抗的配制品将取决于递送的预期路线:例如,对于肺递送的配制品可以由具有确保吸入后渗入肺部深处的物理性质的颗粒组成;局部配制品可以包括粘度改性剂,其延长该药物在作用部位的驻留时间。在某些实施例中,马威利姆单抗可被制备成具有保护它避免快速释放的载体,例如控释配制品,包括植入物、经皮贴片和微囊化递送系统。可以使用可生物降解、生物相容的聚合物,如乙烯乙酸乙烯酯、聚酐类、聚乙醇酸、胶原、聚原酸酯类、以及聚乳酸。许多用于制备此类配制品的方法是本领域的技术人员已知的。参见,例如,罗宾逊·J.R.(Robinson,J.R.)编辑,缓控释药物递送系统(Sustained and Controlled Release Drug Delivery Systems),马塞尔穧德克尔公司(Marcel Dekker,Inc.),纽约,1978年。
DAS28-CRP
临床益处可以基于C-反应蛋白的疾病活性评分28(DAS28-CRP)的减少来确定,例如将DAS28-CRP从基线降低超过1.2,和/或将DAS28-CRP减少至小于2.6。
DAS28-CRP可以如前所述来确定(斯莫伦(Smolen)等人,风湿病学(Rheumatology)42:244-257,2003;威尔斯·G(Wells G)等人,风湿性疾病年鉴(Annals of the Rheumatic Diseases)68:954-960,2009)。如威尔斯(Wells)等人所描述,DAS28考虑28个压痛和肿胀关节计数,总体健康状况(GH;使用100mm的视觉模拟评分法(VAS)的患者疾病活性评估,其中0=最好,100=最差),加上急性期反应物各水平(红细胞沉降率(ESR)(mm/h)或C-反应蛋白(CRP)(mg/升))。DAS28值计算如下:
DAS28-CRP=0.56*√(TJC28)+0.28*√(SJC28)+0.014*GH+0.36*ln(CRP+1)+0.96;
其中,CRP=C-反应蛋白(mg/升),GH=患者总体健康评估,TJC=压痛关节计数,以及SJC=肿胀关节计数。
ACR标准
临床益处可以基于ACR标准或美国风湿病学会标准确定(阿内特(Arnett)等人,关节炎风湿病学(Arthritis Rheum.)31(3):315-324,1988)。这些标准的标准可以在临床试验中被用于比较各种关节炎药物或治疗的有效性。ACR标准被表示为ACR20、ACR50和ACR70。该RA患者可被记分为例如ACR 20(20%患者改善),与未治疗的(例如治疗前的基线)或用安慰剂治疗的进行比较。典型地,方便的是测量与该患者的基线值相比的改善。ACR 20标准可包括在压痛(疼痛的)关节计数和肿胀关节计数中20%的改善,加上以下5个另外的量度中的至少3个的20%的改善:
1.患者通过视觉模拟评分法(VAS)进行的疼痛评估,
2.患者通过疾病活性(VAS)进行的全局评估,
3.医师通过疾病活性(VAS)进行的全局评估,
4.患者通过健康评估问卷(HAQ-DI)测量的自我评估的残疾,以及
5.急性期反应物,CRP或ESR。
ACR 50和70是类似定义的。临床试验报告实现ACR20、ACR50、和ACR70的研究参与者的百分比。例如,如果一个研究报道,55%的患者实现了ACR20,这意味着在研究中55%的患者在压痛或肿胀关节计数中实现了20%的改善连同在其他5个标准中的3个中实现了20%的改善。如果临床试验报道,40%的患者实现了ACR50,这意味着在研究中40%的患者在压痛或肿胀关节计数中实现了50%的改善连同在其他5个标准中的3个中实现了50%的改善。
在1980年引入的HAQ是首批被设计为代表患者源性结果评估模型的患者报告结果工具中的一个(布鲁斯(Bruce)和弗里斯(Fries),临床与实验风湿病学(Clin.Exp.Rheumatol.)23(suppl.39):S14-S18,2005)。
健康评估问卷残疾指数(HAQ-DI)
HAQ-DI是患者报告的残疾的一种标准化测量,由该患者对他或她执行日常活动的能力的报告来确定。关于HAQ和HAQ-DI的详细信息已经被公开(布鲁斯(Bruce)和弗里斯(Fries),临床与实验风湿病学(Clin.Exp.Rheumatol.)23(suppl.39):S14-S18,2005)。
德民(Demin)纵向元分析
德民纵向元分析被用于在本临床研究中观察到与类似群体中的其他生物制剂相比的纵向ACR20曲线的探索性交叉试验比较。德民分析为对类风湿性关节炎已批准的所有生物制剂的随时间推移的ACR20曲线提供最大效应(Emax)模型。我们在德民出版物中使用该模型参数(德民·I.(Demin,I.)等人,临床药理治疗(Clin.Pharmacol.Therap.)92:352-359)以重新创建配置文件,并且然后对目前的研究数据拟合相同的最大效应模型,并且覆盖结果。下面和在图8中所提供的结果显示,在目前的研究中观察到的ACR20结果在开始的速度连同最大ACR20反应速率方面是有高度竞争力的。
健康调查询问36个间题从患者的立场来衡量功能性健康和幸福。它可以跨越年龄(18岁及以上)、疾病、和治疗组使用。它不是特定疾病的健康调查。
CDAI
临床疾病活性指数(CDAI)对于以下类风湿关节炎的患者而言是有用的临床综合得分。CDAI的计算为:SJC(28)+TJC(28)+PGA+EGA。其中,SJC(28)是肿胀28-关节计数(肩、肘、腕、MCP、包括拇指IP的PIP、膝);TJC(28)是压痛28-关节计数(肩、肘、腕、MCP、包括拇指IP的PIP、膝);PGA是患者全局疾病活动(患者的整体RA疾病活性在1至10的数值范围内的自我评估,其中10是最大活性);以及EGA是评价者的全局疾病活性(评价者的整体RA疾病活性在1至10的数值范围内的自我评估,其中10是最大活性)。CDAI≤2.8被理解为缓解;CDAI>2.8和≤10被理解为低疾病活性;CDAI>10和≤22被理解为中度疾病活性;以及CDAI>22被理解为高度疾病活性。
以下披露的实施例仅仅是代表性的。因此,在下面实例中披露的具体结构、功能和程序细节不应被理解为限制性的。
实例
实例1:研究设计综述
共筛选了420个受试者,有326个受试者随后被随机化分成四个组类。这些中,284个受试者被包含在ITT群体中。所有组类就基线和疾病特征而言被良好地平衡。进行一个2b期随机化的、双盲的、安慰剂对照的、多重递增剂量研究以评估患有RA的受试者中马威利姆单抗的功效、安全性和耐受性。该试验允许评估多个因子,包括RA中的临床结果,剂量与安全性和功效之间的关系,以及马威利姆单抗的药物代谢动力学和免疫原性。组类用30mg、100mg、和150mg的剂量治疗。
临床试验研究的主要目的是评价与安慰剂和联合MTX相比马威利姆单抗的三个皮下(SC)剂量(即,30mg、100mg、和150mg)在对非生物的DMARD没有足够反应的受试者中的功效。图1A和1B显示了研究设计。第一个主要终点是在第12周(第85天),与安慰剂相比,联合的马威利姆单抗治疗的受试者的部分实现了DAS28-CRP从基线改善1.2。计算反应率,其中反应者被定义为显示了从他们的基线DAS28-CRP减少超过1.2的受试者。第二个主要终点是在第24周(第169天)的ACR20。次要的终点包括ACR 20、ACR 50和ACR 70反应,缓解率(DAS28-CRP<2.6)和马威利姆单抗的安全性和耐受性。另外的评估包括缓解开始的时间、从基线1.2个点的一个改善、肿胀和压痛关节计数以及急性期反应物的测量(CRP和ESR)。还测量了包括健康评估问卷残疾指数(HAQ-DI)(弗里斯(Fries)等人,关节炎和风湿病(Arthritis and Rheumatism)23:137-145,1980)的患者报告结果。
纳入标准包括由2010ACR/EULAR分类定义的成人发作RA的诊断,如通过在筛选中的DAS28(CRP)≥3.2和在第1天的DAS28(ESR)≥3.2所定义的至少中度活性疾病,在筛选和第1天所定义的至少4个肿胀关节,以及对一个或多个常规的DMARD没有充分反应的受试者。排除标准包括由于缺乏有效性而停止以往的生物性DMARD的治疗,然而,由于除了缺乏有效性外的其他原因而停止以往的生物DMARD的使用是被允许的。
统计方法
样本大小计算是基于主要功效终点(在第12周时DAS28-CRP变化1.2个点)。假定安慰剂反应率为10%,退出率为15%,双侧第1类错误为0.05,并且随机化率为2∶1(有活性的∶安慰剂),为216个受试者的总样本大小提供了86%的检定力以检测在反应率上20%的差异,以用于基于双侧费希尔精确检验(Fisher’s exact test)的分析。
使用费希尔精确检验(Fisher’s exact test)分析所有反应率,包括主要终点ACR20、ACR50和ACR70。使用混合模型重复的测量分析与对于基线DAS28的一个协变量对DAS28得分从基线的变化进行分析。使用科克伦-曼特尔-亨塞尔(Cochran-Mantel-Haenszel)检验对DAS28欧洲抗风湿病联盟(EULAR)反应标准进行分析。使用该EULAR反应标准将DAS28的改善进行分类,如以下表1AA所示:
表1AA-DAS28评分的改善
使用非参数对数秩检验对反应开始时间进行分析。
使用来自意向治疗(ITT)群体的数据进行所有功效分析。使用符合方案(PP)群体进行灵敏度分析。进行每个分析以将组合的安慰剂和组合的马威利姆单抗组进行比较,接着将组合的安慰剂组与每个马威利姆单抗剂量组类进行比较。对安全群体进行安全性数据的分析,该安全群体定义为接受任意剂量的研究药物的所有受试者。
对于该主要终点连同其他反应者分析,对于从研究治疗中撤出的、改变了背景甲氨蝶呤的剂量的或接受其他RA药物的受试者使用非反应者设算。使用末次观测值结转方法设算其他缺失数据点。对DAS28从基线分析的变化不应用设算。
mITT群体的基线特性
如表1AB所示,参与的患者居住于欧洲、南美洲和非洲的许多国家。25%的患者是来自南美洲。
表1AB-国家
表1B显示了参与的患者的以年数计的平均年龄、男性患者与女性患者的百分比、平均体重和平均身体质量指数(BMI)。
表1B-人口统计资料
表1C显示了在四个组类中患者的类风湿性关节炎历史,包括患者接受的甲氨蝶呤(MTX)的平均剂量。
表1C-RA历史
表1D显示了在确定改善了的四个组类中的患者的平均基线疾病活性。
表1D-基线疾病活性ACR组分和DAS28得分
326名患者参与了这项研究,分布如图1A和1B所示。超过90%的受试者完成了治疗。大约50%的安慰剂组的受试者在第169天前退出,主要是由于缺乏功效。如果没有反应,有选项进入开放延长期。人口统计总体上被很好地平衡,但是存在比安慰剂组更高比例的有活性的组的男性受试者,并且存在比安慰剂组更高比例的甾体和有活性的组的受试者。大约20%的受试者为血清阴性。基线DAS28疾病活性是RA群体的典型。
实例2:功效
表2A显示12周(第85天)后,DAS28从基线变化的共同主要终点。四个组类的平均基线DAS28活性范围是从5.7到5.9。12周后,150mg治疗的组类观察到从基线-1.90调整的平均变化,相比于安慰剂组的从基线-0.68调整的平均变化。这代表了150mg治疗的患者比接受安慰剂的那些有一个-1.22的改善。图2显示了从治疗开始至85天的DAS28从基线调整的平均变化,然后对于治疗的患者延长到至少169天。在第169天,150mg治疗的组类观察到几乎-2.2的从基线调整的平均变化,相比于安慰剂组只除了第160天以外仅观察到约-1.1的从基线调整的平均变化。
表2A-共同主要终点:DAS28(CRP)从基线的变化:第85天
一个次要终点是低疾病活性(DAS28得分3.2-2.6)。如表2B所示,在第169天低疾病活性被接受150mg治疗的42%的患者对比接受安慰剂治疗的仅9%的患者实现。
表2B-低疾病活性(DAS28得分3.2-2.6)
表3A显示了24周(第169天)后ARC功效反应的共同主要终点。24周后,73.4%的接受马威利姆单抗150mg剂量的那些实现了ACR20,对比安慰剂组是24.7%。24周后,40.5%的接受马威利姆单抗150mg剂量的那些实现了ACR20,对比安慰剂组是12.3%。24周后,13.9%的接受马威利姆单抗150mg剂量的那些实现了ACR20,对比安慰剂组是3.7%。在表3A中所示的结果也显示于图3A的柱状图中。
表3A-第169天的ACR功效反应(ACR20、ACR50、和ACR70)
图3B、3C和3D分别显示每天的ACR20、ACR50、和ACR70的结果。如可以看到,相比安慰剂组,更高百分比的150mg马威利姆单抗治疗的患者一致地实现了ACR20、ACR50、和ACR70的标准。
表4显示了24周(第169天)后,具有DAS28得分<2.6(缓解)的患者的百分比。24周后,19%的150mg马威利姆单抗治疗的患者得到缓解。图4A是显示从治疗开始至169天缓解的比率的图。
表4-缓解(DAS28得分<2.6)
反应的时间和反应的持续时间
图4B显示了在DAS28CRP缓解开始的时间观察到剂量反应,与安慰剂相比,使用150mg剂量的时间减少。
图4C显示了使用150mg马威利姆单抗治疗的患者比使用安慰剂有更长持续时间的DAS28-CRP缓解。
图4D显示在150mg马威利姆单抗治疗的患者与安慰剂组之间对应于DAS28CRP缓解开始的更快的时间的剂量反应。
图4E显示了使用150mg马威利姆单抗治疗的患者比使用安慰剂有更长持续时间的DAS28-CRP低疾病活性。
表5A显示了在24周(第169天)后,150mg马威利姆单抗治疗的患者表现出-0.55调整的平均变化,相比于安慰剂为-0.29(即,与安慰剂的差异为-0.26)。图5A显示了四个组类从治疗开始至第169天的HAQ-DI从基线调整的平均变化(+/-SE)。
表5A-在第169天HAQ-DI从基线的变化
如表5B中所示,150mg马威利姆单抗治疗的组类确实比安慰剂组(64.6%的马威利姆单抗治疗的组对比29.6%的安慰剂组)的HAQ-DI反应更好。图5B是图解在表5B中所示的结果的图表。
表5B-在第169天的HAQ-DI反应者(改善>=0.25)
图6A至6F展示了150mg马威利姆单抗治疗的额外的、快速的患者益处,早在一个星期和一个剂量的时候发生并继续持续长达24周的时间点。图6A显示了肿胀关节计数从基线调整的平均变化(+/-SE)。图6B显示了压痛关节计数从基线调整的平均变化(+/-SE)。图6C显示了患者全局评估从基线调整的平均变化(+/-SE)。图6D显示了患者疼痛从基线调整的平均变化(+/-SE)。图6E显示了医师全局评估从基线调整的平均变化(+/-SE)。图6F显示了对于基线CRP调整的几何平均比值。
表7A和7B显示对于用150mg马威利姆单抗治疗的患者的患者疲乏数据。
表7A-患者疲乏评分
表7B-FACIT疲乏反应
图7A是显示在第169天FACIT疲乏反应者(改善>=3)的表7B的图示。FACIT(慢性疾病治疗的功能评估)测量系统是针对慢性疾病管理的问卷的集合。除了报告基于FACIT的改善,如下所示给予马威利姆单抗后患者经历了在身体和精神领域评分两者的改善。表7C显示了身体健康得分,其中至少3.1的改善在临床上是重要的。表7D显示了精神健康得分,其中至少3.8的改善在临床上是重要的。表7E显示了在第169天的身体健康总评反应者。图7B是显示在第169天PCS反应者(改善>=3.1)的图示。
表7C-身体健康得分
表7D-精神健康得分
表身体健康总评
表7F显示在第169天的功能性精神卫生组成反应者。图7C是显示在第169天精神健康总评(MCS)反应者(改善>=3.8)的图示。
表精神健康总评
表7G描述了用马威利姆单抗的150mg剂量治疗的患者中临床疾病活性指数(CDAI)反应。CDAI是专注患者的,并不包括CRP。它包括肿胀和压痛关节计数和由患者和风湿病学家评估的全局疾病得分。CDAI减少6.5表示中度改善。下面表7G显示使用马威利姆单抗治疗在所有测试的剂量和时间点导致比中度改善更好的改善。
表7G-CDAI反应
功效汇总
2b期研究的结果显示,共同主要终点,DAS28和ACR20,对于所有三个剂量是统计学上高度显著的。对于DAS28和第85天观察到明确和统计学上显著的剂量反应。此外,采用德民纵向元分析对该结果与标准治疗进行了比较。如图8所示,在目前研究中观察到的ACR20结果,并且尤其是对于150mg组类的结果,在开始的速度连同最大ACR20反应速率方面是有高度竞争力的。
实例3:安全性
为这项研究记录了不良事件的发生率。下面的表格总结了当患者被纳入使用马威利姆单抗的研究中时发生的不良事件(AE)和严重不良事件(SAE)。表8A提供了不良事件的概况。表8B提供了研究期间发生的最常见的不良事件(即,在任何剂量上>3%)的列表。表8C强调了特别感兴趣的不良事件。表8D列出了研究期间检测到的严重不良事件。表8E列出了导致从研究退出的不良事件。
表8A-不良事件综述
表8B-最常见的不良事件
表8C-特别感兴趣的不良事件
*肝功能异常=AST/ALT>3*ULN并且胆红素>2*ULN。由于胆石病导致的1例海氏法则(Hy’s Law)
**嗜中性粒细胞减少症=嗜中性粒细胞绝对值<1.010^3/μL
表8D-严重不良事件
表8E-导致停药的不良事件
肺功能测试(PFT)测量肺部吸入和释放空气的程度,以及它们将气体如氧气从空气输入人体的血液循环的程度。FEV是用力呼气容积;FVC是用力肺活量。表8F列出了研究期间PFT从基线的最大减少。
表8F-PFT从基线的最大减少
对于嗜中性粒细胞;以U/L计的丙氨酸氨基转移酶(ALT);以U/L计的天冬氨酸转氨酶(AST);以及以mg/dL计的LDL胆固醇的化验值是贯穿6个月的治疗期间以定期的间隔获得的。在6个月期间离规范最远的化验值在下面的表8G至8J给出。表8G列出了嗜中性粒细胞水平(10^3/μL);表8H列出了ALT水平;表8I列出了AST水平;以及表J列出了LDL胆固醇水平。
表8G-嗜中性粒细胞水平
表8H-丙氨酸氨基转移酶水平
表8I-天冬氨酸氨基转移酶水平
表8J-LDL胆固醇水平
安全性概述
试验结果表明有活性的组和安慰剂组的肺部AE的类似百分比。还没有PAP的案例或暗示PAP的。报告了两个肺炎病例:(i)安慰剂非严重胸腔积液及(ii)30mg严重感染。还没有其他严重感染。有1例由于胆石病引起的海氏法则,但没有其他临床意义的实验室异常。无过敏反应。两个过敏AE导致停药(在30mg药物过敏和在150mg血管性水肿)。
实例4:研究设计综述日本的研究
该研究是一项随机化的、双盲的、安慰剂控制的、单剂量研究以评估马威利姆单抗在健康日本受试者中的药物动力学、免疫原性、和安全性。主要目的是评估在健康成年日本受试者中单次皮下(SC)给予马威利姆单抗的100mg和150mg剂量的药物动力学(PK)和免疫原性,次要目标是评估在健康日本受试者中单次皮下给予100mg和150mg剂量后马威利姆单抗的安全性。图1A和1B显示了研究设计。受试者是从20岁至55岁的日本族裔,即受试者的父母和两组祖父母都是日本人并且受试者已经在日本以外生活5年或更短。日本受试者具有良好的身体和精神健康,无临床显著的呼吸系统疾病的证据:DLCO、FEV1和FVC大于或等于预测的70%。
表9显示治疗的受试者的人口统计细分。
表9-人口统计资料
实例5:药代动力学:日本的研究
图10显示了在健康日本受试者中单次皮下给予马威利姆单抗剂量(100mg和150mg)的平均药代动力学曲线。表10显示非隔室分析(NCA)的结果。
表10-PK参数-NCA结果
在第85天有2个ADA+(抗药物抗体)样品(滴定度=1),每个(100mg/150mg)马威利姆单抗治疗组中各1个。这两个受试者的数据从表10中排除。总共6.1%(280个样品中的17个)从NCA排除。
图11A、11B、和11C显示了本日本的研究与100mg和150mg马威利姆单抗独立试验之间的药物动力学结果的交叉研究比较。日本的研究数据与以前的研究一致。图12A和12B分别显示观察到的日本受试者的PK曲线落入在100mg和150mg马威利姆单抗下预测的范围(排除ADA+和异常值)内。
表11进一步显示抗药物抗体(ADA)的数据。
表11-ADA
1在第29天和第57天,在基线为阴性。在第85天为阳性。
2在第29天和第57天,在基线为阴性。在第85天为阳性。
*持续阳性被定义为在≥2基线后评估中为阳性(在第一次和最后一次阳性之间≥16周)或在最后基线后评估中为阳性。
实例6:安全性:日本的研究
为这项研究记录了不良事件(AE)的发生率。表12A、12B、和12C总结了当受试者被纳入使用马威利姆单抗的研究中时发生的不良事件。
表12A-不良事件(AE)的概况
*药物过敏(详情见表14-特别感兴趣的AE滑动)
表12B-不良事件(AE)的频率
表12C-特别感兴趣的不良事件(AE)
1肝功能异常=AST/ALT>3*ULN并且胆红素>2*ULN。
2嗜中性粒细胞减少症=嗜中性粒细胞绝对值<1.0103/μL
*一名受试者报道了从给药日注射后大约4小时开始的由于临床试用药品(逐字术语)引起的2级(中度)过敏反应的相关的AE。位点说明:“受试者在1200h时在面部、颈部、胸部和四肢发展了广泛的瘙痒红斑皮疹,在1430h(未经任何治疗)完全解决。受试者主观感觉良好,生命体征正常。”
肺功能测试(PFT)测量肺部吸入和释放空气的程度,以及它们将气体如氧气从空气输入人体的血液循环的程度。FEV是用力呼气容积。FVC是用力肺活量。表12D显示了在基线和第85天评估的PFT结果。
表12D-第85天肺功能测试
1受试者11基线=86%;第85天=70%,无不良事件
2受试者05基线=89%;第85天=68%;1AE:1级鼻炎(第23-33天)
3受试者04基线=80%;第85天=61%;1AE:在第2天1级注射位点反应
对于嗜中性粒细胞;以U/L计的丙氨酸氨基转移酶(ALT);以U/L计的天冬氨酸转氨酶(AST)的化验值被获得并分别显示于表12E、12F、和12G。对于具有值小于正常下限(LLN)的受试者的嗜中性粒细胞曲线显示于图13A,以及对于具有值大于正常上限(ULN)的受试者的ATL曲线显示于图13B。
表12E-嗜中性粒细胞(103/μL)
表12F-ALT(U/L)
表12G-ALT(U/L)
安全性概述
没有观察到整体的安全性信号。AE百分比在试验组与安慰剂组之间是类似的。无死亡、严重/生命威胁或严重不良事件报告。一个温和的、药物过敏(PT)相关的AESI发生在150mg马威利姆单抗组,给药后4小时开始并3小时内得到解决而无需治疗。
有少数预测值的DLCO波动或分离值<70%,这不被PI认为是临床显著的,并不被肺脏学家提及。
***
具体实施例的以上描述将充分地揭示提供的实施例的总体性质,使得在不脱离本披露的一般概念的情况下,其他人可以无需过多的实验通过应用本领域的技术内的知识,容易地针对此类具体实施例的各种应用进行修改和/或改编。因此,基于在此提出的传授内容和指导,此类改编和修改旨在处于所披露实施例的含义和等效范围内。应当理解在此的短语或术语是出于描述而非限制的目的,这样使得本说明书的术语或短语可根据这些传授内容和指导为技术人员所理解。
- 还没有人留言评论。精彩留言会获得点赞!