全水性乳液的渗透干燥的制作方法
本申请要求保护在2014年5月27号提交的美国临时申请号62/003,357的优先权,其以其整体结合到本文中。
发明领域
本发明一般涉及用于基于全水性乳液体系制备固化颗粒或微粒的方法,所述全水性乳液体系包含在其间具有高渗透压梯度的两个或更多个不同的不混溶水性相。具体而言,所述方法依靠通过提高外相中渗透物的浓度将渗透诱导水从内相提取到外相。这种方法可以用于制备生物相容性固化颗粒。
发明背景
如图1中所示,乳液由分散在第二不混溶流体20(称为外相或连续相)中的一个内相10的液滴组成。普通乳液的实例为水包油和油包水乳液。液滴转化成固化颗粒具有相当大的商业应用价值。乳液液滴转化成固化颗粒的现有方式包括引入化学交联剂,其在接受刺激(例如光照和紫外照射)时引发化学反应交联和聚合反应从而固化。其他固化方式包括加热、真空干燥和冷冻干燥。所有这些方式需要大量外部能量输入和其它的后续处理步骤。
渗透诱导水提取,即渗透脱水,现在广泛用于不同领域,例如食品制备、农业制剂、红细胞代用品、化妆品和药品等。在食品工业中,通过将其浸在具有由于溶液中的高浓度的糖和盐导致的高渗透压的水性溶液中从而从物品,如水果和蔬菜,提取水制备适于长时间贮存的食品。蔬菜组织中的水可以使用这种方法部分除去,且因此可以实现食品保存。已报道了在乳液体系中两个水性相之间控制渗透压驱动的水迁移。
当在食品工业中使用时,将液体调味材料转化成容易处理的固体可以改进稳定性且可以控制干燥活性食品成分例如调料、酶等的释放。此外,还提供抵抗分解反应的保护并避免调料损失。
此外,渗透脱水也被应用于冷冻、冷冻干燥、真空干燥和空气干燥之前的预处理。已报道了控制水/油/水(W/O/W)乳液中的两个水性相之间的渗透压驱动的水迁移,且还研究了水传输的动力学。所述方法被许多参数影响,例如两个水性相之间的渗透压梯度的大小、表面活性剂的特性和浓度以及油相的特性和粘度等。
如Kaymak-Ertekin,M. Sultanoglu,Journal of Food Engineering,46,243-250 (2000)中所公开,从原料例如水果和蔬菜的渗透诱导水提取通过将固体/半固体材料整体或分片放到高渗溶液(糖和/或盐)中且溶质从渗透溶液同时反扩散到组织中来实现。该论文推荐这种处理方法作为获得较好食品质量的方式。部分提取水步骤还促进改进原料的结构、营养、感官及其他功能性质。
使用具有施加的电场的常规微流体设备,可以调节和控制在两个不混溶水性相之间液滴的产生。提出基于电喷的方法以受控尺寸和均匀度产生水包水(w/w)液滴。所述方法利用施加到微流体设备的电场以帮助控制液滴的形成。参见Z. Liu,H. C. Shum,Biomicrofluidics,7,044117(2013)。
在全水性乳液体系内,提出一种方法以良好生产速率产生受控和均匀直径的液滴。建议通过机械振荡器引入扰动以产生具有受控尺寸和均匀度的液滴。所述方法建议一种用于液滴微流体的生物和环境友好平台,且确立用于包封相关应用的水包水(w/w)液滴微流体的潜力。H. C. Shum,J. Varnell,D. A. Weitz,Biomicrofluidics,6,012808(2012)。
在论文A. D. Diamond,J. T. Hsu,Biotechnology Techniques,3,119-124 (1989)中确定了用于由葡聚糖和聚乙二醇(PEG)溶液构成的水性两相体系的22℃的相图。在该论文中说明了PEG和葡聚糖的分子量对相分离的影响。
最近在产生基于乳液体系的颗粒中的进步应用于各种领域中,例如食品、化妆品和药物递送工业等。当需要保存采用包封的精细组分形式的颗粒的生物活性时,制备条件以及方法应当是生物相容性的。全水性乳液可以使用所谓的水性两相体系(ATPS)产生,所述水性两相体系形成两个不混溶水性相,这类乳液具有吸引人的特点,例如其生物相容性及无细胞毒性。因此,在医药工业中,基于此类乳液的微粒可以用作用于控制释放生物活性化合物的安全载体。
由于其非毒性、储存稳定性、成本有效性以及制备过程的简单性,由全水性乳液制得的微粒具有变成有希望和广泛使用的用于包封的介质的潜力。它们可以通过不同种类的方法制备,例如喷雾干燥方法或常规匀质方法。后一个方法需要另外的步骤以使乳液液滴固化;其中一种常规方式为引入在刺激(包括光照)时引发交联和/或聚合的化学交联剂。到目前为止,没有涉及在不需要进一步的外部能量或化学物质的情况下渗透干燥全水性乳液体系中的微粒的报道。
微粒,如淀粉、明胶和葡聚糖微粒,可以通过常规均化交联方法使用另外的化学组分作为交联剂来制备。例如,在先前的研究中,具有包封骨形态发生蛋白2的交联明胶微球通过乳化方法制备并通过与具有京尼平(genipin)作为交联剂的小分子交联来稳定化。为了在交联之后获得最终的固化颗粒或微球,微球需要在冻干之前在-80℃下进一步温育2小时。整个过程需要密集外部能量输入且可能非常耗时。参见L. Solorio,C. Zwolinski,A. W. Lund,M. J. Farrell,和J. P. Stegemann,Journal of Tissue Engineering and Regenerative Medicine,4,514-523(2010)。
其他基于乳液的方法总是需要另外的步骤,例如外部搅拌、加热、真空干燥或冷冻干燥,在可以获得完全干燥的微粒之前经过一定的持续时间。而且,这些方法都需要大量外部能量输入。另外,用于包封在微粒中的其他活性成分,例如生物细胞、组织、药物、DNA和包括蛋白质的先导化合物等,需要适当保护其生物活性和良好保存其固有性质的精细处理。
因此,需要提供基于包含两个不混溶水性相的全水性乳液的一步制备固化颗粒的一般方法。
发明概述
本发明提供基于乳液的内相和外相之间的渗透压梯度用于将内相的水性液滴转化(例如干燥)成固化颗粒的方法。其基于内相和外相之间的渗透压梯度,因此不需要其它额外的方法达成颗粒的固化。其可以用于制备基于具有高生物相容性的全水性液滴微流体的固化颗粒。
乳液的内相和外相之间的渗透压梯度可以诱导从内相将水提取至外相,从而诱导液滴固化成颗粒。通过选择外相中具有不同分子量的组分,可以调节和控制制备的颗粒的尺寸和水含量以及制备时间。内相可以包括无活性溶解结构组分,例如淀粉,导致淀粉颗粒形成。而且,内相还可以包括活性溶解组分,例如酶,取代或补充结构组分等。结果为酶颗粒或将酶包封在淀粉基质中的淀粉颗粒。
本发明的方法提供从包含不同水性相的全水性乳液体系制备固化颗粒,而不必执行额外交联和固化步骤。因此,本发明允许通过常规液滴微流体方法一步制备固化颗粒,其中不需要外部能量输入。因此,本发明可以节省时间和能量。此外,由于其温和条件和固化方法,本发明提供生物相容环境以应用到位于内相中的细胞或其他活性生物成分的包封。
基于包含两个不混溶水性相的全水性乳液体系制备固化颗粒可以通过引入从内相到外相的渗透诱导水提取来实现。内相和外相之间的渗透压梯度产生可以通过提高外相中的渗透物浓度实现。
提供高渗透的全水性乳液的外相可以再循环,因此使所述方法成本有效。外相可以在过滤和重新加热溶液等再循环过程之后保持渗透物的浓度,从而再循环利用。
附图简述
从本发明的说明性实施方案的以下详述和附图,本发明的上述和其他特点将更容易地显而易见,其中:
图1为具有内相和外相的全水性乳液的示意图;
图2为液滴产生和固化方法的示意图;
图3(a)和3(b)为固化淀粉颗粒(a)和葡聚糖颗粒(b)的图片;
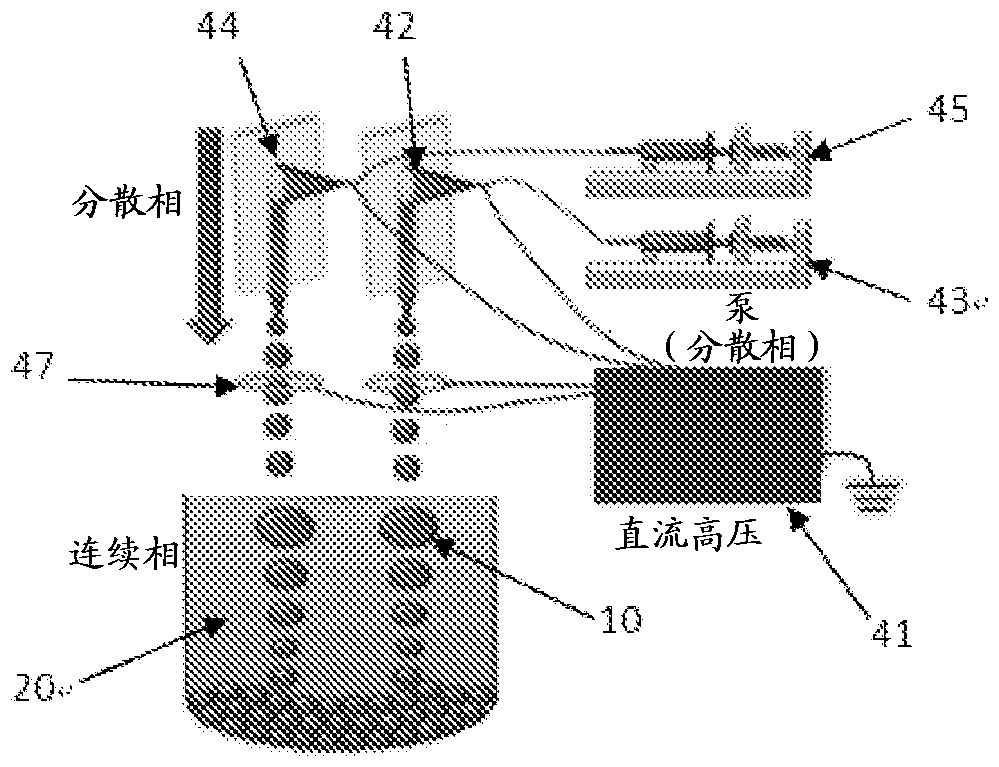
图4为根据本发明的装备的配置的示意图;
图5(a)-5(c)为显示不同分子量的PEG对颗粒尺寸(a)、水含量(b)和总制备时间(c)的影响的图表;
图6(a)-6(c)为从固化颗粒释放的包封细胞的光学显微镜图:(a) 染成蓝色的死细胞;(b) 未染色的活细胞;和(c) 在包封和后续释放之后的活细胞;
图7(a)和7(b)为根据本发明形成的PEG溶液中的固化葡聚糖颗粒和载玻片上的葡聚糖颗粒的示意图;和
图8(a)-8(d)分别为根据本发明形成的PEG溶液中的固化壳聚糖颗粒、PEG溶液中的固化CMS-Na颗粒、PEG溶液中的固化玉米淀粉颗粒和PEG溶液中的固化羟乙基淀粉颗粒的示意图。
说明性例示性实施方案描述
本发明为基于渗透脱水原理固化全水性乳液(W/W)的内相中的组分的方法。通常,根据所述方法,浓溶液(高渗透度),例如PEG或其他大分子,选作全水性乳液体系的外相。诱导与外相的相分离的其他水性溶液可以选作内相。例如,内相可以包括例如淀粉的组分,其可以诱导相分离且形成颗粒的结构组分。随后将内相注射到外相例如浓PEG溶液中。由于内相和外相之间的渗透压梯度,水从内相提取到外相,由此使内相中的组分浓缩到一定程度而引发液滴固化成结构组分的颗粒。
如果将另一种组分例如活性成分例如酶溶解并与内相中的结构组分混合,所述活性成分将结构组分一起浓缩成颗粒。因此,活性组分将嵌入到结构组分的基质例如淀粉内。而且,如果活性成分本身可以充当结构组分,所产生的颗粒将具有活性功能,而不具有任何惰性结构组分。这种固化液滴的方法不需要任何进一步处理且可以在一个步骤中实现活性成分的共包封。
本发明用于处理通过不同方法制备成固化结构的乳液液滴,例如具有不同结构的颗粒。当水从淀粉液滴逐渐提取时,淀粉在该过程期间被固化。最后,可以容易地收集完全固化淀粉颗粒,例如通过过滤,以用于其他应用。而且,浓溶液,例如PEG,可以在取出固化物品之后再循环。
哈佛大学的D.A. Weitz小组在先前开发了可以用于产生用于本发明的简单乳液的玻璃毛细管设备。参见Weitz等人的美国公开专利申请号2009/0131543A1,其以其整体结合到本文中。产生简单水包水乳液的两相流体的优选实例为多糖-蛋白质体系(葡聚糖-明胶;黄原胶-乳清蛋白;氧化淀粉-明胶;藻酸钠-酪蛋白酸钠;阿拉伯胶-明胶;果胶-乳清蛋白;果胶-酪蛋白;藻酸盐-酪蛋白酸盐)。
产生简单水包水乳液的两种水性流体的组合的优选实例为多糖-多糖体系(葡聚糖-硫酸葡聚糖;葡聚糖-羟丙基葡聚糖;fiscoll-葡聚糖;葡聚糖-聚乙烯醇;葡聚糖-聚乙烯基吡咯烷酮;葡聚糖-甲基纤维素)。
产生简单水包水乳液的两种水性流体的组合的优选实例为基于聚乙二醇(PEG)的体系(PEG-葡聚糖;PEG-葡聚糖HEMA;PEG-甲基丙烯酸酯化葡聚糖;PEG-磷酸三钾;PEG-硫酸葡聚糖;PEG-羟丙基葡聚糖;PEG-聚乙烯醇;PEG-聚乙烯基吡咯烷酮;PEG-甲基纤维素)。产生全水性乳液可以通过使用任何水性两相体系(ATPS)使用本发明的方法实现。
引入内相和外相之间的渗透压梯度通过提高乳液体系中的外相中的渗透物的浓度实现。控制固化颗粒的尺寸和水含量通过选择外相中的具有不同分子量的渗透物实现。干燥速率还可以通过改变外相中的渗透物的分子量调节。
制备的颗粒的生物相容性通过包封内相中的蛋白质和细胞并试验蛋白质的生物活性和细胞的生存力来说明。
实施例
根据本发明,通常内相为淀粉的水性溶液(MW=340,10%重量)且外相为聚乙二醇的水性溶液(PEG,MW=8000,40%重量)。外相具有高渗透度,渗透度直接与组分的浓度有关。随后将内相注射到浓PEG溶液中。由于内相和外相之间的渗透压梯度,将水从内相提取到外相,由此使内相中的组分浓缩。最后将组分浓缩到一定程度以引发固化。由此,可以获得固化淀粉颗粒。
在图2中显示液滴形成和固化方法。这种方法用于不同水溶性材料。将葡聚糖溶液(T-500,MW=500000,15%重量)注射到PEG溶液(MW=300,100%)中且制备固化的葡聚糖颗粒。图3为有色淀粉颗粒和葡聚糖颗粒。
实施例1
在实施例1中,内相为淀粉的水性溶液(MW=340,10%重量)且外相为聚乙二醇的水性溶液(PEG,MW=8000,40%重量%=)。外相具有较高渗透性,渗透性直接与其组分的浓度有关。如图2中所说明,将内相10注射到浓PEG溶液20中。由于内相和外相之间的渗透压梯度,将水从内相提取到外相,由此浓缩内相中的组分。最后浓度进行到一定程度以引发固化。由此,获得固化淀粉颗粒。参见图3(a)。
实施例2
使用实施例1的装备配置(图2),两个不混溶相取为外相的聚乙二醇(PEG,MW=300,100重量%)和内相的葡聚糖的水溶液(15重量%)。结果为固化葡聚糖颗粒,如图3(b)中所示。
实施例3
在实施例3中,内相为淀粉的水性溶液(MW=340,10重量%)且外相为聚乙二醇的水性溶液(PEG,MW=8000,40重量%)。图4中所示的微流体设备具有一个毛细管44,其具有200μm的近似端直径。柔性管在注射器确定的流速Qin下从注射器45输送毛细管中的内部流体,所述流速通过注射器确定。直流(DC)高压供应源41连接到如图4中所示的微流体平台,从而在毛细管和电极47之间形成电场。通过改变供应电压控制电场。通过调节供应电压,可以如图4中所示控制乳液液滴的尺寸。
实施例4
使用实施例3的装备配置(图4),两个不混溶相取为外相的聚乙二醇(PEG)溶液(具有相同渗透度但具有不同分子量)和内相的淀粉水性溶液(10重量%)。与实施例3比较,第二不混溶相使用注射器43、毛细管42和第二电极41。为了控制颗粒尺寸和水含量以及总处理时间,重复该试验,其中两个不混溶相取为外相的聚乙二醇(PEG) (具有相同渗透度但具有各种不同分子量)和内相的淀粉水性溶液(10重量%)。发现通过改变外相中的PEG的分子量,可以调节和控制淀粉颗粒的尺寸和水含量以及处理时间。在图5(a)-5(c)中说明分子量改变对体积、水含量和干燥时间的影响。
实施例5
慢性粒细胞白血病细胞在淀粉内相中混合以将其包封在颗粒中。采用合适方法以试验固化颗粒内的细胞生存力。从固化颗粒释放的包封细胞的光学显微镜图在图6中显示,其中图6(a)说明染成蓝色的死细胞;图6(b)说明未染色的活细胞;且图6(c)说明在包封和后续释放之后的活细胞。这说明本发明的生物相容性。
除了可溶淀粉之外,葡聚糖、壳聚糖、CMS-Na(羧基甲基淀粉钠)、玉米淀粉和羟乙基淀粉的水性溶液可以用作水性两相乳液体系的液滴相以制备固化颗粒。图7(a)和7(b)为根据本发明形成的PEG溶液中的固化葡聚糖颗粒和载玻片上的葡聚糖颗粒的示意图。使用葡聚糖T500溶液(15重量%)。
图8(a)-8(d)分别为根据本发明形成的PEG溶液中的固化壳聚糖颗粒、PEG溶液中的固化CMS-Na颗粒、PEG溶液中的固化玉米淀粉颗粒和PEG溶液中的固化羟乙基淀粉颗粒。壳聚糖溶液为6重量%,CMS-Na溶液为4重量%,玉米淀粉溶液为10重量%且羟乙基淀粉溶液为10重量%。
本发明还用于通过处理由不同方法制备的乳液液滴来制备固化颗粒。例如,3D微流体设备可以与外部电场的辅助一起使用以将内相逐滴喷到PEG外相中。当水逐渐从淀粉液滴提取时,淀粉在该过程期间固化。最后,可以容易地收集固化淀粉颗粒以用于其他应用。而且,用作浓溶液的PEG溶液可以通过例如过滤的技术再循环且在取出固化颗粒之后重新加热。
如通过实施例5说明,用于制备固化颗粒的本发明的方法对包封的组分的活性不具有有害影响。因此,制备的颗粒具有生物活性和细胞生存力的高保存性。
本发明对包封成分的干扰较小,例如,活细胞可以使用这种固化技术包封在淀粉颗粒中。以这种方式包封的细胞的生存力为高于90%,这表示这种固化技术对细胞不具有消极影响。这比其他固化技术好得多。具体而言,通过正常固化技术(其中淀粉溶液与细胞混合并放在37℃的烘箱中干燥溶液)形成的包封细胞的生存力仅为10%。其他现有技术如真空干燥将由于真空条件而杀死细胞。
本发明的配置的成本比采用其他技术低得多。成本来自注射设备的制备与购买滤筛和滤纸。并不需要大规模设备。
对于大规模部署,唯一需要的事情仅为用多端设备替换单端微流体设备。这种设备可以用聚二甲基硅氧烷(PDMS)使用3D打印制备。制备方法的成本低。
为了方便仅在一个或多个附图中显示本发明的具体特征,因为各个特征可以与根据本发明的其他特征组合。本领域技术人员将想到备选实施方案且备选实施方案旨在包括在权利要求的范围内。因此,以上描述应当视为说明而不限制本发明的范围。所有这些明显改变和修改在随附权利要求的专利范围内。
虽然已参考本发明的优选实施方案具体显示和描述本发明,本领域技术人员应当理解在不偏离本发明的精神和范围的情况下,在其中可进行形式和细节的各种改变。
- 还没有人留言评论。精彩留言会获得点赞!