阿尔茨海默病(AD)的治疗和预防的制作方法
各种痴呆的特征在于淀粉样蛋白-β多肽(Aβ)的异常积累,导致β-淀粉样蛋白沉积。β-淀粉样变性病的最突出形式是AD。其他实例包括但不限于Lewy体痴呆和唐氏综合征中的痴呆。
AD是目前最普遍的神经退行性疾病,影响着全世界2800万人。它通常表现为与其他认知-、行为-和神经精神变化相关的特征性记忆功能障碍。AD的特征在于细胞内和细胞外淀粉样蛋白沉积物的异常积累–这与广泛的星状细胞增多和胶质细胞增生以及营养不良的神经元和神经元损失密切相关。这些淀粉样蛋白沉积物主要由衍生自淀粉样蛋白前体蛋白(APP;gi:112927)的Aβ-肽Aβ40和Aβ42组成,所述淀粉样蛋白前体蛋白表达于神经系统中的各种细胞类型。Aβ肽被认为直接参与AD的发病和进展。
除了淀粉样蛋白沉积物之外,神经原纤维缠结(NFT)体现出AD的第二个特征性神经病理学标志,其首先由Alois Alzheimer描述。这些损伤发生在海马体、扁桃体相关的皮层(amygdale association cortices)和一些皮层下核。NFT位于神经元的细胞质中且由高度磷酸化的tau蛋白组成。Tau是一种轴突微管结合蛋白,其在正常情况下促进微管组装和稳定。Tau的高度磷酸化导致微管缔合的损失和随后微管的分解,这又导致轴突运输的受损和随后的轴突和神经元变性。仍然不清楚Tau高度磷酸化和缠结形成是AD的原因还是结果。
除了淀粉样蛋白和Tau/高度磷酸化Tau的病理学,神经炎症可以被认为是导致AD中神经变性的病理生理变化的第三个组成支柱。AD中的神经炎症表型的特征在于在受影响的脑区域中的小神经胶质细胞和星形胶质细胞的强力且广泛的活化,导致促炎细胞因子、细胞粘附分子和趋化因子的内源性表达。这些变化被认为是由于针对涉及由淀粉样蛋白和Tau/高度磷酸化的Tau以及它们的传递质引起的持续毒性的事件的神经胶质反应所导致。
目前认为针对AD及相关障碍的一个潜在的治疗策略可基于免疫治疗以预防或减少神经毒性试剂(例如Aβ或Tau/高度磷酸化的Tau)的积累。
靶向Tau/高度磷酸化的Tau的各种主动和被动治疗策略导致在动物模型中Tau/高度磷酸化的Tau的沉积和相关的神经病理变化的减少,但是,目前还没有在人AD患者中的积极数据。相反地,最近有大量的临床实验的失败:来自“靶向淀粉样蛋白-β的两种单克隆抗体(bapineuzumab和solanezumab)的三期临床实验表明,在散发性疾病的痴呆阶段对淀粉样蛋白-β的免疫进攻的临床益处很小”的结果(Aisen等人,Nat.Rev.Drug Disc.12(2013),324-325;Mullard,Nat.Rev.vDrug Disc.11(2012),657-660)。还有其他关于假说驱动的候选疾病调节剂的研究,“例如抗炎药、分泌酶抑制剂和调节剂、激素疗法、他汀类药物和其他药物已经令人失望”,包括“两种最重要的γ-分泌酶抑制剂(semagacestat[..]和avagacestat)的临床失败”(Aisen等人,2013;Mullard,2012)。评论者已经将AD临床实验的这种差的临床结果称为“在阿尔茨海默病治疗实验中‘绝望的十年’的巅峰,自美金刚被批准以来没有任何实质性的成功”(Aisen等人,2013)。在这一发展过程中,US-FDA也修订了批准针对AD的新治疗的规则并推荐使用AD特异性生物标记,例如使用PET(正电子发射断层摄影)扫描的放射性生物标记(Kozauer等人,N.Engl.J.Med.368(2013),1170-1171)。
WO 94/16327 A1公开了涉及“淀粉样蛋白离子通道”的治疗剂。但是,WO 94/16327 A1的这个淀粉样蛋白离子通道的概念没有被进一步实行并最终被合乎科学地挑战(Sokolov等人,J.Gen.Physiol.128(2006),637-647;由Eliezer注释,J.Gen.Physiol.128(2006),631-633)。
此外,WO 94/16327 A1的教导暗示了Al-离子与潜在的Aβ—离子通道在体内的活性相互作用,从而抑制这些通道。因此,为了使铝完成任务,所述化合物必须以建议的浓度到达作为活性部位的脑。在人脑中,正常水平的铝的范围是0.25-0.75mg/kg湿重,其中灰质(主要负责调节在AD中受影响的认知功能)含有约为白质中可见的两倍的浓度(The EFSA Journal(2008)754,24-88;Annex to the EFSA Journal(2008)754,1-34opinion”Safety of aluminium from dietary intake”)。有证据表明,随着年龄的增加,铝浓度甚至可在人脑组织中增加。类似地,多项研究还表明,来自AD患者的脑比健康的对照脑具有更高的Al-水平(可见于Yokel,NeuroToxicology 21(2000),813–828)。因此,所建议的治疗有效的Al浓度已经存在于健康和患病的脑中(在如WO 94/16327 A1,权利要求12中所述的预期的使用-制剂的范围内:0.01-10mg/kg)。此外,在胃肠外和口服摄取之后的脑中的Al的生物利用度依赖于主动调节、高效流入/流出机制而保持较低,并且需要高的外周剂量以达到建议的脑治疗浓度。因此,没有任何合理的科学依据表明,额外地增加外周Al将导致产生直接治疗有益效果所需的而不引起潜在毒性效应的额外的脑Al水平。
此外,本申请的图7和8公开了局部施用的羟基氧化铝(aluminium oxyhydroxide)能够在用于阿尔茨海默病的APP-转基因模型(Tg2576)中显著降低认知衰退而不会显著改变脑的Aβ水平。这意味着,在该AD模型中羟基氧化铝所产生的有益功能效果的背后存在APP/Aβ独立机制。
WO 99/27944 A1公开了AD疫苗,其基本上是基于存在有效诱导针对Aβ的免疫原性应答的试剂。WO 2011/120924 A1涉及一种Aβ疫苗,其基本上基于与病毒样颗粒结合的Aβ1-6肽。WO 2006/005707 A2、WO 2009/149486A2和WO 2009/149485 A2公开了在用于预防和治疗AD的疫苗中使用的Aβ模拟位肽。
Heneka等人(Nature,493(7434)(2012):674-678)建议通过抑制NLRP3来治疗AD以减少淀粉样蛋白-β聚集。Aimanianda等人(TIPS,30(6)(2009):287-295)公开了明矾活化NLRP3。
Magga等人(J.Cell.Mol.Med.16(2012):1060-1073)报道了由骨髓干细胞产生的单核细胞以及它们在AD中的治疗用途。Lebson等人(Cell Transp.Cogn.Com.17(2008):470/471)公开了在AD APP+PS1转基因小鼠中的单核细胞基因疗法。WO 2012/055981 A1建议使用“不含内毒素的TLR4激动剂”以预防或减少淀粉样蛋白沉积中。Malm等人(GLIA 58(2010):889-900)对单核细胞在AD中的作用和治疗潜力进行了综述。
WO 2009/105641 A1公开了M-CSF在治疗淀粉样变性中的用途。Boissionneault等人(Brain 132(4)(2008):1078-1092)报道了M-CSF对AD中的淀粉样蛋白沉积和认知损伤的效应。Luo等人(Neuroscience letters 367(2)(2013):210-172)公开了在受损的神经元中的集落刺激因子1受体(CSF1R)的信号传导促进保护和存活。
因此,到目前为止,没有有效的改变病情的(disease modifying)治疗可用于阻止人患者中的进行性神经变性和相关的认知衰退。针对AD的可用的治疗方式包括三种乙酰胆碱酯酶抑制剂(AChEI)和一种N-甲基-D-天冬氨酸(NMDA)拮抗剂。它们的效果小且在性质上仅仅是症状性的(参见例如Corbett等人,Nat.Rev.Drug Discov.11(2012),833-846)。因此,对改变病情的药物存在高度的医学需求。
本发明的目的是提供治疗和预防AD的手段和方法,其能够治愈AD,所述治愈AD的意思是患病患者的情况不再进一步发展或甚至是得到改善。另一个目标是提供在患有或有发展出AD的风险的人中用于预防AD发展的手段和方法。更具体地,本发明的目的是提供有效的AD治疗,如通过针对至少一种显著的生物标记物所证明的,其通过使用MRI(磁共振成像)或基于发射断层扫描技术的脑成像方式所测量的。
因此,本发明提供了用于治疗和预防与β-淀粉样蛋白沉积相关的痴呆(优选阿尔茨海默病(AD))的铝盐。
在本发明的过程中,令人惊讶地发现,本身被证明在临床实验中有效提供对AD患者真正的改变病情作用的铝盐引起迄今为止在AD药物的任何临床试验中均未见到的临床效力。因此,本发明为这种疾病提供了突破性的技术。首次在AD患者中可检测到显著的改变病情作用。此外,本发明还被证明是有效的,而没有在针对AD药物的其他临床试验中(特别是在AD免疫治疗领域中)所报道的显著副作用。
更具体地,就(右侧)海马体体积的MRI扫描而言,本发明在AD患者中已经实现了统计学显著的改变病情作用。此外,在本发明进行的临床试验过程中首次显示临床生物标记物和放射性生物标记物的关联。在最新的科学文献中(Risacher等人,Annu.Rev.Clin.Psychol.9(2013),621-648;Vermuri等人,Neurology 73(2009),287-293和294-301;Weiner等人,Alzh.Dememt.9(2013),e111-94;Frisoni等人,Nat.Rev.Neurol.6(2010),67-77;Fox等人,Arch.Neurol.57(2000),339-344),结构MRI已作为重要的生物标记物被突出显示。
MRI提供了巨大的力量,以实现横断面群组辨别(cross-sectional groupwise discrimination)以及在横向上一般认知和功能状态之间更好的相关性。MRI反映出临床上确定的疾病阶段,其效果甚至好于所检测的各种CSF生物标记物(Vermuri等人,Neurology 73(2009),287-293和294-301)。在注定从MCI转变成可能的AD的患者(MCI-转变者)中,在临床转变前最多2年,各种研究已经证明了显著降低的海马体和内嗅皮层(EC)体积,以及在中间和侧部的颞叶皮层、顶叶和额叶中降低的皮质厚度(Risacher等人,2013)。
因此,在用于本发明的临床试验过程中研究了该生物标记物,其平行于标准临床参数(监测AD患者的功能性和认知性功能)。
使用本发明,相比于AD患者的通常发展(逐渐的认知、功能和行为衰退),可实现对AD患者发展的显著改善以满足提供针对AD的改变病情治疗的长期需求。
因此,本发明的主题是铝盐在治疗和预防与β-淀粉样蛋白沉积相关的痴呆(优选AD)中的用途,其中将有效量的这种铝盐给药至患有β-淀粉样蛋白沉积或有发展成β-淀粉样蛋白沉积的风险的患者,优选患有或有发展成AD、Lewy体痴呆和唐氏综合征中的痴呆(尤其是AD)的风险的患者。
铝盐长期被用作疫苗中的佐剂,但是,在这些年中,这种盐的药物用途已经减少到主要2种混悬液制剂,即Alhydrogel(羟基氧化铝)和AdjuPhos(羟基磷酸铝),抗原被吸附于其上以用于疫苗制剂(见于E.B.Lindblad(2004)Vaccine 22,3658-3668;E.B.Lindblad(2004)Immunology and Cell Biology 82,497-505;R.K.Gupta(1998)Adv.Drug Delivery Rev.32,155-172)。
尽管Alhydrogel被长期使用,但是尚未了解其作为佐剂的作用模式。最初的假说,即Alhydrogel在注射位点形成储室(depot),已被证明仅是多面性机制的一部分(见于C.Exley,P.H.Eriksson(2010)Trends Immunol.31,103-109;S.L.Hem,H.HogenEsch(2007)Expert Rev.Vaccines 6,685-698;P.Marrack,A.S.McKee,M.W.Munks(2009)Nature Rev.Immunol.9,287-293;S.G.Reed,M.T.Orr,C.B.Fox(2013)Nat.Med.19,1597-1608)。
用于人的铝佐剂主要形式是氢氧化铝(或羟基氧化铝)和磷酸铝。这两种形式通常通过将可溶性铝盐(经验上,通常使用钾矾,即KAl(SO4)2.12H2O)暴露于碱性条件来制备,由此形成混悬液。使用X射线晶体学和IR光谱的表征显示了氢氧化铝的勃姆石样结构(羟基氧化铝)和对应于羟基磷酸铝的磷酸铝的无定形结构。
因此,本发明优选的铝盐具有通式Mea+Alb3+Anc-·nH2O,其中
Me+为Na+、K+、Li+、Rb+、Cs+或NH4+;
An为PO43-、SO42-、O(OH)3-、O2-或OH-;
a为0、1、2或3;
b为1或2;
c为1、2、3、4、5或6;且
n为0-48。
这种铝盐的优选实例是已经在人类使用中研究、检查和验证过的那些,例如氢氧化铝、羟基氧化铝、磷酸铝、硫酸铝或任何类型的“明矾”(其中“明矾”通常是指一类化合物,包括“典型明矾”,具有式KAl(SO4)2·12H2O的水合硫酸铝钾(钾矾),且更通常的为双硫酸盐,其具有式AAl(SO4)2·12H2O,其中A为一价阳离子,例如钾或铵)。
本发明铝盐的最优选的实施方案选自氢氧化铝、羟基氧化铝、磷酸铝或硫酸铝,尤其是羟基氧化铝,其在本发明过程中已经被深入研究,因为它是人类使用中的优选佐剂(在各种疫苗中作为Alhydrogel佐剂)。
本发明铝盐可与其他物质混合以实现本发明的改变病情作用。但是,因为本发明的铝盐也具有蛋白结合能力(还取决于所述蛋白的pI和所述药物制剂的pH),当在将被给药至患者的药物制剂中存在蛋白或多肽时,则所述铝盐浓度必须升高。
例如,磷酸铝(Adju-Phos)对溶菌酶(pI 11.0)具有的最大结合容量(在pH7.4,以mg蛋白/mg铝计)为1.4±0.1;羟基氧化铝(Alhydrogel)对Ovalbumin(pI 4.6)是1.6±0.1和对BSA(pI 4.9)是2.2±0.1(Jones等人,JBC 280,(2005),13406–13414)。为了补偿与这些蛋白结合的铝,在这种混合药物制剂中必须要提供比含有铝盐作为单一有效成分的制剂或者至少在所述药物制剂中不存在蛋白或多肽的制剂更多的铝盐。例如,如果本发明的药物组合物应当提供2mg铝盐(尤其是羟基氧化铝)剂量的有效性且含有特定量的与铝盐结合的蛋白或多肽,那么必须在所述药物制剂中额外包含与结合至该蛋白的铝盐部分相等的量以提供2mg的“游离”铝盐。
因此,优选给药包含在药物制剂中的本发明的铝盐,其中该制剂含有作为单一有效成分的铝盐,尤其是羟基氧化铝。
本发明最优选的实施方案包括向AD患者有效给药羟基氧化铝(特别是作为Alhydrogel)。
羟基氧化铝制剂在pH约为pH 11时具有零电荷点,而羟基磷酸铝可在低至pH 4(取决于磷酸盐含量)时具有零电荷点。因此,羟基氧化铝和羟基磷酸铝在中性pH具有相反的表面电荷,后者带有负电荷。但是,必须提及的是,所述表面电荷可根据确切的缓冲液组成,尤其是具有降低羟基氧化铝表面电荷能力的磷酸根离子而变化。
对于羟基氧化铝,所述制剂没有例如磷酸根、硝酸根或氯离子的阴离子且具有小于20ppm的特定重金属含量。羟基氧化铝的混悬液具有2μm至大约10μm的粒度分布,其是由约2nm x 4.5nm x 10nm的较小纤维构成的聚集体。
根据这个最优选的实施方案,本发明涉及欧洲药典级(羟基氧化铝,专著1664)的使用,更具体地涉及由Brenntag Biosector制造的产品(2%Alhydrogel),其针对EP顺应性进行检测。Alhydrogel有三个品种:Alhydrogel1.3%;Alhydrogel 2%和Alhydrogel“85”。Alhydrogel 2%被选为氢氧化铝凝胶的国际标准制剂。本发明的药物制剂被无菌地配制在合适的缓冲液中,优选等渗磷酸盐缓冲液(1mM至100mM),优选≥1.0mg/ml浓度的Alhydrogel(以Al2O3的当量给出;该度量(作为“Al2O3当量”的Al)通常用于本发明;因此,本申请中提及的所有剂量和量,只要它们涉及铝盐(特别是只要它们涉及羟基氧化铝),是指(羟基氧化铝(Alhydrogel)的)Al2O3当量),甚至更优选浓度≥1.5mg/ml的Alhydrogel(以Al2O3的当量给出),最优选浓度≥2.0mg/ml的Alhydrogel(以Al2O3的当量给出)。用于Alhydrogel的铝盐的量根据制造商所述的浓度(strength)以Al2O3当量给出(即2%Alhydrogel等于2%Al2O3,即20mg/mL)。该浓度通过使用各自的分子量直接可转化成各自的铝浓度(20mg/mL Al2O3(Mw 101,96)对应于10.6mg/mL铝(分子量26,98))。根据所用盐,该值可容易地转化成不同铝盐的必需量/浓度(很明显,这些值仅基于铝(盐)的量,且不考虑其他方面,例如Alhydrogel的颗粒性质的贡献)。
Alhydrogel 2%,通常也被称为明矾,是羟基氧化铝湿凝胶混悬液。
在本发明的最优选实施方案中,给药至AD患者的铝盐是羟基氧化铝混悬液,优选欧洲药典级羟基氧化铝(专著1664),尤其是Alhydrogel。所述羟基氧化铝以有效实现AD改善效果的量进行给药,其通过对用于治疗AD和其他痴呆的医药产品的EMEA指导原则进行确定(2008年7月24日的参考文件CPMP/EWP/553/95Rev.1)。因此,本发明的铝盐制剂(尤其是羟基氧化铝制剂)的任何给药方法或给药方案(其适于实现本发明所提供的AD缓解作用)均属于本发明。尽管可通过缓慢输注的方式递送本发明制剂,但是优选的给药策略是剂量给药,例如通过皮下注射。因此优选地,向AD患者施用的所述铝盐(优选羟基氧化铝)的给药剂量至少为1.2mg。给药至患者的量的优选范围是1.2mg至5.0mg的所述铝盐,优选羟基氧化铝的量。给药所述铝盐(优选羟基氧化铝)的AD改善作用在至少1.5mg的量时甚至更显著。根据另一优选实施方案,将所述铝盐(优选羟基氧化铝)以1.5mg至5.0mg、优选1.5至3.0mg、尤其是1.5至2.5mg的量给药至AD患者。另一优选实施方案包括将所述铝盐(优选羟基氧化铝)以1.6mg至2.5mg、优选1.8至2.2mg、尤其是1.9至2.0mg的量给药至AD患者。
根据另一优选实施方案,所述铝盐(优选羟基氧化铝)以2.2mg或更高的量进行给药。该量甚至高于美国一般生物制品标准中的规定(U.S.C.21CFR610.15(截止2013年4月1日))。该铝盐(优选羟基氧化铝)的这种优选的更高的范围通常是每一个给药剂量2.2至10mg、2.2至8mg、2.2至5mg和2.2至4mg。
优选地,所述铝盐是以给药剂量施用的单一有效物质。但是,本发明的铝盐制剂可含有各种辅助物质,其不具有特定的临床效应但对于待给药的剂型有用,无论是给药目的、储存目的或其他目的。根据优选实施方案,根据本发明待施用的铝盐制剂(优选所述羟基氧化铝制剂)含有药学上可接受的载体、稀释剂或赋形剂,例如注射用水。优选地,本发明的铝盐制剂(尤其是羟基氧化铝制剂)还含有一种或多种稳定剂(尤其是硫柳汞)、洗涤剂、抗氧化剂、用于一价或二价金属离子的络合剂(特别是乙二胺四乙酸(EDTA))、糖、糖醇、甘油和/或缓冲物质(特别是TRIS或磷酸盐缓冲物质)。当然这也包括这些辅助物质的混合物。
给药至受试者的剂型可以以任何方便的体积提供,优选作为可注射混悬液,例如0.1至10ml、更优选0.2至5ml、特别是0.4至3ml的体积。特别优选的体积是0.5、1、1.5和2ml。本发明的药物制剂是根据药物优质生产规范(GMP)生产的,如欧洲和/或美国药典所要求和规定的。
根据优选实施方案,将所述铝盐(优选羟基氧化铝)在pH为4至10、优选5至9、更优选6至8、特别是7.0至7.5的混悬液中给药至患者。优选地,所述混悬液是等渗混悬液。
优选地,通过对AD患者尽可能方便且仍有效实现AD改变作用的途径给药所述铝盐。本发明铝盐(优选羟基氧化铝)的最有效的治疗途径是皮下、结节内、皮内或肌内给药,尤其是皮下给药。皮下给药通过推注到皮下组织(直接位于真皮和表皮下面的皮肤层),尤其是皮下组织中的脂肪组织来完成。
给药方案可针对每个AD患者进行单独优化,其取决于治疗的成功,其通过各种参数测量,尤其是通过认知和功能表现以及通过生物标记物,尤其是与海马体体积有关的结构MRI(如下可见)。在本发明进行的临床试验过程中,至少按月向AD患者给药所述铝盐(优选羟基氧化铝)已被证明成功改善AD。为了获得持久的治疗效果,这种至少按月给药应持续至少3个月,特别是至少6个月。
本发明的铝盐(优选羟基氧化铝)的给药也可以至少每月2次进行(例如每两周一次或每周一次);在这种给药方案中,向AD患者给药所述铝盐(优选羟基氧化铝)还应至少持续3个月,优选至少6个月,更优选至少12个月,特别是至少24个月。
根据优选实施方案,将所述铝盐(优选羟基氧化铝)在上臂(的外侧区域)通过皮下给药至AD患者,优选左上臂和右上臂交替给药(即给药第一剂量至右侧(或左侧)上臂并给药第二剂量至左臂(右臂)等)。用于皮下给药的其他方便(或替代的)区域为刚刚在腰部上方和下方(除了肚脐周围的区域(2英寸的圆))、臀部上方区域(优选刚好在髋骨的后面)、大腿前面、中间位置到外侧、大腿根下4英寸到膝上4英寸等。
或者,待给药的剂量也可分为两个(或多个)分次剂量,其同时给药(在同一次就诊时间;至少在同一天)至所述AD患者。例如,可将2mg的剂量分成1.8和0.2mg、1.7和0.3mg、1.5和0.5mg、1.34和0.76mg、1.0和1.0mg、1.05和0.95mg、1.0、0.5和0.5mg、0.6、0.6和0.7mg、0.2、0.5和1.3mg、0.5、0.5、0.5和0.5mg、0.2、0.3、0.5和1.0mg等分次剂量。所述分次剂量可在不同给药部位或优选在相同给药部位进行给药。所述“相同给药部位”在10cm2的皮肤范围内,优选在5cm2的皮肤范围内,特别是在1cm2的皮肤范围内。优选的分次剂量含有0.8至5.0mg,优选1.0至3.0,特别是1.0至1.5mg量的铝盐(优选羟基氧化铝)。
为了实现非常持久的AD改善效果,本发明的治疗进行长于一年。根据本发明的优选实施方案,向AD患者至少按月给药所述铝盐持续至少两年,优选持续至少四年,特别是至少8年。
可通过任意合适的给药装置进行本发明的铝盐(优选羟基氧化铝)的给药。为了方便起见,通过注射装置,特别是注射器向AD患者给药所述铝盐剂量,优选羟基氧化铝剂量。用于本发明的药物制剂可以以任意合适的形式提供。优选地,它们以储存稳定形式提供。可通过不同手段,例如灭菌、添加稳定剂、冷冻、冻干等确保储存稳定性。优选地,使用这些方法的组合以提高该制剂的储存稳定性。当铝盐试剂(例如羟基氧化铝)被冷冻或冻干时,可在处理过程中观察到佐剂颗粒的聚集。通过以更快的速率冷却该制剂,特别是羟基氧化铝(Alhydrogel)制剂或通过加入足量的玻璃形成赋形剂(glass forming excipient),例如海藻糖,可防止或最小化Alhydrogel的聚集。人们提出,缓冲盐的冷冻-浓缩引起这种铝试剂的表面化学和结晶度的改变,这又有利于聚集。该Alhydrogel颗粒的这些改变和所造成的聚集可通过选择缓冲离子而被排除或最小化,或通过在冷冻过程中快速形成玻璃态而被动力学抑制(参见例如Clausi等人,J Pharm Sci.2008Jun;97(6):2049-61)。
将应用于AD患者的本发明药物组合物于合适的容器中制造(和制成),并以如密封小瓶、安瓿、药筒、软袋(通常用多层塑料进行构造)、玻璃或聚丙烯瓶或优选注射器,尤其是预填充的(即用型或即重构型)注射器进行贩售。
根据本发明的优选实施方案,所述铝盐(优选羟基氧化铝)以至少1.8mg的量给药至AD患者。
被给药本发明所述铝盐制剂(优选羟基氧化铝制剂)的优选患者是早期AD患者,包括通常也被称为“具有轻度认知损伤(MCI)的患者”的那些患者。MCI的概念始于20世纪90年代以收集具有阿尔茨海默氏病(AD)的早期临床症状的患者,其尚未达到痴呆的标准。MCI的健忘变型特征如下:记忆力抱怨,优选由填报人认定;由于年龄的记忆损伤,其通过在一个或多个开发学习能力的神经心理学测试(例如,散文回忆、单词列表)中的低认知表现来指示;一般认知功能未受影响(例如,简易精神状态检查分数为24以上(满分30));完整的日常生活活动;和没有痴呆。具有遗忘型MCI的所有患者中大约有三分之二具有AD的病理特征并在5年内发展出阿尔茨海默痴呆的临床综合征,而剩余三分之一具有认知损伤的非进行性或极缓进展性原因(例如,抑郁症或年龄相关的认知损伤)。在2007年开发的针对AD的新的推荐诊断标准(Dubois等人,Lancet Neurol.6(2007),734-746)建议,如果所述患者对以下4种标记中的至少一种呈阳性,则可将该疾病认为处于MCI阶段:在MRI上的内侧颞叶萎缩;在18F-氟脱氧葡萄糖PET上的颞顶皮质代谢减退;脑脊液标记物(tau,淀粉样蛋白-β42或磷酸-tau)的异常;和在使用PET的淀粉样蛋白成像中阳性。该患者群不仅包括在根据本发明治疗的AD患者中,还是特别优选的本发明的治疗方法对其特别有效的患者群。这符合美国FDA所采用的针对AD临床试验所修订的标准(Aisen等人,2013;Kozauer等人,2013)。因此,优选治疗处于AD早期状态的患者,其通过相对高的MMSE(简易精神状态检查或Folstein检验)得分来确定。优选地,本发明所治疗的AD患者是MMSE得分为23至30(30为最高值),优选24至30,更优选25至29,特别是26至29的患者。其他优选的患者组是大于或等于27点(指示正常认知)、25至27(略低于正常认知)或19至24(轻度认知损伤)的患者。
早期AD患者也可通过其他评分进行选择,优选将认知和功能参数(和数值界限)结合以限制(被有效治疗)的AD群体的评分,例如ADAS-cog等。
本发明首次提供了改变病情的AD治疗。本发明治疗的有效性通过药品授权机构,特别是EMEA和US-FDA要求的参数证明。例如,针对AD治疗的EMEA指南要求反映认知和功能区域的主要终点。因此,组合(综合)评分被用于本发明的临床评估。这个综合评分结合两种已建立的评分,一种是针对认知功能(ADAS-cog(阿尔茨海默病评估量表-认知子量表))且一种是针对功能能力(ADCS-ADL(阿尔茨海默病协同研究-日常生活类活动))。适应性ADAS-cog组合了评估认知功能的项目。适应性ADCS-ADL包括对功能能力敏感的项目。认知技能预期在疾病开始时衰退而一个人执行基本功能的能力预期在该疾病后期衰退。组合的主要结果(本发明的综合评分)组合该适应性ADAS-cog和适应性ADCS-ADL以产生对认知和基本功能的衰退敏感的综合结果。使用以下等式获得组合的主要结果,即组合的综合评分:
本发明的组合的综合评分:
=1.67*单词回忆+1.35*定向能力+1.42*单词识别+0.55*回忆指令+0.81*口语+1.01*查找单词+5.42*ONB+0.15*VPAL+0.19*分类流畅性+0.28*所有物+0.35*购物+0.23*爱好+0.38*饮水+0.37*进食+0.23*新闻动态+0.26*TV+0.33*保持约会+0.37*旅行+0.33*独立生活(Alone)+0.35*使用器械+0.49*穿衣+0.36*阅读+0.62*打电话+0.33*书写
此外,通过本发明观察AD生物标记物,其是AD发展特有的。EMEA和FDA标准推荐新型技术,例如MRI,特别是内嗅区或(对-)海马体皮层的萎缩。在本发明中,应用PET(正电子发射断层摄影)-MRI。更具体地,本发明使用右侧海马体(对难以表达的材料的学习和记忆是至关重要的)的体积作为治疗成功的显著AD生物标记物。
根据本发明,可观察到AD治疗中的临床效应,其可通过与在AD患者中正常的衰退发展相比,认知和/或功能衰退(在约一年的治疗期内)降低至少30%(通过得分下降计算)、优选至少50%、特别是至少70%进行测量。优选地,认知和功能参数在治疗过程中基本上保持不变。这可通过本发明实现,尤其是在患有最早期疾病的患者中(如EMEA和FDA指导所建议和推荐的),例如MMSE为23或更高、优选24或更高、更优选25或更高、特别优选26或更高的AD患者。对于那些患者而言,在本发明治疗过程中的综合评分变化在18个月后仍在初始评分附近。这显著超过EMEA要求的“改变病情效果”的最低要求(“从监管的角度来看,如果通过认知和功能评估工具测量的疾病的进展降低或减缓并且如果这些结果与潜在的疾病过程影响有关,那么医学产品可被认为是改变病情”;“当药理学治疗延迟了潜在的病理学或病理生理学疾病的过程时且当其伴有痴呆病症的临床征兆和症状的改善时,将被认为是改变病情效果”)。
通过以下实施例和附图,但并不限于此,进一步解释了本发明。
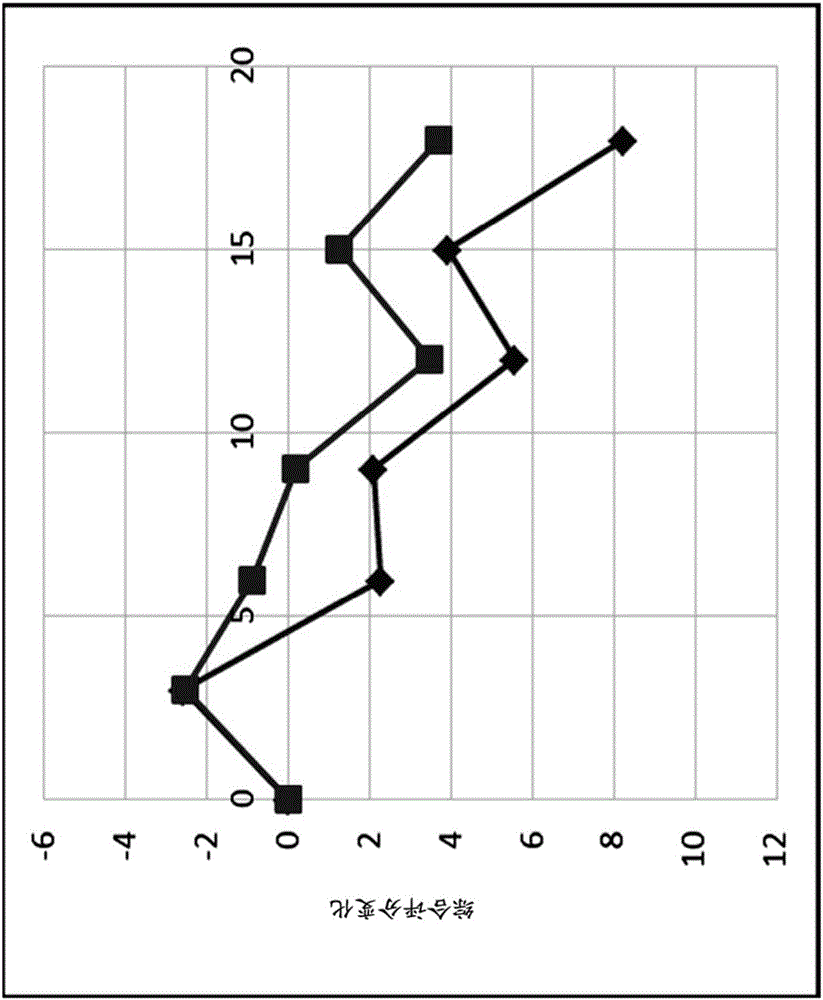
图1显示了就由所有已接受2mg和1mg羟基氧化铝治疗的患者的(部分)适应性ADL变化和适应性ADAS-cog变化组成的综合评分的变化而言,本发明的临床试验结果。
图2显示了两组患者的轻度群体比较(所述轻度群体是由基线MMSE评分为24以上所定义的)表明,该作用在早期疾病阶段的患者群体中最显著。
图3显示了在2mg和1mg铝组中明显的疾病进展减缓,其通过与历史对照相比,1mg和2mg羟基氧化铝组的适应性ADAS-cog(仅ADAS-cog项目;最小均方值)来证明(p-值:1mg vs.HC-ADNI,NS,HC:<0.0001;2mg vs.HC-ADNI,NS,HC:<0.0001)。
图4显示了针对轻度患者群体的2mg和1mg羟基氧化铝治疗组而言(所述轻度群体是由基线MMSE评分为24以上所定义的)的右海马体体积(以mm3计)的发展,表明该作用在早期疾病阶段的患者群体中最显著。
图5显示了针对看护者的生活质量-阿尔茨海默病(QOL-AD)。看护者完成了关于他们的患者的QOL的问卷的测试。该测试由13项组成,以4分等级评定,1为差和4为优秀。结果显示为随时间的变化,其使用混合模型的最小均方值。
图6显示了在Tg2576动物模型中测量的小鼠的免疫应答:以4周的时间间隔,向Tg2576-小鼠皮下注射6次含有30μg纯肽的结合疫苗、用明矾配制的KLH或仅注射明矾。所用的明矾剂量相当于2mg/ml。在处死时采集的血浆样品中测量疫苗诱导的Abs(SeqID 1(n=10),SeqID 2(n=8),KLH-明矾(n=10)和仅明矾(n=8))。分析样品以评估其对抗特异性肽IgG Abs的浓度。所描绘的值是以OD max/2(在405nm处)加上SEM计算的滴度。IgG对各免疫肽的响应(SeqID 1:抗SeqID 1;SeqID 2:抗SeqID 2;KLH-明矾:抗KLH;Alum:抗AD02);B)免疫后对人Aβ1-40/42的反应性。被SeqID 1(n=10)和SeqID 2(n=8)治疗的动物显示抗Aβ40/42反应性;被KLH-明矾和仅被明矾治疗的动物没有显示出超过背景的反应性。将该测试的背景设置为1/100,由在A+B中的黑线和星号表示。
图7显示了所测试的小鼠的记忆和学习:Tg2576小鼠组(n≤10/组)接受6次按月注射的KLH/ALUM(n=9)或SeqID 1-KLH-明矾(n=10)-、SeqID 2-KLH-明矾(n=7)-结合的疫苗或仅明矾(n=8)。将初始体重动物(n=20)用作关联性条件化恐惧(Contextual fear conditioning,CFC)的阳性对照。通过CFC-分析,使用在CFC测试结束时的不动时间%来评估关联性学习和记忆。所描绘的参数为在CFC测试范例的第二天的代表性2分钟时间段内动物99%不动的时间%。*..p<0.05;**..p<0.01。
图8显示了在所测试的动物中的淀粉样蛋白负载量:Tg2576小鼠组(n≤10/组)接受6次按月注射的KLH/ALUM(n=9)或SeqID 1(n=10)-、SeqID 2(n=7)-结合疫苗或仅明矾(n=8)。在所有制剂中的明矾剂量相当于2mg/ml。在第6次免疫后8周分离脑。淀粉样蛋白沉积物所覆盖的相对的总脑面积的定量(以所分析的总组织的%计)是基于免疫荧光染色,其使用Aβ特异性mAb3A5。显示了对照(A,C)和用SeqID 1-(B,D)免疫的小鼠的皮质(A,B)和齿状回(C,D)的代表性亚区。E)相比于KLH-明矾对照,SeqID 1-KLH明矾+SeqID 2-KLH明矾显著降低由淀粉样蛋白沉积物覆盖的相对面积(弥漫性和致密核心淀粉样蛋白;*..p<0.05,**..p<0.01)。在仅用明矾治疗vs.用KLH-明矾治疗的动物中可检测到Aβ沉积的轻微但不显著的减少。(ns)C中的箭头表示来自脑血管的非特异性荧光。比例尺:200μM;以10x倍放大倍数拍摄的照片。
实施例:
1.AD临床试验的摘录(AFF006;Eudract:2009-016504-22)
材料和方法:
支持本发明的数据源于早期AD患者的随机临床试验。该研究(AFF006;Eudract:2009-016504-22)将早期AD患者随机分成5个治疗组。2个研究组的患者接受1mg铝或2mg铝。总共有99名早期AD患者被纳入这2个研究组。给定患者的参与持续18个月。
研究设计:
AFF006作为随机、安慰剂对照、平行组、双盲、多中心的II期研究进行并在早期AD患者中评估临床和免疫活性以及重复皮下给药i.a.铝(不同剂量)的安全性和耐受性,如该方案中所定义的。其在共计6个国家中进行:奥地利、法国、德国、斯洛伐克、捷克共和国和克罗地亚。
临床试验包括10次常规门诊访问和6次电话探访。在开始治疗前最多四周,进行筛选访问(访问1)以确保患者适合该临床试验并建立患者的基线特征。筛选后,将合格的患者随机分配至治疗组。在第0周的随机化后,患者接受1或2mg铝的6次注射。注射由研究人员在第0、4、8、12、40和65周(访问2、3、4、5、7和9)进行皮下施用。
在访问2、3、4、5、6、7和9时,评估了对该疫苗的可能的局部和全身反应以及生命体征(血压、心率、呼吸速率和体温)。此外,进行了身体检查和神经系统检查。在访问1、2、3、5、6、7、8、9、10时评估了有效性参数。在最后一次给药研究药物(访问9)之后12周进行最终访问(访问10)。当患者停止该临床试验时,执行早期中止访问(early discontinuation visit,EDV)。
研究群体
该研究在早期AD患者中进行。诊断由以下标准定义:
-如NINCDS/ADRDA标准所定义的可能的阿尔茨海默病(1)
-MMSE评分≥20(2)
-自由和线索选择性回忆测试(FCSRT)结果为总回忆≤40或自由回忆≤17这一结果表明,海马体损伤损害患者的情景记忆(episodic memory)(3)
-患者大脑的中央读取MRI的结果必须与诊断AD一致,尤其是存在内侧颞叶萎缩(Scheltens评分≥2)(4)
应用其他入选/排除标准(例如,书面的知情同意书;年龄在50至80岁,用免疫抑制药物治疗(排除))。
研究药物的给药
在研究访问2、3、4、5、7和9过程中,所述患者通过研究人员接受研究药物,在65周的治疗期内总共进行6次注射。注射施加到上臂的外表面,在肘部上方大约8-10cm。对于确切位置的首要条件是存在完整的局部淋巴结点。如果两条上臂的引流淋巴结点均不完整,则在腹股沟淋巴结附近的大腿处进行注射。在整个6次注射中,使用两个交替注射部位(例如左和右上臂,左上臂和左大腿)。
将注射施加到皮下组织(皮下)。通过在每次注射前小心地呼吸进行特殊护理以避免鼻内施用。所有给药在实验部位进行。
基于体积的形态测定
在解剖MRI模板上描绘海马体(左和右)和整个侧脑室ROI,以产生用于体积测量的图谱。使用全自动方法确定每个受试者的海马体和侧脑室的体积,所述方法将从针对个体受试者扫描的图谱标记的非线性配准推导出的转换与受试者特异性图像信息组合(Collins等人,J.Comput.Assist.Tomogr.,18:192-205,1994)。对无法进行后处理QC检查的侧脑室和海马体分割(segmentation)进行手动校正。由在预处理过程中产生的脑mask来估计总颅内体积(TIV)并通过对各次访问中所估计的TIV取平均值来确定各受试者的平均TIV(TIVavg)。使用归一化因子(TIV模板/TIVavg_受试者)来标准化各受试者的海马体体积和室体积以弥补头部尺寸的差异。
安全性评估:
安全性评估包括以下:
-不良事件(AE)和严重的不良事件(SAE)(由于AE退出的患者数量;退出原因)
-实验室评估:血液学、生物化学、血凝、血清学、尿分析、APP交叉反应性
-生命体征(血压、心率、呼吸速率和体温)
-身体检查和神经系统检查
有效性评估:
主要的有效性变量是由适应性ADAS-cog所测量的认知的基线变化(CFB)、由适应性ADCS-ADL所测量的功能的CFB和由组合的综合结果所测量的认知和功能的CFB组合:
1.协同的主要疗效:适应性ADAS-cog;
2.协同的主要疗效:适应性ADCS-ADL;
3.组合的主要疗效结果:综合评分。
ADAS-cog和其他包括在所述适应性ADAS-cog中的项目在访问1、2、3、5、6、7、8、9和10时或在EDV时进行测量。ADCS-ADL在访问2、5、6、7、8、9和10时或在EDV时进行测量。对组合的主要疗效结果有贡献的项目在访问2、5、6、7、8、9和10时或在EDV时进行测量。
主要疗效结果均在0至100的范围。对于各适应量表和综合评分而言,较低的得分表示更好的表现。但是,在量表中所包括的一些项目可具有相反方向,即较高的得分表示更好的表现。在计算综合评分之前,将以相反方向记分的有贡献的项目反转。通过从该项目最大可能值减去观察值来反转该项目的得分。反转该项目的得分使得现在较低得分表示更好的表现。包括在适应性ADAS-cog和组合的综合评分中的以下项目需要反转得分:Verbal PAL、NTB分类流畅性和CogState ONB。
第二有效性结果:
生活质量(QOL)看护者
QOL看护者是一个简短的13项调查问卷,其旨在专门从看护者的角度获得患者的QOL评分等级。问题包括与朋友和家人的关系、财务问题、身体状况、情绪和生活质量的整体评估。所有项目的评分为四分制,1为差且4为优。总分为所有项目的总和,其范围可为13至52。QOL看护者值在此处作为基线变化来表示。结果在访问1、6、8和10测量。
统计分析
基线数据
使用人口统计信息和在筛选阶段(访问1)过程中记录的基线特征来描述受试者。
所评估的人口统计信息是年龄、性别、种族群体、吸烟习惯、教育水平、身高和体重。通过针对安全性、ITT和每个方案群体的治疗来总结受试者人口统计数据。
主要疗效分析
通过比较各组之间随时间的变化来分析主要、次要和探索性疗效结果。所述疗效分析采用下述混合模型。所述混合模型分析比较了在每次访问的所有疗效结果中3个疫苗组和2个铝组之间的估计的基线变化。分别重复使用的模型测量各疗效终点的纵向模型。该分析评估了在治疗组之间是否存在估计的CFB值的差异。
使用SAS·PROC MIXED以拟合具有重复测量的混合模型(MMRM),其中每个疗效结果(例如,适应性ADAS-cog)的CFB作为反应变量,还具有以下协变量和固定效应:
年龄(协变量);
教育水平(固定效应分为≤12年,>12年);
性别(固定效应);
疗效参数的基线测试分数(协变量);
中心(固定效应);
治疗(固定效应);
APOEe4状态(固定效应,阳性或阴性);
使用AChE抑制剂(固定效应,由药物确定);
时间(协变量,时间将根据访问来确定);
治疗相互作用的时间(时间*治疗);
该模型的协方差结构是一阶异质自回归(ARH[1])。在该研究的每次访问中评估最小均方值。在特定访问时的LS平均值被解释为在施用具体治疗的时间点(访问)时疗效结果中的预期CFB。在各访问时由混合模型估计最小均方值和标准误差并针对不同组进行显示。
适应性ADAS-cog结合评估认知功能的项目。所述适应性ADCS-ADL包括对功能性能力敏感的项目。认知技能预期在该疾病开始时衰退且一个人执行基本功能的能力预期在该疾病的后期衰退。组合的主要结果(在本文中称为“综合评分”)将适应性ADAS-cog和适应性ADCS-ADL组合以产生对认知和基本功能衰退敏感的综合评分。以下等式被用于得出组合的主要结果,即组合的综合评分:
组合的综合评分:
=1.67*单词回忆+1.35*定向能力+1.42*单词识别+0.55*回忆指令+0.81*口语+1.01*单词查找+5.42*ONB+0.15*VPAL+0.19*分类流畅性+0.28*所有物+0.35*购物+0.23*爱好+0.38*饮水+0.37*进食+0.23*新闻动态+0.26*TV+0.33*持续约会+0.37*旅行+0.33*独立生活+0.35*使用器械+0.49*穿衣+0.36*阅读+0.62*打电话+0.33*书写
各项目对组合的综合评分的贡献百分比可见于下表1中:
结果
AFF006基于人口统计数据(表2)以及显示研究组的基线特征的数据(表3)招募了早期AD患者的研究群体。
局部反应的频率和强度取决于给药的铝剂量(表4)。这种局部反应(LR)用作先天免疫应答激活的量度。
就通知疾病进展的参数而言,2mg铝组甚至优于1mg铝组(其他组)(图1和5)。两组轻度患者群体的比较表明,这种效果在早期疾病阶段的患者群体中最显著(图2)。在18个月中疾病进展的减缓在2mg铝组中特别明显,如适应性ADAS-cog所举例说明的那样(图3)。
将获得的结果与公共数据集进行比较。经鉴定的历史数据集是ADNI 1轻度AD组(观察性研究)、来自ADCS高半胱氨酸试验的轻度安慰剂患者(HC,MMSE>=20)和来自罗非昔布和萘普生的ADCS NSAID研究的安慰剂组(NS,MMSE>=20)。将这3个组组合以得到历史对照(HC-ADNI,NS;HC)。数据点在第6个月可获自344名患者,在第12个月可获自317名患者和在第18个月可获自226名患者。所述ADNI试验仅在第6、12和24个月进行评估,因此18个月的值是用直线估算的。所述NS研究只有12个月,因此没有18个月的数据可用于该研究。
尽管适应性的ADAS-cog使用了来自ADAS-cog的一些项目,所述ADAS-cog补充有NTB和CogState Battery的项目,但是并非所有的历史研究都具有这些项目。因此,创造了适应性的ADAS-cog 2,其使用了与所述ADAS-cog项目的适应性ADAS-cog相同权重,但不包含所述NTB和CogState项目(1.67*单词回忆+1.35*定向能力+1.42*单词识别+0.55*回忆指令+0.81*口语+1.01*单词查找)。
与来自AFF006研究的1和2mg羟基氧化铝治疗组相比,所述适应性ADAS-cog2在历史对照组中显示出更显著的衰退(图3)。p-值为:1mg vs.HC-ADNI,NS,HC:<0.0001;2mg vs.HC-ADNI,NS,HC:<0.0001。
此外,所述MRI数据显示了对于2mg患者组具有统计学显著的改变病情效果和海马体体积与临床终点的关联,例如右海马体具有adapADAS:p=0.0006或综合评分:p=0.0095)(图4)。必须特别提及的是,本研究已首次提供了具有放射性生物标记物(在本案中的MRI))的临床数据的平行研发。
图4显示,根据本发明所治疗的患者在18个月的时间期内几乎没有显示出任何与AD相关的海马体体积的减少而AD患者每年脑萎缩的速率为每年3至6%的范围(Risacher等人,2013,表2);健康老年个体的比率通常在0.5至2.2的范围(也参见Risacher等人的表2)。
图5显示,相比于1mg明矾和其他组(未显示)而言,根据本发明治疗的患者的看护者将施用2mg后18个月的时间的患者的QOL评定为显著改善。
表2:患者人数和情况
表3:人口统计数据–种族、性别、教育、年龄
表4:局部反应的不良事件总结
2.两种Aβ靶向疫苗SeqID 1-KLH-明矾和SeqID 2-KLH-明矾相比于KLH-明矾和仅明矾的免疫原性
SeqID:
SeqID 1:SWEFRTC
SeqID 2:SEFKHGC
动物实验:
所有动物实验是根据奥地利动物实验法案(TVG2012),使用Tg2576-小鼠(Taconic Farms,USA;129S6/SvEvTac)进行的。一般健康由改良的Smith Kline Beecham,Harwell,Imperial College,Royal London Hospital,表型评估(SHIRPA)最初观察筛选来检查(Rogers DC等人(1999)Behav Brain Res 105:207-217.)。以按月时间间隔向小鼠皮下注射6次。以定期的时间间隔采集血液,制备血浆并储存直至进一步使用。研究结束时将小鼠处死,收集脑并分离半球。将一个半球固定在4%多聚甲醛中(PFA,Sigma Aldrich,USA),脱水并石蜡包埋。使用滑动切片机(Leitz,德国)将脑组织切成7μM并将切片装在Superfrost Plus载玻片上(Menzel,德国)。
ELISA的滴定测定:
标准酶联免疫吸附测试(ELISA)技术被用于测量血浆中疫苗诱导的抗体和CSF的水平(Mandler M等人(2012)J Alzheimers Dis 28:783-794.)。所用底物包括人(BACHEM,CH)Aβ1-40/42(在5μg/ml)、KLH(1μg/ml)和肽-牛血清白蛋白(BSA)结合物(SeqID 1和SeqID 2,1μM)。使用微孔读取器(Tecan,CH)测量在405nm处的光密度(OD)。计算ODmax/2。
行为测试:
为了分析认知功能障碍,将免疫的Tg2576动物进行关联性条件化恐惧(CFC,Comery TA等人(2005)J Neurosci 25:8898-8902.),使用AnyMaze软件(Stoelting Co,USA)分析。对于CFC,在第1天将小鼠置于调理室(AFFiRiS AG,奥地利),使其适应2分钟并以2分钟的时间间隔加上30秒休息接受3次0.8mA的足部电击。为了评估在第2天的关联性学习,使动物重新入室并监测5min,选择s120-240作为分析的时限(不动的时间=除呼吸外无活动)。在第1天的前两分钟被认为是不动的基线,将其从第2天的值中减去。
脑Aβ的分析:
如之前所述进行免疫荧光(IF)分析(Mandler M等人(2012)J Alzheimers Dis 28:783-794)。对于Aβ-特异性IF-染色,使用mAb 3A5(AFFiRiS AG,奥地利)处理免疫Tg2576的脑切片以用于分析淀粉样蛋白负载量。使用的所有第二试剂均获自Vector Labs(USA)。对于IF,使用含DAPI的VECTASHIELD-HardSet封片剂将切片封片并复染色。使用MIRAX-SCAN(Carl Zeiss AG,德国)检查切片。使用半自动区域识别程序(eDefiniens Architect XD;www.definiens.com,Mandler M.等人(2015)PLoS ONE 10(1):e0115237.),通过确定被淀粉样蛋白沉积物所占据的相对脑面积来评估动物中的AD-样病状。为了分析,评估三个载玻片/动物和≤五个单独的切片/载玻片。排除携带组织伪差或异常染色的切片。为了评估Aβ-阳性血管的数量,已经分析了3A5染色的切片(3个覆盖皮质和海马体的载玻片/动物以及每个载玻片最多5个单独的切片)。在皮质和海马体的亚区域手动计数Aβ-阳性血管。测量每平方毫米阳性血管的数目。
参考文献:
Rogers等人,Behav Brain Res 105(1999):207-217.
Mandler等人,PLoS ONE 10(1)(2015):e0115237。doi:10.1371/journal.pone.0115237.
Mandler等人,J Alzheimers Dis 28:783-794.
Comery等人,J Neurosci 25(2005):8898-8902.
结果:
为了测试两种Aβ靶向疫苗SeqID 1-KLH-明矾和SeqID 2-KLH明矾相比于KLH-明矾和仅明矾(羟基氧化铝)的免疫原性,以4周的时间间隔向Tg2576-小鼠皮下注射6次含有30μg纯肽的结合疫苗、等剂量的配以明矾的KLH或仅明矾。所用的明矾剂量等于2mg/ml。测量在处死时采集的血浆样品中的疫苗注射诱导的Abs(SeqID 1(n=10),SeqID 2(n=8),KLH-明矾(n=10)和仅明矾(n=8))。这3种疫苗均产生针对用于免疫的肽的强烈且相当的IgG滴度(图6A)。仅明矾没有产生高于背景的信号(图6A)。这两种Aβ靶向疫苗,SeqID 1-KLH-明矾和SeqID 2-KLH-明矾,均产生针对人Aβ的Abs而KLH-明矾疫苗和仅明矾在所治疗的动物中并没有产生高于背景的信号(图6B)。
为了评估仅羟基氧化铝(明矾)相比于Aβ靶向疫苗(SeqID 1-+SeqID2-KLH-明矾)和非Aβ特异性疫苗(KLH-明矾)对认知功能的作用,我们应用关联性条件化恐惧(CFC),以分析在Tg2576-小鼠中的关联性记忆和学习。如所预期的,在这个Aβ沉积物的该AD模型中,CFC证明SeqID 1-和SeqID 2-治疗的小鼠优于接受KLH-明矾的对照动物(因此不产生Aβ特异性免疫应答)(图7)。有趣的是,仅接受明矾的动物(没有分别针对KLH或Aβ产生主动免疫应答的结合物)显示出与不存在Aβ-特异性抗体的AD模型中用Aβ靶向疫苗可检测到的类似的效果。
为了测试是否明矾也将显著影响脑淀粉样蛋白负载量,随后将14个月大的处于CFC中的动物处死。通过IF-染色,使用单克隆抗体3A5评估它们脑的弥漫性和致密核心斑块。大量淀粉样蛋白斑块覆盖注射KLH/ALUM的对照的皮质以及海马体切片(图8A+C)。相比之下,SeqID 1-和SeqID 2-免疫的Tg2576-小鼠的各脑区域含有显著更少的沉积物(图8B+D和E,p<0.05和数据未显示)。重要的是,在该AD模型中,仅用明矾治疗的Tg2576动物相比于用KLH-明矾治疗的动物不会显著改变淀粉样蛋白沉积(图8E)。
因此,图7和8还公开,局部施用的羟基氧化铝能够在阿尔茨海默病的APP-转基因模型(Tg2576)中显著降低认知衰退而不会显著改变脑的Aβ水平。这意指在该AD模型中由羟基氧化铝产生的有益功能效应背后存在APP/Aβ独立机制并进一步证明“淀粉样蛋白通道假说”缺乏科学可信性。
因此,本发明公开了以下各优选的实施方案:
1.用于治疗和预防与β-淀粉样蛋白沉积相关的痴呆、优选阿尔茨海默病(AD)的铝盐。
2.根据实施方案1的铝盐,其中所述铝盐具有通式Mea+Alb3+Anc-·nH2O,其中
Me+为Na+、K+、Li+、Rb+、Cs+或NH4+;
An为PO43-、SO42-、O(OH)3-、O2-或OH-;
a为0、1、2或3;
b为1或2;
c为1、2、3、4、5或6;和
n为0至48。
3.根据实施方案1或2的铝盐,其中所述铝盐选自氢氧化铝、羟基氧化铝、磷酸铝或硫酸铝。
4.实施方案1-3中任一项的铝盐以即用型直接施用于患者,特别是在预填充的注射器中给药。
5.实施方案1-4中任一项的铝盐,其包含在药物制剂中。
6.实施方案1-5中任一项的铝盐,其包含在药物制剂中,其中所述制剂包含铝盐作为单一有效成分。
7.实施方案1-6中任一项的铝盐,其包含在药物制剂中,其中所述制剂包含辅助物质,尤其是稳定剂、洗涤剂、抗氧化剂、用于一价或二价金属离子的络合剂、碳水化合物和/或缓冲物质。
8.实施方案1-7中任一项的铝盐,其包含在药物制剂中,其中所述制剂是无菌的且任选地为液体的、冷冻的或冻干的,优选液体的。
9.实施方案1-8中任一项的铝盐,其包含在药物制剂中,其中所述制剂是液体和具有5至9的pH,优选5.5至8.0,特别是6至7.5。
10.实施方案1-9中任一项的铝盐,其中所述铝盐作为单一有效成分(活性物质)存在于药物中。
11.实施方案1-10中任一项的铝盐,其中所述铝盐是羟基氧化铝混悬液,优选欧洲药典级羟基氧化铝(专著1664),特别是Alhydrogel。
12.实施方案1-11中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少1.2mg(以Al2O3的当量给出)的量给药至AD患者。
13.实施方案1-12中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以1.2mg至5.0mg(以Al2O3的当量给出)的量给药至AD患者。
14.实施方案1-13中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少1.5mg(以Al2O3的当量给出)的量给药至AD患者。
15.实施方案1-14中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以1.5mg至5.0mg、优选1.5至3.0mg、特别是1.5至2.5mg(以Al2O3的当量给出)的量给药至AD患者。
16.实施方案1-15中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以1.6mg至2.5mg、优选1.8至2.2mg、特别是1.9至2.0mg(以Al2O3的当量给出)的量给药至AD患者。
17.实施方案1-16中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)还含有一种或多种稳定剂(特别是硫柳汞)、洗涤剂、抗氧化剂、用于一价或二价金属离子的络合剂(特别是乙二胺四乙酸(EDTA))、糖、糖醇、甘油和/或缓冲物质(特别是TRIS或磷酸盐缓冲物质)。
18.实施方案1-17中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以pH为4至10、优选5至9、更优选6至8、特别是7.0至7.5的混悬液给药至患者。
19.实施方案1-18中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以等渗混悬液给药至患者。
20.实施方案1-19中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以皮下、结节内、皮内或肌内(特别是皮下给药)至AD患者。
21.实施方案1-20中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少每月一次给药至AD患者,持续至少2个月。
22.实施方案1-21中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少每月一次给药至AD患者,持续至少6个月。
23.实施方案1-22中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少每月两次给药至AD患者,持续至少6个月,优选至少12个月,特别是至少24个月。
24.实施方案1-23中任一项的铝盐,其中将所述铝盐(优选羟基氧化铝)皮下给药至AD患者的上臂,优选左上臂和右上臂交替给药。
25.实施方案1-24中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以分次剂量给药至AD患者,特别是在相同的给药部位。
26.实施方案1-25中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以0.8至5.0mg、优选1.0至3.0、特别是1.0至1.5mg(以Al2O3的当量给出)的分次剂量给药至AD患者。
27.实施方案1-26中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少每月一次给药至AD患者,持续至少2年,优选至少4年,特别是至少8年。
28.实施方案1-27中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)通过注射装置(特别是注射器)给药至AD患者。
29.实施方案1-28中任一项的铝盐,其中所述铝盐(优选羟基氧化铝)以至少1.8mg(以Al2O3的当量给出)的量给药至AD患者。
30.实施方案1-29中任一项的铝盐,其中所述铝盐优选为羟基氧化铝并以液体形式给药至AD患者,其施用体积为0.1至10ml,优选0.2至5ml,特别是0.4至3ml。
31.实施方案1-30中任一项的铝盐,其包含在药物制剂中,其中所述制剂没有硫酸根、硝酸根或氯阴离子。
32.实施方案1-31中任一项的铝盐,其包含在药物制剂中,其中所述制剂具有不到20ppm的重金属含量。
33.实施方案1-32中任一项的铝盐,其包含在药物制剂中,其中所述制剂为羟基氧化铝的混悬液且具有2μm至约10μm的粒度分布,所述颗粒为由优选约2nm x 4.5nm x 10nm的较小纤维组成的聚集体。
- 还没有人留言评论。精彩留言会获得点赞!