抗流感病毒剂及抗流感病毒剂的筛选方法与流程
本发明涉及一种将以人为代表的宿主细胞的生物分子作为靶标的抗流感病毒剂、以及对该抗流感病毒剂的候选分子进行筛选的方法。本申请基于2014年9月22日提出的日本申请特愿2014-192752号要求优先权,在此援引其内容。
背景技术:
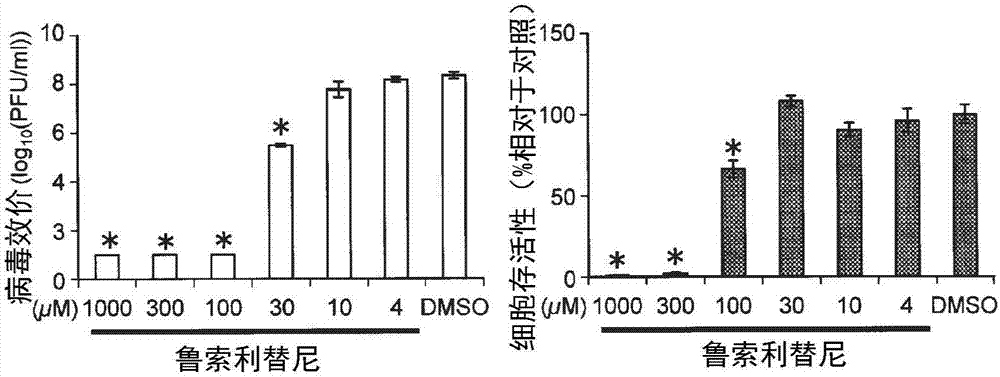
:流感病毒每年都引发疫病,有时会引发导致几百万人伤亡的大流行流感(pandemic)。因此,要求开发更有效的抗流感病毒剂。作为抗流感病毒剂的靶分子,优选相比于病毒蛋白质,有助于病毒的感染、复制的宿主细胞的生物分子。这是因为,对宿主细胞的生物分子而言,相比于病毒蛋白,难以产生因药剂的选择压力而导致的变异。近年来,通过6个全基因组筛选,鉴定了被认为在流感病毒的生命周期中发挥着某种作用的总计为1449个人类基因(包含110个果蝇(drosophila)基因的人类同源基因。)(参见非专利文献1~6。)。各全基因组筛选的结果分别是仅有一部分一致,但推测是因为实验条件不同而造成的。现有技术文献非专利文献非专利文献1:brass,etal.,cell,2009,vol.139,p.1243~1254;非专利文献2:hao,etal.,nature,2008,vol.454,p.890~893;非专利文献3:karlas,etal.,nature,2010,vol.463,p.818~822;非专利文献4:konig,etal.,nature,2010,vol.463,p.813~817;非专利文献5:shapira,etal.,cell,2009,vol.139,p.1255~1267;非专利文献6:sui,etal.,virology,2009,vol.387,p.473~481;非专利文献7:neumann,etal.,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,1999,vol.96,p.9345~9350;非专利文献8:tobita,etal.,medicalmicrobiologyandimmunology,1975,vol.162,p.9~14;非专利文献9:ozawaetal.,journalofgeneralvirology,2011,vol.92,p.2879~2888;非专利文献10:octavianietal.,journalofvirology,2010,vol.84,p.10918~10922;非专利文献11:kawakamietal.,journalofvirologicalmethods,2011,vol.173,p.1~6;非专利文献12:wishartetal.,nucleicacidsresearch,2006,vol.34,p.d668~672;非专利文献13:pattersonetal.,journalofgeneralvirology,1979,vol.43,p.223~229;非专利文献14:widjajaetal.,journalofvirology,2010,vol.84,p.9625~9631;非专利文献15:nodaetal.,nature,2006,vol.439,p.490~492。技术实现要素:发明所要解决的问题通过几个全基因组筛选,与流感病毒的复制等有关的宿主细胞的蛋白质被确定。然而,这些蛋白质如何影响流感感染症还尚未明确,是否能成为新的抗流感病毒剂的候选分子还不明确。本发明的主要目的在于提供一种抗流感病毒剂,该抗流感病毒剂以作为以人为代表的宿主细胞内的生物分子的、参与流感病毒的生命周期的蛋白质为靶标,本发明的目的还在于提供一种新的抗流感病毒剂的候选分子的筛选方法。解决问题的技术方案本发明人等进行了精心的研究,其结果是,通过利用来自人胚肾的hek293细胞的细胞溶解液的免疫沉降法,对与流感病毒蛋白质具有相互作用的1292个人类蛋白质进行确定,然后,利用rna干涉,从这些人类蛋白质中,确定出抑制其表达量时不会显著损害宿主细胞的增殖性、而使流感病毒的增殖被显著抑制的蛋白质,从而完成了本发明。即,本发明的抗流感病毒剂以及抗流感病毒剂的筛选方法为下述[1]~[10]。[1]一种抗流感病毒剂,其特征在于,具有抑制对蛋白质进行编码的基因的表达的作用、或者抑制所述蛋白质的功能的作用,所述蛋白质参与宿主细胞内的流感病毒的vrna或np蛋白质向流感病毒样颗粒中的进入,所述基因是选自由jak1基因、cherp基因、ddx21基因、dnajc11基因、eef1a2基因、hnrnpk基因、itm2b基因、mrcl3基因、myh10基因、ndufs8基因、psmd13基因、rpl26基因、sdf2l1基因、sdf4基因、sfrs2b基因、snrpc基因、sqstm1基因、taf15基因、tomm40基因、trm2b基因、usp9x基因、basp1基因、thoc2基因、ppp6c基因、tesc基因以及pcdhb12基因所组成的组中的一种以上。[2]如所述[1]中的抗流感病毒剂,所述基因为jak1基因或usp9x基因。[3]如所述[1]中的抗流感病毒剂,所述抗流感病毒剂是选自由鲁索利替尼(ruxolitinib)、托法替尼(tofacitinib)、托法替尼(tofacitinib)(cp-690550)柠檬酸盐(citrate)、酪氨酸磷酸化抑制剂(tyrphostin)b42(ag-490)、巴瑞克替尼(baricitinib)(ly3009104、incb028050)、at9283、莫米洛替尼(momelotinib)、cep33779、nvp-bsk805、zm39923、非哥替尼(filgotinib)、janex-1、nvp-bsk805、sb1317以及wp1130所组成的组中的一种以上。[4]一种抗流感病毒剂,其特征在于,具有抑制对蛋白质进行编码的基因的表达的作用、或者抑制所述蛋白质的功能的作用,所述蛋白质参与宿主细胞内的流感病毒的复制或转录,所述基因是选自由ccdc56基因、cltc基因、cyc1基因、nibp基因、zc3h15基因、c14orf173基因、anp32b基因、bag3基因、brd8基因、ccdc135基因、ddx55基因、dpm3基因、eef2基因、igf2bp2基因、krt14基因以及s100a4基因所组成的组中的一种以上。[5]一种抗流感病毒剂,其特征在于,具有抑制对蛋白质进行编码的基因的表达的作用、或者抑制所述蛋白质的功能的作用,所述蛋白质参与宿主细胞内的流感病毒样颗粒的形成,所述基因是选自由gbf1基因、ascc3l1基因、brd8基因、c19orf43基因、ddx55基因、dkfzp564k142基因、dpm3基因、eef2基因、fam73b基因、flj20303基因、ncln基因、c14orf173基因、lrpprc基因以及rcn1基因所组成的组中的一种以上。[6]如所述[5]中的抗流感病毒剂,所述基因为gbf1基因。[7]如所述[5]中的抗流感病毒剂,所述抗流感病毒剂为golgicidea。[8]一种抗流感病毒剂的筛选方法,其是对抗流感病毒剂的候选化合物进行筛选的方法,其特征在于,将对选自由jak1基因、cherp基因、ddx21基因、dnajc11基因、eef1a2基因、hnrnpk基因、itm2b基因、mrcl3基因、myh10基因、ndufs8基因、psmd13基因、rpl26基因、sdf2l1基因、sdf4基因、sfrs2b基因、snrpc基因、sqstm1基因、taf15基因、tomm40基因、trm2b基因、usp9x基因、basp1基因、thoc2基因、ppp6c基因、tesc基因、pcdhb12基因、ccdc56基因、cltc基因、cyc1基因、nibp基因、zc3h15基因、c14orf173基因、anp32b基因、bag3基因、brd8基因、ccdc135基因、ddx55基因、dpm3基因、eef2基因、igf2bp2基因、krt14基因、s100a4基因、gbf1基因、ascc3l1基因、c19orf43基因、dkfzp564k142基因、fam73b基因、flj20303基因、ncln基因、lrpprc基因以及rcn1基因所组成的组中的一种以上的基因的表达或所述基因所编码的蛋白质的功能具有抑制或阻断能力的化合物作为抗流感病毒剂的候选化合物来进行筛选。[9]如所述[8]中的抗流感病毒剂的筛选方法,包括:导入工序,在细胞中导入作为评价是否为抗流感病毒剂的候选化合物的对象的化合物;测定工序,对导入了所述化合物的细胞中的所述基因的表达量进行测定;选择工序,在所述基因的表达量与导入所述化合物前的细胞相比明显下降的情况下,选择该化合物作为抗流感病毒剂的候选化合物。[10]如所述[8]中的抗流感病毒剂的筛选方法,所述基因所编码的蛋白质是酶,所述筛选方法包括:测定工序,在作为评价是否为抗流感病毒剂的候选化合物的对象的化合物的存在下,对所述基因所编码的蛋白质的酶活性进行测定;选择工序,在所述化合物的存在下的所述蛋白质的酶活性与未存在所述化合物时相比下降时,选择该化合物作为抗流感病毒剂的候选化合物。发明效果本发明的抗流感病毒剂不是构成流感病毒的物质,而是以宿主细胞的蛋白质为靶标,因此,具有难以产生因药剂的选择压力而导致的变异的优点。另外,本发明的抗流感病毒剂的筛选方法能够筛选出以参与流感病毒的感染、复制的宿主细胞的蛋白质为靶标的抗流感病毒剂的候选分子,因此,适用于新的抗流感病毒剂的设计和制造。附图说明图1是表示在实施例2中用golgicidea处理的细胞的病毒效价(log10(pfu/ml))与细胞存活率(%)的测定结果的图。图2是表示在实施例2中用鲁索利替尼处理的细胞的病毒效价(log10(pfu/ml))与细胞存活率(%)的测定结果的图。图3是实施例3中的导入了对照sirna的细胞(上方)、以及导入了jak1基因的sirna的细胞(下方)的电子显微镜照片。具体实施方式<抗流感病毒剂>本发明的抗流感病毒剂是与流感病毒蛋白质进行相互作用的宿主细胞蛋白质,具有抑制对下述蛋白质进行编码的基因(以下,有时称作“抗flu基因”。)的表达的作用、或者抑制该蛋白质的功能的作用,所述蛋白质在宿主细胞内的表达被抑制的情况下不会过度损害宿主细胞的增殖性,而流感病毒的复制被抑制。作为抗flu基因,具体而言,可举出jak1基因、cherp基因、ddx21基因、dnajc11基因、eef1a2基因、hnrnpk基因、itm2b基因、mrcl3基因、myh10基因、ndufs8基因、psmd13基因、rpl26基因、sdf2l1基因、sdf4基因、sfrs2b基因、snrpc基因、sqstm1基因、taf15基因、tomm40基因、trm2b基因、usp9x基因、basp1基因、thoc2基因、ppp6c基因、tesc基因、pcdhb12基因、ccdc56基因、cltc基因、cyc1基因、nibp基因、zc3h15基因、c14orf173基因、anp32b基因、bag3基因、brd8基因、ccdc135基因、ddx55基因、dpm3基因、eef2基因、igf2bp2基因、krt14基因、s100a4基因、ascc3l1基因、c19orf43基因、dkfzp564k142基因、fam73b基因、flj20303基因、gbf1基因、ncln基因、lrpprc基因或rcn1基因。如后述实施例所示,这些抗flu基因所编码的蛋白质是与11种流感病毒蛋白质(pb2、pb1、pa、ha、np、na、m1、m2、ns1、ns2以及pb1-f2)直接或间接结合的蛋白质,两者的相互作用在流感病毒的生命周期中发挥重要作用。在本发明的抗flu基因中,jak1基因、cherp基因、ddx21基因、dnajc11基因、eef1a2基因、hnrnpk基因、itm2b基因、mrcl3基因、myh10基因、ndufs8基因、psmd13基因、rpl26基因、sdf2l1基因、sdf4基因、sfrs2b基因、snrpc基因、sqstm1基因、taf15基因、tomm40基因、trm2b基因、usp9x基因、basp1基因、thoc2基因、ppp6c基因、tesc基因以及pcdhb12基因是对参与宿主细胞内的流感病毒的vrna或np蛋白质向流感病毒样颗粒中进入的蛋白质进行编码的基因。因此,通过将具有抑制所述基因的表达的作用、或者具有抑制所述基因所编码的蛋白质的功能的作用的物质给药宿主细胞中,从而在宿主细胞内抑制vrna或np蛋白质进入流感病毒样颗粒中,其结果,发挥抗流感病毒效果(流感病毒的复制阻断效果)。在本发明的抗flu基因中,ccdc56基因、cltc基因、cyc1基因、nibp基因、zc3h15基因、c14orf173基因、anp32b基因、bag3基因、brd8基因、ccdc135基因、ddx55基因、dpm3基因、eef2基因、igf2bp2基因、krt14基因以及s100a4基因对参与宿主细胞内的流感病毒的复制或转录的蛋白质进行编码。因此,通过将具有抑制所述基因的表达的作用、或者抑制所述基因所编码的蛋白质的功能的作用的物质给药宿主细胞,从而在宿主细胞内使流感病毒的复制或转录被抑制,其结果,发挥出抗流感病毒效果。本发明的抗flu基因中,ascc3l1基因、brd8基因、c19orf43基因、ddx55基因、dkfzp564k142基因、dpm3基因、eef2基因、fam73b基因、flj20303基因、gbf1基因、ncln基因、c14orf173基因、lrpprc基因以及rcn1基因对参与宿主细胞内的流感病毒样颗粒的形成的蛋白质进行编码。因此,通过将具有抑制所述基因的表达的作用、或者具有抑制所述基因所编码的蛋白质的功能的作用的物质给药宿主细胞,从而在宿主细胞内使流感病毒样颗粒的形成被抑制,其结果,发挥出抗流感病毒效果。作为本发明的抗流感病毒剂,可举出以具有抑制本发明的抗flu基因的表达的作用的物质为有效成分的药剂。作为具有抑制抗flu基因的表达的作用的物质,例如,可举出具有由抗flu基因的cdna的部分区域(rnai(rna干涉)靶区域)的正义链与反义链构成的双链结构的sirna(小干扰rna(smallinterferingrna))、shrna(短发夹rna(shorthairpinrna))或mirna(小分子rna(microrna))。另外,宿主细胞内,可以是能够使sirna等产生的rnai诱导载体。对sirna、shrna、mirna以及rnai诱导载体的制备而言,其能够根据作为靶标的抗flu基因的cdna的碱基序列信息,通过常规方法来设计制备。另外,rnai诱导载体也能够通过在市售的各种rnai载体的碱基序列中插入rnai靶区域的碱基序列来制备。作为本发明的抗流感病毒剂,可举出以下述物质为有效成分的药剂,该物质具有抑制本发明的抗flu基因所编码的蛋白质的功能(以下,有时简称为“本发明的抗flu基因的功能”。)的作用。作为具有抑制抗flu基因的功能的作用的物质,可举出如针对本发明的抗flu基因所编码的蛋白质(以下,有时简称为“本发明的抗flu蛋白质”。)的抗体那样的、通过与本发明的抗flu蛋白质结合而抑制该蛋白质的功能的物质。作为该抗体,可以是单克隆抗体,也可以是多克隆抗体。另外,还可以是嵌合抗体、单链抗体、人源化抗体等人工合成的抗体。这些抗体能够通过常规方法进行制造。本发明的抗flu蛋白质是酶时,作为具有抑制抗flu基因的功能的作用的物质,可以是针对该酶的阻断剂。作为本发明的抗流感病毒剂,可以是具有抑制一种抗flu基因的表达、功能的作用的抗流感病毒剂,也可以是具有抑制两种以上的抗flu基因的表达、功能的作用的抗流感病毒剂。作为本发明的抗流感病毒剂,优选具有抑制选自由jak1基因、gbf1基因以及usp9x基因所组成的组中的一种以上的抗flu基因的表达、功能的作用的抗流感病毒剂,更优选具有抑制选自由jak1基因及gbf1基因所组成的组中的一种以上的抗flu基因的表达、功能的作用的抗流感病毒剂,进一步优选具有抑制jak1基因的表达、功能的作用的抗流感病毒剂。作为具有抑制jak1基因的功能的作用的物质,可举出鲁索利替尼(casno.:941678-49-5)、托法替尼(casno.:477600-75-2)等jak阻断剂。鲁索利替尼获准用作骨髓纤维化症的治疗药,托法替尼获准用作风湿药,对人体而言,它们是能相对安全地使用的物质。另外,作为具有抑制gbf1基因的功能的作用的物质,可举出golgicidea(casno.:1005036-73-6)。对golgicidea而言,通过适当地设定给药浓度,能够抑制流感病毒的增殖,而不会影响宿主细胞的增殖。除此以外,托法替尼(cp-690550)柠檬酸盐(3-((3r,4r)-4-甲基-3-(甲基(7h-吡咯并[2,3-d]嘧啶-4-基)氨基)哌啶-1-基)-3-氧代丙腈)、酪氨酸磷酸化抑制剂b42(ag-490)((e)-n-苄基-2-氰基-3-(3,4-二羟基苯基)丙烯酰胺)、巴瑞克替尼(ly3009104,incb028050)(2-[1-乙基磺酰基-3-[4-(7h-吡咯并[2,3-d]嘧啶-4-基)吡唑-1-基]氮杂环丁烷-3-基]乙腈)、at9283(1-环丙基-3-(3-(5-(吗啉甲基)-1h-苯并[d]咪唑-2-基)-1h-吡唑-4-基)脲)、莫米洛替尼(cyt387)(n-(氰基甲基)-4-(2-(4-吗啉基苯基氨基)嘧啶-4-基)苯甲酰胺)、cep33779([1,2,4]三唑并[1,5-a]吡啶-2-胺,n-[3-(4-甲基-1-哌嗪基)苯基]-8-[4-(甲基磺酰基)苯基]-)、nvp-bsk805(8-(3,5-二氟代-4-(吗啉代甲基)苯基)-2-(1-(哌啶-4-基)-1h-吡唑-4-基)喹喔啉)、zm39923(1-丙酮,3-[(1-甲基乙基)(苯甲基)氨基]-1-(2-萘基)-,盐酸盐(1:1))、非哥替尼(glpg0634)(n-[5-[4-[(1,1-二氧代-4-硫代吗啉基)甲基]苯基][1,2,4]三唑并[1,5-a]吡啶-2-基]环丙烷甲酰胺)、janex-1(4-[(6,7-二甲氧基-4-喹唑啉)氨基]-苯酚)、nvp-bsk805(4-[[2,6-二氟-4-[3-(1-哌啶-4-基吡唑-4-基)喹喔啉-5-基]苯基]甲基]吗啉;二盐酸盐)、sb1317(20-氧杂-5,7,14,27-四氮杂四环[19.3.1.12,6.18,12]二十七烷-1(25),2,4,6(27),8,10,12(26),16,21,23-十烯,14-甲基-)等jak阻断剂也被用作本发明的抗流感病毒剂。另外,作为具有抑制usp9x基因的功能的作用的物质,可举出作为dub阻断剂的wp1130(degrasyn)((2e)-3-(6-溴-2-吡啶基)-2-氰基-n-[1s-苯基丁基]-2-丙烯酰胺)。将具有抑制本发明的抗flu基因的表达的作用的物质作为有效成分时,作为本发明的抗流感病毒剂,优选能使抗flu基因的表达量相比于不存在该抗流感病毒剂时降低50%以上的抗流感病毒剂,更优选能使所述表达量降低75%以上的抗流感病毒剂,进一步优选能使所述表达量降低80%以上的抗流感病毒剂。同样地,将具有抑制抗flu基因的功能的作用的物质作为有效成分时,作为本发明的抗流感病毒剂,优选能使抗flu基因的功能相比于不存在该抗流感病毒剂时降低50%以上的抗流感病毒剂,更优选能够降低75%以上的抗流感病毒剂,进一步优选能够降低80%以上的抗流感病毒剂。本发明的抗流感病毒剂能够用于对动物进行流感病毒的感染预防、对感染了流感病毒的动物的治疗中。作为用于对流感病毒进行感染预防或治疗流感时被给药本发明的抗流感病毒剂的动物,例如,可举出人、猴、猪、马、狗、猫、虎等哺乳类;鸡、家鸭、鹌鹑、鹅、野鸭、火鸡、虎皮鹦鹉、鹦鹉、鸳鸯、天鹅等鸟类。作为本发明的抗流感病毒剂,优选用于对人进行流感病毒的感染预防、对感染了流感病毒的动物进行治疗的抗流感病毒剂。对于感染了流感病毒的动物或有必要进行预防流感病毒感染的动物,通过给药有效量的本发明的抗流感病毒剂,能够进行流感的治疗。对抗流感病毒剂的有效量而言,可以是对于已给药的动物而言,相比于未给药的情况,能使体内的流感病毒的量降低的量,或者是能够防止流感病毒的感染的量,优选不会因该抗流感病毒剂而产生严重副作用的量。对于各抗流感病毒剂的有效量而言,能够考虑抗流感病毒剂的种类、作为给药对象的动物的种类、给药方法等以实验的方式求出。例如,在对感染了流感病毒的实验动物给药的情况下,将与未给药的实验动物相比,能够使以pfu计的该实验动物的体内的流感病毒量成为70%以下、优选成为80%以下、更优选成为90%以下的量规定为有效量。本发明的抗流感病毒剂能够通过常规方法进行制剂化而成为适于口服给药、静脉注射、对鼻腔或口腔直接给药、经皮给药等各种给药形式的剂型。作为该剂型,可举出片剂、粉剂、颗粒剂、胶囊剂、咀嚼片剂、糖浆剂、溶液剂、悬浮液剂、注射剂、含漱剂、喷雾剂、贴剂、软膏剂等。本发明的抗流感病毒剂除了包含具有抑制抗flu基因的表达、功能的作用的物质以外,还可以包含各种添加剂。作为该添加剂,可举出赋形剂、粘合剂、润滑剂、润湿剂、溶剂、崩解剂、增溶剂、悬浮剂、乳化剂、等渗剂、稳定剂、缓冲剂、防腐剂、抗氧化剂、调味剂、着色剂等。作为所述添加剂,是药学上可接受的物质,能够适当地从用于药物的制剂化的物质中选择而使用。<抗流感病毒剂的筛选方法>本发明的抗流感病毒剂的筛选方法(以下,有时也称作“本发明的筛选方法”。)是对抗流感病毒剂的候选化合物进行筛选的方法,其特征在于,筛选对本发明的抗flu基因的表达或功能具有抑制或阻断能力的候选化合物,作为抗流感病毒剂的候选化合物。在本发明的筛选方法中,可以是筛选对一种抗flu基因的表达或功能具有抑制或阻断能力的物质的方法,也可以是筛选对两种以上的抗flu基因的表达或功能具有抑制或阻断能力的物质的方法。具体而言,对抗flu基因的表达具有抑制能力或阻断能力的物质的筛选是,首先,在细胞中导入作为评价是否为抗流感病毒剂的候选化合物的对象的化合物,检测抗flu基因的表达是否被抑制。当抗flu基因的表达被明显抑制时,选择该化合物作为抗流感病毒剂的候选化合物。即,通过下述工序来进行筛选:导入工序,在细胞中导入作为评价是否为抗流感病毒剂的候选化合物的对象的化合物;测定工序,对导入了所述化合物的细胞中的抗flu基因的表达量进行测定;选择工序,当所述抗flu基因的表达量与导入所述化合物之前的细胞中的该抗flu基因的表达量相比显著下降时,选择该化合物作为抗流感病毒剂的候选化合物。对于用于筛选的细胞而言,优选作为流感病毒的宿主的生物物种的细胞,从处理的方便性考虑,更优选哺乳类、鸟类的培养细胞株,进一步优选人的培养细胞株。另外,对作为评价对象的化合物而言,能够采用电穿孔法、脂质体法、磷酸钙法等导入细胞内。当作为评价对象的化合物为低分子化合物时,通过将该化合物添加于培养液中,能够将该化合物导入细胞内。对于抗flu基因的表达量的变化而言,可以通过mrna水平进行评价,也可以通过蛋白质水平进行评价。例如,能够采用rt-pcr法等的核酸扩增反应,或者通过免疫组织化学法、蛋白质免疫印迹(westernblot)法,定量地比较抗flu基因的表达量。具体而言,例如,从在导入了作为评价对象的化合物的状态下培养了1~2天的细胞中提取rna,通过反转录反应,由该rna合成cdna,以该cdna为模板进行pcr,对抗flu基因的cdna的全长或一部分进行扩增。当得到的扩增产物量与由导入该化合物之前的细胞以同样的方式得到的扩增产物量相比显著减少时,评价为该化合物对抗flu基因的表达具有抑制能力或阻断能力。另外,例如,针对在导入了作为评价对象的化合物的状态下培养了1~2天的细胞与导入该化合物前的细胞,使用经荧光标记的抗体对细胞内的抗flu蛋白质进行染色,对比各细胞的荧光强度。当导入了该化合物的细胞中的各细胞的荧光强度与未导入该化合物的细胞相比显著小时,则评价为该化合物对抗flu基因的表达具有抑制或阻断能力。另外,例如,对在导入了作为评价对象的化合物的状态下培养了1~2天的细胞与导入该化合物之前的细胞的细胞提取液(裂解液)进行电泳并分离,然后转印至膜,使用经荧光标记的抗体对该膜上的抗flu蛋白质条带进行染色,对比条带的荧光强度。当来自于导入了该化合物的细胞的抗flu蛋白质条带的荧光强度与未导入该化合物的细胞相比显著小时,评价为该化合物对抗flu基因的表达具有抑制或阻断能力。当抗flu蛋白质的功能是与特定生物分子的相互作用时,例如,在作为评价对象的化合物的存在下以及未存在下,进行抗flu蛋白质与该特定生物分子的结合分析测试,相比于未存在下,在作为评价对象的化合物的存在下,两者的结合性降低时,评价为该化合物对抗flu基因的功能具有抑制或阻断能力。另外,当抗flu蛋白质是酶时,例如,在作为评价对象的化合物的存在下以及未存在下,对抗flu蛋白质的酶活性进行测定,与未存在下相比,在作为评价对象的化合物的存在下,抗flu蛋白质的酶活性降低时,评价为该化合物对抗flu基因的功能具有抑制或阻断能力。实施例下面,通过实施例等进一步详细说明本发明,但本发明不受这些实施例的限定。<细胞的培养>在下述的实施例中,使用含有10%fcs(胎牛血清)以及抗生素的dmem培养基(西格玛奥德里奇公司(シグマアルドリッチ社)制),在5%二氧化碳环境下,在37℃温度培养hek293细胞及a549细胞(来自于人肺上皮细胞)。使用含5%ncs(新生胎牛血清)伊格尔最小必需培养基(eagle'smem)(gibco公司制),在5%二氧化碳环境下,在37℃温度培养mdck(犬肾上皮细胞系(madin-darbycaninekidney))细胞。<流感病毒>对于下述实施例中使用的流感病毒而言,只要没有特别的记载,就使用a型流感病毒(a/wsn/33,h1n1亚型;wsn)。该病毒是适应于小鼠的人源流感病毒,是通过利用反向遗传学的方法(参见非专利文献7。)制成的流感病毒,使其在mdck细胞中进行增殖。另外,通过使用mdck细胞的空斑测试(plaqueassay)对病毒的效价进行测定(参见非专利文献8。)。pb2-ko/rluc病毒(具有萤火虫荧光素酶基因的pb2敲除的病毒)是缺失复制能力的病毒,在聚合酶pb2蛋白质的编码区域具有编码海肾荧光素酶(renillaluciferase)的报告基因。pb2-ko/rluc病毒由ppolipb2(120)rluc(120)(对被来自于pb2片段的n末端及c末端的120个碱基夹持的海肾荧光素酶基因进行编码的质粒)、以及对七个病毒rna片段进行编码的质粒来进行制备。对于pb2-ko/rluc病毒的增殖与效价的测定而言,在恒定地表达pb2蛋白质的mdck细胞中进行(参见非专利文献9。)。<抗体>用于下述实施例的小鼠抗ha抗体(ws3-54)、小鼠抗na抗体(ws5-29)、以及小鼠抗m1抗体(ws-27/52)使用由国立感染症研究所的高下惠美主任研究员提供的抗体。小鼠抗aichinp抗体(2s-347/3)以及兔抗wsn病毒抗体(r309)使用发明人等通过常规方法制备的抗体。抗β-肌动蛋白(β-actin)(ac-74)抗体使用由西格玛奥德里奇(シグマアルドリッチ)公司购买的抗体。[实施例1]<与流感病毒蛋白质进行相互作用的宿主蛋白质的鉴定>本发明人等首先通过免疫沉降法,对与流感病毒蛋白质进行相互作用的宿主蛋白质进行鉴定。具体而言,首先,对于11种流感病毒蛋白质(pb2、pb1、pa、ha、np、na、m1、m2、ns1、ns2以及pb1-f2),分别使flag标签融合于n末端或c末端从而制成flag融合蛋白质,将对该融合蛋白质进行编码的质粒转染至hek293细胞。使用transit293试剂(mirusbiocorp制造)进行转染。将转染后培养了24小时的细胞混合于细胞溶解缓冲液(50mmtris-hcl(ph7.5),150mmnacl,1mmedta,0.5%nonidetp-40,蛋白酶抑制剂混合物(proteaseinhibitormixture)completemini(roche,mannheim,germany))中,在4℃温度进行1小时孵育,从而进行溶解,得到裂解液。将得到的裂解液进行离心分离处理,于回收的上清液中混合已结合抗flag抗体的亲和凝胶(anti-flagm2affinitygel,西格玛奥德里奇公司制造),在4℃温度孵育18小时。然后,用细胞溶解缓冲液将亲和凝胶清洗3次,接着用ip(免疫沉降)缓冲液(50mmtris-hcl(ph7.5),150mmnacl,1mmedta)清洗2次,然后,用含有0.5mg/ml的flag肽(f1804,西格玛奥德里奇公司制)的ip缓冲液在4℃温度搅拌2小时。然后,通过离心分离处理去除亲和凝胶,回收上清液。将回收的上清液用ultrafree-mc过滤器(ultrafree-mcfilter)(密里博公司(ミリポア社)制)进行过滤后,通过nanolc-ms/ms(纳流液相色谱串联质谱(nanoflowliquidchromatographytandemmassspectrometry))分析,对所含的蛋白质进行鉴定。在质谱数据库的解析中,使用组合了dina(kya科技公司(ケーワイエーテクノロジーズ社)制)的q-starelite(美国应用公司(エービー·サイエックス社)制)。将得到的ms/ms信号与refseq(美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation)人类蛋白质数据库)进行对比,从而对免疫共沉降的hek293细胞(宿主细胞)的蛋白质进行鉴定。使用mascot算法(版本2.2.04;矩阵科技公司(matrixscience社)制),在下述条件下进行上述对比:可变修饰(variablemodifications),氧化(oxidation)(met),n-乙酰化(n-acetylation);最大漏切位点个数(maximummissedcleavages),2;肽段质量误差范围(peptidemasstolerance),200ppm;串联质谱误差(ms/mstolerance),0.5da.)。蛋白质的鉴定的条件是:mascot得分显著超过阈值的ms/ms信号至少存在一个。其结果,388个宿主蛋白质与pb2蛋白质免疫共沉降,322个宿主蛋白质与pb1蛋白质免疫共沉降,304个宿主蛋白质与pa蛋白质免疫共沉降,351个宿主蛋白质与ha蛋白质免疫共沉降,574个宿主蛋白质与np蛋白质免疫共沉降,675个宿主蛋白质与na蛋白质免疫共沉降,659个宿主蛋白质与m1蛋白质免疫共沉降,531个宿主蛋白质与m2蛋白质免疫共沉降,113个宿主蛋白质与ns1蛋白质免疫共沉降,42个宿主蛋白质与ns2蛋白质免疫共沉降,81个宿主蛋白质与pb1-f2蛋白质免疫共沉降。即,总计为1292个宿主蛋白质与11种流感病毒蛋白质中的任意种免疫共沉降。<sirna>然后,针对编码通过免疫沉降而鉴定的1292个宿主蛋白质的基因,进行rna干涉,检测这些蛋白质实际上是否参与流感病毒的增殖。对使用的sirna而言,针对各宿主基因,分别从全基因组人类sirna文库(humansirnalibrary)(flexitubesirna;凯杰公司(キアゲン社)制)中选择两种使用。另外,作为阴性对照,使用allstars阴性对照sirna(allstarsnegativecontrolsirna)(凯杰公司(キアゲン社)制)(对照sirna)。另外,wsn病毒的np基因的sirna(ggaucuuauuucuucggaguu)从西格玛奥德里奇公司购入。具体而言,首先,使用rnaimax试剂(美国英杰生命技术公司(invitrogen社)制),将两种sirna分别以25nm(最终浓度:50nm)添加于hek293细胞,进行两次转染。<细胞的存活性>对于sirna的第二次转染后经过24小时后的细胞的存活性,按照附带的说明书,使用celltiter-glo测试系统(celltiter-gloassaysystem)(普洛麦格公司(プロメガ社)制)进行检测。计算导入了各sirna的细胞的活细胞数目相对于导入了对照sirna的细胞的活细胞数目的比率,作为细胞存活率(%)。<qrt-pcr>针对sirna的转染前的细胞与转染后经过48小时后的细胞,进行qrt-pcr(反转录定量pcr(quantitativereversetranscription-pcr)),确认了是否因sirna而导致靶宿主基因的表达被抑制。具体而言,首先,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,将第二次转染后经过48小时后的细胞溶解于所述细胞溶解缓冲液中,制备裂解液。使用maxwell16levsimplyrna组织试剂盒(maxwell16levsimplyrnatissuekit)(普洛麦格公司(プロメガ社)制)从制备的裂解液中提取总rna,并将其作为模板,使用利用高效反转录酶revertraace进行的实时定量pcr反应试剂(revertraaceqpcrrtmastermix)(东洋纺公司制)或superscriptiii反转录酶(superscriptiiireversetranscriptase)(美国英杰生命技术公司(invitrogen社)制)进行反转录反应。以合成的cdna为模板,使用对各宿主基因具有特异性的引物组与thunderbirdsybr定量pcr试剂(thunderbirdsybrqpcrmix)(东洋纺公司制)进行定量pcr。对于各宿主基因的mrna表达量水平的对比而言,以β-肌动蛋白为内源性标准物质,通过δδct法计算。对导入了各sirna的细胞中的mrna表达量相对于导入了对照sirna的细胞中的mrna表达量的比率进行计算,作为沉默率(%)。<病毒的增殖性>在两个24孔培养皿中,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,使50pfu(plaque-formingunit)的流感病毒感染第二次转染后的细胞。病毒感染后经过48小时后,回收培养上清液,通过利用mdck细胞的空斑测试(plaqueassay),对病毒的效价进行检测。计算出导入了各sirna的细胞的病毒效价的常用对数值除以导入了对照sirna的细胞中的病毒效价的常用对数值而得到的值,作为病毒效价的变化量。其结果,在323个宿主基因中,通过sirna的转染,基因表达水平下降。在该323个基因中,对299个宿主基因而言,流感病毒的效价降低程度以常用对数值计为2以上(即,病毒效价的变化量为-2以上),对于24个宿主基因而言,流感病毒的效价升高程度以常用对数值计为1以上(即,病毒效价的变化量为1以上)。其中,对下述91个宿主基因而言,显示出虽然宿主细胞的存活性保持为80%以上,但流感病毒的效价以常用对数值计的3以上的程度下降,作为抗流感病毒剂的靶标很有用:anp32b基因、ap2a2基因、ascc3l1基因、atp5o基因、bag3基因、basp1基因、brd8基因、bub3基因、c14orf173基因、c19orf43基因、caprin1基因、ccdc135基因、ccdc56基因、cherp基因、cirbp基因、cltc基因、cnot1基因、ctnnb1基因、cyc1基因、ddx21基因、ddx55基因、dkfzp564k142基因、dnajc11基因、dpm3基因、eef1a2基因、eef2基因、fam73b基因、flj20303基因、gbf1基因、gemin4基因、hnrnpk基因、iars基因、igf2bp2基因、itga3基因、itgb4bp基因、itm2b基因、jak1基因、kiaa0664基因、krt14基因、lrpprc基因、mrcl3基因、myh10基因、ncapd3基因、ncln基因、ndufa10基因、ndufs8基因、nfia基因、nibp基因、nup160基因、nup205基因、pcdhb12基因、phb基因、ppp6c基因、psma4基因、psma5基因、psmb2基因、psmc1基因、psmc4基因、psmc6基因、psmd11基因、psmd12基因、psmd13基因、psmd14基因、psmd2基因、psmd6基因、rcn1基因、rpl26基因、s100a4基因、samhd1基因、sdf2l1基因、sdf4基因、sf3a2基因、sf3b2基因、sf3b4基因、sfrs10基因、sfrs2b基因、snrp70基因、snrpc基因、snrpd3基因、sqstm1基因、stk38基因、taf15基因、tesc基因、thoc2基因、tomm40基因、trim28基因、uap1基因、usp9x基因、vcp基因、xpo1基因、zc3h15基因。将所述91个宿主基因的病毒效价的变化量、细胞存活率(%)以及沉默率(%)示于表1~3中。表1表2表3<对细胞内蛋白质的合成的影响>对抑制所述91个宿主基因的表达是否对细胞内蛋白质合成产生影响进行了检测。具体而言,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,在第二次转染后经过24小时后的细胞中,在细胞内发挥作用的rna聚合酶ii启动子(例如,鸡β-肌动蛋白启动子)的控制下,将表达海肾荧光素酶的质粒用作对照。对于转染后经过48小时后的细胞,使用海肾荧光素酶测试系统(renillaluciferaseassaysystem)(普洛麦格公司(プロメガ社)制),进行荧光素酶测定。荧光素酶活性使用glomax-96微孔板发光检测仪(glomax-96microplateluminometer)(普洛麦格公司制)进行测定。对导入了各sirna的细胞中的海肾荧光素酶活性相对于导入了对照sirna的细胞中的海肾荧光素酶活性的比率进行了计算,作为细胞内蛋白质的合成效率(%)。将算出的细胞内蛋白质的合成效率(%)示于表4中。其结果是,在所述91个宿主基因中,在导入了28个宿主基因(atp5o基因、cnot1基因、gemin4基因、itgb4bp基因、ncapd3基因、nup160基因、nup205基因、psma4基因、psma5基因、psmb2基因、psmc1基因、psmc4基因、psmd11基因、psmd2基因、psmd6基因、sf3a2基因、sf3b4基因、snrpd3基因、vcp基因、psmc6基因、psmd12基因、psmd14基因、samhd1基因、sf3b2基因、snrp70基因、caprin1基因、phb基因以及sfrs10基因)的sirna的细胞中,萤火虫荧光素酶活性与导入了对照sirna的细胞相比,降低了80%以上(p<0.05)。该结果显示:所述宿主基因参与宿主细胞中的转录、翻译,通过使该宿主基因的表达降低,流感病毒的转录、翻译被抑制,进而流感病毒的复制被阻断。表4<微型复制测试(minirepliconassary)>通过对流感病毒的rna聚合酶活性进行检测的微型复制测试(参见非专利文献10。),对所述91个宿主基因是否参与病毒基因组复制及转录进行检测。更具体而言,微型复制测试是基于编码萤火虫荧光素酶报告蛋白质的病毒样rna的复制活性对病毒复制复合体(含有pb2蛋白质、pb1蛋白质、pa蛋白质以及np蛋白质的复合体)的活性进行检测的测试。具体而言,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,将用于表达pa的质粒、用于表达pb1的质粒、用于表达pb2的质粒、用于表达np的质粒以及用于表达编码萤火虫荧光素酶的病毒样rna的质粒(ppolinp(0)1uc2(0))转染至第二次转染后经过24个小时后的细胞中。需要说明的是,用于表达pa、pb1、pb2或np的质粒是分别将编码各蛋白质的cdna组合于质粒pcaggs的多克隆位点而成的质粒。另外,将在宿主细胞内发挥作用的rna聚合酶ii启动子(例如,鸡β-肌动蛋白启动子)的控制下使海肾荧光素酶进行表达的质粒用作对照。对于转染后经过48小时后的细胞,使用dual-glo荧光素酶测试系统(dual-gloluciferaseassaysystem)(普洛麦格公司制)进行荧光素酶测试。荧光素酶活性是使用glomax-96微孔板发光检测仪(glomax-96microplateluminometer)(普洛麦格公司制)进行测定。计算病毒rna聚合酶活性,作为利用海肾荧光素酶活性标准化的萤火虫荧光素酶活性。对导入了各sirna的细胞的萤火虫荧光素酶活性相对于导入了对照sirna的细胞的萤火虫荧光素酶活性的比率进行计算,作为病毒聚合酶活性(%)。该病毒聚合酶活性表示萤火虫荧光素酶报告蛋白质的表达水平,作为病毒基因组复制以及转录的效率的指标。将算出的病毒聚合酶活性(%)示于表5中。其结果是,在所述91个宿主基因中,对于导入了9个宿主基因(bub3基因、ccdc56基因、cltc基因、cyc1基因、nibp基因、zc3h15基因、c14orf173基因、ctnnb1基因以及anp32b基因)的sirna的细胞而言,病毒聚合酶活性、即病毒基因组复制及转录与导入了对照sirna的细胞相比降低了50%以上(p<0.05)。该结果显示:所述宿主基因参与病毒基因组复制及转录,通过使这些宿主基因的表达降低,流感病毒的基因组复制及转录被抑制。表5<pb2-ko/rluc病毒测试>针对所述91个宿主基因,为了对其是否参与病毒的生命周期的初始阶段进行检测,因此进行了pb2-ko/rluc病毒测试,检测病毒的侵入效率。具体而言,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,使pb2-ko/rluc病毒感染第二次转染后经过24小时后的细胞。对于感染后经过8小时后的细胞,使用海肾荧光素酶测试系统(renillaluciferaseassaysystem)(普洛麦格公司制)进行荧光素酶测试。荧光是使用glomax-96微孔板发光检测仪(glomax-96microplateluminometer)(普洛麦格公司制)进行测定。对导入了各sirna的细胞的海肾荧光素酶活性相对于导入了对照sirna的细胞的海肾荧光素酶活性的比率进行计算,作为病毒的侵入效率(%)。将算出的病毒侵入效率(%)示于表6中。其结果,在所述91个宿主基因中,对于23个宿主基因(sf3a2基因、gemin4基因、sfrs10基因、bag3基因、caprin1基因、ccdc135基因、igf2bp2基因、krt14基因、atp5o基因、samhd1基因、psmd6基因、brd8基因、psmd11基因、sf3b2基因、sf3b4基因、dpm3基因、ncapd3基因、eef2基因、phb基因、nup205基因、s100a4基因、psmd14基因以及ddx55基因)而言,病毒侵入效率与导入了对照sirna的细胞相比下降了50%以上(p<0.05)。该结果显示:所述宿主基因参与流感病毒侵入宿主细胞,通过使所述宿主基因的表达降低,流感病毒对宿主细胞的侵入受到阻断,进而流感病毒的复制受到阻断。表6另外,可知在所述23个宿主基因中,9个宿主基因(bag3基因、brd8基因、ccdc135基因、ddx55基因、dpm3基因、eef2基因、igf2bp2基因、krt14基因以及s100a4基因)不参与宿主细胞的转录、翻译,而特异性地参与流感病毒的转录、翻译。另外,对所述9个宿主基因而言,在所述微型复制测试中未能确认到流感病毒的复制的阻断活性,因此,所述宿主基因在病毒结合于宿主细胞表面、进入宿主细胞、vrnp(病毒核糖核酸蛋白质)复合体移动至核等的病毒的生命周期的初始阶段发挥重要的作用。<vlp形成测试>通过病毒样颗粒(virus-likeparticle,vlp)形成测试,检测所述91个宿主基因是否参与病毒颗粒形成。具体而言,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,在该细胞中使用transit293转染试剂(transit293transfectionreagent)(mirus社制),将用于表达ha的质粒、用于表达na的质粒以及用于表达m1的质粒进行转染。需要说明的是,用于表达ha、na或m1的质粒分别是将编码各蛋白质的cdna组合于质粒pcaggs的多克隆位点而成的质粒。使用含有100mmdtt的sds样本缓冲溶液(sdssamplebuffersolution)(和光纯药公司制),使质粒转染后经过48小时后的细胞进行溶解。将得到的裂解液回收,进行离心分离处理(3000×g、4℃、5分钟),从细胞残渣中分离并回收含有vlp的上清液。将得到的上清液施加在注入于超离心用管中的含有30质量/容量%蔗糖的pbs(磷酸缓冲生理盐水)上,进行超离心分离处理(50000rpm,4℃,1小时,sw55ti转子)。使得到的沉淀物溶解于含有100mmdtt的sds样本缓冲溶液(sdssamplebuffersolution)(和光纯药公司制)而制成的溶液作为蛋白质免疫印迹(westernblotting)用样本。将tris-甘氨酸sds样本缓冲液(tris-glycinesdssamplebuffer)(美国英杰生命技术公司(invitrogen社)制)与已制备的蛋白质免疫印迹(westernblotting)用样本进行混合,将混合成的样本加入4%-20%mini-proteantgx梯度凝胶(mini-proteantgxgradientgels)(伯乐公司(バイオ·ラッド社)制)中,进行sds-page,将分离的蛋白质转印于pvdf膜,使用封闭溶液(blockingonesolution)(纳卡拉组织公司(ナカライテスク社)制),对转印膜封闭。在初级抗体溶液(将兔抗wsn病毒抗体(r309)或抗β-肌动蛋白(ac-74)抗体用附属于cangetsignal(东洋纺公司制)的溶液-溶液i(solutioni)稀释而成的溶液)中,在室温条件下,将该转印膜至少孵育1小时。接着,用含有0.05容量%吐温-20(tween-20)的tbs(tbst)清洗该转印膜3次,然后,在次级抗体溶液(将连接有辣根过氧化物酶的ecl驴抗小鼠igg抗体(ge医疗集团制)用附属于cangetsignal(东洋纺公司制)的溶液-溶液ii(solutionii)稀释而成的溶液)中进行孵育后,用tbst清洗3次。该转印膜在eclprime蛋白质免疫印迹检测试剂(eclprimewesternblottingdetectionreagent)(ge医疗集团制)中进行孵育后,通过versadoc成像系统(versadocimagingsystem)(伯乐公司(バイオ·ラッド社)制),检测因化学发光而产生的信号,检测vlp中的ha蛋白质及m1蛋白质的条带、以及β-肌动蛋白的条带。将vlp产生量作为vlp中的ha蛋白质或m1蛋白质的量相对于裂解液中的ha蛋白质或m1蛋白质的量的比率来计算。计算出导入了各sirna的细胞的vlp的产生量相对于导入了对照sirna的细胞的vlp的产生量的比率,作为vlp的产生效率(%)。将基于ha蛋白质的vlp产生效率(%)的结果示于表7,将基于m1蛋白质的vlp产生效率(%)的结果示于表8。其结果,在所述91个宿主基因中,对于15个宿主基因(ascc3l1基因、brd8基因、c19orf43基因、ddx55基因、dkfzp564k142基因、dpm3基因、eef2基因、fam73b基因、flj20303基因、gbf1基因、ncln基因、c14orf173基因、xpo1基因、lrpprc基因以及rcn1基因)而言,vlp的形成效率与导入了对照sirna的细胞相比降低了50%以上(p<0.05)。该结果显示:所述宿主基因参与vlp的形成,通过使该宿主基因的表达降低,vlp的形成被阻断,进而流感病毒的复制被阻断。表7表8<vrnp进入子代病毒颗粒的效率>为了检测所述91个宿主基因是否参与vrnp进入子代病毒颗粒,对vrna及np进入子代病毒颗粒进行了检测。具体而言,首先,与所述<sirna>同样地进行操作,将sirna转染至hek293细胞,使moi(感染复数(multiplicityofinfection))为5的流感病毒感染第二次转染后的细胞。从感染起经过12小时后,通过离心分离处理(3000×g,4℃,5分钟),从细胞残渣中分离并回收所放出的含有病毒颗粒的培养上清液。将得到的上清液施加在注入于超离心用管中的含有30重量/容量%蔗糖的pbs上,进行超离心分离处理(50000rpm,4℃,1小时,sw55ti转子)。将含有病毒颗粒的沉淀物在pbs中均质,使用maxwell16levsimplyrna组织试剂盒(maxwell16levsimplyrnatissuekit)提取病毒rna。根据kawakami等人的方法(参见非专利文献11。),通过链特异性实时pcr,对上清液中的病毒rna量以及细胞中的病毒rna量进行定量。需要说明的是,使用superscriptiii反转录酶(superscriptiiireversetranscriptase)及在5’末端附加有由19个碱基构成的标签序列的流感病毒基因组特异性引物(vrnatag_np_1f;ggccgtcatggtggcgaatagcaaaagcagggtagataatcactc(小写字母部分为标签序列)),进行以总rna为模板的反转录反应。另外,使用对所述标签序列具有特异性的引物(vrnatag;ggccgtcatggtggcgaat)、对病毒基因组具有特异性的引物(wsn-np_100r;gttctccatcagtctccatc)、以6-fam/zen/ibfq标记的探针(idt,wsn-np_46-70;atggcgaccaaaggcaccaaacgat)以及thunderbird探针定量pcr试剂(thunderbirdprobeqpcrmix)进行定量pcr。对于vrna及np蛋白质进入子代病毒颗粒的量,通过用从培养上清液中回收的病毒中的vrna或np蛋白质的量除以裂解液中的vrna或np蛋白质的量而得到的值确定。计算出导入了各sirna的细胞中的vrna进入子代病毒颗粒的量相对于导入了对照sirna的细胞中的vrna进入子代病毒颗粒的量的比率,将其作为vrna的进入效率(%)。计算出导入了各sirna的细胞中的np蛋白质进入子代病毒颗粒的量相对于导入了对照sirna的细胞中的np蛋白质进入子代病毒颗粒的量的比率,将其作为np蛋白质的进入效率(%)。将算出的结果示于表9及10中。其结果,在所述91个宿主基因中,对于导入了16个宿主基因(hnrnpk基因、ddx21基因、jak1基因、eef1a2基因、sfrs2b基因、dnajc11基因、sqstm1基因、basp1基因、pcdhb12基因、kiaa0664基因、snrpc基因、ppp6c基因、mrcl3基因、itm2b基因、taf15基因以及sdf4基因)的sirna的细胞而言,vrna进入子代病毒颗粒中的效率与导入了对照sirna的细胞相比降低了50%以上(p<0.05),在导入了27个宿主基因(sfrs2b基因、basp1基因、thoc2基因、snrpc基因、kiaa0664基因、ppp6c基因、hnrnpk基因、itm2b基因、sqstm1基因、rpl26基因、ndufs8基因、sdf2l1基因、jak1基因、ddx21基因、eef1a2基因、trim28基因、sdf4基因、usp9x基因、psmd13基因、taf15基因、cirbp基因、cherp基因、tesc基因、myh10基因、tomm40基因、mrcl3基因以及pcdhb12基因)的sirna的细胞中,np蛋白质进入子代病毒颗粒中的效率与导入了对照sirna的细胞相比降低了50%以上(p<0.05)。所述结果显示:所述宿主基因参与vrna或np蛋白质向子代病毒颗粒的进入,通过降低所述宿主基因的表达,vrna或np蛋白质被阻止进入子代病毒颗粒,进而流感病毒的复制受到阻断。表9表10[实施例2]在实施例1中,针对因sirna的导入而导致流感病毒的效价以常用对数值计降低了2以上的299个宿主基因,检测公知的阻断剂是否能用作抗流感病毒剂。首先,从药物银行数据库(drugbankdatabase)(参见非专利文献12。)、ipa(ingenuity)、以及制药公司(密里博(millipore),西格玛奥德里奇,赛力克化学(selleckchemicals))的数据库中,检测作为所述宿主基因的功能的阻断剂的化合物。其结果,发现了61个化合物,作为对44个宿主基因的阻断剂。从所述61个化合物中,选择表11所示的11个阻断剂,检测这些化合物对流感病毒的复制的影响。在所述化合物中,硼替佐米(bortezomib)与秋水仙碱(colchicine)作为流感病毒的复制阻断剂广为人知(参见非专利文献13及14。)。表11具体而言,使moi为0.001的流感病毒感染hek293细胞或a549细胞。对感染后经过1小时后的细胞进行清洗,然后,在含有各阻断剂的培养液中进行培养。作为对照,使用dmso溶液(最终浓度:1容量%)来代替各阻断剂。在阻断剂的存在下培养48小时,然后,回收培养上清液,与实施例1同样地进行操作,求出病毒的效价。另外,对于细胞的存活率(%)而言,按照附带的说明书使用celltiter-glo测试系统(celltiter-gloassaysystem)(普洛麦格公司制),计算出用含有各阻断剂的培养基进行培养的细胞的活细胞数相对于用含有对照(dmso溶液)的培养基进行培养的细胞的活细胞数的比率,作为细胞存活率(%)。其结果可知,2,3-丁二酮2-肟(30mm)以及wp1130(50μm)能够使以常用对数值表示的病毒效价降低5以上,但细胞存活率也显著降低,对宿主细胞的毒性强。作为公知的抗流感病毒剂的硼替佐米(0.2μm)与秋水仙碱(2.5μm)在a549细胞中,不会表现严重的细胞毒性,能够使以常用对数值表示的病毒效价降低4(硼替佐米)或2(秋水仙碱)以上。另一方面,目前未指出与流感病毒的复制的相互关系的golgicidea(10μm)与鲁索利替尼(30μm)能够显著地使病毒效价降低。鲁索利替尼(30μm)不会表现显著的毒性,确认了golgicidea(10μm)在hek293细胞中的细胞存活率降低,但在a549细胞中未能确认。分别将golgicidea的结果示于图1、将鲁索利替尼的结果示于图2。根据所述结果,组蛋白乙酰转移酶抑制剂ii(histoneacetyltransferaseinhibitorii)、染料木黄酮(genistein)、2,3-丁二酮2-肟、wp1130、golgicidea及鲁索利替尼与硼替佐米及秋水仙碱同样地,具有抗流感病毒作用,其中,golgicidea及鲁索利替尼对宿主细胞的毒性相对小,作为抗流感病毒剂非常有用。[实施例3]鲁索利替尼是对于作为酪氨酸激酶的jak1的阻断剂。如实施例1所示,在通过导入sirna而使jak1的表达下降的细胞中,基于m1蛋白质的vlp产生效率为57.7%,接近于作为截止值设定的50%。于是,通过电子显微镜对导入了jak1的sirna的细胞进行观察,检测jak1基因的表达下降对流感病毒的病毒颗粒形成的影响。具体而言,首先,与所述<sirna>同样地进行操作,将jak1基因的sirna或对照sirna转染至hek293细胞,使moi为5的流感病毒感染第二次转染后的细胞。在感染后经过12小时后的细胞中,按照noda等人的方法(非专利文献15),制备细胞的超薄切片,通过电子显微镜对其观察。电子显微镜使用泰克莱(tecnai)(注册商标)f20电子显微镜(fei公司制)。将导入了对照sirna的细胞的电子显微镜照片(上方)、以及导入了jak1基因的sirna的细胞的电子显微镜照片(下方)示于图3。可知与导入了对照sirna的细胞相比,在导入了jak1基因的sirna的细胞中,已形成的病毒样颗粒明显较少,通过使jak1基因的表达降低,病毒颗粒的形成降低。所述结果显示,jak1在流感病毒复制周期的后期发挥重要作用。[实施例4]将表12中所示的蛋白质阻断剂作为受检化合物,检测细胞毒性、以及对流感病毒的增殖的效果。表12阻断剂名cas号功能j1托法替尼(cp-690550)柠檬酸盐477600-75-2jak阻断剂j4酪氨酸磷酸化抑制剂b42133550-30-8jak阻断剂j6巴瑞克替尼1187594-09-7jak阻断剂j7at9283896466-04-9jak阻断剂j8莫米洛替尼1056634-68-4jak阻断剂j11cep337791257704-57-6jak阻断剂j13nvp-bsk8052hcl1092499-93-8(游离碱)jak阻断剂j15zm39923hcl1021868-92-7jak阻断剂j19非哥替尼1206161-97-8jak阻断剂j20janex-1202475-60-3jak阻断剂j21nvp-bsk805二盐酸盐1092499-93-8(游离碱)jak阻断剂j23sb1317937270-47-8jak阻断剂j25wp1130856243-80-6dub阻断剂<细胞毒性试验>首先,作为受检化合物溶液,用含有1%二甲基亚砜的mem制备受检化合物,以使作为终浓度成为1000μm、100μm、10μm、1μm、0.1μm、0.01μm或0.001μm。用最小必需培养基(minimumessentialmedium;mem)将mdck细胞、a549细胞以及hek293细胞分别制成浓度为6.25×105细胞/ml、2.5×106细胞/ml、1.25×105细胞/ml的细胞液,将该细胞液分别以0.1ml/孔添加于96孔板,播种细胞。在二氧化碳培养箱中以37℃温度对该96孔板中的细胞进行培养,在播种日的次日用mem进行清洗。在清洗后的96孔板中的细胞中,以每个浓度添加三个孔的方式,添加各受检化合物溶液0.1ml,然后,将该96孔板中的细胞在二氧化碳培养箱中以37℃温度培养48小时。培养后,将细胞计数试剂盒-8(cellcountingkit-8)溶液(同仁化学研究所制)分别以10μl添加于各孔,进而在37℃温度培养几小时。培养后,利用酶标仪对该96孔板的各孔中的溶液的450nm处的吸光度进行测定。将添加溶剂(含1%二甲基亚砜的mem)来代替受检化合物时的吸光度值作为全部细胞存活的情况、即100%,计算吸光度为50%时的受检化合物的终浓度值,作为50%细胞毒性浓度(cc50值)。<抗病毒效果试验>首先,作为受检化合物溶液,用含1%二甲基亚砜的mem制备受检化合物,以使作为终浓度成为1000μm、100μm、10μm、1μm、0.1μm、0.01μm或0.001μm。用mem分别将mdck细胞、a549细胞以及hek293细胞制成浓度为1.25×106细胞/ml、5×106细胞/ml、2.5×105细胞/ml的细胞液,将制备的细胞液分别以0.1ml/孔添加于96孔板,播种细胞。将该96孔板中的细胞在二氧化碳培养箱中以37℃温度进行培养,在播种日的次日用mem进行清洗。在清洗后的96孔板中的细胞中,以每个浓度添加三个孔的方式,添加各受检化合物溶液0.1ml,然后,将该96孔板中的细胞在二氧化碳培养箱中以37℃温度培养1小时。培养后,从各孔中除去受检化合物溶液,使50μl的流感病毒a/wsnrg#1-1株感染,以使moi(每个细胞感染病毒的个数)成为0.001,在二氧化碳培养箱中以37℃温度培养1小时。培养后,从各孔中除去病毒液,分别以0.1ml/孔添加含有1μg/ml胰蛋白酶的受检化合物溶液,进一步地在37℃温度培养48小时。检测培养后的各孔中有无病毒,算出当添加了相同浓度的受检化合物的培养孔的半数(50%)计算为没有病毒时的受检化合物的终浓度值,作为50%病毒增殖阻断浓度(ic50)。需要说明的是,通过判定在从各培养孔中采集的50μl的培养液中添加含有1%豚鼠红血球的红血球溶液50μl时有无凝集,从而判定各培养孔有无病毒。将各蛋白质阻断剂的cc50及ic50的常用对数值示于表13中。表中,空栏是ic50与cc50的差小于10倍(常用对数值的差小于1)的情况。其结果,对于所述蛋白质阻断剂而言,至少在mdck细胞、a549细胞以及hek293细胞中的任意细胞中,ic50为比cc50低10倍以上的低浓度。即,所述蛋白质阻断剂能抑制流感病毒的增殖,而不会显著损害宿主细胞的增殖性,优选作为抗流感病毒剂的有效成分。表13序列表<110>国立研究开发法人科学技术振兴机构<120>抗流感病毒剂及抗流感病毒剂的筛选方法<130>pc-20682<160>5<170>patentinversion3.1<210>1<211>21<212>rna<213>人工序列<220><223>人工序列的说明:wsn病毒的np基因<400>1ggaucuuauuucuucggaguu21<210>2<211>45<212>dna<213>人工序列<220><223>人工序列的说明:vrnatag_np_1f引物.<400>2ggccgtcatggtggcgaatagcaaaagcagggtagataatcactc45<210>3<211>19<212>dna<213>人工序列<220><223>人工序列的说明:vrnatag引物.<400>3ggccgtcatggtggcgaat19<210>4<211>20<212>dna<213>人工序列<220><223>人工序列的说明:wsn-np_100r引物.<400>4gttctccatcagtctccatc20<210>5<211>25<212>dna<213>人工序列<220><223>人工序列的说明:idt,wsn-np_46-70引物.<400>5atggcgaccaaaggcaccaaacgat25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1