生物胶及其作为药物的用途的制作方法
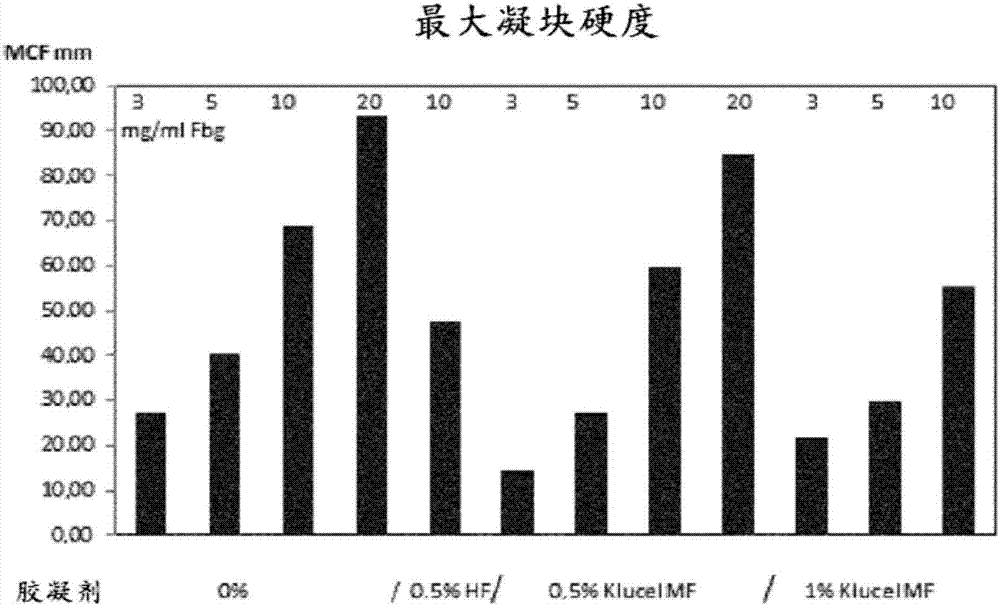
本发明涉及包含纤维蛋白原和活化因子vii的生物胶。本发明还涉及包含纤维蛋白原、活化因子vii和钙离子源的生物胶。所谓“生物胶”是指能够连接组织单元(皮肤、骨骼、多种器官)并且同时确保受损组织的止血,从而能够加强、完成或替换通过一条或多条缝线进行的组织连接的组分。所述组分还允许增强的修复/愈合,特别是通过提供活性化合物的可能的缓慢扩散来实现。血液凝固通过串联步骤发生,所述的步骤涉及血液中包含的不同的酶原和前辅因子,它们通过蛋白水解酶被转化为其活化形式。这种连续的步骤或凝固级联通过称为外部凝固途径和内部凝固途径的两种凝固系统进行,导致凝血酶原转化为凝血酶。外部途径涉及血液中所含的因子vii的作用。然而,该因子需要导致活化因子vii或因子viia引发该凝固级联的活化。因子viia具有低酶活性,直到它与组织损伤后释放的磷脂类型的组织因子复合。因此,在钙离子存在下,复合的因子viia将因子x(fx)转化为因子xa(fxa)。因子xa由此将凝血酶原转化为凝血酶,其活化因子v(因子va)。凝血酶还将因子xiii活化成因子xiiia。在钙的存在下,凝血酶作用于纤维蛋白原,将其转化为纤维蛋白。因子xiiia的存在允许形成具有坚固的、粘附的网状网格的纤维蛋白凝块,其随着网格作为基质起作用的固结愈合组织的组装而被逐渐和缓慢地再吸收。内部凝固途径包括通过因子xii(fxii)导致凝血酶活化的反应级联。后者活化在磷脂组织因子(tf)存在下活化因子ix(因子ixa-fixa)的因子xi(因子xia-fxia)。因子ixa在因子viiia、组织因子和钙离子的存在下参与将因子x活化成因子xa。然后这导致凝血酶原转化为凝血酶。应注意,因子xa或凝血酶的存在也允许活化因子vii(因子viia)。因此,显而易见,因子viia在内部凝固机制中起主要作用,导致血块形成。它用于治疗使用循环抑制剂、即限制或阻止因子viii(fviii)活化的特异性抗体的a型血友病患者。因子viia的优点是即使在不存在因子viii或ix的情况下,也能够在产生组织损伤的出血之后释放的组织因子的存在下局部地起作用。然而,在由切口、伤口或外部手术过程产生的出血性组织损伤的情况下,根据上述机制,通过缝线的组织修复是必需的,特别是对于通过形成纤维蛋白凝块来促进止血。特别是在重度外科手术过程中可能需要促进受损组织的止血。除了损伤的组织的止血之外,还需要通过连接组织防止其开裂来加速、加强、甚至完成使用或不使用缝线的组织的自然愈合过程。当局部应用生物胶时,这是特别可行的。生物胶由凝血循环因子、特别是纤维蛋白原和因子xiii的混合物形成。它们还需要凝血酶的外源性辅助剂,即将纤维蛋白原转化为可通过因子xiii交联的不溶性纤维蛋白所需的酶。需要额外的组分来获得纤维蛋白原、特别是钙离子和任选的因为其抗纤维蛋白溶解性质被加入的抑肽酶的凝固。生物胶还可以用于将多种类型的生物材料(胶原蛋白、藻酸盐和聚乳酸)固定到生物组织上,以增强其机械性能,直到通过体细胞的天然再生发生固结为止,例如用于人造皮肤。生物胶还可用作随时间调配的储库,并且正如在用于吸收不同活性化合物例如抗生素、生长或细胞刺激因子时。商购可获得的生物胶是包含至少4种上述干燥形式的组分的试剂盒形式,其中凝血酶活化的蛋白质、纤维蛋白原和因子viii必须与凝血酶分离,因为其结合在极短时间内在液体重构和混合后约几秒钟产生聚合为纤维蛋白。这就是为何生物胶试剂盒至少是双组分的原因,即包含含有纤维蛋白原和因子xiii的包和含有凝血酶的另一个包。生物胶通过重构和混合两个包来满足上述功能,例如,使用注射器和针头,然后应用于待封闭的组织或通过喷洒到伤口上。然而,这类重构和混合是相对复杂的,并且是可能发生错误的来源,特别是在紧急情况下,因为一旦纤维蛋白原和凝血酶以液体形式接触,则在其它组分的存在下,几乎立即形成纤维蛋白。因此,纤维蛋白原-凝血酶混合仅在应用到伤口或手术部位之前立即或直接应用到伤口上才能进行。此外,如果使用单个生物胶分配装置,则在装置本身中存在纤维蛋白凝固的真正风险,这可能导致分配和应用系统的堵塞。此外,由于产品不稳定,在开始操作之前可能难以计划所需的体积。冻干产品的紧急重构伴随着产品稳定的等待时间,这可能对正确的外科手术进行有害。因此,上述缺点引起了问题,特别是当需要快速的护理时,在外科手术和/或紧急情况下。观察到这类缺点可能在组织粘附之前通过形成纤维蛋白簇而产生组织的非均匀连接,这可能进一步被凝块的皱缩加剧,最终导致不规则的瘢痕形成,使其自身开裂和继发性手术后出血。为了克服这些缺点,申请人开发了满足几个共同目的的生物胶。第一个目的是提供包含不含凝血酶的凝固因子的生物胶,其在应用于生物组织之前没有纤维蛋白形成的风险并且能够以均匀溶质的形式储存。第二个目的是提供具有增加的损伤组织的止血能力和用于组织连接,从而改善愈合的胶。申请wo2007080276描述了不含凝血酶并且包含纤维蛋白原、因子viia和钙离子源的单一化合物液体生物胶。然而,当血流趋向于分散生物胶并且将该胶从损伤部位或受损组织洗涤掉时,这种生物胶的功效可能在大量出血的情况下受到限制。申请人通过优化胶中组分纤维蛋白原和因子vii的浓度,开发了所描述的生物胶的改进制剂。新制剂对于损伤组织的止血更有效,并且可以在降低生产成本的同时改善愈合。此外,本发明的新生物胶有利地具有增加的粘合性能。申请人还研究了该制剂在组合物中包含至少一种胶凝剂,其允许减少或避免在出血时、特别是大量出血时生物胶在损伤部位之外分散的风险。申请人还表明,与不含胶凝剂的制剂相比,胶凝剂的存在进一步提高了所述生物胶在环境温度的稳定性。最后,申请人已经表明,纤维蛋白原浓度降低、特别是低于60mg/ml、对于fviia浓度为0.34-34ui/ml对于生物胶具有改善的粘合能力和止血特性是有利的。因此,生物胶中纤维蛋白原浓度与fviia浓度(浓度以重量/体积计)具有最佳比例,该比例为60000:1-1000:1。生物胶因此,本发明涉及用于治疗用途的无凝血酶的液体生物胶,其包含纤维蛋白原和因子viia,其中纤维蛋白原浓度与fviia浓度(浓度以重量/体积表示)之比为60000:1-1000:1。根据一些实施方案,该生物胶还包含钙离子源和/或至少一种胶凝剂。本发明还涉及用于治疗用途的无凝血酶的液体生物胶,其包含纤维蛋白原、因子viia和至少一种胶凝剂。根据一些实施方案,该生物胶还包含钙离子源。所述生物胶是药物组合物的形式,即“单一化合物”制剂,其中所关注的构成胶组分形成单一液体或待重构的冻干组合物,与现有技术中的双化合物胶相反。在本发明中,任何现有技术的纤维蛋白原(fbg)和活化因子vii(fviia)(优选重组体)都适用于生产所述胶,然而,条件是它们与钙离子相容,钙离子可加入到以液体形式获得的胶中,即它们的接触不会产生纤维蛋白原转化为纤维蛋白,特别是在使用前至少24小时。因此,两种活性成分纤维蛋白原和fviia必须不含残留的凝血酶(fiia),而且也不含凝固因子,在钙离子存在下它们会触发内部或外部凝固的级联。这类凝固因子是因子ii(fii)和因子x(fx),并且优选凝血酶原因子(因子ii、ix和x),并且特别是其活化形式。例如,纤维蛋白原中fii和fx的最大可接受含量对于其每一种约为0.1ui/g纤维蛋白原。优选地,所述胶的纤维蛋白原和fviia不来源于预活化的血浆。优选病毒安全的纤维蛋白原可以使用现有技术中已知的任何部分或完全血浆分级技术来制备。它可以是在ep0305243中描述的技术或申请人在专利申请fr0506640中开发的技术,其中可以获得纤维蛋白原浓缩物。还能够使用来自细胞系制备或转基因动物、特别是其乳的重组纤维蛋白原。也可以是根据专利申请wo95/23868、wo00/17234、wo00/17239或wo2009/134130中描述的方法制备和纯化的转基因纤维蛋白原,特别是在转基因牛的乳中制备的。术语“纤维蛋白原”包括可能存在的纤维蛋白原的所有天然等位基因变化形式和任何糖基化形式或程度或任何其它翻译后修饰。纤维蛋白原天然经历磷酸化、硫酸化和糖基化。与野生型的活性相比,术语“纤维蛋白原”还包括具有相似或更高生物活性的纤维蛋白原的变体,这些变体特别包括通过插入缺失或取代一个或多个氨基酸而与野生型纤维蛋白原不同的多肽。因子viia、特别是以浓缩物的形式、优选病毒安全的制剂也是已知的。例如,可以提及专利ep346241。还能够使用重组或转基因因子viia,特别是如文献fr0604872中所述。根据一个优选的实施方案,人因子viia在非-人的转基因哺乳动物乳中产生,所述非-人的转基因哺乳动物经遗传修饰以产生该蛋白质。优选地,其在转基因兔或山羊的乳中产生。通过乳腺分泌因子viia(允许其在转基因哺乳动物的乳中分泌)意味着组织依赖性控制因子viia的表达。这类控制方法在现有技术中是众所周知的。通过使用允许蛋白质在动物的特定组织中表达的序列获得表达控制。这些序列包含wap启动子、β-酪蛋白、β-乳球蛋白序列和肽信号序列。特别地,专利ep0264166中描述了从转基因动物的乳中提取目的蛋白质的方法。特别地,本发明中使用的因子viia可以是转基因兔的乳中产生的人因子viia,例如chevreux等人,glycobiology2013年12月;23(12):1531-46中所述。或者,因子viia可以通过来自bhk幼仓鼠肾细胞的遗传改造产生。例如,因子viia可以是因子viia,由丹麦公司novonordisk生产,自1996年在欧洲市场授权并且在1999年在美国市场授权。因子viia也可以是名为novoseven的novoseven变体。术语“因子viia”或“活化因子vii”还包含具有与野生型相似或比其更高生物活性的因子vii的变体,这些特别的变体包括通过插入、缺失或取代一个或多个氨基酸而与因子viia的野生型不同的多肽。根据一个实施方案,本发明的胶还包含因子xiii。因子xiii的外源性添加促进纤维蛋白网状结构的交联,并且由此促进其凝固和愈合力。优选地,当纤维蛋白原是重组形式时,所述生物胶包含fxiii。申请人已经观察到包含重组纤维蛋白原的生物胶导致凝固速率降低,并且形成的凝块的增幅和硬度降低,并且通过向该生物胶中加入fxiii可以部分或全部地抵消这种减少。根据一个实施方案,本发明的胶还包含钙离子源和因子xiii。可以使用现有技术开发的任何方法从血浆中分离因子xiii,优选是病毒安全的,并且可有利地在血浆分级时形成纤维蛋白原的伴随蛋白质。在这种情况下,优选使用专利申请fr0506640中描述的方法。还能够使用来自哺乳动物或酵母细胞系制备的重组因子viii,或转基因动物的乳中产生的转基因。然而,该活性成分必须满足与上述举出的相同的纯度标准,特别是在如果因子viii具有血浆来源时存在某些其它血浆因子的方面。根据另一个实施方案,所述生物胶不含除纤维蛋白原和fviia之外的任何凝固因子。所述胶具有仅需要两种凝固因子的优点,它们由于存在最小但有效量的活性组分而限制了工业规模的胶的制备成本。根据另一个实施方案,所述生物胶包含钙离子源,并且不含除纤维蛋白原和fviia之外的任何凝固因子。根据一个实施方案,本发明的胶还包含钙离子源。钙离子源是与临床使用相容的水溶性组分。优选地,这些组分是无机盐,例如氯化钙(cacl2)或葡萄糖酸钙。所述胶的组成组分以有效量被包含,使该胶满足期望的治疗目的。因此,所述生物胶有利地具有低于60mg/ml的纤维蛋白原含量。特别地,所述生物胶具有低于55mg/ml、低于50mg/ml、低于45mg/ml、低于40mg/ml、低于35mg/ml、低于30mg/ml、低于25mg/ml、低于20mg/ml、低于15mg/ml、低于10mg/ml或低于5mg/ml的纤维蛋白原含量。特别地,所述生物胶具有每ml生物胶0.1mg-60mg的纤维蛋白原含量,优选0.1-45mg/ml、更优选0.1-40mg/ml、0.2-60mg/ml、0.3-40mg/ml、0.5-30mg/ml、1-20mg/ml或甚至1-10mg/ml的纤维蛋白原含量。所述生物胶具有每ml生物胶0.1μg-10μg的fviia含量、更优选1-5μg/ml的因子viia(即3.4-16.7ui/ml)并且进一步优选为2-4μg/ml(即6.8-13.6ui/ml)。当存在时,因子xiii以2ui/ml-700ui/ml、优选2ui/ml-10ui/ml的比例被包含。当存在时,所述生物胶包含每ml生物胶2μmoles-30μmoles的钙离子源,更优选3-6μmole/ml的钙离子源。然而,申请人已经观察到,当特别地选择两种凝固因子纤维蛋白原和fviia的含量并且特别是其比例时,可以在上述举出的期望效果方面获得最佳结果。因此,在本发明的生物胶中,纤维蛋白原浓度与fviia浓度(浓度以重量/体积表示)之比为60000:1-1000:1,更优选为20000:1-1000:1,并且进一步优选为10000:1-1000:1。根据一个实施方案,本发明的生物胶的粘度在37℃高于1mpa.s。本发明的生物胶的粘度增加,并且相当于通过存在至少一种胶凝剂获得的粘度,所述胶凝剂的含量为0.01%-10%(重量/体积,即0.01-10克/100ml溶液),更优选为0.1-5%,或甚至为0.5-2%。根据一个实施方案,所述胶包含钙离子源,并且根据本发明的粘度在37℃高于1mpa.s。包含钙离子源的生物胶的粘度增加,并且相当于通过存在至少一种胶凝剂获得的粘度,所述胶凝剂的含量为0.01%-10%(重量/体积,即0.01-10克)/100ml溶液),更优选为0.1%-5%,或甚至为0.5-2%。在上述情况下,所述胶凝剂是药学上可接受的胶凝剂。在本发明中,胶凝剂是指胶凝剂和/或增稠剂。优选地,它是天然来源的化合物的衍生物,例如纤维素,优选所述胶凝剂是羟丙基纤维素。所述胶凝剂优选具有高于60kda、有利地为500-2000kda、更有利地为500-1000kda的分子量。例如,所使用的胶凝剂可以是药用级的klucelmf(ashland)。除了纤维素衍生物之外,胶凝剂还可以选自丙烯酸聚合物、壳聚糖、明胶、藻酸盐、角叉菜胶,以及它们的相应的衍生物,该列表是非限制性的。根据本发明的一个实施方案,可以使用几种胶凝剂的混合物。根据本发明的一个实施方案,包含钙离子的胶包含几种胶凝剂的混合物。浓度和活性以每毫升生物胶的最终液体溶液给出。所述溶液可以特别地通过重构冻干组分而获得。如上所述,优选以这样的浓度包含的这些因子确保了本发明生物胶的期望功能。本发明的液体生物胶是稳定的,因为其组分可以在液体介质的存在下因其功能用途而被包含,甚至在使用前至少24小时,而没有任何凝固过程的早期触发风险。因为在环境温度24小时的温育时间期间没有观察到纤维蛋白形成,所以验证了所述胶的稳定性。本发明的生物胶一旦应用于伤口或出血组织即可实现其组织修复功能,因为通过所述生物胶与伤口或出血组织接触就可以原位形成凝血酶。这种凝血酶的原位形成由因子viia确保,因子viia因此与所有血浆组分接触,允许通过外部或内部途径触发和发生凝固。如前所述,其生物活性取决于与内源性磷脂类型的组织因子的相互作用。在钙离子存在下,活化因子vii/组织因子复合物将血浆中所含的因子x转化为活化因子x,其由此将凝血酶原转化为凝血酶,所述凝血酶是在纤维蛋白原存在下通过生成纤维蛋白负责凝块形成的酶。然后发生纤维蛋白形成,并且增强所获得的生物胶的粘合能力,因为纤维蛋白直接形成在外科手术修复的伤口或组织上,其中磷脂细胞组分被暴露。尽管纤维蛋白原已经天然存在于血液中,但是即使与现有技术的胶相比,其添加通过本发明的生物胶进一步加强和加速组织连接和止血的过程。这形成了该胶的决定性优势。类似地,尽管钙已经天然存在于血液中,但是即使与现有技术的胶相比,其添加通过本发明的生物胶进一步加强和加速了组织连接和止血的过程。特别地,钙离子的添加作为fvii的辅因子起作用,并且原位增强了因子viia的活性。胶凝剂的添加促进了所述胶与伤口的接触。这种添加还能够在出血伤口、包括大量出血处限制所述胶的分散。本发明人已经观察到,添加胶凝剂能够提高所述胶的稳定性并且改善凝固效果。本发明的生物胶具有许多其它优点。其提供避免了在现有技术中、特别是在紧急情况下与生物胶的处理和制备有关的缺点,从而改善了在形成过程中瘢痕处开裂和不存在二次出血方面的组织封闭能力。例如,本发明的胶避免了由于可能在纤维蛋白形成之后,在接触和粘附伤口之前,胶的不均匀独立凝固而在伤口中看到的“包”或纤维蛋白簇的形成。与当使用首先基于包含因子xiii的纤维蛋白原混合物和第二基于含钙的凝血酶的混合物的双化合物生物胶时(没有达到该效果),同一时间段获得的粘结相比,形成的瘢痕还具有清晰的切割线。其制备简单,并且随着时间的推移具有增加的稳定性,因为在环境温度24小时没有观察到纤维蛋白形成。例如,它在环境温度至少24小时特别是至少2、4或6天是稳定的液体形式。如上所述,本发明的生物胶是备用的并且包含液体形式的所有组分的均匀混合物。它也可以是冻干形式,这意味着它可以以这种形式长时间储存至少2年,而不会在解冻时观察到任何纤维蛋白形成的风险。所述胶仅需要回到环境温度才能使用。本发明还涉及用于治疗用途的冻干形式并且能够长时间储存的无凝血酶的基于纤维蛋白原的生物胶,其包含因子viia,例如以上定义的。它可以通过实施用于冻干液体形式的胶的已知技术来获得。提供这种形式的胶具有决定性的优点,即仅需要在生物相容性溶剂或水性介质中仅重构包含凝固因子的冻干物以获得稳定的液体胶,该制备在计划使用之前进行。本发明还涉及用于治疗用途的冻干形式并且能够长时间储存的无凝血酶的基于纤维蛋白原的生物胶,其包含因子viia和钙离子源,例如以上定义的。它可以通过实施用于冻干液体形式的胶的已知技术来获得。提供所述形式的胶具有决定性的优点,即仅需要在生物相容性溶剂或水性介质中仅重构包含凝固因子和钙离子源的冻干物,以获得稳定的液体胶,该制备在计划使用之前进行。根据另一个实施方案,本发明还涉及冻干形式并且能够长时间储存的不含凝血因子的基于纤维蛋白原的生物胶,其包含因子viia和至少一种胶凝剂,例如以上定义的。它可以通过实施用于冻干液体形式的胶的已知技术来获得。提供所述形式的胶具有决定性的优点,即仅需要在生物相容性溶剂或水性介质中仅重构包含凝固因子和胶凝剂的冻干物,以获得稳定的液体胶,该制备在计划使用之前进行。根据另一个更特别的实施方案,本发明还涉及用于治疗用途的冻干形式并且能够长期储存的无凝血酶的基于纤维蛋白原的生物胶,其包含因子viia、钙离子源和至少一种胶凝剂,例如以上定义的。它可以通过实施用于冻干液体形式的胶的已知技术来获得。提供所述形式的胶具有决定性的优点,即仅需要在生物相容性溶剂或水性介质中仅重构包含凝固因子、钙离子源和胶凝剂的冻干物,以获得稳定的液体胶,该制备在计划使用之前进行。此外,所述冻干的胶在环境温度非常容易储存至少2年,而没有在重构后观察到纤维蛋白形成的风险。它们可以很容易地被运送到患者需要应用这些胶的位置。试剂盒本发明还涉及用于制备本发明的生物胶的试剂盒,其包含包装用具,该包装用具包含冻干的纤维蛋白原包、冻干因子fviia包和水性溶剂。本发明还涉及用于制备本发明的生物胶的试剂盒,其包含包装用具,该包装用具包含冻干的纤维蛋白原包、冻干因子fviia包、粉末形式的钙离子源包和水性溶剂。包含本发明胶的干燥形式的每种特别构成组分的不同单独包装物的所述试剂盒实际上是中间产品,其包装内容物可以容易地组合和溶解在生物相容的溶剂或水性介质中,例如纯化注射用水(pwi),以获得本发明的稳定的液体生物胶,必要时浓缩,然后可以冷冻。提供所述试剂盒的优点在于在环境温度将不同包装长期储存至少2年的可能性,而不会在重构后观察到任何纤维蛋白形成,以及仅通过溶解即可获得稳定的液体生物胶的优点。根据本发明的一个实施方案,所述试剂盒还包含至少一种干燥的胶凝剂组分。根据本发明的一个实施方案,所述试剂盒还包含粉末形式的钙离子源组分。根据本发明的一个实施方案,所述试剂盒包含至少一种干燥形式的胶凝剂组分和粉末形式的钙离子源组分。包装用具特别形成了允许胶组分储存、其使用前的制备和其调配的用具。它们还有利地包含用于每种组分的至少一种容器。每种容器旨在接收稍后溶解在水性溶剂中的组分之一。容器可以是生物相容性的玻璃和聚合物类型的多种材料的瓶子。优选地,所述包装用具可以有利地是包含所有组分的单个容器。所述包装具有的优点在于仅整体溶解就直接提供备用的液体胶。有利地,所述试剂盒还包含一旦通过将上述组分溶解在水性溶剂中制备则调配液体胶的装置。所述装置是例如适当体积的注射器,所述体积作为待递送胶剂量的函数,所述注射器包含典型地具有小于2mm、特别是小于1mm的直径的细针;否则就是常规的导管或喷雾装置,其允许将小体积的产品分配到大表面上;或可用于在伤口表面上铺展精确量的重构胶的刷子;否则就是保持所述胶在伤口上的生物相容性和/或可生物降解的织物。所述织物已经用重构的胶临时浸渍,或者可以在所述胶的存在下织造。使用后一种选择,将整合所述生物胶的化合物的织物随后备用并且使其直接沉积在伤口上。优选地,上述试剂盒包含含有所述冻干因子的混合物的多组分包。在一种变通实施方案中,该试剂盒包含本发明的凝固因子的冻干的混合物包和粉末形式的钙离子源包(其也可以是冻干物),这些只是需要在水性介质例如pwi水中合并和混合,然后使用。作为一种变通实施方案,所述试剂盒可以包含凝固因子的冻干混合物的包和水溶液形式的钙离子源包。有利地,该试剂盒还包含至少一种干燥形式或水溶液形式的胶凝剂,从而与钙离子源以混合物形成双组分包,或形成单独的包。优选地,本发明的试剂盒的特征在于如下事实:冻干的纤维蛋白原或fviia的每个包或所述冻干因子的混合物的双组分包包含药学上可接受的冻干稳定的制剂的组分。同样适用于冻干的生物胶。凝固因子的不同冻干物通过使用常规技术冻干因子或这些因子各自的浓缩物或液体溶液而获得,所述常规技术有利地包括用于该目的的冻干稳定的制剂。根据需要,稳定制剂可以包含本领域已知的稳定佐剂。因此,本发明还涉及使用本发明的试剂盒在制备液体生物胶中的用途,通过在生物相容的水性溶剂中重构所述组分、任选地随后冷冻来进行。治疗应用本发明还涉及用作药物的生物胶,例如以上描述的。特别地,本发明涉及用作药物的生物胶,其包含纤维蛋白原、活化因子vii,例如以上描述的。本发明还涉及用作药物的生物胶,其包含纤维蛋白原、活化因子vii和钙离子源,例如以上描述的。如果所述胶以冷冻形式储存,则在使用前解冻胶就足够。如果将所述胶单独冻干或与织物接触,则在生物相容性水性溶剂中重构允许使用它来获得期望的效果。如果胶是液体制剂或浸渍织物的形式,则将其备用。因此,本发明的生物胶被用于刺激恢复受损的生物组织例如皮肤或任何可能进行外科手术的器官(脾、肝、肺、肠、血管等)的止血和/或愈合,如上所述,这些受损的组织可以具有原始组织或出血性创伤,其出血甚至可能是轻微的,凝血级联所需的所有因子均存在。对于局部应用所述胶至出血部位,特别是原始组织或出血性伤口,所述胶可以单独使用,而不加入另外的凝固因子,例如,不添加血浆。所述胶可以在血浆的存在下用于制备药物,后者有利地预期用于治疗损伤的组织,例如,连接这些选自软骨、胶原、骨和骨粉的组织。此外,在血浆的存在下,还可以用于制备药物,所述的药物预期连接选自藻酸盐或聚乳酸的生物材料。因此,在某些情况下,血浆的存在对于外源性供应血浆因子以引发凝固级联是必要的,并且优选其是相容的或自体血浆。提供该供应可以特别地用于口腔学或牙科学中的常规外科手术。生物组织也可以衍生自培养和分化的干细胞。尽管本发明的胶是药物,特别是用于局部应用的敷料,即如上所述在伤口上等外部使用的敷料,但不排除该药物还可以是适合的胶囊,不管是否胃抵抗的,其中所述生物胶为干燥形式并且被摄取以治疗消化道出血。本发明的胶至少24小时的稳定性使其能够保持流动性,因此能够用于制备用于预期栓塞肿瘤靶的滋养血管的药物。这有利于通过使用常规导管的注射实现,只要这些肿瘤靶向“干燥”肿瘤。所述胶可通过用于显微外科手术(取样、活检、息肉切除等)的内窥镜系统获得止血。该胶的流动性特别是与其稳定性有关,这意味着它可以通过典型地直径小于1mm、特别是小于0.5mm的细针使用,以便应用于在显微镜下的手术中,例如眼科手术。以下附图和实施例示例本发明,但不限制其范围。附图图1显示胶凝剂、其浓度和纤维蛋白原(fbg)浓度对形成的凝块的总形成时间(ct+cft)的影响。图2显示胶凝剂、其浓度和纤维蛋白原浓度对形成的凝块的硬度的影响。图3显示胶凝剂、其浓度和纤维蛋白原浓度对形成的凝块的功效(凝块强度与凝块形成速率之比)的影响。图4给出了在没有胶凝剂的存在下、在不同浓度的纤维蛋白原的存在下关于胶的稳定性与总凝块形成时间(ct+cft)的相关性的研究。图5给出了在没有胶凝剂的存在下、在不同浓度的纤维蛋白原的存在下关于胶的稳定性与凝块硬度的相关性的研究。图6给出了在1%klucelmf的存在下、在不同浓度的纤维蛋白原存在下关于胶的稳定性与总凝块形成时间(ct+cft)的相关性的研究。图7给出了在1%klucelmf的存在下、在不同浓度的纤维蛋白原存在下关于胶的稳定性与凝块硬度的相关性的研究。图8示例了8种胶组合物在颈动脉区中15分钟时的粘合能力。图9示例了7种胶组合物在肝区中15分钟时的粘合能力。图10示例了5种胶组合物在脾区中15分钟时的粘合能力。图11示例了在切割和应用8种试验胶组合物之一后15分钟时以克计的肝出血量。图12示例了在切割和应用5种试验胶组合物之一后15分钟时以克计的脾出血量。图13示例了在切割和施用5种试验胶组合物之一后15分钟时以克计的肾出血量。实施例实施例1:有关胶凝剂类型的研究试验了4种化合物的胶凝能力:klucelhf(mw:1150kda)、klucelmf(mw:850kda)、plasdonec30(mw:58kda)和plasdonec17(mw:10kda)。需要强浓度的胶凝剂plasdonec30和plasdonec17(浓度高于30%,以g/ml溶液计)以获得令人满意的粘度,与klucelhf和klucelmf相反,其浓度为0.01-10%,得到胶制剂的主要增稠。因此,在klucelhf和klucelmf的存在下研究胶凝的胶的特性。实施例2:胶凝剂和纤维蛋白原浓度对总凝块形成时间的影响生物胶的胶凝通过rotem测定。rotem是血栓弹性测定法的量度,其系统地提供了几个参数:凝固时间(ct)和凝块形成时间(cft),表征溶液凝固迅速性的两个动力学参数。为了更简单,给出相当于这两个参数(ct+cft)的总和的值,其相当于总凝块形成时间。该系统还提供了反映最大凝块硬度(mcf,以mm计)的值。简言之,通过将粉末胶凝剂在25mmhepes缓冲液、175mmnaclph7.4中在环境温度重构16小时来制备胶凝剂溶液。由此制备2×胶凝剂浓溶液(1或2g/100ml)。第二天,将一定体积的该胶凝溶液(或阴性对照缓冲液)加入到先前相对于相同hepes缓冲液(稀释前为6-90mg/ml的纤维蛋白原溶液)透析的一定体积的2×浓纤维蛋白原溶液中。然后以最小体积(<1%总体积)以期望浓度(2-5μg/ml)加入fviia。预先对hepes缓冲液稀释fviia。通过在小rotem培养皿(500μl)中加入0.5pm组织因子、4μm磷脂、5%人血浆和5μmcacl2来启动试验。根据溶液密度的增加记录纤维蛋白形成。在每种条件下测量凝块形成时间和凝结时间的总和(图1)。在没有胶凝剂的情况下,纤维蛋白原浓度的增加导致凝块起始时间有规则地从1164秒缩短至300秒。在0.5%klucelhf的存在下,使用10mg/ml纤维蛋白原的时间保持高于没有胶凝剂存在时获得的时间,这种差异并不显著。在0.5%或1%klucelmf的存在下,凝块形成时间类似于没有胶凝剂的凝块形成时间,使用20mg/ml纤维蛋白原和0.5%klucelmf的时间甚至更低。因此,0.5-1%的klucelmf或klucelhf的存在不会显著地改变凝块形成时间。实施例3:胶凝剂浓度和纤维蛋白原浓度对凝块强度的影响如实施例2(图2)所述,通过rotem测量凝块硬度(mcf,以mm计)。在没有胶凝剂的情况下,凝块硬度随着纤维蛋白原浓度而有规则地增加,从使用3mg/ml纤维蛋白原的27mm增加到使用20mg/ml纤维蛋白原的93mm。0.5%klucelmf或klucelhf的存在不会显著地改变硬度,特别是在使用10mg/ml纤维蛋白原时和使用其之后。实施例4:胶凝剂浓度和纤维蛋白原浓度对凝块形成功效的影响凝块硬度(以mm计)与凝块形成速率(以秒计)之比允许以单一参数方式评价凝块形成的总体质量。计算该比值并且作为研究的不同参数的函数给出(图3)。在没有胶凝剂的情况下,该比值作为纤维蛋白原浓度的函数而有规律地增加,达到最大值为20mg/ml(比值=0.31)。在0.5%klucelhf的存在下,该比例用10mg/ml纤维蛋白原降低。在1%klucelmf的存在下,使用低浓度的纤维蛋白原(3和5mg/ml)比不存在纤维蛋白原时的比值更好。在0.5%klucelmf的存在下,相对于不含胶凝剂的溶液,这些比值得到总体维持。在20mg/ml纤维蛋白原的区域中观察到最佳结果。这些数据表明,klucelmf增稠剂在生物胶溶液中的存在不会影响纤维蛋白凝块的形成,同时增加了溶液的粘度。实施例5:对不同胶在最大凝块硬度(mcf)、凝结时间(ct)和凝块形成时间(cft)方面的稳定性的研究。通过rotem分析评估了几种胶制剂的稳定性。首先,制备并分析不含任何胶凝剂的生物胶的制剂。这些是在fviia存在下温育0-10天或其中fviia临时添加的10或20mg/ml纤维蛋白原的混合物。通过在5%人血浆的存在下加入诱导混合物(0.5pm组织因子、2μm磷脂、3mm钙)引发胶的聚合。溶液长达7天的温育不影响凝块的发生速率(ct+cft),无论fviia是否在(fbg-fviia)存在下温育或在测量时加入(fbg)(图4)。7天后,凝块形成时间在所有检查条件下均有规律地增加。无论fviia是否在纤维蛋白原存在下温育,凝块硬度在使用20mg/ml纤维蛋白原时最佳(图5,■和×)。在前7天,硬度没有变化,此后,在所有检查条件下随着时间的推移有规律地下降。由包含20mg/ml纤维蛋白原的混合物形成的凝块比由10mg/ml溶液形成的凝块更具抵抗性。通过向纤维蛋白原中加入1%(1g/100ml溶液)的klucelmf胶凝剂并且将其共同温育不同的时间重复类似的试验(图6和7)。胶凝剂的存在不会对形成的凝块的质量造成任何重大的改变。它甚至趋向于限制第7天至第10天之间的功效丧失。如前所述,由20mg/ml纤维蛋白原形成的混合物产生更具抵抗性和更快速形成的凝块。总之,可以将生物胶制剂在25℃温育达7天,而不会损失或降低其凝固功能。加入1%klucelmf可以在更长的时间期限内改善溶液的性能。实施例6:有关生物胶的8种制剂的体内研究在本研究中,在兔器官出血模型中试验了几种胶制剂。显示出8种试验制剂:胶a、胶b、胶c(相当于具有不同纤维蛋白原浓度的3种胶制剂)和溶液1、溶液2、溶液3、溶液4、溶液5(具有添加的胶凝剂的胶制剂),将所有这些溶液与安慰剂(缓冲溶液)进行比较。胶a:3mg/ml纤维蛋白原+2μg/mlfviia胶b:20mg/ml纤维蛋白原+2μg/mlfviia胶c:80mg/ml纤维蛋白原+2μg/mlfviia溶液1:3mg/ml纤维蛋白原+2μg/mlfviia+1%(w/v)klucelmf溶液2:20mg/ml纤维蛋白原+2μg/mlfviia+1%(w/v)klucelmf溶液3:10mg/ml纤维蛋白原(胞质来源)+2μg/mlfviia+1%(w/v)klucelmf溶液4:10mg/ml纤维蛋白原(转基因来源)+2μg/mlfviia+1%(w/v)klucelmf溶液5:10mg/ml纤维蛋白原(转基因来源)+2μg/mlfviia+1%(w/v)klucelmf+33μg/mlfxiii一级评价标准为器官出血,其通过器官损伤后失血量进行评估。二级评价标准是在颈动脉血管(无诱发伤口)和器官损伤边缘处观察到的粘合能力,分级为0-2(0=无粘合力,1=低粘合力,2=强粘合力)。这种双盲、随机化、对照研究包括总共48只体重约为3kg-4kg的雌性新西兰兔,将其分成5只动物(其中3只为试点(pilot)动物)一组的9个组:安慰剂组、胶a组、胶b组、胶c组、溶液1组、溶液2组、溶液3组、溶液4组和溶液5组。应用器官出血模型评估具有器官手术伤口的兔中的止血能力(限制出血能力)和粘合能力。整个试验在全身麻醉下进行。治疗顺序(胶或安慰剂)通过抽签进行。诱导麻醉后,将兔气管切开并且机械通气。首先,检查在颈动脉区中的粘合能力(无诱发出血)。在5和15分钟时,使用0-2的评分(0=无粘合能力,1=低粘合力,2=强粘合力)评价粘合能力。然后在中线xuphopubic剖腹术后检查器官出血,并且历经15分钟对于每个器官进行肝、脾、然后肾损伤采血。称重采集的失血。更详细地,在垂直于肝的游离边缘并且远离血管蒂形成前6个标准化切口。将止血产品应用于损伤。15分钟后,通过称重放置在肝下方和周围的压缩物来评估出血。将5分钟和15分钟时的粘合能力在0与2之间分级。类似地,在垂直于凸起的4个切口之后获得脾出血量,然后在每个肾上3次穿刺伤口后获得左右肾出血量。对于每个器官,在应用止血产品后,在15分钟时测量出血量,并且对于肝和脾,在5分钟和15分钟时对于粘合能力进行分级。本试验完成时,通过注射致死剂量的戊巴比妥来处死动物。3个试点动物允许对于每个器官的损伤类型和数量进行适应和标准化。表1:有关不同制剂的粘合能力的研究胶a和胶b在颈动脉和肝区中具有比安慰剂更强的粘合能力。具有最高纤维蛋白原含量的胶c在颈动脉区中仅具有比安慰剂显著更强的粘合能力。因此,具有低于60mg/ml的纤维蛋白原浓度的胶的应用通常能够使得该胶的粘合能力增加。表1二:对不同制剂的粘合能力的研究*:应用后5分钟和15分钟时的得分总和(两条颈动脉)**:应用后5分钟和15分钟时的得分总和中值(最小值-最大值)ns:无显著性溶液1-5在试验区域上具有比安慰剂更强的粘合能力(图8、9、10)。此外,胶凝剂的应用能够最有利地增加所述胶的粘合能力(胶a和胶b以及溶液1和2的比较)。表2:有关失血的研究表2二:有关失血的研究失血表示为中值(最小值-最大值)。“胶a”组中的肝出血在统计学上低于安慰剂组。由于溶液1组中的极值,所以“溶液1”组与安慰剂组之间无显著性差异(图11)。然而,在溶液3和4组中观察到倾向于肝出血减少的显著趋势。另外,不同组之间由于数值广泛分散而在脾出血方面没有显著性差异(图12)。然而,在溶液1和2组中观察到倾向于脾和肝出血减少的非显著性趋势。显而易见,溶液1和2能够减少肾出血,不过,对于溶液1,这种效果并不显著(图13)。通常,低于60mg/ml的纤维蛋白原浓度的应用似乎优选限制出血。在胶制剂中使用胶凝剂还可以减少出血,特别是在脾和肾区中减少出血。实施例7:有关愈合特性的体内研究在皮肤取样后,在猪中试验两种胶。用单独的或在包含45mg/ml纤维蛋白原的胶存在下包扎移植物。在全身麻醉下,使用取皮机从largewhitelandras猪背部采集4个皮肤样品(7cm×7cm×4,即身体表面积的约15%)。胶1包含20mg/ml纤维蛋白原、4μg/mlfviia和1%klucelmf,胶2包含45mg/ml纤维蛋白原、4μg/mlfviia和1%klucelmf。将两种胶与膜(smith&nephew,london,uk)联合进行试验,并且在第2、5和14天时将临床愈合进展与应用进行比较。包含藻酸钙的是常规用于伤口处置手术的止血敷料。仅在本文中用作本发明胶的底物,因为它有利地用作非粘合性敷料,并且本质上不包含任何愈合活性成分。“100%”愈合表示完全愈合。百分比表示占总损伤表面积(49cm2)的愈合表面积。表3给出了获得的结果。表3:作为治疗功能的愈合进展胶1(n=4)胶2(n=4)algostéril(n=3)第2天0%0%3%第5天82%52.5%5%第14天100%82.5%70%这些结果表明,与标准的敷料方法相比,所使用的胶能够极为显著地加速愈合过程。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1