改善眼的自觉症状的制剂和方法与流程
本发明涉及改善人眼的自觉症状的制剂和方法。
背景技术:
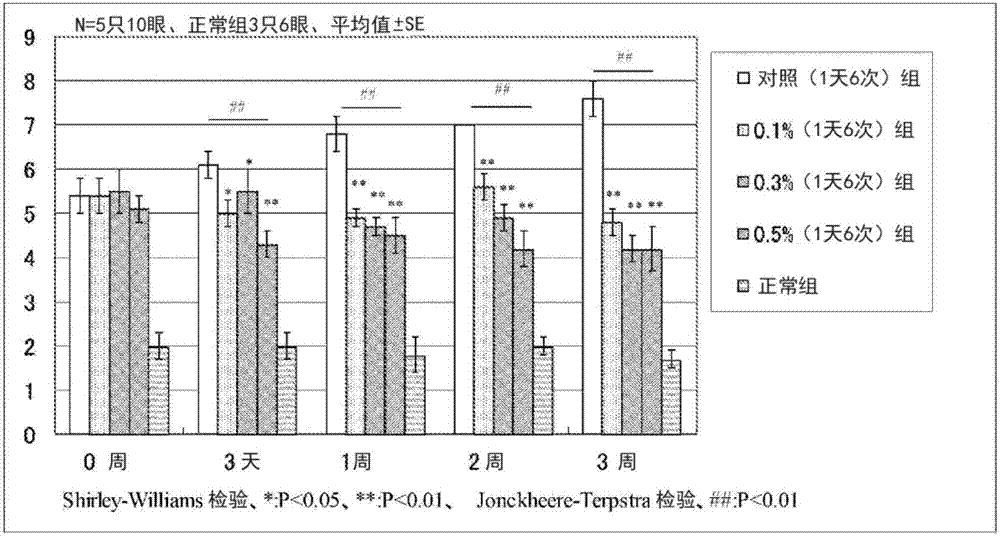
:以往,眼异常的改善以外部的观察、评价(他觉所见)为中心进行判断,未重视眼的不愉快感、不适感(自觉症状)之类的出于患者的主观观点的评价。例如,作为眼的异常之一的干眼症的改善效果以泪液量的正常化、角结膜上皮的异常部位的减少之类的他觉所见为中心进行评价。实际上,分别地,在日本有透明质酸钠、地夸磷索钠、瑞巴派特作为干眼症的处方滴眼药而被承认;在美国有环孢素作为干眼症的处方滴眼药而被承认,作为在他觉所见的改善的基础上,还满足自觉症状的改善的药物尚没有被承认。已知有键合有疏水基团的透明质酸对于干眼症等眼的异常(例如参照日本特表2009-511423号公报)的效果,但其效果如前述那样,完全基于“他觉所见”,尚未进行自觉症状的改善乃至治疗之类的观点上的评价本身。现有技术文献专利文献专利文献1:日本特表2009-511423号公报技术实现要素:发明要解决的问题他觉所见与自觉症状未必显示出同样的倾向,他觉所见即使良好自觉症状也有时不良,相反地,即使没有自觉症状他觉所见也有时不良。另外,现有的干眼症处方的滴眼药需要长时间地给予直至患者中其药效体现为止,症状重的干眼症患者中,存在强烈坚持长时间继续给予相同滴眼药的意思·意志本身丧失的问题,期望提供:给予开始后从初期体现药效的药剂。本发明的课题在于,提供用于改善人眼的自觉症状的制剂和方法。用于解决问题的方案本发明人等为了解决上述课题进行了深入研究,结果发现:透明质酸(以下也称为“ha”)共价键合有肉桂酸氨基烷酯的化合物发挥改善人眼的自觉症状的效果,完成了本发明。即,本发明提供一种人眼的自觉症状的改善剂(以下也称为“本发明制剂”),其含有:共价键合有肉桂酸氨基烷酯的ha。该制剂优选为溶液且以0.3%(w/v)的浓度含有共价键合有肉桂酸氨基烷酯的ha。另外,优选的是,被给予其的人是伴有干眼症的人。另外,本发明提供人眼的自觉症状的改善方法(以下称为“本发明方法”),其包括如下步骤:对人眼给予共价键合有肉桂酸氨基丙酯的ha。该共价键合有肉桂酸氨基丙酯的ha优选以其0.3%(w/v)的溶液进行给予。另外,被给予的人优选是伴有干眼症的人。发明的效果根据本发明,提供改善人眼的自觉症状的ha基质的制剂、和使用ha基质的化合物的人眼自觉症状的改善方法。附图说明图1示出将制剂1天1次给予至模型动物的眼时的荧光素染色的程度。图2示出将制剂1天6次给予至模型动物的眼时的荧光素染色的程度。图3示出将制剂给予至人患者的眼时的自觉症状(眼的不愉快感)的变化。图4示出将制剂给予至人患者的眼时的自觉症状(干燥感)的变化。图5示出将制剂给予至人患者的眼时的自觉症状(粗糙感)的变化。图6示出将制剂给予至人患者的眼时的各种自觉症状中最差的症状的变化。图7示出将制剂给予至人患者的眼时的全部自觉症状的平均值的变化。图8示出将制剂给予至人患者的眼时的自觉症状(眼的不愉快感、干燥感)的平均值的变化。图9示出将制剂给予至人患者的眼时的荧光素染色的程度。具体实施方式本说明书中“步骤”的术语,不仅为独立的步骤,而且与其他步骤无法明确区别的情况下,只要能够达成该步骤的所期望的目的就也包含于本术语中。另外,对于组合物中的各成分的含量,组合物中相当于各成分的物质存在多个时,只要没有特别限定,是指组合物中存在的该多个物质的总计量。以下,对本发明的实施方式进行说明。(1)本发明制剂本发明制剂为人眼的自觉症状的改善剂乃至改善用药物,其含有:共价键合有肉桂酸氨基烷酯的ha(以下称为“本化合物”)。(1-1)本化合物作为本发明制剂的有效成分的本化合物为共价键合有肉桂酸氨基烷酯和ha的化合物(透明质酸衍生物)。作为“肉桂酸氨基烷酯”,例如可以举出:肉桂酸氨基乙酯、肉桂酸氨基丙酯等。其中优选肉桂酸2-氨基乙酯、肉桂酸3-氨基丙酯,特别优选肉桂酸3-氨基丙酯。可以容易地理解为,包括以下的说明的、本说明书中的“肉桂酸氨基烷酯”的术语,包含这些具体的、乃至优选的肉桂酸酯、以及能够取代为其的物质。这样的“肉桂酸氨基烷酯”共价键合而成的ha只要为以n-乙酰基-d-葡糖胺与d-葡萄糖醛酸以β1,3键键合而成的二糖单元为构成单元并且该二糖单元通过β1,4键重复键合而构成的糖胺聚糖即可,没有特别限定。另外,可以为未形成盐的游离状态,也可以形成药学上能够允许的盐。作为ha的药学上能够允许的盐,可以举出:钠盐、钾盐等碱金属离子盐、镁盐、钙盐等碱土金属离子盐;铵盐等与无机碱的盐;二乙醇胺、环己基胺、氨基酸等与有机碱的盐。作为ha盐,更优选与碱金属离子的盐,特别优选与钠离子的盐。ha可以为能够从鸡冠、脐带、软骨、皮肤等生物体的一部分提取而得到的天然物来源的ha、经过化学合成的ha、通过微生物的培养或基因工程学方法而生产的ha的任意者。需要说明的是,本化合物给予至生物体,因此,本化合物当然优选的是,作为其原料的ha也是实质上不含有以药物的形式不允许混入物质的高纯度的物质。ha的重均分子量没有特别限定,例如可以举出1万~500万。ha的重均分子量可以举出:优选为20万~300万、更优选为50万~250万。需要说明的是,ha的重均分子量可以利用特性粘度法测定。通过使这样的ha与肉桂酸氨基烷酯共价键合,可以制造本化合物。该共价键的样式也没有限定,优选肉桂酸氨基烷酯的氨基与ha的羧基进行酰胺键的样式。以下,列举该共价键为酰胺键的本化合物作为例子进行说明。本化合物中,ha中的羧基无需全部与肉桂酸氨基烷酯进行酰胺键合,也可以是其一部分进行酰胺键合。以下,将ha中存在的全部羧基中的形成酰胺键合的比率称为“导入率”(ds)。ds以ha的每个构成二糖单元的肉桂酸氨基烷酯残基的导入的比率(%)计算。例如,每个构成二糖单元导入了1个肉桂酸氨基烷酯残基的ha衍生物、以及每200个糖(以构成二糖单元计为100个)导入了1个肉桂酸氨基烷酯残基的ha衍生物的ds分别为100%和1%。作为本化合物中的优选的ds,可以举出:3~30%、更优选10~20%、进一步优选12~18%。本化合物可以通过将源自构成肉桂酸氨基烷酯的氨基烷醇(例如氨基乙醇(2-氨基乙醇等)、氨基丙醇(3-氨基丙醇等))的氨基与ha的羧基进行酰胺键合来制造。上述肉桂酸氨基烷酯为肉桂酸的羧基与氨基烷醇的羟基通过酯键键合而成的酯化合物。需要说明的是,构成肉桂酸氨基烷酯的肉桂酸也可以为具有取代基的取代肉桂酸。本化合物可以依据日本特开2002-249501号公报、wo2008/069348号小册子等中记载的方法而制造。制造方法例如只要为能够使肉桂酸氨基烷酯与ha通过酰胺键以化学方式键合的方法就没有特别限定。作为制造方法,例如可以举出:使用水溶性碳二亚胺(例如1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edci·hcl)、1-环己基-3-(2-吗啉代乙基)碳二亚胺-间-对甲苯磺酸盐)等水溶性缩合剂的方法;使用n-羟基琥珀酰亚胺(hosu)、n-羟基苯并三唑(hobt)等缩合辅助剂与上述缩合剂的方法;使用4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基氯化吗啉鎓(dmt-mm)等缩合剂的方法;活性酯法;酸酐法等。本化合物可以预先使肉桂酸与氨基烷醇(例如3-氨基丙醇。以下相同)反应制备肉桂酸氨基烷酯(例如肉桂酸3-氨基丙酯。以下相同),使该肉桂酸氨基烷酯的氨基与ha的羧基进行酰胺键合而制备,也可以使氨基烷醇的氨基与ha的羧基进行酰胺键合而制备导入了氨基烷醇的ha,之后,使肉桂酸的羧基与前述导入了氨基烷醇的ha中的源自氨基烷醇的羟基进行酯键合而制备。(1-2)制剂化本发明制剂可以通过含有共价键合有肉桂酸氨基烷酯的ha并进行制剂化而制造。制剂化的方法只要能够形成给予至人眼的制剂乃至药物就没有特别限定,优选为溶液形态。该溶液优选为眼用溶液乃至滴眼溶液。另外,本化合物如后述那样,以0.3%(w/v)的浓度发挥显著乃至质变的效果,因此,本发明制剂特别优选为溶液且以0.3%(w/v)的浓度含有本化合物的方案。这样的制剂化时,本领域技术人员可以根据需要适当实施:添加药学上允许的载体;进行灭菌;填充至适于对人眼给予的容器等。本发明制剂中,例如可以根据需要选择并添加:磷酸钠、磷酸氢钠、磷酸二氢钠、乙酸钠、ε-氨基己酸等缓冲化剂;氯化钠、氯化钾、浓甘油等等渗剂;聚氧亚乙基失水山梨醇单油酸酯、硬脂酸聚烃氧酯40、聚氧乙烯氢化蓖麻油等表面活性剂;苯扎氯铵等防腐剂等。另外,本发明制剂的ph只要处于作为眼科制剂允许的范围内即可,优选为ph5~6的范围。(1-3)本发明制剂的使用方法本发明制剂可以通过将其给予至人眼而使用。本发明制剂对人眼的给予只要以对人眼的给予的形式以医学上允许的方式进行、且能够发挥本发明的效果就没有特别限定。给予的具体方法没有特别限定,可以根据制剂形态而适当给予,可优选示例滴眼。另外,本发明制剂的给予的次数·频率等没有特别限定,优选示例1天1~6次、1天4次左右的给予、每天给予、14天以上的每天连续给予、28天以上的每天连续给予等,更优选示例它们的组合(例如1天4次左右且每天给予、1天4次左右且14天以上每天的连续给予、1天4次左右且28天以上的每天连续给予)。另外,作为1次的给予量,可以示例1、2乃至3滴的给予量。通过对人眼给予本发明制剂,可以改善人眼的自觉症状。作为给予对象的人只要是有眼的自觉症状的人就没有特别限定。另外,给予的目的也只要以改善人眼的自觉症状为目的就没有特别限定。本说明书中的“眼的自觉症状”没有特别限定,可以举出:眼的不愉快感(oculardiscomfort)(不包括制剂对眼的给予其本身所导致的物理刺激等不愉快感。例如包括干眼症患者通常感到的不愉快感)、干燥感(dryness)(为眼干的感觉)、灼热感(burning)(为眼热而刺痛那样的感觉)、异物感(foreignbody)(为眨眼时接触某物那样的不适感、眼滚动的感觉)、粗糙感(grittiness)(为眼的表面不光滑的感觉,例如为沙子进入眼那样的感觉)、针刺感(stinging)(是指感到用针刺那样的疼痛)、蒙胧感、发痒、光晃眼、物模糊可见的、物体昏暗可见等症状,可以对这些1个或2个以上的症状应用本发明制剂。本发明制剂特别是对选自由眼的不愉快感、干燥感、灼热感、粗糙感、针刺感组成的组中的1个或2个以上的自觉症状、其中对选自由眼的不愉快感、干燥感、灼热感、粗糙感组成的组中的1个或2个以上的自觉症状、尤其是对选自由眼的不愉快感、干燥感、粗糙感组成的组中的1个或2个以上的自觉症状是有效的,因此,优选对有这些自觉症状的人给予,另外,优选以改善这些症状为目的而给予。本发明制剂特别是给予开始后迅速地发挥自觉症状的改善效果,对给予开始后初期时的自觉症状的改善是有效的,因此,也优选用于这样的给予开始后初期时的自觉症状改善的目的。对于本说明书中“给予开始后初期”,可以示例给予开始后数周为止的期间,可以优选示例以给予开始日为第0天,第13天左右为止的期间,可以进一步优选示例第6天左右为止的期间。另外,本说明书中“给予刚刚开始后”是指,给予开始的第二天。人眼的自觉症状中,眼的不愉快感和干燥感作为干眼症患者的自诉病状是最多的,占整体的约80%。通过从给予开始后初期、特别是给予刚刚开始后改善该症状,从而可以促进基于干眼症患者的自发的给予的继续,确实地发挥所期待的治疗效果。如后述的实施例所示那样,本发明制剂在这些自觉症状评分的平均值的解析中,从给予刚刚开始后和给予后初期就体现药效,因此,本发明制剂可以期待基于患者本身的自发给予的继续和治疗效果。另外,本发明制剂特别是对强烈感到前述的自觉症状的人(自觉症状强的人、例如自觉症状最强的平均评分显示出2.5以上的人)的、该症状的改善有效,因此也优选对这样的人以这样的目的进行给予。此处所谓“评分”如后述的实施例中所说明那样是指,给予的人本身按照自己的知觉的情况,评价前述各种感觉的0(没有自觉症状)~5(自觉症状最强)的分数。针对该各种感觉的评分中,分数最高为平均2.5以上的人为“自觉症状最强的平均评分显示出2.5以上的人”。另外,给予了本发明制剂的人优选伴有干眼症(本说明书中,与干眼症疾病、干眼症症候群为相同含义)的人。本发明制剂例如对一天中严重用眼,认为自觉症状最强体现的就寝前(beforebedtime)的自觉症状的改善是特别有效的,因此,可以以改善这样的就寝前的自觉症状为目的而使用。本说明书中自觉症状的“改善”是指,自觉症状的减少。自觉症状的改善可以根据自觉症状的评分的减少而定量地评价。(2)本发明方法本发明方法为一种人眼的自觉症状的改善方法,其包括如下步骤:将本化合物(当然也包括为本发明制剂的形态的物质)给予至人眼。本发明方法可以依据前述“(1)本发明制剂”的说明而同样地实施。因此,例如,优选以0.3%(w/v)的溶液给予本化合物、给予的人优选伴有干眼症等也与前述同样。本发明包括:本化合物在改善人眼的自觉症状中的应用;和本发明制剂在改善人眼的自觉症状中的应用。实施例以下,根据实施例对本发明进行说明。然而,本发明的保护范围不由此限定。[实施例1]共价键合有肉桂酸氨基烷酯的ha的制备以重均分子量88万(用特性粘度法测定)的ha为起始原料,依据日本特开2002-249501号公报的实施例2中记载的方法,制备共价键合有肉桂酸氨基丙酯的ha。以下,将该“共价键合有肉桂酸氨基丙酯的ha”简记作“ha-3apc”。对制造的ha-3apc用日本特开2002-249501号公报的实施例中记载的方法进行分析,结果,ha的每个重复二糖单元的肉桂酸氨基丙酯的导入率为15.3%。[实施例2]滴眼药的制备1在实施例1中制备的ha-3apc(受试物质)中加入磷酸缓冲生理食盐液(pbs),制备ha-3apc的0.5w/v%、0.3w/v%和0.1w/v%的各溶液,然后用0.22μm过滤器进行过滤灭菌,将它们作为滴眼药。以下,将这些滴眼药分别称为0.5%受试物质溶液、0.3%受试物质溶液、0.1%受试物质溶液。[参考例1]使用干眼症疾病模型动物的试验(1)模型动物的制作用二乙醚对7周龄的sd系雄性大鼠(spf)进行轻麻醉,然后在异氟烷吸入麻醉下剪去左右两侧的颊部的毛。将剪去了毛的部分用70%乙醇水溶液消毒,然后,将耳的下方约7mm的部分沿纵向切开约7mm,摘除两眼的眼窝外泪腺。接着,在切开伤面部分涂布抗菌剂(泰利必妥(注册商标)眼软膏),缝合伤面,然后将缝合部用10%聚维酮碘液消毒。从该泪腺摘除2个月后,在异氟烷吸入麻醉下,使用フローレス(注册商标)试验纸(昭和药品化工株式会社),对两眼的角膜上皮进行荧光素染色。由此,角膜上皮的缺损部分(损伤部分)被荧光素染色。在裂隙灯(sl-d7、topconcorporation社制)开灯下,将角膜整体以肉眼从上分为三份,对于该各部分,按照以下基准,对角膜上皮损伤的程度进行评分化(每1个眼变成9分满分)。各个体的评分用两眼的平均值表示。另外,用数字拍摄单元拍摄评分化的各个体的角膜整体。(基准)0点:没有点状染色1点:疏(点状的荧光素染色分离)2点:中间(疏与密的中间)3点:密(点状的荧光素染色基本相邻)(2)分组将如上述制作并评分化的模型动物以组间的平均评分成为相同的方式分为表1所示的9个组。[表1]组名给予物质动物(眼)数给予量给予次数/天对照(1天1次)组pbs5只(10眼)1次5μl1次对照(1天6次)组pbs5只(10眼)1次5μl6次0.1%(1天1次)组0.1%受试物质溶液5只(10眼)1次5μl1次0.3%(1天1次)组0.3%受试物质溶液5只(10眼)1次5μl1次0.5%(1天1次)组0.5%受试物质溶液5只(10眼)1次5μl1次0.1%(1天6次)组0.1%受试物质溶液5只(10眼)1次5μl6次0.3%(1天6次)组0.3%受试物质溶液5只(10眼)1次5μl6次0.5%(1天6次)组0.5%受试物质溶液5只(10眼)1次5μl6次正常无3只(6眼)无无(3)试验方法依据表1对各组给予给予物质。给予使用连续分注器(multipetteplus、eppendorf公司制)通过滴眼来进行。需要说明的是,1天6次给予的组以1.5小时间隔1天共计6次;对于1天1次给予的组,与1天6次给予的组的初次给予相符合地1天1次,分别进行给予,将其继续共计21天(3周)。在给予刚刚开始后(第0周)、第3天、第1周、第2周和第3周,分别评价角膜上皮损伤的程度。评价依据前述的基准,在遮挡下进行评分化,从而进行。各组的结果用平均值土标准偏差表示。对于给予了受试物质溶液的组的、各评价时刻时的各组的评分,根据shirley-williams检验和jonckheere-terpstra检验确认用量反应性。均使显著性水平低于5%为显著。(4)试验结果将结果示于图1和图2。基于shirley-williams检验的用量反应性检验中,1天1次给予的组(图1)中,对于给予了0.5%的组,第3天以及以后的全部评价时刻下,对于给予了0.1%的组和给予了0.3%的组,在第1周和第3周,分别相对于对照(1天1次)组是显著的。另外,1天6次给予的组(图2)中,对于给予了受试物质的全部组,第3天以及以后的全部评价时刻下,相对于对照(1天6次)组是显著的。另外,基于jonckheere-terpstra检验的用量反应性的倾向检验中,1天1次给予的组(图1)中,在第3天、第2周和第3周,jonck统计量是显著的;1天6次给予的组(图2)中,在全部评价时刻下,jonck统计量是显著的。1天1次给予、1天6次给予在作为最终评价时刻的第3周的两个检验均是显著的,因此,无论1天的给予次数,均显示出有用量反应性。[实施例3]滴眼药的制备2在实施例1中制备的ha-3apc中添加基材(作为等渗剂的氯化钠、氯化钾;作为缓冲剂的磷酸氢钠、磷酸二氢钠;作为稳定化剂的依地酸二钠和作为防腐剂的0.003%的苯扎氯铵),以成为ph5.0~6.0的方式进行调整,制备0.5w/v%和0.3w/v%的各ha-3apc水溶液后,用0.22μm过滤器进行过滤灭菌,将其作为滴眼药。以下,将它们分别称为0.5%滴眼药、0.3%滴眼药。另外,将不含有ha-3apc的基材水溶液作为安慰剂。[实施例4]以干眼症患者为对象的使用cae(注册商标)模型的临床试验(1)受试者将全部满足下述条件a)~c)的人作为受试者。a)18岁以上b)书面同意了知情同意书c)两眼均有干眼症的既往病史其中,属于以下的a)~d)中的任1者的人排除在试验之外。a)使用隐形眼镜的人b)控制不良的全身性疾病的患者c)控制不良的精神疾病、药物或酒精依赖症的患者d)哺乳中、妊娠中或计划妊娠的女性(2)试验方法在较低地维持湿度、温度、风的流动、照明、和使用眼的作业得到控制的环境下进行试验的、作为眼科领域中确立的治疗评价体系的cae(注册商标)模型(controlledadverseenvironment(cae(注册商标))模型、ora,inc,andover,ma,usa)(参照georgew.ousleretal.annallergyasthmaimmunol.2004;93:460-464)下,进行多中心随机双盲比较试验。首先,作为对试验的导入,对受试者的两眼分别以每1次1滴、1天4次(早上、中午、午后、晚上就寝前)滴眼安慰剂,将其继续导入期间(2周)。对于受试者,在该滴眼期间中的每天、就寝时(就寝前的滴眼前),针对各眼的自觉症状(眼的不愉快感、干燥感、灼热感、粗糙感和针刺感),依据自己知觉进行评分,将其记录于日志。评分设为0(无自觉症状)~5(自觉症状最强)。(3)滴眼药的给予之后,对受试者的两眼,分别以每1次1滴、1天4次(早上、中午、午后、晚上就寝前)滴眼实施例3中制备的0.5%滴眼药、0.3%滴眼药或安慰剂,将其继续4周。对于受试者,在滴眼期间中的每天、就寝时(就寝时的滴眼前),与前述同样地进行评分,将其记录于日志。(4)结果对强烈感到(最强的(分数高)自觉症状评分(worstsymptomscore)的平均为2.5以上)滴眼药给予开始的即将开始期(滴眼药给予开始的7天前~1天前的期间)自觉症状的受试者进行评价,将给予期间中的经时变化进行作图化。该评价使用与各给予组中的第0天进行的滴眼的即将开始期(滴眼药给予开始的7天前~1天前的期间)的自觉症状评分平均值(基线)的差。另外,该评价使用各评价时刻中的、各给予组的、对于各自觉症状的评分的平均值。将结果示于图3~图8。需要说明的是,这些结果是1天中持续用眼的疲劳蓄积的时刻即“就寝时(就寝时的滴眼前)”的结果,是认为自觉症状最强出现,对睡眠也可能有较大影响的时刻。即,以下的结果是对于自觉症状强的患者、在认为1天中症状最强出现的时刻进行评价的。需要说明的是,给予了0.5%滴眼药、0.3%滴眼药、安慰剂的各组的数量分别为23、26、26。(4-1)眼的不愉快感将结果示于图3。解析的结果可见,0.3%滴眼药组中,在以下的期间可见相对于安慰剂组统计学显著性自觉症状的减少。·第0天~第6天(p=0.0219、t-test(t-检验);p=0.0249、ancova)·第0天~第13天(p=0.0143、t-test;p=0.0210、ancova)·第0天~第20天(p=0.0387、t-test)·第7天~第13天(p=0.0233、t-test;p=0.0407、ancova)另一方面,0.5%滴眼药组仅在第21天~第27天的期间,可见相对于安慰剂组统计学显著性差异(p=0.0306、检验方法:t-test)。如此,0.3%滴眼药显示出如下令人惊奇的结果:对于人眼的自觉症状(眼的不愉快感),在滴眼药给予开始后初期(第0天~第20天)体现改善效果,且其效果比0.5%滴眼药优异。(4-2)干燥感将结果示于图4。解析的结果,0.3%滴眼药组中,在以下的期间可见相对于安慰剂组统计学显著性自觉症状的减少。·第0天~第6天(p=0.0480、t-test)·第0天~第13天(p=0.0173、t-test;p=0.0259、ancova)·第0天~第20天(p=0.0466、t-test)·第7天~第13天(p=0.0140、t-test;p=0.0240、ancova)·第0天~第27天(p=0.0365、wilcoxonranksum)另一方面,0.5%滴眼药组中,未见统计学的显著差异。如此,0.3%滴眼药显示出如下令人惊奇的结果:对于人眼的自觉症状(干燥感),在滴眼药给予开始后初期(第0天~第27天)体现改善效果,且其效果比0.5%滴眼药优异。(4-3)粗糙感将结果示于图5。解析的结果,0.3%滴眼药组中,在第0天~第13天的期间可见相对于安慰剂组统计学显著性自觉症状的减少(p=0.0286、wilcoxonranksum)另一方面,0.5%滴眼药组中,未见统计学的显著差异。如此,0.3%滴眼药显示出如下令人惊奇的结果:对于人眼的自觉症状(粗糙感),在滴眼药给予开始后初期(第0天~第13天)体现改善效果,且其效果比0.5%滴眼药优异。(4-4)最强的自觉症状评分图6示出各患者中的各自觉症状(眼的不愉快感、灼热感、干燥感、粗糙感和针刺感)中、最强者(症状评分高者)的结果。解析的结果,0.3%滴眼药组中,在以下的期间可见相对于安慰剂组统计学显著性自觉症状的减少。·第0天~第13天(p=0.0232、t-test;p=0.0324、ancova)·第7天~第13天(p=0.0204、t-test;p=0.0308、ancova)另一方面,0.5%滴眼药组中,未见统计学的显著差异。如此,0.3%滴眼药显示出如下令人惊奇的结果:对于人眼的自觉症状中最强者,在滴眼药给予开始后初期(第0天~第13天)体现改善效果,且其效果比0.5%滴眼药优异。(4-5)自觉症状评分的平均值图7为对各患者中的各自觉症状(眼的不愉快感、灼热感、干燥感、粗糙感和针刺感)的评分的平均值进行解析的结果。0.3%滴眼药组中,在以下的期间可见相对于安慰剂组统计学显著性自觉症状的减少。·第0天~第6天(p=0.0481、t-test)·第0天~第13天(p=0.0404、t-test;p=0.0422、ancova)·第7天~第13天(p=0.0148、wilcoxonranksum)另一方面,0.5%滴眼药组中,未见统计学的显著差异。如此,0.3%滴眼药显示出如下令人惊奇的结果:对于人眼的全部自觉症状,在滴眼药给予开始后初期(第0天~第6天)体现改善效果,且其效果比0.5%滴眼药优异。(4-6)自觉症状评分(眼的不愉快感、干燥感)的平均值图8为对各患者中的各自觉症状(眼的不愉快感、干燥感)的评分的平均值进行解析的结果。0.3%滴眼药组中,在以下的期间和天,可见相对于安慰剂组统计学显著性自觉症状的减少。·第0天~第13天(p=0.0111、t-test;p=0.0080、wilcoxonranksum;p=0.0138、ancova)·第1、4、5、8、9、10天(分别地p=0.0235、0.0066、0.0046、0.0018、0.0313、0.0145、t-test)另一方面,0.5%滴眼药组中,未见统计学的显著差异。如此,0.3%滴眼药显示出如下令人惊奇的结果:对于人眼的自觉症状中、由患者主诉的自觉症状特别多的、眼的不愉快感、干燥感的平均值,在滴眼药给予刚刚开始后(令人惊奇地是,在滴眼药给予的开始第二天)体现效果,另外,在滴眼药给予开始后初期(第0天~第13天)体现改善效果,且其效果比0.5%滴眼药优异。(5)cae(注册商标)前后的荧光素染色评分的变化对于第28天的各受试者,对cae(注册商标)前后的、角膜整体和角结膜整体的荧光素染色(角结膜上皮异常部位的染色)评分的变化进行评价。将结果示于图9。解析的结果,在0.3%滴眼药组中,角膜整体和角结膜整体这两者中,可见相对于安慰剂组统计学显著性染色评分的减少。另一方面,在0.5%滴眼药组中,角膜整体和角结膜整体任一者中,未见统计学的显著差异。如此,0.3%滴眼药显示出如下令人惊奇的结果:体现降低人眼的角结膜上皮损伤的发生的效果,且其效果比0.5%滴眼药优异。(6)安全性评价在0.3%滴眼药组、0.5%滴眼药组与安慰剂组之间,对于全身性的有害现象发现率、眼部的有害现象发现率和副作用发现率中任一者均未见统计学显著性差异,未见担心ha-3apc的安全性的现象。日本国专利申请2001-385072号(申请日:2001年12月18日)、日本国专利申请2008-519554号(申请日:2006年10月12日)和日本国专利申请2014-263710号(申请日:2014年12月26日)的公开内容的整体作为参照引入至本说明书。本说明书中记载的全部文献、专利申请和技术规范,与具体且分别记载各文献、专利申请和技术规范作为参照被引入的情况同等程度地作为参照引入至说明书。产业上的可利用性本发明制剂作为改善人眼的自觉症状的制剂可以在产业上利用,本发明方法作为使用ha基质的化合物的人眼的自觉症状的改善方法可以在产业上利用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1