万古霉素的水溶液制剂的制作方法
相关申请的交叉引用
本申请要求2015年2月6日提交的第61/113,322号美国申请的优先权,所述申请的公开内容出于所有目的通过引用特此将其整体并入。
发明领域
本发明涉及包含万古霉素、色氨酸和水的溶液组合物,其用于治疗和预防感染。
发明背景
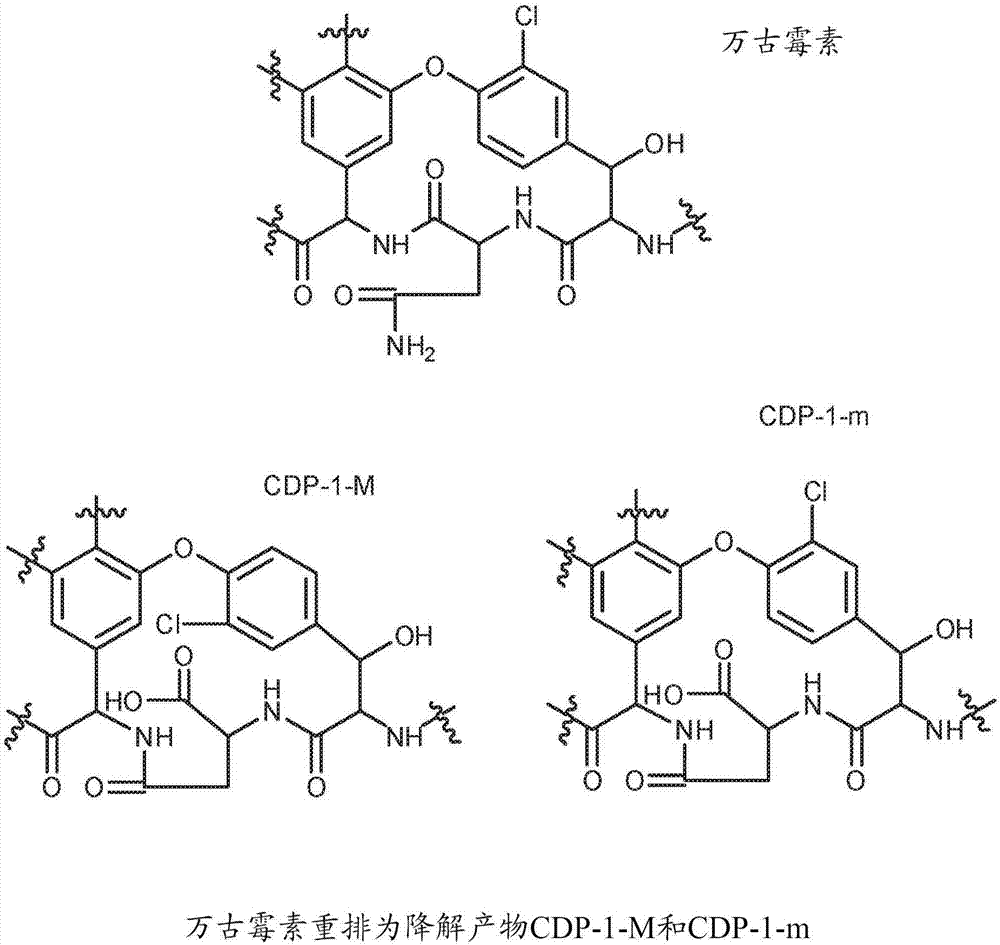
万古霉素是重要的抗生素,其通常是用于治疗葡萄球菌感染或由革兰氏阳性菌、特别是耐甲氧西林葡萄球菌菌株(mrsa)引起的其它感染的处方药。万古霉素(图1)在水中降解为许多产物,包括它的主要降解产物,其被称为万古霉素cdp-1或cdp-1-m和cdp-1-m(被共同称为cdp-1s)(参见sheldrick等人,nature271:223,1978,harris等人,j.am.chem.sci.1983,105,6915-6922)。cdp-1形成涉及万古霉素结构中天冬酰胺部分的水解、脱酰胺和重排(图2)。cdp-1s在水中是不溶的并且易于从溶液中沉淀,使得溶液对于注射是不安全的。尽管充分阐述了万古霉素降解途径和cdp-1s的结构,但是通常不存在可利用的抑制水中形成cdp-1或抑制万古霉素降解的方法。迄今为止,因为万古霉素在水中的有限的稳定性,液态的、水性的和即用型的万古霉素药物产品是不可得的。
目前,将万古霉素配制为用于口服给药的胶囊中的干粉、填装在小瓶中的无菌干粉或用于肠胃外用途的冷冻液体制剂来用于医药用途。填装在小瓶中的干粉通过冻干法来生产,并且在其可以被注射前必须溶于水中。冷冻液体在使用前需要进行解冻和升温至室温。两种形式在制造、分配和储存上成本高并且不方便,因为它们不是即用型的形式。因此,水性的即用型的万古霉素溶液制剂是非常需要的。溶液制剂将通过消除对冻干的需要而具有降低的制造成本。可以降低配药时间和人力及其成本,因为既不需要重组干粉也不需要冷冻储存。
由于cdp-1s的快速产生,由目前市售产品制备的溶液(即,由万古霉素干粉重组的溶液或由冷冻溶液解冻的溶液)在数小时或数天内将不能通过由美国药典(usp)对万古霉素注射所规定的杂质和/或颗粒物质质量标准。对于在水中的万古霉素,cdp-1s的形成是限制其贮存期的降解途径。
因此,期望万古霉素在其中是稳定的溶液制剂。此外,此类稳定的万古霉素溶液制剂能够开发用于局部、眼部、耳部、鼻内、滴注或阴道内给药途径的万古霉素的其它剂型以用于通常需要即用型溶液的应用中。
wo1997019690a1公开了万古霉素盐酸盐的稳定溶液,其包含约0.5%w/v至约12%w/v万古霉素盐酸盐和约0.5%v/v至约30%v/v乙醇。这些溶液特别用于以液态来储存,不需要冷冻或冷冻干燥以维持活性剂的稳定性。在该专利中未提及使用色氨酸作为万古霉素的稳定剂。
wo2014085526a1教导了稳定的、基于脂质的糖肽抗生素组合物,其包含:(a)脂质组分;(b)糖肽抗生素组分;以及(c)氨基酸或其衍生物,其中所述氨基酸或其衍生物使糖肽抗生素稳定。适用于此发明的示例性的氨基酸和氨基酸衍生物包括丙氨酸(ala)、d-丙氨酸(d-ala)、丙氨酸-丙氨酸(ala-ala)、β-丙氨酸(bala)、丙氨酸-β-丙氨酸(ala-bala)、3-氨基丁酸(3-aba)、γ-氨基丁酸(gaba)、谷氨酸(glu或glut)、d-谷氨酸(d-glu)、甘氨酸(gly)、甘氨酰甘氨酸(gly-gly)、甘氨酸-丙氨酸(gly-ala)、丙氨酸-甘氨酸(ala-gly)、天冬氨酸(asp)、d-天冬氨酸(d-asp)、赖氨酸-丙氨酸-丙氨酸(lys-ala-ala)、l~赖氨酸-d~丙氨酸-d~丙氨酸(l-lys-d-ala-d-ala)、甜菜碱、n-三(羟甲基)甲基甘氨酸、肌氨酸和亚氨基二乙酸(idaa)。在该专利中未提及使用色氨酸作为万古霉素的稳定剂。
wo2012159103a1公开了包含万古霉素或其药学上可接受的盐的组合物,其中所述组合物为干粉,并且其中所述组合物还包含选自色氨酸、酪氨酸、亮氨酸、三亮氨酸和苯丙氨酸的疏水性氨基酸。发明人陈述,“可以期望在本公开内容的组合物中包括疏水性氨基酸,以便改善组合物的物理稳定性和/或分散性,改善万古霉素或其药学上可接受的盐的化学稳定性,和/或通过掩盖万古霉素及其盐的苦味来改变组合物的味道,和/或改变组合物从肺被吸收至体循环内的速率(例如,增加或降低速率)。虽然不希望受到任何特定理论的束缚,但是目前认为疏水性氨基酸添加剂保留在颗粒的表面上并且保护它们不受潮并避光,由此增加制剂的稳定性”。在该专利中未教导和建议在溶液中使用色氨酸作为万古霉素的稳定剂以抑制cdp-1形成。
us20070116649a1专利申请公开了包含抗革兰氏阳性菌抗生素或其盐的水性或粉末组合物,其浓度为该抗革兰氏阳性菌抗生素或其盐在25℃和1.0个大气压下的约0.6至约0.9的水溶解度极限。所述抗革兰氏阳性菌抗生素包括万古霉素,诸如填充剂、缓冲剂或分散剂的示例性赋形剂包括疏水性氨基酸,例如亮氨酸、缬氨酸、异亮氨酸、色氨酸、丙氨酸、蛋氨酸、苯丙氨酸、酪氨酸、组氨酸和脯氨酸。根据merckindex(第12版),万古霉素盐酸盐在水中的溶解度为>10%w/v,因此,为约0.6至约0.9的万古霉素溶解度极限的万古霉素浓度范围对应于>6%w/v至约>9%w/v万古霉素,其比用于本发明的万古霉素浓度范围(0.1%w/v和约5%w/v)更高。
以上相关技术既未公开本发明的稳定的万古霉素溶液组合物,也未教导使用色氨酸来稳定溶液中的万古霉素的方法。依然需要水性的、即用型、可注射的和以非冷冻形式稳定至少12个月的新的万古霉素溶液制剂。
发明概述
在一方面,本发明提供非冷冻的、水性的、稳定的即用型万古霉素溶液制剂。
本发明提供稳定的、即用型的万古霉素水溶液的组合物,其包含万古霉素、色氨酸和水,或者基本上由万古霉素、色氨酸和水组成,或者由万古霉素、色氨酸和水组成。
本发明提供通过在同一溶液中包含色氨酸来抑制万古霉素的物理和化学降解而使万古霉素在水中稳定的方法。
本发明提供通过在同一溶液中包含色氨酸来防止形成cdp-1s而使万古霉素在水中稳定的方法。
本发明提供通过在同一溶液中包含色氨酸来防止或延迟cdp-1s的沉淀而使万古霉素在水中稳定的方法。
本发明提供稳定的万古霉素水溶液,其包含任意浓度至其溶解度极限(其为约12%w/v)的万古霉素和任意浓度至其溶解度极限(其为约2.5%w/v)的色氨酸。应注意,色氨酸在水中的溶解度从同一溶液中不存在万古霉素时的约1.4%w/v增加至在同一溶液中存在万古霉素时的约2.5%w/v。这些溶液的效用为,其使万古霉素保持稳定并且允许万古霉素储存为不需要冷冻或使万古霉素转化成干粉以维持其稳定性的即用型液体。
本发明还提供使用任意浓度至接近其溶解度极限(其为约12%w/v(120mg/ml))的万古霉素和任意浓度至其溶解度极限(其为约2.5%w/v(25mg/ml))的色氨酸抑制万古霉素在水中降解的方法。
本发明特别关注的万古霉素溶液包含在约0.1%w/v至约12%w/v之间的任意浓度的万古霉素和浓度在约0.1%w/v至约2.5%w/v之间的色氨酸。优选的溶液包含约0.5%w/v、约1%w/v或约5%w/v的万古霉素和约0.3%w/v至1.5%w/v浓度的色氨酸。
本发明的万古霉素溶液包含为或部分为经相溶解度图(实施例1)证实的非共价的、可逆的和可解离的分子复合物形式的万古霉素和色氨酸。根据实施例1中的相溶解度图方法测量的用于形成此类复合物的优选摩尔混合比(万古霉素比色氨酸)为约10:1至1:20,更优选为10:1至1:5,并且最优选为约5:1至1:1。
由万古霉素溶液中包含色氨酸所提供的益处与通过色氨酸抑制万古霉素降解的新方法密切相关。本发明人意外地发现,色氨酸通过抑制或防止万古霉素降解形成包括cdp-1s在内的多种杂质来使万古霉素稳定。此外,该方法还抑制万古霉素降解产物沉淀,并且使得本发明的溶液组合物通过根据美国药典(usp)对肠胃外药物的质量标准的颗粒物质测试。
本发明的优选方法包括在水溶液中使约0.1%w/v至约12%w/v的万古霉素和约0.1%w/v至2.5%w/v的色氨酸组合。
本发明还提供使万古霉素和色氨酸组合以形成水溶液的方法,其包括(1)首先在水中添加色氨酸并使其溶于水,然后在同一溶液中添加万古霉素并使其溶于同一溶液中,(2)添加色氨酸和万古霉素并使其溶于同一溶液中,以及(3)首先在水中添加万古霉素并使其溶于水,然后在同一溶液中添加色氨酸并使其溶于同一溶液中。
本发明还提供通过将包含万古霉素、色氨酸和水的组合物向人或动物患者给药来治疗或预防该患者的疾病的方法。优选的给药途径包括注射、滴注、局部、眼部、耳部、鼻内或阴道内施用。
在另一方面,本发明提供适用于注射或适用于局部、吸入、滴注、眼部、耳部、鼻内、阴道内或直肠施用的万古霉素溶液制剂。
在另一方面,本发明提供包含万古霉素、色氨酸和水,基本上由万古霉素、色氨酸和水组成,或由万古霉素、色氨酸和水组成的溶液制剂。
在另一方面,本发明提供包含由万古霉素和色氨酸形成的分子复合物的溶液制剂。
本发明还提供通过将色氨酸添加至同一溶液中以抑制万古霉素降解形成包括cdp-1s在内的多种杂质来使万古霉素在溶液中稳定的方法。
本发明还提供通过将色氨酸添加至同一溶液中以抑制包括cdp-1s在内的万古霉素降解产物的沉淀来使万古霉素在溶液中稳定的方法。
本发明还提供制备包含万古霉素、色氨酸和水的稳定的万古霉素溶液制剂的方法。
在另一方面,本发明提供通过给予包含万古霉素、色氨酸和水的万古霉素制剂,为患者提供治疗或预防的方法。
通过本发明人的发现,即,某些浓度的色氨酸可以用于使万古霉素在水中稳定,已经实现了这些方面和其它方面,其在以下描述中将变得显而易见。
附图简述
图1示出了万古霉素的化学结构。
图2示出了万古霉素结构和cdp-1结构。
图3示出了在同一溶液中在存在万古霉素时色氨酸的相溶解度图或万古霉素对色氨酸溶解度的增加。
图4示出了万古霉素稳定性随着色氨酸浓度的增加而改善。
图5示出了万古霉素的ph稳定性曲线。
发明详述
i.定义
本文所用的各种术语应具有以下定义:
如本文所用,“约”描述了具有覆盖从目标值的两侧扩展10%的范围的数量。例如,“约100”意指在90至110之间的任意值,包括90和110以及在其间的数字。
如本文所用,“酸”是指适用于药物用途的任何有机酸或无机酸。优选那些先前已被fda批准用于可注射溶液药物或其它溶液药物或者列在fda的惰性成分列表上的酸。特别用于本发明的酸包括但不限于乙酸、抗坏血酸、天冬氨酸、苯磺酸、苯甲酸、柠檬酸、甲酸、富马酸、盐酸、氢溴酸、乳酸、乳糖酸、马来酸、苹果酸、丙二酸、甲磺酸、磷酸、丙酸、琥珀酸、硫酸和酒石酸。
“抗氧化剂”为可以添加至液体组合物中以防止活性药物或惰性组分氧化的药物添加剂。抗氧化剂包括但不限于还原剂、金属离子螯合试剂和惰性气体。
如本文所用,“水性的”意指所述组合物用水作为液体介质来制备并且基本上不含有机溶剂。
如本文所用,短语“透明的”或“无沉淀物”意指溶液组合物未表现出可见的沉淀物或颗粒,或者其通过了usp专论<788>中描述的“注射剂中的颗粒物质(particulatematterininjections)”的usp测试规范。对于所有的可注射溶液制剂,通常要求满足usp<788>质量标准,以便人用时被认为是安全的。
如本文所用,“cdp-1”或“万古霉素cdp-1”是指万古霉素中天冬酰胺残基脱酰胺化的产物或如图2所示的cdp-1-m和cdp-1-m。万古霉素脱酰胺化导致形成含有异天冬氨酸盐的降解物(结晶降解产物-1(cdp-1)),其以两种旋转异构体(cdp-1-m和cdp-1-m)存在(harriscm,kopeckah,harristm.1983.vancomycin:structureandtransformationtocdp-1.j.amchemsoc105:6915-6922)。在水溶液中,cdp-1s似乎是随时间形成的最显著的降解产物。cdp-1s易于通过hplc分析来检测。如在usp中所用的,cdp-1-m和cdp-1-m还可以分别称为“拆分化合物1”和“拆分化合物2”。由于它们在水中不溶,cdp-1s易于在水中沉淀,使得溶液对于注射或其它药物应用而言是不安全的。
如本文所用,“fda”是指美国食品药品管理局。
如本文所用,“可过滤的”意指液体通过某一孔径(例如0.2微米)的过滤膜的能力。本发明的万古霉素溶液组合物是可过滤的。
如本文所用,“可注射的”是指可以通过静脉内、动脉内、皮下、肌内、皮内、海绵体内或其它注射途径安全注射的制剂。
术语“金属离子螯合试剂或螯合剂”包括安全用于可注射产品的金属离子螯合剂。金属离子螯合剂通过结合金属离子起作用,并且由此降低该金属离子在氧化、水解或其它降解反应中的催化作用。用于本发明的金属螯合剂可以包括乙二胺四乙酸(edta,乙二胺四乙酸盐)、甘氨酸和柠檬酸以及各自的盐或它们的混合物。优选的螯合剂的实例包括edta的钠盐、钾盐或钙盐。本发明的万古霉素组合物可以任选地含有螯合剂。
如本文所用,“分子复合物”意指在非共价键合的两个分子之间的特定的相互作用。当涉及所述分子的物理或化学性质(例如,稳定性或溶解性)的某些变化时,表明存在分子复合物。检测分子复合物形成的方法之一为相溶解度图,其测量一个分子(“底物”)的溶解度变化作为另一分子(“复合剂(complexingagent)”)的函数(t.higuchi和j.l.lach,j.am.pharm.assoc.,sci.ed.43,349,525,527,1954)。为了证实在万古霉素与色氨酸之间形成的分子复合物,在存在多种浓度的万古霉素时测量色氨酸在水中的溶解度,以产生相溶解度图(图3)。数据显示,万古霉素以线性方式增加色氨酸溶解度(图3),这表明色氨酸能够与万古霉素形成分子复合物,并且万古霉素复合的色氨酸在水中比未复合的色氨酸(约0.07m或1.4%w/v)具有更大的溶解度(>0.07m或>1.4%w/v)。根据相溶解度图的斜率,形成的万古霉素:色氨酸分子复合物的化学计量摩尔比估计为约1.1:1至1.4:1(万古霉素与色氨酸的摩尔比)或7.7:1至9.7:1(万古霉素与色氨酸的重量比)(实施例1)。由于相同的原因,在本发明的组合物中揭示的由色氨酸改善的万古霉素的稳定性也被认为是在万古霉素与色氨酸之间形成的分子复合物的结果(实施例4)。在一方面,本发明以例如通过实施例1中的相溶解度图方法测量的约1.1:1至1.4:1(万古霉素与色氨酸的摩尔比)或7.7:1至9.7:1(万古霉素与色氨酸的重量比)的所有这些比率提供此类万古霉素和色氨酸。
对于固定浓度的万古霉素,向同一溶液中添加的色氨酸越多,万古霉素在溶液中的稳定性越好(图4)。为了使万古霉素在溶液中稳定,还可以使用万古霉素和色氨酸的混合物,其中仅一部分的色氨酸或万古霉素为分子复合物形式,而其余的以游离的、未复合的形式存在。例如,在万古霉素与色氨酸的10:1摩尔混合物中,仅约10%的万古霉素可以与色氨酸形成复合物。然而,这种分子复合物的部分配制对于万古霉素在溶液中的稳定性依然是有益的。本发明的组合物中万古霉素:色氨酸的期望的摩尔混合比为约10:1至1:20。负责万古霉素:色氨酸分子复合物的特定相互作用可以包括但不限于氢键、范德华力、π-相互作用、疏水作用和其它可能的分子间相互作用。重要的是应注意,此类分子复合物是非共价的并且是完全可解离的而没有形成新的化学实体,并且色氨酸稳定的万古霉素不涉及形成万古霉素的新的盐、前药或衍生物。在本发明的万古霉素溶液中,万古霉素和色氨酸保持为两个单独的、结构未改变的化学品,使得色氨酸被认为是真正的赋形剂。此外,在具有万古霉素的同一溶液中包含色氨酸不会改变万古霉素的抗微生物效能。
如本文所用,术语“肠胃外的”意指通过除了口服、局部或直肠摄取以外的一些其它方式的药物/制剂的给药途径,特别是静脉内或通过注射的给药途径。
如本文所用,“杂质%”是指万古霉素相关的杂质的峰面积与所有的万古霉素相关的峰的总峰面积的比,所述所有的万古霉素相关的峰包括通过hplc在280nm检测波长下测量的万古霉素的母峰,并且如下进行计算:杂质%=所述杂质的峰面积÷所有的万古霉素相关的峰的总峰面积×100。
如本文所用,“ph”是水溶液的酸度或碱度的量度。通常用ph计进行本发明组合物的ph测定,ph计由与电子表连接的玻璃电极组成,电子表测量并显示ph。使用水性标准ph缓冲液校准ph计。将ph小于7的溶液称作是酸性的,并且ph大于7的溶液是碱性的。纯水具有非常接近7的ph。
如本文所用,“防腐剂”是可以添加至液体组合物中以抑制细菌和真菌生长的药物添加剂。用于本发明的抗微生物防腐剂包括但不限于甲酚、苯酚、苄醇、乙醇、氯丁醇、对羟基苯甲酸酯类、咪脲、苯扎氯铵、edta或其盐或者它们的组合。本发明的万古霉素组合物可以任选地含有防腐剂。
如本文所用,术语“即用型”意指可以直接使用的液体药物制剂,即不需要重组而进行注射、稀释或施用。
如本文所用,术语“重组”是指通过添加水或其它液体稀释剂将干粉或者脱水的、浓缩的或冻干的状态返回至液态的过程。
如本文所用,术语“rld”或“参考目录药物”是指“用于注射的万古霉素盐酸盐,usp”,其目前在美国市售,由hospirainc.制造并且可以小瓶(每个小瓶含有500mg、750mg、1g、5g和10g万古霉素无菌干粉)购得。
如本文所用,术语“溶解度”意指溶质在溶剂中已经达到其最大浓度。例如,万古霉素在水中的溶解度为约12%w/v或120mg/ml,以及色氨酸在水中的溶解度为约14mg/ml。由于分子复合物形成,色氨酸的溶解度在存在万古霉素时增加,这允许使用浓度高达约5%或50mg/ml的色氨酸,这超过了其固有的溶解度14mg/ml。本发明的万古霉素溶液包含约0.1%w/v至约12%w/v的万古霉素和约0.1%w/v至约5%w/v的色氨酸,优选约0.1%w/v至约2.5%w/v的色氨酸。
如本文所用,“溶液”是指仅由一个相组成的透明的、均匀的液体混合物。
如本文所用,术语“基本上不含”意指低于总的组合物重量的1%。例如,本发明的万古霉素溶液基本上不含醇。
如本文所用,“稳定的”意指组合物在冷库温度(2-8℃)下18个月后保持不低于90%的初始万古霉素浓度(或测定)。
如本文所用,术语“张力调节剂”意指添加至液体制剂中以增加其渗透压的某些赋形剂。对于可注射的组合物,期望调节其渗透压至等效于生理盐水(“等渗的或等张的”)。用于本发明的组合物的张力调节剂可以包括但不限于可注射的盐、多元醇、糖或氨基酸。示例性盐为氯化钠、乙酸钠、磷酸钠、氯化钾,示例性多元醇为甘油、甘露醇、山梨糖醇,示例性糖为右旋糖、乳糖、海藻糖和蔗糖,以及示例性氨基酸为甘氨酸、丙氨酸、赖氨酸、脯氨酸、组氨酸和色氨酸。
如本文所用,“色氨酸”是指具有以下实验式的氨基酸:c11h42n2o2,cas#:73-22-3和分子量:204.23,含有l-形式或d-形式或它们的混合物的类色氨酸结构的其它氨基酸,例如n-乙酰基-色氨酸、血清素、褪黑素、含有色氨酸的短肽或其盐。优选的色氨酸为l-色氨酸。
如本文所用,“usp”意指当前版本的美国药典。
如本文所用,“万古霉素”是指具有以下实验式的糖肽:c66h75c12n9o24,cas#:1404-90-6和分子量:1,449.3,或含有类万古霉素结构的另一糖肽,例如去甲万古霉素、替考拉宁、特拉万星、博来霉素、雷莫拉宁和decaplanin,或其盐。优选的万古霉素盐为万古霉素盐酸盐、万古霉素hcl或万古霉素氯化物。
如本文所用,术语“%”意指重量/体积百分数或%w/v。例如,1%w/v意指100ml中的一克或10mg/ml。
ii.描述
在一方面,本发明提供了溶液制剂,其包含:
a.约0.1%w/v至约12%w/v浓度的万古霉素;
b.约0.1%w/v至约2.5%w/v浓度的色氨酸;以及
c.水。
在一方面,本发明的溶液组合物在2-8℃下持续18个月保持透明或无沉淀物或者在25℃下持续1个月保持透明或无沉淀物。
在一方面,本发明的组合物含有0.1%w/v至12%w/v的万古霉素(对应于1mg/ml至120mg/ml或0.0007m至0.084m的万古霉素)。在更优选的方面,本发明的组合物含有约0.5%w/v、1%w/v或5%w/v万古霉素。在另一优选方面,本发明的组合物含有0.5%w/v、0.6%w/v、0.7%w/v、0.8%w/v、0.9%w/v、1.0%w/v、1.1%w/v、1.2%w/v、1.3%w/v、1.4%w/v、1.5%w/v、1.6%w/v、1.7%w/v、1.8%w/v、1.9%w/v、2.0%w/v、2.1%w/v、2.2%w/v、2.3%w/v、2.4%w/v、2.5%w/v、2.6%w/v、2.7%w/v、2.8%w/v、2.9%w/v、3.0%w/v、3.5%w/v、4%w/v、5%w/v、6%w/v、7%w/v、8%w/v、9%w/v、10%w/v、11%w/v和12%w/v万古霉素。
在一方面,本发明的组合物含有0.1%w/v至5%w/v的色氨酸(对应于1mg/ml至50mg/ml或0.0049m至0.246m的色氨酸)。在优选方面,本发明的组合物含有0.1%w/v、0.2%w/v、0.3%w/v、0.4%w/v、0.5%w/v、0.6%w/v、0.7%w/v、0.8%w/v、0.9%w/v、1.0%w/v、1.1%w/v、1.2%w/v、1.3%w/v、1.4%w/v、1.5%w/v、1.6%w/v、1.7%w/v、1.8%w/v、1.9%w/v、2.0%w/v、2.1%w/v、2.2%w/v、2.3%w/v、2.4%w/v或2.5%w/v色氨酸。
在一方面,本发明的组合物含有万古霉素:色氨酸混合物或复合物,其中万古霉素与色氨酸的比率按重量计为约100:1至约1:25,并且按重量计优选为约10:1至1:20。
在另一方面,本发明的组合物的ph为约3至约6。在优选方面,本发明的组合物的ph为3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.2、5.5或6.0。
在另一方面,本发明的组合物的ph为约3至约6,使用酸对ph进行调节。优选的酸为盐酸。
在另一方面,本发明的组合物包含防腐剂。优选的防腐剂为苯扎氯铵、甲酚、间甲酚(metacresol/m-cresol)、苯酚、对羟基苯甲酸酯、苄醇、edta或其混合物。可以使用浓度为约0.01%至1%的苯扎氯铵,0.08%至0.315%的甲酚/间甲酚,0.06%至1.3%的苯酚,0.01%至1.5%对羟基苯甲酸酯,0.05%至10%的苄醇,0.005%至0.2%的edta二钠,和0.005%至0.34%的edta钙二钠。
在一方面,本发明的组合物还含有抗氧化剂。有用的抗氧化剂可以包括但不限于惰性气体、蛋氨酸、半胱氨酸、右旋糖、果糖、乳糖和乙二胺四乙酸(edta)的盐或它们的组合。优选的抗氧化剂为蛋氨酸和edta的组合。各抗氧化剂的浓度可以根据其对本发明的组合物中的万古霉素的稳定作用及其对患者的安全性来确定。各抗氧化剂的正常的浓度范围可见于fda的非活性成分列表。例如,用于可注射制剂的蛋氨酸浓度范围为0.01%至49.2%。
在一方面,本发明提供了透明的、稳定的即用型溶液制剂,其包含:
a.约0.1%w/v至约12%w/v的万古霉素;
b.约0.1%w/v至约2.5%w/v的色氨酸;以及
c.水,其中所述溶液的ph为约3至约6。
在一方面,本发明提供了透明的、等渗的即用型溶液制剂,其包含:
a.约0.5%w/v万古霉素;
b.约0.5%w/v色氨酸;
c.添加至等渗浓度的氯化钠;以及
d.水,其中所述溶液的ph为约3至约6。
在一方面,本发明提供了透明的、等渗的即用型溶液制剂,其包含:
a.约1%w/v万古霉素;
b.约1.0%w/v至1.4%w/v色氨酸;
c.添加至等渗浓度的氯化钠;以及
d.水。
在一方面,本发明提供了透明的即用型溶液制剂,其包含:
a.约5%w/v万古霉素;
b.约1.5%w/v色氨酸;以及
c.水。
在另一方面,本发明提供了制备溶液制剂的方法,其包括:(1)首先将万古霉素溶于水,然后将色氨酸溶于同一溶液中以形成含有约0.1%w/v至约12%w/v万古霉素和0.1%w/v至约2.5%w/v色氨酸的透明溶液,以及(2)使用酸调节ph至约3至约6。
在另一方面,本发明提供了制备溶液制剂的方法,其包括:(1)首先将色氨酸溶于水,然后将万古霉素溶于同一溶液中以形成含有约0.1%w/v至约12%w/v万古霉素和0.1%w/v至约2.5%w/v色氨酸的透明溶液,以及(2)使用酸调节ph至约3至约6。
在另一方面,本发明提供了制备溶液制剂的方法,其包括:(1)将色氨酸和万古霉素一起溶于同一溶液中,形成含有约0.1%w/v至约12%w/v万古霉素和0.1%w/v至约2.5%w/v色氨酸的透明溶液,以及(2)使用酸调节ph至约3至约6。
在另一方面,本发明提供了制备溶液制剂的方法,其包括:(1)使万古霉素和色氨酸混合,(2)使它们一起溶于水中以形成含有约0.1%w/v至约12%w/v万古霉素和0.1%w/v至约2.5%w/v色氨酸的透明溶液,以及(3)使用酸调节ph至约3至约6。
在另一方面,本发明提供了制备溶液制剂的方法,其包括将水添加至包含万古霉素、色氨酸和任选的酸的固体组合物。所述固体组合物含有计算量的万古霉素、色氨酸和酸,使得用水重组时,其形成含有约0.1%w/v至约12%w/v万古霉素和0.1%w/v至约2.5%w/v色氨酸以及具有约3至约6的ph的透明溶液。
本发明的溶液制剂可以在给药前照其原样(未稀释的)或稀释的形式进行给药。可以使用5%或10%右旋糖溶液或另一可注射稀释剂或输注液进行稀释。给药途径可以包括但不限于注射、滴注、吸入、口服、耳部、鼻腔、局部、眼部、阴道和直肠给药。可以将本发明的溶液制剂使用针/注射器、输注器、导管、涂药器、瓶、喷雾器、吸入装置或作为/从伤口敷料进行递送。
在一方面,本发明的溶液制剂与允许用于rld的相同的输注液相容,其包括:5%右旋糖注射液,usp,5%右旋糖和0.9%氯化钠注射液,usp乳酸林格氏注射液,usp5%右旋糖和乳酸林格氏注射液,normosol-m和5%右旋糖,0.9%氯化钠注射液usp,isolytee及它们的组合。
在一方面,本发明的万古霉素溶液制剂表现出与具有相同的万古霉素浓度且没有色氨酸的万古霉素水溶液相同的抗菌活性。
在一方面,本发明的溶液组合物,其中万古霉素在2-8℃下稳定18个月或在25℃下稳定1个月。
在一方面,本发明的溶液组合物在2-8℃下持续18个月或在25℃下持续1个月保持透明或无沉淀物。
在一方面,本发明的溶液组合物中任何单独的万古霉素相关的杂质的杂质%在2-8℃下持续12个月或在25℃下持续1个月时不大于4%。
在一方面,本发明的组合物在2-8℃下储存18个月或在25℃下储存1个月后能够通过usp专论<788>中描述的关于“注射剂中的颗粒物质”的usp测试规范。
在一方面,本发明的组合物能够通过在“用于注射的万古霉素,usp”专论(usp-nf28)中限定的usp测试分析和杂质质量标准。
在一方面,本发明的组合物具有约200mosmol/l至600mosmol/l的渗透压。
在一方面,本发明的组合物含有约5mg/ml至10mg/ml万古霉素并且是等渗的。
在一方面,本发明的溶液组合物中的色氨酸在2-8℃下保持稳定6个月,并且不存在所形成的任何色氨酸相关的杂质的浓度大于0.1%的情况。
在一方面,本发明的组合物是即用型的。
在一方面,本发明的组合物可过滤通过0.2微米或0.45微米的膜。
在一方面,本发明的组合物填装在玻璃小瓶、注射器、滴瓶、管、涂药器、单位分配器、输注袋、喷雾器、吸入装置或其它药物容器中。
在一方面,本发明的组合物填装在玻璃小瓶、注射器、滴瓶、管、涂药器、单位分配器、输注袋、喷雾器、吸入装置或其它药物容器中,并且用诸如氮气的惰性气体填充在顶部空间。
在一方面,本发明的组合物用于治疗或预防包括葡萄球菌感染在内的细菌感染。
在一方面,本发明的组合物用于治疗或预防由耐甲氧西林葡萄球菌菌株(mrsa)引起的感染。
在一方面,将含有约5mg/ml至10mg/ml万古霉素的本发明的组合物未经任何的进一步稀释或混合而直接进行注射。
在一方面,将含有约50mg/ml或更多的万古霉素的本发明的组合物首先在相容的输注流体之一中稀释至约5mg/ml至10mg/ml,然后进行注射。
将参考以下非限制性实施例进一步理解本发明。
实施例1
本研究的目的为根据测量在增加万古霉素浓度的溶液中的色氨酸溶解度,使用相溶解度图证实在万古霉素与色氨酸之间形成分子复合物。此外,本研究旨在测定所形成的此类分子复合物的化学计量比。为了获得色氨酸的相溶解度图,将预先计算量的色氨酸、万古霉素和水加入塑料管内以形成悬浮液,其中万古霉素完全溶解但色氨酸不完全溶解,将悬浮液调节至ph6.2,在室温(rt)下混合过夜以达到溶解/再结晶平衡,然后通过0.2微米过滤膜进行过滤。将滤液稀释并且通过hplc(使用usphplc万古霉素测定方法)分析,以测定色氨酸和万古霉素的浓度。下表中提供了在各悬浮液样品中所测量的色氨酸的溶解度和所测量的添加的万古霉素的浓度。
图3显示了色氨酸的相溶解度图或由万古霉素引起的色氨酸溶解度的增加。
从色氨酸相溶解度图来看,显然在万古霉素与色氨酸之间形成了非共价的分子复合物。此类复合物中万古霉素与色氨酸的化学计量比可以从约1:1变化至1.4:1(摩尔比)或从7.7:1变化至9.7:1(重量比),这意味着每个色氨酸分子可以与约一个或多个万古霉素分子形成分子复合物。分子复合物的形成增加了色氨酸的表观溶解度,因为万古霉素-色氨酸复合物形式中的色氨酸比同一溶液中不存在万古霉素时的色氨酸更加可溶。换言之,通过添加万古霉素,色氨酸的溶解度从1.43%(添加0%万古霉素)增加至2.2%(添加7.7%万古霉素)、至估算的2.5%(添加10%万古霉素)。由于相同的原因,万古霉素-色氨酸分子复合物的形成增加了本发明的溶液组合物中的万古霉素的稳定性,因为复合物中的万古霉素比单独的万古霉素更稳定(实施例4)。
实施例2
本研究的目的为比较溶液中的多种成分对万古霉素稳定性的作用,以便鉴定能够使万古霉素在溶液中的降解变缓慢的稳定剂。通过使万古霉素hcl溶解至1%浓度以及以下表所列的浓度添加稳定剂来制备各溶液样品(以f-#编码)。将各溶液调节至约ph4.7并且在2℃-8℃和50℃下储存2天。在选定的温度下储存后,通过万古霉素回收率(相对于初始浓度的%)来表示万古霉素的稳定性。使用hplc方法(usp万古霉素测定方法)测量万古霉素的浓度或万古霉素测定。以万古霉素浓度或测定回收率(相对于初始浓度的%)来表达各溶液中万古霉素的相对稳定性。测试样品组合物和测试结果显示于下表中。
*1,2-二肉豆蔻酰-sn-甘油基-3-磷酸甘油,钠盐
本研究的结果表明,色氨酸或色氨酸类似物(n-乙酰基-色氨酸)能够使溶液中的万古霉素的降解缓慢下来。其它添加剂对溶液中的万古霉素稳定性表现出无作用或负作用。
实施例3
本研究的目的为比较包括色氨酸在内的多种氨基酸对水溶液中万古霉素稳定性的作用。类似于实施例2来制备和测试溶液样品。样品组合物和测试结果显示于下表:
本研究证实色氨酸能够使万古霉素的降解缓慢下来,而其它氨基酸对溶液中万古霉素稳定性无作用或具有负作用。
实施例4
本研究的目的为证实色氨酸浓度对溶液中万古霉素稳定性的作用。以与实施例2类似的方式制备和测试溶液样品。测试样品组合物和测试结果显示于下表中,并且图4用图解描述了色氨酸浓度对万古霉素稳定性的作用。
图4显示了万古霉素稳定性随着色氨酸浓度的增加而改善。这些结果表明,色氨酸以浓度依赖性方式改善了万古霉素稳定性,在所测试的0至1.5%w/w的色氨酸浓度范围内,更高浓度的色氨酸在溶液中产生更好的万古霉素稳定性。
实施例5
本研究的目的为确定万古霉素最稳定时的ph或ph范围。制备含有5mg/ml万古霉素hcl的各测试溶液,并且用hcl/naoh将溶液的ph调节至约3、3.3、3.7、4、4.3、4.7、5、5.3、5.7或6。将溶液储存在25℃、40℃、50℃和60℃下,并且通过万古霉素hplc方法在多个时间后分析万古霉素浓度。计算万古霉素的降解速率(mg/ml/hr),针对溶液的ph制图并且用于确定万古霉素最稳定时的ph或ph范围。图5用图解描述了测试结果。这些结果表明,万古霉素在ph3至ph6、优选在ph3.5至ph5.5以及更优选在ph4至ph5.5内是更稳定的。
实施例6
已经使用以下工序制备多批的本发明的溶液制剂:
步骤#1:称取l-色氨酸和氯化钠(若需要)并且将它们加入透明塑料容器中。
步骤#2:添加注射用水usp(wfi)至批重量的约95%。
步骤#3:使用磁力搅拌棒混合以溶解固体。为了加速溶解,应用超声并且加热至不高于50℃。所获得的溶液是透明的且几乎无色的液体。
步骤#4:称取万古霉素原料(或活性药物成分或api)并且将其添加至同一容器中。
步骤#5:使用磁力搅拌棒混合以溶解固体。万古霉素快速溶解并且该过程通常花费约1小时来完成。所获得的溶液是透明的并且颜色根据所用的api和万古霉素的终浓度可以从几乎无色变化至黄色。该溶液的ph通常为约5.5。
步骤#6:在搅拌的同时,使用1n盐酸溶液将溶液ph调节至目标范围内。如果ph超过目标,则添加1n氢氧化钠调节回来。
步骤#7:添加wfi至最终的批重量。
步骤#8:使用磁力搅拌棒在室温下混合,以使ph稳定。
步骤#9:测量ph。如果ph已经变化了多于0.2个单位,则用1nhcl或1nnaoh再调节ph,然后再混合30分钟。
步骤#10:使溶液通过无菌的0.2μm过滤器以灭菌。收集在无菌容器中的滤液。
步骤#11:将滤液无菌地装入最终容器内,例如玻璃小瓶或预灌封注射器。
实施例7
已经制备以下批次的本发明的溶液制剂并且测试了稳定性:
对本发明的溶液制剂实施以下稳定性测试。无论何时都适用,使用usp分析测试方法和“用于注射的万古霉素盐酸盐,usp”质量标准。
制剂编码:f-51在玻璃小瓶中
储存:2-8℃
小瓶方向:直立的
*用lekapi制备的溶液是琥珀色的,而用xellia或xinchangapi制备的溶液几乎是无色至淡黄色。
**这种高的值被确定为异常值,由于分析的人工因素。其未获得hiac读数或随后的每月hplc测试结果的支持。
根据下表制备三种另外的万古霉素溶液组合物。将溶液填入玻璃小瓶内或预先灭菌的注射器内并且保持在2-8℃和25℃下。
测试在玻璃小瓶中的f-87的长期稳定性,并且测试结果提供在下表中:
制剂编码:f-78在玻璃小瓶中
储存:2-8℃
小瓶方向:直立的
制剂编码:f-78在玻璃小瓶中
储存:25℃
小瓶方向:直立的
制剂编码:f-82在预灌封注射器中
储存:2-8℃
预灌封注射器方向:直立的
制剂编码:f-82在预灌封注射器中
储存:25℃
预灌封注射器方向:直立的
制剂编码:f-82在玻璃小瓶中
储存:2-8℃
小瓶方向:直立的
制剂编码:f-87在玻璃小瓶中
储存:2-8℃
小瓶方向:直立的
制剂编码:f-87在玻璃小瓶中
储存:25℃
小瓶方向:直立的
这些结果表明,本发明的万古霉素溶液组合物在2-8℃下稳定18个月或在25℃下稳定1个月。
实施例8
本研究的目的为证实浓的万古霉素溶液在用静脉输注液稀释后的稳定性。根据rld,用于注射的万古霉素hcl,usp的包装说明书中所列的那些输注液选择输注液。根据rld的包装说明书上的指示在无菌的20ml玻璃小瓶中制备稀释液。按照rld的包装说明书上的指示,将稀释液在2-8℃下储存2周。
浓的万古霉素溶液的组成显示于以下表中。
将研究中评价的输注液列于下表中:
5%右旋糖注射液,usp
5%右旋糖和0.9%氯化钠注射液,usp
乳酸林格氏注射液,usp
5%右旋糖和乳酸林格氏注射液
normosol-m和5%右旋糖
0.9%氯化钠注射液,usp
isolytee
测试在输注液中稀释的f-82的稳定性,并且将测试结果提供在下表中:
结果证实,当根据rld包装说明书指示进行稀释和储存时,本发明的浓的万古霉素溶液形式在rld的包装说明书所列的输注液中是稳定的。此外,所获得的结果表明,浓的万古霉素溶液f-82的稳定性与rld的稳定性是等效的或比rld的稳定性更好。既没有主要的万古霉素杂质(cdp-1s)也没有任何其它的单个杂质在研究期间对于任何输注液等于或超过4.0%总面积的限度。因此,本发明的万古霉素溶液组合物是相容的,并且可以使用允许与rld一起使用的相同标记的输注液进行稀释。
实施例9
本研究的目的为证实本发明的溶液组合物中的万古霉素的抗生素活性(效价)。使用目前的用于抗生素测定的usp方法<81>来测定抗生素效价。下表描述了用于测试抗生素效价的万古霉素溶液组合物。
下表显示了抗生素效价测试的结果:
结果表明,本发明的万古霉素溶液制剂通过了效价测试并且符合抗生素测定的usp质量标准。
实施例10
本研究的目的为证实最小抑制浓度(mic),抗生素剂在液体中能够抑制微生物增殖的最低水平的测量值。该方法的标准由临床和实验室标准协会(clsi)概述。下表描述了用于测试抗生素效价的万古霉素溶液组合物:
下表显示了f-51的抗生素效价测试的结果:
结果表明,本发明的万古霉素溶液组合物至少对于0.001%w/v的万古霉素浓度是足够有效的。
实施例11
本研究的目的为证实最小抑制浓度(mic),抗生素剂在液体中能够抑制微生物增殖的最低水平的测量值。该方法的标准由临床和实验室标准协会(clsi)概述。
下表描述了用于测试抗生素效价的万古霉素溶液组合物。
下表描述了本研究中使用的测试参数。
下表示出了抗生素效价测试的结果:
结果表明,将色氨酸添加至本发明的万古霉素溶液中不影响万古霉素对所测试的细菌菌株的mic。
实施例12
本研究的目的为证实在本发明的万古霉素溶液中色氨酸的稳定性。下表描述了用于测试色氨酸稳定性的万古霉素溶液和相应的介质溶液组合物。
下表显示了用于评价色氨酸稳定性的储存/应力条件
下表概述了色氨酸相关的杂质或降解产物的峰面积(%)。万古霉素及其相关峰并不包括在hplc数据集成和计算中。
结果表明,色氨酸在本发明的万古霉素溶液中是非常稳定的并且不必担忧杂质或降解产物。在2-8℃×6个月的万古霉素溶液及其介质中未发现具有超过0.1%的峰面积的色氨酸相关的杂质。甚至在诸如高压灭菌法的实质性应力后,万古霉素溶液中形成的色氨酸相关的杂质保持低于0.1%或低于根据fda的杂质指导(新药产品中的工业q3b(r2)杂质的指导)的“报告阈值”。期望色氨酸纯度以峰面积计保持高于99.9%。不期望色氨酸杂质干扰通过hplc方法的已知的万古霉素杂质。
根据前述的详细描述,本发明的修改和变化对于本领域技术人员而言是显而易见的,并且旨在落入权利要求的范围内。本文引用的所有文献的教导通过参考具体地并入。
- 还没有人留言评论。精彩留言会获得点赞!