治疗癌症干细胞的组合物的制作方法
本发明涉及一种治疗癌症干细胞的组合物,其含有葡萄糖吸收抑制剂和钙泵抑制剂。
背景技术:
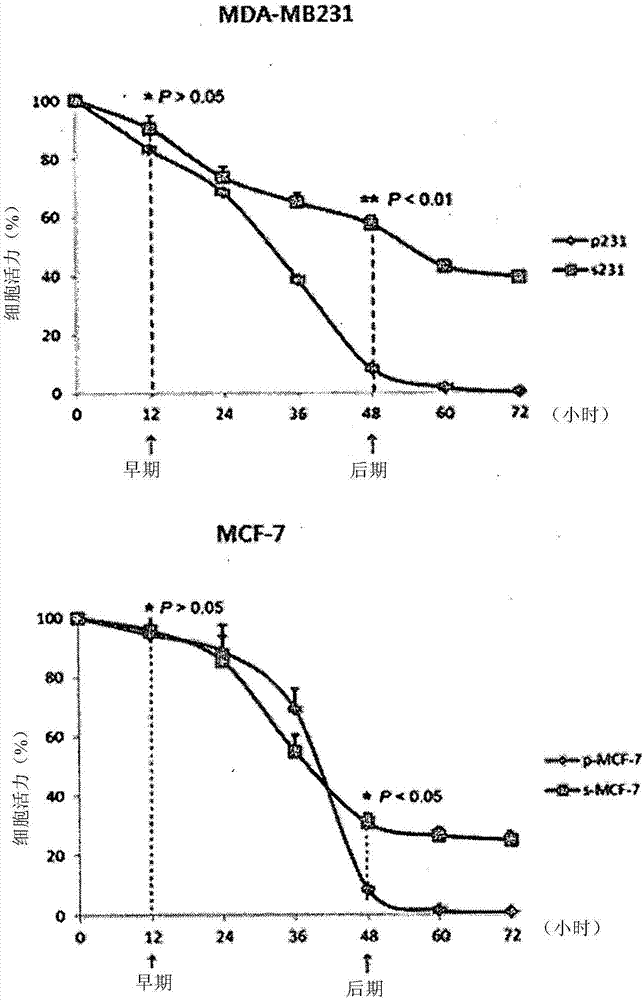
:目前在积极开发并实际用于抗癌治疗的抗癌药物,主要是靶向快速增殖的癌细胞的药物。在使用这些药物作为抗癌疗法的情况下,似乎癌细胞在初始阶段被有效杀伤了,表明癌症得到了治疗。然而,保留在体内的癌症干细胞没有被清除,因此容易出现癌症复发和/或转移。最终,常常出现对现有的抗癌疗法产生抗性这样的问题。基于此原因,癌症干细胞成为最近研究的热点。众所周知,癌症干细胞是一种具有无限自我更新能力的癌细胞,这一点与普通干细胞相同,与普通癌细胞不同的是其增殖缓慢,癌症干细胞也具有自我更新或分化的能力,这是干细胞的特征。而且,已知这些癌症干细胞具有与先前所知的癌细胞不同的机制。然而,对癌症干细胞还没有积极地进行研究,尤其是对靶向癌症干细胞用于治疗癌症干细胞的药物的研究几乎没有或没有(韩国专利申请号:10-2011-0066035)。因此,期望对能够有效地针对癌症干细胞的、用于治疗癌症干细胞的组合物的开发能够提供一种有效的治疗方法,所述治疗方法能够增加癌症治疗效果并且能够抑制癌症复发和/或转移。技术问题本发明是为了解决现有技术中出现的上述问题,本发明的一个目的是提供一种治疗癌症干细胞的组合物,该组合物含有葡萄糖吸收抑制剂和钙泵抑制剂。然而,此发明所达到的技术效果并不局限于上述技术效果,其他未被提及到的技术效果可以通过以下描述被该本领域技术人员清楚地了解。技术方案在下文中,描述的多种实施方式将参考附图进行描述。在接下来的说明书中,描述了很多具体细节,如具体结构、组合物和工艺等,以提供对本发明的充分理解。然而,某些实施方式可能在没有一个或多个这些特定细节的情况下实施,或者与其他已知的方法和结构组合实施。在其他情况中,为了不要不必要地混淆本发明,已知的方法和制备技术没有被特别详细地描述。贯穿整个说明书中对“一个实施方式”和“实施方式”的提及意味着结合该实施方式描述的特定特征、结构、组成、或特性包括在本发明的至少一个实施方式中。因此,在本说明书中的许多地方出现的词组“一个实施方式中”或“一实施方式”不一定指的是本发明的同一实施方式。另外,特定的特征、结构、组成或特性可以以任何适合的方式组合在一个或多个实施方式中。如下文所用,术语“癌症干细胞”指的是具有自我更新或分化能力的癌细胞,这是干细胞的特征。与正常癌细胞不同,癌症干细胞可在正常的肿瘤生长条件(指这样的情况:细胞生长必需的营养(葡萄糖)充足,且肿瘤微环境条件丰富从而没有细胞应激)下缓慢增殖,或者可以保持在休眠状态,因此对抗癌药物具有耐药性。例如,与普通肿瘤细胞不同,癌症干细胞中的转录调节因子如pgc-1α的表达可以被调控,因此,癌症干细胞的主要代谢调控因子的功能可以与普通癌细胞不同。通过这种不同的代谢调控能力和对与其机械连接的信号转导系统的调控,癌症干细胞在营养缺乏的条件下获得对细胞凋亡的抗性,并能够浸润和/或转移。然而,癌症干细胞不局限于此,只要能够分化成普通癌细胞即可。本发明提供一种用于抑制癌症干细胞生长或治疗癌症干细胞的药物组合物,其包含作为为活性成分的葡萄糖吸收抑制剂和钙泵抑制剂。在本发明的一个实施方式中,葡萄糖吸收抑制剂优选为葡萄糖衍生物,更优选为2-脱氧葡萄糖(2dg),但不限于此,只要是能抑制葡萄糖(其为细胞的能量来源)吸收的化合物即可,以在癌症干细胞中诱导营养缺乏和/或代谢能量耗尽相关的内质网应激从而抑制细胞生长并诱导质膜ca2+atp酶(pmca)的表达。如本文所用,术语“葡萄糖衍生物”是指通过修饰葡萄糖的一部分得到的化合物,并且其与正常的葡萄糖发生竞争性作用,从而抑制葡萄糖摄的吸收。在本发明的另一个实施方式中,钙泵抑制剂优选为质膜ca2+atp酶(pmca)的抑制剂,ca2+/钙调蛋白依赖性激酶-2-α(camk-2α)的抑制剂,等等。更优选地,钙泵抑制剂可以是caloxin、硝苯地平、kn62(1-[n,o-双(5-异喹啉磺酰基)-n-甲基-l-酪氨酰]-4-苯基哌嗪)、与camk-2α特异性结合的sirna,等等,但不限于此,只要是能够抑制癌症干细胞的能力以控制胞内钙浓度的物质即可。如本文所述,术语“pmca抑制剂”是指能够抑制pmca的活性以抑制钙的细胞外释放的物质。在本发明的另一个实施方式中,组合物还可进一步包含双胍类化合物。双胍类化合物优选为治疗糖尿病的双胍类药物。更优选地,双胍类化合物可以是二甲双胍,苯乙双胍,丁基双胍,等等,但不限于此,只要是干扰细胞内能量生成以诱导营养缺乏样状态的双胍类化合物即可。在本发明的另一个实施方式中,癌症可以优选为乳腺癌,子宫癌,胃癌,脑癌,直肠癌,结肠直肠癌,肺癌,皮肤癌,卵巢癌,肾癌,血癌,胰腺癌,前列腺癌,甲状腺癌,肝癌,等等。更优选地,癌症可以是乳腺癌,但不限于此,只要其进展(例如肿瘤分化和/或生长)依赖于本发明所述的癌症干细胞即可。用于治疗癌症干细胞的药物组合物也可以与其它抗癌药物联合给药,从而不仅能够有效治疗癌症干细胞,而且也能有效地治疗普通癌细胞。此外,所述药物组合物也可以用作抑制癌症复发或转移的药物组合物。本发明中,药物组合物可以是以胶囊,片剂,颗粒剂,注射液,软膏,粉末或饮料的形式,并且可以用于人对象。为了使用,可以分别根据常规方法,将药物组合物制备成口服制剂,包括粉末、颗粒、胶囊、片剂、水混悬液等等,外用栓剂,和无菌注射剂,但不限于此。本发明的药物组合物可以含有药学上可接受的载体。对于口服给药,药学上可接受的载体可包括以下中的一种或多种:粘合剂,润滑剂,崩解剂,赋形剂,增溶剂,分散剂,稳定剂,助悬剂,色素,芳香剂,等等。对于注射剂,药学上可接受的载体可包括以下中的一种或多种:缓冲剂,防腐剂,止痛剂,增溶剂,等渗剂,稳定剂,等等。对于局部给药,药学上可接受的载体可包括以下中的一种或多种:碱,赋形剂,润滑剂,防腐剂,等等。根据本发明所述的药物组合物可以和如上所述药学上可接受的载体混合以提供各种制剂。例如,对于口服给药,本发明的药物组合物可以以片剂、锭剂、胶囊剂、酏剂、混悬液、糖浆、薄片(wafer)、等等的形式制备,对于注射给药,药物组合物可以以单位剂量安瓿或多剂量容器的形式制备。此外,本发明的药物组合物可以制备成溶液剂,混悬剂,片剂,胶囊,缓释制剂,等等。同时,适用于制剂的载体、赋形剂和稀释剂包括乳糖,葡萄糖,蔗糖,山梨醇,甘露醇,木糖醇,赤藓醇,麦芽糖醇,淀粉,阿拉伯胶,藻酸盐,明胶,磷酸钙,硅酸钙,纤维素,甲基纤维素,微晶纤维素,聚乙烯吡咯烷酮,水,羟基苯甲酸甲酯,羟基苯甲酸丙酯,滑石粉,硬脂酸镁,矿物油,等等。此外,本发明所述的药物组合物还可进一步包括填充剂、抗凝剂、润滑剂、润湿剂、芳香剂、乳化剂、防腐剂、等等中的一种或多种。根据本发明所述的药物组合物的给药途径包括但不限于口服,静脉内,肌内,动脉内,骨髓内,鞘内,心内,经皮,皮下,腹膜内,鼻内,肠内直肠内,局部,舌下和直肠内途径。优选口服或肠胃外给药。本文所用的术语“肠胃外”指的是包括皮下,皮内,静脉内,肌内,关节内,囊内,肠内,鞘内,脑内和颅内注射或灌注技术。本发明的药物组合物也可以用于直肠给药的栓剂的形式给药。本发明的药物组合物的给药剂量可根据具体所用化合物的活性、患者的年龄、体重、一般健康状况、性别、饮食、给药时间、给药途径、排泄率、药物组合、以及预防或治疗的特定疾病的严重程度而变化。药物组合物可以以0.0001-50mg/kg/天或0.001-50mg/kg/天的剂量给药,这取决于患者的状况,体重,疾病的严重程度,药物的形式,给药途径、给药周期。本发明的药物组合物可以每天给药一次或几次。剂量不以任何方式限制本发明的范围。本发明的药物组合物可以制备成丸剂,糖衣片,胶囊,溶液,凝胶,糖浆,药浆、或混悬液。有益效果本发明所述用于治疗癌症干细胞的组合物包含葡萄糖吸收抑制剂和钙泵抑制剂。本发明的组合物包含葡萄糖吸收抑制剂和双胍类药物,其诱导营养缺乏和代谢能量耗竭相关的内质网应激,从而诱导癌症干细胞中质膜ca2+atp酶(pmca)的表达。此外,本发明的组合物还含有钙泵抑制剂,其可以降低癌症干细胞对ca2+相关凋亡的抗性,从而诱导癌症干细胞死亡,表明该组合物可以用作治疗癌症干细胞的有效药物。因此,预期本发明的组合物可以有效地治疗各种癌症干细胞,从而抑制癌症复发和/或转移。附图描述图1显示根据本发明的一个实施例,通过结晶紫染色法测定葡萄糖缺乏情况下s-mda-mb-231和s-mcf-7细胞系活力的结果。图2显示根据本发明的一个实施例,通过mtt试验测定葡萄糖缺乏情况下s-mda-mb-231和s-mcf-7细胞系的活力的结果。图3显示根据本发明的一个实施例进行的tunel测定的结果。图4显示根据本发明的一个实施例进行的免疫印迹分析的结果。图5显示根据本发明的一个实施例进行的细胞周期分析的结果。图6显示根据本发明的一个实施例分析细胞内ca2+水平的结果。图7显示根据本发明的一个实施例分析camk-2α表达水平的结果。图8显示根据本发明的一个实施例,分析camk-2α表达被抑制的细胞系中细胞内ca2+水平的结果。图9显示根据本发明的一个实施例,camk-2α表达被抑制的细胞系中tunel测定的结果。图10显示根据本发明的一个实施例,camk-2α表达被抑制的细胞系中免疫印迹分析的结果。图11显示根据本发明的一个实施例,camk-2α表达被抑制的细胞系中细胞周期分析的结果。图12显示根据本发明的一个实施例分析pgc-1α和camk-2α之间关系的结果。图13显示根据本发明的一个实施例,pgc-1α表达被抑制的细胞系中细胞内ca2+水平测定的结果。图14显示根据本发明的一个实施例,通过emsa分析pgc-1α和pmca1之间结合关系的结果。图15显示根据本发明的一个实施例,通过emsa分析pgc-1α和pmca2之间的结合关系的结果。图16显示根据本发明的一个实施例,分析营养缺乏条件下pmca表达水平的结果。图17显示根据本发明的一个实施例,分析camk-2α表达被抑制的细胞系中pmca表达水平的结果。图18显示根据本发明的一个实施例分析钙泵抑制剂的作用的结果。图19显示根据本发明的一个实施例,通过免疫化学染色分析在乳腺癌动物模型中蛋白表达的结果。图20显示根据本发明的一个实施例,通过免疫化学染色分析在乳腺癌动物模型中共同给药的作用的结果。图21显示根据本发明的一个实施例,分析癌细胞和癌症干细胞之间基因表达差异的结果。图22显示根据本发明的一个实施例,在癌细胞和癌症干细胞中进行钙调节相关蛋白表达的免疫印迹分析结果。图23是显示根据本发明的一个实施例癌症干细胞中钙离子调节机制的示意图。图24显示根据本发明的一个实施例,测定的camk-2α信号转导机制的时间依赖性变化。图25显示根据本发明的一个实施例分析pnf-kb的作用的结果。图26显示根据本发明的一个实施例进行的tunel检测的结果。图27显示根据本发明的一个实施例进行的免疫印迹分析的结果。图28显示根据本发明的一个实施例进行的细胞活力检测结果。图29显示根据本发明的一个实施例,在基于癌症干细胞的动物模型中检测肿瘤生长的结果。图30显示根据本发明的一个实施例,在基于癌症干细胞的动物模型中分析蛋白表达水平的结果。图31显示根据本发明的一个实施例,在基于癌症干细胞的动物模型中分析蛋白表达水平的结果。最佳实施方式以下对本发明进行更详细的说明。对本领域技术人员显而易见的是,这些实施例仅用于说明的目的,并不意于限制本发明的范围,实施例1:癌症干细胞的产生为了产生癌症干细胞,诱导p-mda-mb-231和p-mcf-7(分别是mda-mb-231和mcf-7细胞系(乳腺癌细胞系)的亲本细胞)的长期营养缺乏,通过分析对一般癌症干细胞特异性的生物特征,筛选和验证在营养缺乏的环境下避免了细胞凋亡的存活细胞(s-mda-mb-231和s-mcf-7),从而产生癌症干细胞。为了鉴定癌症干细胞的机制和开发出能够抑制癌症干细胞的治疗剂,将shpgc-1αpgfp-v-rs载体(origene)分别转染至s-mda-mb-231和s-mcf-7细胞系中,从而培养出稳定表达shpgc-1α的sshpgc-1α-mda-mb-231和s-shpgc-1α-mcf-7干细胞。产生的细胞系用于实验。将每个细胞系培养在含有10%胎牛血清(fbs)的rpmi-1640培养基中。实施例2:葡萄糖缺乏条件下癌症干细胞活力的测定为了比较葡萄糖缺乏条件下癌细胞和癌症干细胞的活力,按照与实施例1相同的方法培养的p-mda-mb-231,p-mcf-7,s-mda-mb-231和s-mcf-7细胞系,分别加入到96孔板中,细胞浓度为5×103个细胞/100μl,并培养至约70%的融合,然后培养基更换成葡萄糖缺乏且含有10%fbs的rpmi-1640培养基,将细胞继续培养3天。分别在0、12、24、36、48、60和72小时,通过结晶紫染色和mtt(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物)试验测定每个细胞系的活力。结晶紫染色法的测定结果如图1,mτt法测定的结果示如图2。如图1所示,通过结晶紫染色法对贴附在培养板表面的细胞进行计数,结果表明,与亲代细胞系(p-mda-mb-231和p-mcf-7)相比,癌症干细胞系(s-mda-mb-231和s-mcf-7)具有显著的高活力。此外,如图2所示,在培养的早期阶段(培养12小时后),癌症干细胞与普通癌细胞的细胞活力无显著性差异。然而,在培养的后期阶段(培养48小时后),癌症干细胞与普通癌细胞之间的细胞活力存在显著差异,尤其对s-mda-mb231细胞系,显示癌细胞与癌症干细胞之间的细胞活力差异为40%或更高。通过上述结果发现,在葡萄糖缺乏(即营养缺乏)条件下,与普通癌细胞相比,癌症干细胞具有高活力,表明癌症干细胞对营养缺乏(即能量缺乏)具有高抗性。实施例3:癌症干细胞凋亡抗性分析3.1:tunel测定为了检测癌症干细胞在营养缺乏条件下的高活力是否是由于其对细胞凋亡具有抗性,p-mda-mb-231,p-mcf-7,s-mda-mb-231和s-mcf-7细胞株各自按照与实施例2相同的方法在葡萄糖缺乏条件下培养40小时,收集并进行tunel测定。在tunel测定中,将收集的细胞用4%多聚甲醛溶液固定48小时,然后根据生产商的说明使用末端脱氧核苷酸转移酶dutp缺口末端标记(dutpnickendlabeling,tunel)试剂盒进行染色,使用荧光显微镜获得细胞的荧光图像,并使用zeisslsmimagebrowser软件程序进行分析。结果示于图3。如图3所示,在普通癌细胞系(p-mda-mb-231和p-mcf-7)中,大量细胞中出现细胞凋亡导致的dna片段化,然而,在癌症干细胞系(s-mda-mb-231和s-mcf-7)中,较少量细胞中出现dna片段化。这表明癌症干细胞对营养缺乏诱导的细胞凋亡具有抗性,即使在营养缺乏的情况下也表现出较高活力。3.2:免疫印迹分析(western印迹)为了检测凋亡相关蛋白是否参与了凋亡抗性(凋亡抗性是癌症干细胞在营养缺乏条件下显示高活力的原因),p-mda-mb-231,p-mcf-7,s-mda-mb-231和s-mcf-7细胞系按照与实施例2相同的方法在葡萄糖缺乏条件下培养40小时,收集并进行免疫印迹分析。收集的细胞用冰冷的pbs(磷酸盐缓冲盐水)缓冲液清洗两次,并用ripa缓冲液裂解细胞以分离蛋白。对于下一个实验,通过bca法测定分离出的蛋白的量。从每个细胞系获得的蛋白质取20μg,在8-10%sds-聚丙烯酰胺凝胶上进行电泳,通过电转移到pvdf膜上。蛋白质转移的pvdp膜在室温下用5%脱脂乳处理1小时,然后与分别针对半胱天冬酶-3、半胱天冬酶-7、bcl-2和β-肌动蛋白(对照)的第一抗体4℃孵化16小时。抗体孵育的pvdp膜用tbst缓冲液清洗三次以除去未结合的第一抗体,并在室温下与hpr耦合的第二抗体进一步孵育1小时。孵育结束后,用tbst缓冲液清洗膜以完全除去第二抗体,并用ecl缓冲液处理,孵育3分钟后,暴露于柯达x-omatar胶片。结果如图4.如图4所示,在s-mda-mb231细胞系中,活化的半胱天冬酶(切割的形式)3和7的水平均降低,在s-mcf-7中,切割的半胱天冬酶7和9的水平均降低。这些结果表明,癌症干细胞在营养缺乏条件下,已知为凋亡标记物的半胱天冬酶和自噬细胞死亡相关的物质p62和lc3b的表达降低,但已知为抗凋亡标记物的bcl-2的表达增加,因此,癌症干细胞在营养缺乏条件下的活力增加。3.3:细胞周期分析为了检测营养缺乏的条件下是否诱导癌症干细胞的凋亡,p-mda-mb-231、p-mcf-7、s-mda-mb-231和s-mcf-7细胞系分别按照与实施例2相同的方法在葡萄糖缺乏的条件下培养12小时(早期)和40小时(后期),收集并进行细胞周期分析。收集到的细胞用70%乙醇固定,然后在含有40μg/ml碘化丙啶(pi)和100μg/ml核糖核酸酶的pbs缓冲液中孵育30分钟,以染色总dna。使用facscalibur流式细胞仪对染色的细胞进行细胞周期分析。使用facs和dna软件程序(flowjo)测量g0/g1期、s期和g2/m期细胞的比例。结果如图5。如图5所示,在早期阶段,普通干细胞和癌症干细胞无明显的细胞周期依赖性变化;然而在后期阶段,sub-g0/gl期癌症干细胞数明显减少。这些结果表明,在营养缺乏的条件下后期阶段普通癌细胞的凋亡增加,而营养缺乏条件下癌症干细胞的凋亡减少。从上述结果可以看出,与普通干细胞不同,癌症干细胞在营养缺乏条件下对细胞凋亡具有抗性(抗凋亡),因此即使在营养缺乏条件下仍显示高活力。实施例4:检测癌症干细胞凋亡抗性的原因4.1:细胞内ca2+水平的测定在发生凋亡的很多细胞中,细胞内钙的浓度没有被保持,因为发生了ca2+从内质网释放到细胞质或ca2+通过质膜流入细胞的情况。因此,为了检测ca2+迁移是否也发生在癌症干细胞中,按照与实施例3相同的方法在营养缺乏的条件下培养细胞系,使用钙离子指示剂fura-2-am检测细胞内ca2+水平。结果如图6所示。如图6所示,在早期阶段,普通癌细胞和癌症干细胞之间ca2+水平无明显的差异;然而,在后期阶段,癌症干细胞内ca2+水平高于普通癌细胞。4.2:camk-2α(ca2+/钙调蛋白依赖性激酶2α)表达水平分析为了研究癌症干细胞内ca2+水平高于普通癌细胞的原因,通过免疫印迹检测camk-2α表达水平。免疫印迹按照与实施例3.2描述操作,结果如图7所示。如图7所示,在早期以及后期阶段,camk-2α在癌症干细胞中的表达水平增加。从这些结果可以看出,camk-2α在癌症干细胞中的表达水平增加,因此,在营养缺乏和代谢能量应激条件下,ca2+从内质网释放到细胞的水平将被控制在一个控制水平,并因此癌症干细胞对细胞凋亡具有抗性。4.3:camk-2α(ca2+/钙调蛋白依赖性激酶2α)表达抑制效果的检测为了检测当camk-2α在癌症干细胞中表达时的效果,将从bioneer(韩国)购买的camk-2αsirna转染到每个细胞系中,从而产生表达camk-2α的癌症干细胞。此外,按照与实施例4.1和实施例4.2相同的方法检测camk-2α表达水平和细胞内ca2+的水平,结果如图8。如图8所示,在camk-2α表达被抑制的癌症干细胞中,ca2+的水平没有减少。该结果表明癌症干细胞中camk-2α的表达在维持细胞内ca2+水平方面起重要作用。另外,按照与实施例3所述相同方法,对camk-2α表达被抑制的癌症干细胞进行tunel测定、免疫印迹分析和细胞周期分析,分析结果分别如图9-11所示。如图9所示,营养缺乏下的癌症干细胞通常表现出对细胞凋亡具有抗性;然而在使用sirna抑制camk-2α表达的癌症干细胞中,与普通癌细胞一样,细胞凋亡被诱导以引起dna片段化。如图10所示,在camk-2α表达被抑制的癌症干细胞中,与普通癌细胞一样,在营养缺乏条件下,切割的半胱天冬酶水平再次增加,bcl-2的表达水平下降。另外,结果显示磷酸化的αkτ(ραkτ),磷酸化的ikb(pikb)和磷酸化的nf-kb(pnf-kb)的水平降低,ip3r(其为一种钙离子释放通道)增加。这些结果表明,当癌症干细胞中camk-2α的表达被抑制时,在营养缺乏条件下癌症干细胞的凋亡抗性下降,癌症干细胞与普通癌细胞显示出相似的结果。如图11所示,在camk-2α表达被抑制的癌症干细胞中,与普通干细胞一样,后期sub-g0/g1期的细胞比例增加,表明在营养缺乏条件下,癌症干细胞凋亡增多。从上述结果可以看出,营养缺乏下,癌症干细胞通过增加细胞中camk-2α的表达水平以将细胞内ca2+水平调节到适当的水平从而对ca2+介导的细胞凋亡产生抗性,当癌症干细胞中的camk-2α表达被抑制时,癌症干细胞丧失其对细胞凋亡的抗性。4.4:测定pgc-1α(过氧化物酶体增殖剂激活的受体γ)与camk-2α的关系为了研究pgc-1α(已知其表达在营养缺乏条件下被调节)是否与对ca2+介导的细胞凋亡的抗性有关,将sh-pgc-1α载体(origene)转染到s-mda-mb-231细胞系中,从而制备pgc-1α表达被抑制的癌症干细胞系。按照与实施例3.2中所述相同的方法对癌症干细胞系进行免疫印迹分析。结果如图12。如图12所示,营养缺乏条件下,在pgc-1α表达被抑制的癌症干细胞中,如普通癌细胞一样,早期和后期阶段camk-2α的表达也受到抑制,bcl-2、磷酸化akt和磷酸化nf-kb的表达水平减少。此外,结果显示,已知参与ca2+从内质网释放到细胞外的pmca(质膜ca2+atp酶)蛋白的表达水平也降低。从上述结果可以看出,在pgc-1α表达被抑制的癌症干细胞中,camk-2α和pmca的表达水平受到抑制。因此,为了检查细胞内ca2+的水平是否发生变化,按照与实施例4.1所述相同的方法测定ca2+的水平,结果如图13。如图13所示,在营养缺乏的早期阶段无明显差异;然而,在后期阶段,在pgc-1α表达的癌症干细胞中,细胞内ca2+水平升高,出现癌症干细胞凋亡。上述结果表明,在营养缺乏条件下,癌症干细胞中pgc-1α表达水平升高以诱导camk-2α的表达,因而使细胞内ca2+水平保持在适当的水平,从而对ca2+介导的细胞凋亡具有抗性,并且在营养缺乏条件下,pgc-1α对提高癌症干细胞的活力发挥重要作用。实施例5:检测pgc-1α在癌症干细胞中的作用5.1:检测pgc-1α和pmca1之间的结合关系为了检测pgc-1α和pmca1之间的结合关系,按照生产商的说明使用emsa试剂盒进行emsa测定。作为结合序列(探针),使用pmca1启动子结合位点序列“ttgacctttggccca”。结果示于图14。如图14所示,癌症干细胞在后期阶段,hnf4α、pgc-1α和dna(探针)之间的结合增加,而在普通癌细胞或pgc-1α表达被抑制的癌症干细胞中结合降低。这些结果表明,在营养缺乏条件下,pgc-1α与hnf4α结合并与pmca1的启动子区结合,从而调节pmca1的表达。5.2:检测pgc-1α和pmca2之间的结合关系为了检查pgc-1α和pmca2之间的关系,按照生产商的说明使用emsa试剂盒进行emsa测定。作为结合序列(探针),使用pmca2启动子的结合位点序列的“ctggaaatacccc”。结果示于图15。如图15所示,在营养缺乏条件下的癌症干细胞中,nf-kb、pgc-1α和dna(探针)之间的结合增加,当加入抗nf-kb的抗体anti-p65或anti-p50时,抗体进一步结合导致超迁移。这些结果表明,在营养缺乏条件下,pgc-1α与nf-kb结合并与pmca2的启动子区结合,从而调节pmca2的表达。5.3:测定pmca与营养缺乏的关系为了测定营养缺乏条件下pmca表达水平的变化,按照与实施例2所述相同的方法,在营养缺乏条件下培养每种细胞系,并且在不同培养时间点进行qrt-pcr。每个时间点收集细胞,并按照生产商的说明使用rneasymini试剂盒提取rna。取1μg提取的rna,使用一步rt-pcr试剂盒进行qrt-pcr。所用的引物序列如下表1所示。结果如图16,此外,使用camk-2α的表达被抑制的细胞系进行上述相同的实验,结果示于图17。表1基因产物正向引物反向引物pmca1tttccaaacactgcttctcttcggtccacagatgcattacgapmca2gttttaggcacttttgtggtctaattcctcctcaggtattpmca3aggcctggcagacaacaccatcccacaccagctgcaggaapmca4gagcttcctggataccgatgctagcttggccacactggapdhggtaaggtcggagtcaacgggaggtcaatgaaggggtcattg如图16所示,在s-mda-mb-231细胞系中,随着培养时间的延长,pmca1和pmca2的表达水平增加,而在s-mcf-7细胞系中,pmca1、pmca2和pmca4的表达水平升高。另外,如图17所示,与癌症干细胞不同,在camk-2α表达被抑制的细胞系中,营养缺乏下pmca的表达水平没有增加。5.4:pmca抑制的效果的检测为了研究在营养缺乏条件下pmca被抑制时,癌症干细胞钙浓度调节能力是否发生变化,通过使用caloxin(一种钙泵抑制剂)作为pmca(充当质膜中的ca2+-atpase(钙atp酶))的抑制剂和使用毒胡萝卜素作为serca(sarco/内质网ca2+-atpase,充当ca2+-atpase(钙atp酶))的抑制剂,抑制pmca和serca的活性,然后测定癌症干细胞的细胞外ca2+浓度的变化。结果如图18。如图18所示,与普通癌细胞相似,当使用钙泵抑制剂caloxin处理癌症干细胞时,癌症干细胞外的细胞外钙浓度降低,细胞活力也下降。然而,结果显示,当用serca抑制剂毒胡萝卜素处理癌症干细胞时,癌症干细胞的细胞外钙浓度保持在高水平,并且细胞活力也高。这些结果表明,当用钙泵抑制剂抑制pmca的活性时,可降低癌症干细胞在营养缺乏条件下的活力。从上述结果可以看出,在营养缺乏和代谢能量耗竭相关的内质网应激的条件下,癌症干细胞中pgc-1α的表达增加以促进camk-2α的表达,癌症干细胞显示出对ca2+介导的细胞凋亡的抗性,其中ca2+(作为pmca1和pmca2的共激活剂以提高pmca蛋白的表达,其在营养缺乏条件下从内质网释放到细胞质中)被释放到细胞外,从而在线粒体中积累以因而诱导凋亡。此外,从上述结果可以预期,钙泵抑制剂和通常用于抗癌治疗的诱导营养缺乏的方法相组合可以用作治疗癌症干细胞的有效方法。实施例6:癌症干细胞有效治疗方法的鉴定6.1:动物模型的构建为了鉴定针对癌症干细胞的有效治疗方法,构建了乳腺癌动物模型。为了构建乳腺癌动物模型,乳腺癌细胞(p-mda-mb-231和p-mcf-7)和乳腺癌干细胞系(s-mda-mb-231和s-mcf-7)分别在体外培养,将培养的细胞注射到5-6周龄balb/c裸鼠的左上腹部,细胞密度为1.0×107个细胞/小鼠。然后,将小鼠放在22℃、12h光照和12h黑暗交替环境下饲养7天,期间饲喂并饮水,从而构建乳腺癌动物模型。6.2:免疫组织化学为了检测以实施例6.1所述相同方法构建的乳腺癌动物模型中pmca1,pmca2,pgc-1α和camk-2α的表达是否增加,进行免疫组织化学分析。具体来说,根据标准外科病理学操作程序,从每只小鼠中收集肿瘤组织,并用10%中性缓冲福尔马林固定并包埋在石蜡中,然后,将组织切至5μm的厚度,除去石蜡。将切片组织置于柠檬酸盐缓冲液(ph6)中进行抗原恢复,并用3%过氧化氢处理5分钟,然后组织用1:100倍稀释的针对pmca1,pmca2,pgc-1α和camk-2α的单克隆抗体处理。然后,用苏木精对组织反染色,干燥后观察。使用metamorph4.6软件对染色部分进行定量。结果如图19。如图19所示,在癌症干细胞注射的乳腺癌动物模型中,pmca1,pmca2,pgc-1α和camk-2α的表达均增加。6.3:治疗癌症干细胞的方法的鉴定按照以实施例6.1所述相同方法构建的乳腺癌动物模型被分成几组,每组由9只动物组成,每只动物腹膜内注射500mg/kg葡萄糖吸收抑制剂2-脱氧葡萄糖(2dg)、250mg/kg双胍类药物二甲双胍和200mg/kgcaloxin2al的组合,每天一次,连续给药45天,每天使用卡尺测量肿瘤的水平直径(a)和垂直直径(b),并根据以下公式计算肿瘤的体积:4/3xbx(acmxbcm)3x1/2。结果如表2和图20。表2如上表2和图20所示,对普通癌细胞和癌症干细胞之间肿瘤体积进行比较时,结果显示癌症干细胞组的肿瘤生长明显地快。此外,与对照组相比,在2-脱氧葡萄糖单独给药治疗癌症干细胞的情况下,肿瘤体积略有下降。在2-脱氧葡萄糖和二甲双胍联合给药治疗癌症干细胞的情况下,肿瘤体积略有下降,但在2-脱氧葡萄糖和caloxin联合给药治疗癌症干细胞的情况下,肿瘤体积减少5倍或更多。此外,在2-脱氧葡萄糖、caloxin和二甲双胍联合给药治疗癌症干细胞的情况下,癌症干细胞基本上不生长。上述结果说明,葡萄糖吸收抑制剂和双胍类药物诱导癌症干细胞中的营养缺乏和代谢能量耗竭相关的内质网应激,从而诱导癌症干细胞中pmca的表达,结果还说明,钙泵抑制剂联合葡萄糖吸收抑制剂和双胍类药物给药降低癌症干细胞对ca2+介导的细胞凋亡的抗性,从而诱导癌症干细胞的凋亡,表明其可以提供一种特异性针对癌症干细胞的有效治疗方法。因此,可以发现葡萄糖吸收抑制剂和双胍类药物与钙泵抑制剂联合使用可以有效抑制癌症干细胞介导的癌症复发和/或转移(这是常规抗癌药物的局限性)。实施例7:癌症干细胞存活机制的检测7.1:测定癌细胞与癌症干细胞之间的基因表达差异为了检测癌症干细胞的存活机制,按照与实施例2所述相同的方法将p-mda-mb-231,p-mcf-7,s-mda-mb-231和s-mcf-7细胞系分别在葡萄糖缺乏的条件下培养40小时,收集细胞,并按照与实施例5.3所述相同的方法从收集的细胞中提取rna,并进行微阵列分析,结果如图21。如图21所示,作为ca2+-atpase(钙atp酶)的serca2基因在癌症干细胞中显著增加。此外,为了测定钙调节基因的表达差异,按照与实施例3.2所述相同的方法进行免疫印迹分析。结果如图22显示。如图22所示,在癌症干细胞中,serca2的表达增加,而ip3r的表达降低。通常所知,在葡萄糖缺乏条件下,细胞中的钙离子通过ip3r通道释放到细胞质中,当钙的释放迅速增加时,最终诱导细胞凋亡,并且在诱导凋亡过程中,可能出现通过serca2重吸收钙离子以抑制细胞凋亡。从上述结果可以看出,在癌症干细胞中,serca2的表达增加以促进钙的再吸收,且ip3r的表达被抑制从而钙离子释放到细胞质中也被抑制。如图23可以看出,由于camk-2α的调节,癌症干细胞中ip3r的表达首先被抑制,从而钙离子的释放将被抑制,然后发生通过serca的被释放钙离子的细胞内吸收以抑制细胞凋亡,从而即使在营养耗竭的情况下,细胞的活力也会增加。7.2:测定camk-2α信号转导机制的变化为了测定在营养缺乏条件下,camk-2α信号机制的时间依赖性变化,按照与实施例3.2所述相同的方法进行免疫印迹,按照与实施例5.1所述的相同方法使用pnf-kb进行emsa测定。结果示于图24和图25。如图24所示,与普通干细胞不同,在癌症干细胞中,随着营养缺乏的进展,camk-2α信号转导机制的信号传导物质被激活。此外,如图25所示,pnf-kb作为转录因子,提高ip3r抑制剂bcl-2和serca2的表达。这些结果表明,当camk-2α信号转导被激活时,nf-kb被磷酸化和活化,并且由于活化的nf-kb,bcl-2和cerca2的表达增加,从而使得钙离子的再吸收增加,并且ip3r的表达被抑制从而钙离子的释放被抑制。7.3测定camk-2α信号转导机制被抑制的影响为了测定当camk-2α信号被抑制时发生的影响,用10μm公知为camk-2α抑制剂的kn62(1-[n,o-双(5-异喹啉磺酰基-n-甲基-l-酪氨酰基]-4-苯基哌嗪)处理癌症干细胞,然后按照与实施例3.1所述相同的方式进行tunel测定以检测凋亡和dna片段化。此外,按照与实施例3.2中所述相同的免疫印迹法检测基因的表达,并按照与实施例2所述相同的方法测量细胞的活力。结果如图26-28。如图26-28显示,当在营养缺乏条件下癌症干细胞的camk-2α信号转导被抑制时,没有发生nf-kb磷酸化,基于此原因,ip3r的表达被抑制,而serca2的表达提高,因此钙离子的释放将被增加,从而诱导凋亡。这些结果表明,camk-2α的抑制剂可以降低癌症干细胞对ca2+介导的细胞凋亡的抗性,从而诱导癌症干细胞的凋亡,表明camk-2α抑制剂的使用能够提供特异性针对癌症干细胞的有效治疗方法。实施例8:测定癌症干细胞动物模型的特征为了测定按照实施例6所述相同的方法构建的动物模型的特征,从动物模型中提取已产生的乳腺癌组织,并测量肿瘤体积。结果如图29所示。此外,通过免疫印迹和免疫组织化学分析乳腺癌组织中蛋白质的表达水平。按照与实施例3.2所述相同的方法进行免疫印迹分析,按照与实施例6.2所述相同的方法进行免疫组织化学分析,结果如图30和图31。如图29所示,基于癌症干细胞的动物模型中肿瘤的生长率高于基于普通癌细胞的动物模型。另外,如图30和图31所示,与基于普通癌细胞的动物模型相比,基于癌症干细胞的动物模型中ip3r的表达降低,serca2的表达增加。这些结果与体外实验结果一致。从这些结果可以看出,在癌症干细胞中,camk-2α信号转导机制可以在体内恶劣的环境中被激活,从而抑制ip3r的表达并增加serca2的表达,从而抑制钙离子释放诱导的凋亡,因而提高癌细胞在体内的活力并促进肿瘤复发和/或转移。这表明,有效针对癌症干细胞的用于治疗癌症干细胞的组合物可以用作有效的治疗方法,其可以克服传统抗癌疗法的局限性,从而最大化对癌症的治疗效率并抑制癌症复发和/或转移。尽管参考具体特征详细描述了本公开发明,但对本领域技术人员显而易见的是,该描述仅仅是其优选实施方式,并不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等价形式来限定。工业适用性如上所述,本发明的组合物可以通过有效地诱导癌症干细胞的凋亡从而用作治疗癌症干细胞的药剂。因此,本发明的组合物可用作能够有效治疗各种癌症干细胞以有效抑制癌症复发和/或转移的药物组合物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1