鞣酸在制备护肝药物中的应用的制作方法
本发明涉及鞣酸的新用途,具体地说是鞣酸在制备具有保护肝脏功效药物中的用途。
背景技术:
多元酚类化合物鞣酸(tannic acid),又名单宁酸、单宁,由五倍子中得到的一种鞣质。分子式为C76H52O46,相对分子质量为1701.20,淡黄色至浅棕色无定型粉末或松散有光泽的鳞片状或海绵状固体,暴露于空气中能变黑。无臭,微有特殊气味,具强烈的涩味,露置光和空气中色变深。溶于水,易溶乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚,CAS号:1401-55-4。
对乙酰氨基酚是典型的剂量依赖性肝毒性药物,在体内经氧化反应形成高活性的中间代谢产物N-乙酰-对-苯醌亚胺(NAPQI)。在治疗剂量时,对乙酰氨基酚在肝脏代谢主要是生物转化的第二相反应即与硫酸盐和葡萄糖醛酸结合,但有一小部分代谢药物通过生物转化的第一相反应即肝内质网中的细胞色素P450(CYP)介导的氧化反应,随后再进行第二相结合反应。在生理状态下,氧化反应主要通过细胞色素P450酶系统,主要是CYP2E1和CYP3A4两种同功酶,形成大量的NAPQI,NAPQI与谷胱甘肽结合无毒的硫醇尿酸而排出。当对乙酰氨基酚过量时,硫酸盐化作用和糖脂化作用的通路饱和,快速生成的NAPQI可导致肝内的谷胱甘肽(GSH)储备耗竭和降低解毒作用。NAPQI耗尽肝内的GSH,使氧化系统和抗氧化系统失衡,生成大量活性氧族(ROS)和活性氮族(RNS)并产生氧化应激,最终导致肝小叶中心的坏死。
鞣酸是一种植物来源的水溶性多元酚,红酒和绿茶中含有丰富的鞣酸。近期的研究结果发现鞣酸的心血管保护作用与其抑制L-型钙离子通道、激活开放Kv7.4/7.5离子通道和降低心肌收缩力有关。但是至今未见鞣酸对肝脏急性损伤保护作用的报道。
技术实现要素:
本发明的目的就是提供鞣酸的一种新用途,即在制备保护肝脏的药物中的应用,尤其在减轻对乙酰氨基酚诱导的肝脏毒性药物中的应用,起到肝细胞保护的作用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备通过抗氧化应激、抗炎和抗凋亡作用达到多靶点治疗肝脏毒性药物中的应用,尤其在治疗乙酰氨基酚诱导的肝脏毒性药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备降低丙氨酸转氨酶(ALT)、氨基转移酶(AST)水平药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备降低一氧化氮(NO)、内皮素-1(ET-1)水平药物中的应用。
进一步本发明提供了一种多元酚类类化合物鞣酸的新用途,即鞣酸在制备降低丙二醛(MDA)的水平药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备减轻肝组织肝窦充血、减少炎性细胞浸润并且减少肝细胞坏死药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备降低c-fos、c-jun、肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)的表达药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备增加细胞凋亡相关因子bcl-2表达水平药物中的应用。
进一步本发明提供了一种多元酚类化合物鞣酸的新用途,即鞣酸在制备降低细胞凋亡相关因子bax、NF-κB(p65)、caspase-3表达水平药物中的应用。
本发明提供的鞣酸作为肝脏保护药,与药学上允许使用的载体或稀释剂混合,制备成抑制对乙酰氨基酚诱导的肝细胞氧化应激反应、炎症反应和肝细胞凋亡药物制剂,可保护肝细胞。
本发明所述化合物均可从商业渠道获得。
本发明所指药学上可以接受的载体或稀释剂,可选自药物制剂中常用的赋形剂、辅料或溶剂。如乳糖、蔗糖、糊精、滑石粉、明胶、琼脂、果胶、阿拉伯树胶、硬脂酸镁、硬脂酸、纤维素的低级烷基醚、玉米淀粉、马铃薯淀粉、树胶、糖浆、花生油、橄榄油、磷脂、脂肪酸、脂肪酸胺、单硬脂酸甘油脂或二硬脂酸甘油脂、着色剂、矫味剂、防腐剂、水、乙醇、丙醇、生理盐水、葡萄糖溶液等等。
本发明提供的鞣酸作为肝脏保护药的具体制备方法可按照制剂常规进行。如本发明所述化合物可以作为活性成份,与水、蔗糖、山梨醇糖、果糖等制备成口服液体制剂;也可以乳糖、葡萄糖、蔗糖、甘露醇糖等为赋形剂,以淀粉等为崩解剂,以硬脂酸、滑石粉等为润滑剂,明胶、聚乙烯醇为结合剂制备成片剂或胶囊剂;还可与生理盐水、葡萄糖溶液或盐水与葡萄糖组成的混合载体制备成注射液。还可制成无菌粉针剂以及各种缓释剂、混悬剂、乳剂等等。
附图说明
图1鞣酸的化学结构式
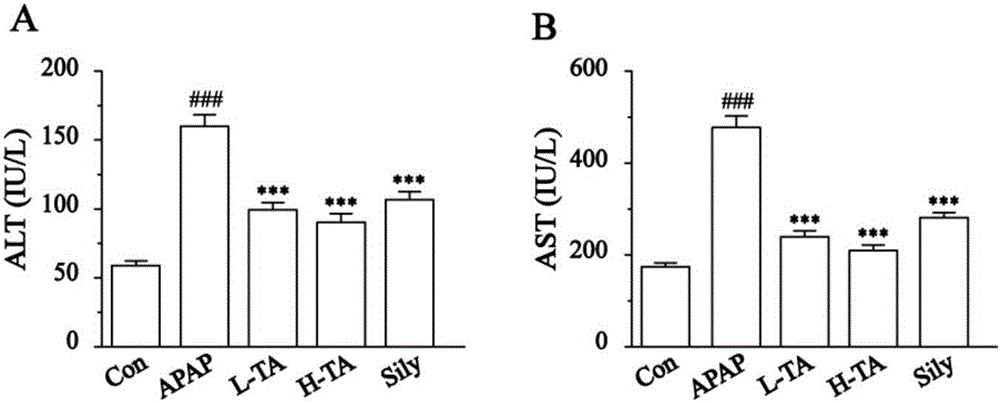
图2A鞣酸抑制ALT的统计图;
图2B鞣酸抑制AST的统计图;
图3A鞣酸抑制ET-1的统计图;
图3B鞣酸抑制NO的统计图;
图4A鞣酸增大SOD活性的统计图;
图4B鞣酸增大GSH-Px活性的统计图;
图4C鞣酸降低MDA含量的统计图;
图4D鞣酸增大CAT活性的统计图;
图5A空白组小鼠的病理切片图(400×);
图5B对乙酰氨基酚模型组小鼠的病理切片图(400×);
图5C鞣酸低剂量组(25mg/kg)小鼠的病理切片图(400×);
图5D鞣酸高剂量组(50mg/kg)小鼠的病理切片图(400×);
图5E水飞蓟素组(100mg/kg)小鼠的病理切片图(400×);
图6A空白组小鼠肝脏免疫组化切片图(400×);
图6B对乙酰氨基酚模型组小鼠肝脏免疫组化切片图(400×);
图6C鞣酸低剂量组(25mg/kg)小鼠肝脏免疫组化切片图(400×);
图6D鞣酸高剂量组(50mg/kg)小鼠肝脏免疫组化切片图(400×);
图6E水飞蓟素组(100mg/kg)小鼠肝脏免疫组化切片图(400×);
图7A鞣酸降低bax表达的Western blot条带及统计图;
图7B鞣酸降低caspase-3表达的Western blot条带及统计图;
图7C鞣酸增大bcl-2表达的Western blot条带及统计图;
图7D鞣酸降低NF-κB(p65)表达的Western blot条带及统计图。
具体实施方式
实施例1鞣酸对对乙酰氨基酚所致肝损伤的保护作用。
1材料与方法:
1.1实验动物
纯种清洁级雄性昆明小鼠50只,体重18-22g,购自河北医科大学实验动物中心。
1.2实验用药物
鞣酸(Tannic acid,TA)购自Sigma Chemicals(St.Louis,MO,USA)。
对乙酰氨基酚(Acetaminophen,APAP)购自Sigma Chemicals(St.Louis,MO,USA)。
水飞蓟素(Silymarin,Sily)购自西安一禾生物工程有限公司(Xi'an,China)。
1.3模型制备
实验动物常规观察1周后随机分为5组,每组各10只。分别为空白对照组(Con)、APAP诱导肝损伤模型对照组(400mg/kg,APAP)、TA低剂量组(25mg/kg,L-TA)、TA高剂量组(50mg/kg,H-TA)和Sily阳性药对照组(100 mg/kg,Sily)。各组小鼠称重后,Con及APAP组每天灌胃生理盐水0.2ml/10g,L-TA、H-TA和Sily组分别灌胃25mg/kg TA,50mg/kg TA和100mg/kg Sily,连续3天。后除空白组外其余各组于第3天一次性灌胃400mg/kg APAP,复制小鼠急性肝损伤模型。
1.4检测指标
1.4.1生物化学方法测定氧化应激及器官功能相关因子:丙氨酸转氨酶(ALT)、氨基转移酶(AST)、一氧化氮(NO)、内皮素-1(ET-1)、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)。
1.4.2病理学指标:光镜观察肝脏组织病理学变化。
1.4.3 Western blot测定细胞凋亡相关因子(bax/bcl-2,NF-κB(p65),caspase-3)表达水平。
1.4.4免疫组化测定c-fos,c-jun,肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)的表达。
1.5统计处理
实验数据以均数±标准差表示,P<0.05具有统计学意义。
2结果
2.1 TA对ALT和AST的影响
与空白对照组比较,APAP诱导急性肝损伤小鼠的ALT和AST水平明显升高(P<0.001),而接受TA(25,50mg/kg)和Sily(100mg/kg)预处理后ALT和AST水平下降(P<0.001)(详见图2A,2B)。
2.2 TA对NO和ET-1的影响
与空白对照组比较,APAP诱导急性肝损伤小鼠的NO和ET-1水平明显升高(P<0.001),而接受TA(25,50mg/kg)和Sily(100mg/kg)预处理后NO和ET-1水平下降(P<0.001)(详见图3A,3B)。
2.3 TA对MDA、SOD、CAT和GSH-Px的影响
与空白对照组比较,APAP诱导急性肝损伤小鼠的SOD、CAT和GSH-Px水平明显降低而MDA水平明显升高(P<0.001)而接受TA(25,50mg/kg)和Sily(100mg/kg)预处理后SOD、CAT和GSH-Px水平明显上升(P<0.001,P<0.005)而MDA水平明显下降(P<0.001)(详见图4A,B,C和D)。
2.4 TA对肝脏组织病理学变化的影响
本实验病理学显示空白对照组肝脏部分具有正常组织结构(图5A)。正常对照组具有正常的肝组织结构;APAP模型对照组肝脏组织则造成严重的肝窦充血,炎性细胞浸润和肝细胞退化(图5B)。经TA和Sily预处理后,肝组织肝窦充血减轻,炎性细胞浸润减少并且肝细胞保存完好坏死减少(图5C,D和E)。
2.5 TA对c-fos,c-jun,TNF-α和IL-1β表达的影响
免疫组化结果显示APAP模型对照组(图6B)中肝脏组织高表达c-fos,c-jun,TNF-α和IL-1β,而在空白对照组(图6A)中则低表达c-fos,c-jun,TNF-α和IL-1β。与APAP模型对照组相比,TA低(图6C)、高(图6D)剂量组和Sily组(图6E)能够使小鼠肝脏组织中c-fos,c-jun,TNF-α和IL-1β表达降低(P<0.001 or P<0.005)。2.6TA对细胞凋亡相关因子bax/bcl-2,NF-κB(p65),caspase-3表达水平的影响
Western blot检测结果显示与空白对照组相比较,APAP模型对照组bax,NF-κB(p65),caspase-3表达显著增加(P<0.01),而bcl-2的表达显著降低(P<0.001)。与之相反,TA和Sily组的bax,NF-κB(p65),caspase-3表达显著降低(P<0.001 or P<0.05),而bcl-2的表达显著增加(P<0.05,P<0.005,P<0.001)(详见图7A,B,C和D)。
本实验结果显示,TA剂量依赖性地改善过量APAP诱导急性肝损伤导致的肝组织病理学变化,降低ALT、AST、NO、ET-1、MDA含量,提高SOD、CAT、GSH-Px的活性,抑制c-fos,c-jun,TNF-α,IL-1β,Caspase-3和Bax的过度表达而上调Bcl-2的表达。本实验结果提示TA具有明显的抗APAP诱导的氧化应激作用,表明TA的肝保护作用机制可能与抗氧化、抗炎、抗凋亡有关。
实施例2制备口服片剂
按照本领域已知的方法制备片剂,每片含有下述成分:
以上实施例是为了更详细地说明本发明,但它不以任何形式限制本发明。
- 还没有人留言评论。精彩留言会获得点赞!