抗肿瘤中药组合物及其制备方法与流程
本发明涉及抗肿瘤中药技术领域,具体涉及一种抗肿瘤中药组合物及其制备方法。
背景技术:
肿瘤(tumor)是机体在各种致癌因素作用下,局部组织的某一个细胞在基因水平上失去对其生长的正常调控,导致其克隆性异常增生而形成的新生物。一般认为,肿瘤细胞是单克隆性的,即一个肿瘤中的所有瘤细胞均是一个突变的细胞的后代。肿瘤的肉眼观形态多种多样,并可在一定程度上反映肿瘤的良恶性。医学界一般将肿瘤分为良性和恶性两大类,其中恶性肿瘤又称为癌症,可发生在身体的大多数组织器官,其主要临床特征是生长迅速,对组织的浸润性强,可转移到身体其他部位,还会产生有害物质,破坏正常器官组织结构,使机体功能失调,严重的威胁患者生命。
世卫组织最新数据显示,到2020年前,全球癌症发病率将增加50%,即每年将新增1500万癌症患者。不仅如此,癌症的死亡人数也在全球迅猛上升,2007年全球共有760万人死于癌症,2030年这个数字可能会增至1320万。而且,全球20%的新发癌症病人在中国,24%的癌症死亡病人在中国。目前我国每死亡5人,即有1人死于癌症,而在0—64岁人口中,每死亡4人,即有1人死于癌症。在《2012中国肿瘤登记年报》中显示,我国每分钟就有6人被确诊为癌症患者,依此计算,我国每天就有8000多人被确诊为癌症,因而每年多达三百多万新增癌症病人。
目前尚未有特别有效的抗癌药物,能有效改善癌症患者症状的抗肿瘤药物数量也很少,而且需要长期使用,相对于庞大的癌症患者数量,目前可选的抗癌药物不多,并且价格昂贵,使大量癌症患者无法得到有效治疗。
近年来西医西药对癌症的治疗出现靶向药物和免疫细胞治疗法。“靶向药物”的意思是指这种药物可以分清“敌”、“我”,只针对癌细胞,不损害健康细胞。正是因为靶向杀伤或抑制癌细胞而极少伤害正常细胞的靶向治疗,该技术已经成为研究癌症治疗新技术的重要方向。“靶向药物”按其作用的标靶不同又可分为以下几种:(1)基因治疗和病毒治疗:早在2004年,全世界就有1020多个方案进入临床,63.4%用于癌症的治疗。主要是用复制缺陷型载体转运抗血管生成因子、抑癌基因、前药活化基因以及免疫刺激基因。其中以腺病毒携带P53临床进展最为迅速,全球至少有5个方案进入111期临床试验。但是,肿瘤基因治疗仍存在很多障碍,主要问题是载体不能特异性靶向肿瘤细胞,治疗基因在肿瘤细胞中高效表达低不足以消灭肿瘤,以及病毒载体外壳的改变等。
近年,治疗肿瘤的抗体药物研究取得了突破性进展。目前,国际上已有500多种抗体用于诊断与治疗,美国FDA已批准18个抗体上市,其中8个用于肿瘤治疗的靶向抗体。例如,治疗淋巴瘤的抗体Rituxan已治疗了30多万病人,用于一线治疗总反应率为60%—75%,其疗效与化疗相同;联合化疗有效率高达80%以上,完全缓解率达40%一63%;针对血管内皮生长因子的抗体Avastin使晚期结肠癌患者的生存期平均延长了5个月,目前美国95%结肠癌病人使用该药。但是,目前抗体治疗实体瘤仍存在着3个难题:抗体难以穿透实体肿瘤的细胞,因此,治疗大体积实体肿瘤的疗效仍不理想;生产成本及价格均非常昂贵;只能针对肿瘤细胞某个特异性受体,治疗中需要为抗体标上同位素或毒素,但副作用也随之增加。
肿瘤的发生、发展与细胞增殖、凋亡等信号传导通路中某一个环节密切相关。信号传导最重要的分子之一是蛋白质酪氨酸激酶,针对后者开发靶向药物成了抗癌药物的研究热点之一。目前,已被美国FDA批准的小分子STI-571(GleeveC或GliveC)可特异性杀死肿瘤细胞。在过去的15年中,人们发现了多个可以穿入活细胞的小肤,用这些小肤携带外源物质进入细胞,效率非常之高。但是,目前这些方法还处于初步实验,还有很多问题需要解决,如穿膜肤并非可以穿入所有细胞,其穿入机制也不明确,诱发免疫反应会干扰它在体内的疗效等。
RNA干扰(RNAinterferenCe,RNAi)是一种由短的双链RNA诱发的mRNA降解。这种现象发生在转录后水平,又称为转录后基因沉默。RNAi只降解与之序列相应的单个内源基因的mRNA,具有很高的特异性与效率。接受了小干扰RNA基因药物治疗的移植瘤模型,可同时提高对化疗药物的敏感性。但是,RNAi的治疗技术迄今没有获得广泛应用,主要问题是RNAi不容易导入肿瘤组织,在体内的半衰期也比较短。
以蛋白酪氨酸激酶为靶点的新药研发进展迅速。此激酶可催化ATP中γ一磷酸基转移到多种蛋白质的酪氨酸残基上,这在细胞生长、增殖和分化进程中具有重要作用。HerCeptinTM(GenenteCh与ROChe公司)是以酪氨酸激酶受体HERZ/neu为靶点的人源化单克隆抗体,与多种化疗药物有相加或协同效应。GleeveCTTM(瑞士NOvatiS公司)是针对酪氨酸激酶BCrAbl的一种特异性抑制剂。对治疗慢性髓样白血病具有非常好的疗效,已被FDA批准提前上市,用于治疗费城染色体呈阳性的慢性髓样白血病患者。Iressa(AstraZeneca公司)是针对EGFR酪氨酸激酶的可口服的小分子抑制剂。2003年5月FDA批准用于经含铂类或紫杉类方案化疗失败的晚期非小细胞肺癌,是第1个用于实体瘤治疗的针对特定靶点的小分子酪氨酸激酶抑制剂。但是,小分子靶向药物通常具有较大的毒副作用,而且存在明显的个体差异,因而大部分小分子靶向药物均在试验性治疗阶段。
近年研究发现,有几种细胞可以携带病毒载体进行系统给药治疗。这些细胞包括巨噬细胞、T细胞、NK细胞、异体肿瘤细胞以及目前研究最热的干细胞等。这些肿瘤趋化细胞可以感应肿瘤微环境发出的信号,具有追踪肿瘤、传递基因的作用,但仍需要更深入地研究。与传统方法相比,应用干细胞治疗疾病具有毒性低、一次用药有效、不需要完全了解疾病发病的确切机理等优点。但是,由于间充质干细胞主要来源于骨髓,在放化疗后的病人难以大量扩增这类细胞。
免疫细胞疗法是向肿瘤患者输入具有抗肿瘤活性的免疫细胞,直接杀伤肿瘤或激发机体抗肿瘤免疫反应,从而达到治疗效果的生物疗法。其操作包括细胞在体外的传代、扩增、修饰、筛选及经药物或其他能改变细胞生物学行为的处理;经体外操作后的体细胞可用于肿瘤治疗,也可用于肿瘤预防。体细胞免疫治疗已成为肿瘤患者放、化疗后辅助治疗的重要手段之一,其对于促进患者免疫系统的重建、消除残留病灶及骨髓净化都具有良好效果。但是,免疫细胞疗法目前处于初级阶段,主要用于辅助治疗,而患者反应不一,部分病人对此疗法不敏感。
从中医角度上说肿瘤的病因病机:肿瘤是由虚、毒、瘀、结四端引起所致,其形成的根本原因为正气亏虚,邪毒内蕴“其病机演变则为内蕴邪毒,耗气伤血,正不抑邪,邪毒乘虚,流窜经络、气血、筋骨,客于脏腑,日久聚而成积其过程充分体现了因虚致病,又因病致虚,正虚邪盛,正不抑邪的恶性演变规律”。这与现代医学对肿瘤发生机制的研究相吻合:虚——体现在机体免疫监控能力低下,而宿主低下的免疫状态是影响肿瘤细胞转移的重要因素,正虚的病理结果是肿瘤细胞在体内存活;毒——体现在余毒未清,手术、放、化疗后仍残存的亚临床病灶,成为死灰复燃、转移复发的根源;瘀——体现在血液的高凝、高粘及高聚状态;结——体现在微瘤栓的附壁、着床及转移瘤的迅速增殖和生长。
中医治疗癌症主要以扶正祛邪、标本兼治为原则,但目前中医治癌技术的发展也不尽人意。全国目前抗肿瘤中药产品虽多,却无法进入抗肿瘤主流药物行列。下列简述我国目前常见的几类抗肿瘤中药产品现状。
抑制癌细胞中药:包括康莱特注射液(主要成分:薏苡仁油)、消癌平注射液(主要成分:乌骨藤等)、鸦胆子油乳注射液(主要成分:鸦胆子提取物)、艾迪注射液(主要成分:黄芪、刺五加、人参、斑鳌提取物)、安尔欣注射液(主要成分:人参多糖)、华蟾素注射液(主要成分:中华大蟾蜍提取物)、金龙胶囊(主要成分:鲜守宫、鲜金钱白花蛇草)、抗肿瘤胶囊(主要成分:人参、斑鳌、半枝莲、甘草、熊胆粉、女贞子等)、安替可胶囊(主要成分:蟾皮等)、博生癌宁透皮贴(主要成分:布鲁生(Brucine)蟾蛛皮、番水鳖碱、藤黄素、大戟二烯醇、大黄素等)。这些中药产品主要通过抑制或直接杀灭肿瘤细胞而达到抗癌作用。
提高免疫抗肿瘤中药:包括莪术油注射液(主要成分:莪术油)、白花蛇舌草注射液(主要成分:白花蛇舌草提取物)、博尔宁胶囊(主要成分:黄芪、光慈菇、重楼、龙葵、紫苏子、僵蚕、大黄等)、复方红豆杉胶囊(主要成分:紫杉醇、人参皂甙、甘草甜素等)、楼莲胶囊(主要成分:重楼、半边莲、半枝莲、白花蛇舌草、蓬莪术、水蛙、水红花子、新开河红参、制何首乌、缩砂仁),等。这些中药产品主要通过提高或激活患者体内免疫力而达到抑制肿瘤细胞增殖的作用。
止痛类抗肿瘤中药:包括乌头注射液(主要成分:生川乌、生草乌提取物)、吗特灵注射液(主要成分:天然药物苦参提取物)、抗癌平丸(主要成分:珍珠菜、兰香草、百草霜、藤梨根、蛇毒、蟾酥、白花蛇舌草、石上柏、半枝莲、肿节风、合成蛋白等)、科博肽(主要成分:眼镜蛇神经毒素等),等。这些中药产品主要通过消肿作用而减轻肿瘤导致的疼痛症状,有的还具有抑制肿瘤细胞增殖的作用。
扶正类抗肿瘤中药:包括香菇多糖注射液(主要成分:香菇多糖)、云芝糖肽胶囊(主要成分:云芝多糖等)、天康宁胶囊(主要成分:桑蚕蛹和桑蚕卵)、贞芪扶正冲剂(主要成分:黄芪、女贞子)、参芪片(主要成分:人参、黄芪、当归、鹿角胶等)、龟鳖丸(主要成分:全龟、全鳖)、龟甲养阴片(主要成分:龟甲、鳖甲、地黄、珍珠等)、峰龄胶囊(主要成分:野生峰龄孢子发酵提取物),等。这些中药产品主要功能类似免疫增强剂的作用,通过增强机体抵抗力而达到抗肿瘤效果。
目前的抗肿瘤中药组合物项目很多,但迄今未见有中药产品可以取代西医西药的抗肿瘤治疗。虽然当今中西医对癌症的治疗虽有较大发展,但是尚无特别有效的方法可以解决癌症的治疗问题。
技术实现要素:
基于此,本发明提供一种抗肿瘤中药组合物,具有高效抗肿瘤活性又无显著毒副作用,且耐药性低。
本发明还提供一种抗肿瘤中药组合物的制备方法。
为了实现本发明的目的,本发明采用以下技术方案:
一种抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪15-45份、炒白术8-25份、白芍3-18份、柴胡8-25份、鸡血藤8-35份、丹皮8-25份、生半夏8-35份、厚朴3-18份、蚤休8-25份、莪术8-25份、蜈蚣3-18份、甘草3-15份、辣木籽3-18份、虎杖8-25份。
在其中一些实施例中,所述的抗肿瘤中药组合物包括如下重量份的组分:
黄芪20-40份、炒白术10-20份、白芍5-15份、柴胡10-20份、鸡血藤10-30份、丹皮10-20份、生半夏10-30份、厚朴5-15份、蚤休10-20份、莪术10-20份、蜈蚣5-15份、甘草3-10份、辣木籽5-15份、虎杖10-20份。
在其中一些实施例中,所述的抗肿瘤中药组合物包括如下重量份的组分:
黄芪30份、炒白术15份、白芍10份、柴胡15份、鸡血藤20份、丹皮15份、生半夏20份、厚朴10份、蚤休15份、莪术15份、蜈蚣10份、甘草6份、辣木籽10份、虎杖15份。
本发明还采用如下的技术方案:所述抗肿瘤中药组合物的制备方法为:
提供如下重量份的组分:黄芪15-45份、炒白术8-25份、白芍3-18份、柴胡8-25份、鸡血藤8-35份、丹皮8-25份、生半夏8-35份、厚朴3-18份、蚤休8-25份、莪术8-25份、蜈蚣3-18份、甘草3-15份、辣木籽3-18份、虎杖8-25份;
将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖置于提取容器中,加入上述药物体积8-12倍的水,加热所述提取容器,回流提取1.5h-2.5h,同时收集提取过程中产生的挥发油,提取完成后过滤,得到一次提取液;再向滤渣中加入滤渣体积6-10倍的水,继续提取1h-2h,同时收集提取过程中产生的挥发油,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,浓缩至每毫升浓缩液含生药量2-4克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。
在其中一些实施例中,所述的浓缩方法为:采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量2-4克。
本发明所述的抗肿瘤中药组合物,经试验,其对人肺癌A549细胞、鼻咽癌CNE-2Z细胞、骨肉瘤143B细胞、急性早幼粒细胞白血病HL-60细胞均具有高效的抑制作用,相比目前市场上用于治疗肺癌、鼻咽癌、骨肉瘤、急性早幼粒细胞白血病的常规用药长春瑞滨、尼莫司汀、甲氨蝶呤、维A酸等副作用低,不易诱发耐药性,具有高效抗肿瘤活性又无显著毒副作用,且药物耐药性低。
附图说明
图1是本发明实施例一所述的试验中1号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
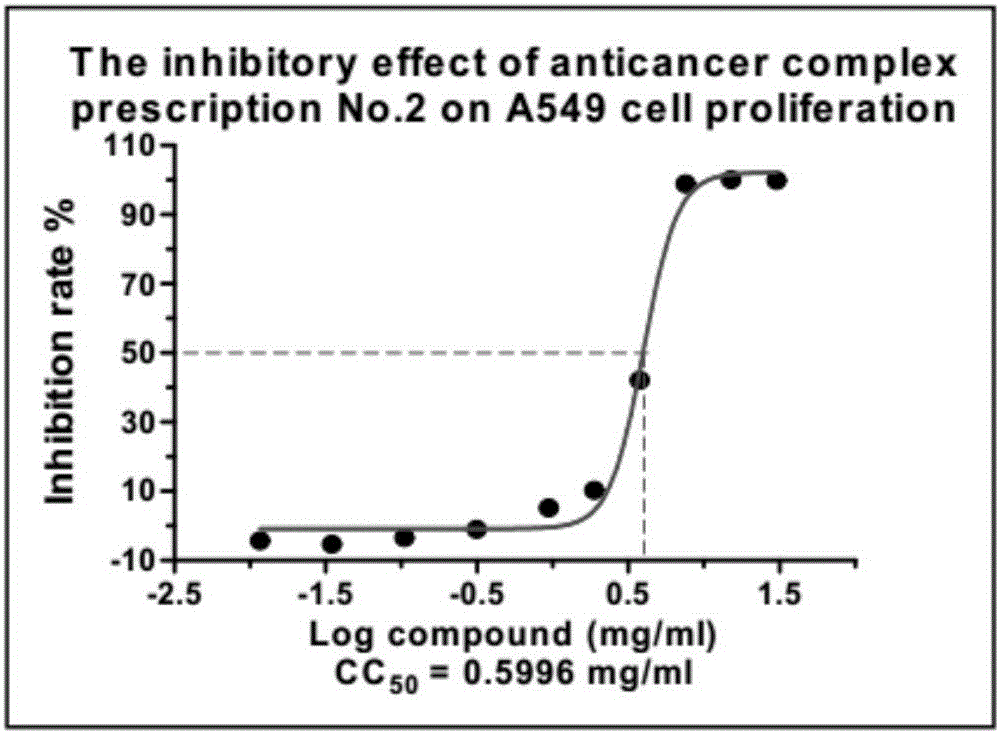
图2是本发明实施例一所述的试验中2号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图3是本发明实施例一所述的试验中3号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图4是本发明实施例一所述的试验中4号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图5是本发明实施例一所述的试验中5号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图6是本发明实施例一所述的试验中6号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图7是本发明实施例一所述的试验中7号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图8是本发明实施例一所述的试验中8号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图9是本发明实施例一所述的试验中9号组对人肺癌A549细胞生长抑制率及CC50值曲线图;
图10是本发明实施例一所述的试验中1号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图11是本发明实施例一所述的试验中2号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图12是本发明实施例一所述的试验中3号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图13是本发明实施例一所述的试验中4号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图14是本发明实施例一所述的试验中5号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图15是本发明实施例一所述的试验中6号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图16是本发明实施例一所述的试验中7号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图17是本发明实施例一所述的试验中8号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图18是本发明实施例一所述的试验中9号组对鼻咽癌CNE-2Z细胞生长抑制率及CC50值曲线图;
图19是本发明实施例一所述的试验中1号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图20是本发明实施例一所述的试验中2号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图21是本发明实施例一所述的试验中3号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图22是本发明实施例一所述的试验中4号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图23是本发明实施例一所述的试验中5号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图24是本发明实施例一所述的试验中6号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图25是本发明实施例一所述的试验中7号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图26是本发明实施例一所述的试验中8号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图27是本发明实施例一所述的试验中9号组对骨肉瘤143B细胞生长抑制率及CC50值曲线图;
图28是本发明实施例一所述的试验中1号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图29是本发明实施例一所述的试验中2号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图30是本发明实施例一所述的试验中3号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图31是本发明实施例一所述的试验中4号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图32是本发明实施例一所述的试验中5号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图33是本发明实施例一所述的试验中6号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图34是本发明实施例一所述的试验中7号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图35是本发明实施例一所述的试验中8号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图;
图36是本发明实施例一所述的试验中9号组对急性早幼粒细胞白血病HL-60细胞生长抑制率及CC50值曲线图。
具体实施方式
为了便于理解本发明,下面将对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪15-45份、炒白术8-25份、白芍3-18份、柴胡8-25份、鸡血藤8-35份、丹皮8-25份、生半夏8-35份、厚朴3-18份、蚤休8-25份、莪术8-25份、蜈蚣3-18份、甘草3-15份、辣木籽3-18份、虎杖8-25份。
在其中一些实施例中,所述的抗肿瘤中药组合物包括如下重量份的组分:
黄芪20-40份、炒白术10-20份、白芍5-15份、柴胡10-20份、鸡血藤10-30份、丹皮10-20份、生半夏10-30份、厚朴5-15份、蚤休10-20份、莪术10-20份、蜈蚣5-15份、甘草3-10份、辣木籽5-15份、虎杖10-20份。
在其中一些实施例中,所述的抗肿瘤中药组合物包括如下重量份的组分:
黄芪30份、炒白术15份、白芍10份、柴胡15份、鸡血藤20份、丹皮15份、生半夏20份、厚朴10份、蚤休15份、莪术15份、蜈蚣10份、甘草6份、辣木籽10份、虎杖15份。
其中,所述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖置于提取容器中,加入上述药物体积8-12倍的水,加热所述提取容器,回流提取1.5h-2.5h,同时收集提取过程中产生的挥发油,提取完成后过滤,得到一次提取液;再向滤渣中加入滤渣体积6-10倍的水,继续提取1h-2h,同时收集提取过程中产生的挥发油,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,浓缩至每毫升浓缩液含生药量2-4克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。在提取之前还可将上述的药品均进行粉碎,然后经40℃-50℃热水浸泡一段时间后再进行提取。其中的过滤方法为:采用高速离心或压滤等方法。
其中,所述的浓缩方法为:采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量2-4克。
当然,提取次数不限于两次,还可以进行两次以上的提取,合并多次提取液再进行过滤。提取次数越多,后面滤液所含的药物成分就越少。两次提取可基本达到80%-90%的提取率。
以下将通过几个实施例来进一步说明本发明的方案。
实施例一
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪30份、炒白术15份、白芍10份、柴胡15份、鸡血藤20份、丹皮15份、生半夏20份、厚朴10份、蚤休15份、莪术15份、蜈蚣10份、甘草6份、辣木籽10份、虎杖15份。
上述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖均进行粉碎,然后经40℃热水浸泡半小时,再置于提取容器中,加入上述药物体积10倍的水,加热所述提取容器,待沸腾后开始回流提取2h,采用挥发油提取器收集提取过程中的挥发油,提取完成后采用高速离心或压滤等方法进行过滤,得到一次提取液;再向滤渣中加入滤渣体积8倍的水,继续提取滤渣1.5h,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量3克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。上述药物浸膏直接食用即可。
采用实施例一所述的药物浸膏进行样品试验如下:
试验浸膏样品的制备:称取米粒大小的浸膏至离心管中,按1ml的量逐次加入蒸馏水,震荡溶解,至溶液澄清,离心机离心1000rpm*3min,用移液枪将上清液移至干净试管A内。向离心管底部的沉淀物中加少许蒸馏水,震荡溶解,肉眼观察是否溶解完全,若沉淀物的量不随溶液量增加而减少,则停止加液,记录下总共加入的蒸馏水的体积x ml。并将搅拌使试管内的溶液混匀,将该试管内的溶液分装在两个EP管内,每管5ml,EP管密封,并标明处方号、浸膏浓度、日期。按照表一所述的实验设计进行试验:
表一抗癌中药复方9个样本抗肿瘤实验设计表
抗肿瘤活性实验部分:
瘤细胞试验:按照《细胞毒类抗肿瘤药物非临床研究技术指导原则》(中国新药与临床杂志,27(6):462,2008),进行体外抗肿瘤细胞试验,测定9个中药复方的抗肿瘤活性。采用培养肿瘤细胞,观察细胞生长速度,以合适的细胞密度2.0-5.0×103cells/well接种于96孔培养板,培养16-24小时后,加入10个梯度浓度的化合物(9个中药抗癌复方样品),孵育培养72小时后CCK-8法测定细胞活力,得出不同浓度的中药复方提取物对人肺癌A549细胞、鼻咽癌CNE-2Z细胞、骨肉瘤143B细胞、急性早幼粒细胞白血病HL-60细胞的增殖抑制率及CC50值。
一、细胞培养:采用RPMI-1640培养基,10%FBS培养人肺癌A549细胞、鼻咽癌CNE-2Z细胞、骨肉瘤143B细胞,置于37℃、5%二氧化碳培养箱中培养。每日使用倒置显微镜观察细胞1次,隔2-4天换培养液一次。培养瓶中的细胞生长到80%~95%融合时进行细胞传代或收集细胞铺板培养。弃去旧培养液,加入0.25%胰酶消化液2ml,细胞变圆﹑上浮后,加入4ml培养液终止消化,再转移至无菌离心管中,1000r/min离心4min,弃上清液,以1:4-1:6比例转移至新的无菌培养皿中培养。采用IMDM培养基,20%FBS培养人急性早幼粒细胞白血病HL-60细胞,置于37℃、5%二氧化碳培养箱中培养。每日使用倒置显微镜观察细胞1次,隔2-4天换培养液一次。培养瓶中的细胞生长到80%~95%融合时进行细胞传代或收集细胞铺板培养。将细胞悬液转移至无菌离心管中,1200r/min离心5min,弃上清液,以1:4-1:6比例转移至新的无菌培养皿中培养。
二、药物配制:受试的中药抗癌复方提取物中采用含5%FBS的RPMI-1640培养基配制,2-4倍梯度稀释,配制成9个浓度梯度浓度的工作液。
三、细胞铺板:收集对数生长期的A549、143B、CNE-2Z细胞,计数,用5%FBS的RPMI-1640培养基重悬细胞,调整细胞浓度2.22~5.55×104Cells/ml,接种96孔板,每孔加90μl的细胞悬液约2000~5000个细胞,在37℃,5%CO2条件下孵育过夜。收集对数生长期的HL-60细胞,计数,用10%FBS的IMDM培养基重悬细胞,调整细胞浓度1.66~2.22×105Cells/ml,接种96孔板,每孔加90μl的细胞悬液约15000~20000个细胞,在37℃,5%CO2条件下孵育培养。
四、细胞给药:待A549、143B、CNE-2Z细胞铺板孵育过夜后(待HL细胞铺板孵育1-4小时后),弃去原培养基,每孔对应加入9个梯度浓度的工作液10μl(第1,2个高浓度给药孔直接加入10-20μl的样品母液),置于37℃含5%CO2培养箱中孵育72小时;同时设立不加化合物加细胞的阴性对照组Ac和不加细胞及化合物的空白对照组Ab。
五、吸光度测定:加药72小时后,弃去原培养基,加入100μl含10%CCK-8的DMEM培养基置于37℃培养箱中孵育1.5-2.5小时,酶标仪450nm处检测各孔的吸光度(A)值。
数据处理:按下式计算药物对肿瘤细胞生长的抑制率:肿瘤细胞生长抑制率%=[(Ac-As)/(Ac-Ab)]×100%;其中,As:样品的吸光度(细胞+CCK-8+待测化合物);Ac:阴性对照的吸光度(细胞+CCK-8+DMSO);Ab:空白对照的吸光度(培养基+CCK-8+DMSO),并采用Graph Pad Prism 5软件分析数据及作图。数据处理软件分别计算各化合物在72小时的CC50值。
结果:本次实验的9个中药抗癌复方样本人肺癌A549细胞、鼻咽癌CNE-2Z细胞、骨肉瘤143B细胞、急性早幼粒细胞白血病HL-60细胞均有一定疗效;CC50值在0.4mg/ml至25mg/ml之间。按照一定的浓度梯度给药48h后,显微镜下观察可明显看到细胞生长活性的变化,由高浓度向低浓度给药孔、阴性对照孔,细胞的数量是逐渐增多的;在前面的几个高剂量孔可明显看到较多的细胞碎片,细胞的整体活性较差。中药复方1-3号样品的浓度较低,个别样高浓度给药孔对细胞的最大抑制率低于50%未能得到CC50值。中药抗癌复方4号、6号、7号、8号、9号均有较好的抑瘤疗效;CC50值在10mg/ml以内(具体实验结果如下图“中药抗癌复方对A549、CNE-2Z、143B、HL-60细胞增殖抑制疗效曲线图”所示)。实验采用Cell Counting Kit-8试剂盒进行检测,活细胞越多孵育的时间越长则颜色越深,相对应的450nm吸光度值越大。由于中药抗癌复方样本有颜色,HL60细胞是悬浮生长的细胞,检测前不能换液,对检测值会造成直接影响。检测时,高浓度给药孔的吸光度值较高,而实际镜下观察高浓度给药孔的细胞较少、活性较差;这里观察结果与检测值出现偏差,检测值仅做参考。建议尽量避免选取悬浮细胞做药效筛选。实验周期较长样品反复冻融放置一段时间后可在管底析出沉淀,提示样品的溶解度、稳定性、均一性较差;这也造成了个别样本重复实验的结果波动较大。
附图1-36分别示出了1-9号试验组分别对人肺癌A549细胞、鼻咽癌CNE-2Z细胞、骨肉瘤143B细胞、急性早幼粒细胞白血病HL-60细胞的增殖抑制率及CC50值曲线图。由图中可以得出结论:本次受试的中药抗癌复方1-9号均具有高效的抗肿瘤抑制细胞增殖作用,尤其4号、6号、7号、8号、9号效果更佳。
实施例二
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪20份、炒白术10份、白芍5份、柴胡10份、鸡血藤10份、丹皮10份、生半夏10份、厚朴5份、蚤休10份、莪术10份、蜈蚣5份、甘草3份、辣木籽5份、虎杖10份。
上述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖均进行粉碎,然后经40℃热水浸泡半小时,再置于提取容器中,加入上述药物体积8倍的水,加热所述提取容器,待沸腾后开始回流提取2.5h,采用挥发油提取器收集提取过程中的挥发油,提取完成后采用高速离心或压滤等方法进行过滤,得到一次提取液;在向滤渣中加入滤渣体积6倍的水,继续提取滤渣1h,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量4克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。上述药物浸膏直接食用即可。
针对实施例二采用与实施例一相同的方法进行试验,得到实施例二所述的药物对抗肿瘤也具有很好的效果,且无毒副作用。
实施例三
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪40份、炒白术20份、白芍15份、柴胡20份、鸡血藤30份、丹皮20份、生半夏30份、厚朴15份、蚤休20份、莪术20份、蜈蚣15份、甘草10份、辣木籽15份、虎杖20份。
上述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖均进行粉碎,然后经40℃热水浸泡半小时,再置于提取容器中,加入上述药物体积12倍的水,加热所述提取容器,待沸腾后开始回流提取1.5h,采用挥发油提取器收集提取过程中的挥发油,提取完成后采用高速离心或压滤等方法进行过滤,得到一次提取液;在向滤渣中加入滤渣体积6倍的水,继续提取滤渣1h,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,采用减压真空浓缩设备或薄膜浓缩设备浓缩至得到浓缩液,然后将浓缩液与挥发油合并,每毫升浓缩液含生药量2克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。上述药物浸膏直接食用即可。
针对实施例三采用与实施例一相同的方法进行试验,得到实施例二所述的药物对抗肿瘤也具有很好的效果,且无毒副作用。
实施例四
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪15份、炒白术8份、白芍3份、柴胡8份、鸡血藤8份、丹皮8份、生半夏8份、厚朴3份、蚤休8份、莪术8份、蜈蚣3份、甘草3份、辣木籽3份、虎杖8份。
上述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖均进行粉碎,然后经40℃热水浸泡半小时,再置于提取容器中,加入上述药物体积10倍的水,加热所述提取容器,待沸腾后开始回流提取1.5h,采用挥发油提取器收集提取过程中的挥发油,提取完成后采用高速离心或压滤等方法进行过滤,得到一次提取液;在向滤渣中加入滤渣体积9倍的水,继续提取滤渣1.8h,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量3克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。上述药物浸膏直接食用即可。
针对实施例四采用与实施例一相同的方法进行试验,得到实施例二所述的药物对抗肿瘤也具有很好的效果,且无毒副作用。
实施例五
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪45份、炒白术25份、白芍18份、柴胡25份、鸡血藤35份、丹皮25份、生半夏35份、厚朴18份、蚤休25份、莪术25份、蜈蚣18份、甘草15份、辣木籽18份、虎杖25份。
上述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖均进行粉碎,然后经40℃热水浸泡半小时,再置于提取容器中,加入上述药物体积12倍的水,加热所述提取容器,待沸腾后开始回流提取2.5h,采用挥发油提取器收集提取过程中的挥发油,提取完成后采用高速离心或压滤等方法进行过滤,得到一次提取液;在向滤渣中加入滤渣体积10倍的水,继续提取滤渣1.5h,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量3克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。上述药物浸膏直接食用即可。
针对实施例五采用与实施例一相同的方法进行试验,得到实施例二所述的药物对抗肿瘤也具有很好的效果,且无毒副作用。
实施例六
本发明所述的抗肿瘤中药组合物,其包括如下重量份的组分:
黄芪32份、炒白术20份、白芍15份、柴胡10份、鸡血藤12份、丹皮20份、生半夏23份、厚朴12份、蚤休18份、莪术15份、蜈蚣15份、甘草10份、辣木籽8份、虎杖13份。
上述抗肿瘤中药组合物的制备方法为:将黄芪、炒白术、白芍、柴胡、鸡血藤、丹皮、生半夏、厚朴、蚤休、莪术、蜈蚣、甘草、辣木籽以及虎杖均进行粉碎,然后经40℃热水浸泡半小时,再置于提取容器中,加入上述药物体积10倍的水,加热所述提取容器,待沸腾后开始回流提取2h,采用挥发油提取器收集提取过程中的挥发油,提取完成后采用高速离心或压滤等方法进行过滤,得到一次提取液;在向滤渣中加入滤渣体积8倍的水,继续提取滤渣1.5h,提取完成后过滤,得到二次提取液;合并上述一次提取液与二次提取液,采用减压真空浓缩设备或薄膜浓缩设备浓缩至每毫升浓缩液含生药量1克,得到浓缩液,然后将浓缩液与挥发油合并,得到药物浸膏。上述药物浸膏直接食用即可。
针对实施例六采用与实施例一相同的方法进行试验,得到实施例二所述的药物对抗肿瘤也具有很好的效果,且无毒副作用。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!