一种左乙拉西坦注射液的生产方法及其产品与流程
本发明属于药品注射液
技术领域:
,具体涉及一种左乙拉西坦注射液的生产方法,以及依据该生产方法而制得的产品,即一种左乙拉西坦注射液。
背景技术:
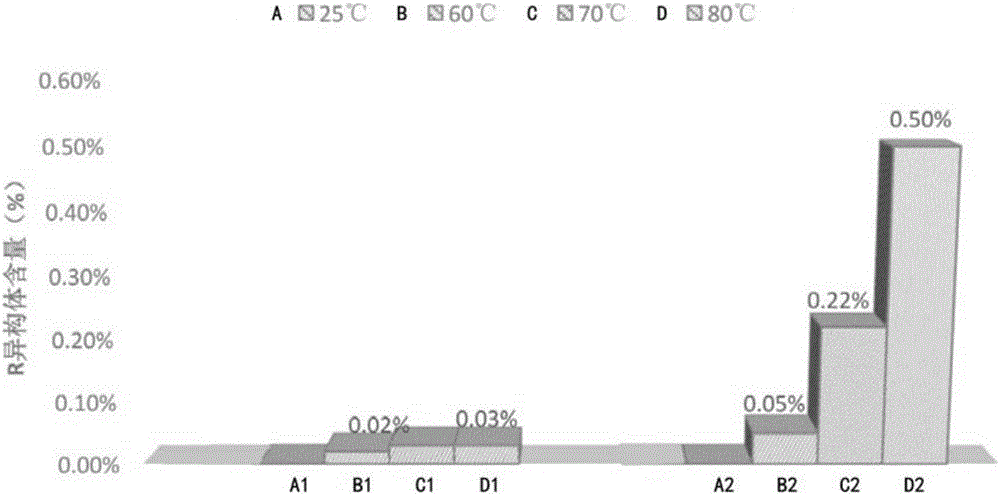
:癫痫(epilepsy)即俗称的“羊角风”或“羊癫风”,是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病。据中国最新流行病学资料显示,国内癫痫的总体患病率为7.0‰,年发病率为28.8/10万,1年内有发作的活动性癫痫患病率为4.6‰。据此估计中国约有900万左右的癫痫患者,其中500~600万是活动性癫痫患者,同时每年新增加癫痫患者约40万,在国内,癫痫已经成为神经科仅次于头痛的第二大常见病。左乙拉西坦是一种有效的抗癫痫药(EP0162036B),其化学名称为(S)-α-乙基-2-氧合-1-乙酰胺吡咯烷((-)-(S)-α-ethyl-2-oxo-1-pyrrolidineacetamide),其分子式为C8H14N2O2,分子量为170.21,具体结构式如下:左乙拉西坦为白色至类白色结晶性粉末,易溶于水(104.0g/100mL),氯仿(65.3g/100mL)和甲醇(53.6g/100mL),溶于乙醇(16.5g/100mL),微溶于乙腈(5.7g/100mL),不溶于正己烷。左乙拉西坦注射液作为成年癫痫症患者的部分性癫痫发作的辅助用药;当口服用药暂时不可行时,左乙拉西坦注射液可作为替代治疗。左乙拉西坦作为一种全新抗癫痫药物,具有良好的线性药代动力学,以原型从肾脏排出,无肝脏毒性,药物间相互作用少,有效率高,耐受性强,无严重不良反应。有望在全面性和部分癫痫中得到广泛应用。并且,临床试验证明,其右旋对映异构体(R)-α-乙基-2-氧合-1-乙酰胺吡咯烷完全没有抗癫痫活性(AJ.Gowe等,Eur.J.Pharmacol.,222,1992,193-203)。左乙拉西坦的确切抗癫痫作用机制尚不完全明确。目前普遍认为其与传统抗癫痫药物的作用机制不同,对γ-氨基丁酸能及谷氨酸能神经传导通路无直接作用,与苯二氮卓受体无亲和力,对神经元的电压门控钠离子通道、低电压门控T型钙离子通道无直接联系。目前的研究表明,其主要通过以下途径发挥作用:①与中枢神经元内广泛分布的突触小泡蛋白2A发生作用,调节突触囊泡的胞外分泌功能和突触前神经递质的释放。动物实验表明SV2A基因敲除小鼠表现出生长受限、神经元兴奋性增加及严重的惊厥易感性。左乙拉西坦与SV2A在脑内有很高的亲和性,并与抑制痫性放电密切相关。②对抗γ-氨基丁酸受体阻滞剂,从而间接增强γ-氨基丁酸受体的作用、抑制海马CA3区等处神经元的兴奋性。③抑制高电压激活的N型钙离子通道。④神经元兴奋性增高与海马内用于合成脑源性神经营养因子及神经肽γ的mRNA水平上调有关。左乙拉西坦则可减少这些基因表达的上调,从而抑制与之相关的神经元兴奋性增高。然而,在实际生产中,左乙拉西坦注射液里往往存在一些杂质,从而降低了左乙拉西坦的有效含量,其中最主要的杂质为左乙拉西坦的R异构体和左乙拉西坦酸;美国药典、英国药典以及欧洲药典中均明确规定应当控制上述杂质的限度,并且显示在左乙拉西坦中存在较高含量的R异构体等杂质;因此,在配制注射液时,应当有效控制该R异构体和左乙拉西坦酸杂质的含量。现有技术中,存在一系列左乙拉西坦注射液的配方与相应的生产工艺,例如:中国专利CN101623250A公开了一种含有左乙拉西坦的注射用药物组合物及其制备方法,包括:左乙拉西坦20%、氯化钠0.9%、冰醋酸1.0%、氢氧化钠1.1%、甘露醇77.0%以及注射用水,其使用常规的注射液配制工艺进行制备。中国专利申请CN101919811A公开了一种左乙拉西坦注射液配方,其使用了安瓿瓶作为封装容器,然而仍然采用了常规的注射液配制工艺进行制备。又如,中国专利申请CN102525900A公开了一种左乙拉西坦注射液的制备方法,该制备方法包括称取各组分,搅拌溶解,加入0.05%~0.2%(W/V)的针用活性碳,加压过滤药液去除热原,调节溶液的pH值在5.0~6.0范围内,然后先用0.45μm滤膜粗滤,再用0.22μm滤膜精滤,质检合格后灌装入5ml的西林瓶中,压盖密封;然后在121℃,15分钟的终端灭菌条件下灭菌后即得最终产品。然而,该制备方法不能有效降低左乙拉西坦的R异构体和左乙拉西坦酸的含量。由此可见,目前亟需提供一种全新的左乙拉西坦注射液的生产工艺,在确保有效降低R异构体和左乙拉西坦酸等杂质含量的基础上,以简单的操作步骤和较低的生产成本配制出高品质的左乙拉西坦注射液。技术实现要素:针对上述现有技术中存在的缺陷与不足,发明人旨在提供一种能够有效降低R异构体和左乙拉西坦酸等杂质含量的左乙拉西坦注射液的生产工艺;发明人意外地发现,采用特定的原辅料加入顺序可以制备出高品质的左乙拉西坦注射液,具有优异的稳定性。因此,本发明的第一方面,提供了一种左乙拉西坦注射液的生产方法,包括以下步骤:(1)称取占处方量60v%~90v%的注射用水,注入已清洁消毒的配液罐中,开启搅拌,然后分别加入处方量的氯化钠和处方量的醋酸钠,搅拌溶解完全;(2)向该配液罐中加入醋酸溶液,调节混合溶液的pH值至5.5±0.5;(3)向该配液罐中加入处方量的左乙拉西坦,搅拌溶解;并且,根据pH值偏离情况,再次使用醋酸溶液调节混合溶液的pH值至5.5±0.5;(4)补加所述注射用水至全量,继续搅拌,混合均匀得左乙拉西坦混合液;(5)向上述左乙拉西坦混合液中加入活性炭,在50℃~70℃下搅拌10~30min;(6)过滤,滤除活性炭;(7)调整装量符合规定后,滤液灌装于安瓿瓶中,熔封,灭菌,质检,贴签,包装后即得左乙拉西坦注射液产品。优选地,在上述左乙拉西坦注射液的生产方法中,所述注射用水的温度≤80℃。其中,注射用水符合《中国药典》2015年版通则0261制药用水项下的规定;并且,在本发明所提供的技术方案中,其它作为溶剂的水也为注射用水,例如,醋酸溶液中所使用的水。优选地,在上述左乙拉西坦注射液的生产方法中,所述醋酸溶液的浓度为1wt%~5wt%。优选地,在上述左乙拉西坦注射液的生产方法中,所述活性炭的加入质量为所述左乙拉西坦混合液总体积的0.05%~0.2%(w/v)。优选地,在上述左乙拉西坦注射液的生产方法中,步骤(6)包括:使含活性炭的左乙拉西坦混合液流经钛棒过滤器,再经0.45μm及二级0.22μm的过滤器过滤至缓冲罐,以滤除活性炭并降低微生物负荷。值得说明的是,所述活性炭为针用活性炭,主要用于去除热原并降低微生物负荷。优选地,在上述左乙拉西坦注射液的生产方法中,步骤(7)中的灭菌包括:将熔封后的安瓿瓶推入灭菌柜进行加热灭菌,灭菌温度为121~124℃,灭菌时间为15~18分钟。优选地,在上述左乙拉西坦注射液的生产方法中,步骤(7)中的质检包括:灭菌结束后进行色水检漏;灯检,调节照度至1000~1500lux,逐支检查。进一步优选地,在上述左乙拉西坦注射液的生产方法中,所述处方量的注射用水:所述处方量的氯化钠:所述处方量的醋酸钠:所述处方量的左乙拉西坦=5ml:45mg:8.2mg:0.5g。此外,醋酸溶液的用量根据实际情况而定,以保证混合溶液的pH值至5.5±0.5时的用量为准。此外,上述各物质是优选按上述比例投料的,例如,在大规模生产时,使用250L注射用水、2.25kg氯化钠、410g醋酸钠和25kg左乙拉西坦;同样采用适量醋酸溶液调节混合溶液的pH值至5.5±0.5。本发明的第二方面,提供了一种左乙拉西坦注射液,其由本发明第一方面所述的左乙拉西坦注射液的生产方法制得。优选地,上述左乙拉西坦注射液中,相对于左乙拉西坦的总质量,其中的左乙拉西坦酸的含量≤0.20wt%,其中的R异构体的含量≤0.08wt%。本发明所提供的左乙拉西坦注射液的生产方法,能够在确保有效降低R异构体和左乙拉西坦酸等杂质含量的基础上,以简单的操作步骤和较低的生产成本配制出高品质的左乙拉西坦注射液;该生产方法的原辅料加入顺序,为本技术方案的关键,意外地获得了比现有常规生产工艺更高品质的左乙拉西坦注射液。依据本发明所述生产方法制得的左乙拉西坦注射液,相对于左乙拉西坦的总质量,其中的左乙拉西坦酸的含量≤0.20wt%,其中的R异构体的含量≤0.08wt%,远小于现有常规生产工艺中结果。此外,《药品生产质量管理规范》(2010年修订)(卫生部令第79号)中规定:注射用水的制备、贮存和分配应当能够防止微生物的滋生,注射用水可采用70℃以上保温循环。左乙拉西坦注射液在放大生产过程中,如果采用常规生产工艺,则往往需要先将注射用水降温处理,并且之后进行活性炭除热源步骤时又需升高温度至60℃~70℃,这种操作会造成能源上的浪费,而且生产步骤繁琐;采用本发明所提供的左乙拉西坦注射液的生产方法时,无需降低注射用水的温度,生产可操作性更强,且高温更易于抑制微生物的增长,从而有效地降低过滤前药液的微生物负荷,多方面提高左乙拉西坦注射液的品质。众所周知,左乙拉西坦原料药在碱性高温条件下容易发生降解,在pH值5.0~6.0的高温条件下最稳定。然而,在常规的生产工艺中,左乙拉西坦溶解时的环境中性偏碱(pH值约7.0~7.5),因此,易生成酰胺键降解后的杂质左乙拉西坦酸,同时导致左乙拉西坦的R异构体含量升高;与此不同,在本发明所提供的技术方案中,左乙拉西坦溶解时的环境pH值约为5.5,为弱酸性环境,因此可有效避免左乙拉西坦酸和R异构体的生成,显著提高产品品质。综上所述,本发明所提供的左乙拉西坦注射液的生产方法,以及依据该生产方法而制得的产品,均具有良好的应用前景。附图说明图1为不同注射用水温度下,实施例1所制得的左乙拉西坦注射液产品(A1,B1,C1,D1)与左乙拉西坦注射液对比例产品(A2,B2,C2,D2)中左乙拉西坦酸杂质含量的对比柱状图;图2为不同注射用水温度下,实施例1所制得的左乙拉西坦注射液产品(A1,B1,C1,D1)与左乙拉西坦注射液对比例产品(A2,B2,C2,D2)中R异构体杂质含量的对比柱状图。具体实施方式下面结合具体实施方式对本发明作进一步阐述,但本发明并不限于以下实施方式。第一方面,本发明提供了一种左乙拉西坦注射液的生产方法,包括以下步骤:(1)称取占处方量60v%~90v%的注射用水,注入已清洁消毒的配液罐中,开启搅拌,然后分别加入处方量的氯化钠和处方量的醋酸钠,搅拌溶解完全;(2)向该配液罐中加入醋酸溶液,调节混合溶液的pH值至5.5±0.5;(3)向该配液罐中加入处方量的左乙拉西坦,搅拌溶解;并且,根据pH值偏离情况,再次使用醋酸溶液调节混合溶液的pH值至5.5±0.5;(4)补加所述注射用水至全量,继续搅拌,混合均匀得左乙拉西坦混合液;(5)向上述左乙拉西坦混合液中加入活性炭,在50℃~70℃下搅拌10~30min;(6)过滤,滤除活性炭;(7)调整装量符合规定后,滤液灌装于安瓿瓶中,熔封,灭菌,质检,贴签,包装后即得左乙拉西坦注射液产品。在一个优选实施例中,所述注射用水的温度≤80℃。在一个优选实施例中,所述醋酸溶液的浓度为1wt%~5wt%。在一个优选实施例中,所述活性炭的加入质量为所述左乙拉西坦混合液总体积的0.05%~0.2%(w/v)。在一个优选实施例中,步骤(6)包括:使含活性炭的左乙拉西坦混合液流经钛棒过滤器,再经0.45μm及二级0.22μm的过滤器过滤至缓冲罐,以滤除活性炭并降低微生物负荷。在一个优选实施例中,步骤(7)中的灭菌包括:将熔封后的安瓿瓶推入灭菌柜进行加热灭菌,灭菌温度为121~124℃,灭菌时间为15~18分钟。在一个优选实施例中,步骤(7)中的质检包括:灭菌结束后进行色水检漏;灯检,调节照度至1000~1500lux,逐支检查。在一个进一步优选的实施例中,所述处方量的注射用水:所述处方量的氯化钠:所述处方量的醋酸钠:所述处方量的左乙拉西坦=5ml:45mg:8.2mg:0.5g。第二方面,本发明提供了一种左乙拉西坦注射液,其由本发明第一方面所述的左乙拉西坦注射液的生产方法制得。在一个优选实施例中,上述左乙拉西坦注射液中,相对于左乙拉西坦的总质量,其中的左乙拉西坦酸的含量≤0.20wt%,其中的R异构体的含量≤0.08wt%。实施例1按照本发明所提供的生产方法制备左乙拉西坦注射液,其中,处方组成如下表1所示:原辅料名称单剂量用量左乙拉西坦0.5g醋酸钠8.2mg氯化钠45mg醋酸溶液(2wt%)调节pH值至5.5±0.5注射用水加至5ml实施例2按照本发明所提供的生产方法制备左乙拉西坦注射液,其中,处方组成如下表2所示:原辅料名称单剂量用量左乙拉西坦2.5g醋酸钠41mg氯化钠225mg醋酸溶液(4wt%)调节pH值至5.5±0.5注射用水加至25ml实施例3按照本发明所提供的生产方法制备左乙拉西坦注射液,其中,处方组成如下表3所示:原辅料名称单剂量用量左乙拉西坦10g醋酸钠164mg氯化钠900mg醋酸溶液(5wt%)调节pH值至5.5±0.5注射用水加至100ml实施例4按照本发明所提供的生产方法制备左乙拉西坦注射液,其中,处方组成如下表4所示:原辅料名称单剂量用量左乙拉西坦25kg醋酸钠410g氯化钠2.25kg醋酸溶液(5wt%)调节pH值至5.5±0.5注射用水加至250L对比例(1)称取占处方量60v%~90v%的注射用水,注入已清洁消毒的配液罐中,开启搅拌,同时加入处方量的氯化钠、处方量的醋酸钠、处方量的左乙拉西坦,搅拌溶解完全,所得混合溶液的pH值为7.0~7.5;(2)向该配液罐中加入醋酸溶液(1wt%~5wt%),调节混合溶液的pH值至5.5±0.5;(3)补加所述注射用水至全量,继续搅拌,混合均匀得左乙拉西坦混合液;(4)向上述左乙拉西坦混合液中加入0.05%~0.2%(w/v)的针用活性炭,在50℃~70℃下搅拌10~30min;(5)依次用0.45μm和0.22μm的微孔滤膜过滤,以滤除活性炭;(7)调整装量符合规定后,滤液灌装于玻璃瓶中,密封,热压灭菌(121℃/15min或者115℃/30min),质检,贴签,包装后即得左乙拉西坦注射液对比例产品。此外,发明人采用不同注射用水温度,进一步检测并考察了实施例1所制得的左乙拉西坦注射液产品与左乙拉西坦注射液对比例产品的各项指标,主要包括性状、pH值、有效含量、左乙拉西坦酸含量以及R异构体含量,具体如下表5所示(表中的百分比为质量百分比):注:“N.D”代表“未检出”。结合附图1和2可以更直观的看出,采用本发明所述生产方法所制得的左乙拉西坦注射液中所含的杂质(主要为左乙拉西坦酸含量以及R异构体)更少,左乙拉西坦注射液产品品质更高。进一步地,发明人按照实施例4所述工艺制备了3批左乙拉西坦注射液产品,批量250L(相当于5万支/批),并进行了加速稳定性试验(40℃/RH75%),所测得的数据如下表6所示:由此可见,稳定性数据表明本发明所提供的左乙拉西坦注射液产品具有优异的稳定性。以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1