一种用于促进骨再生的生物材料及其制备方法和应用与流程
本发明涉及骨材料,更具体地,涉及一种用于促进骨再生的生物材料及其制备方法和应用。
背景技术:
骨缺损是常见症状,可由创伤,恶性肿瘤,感染和先天性疾病引起。临床上,需要骨再生或者扩充以治愈这种骨缺损。尽管多年的发展,获得可靠和可预测的骨重建仍然是个挑战。自体骨移植物(来自患者体内的骨)是治疗的黄金标准,但是它们遭受诸如组织可用性有限,手术时间增加以及供体部位的额外疼痛和化妆品缺陷的问题。同种异体移植物(来自供体或尸体的骨)是最广泛使用的骨移植物,但是它们遭受高成本,对骨的不确定愈合,疾病转移的风险和不期望的宿主免疫反应。合成骨移植替代品具有诸如一致的质量,安全性和良好的组织耐受性的优点,但它们通常用作惰性或仅仅有骨传导作用的植入物。单独使用合成生物材料通常不能在临床上显著再生出新骨,因为合成生物材料通常缺乏自体骨移植物的骨诱导能力。在实践中,目前的合成骨替代物通常与自体骨,成骨细胞或成骨生长因子混合,以实现骨的可靠重建。因此,需要提供一种新的和改进的骨诱导生物材料类,其具有诱导骨形成并从而增强骨修复和再生的能力。
技术实现要素:
本发明的目的在于,克服传统材料的缺陷,在单独使用时,也具有显著的促进新骨再生的功能,另外一个目的在于,提高目前的骨材料的新骨再生的促进功能。
根据以上目的,本发明首先公开一种用于促进骨再生的生物材料,所述的生物材料的表面具有一个或多个凹孔,所述凹孔的深度不小于5微米,所述的凹孔的尺寸在10~5000微米之间。所述生物材料在植入体内后,在其内凹表面空间内,会有明显的新骨组织形成,并且新生骨组织会沿内凹表面径向方向不断向外生长。
优选的,所述小孔为无规则形状或者规则形状,所述的生物材料为无定型形状或者球形。
优选的,所述的生物材料为颗粒;所述的生物材料中不少于90%的生物材料会被生物体降解。
优选的,所述的生物材料由陶瓷、无机盐、金属、同种异体骨、异种骨或高分子聚合物中的一种或多种材料制备而成。
优选的,所述的生物材料由钙盐组成,优选为磷酸钙盐、硫酸钙盐或硅酸钙盐。
更进一步地,根据上述的生物材料的制备方法,包括以下步骤:
s1.制备具有中空结构的生物前体材料或者利用已有的中空结构的生物前体材料,
s2.通过物理或者化学的方法使得所述的中空结构产生开口,或直接破坏所述中空材料使之产生凹孔。
另外在提供一种上述的生物材料的制备方法,包括以下步骤:
s1.制备、使用具有支持形成具有所需尺寸的磷酸钙盐层的能力的前体颗粒,
s2.所述前体颗粒通过在含有磷酸盐溶液中孵育,自动转化成空心磷酸钙盐颗粒,
s3.通过机械或者化学方法处理所述空心磷酸钙颗粒,破坏其空心壳的完整性,暴露其内凹表面,形成具有开口的并且有内凹结构的颗粒材料。
还可以通过这样的制备方法,制备并使用能够制造具有内凹结构微粒的模具,在模具中填充生物材料,移除模具后,直接获得用于促进骨再生的生物材料。
然后再提供上述的生物材料在促进骨再生中的应用,优选的,单独使用所述的生物材料来促进新骨再生。
本发明具有以下优点:
1.本发明提供了具有诱导骨形成的能力的新类型的生物材料,这种诱导骨形成能力产生于本发明生物材料的特定化学,物理,几何和形态性质。根据本发明的一个实施方案,具有固有骨诱导性的本发明生物材料可由具有内凹表面的开放羟基磷灰石(ha)微球体/颗粒组成。
2.本发明的生物材料可以取代传统上临床使用的患者自身骨、成骨细胞,异体骨,以及其他活性蛋白质例如成骨生长因子。因此,本发明的生物材料可以促进手术植入过程,并且可以大大减少与使用那些传统材料相关的副作用,避免严重的并发症,并且降低治疗成本。
附图说明
图1为光学显微镜照片。
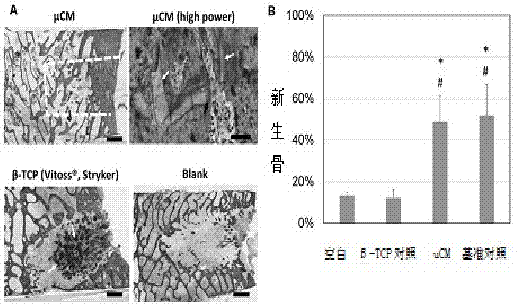
图2为羊髂非关键尺寸缺陷模型。
具体实施方式
下面结合附图和具体实施例进一步详细说明本发明。除非特别说明,本发明采用的试剂、设备和方法为本技术领域常规市购的试剂、设备和常规使用的方法。
根据本发明的一个实施方案,本发明的制造方法包括以下步骤:i)用组合物选择和制备前体颗粒,以支持具有所需尺寸的磷酸钙生物材料壳层的形成,ii)将所述前体颗粒转化成中空ha微球/颗粒,通过在磷酸盐水溶液中孵育所述前体颗粒,和iii)通过研磨在所述中空ha微球/颗粒中产生开口以暴露内凹内部区域。上述前体材料可以是能够支持在某些溶液中形成磷酸钙盐的任何材料。前体材料的一些典型特性包括:i)在水性介质中的溶解度;ii)含有钙(ca),磷(p)或两者的组合物;虽然该组合物是典型的,但是不含这两种元素的组合物也是适用的;和iii)所述组合物应当不含细胞毒性元素。前体材料颗粒的形状可以是球形或非球形。在上述磷酸钙盐转化步骤中,转化可以通过将微球或颗粒在合适的溶液中孵育来实现。例如,当使用具有组成(wt%):15.0cao,10.6lixo,74.4b2o3的玻璃时,将玻璃微球浸入37℃和ph=9.0的0.02mk2hpo4溶液中。在典型的方法中,将1克玻璃微球体加入到200ml溶液中,并将体系在200rpm下搅拌3天。在转化过程完成后,用蒸馏水然后用乙醇洗涤样品,在90℃下干燥至少12小时,并储存在干燥器中以备将来使用。或者,前体微球或颗粒可以浸入模拟体液(sbf)中,并在37℃下孵育合适的时间,在此期间,磷酸钙层沉积在微球或颗粒的表面上。然后可以将样品浸泡在水或适当的溶液中以溶解掉前体核。在上述生产步骤中,研磨中空微球或颗粒以在壳中形成开口。该步骤的目的是在(封闭的)中空微球或颗粒的壳体中产生开口(孔),以便暴露壳体内侧上的内凹表面。开口的尺寸可以小于或等于中空微球或颗粒的内径。可以使用多种合适的方法。在一种方法中,微球或颗粒可以嵌入冰中并放置在平面上,使得所有颗粒可以被均匀研磨。该研磨步骤的结果(例如开放微球的产率;孔尺寸的均匀性)随着微球在平面上的更均匀的嵌入和放置而改善。研磨可以使用任何合适的方法进行,例如在我们的工作中使用的在1200砂纸上研磨。磨碎的样品可以通过浸入水中,收集并在烘箱中干燥而容易地从嵌入的冰块中释放。发明人的研究表明,~50%的(封闭的)ha微球或颗粒可以容易地转化为开放的微球或颗粒。可以通过减小原始玻璃微球或颗粒的粒度分布和进一步改进研磨过程来实现更高的百分比。
图1.(a):本发明内凹磷酸钙材料的光学显微镜照片。刻度:200um。钙磷酸钙(μm)微球在缺损中诱导骨生长:(b)与内凹部(箭头)相关联形成的新骨,和微穴磷酸钙倾向于桥接整个缺陷(d);相反,没有内凹结构但具有相同化学性质和粒径的对照组(c)显示出很少的骨生长。(e):内凹磷酸钙材料的新骨体积比对照组高大约100%。n=4;误差线:标准偏差。b-d是pmma包埋切片(〜50um),并通过sanderson的快速骨染色进行染色。红色表示骨组织。颅盖缺损大小为4.6mm,在成年sprague-dawley大鼠上产生;植入时间为10周。*:p<0.05(n=4)。
图2羊髂非关键尺寸缺陷模型,用于评估μcm在修复较大的骨缺损方面的有效性。缺陷尺寸为6×8mm(直径×深度)。对照组是由β-tcp制成的骨填料(vitoss,stryker,在美国临床上应用最广的产品),作为阳性对照,空白缺陷作为阴性对照。每种材料填满每个缺陷。6周后,收集样品并包埋在塑料中,切片并研磨成20-40um,然后用h&e染色,用于组织学观察和组织形态计量学定量。n=4。(左上)μcm组的组织学形态,虚线勾画出原始缺陷区域,高倍图像(右上图)显示了嵌入新骨基质中的植入的μcm(箭头)的残留物。阳性对照β-tcp(左下)在缺陷中显示最小的新骨散射,并且大量β-tcp颗粒保留在原位(箭头,黑暗物质)。此外,在β-tcp植入物下面存在的异常大的空隙区域表明β-tcp在该区域被吸收后新骨的生长失败。新骨生长和植入物再吸收速率在β-tcp组中不匹配。空白组显示在宿主骨边缘周围的典型有限生长并且在缺损中随机。(b)组织形态计量分析显示,与天然髂骨的基准(测量具有与缺损相同的尺寸并且类似地覆盖皮质和小梁区域的区域)相比,μcm将骨恢复至天然体积,相比之下,对照组β-tcp(vitoss®,stryker)显示明显少的新骨。*:p<0.05,与空白比较;#:p<0.05,与β-tcp对照相比。n=4。空白和β-tcp之间没有差异,μcm和基准值之间没有差异(p>0.05)。n=4。
所述实施例仅为本发明的较佳实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!