涉及类视黄醇受体选择性通路的方法和组合物与流程
本申请是申请号为201180030974.9的中国专利申请的分案申请,原申请是2011年5月6日提交的pct国际申请pct/us2011/035651于2012年12月21日进入中国国家阶段的申请。
相关申请
依据美国法典第35编第119(e)节,本申请要求于20010年5月6日提交的美国临时专利申请序列号61/332,124的优先权,其整体通过引用并入本文。
关于联邦政府资助研发的声明
本发明在nih授予的ca109345和美国陆军医学研究和材料司令部授予的w81xwh-08-1-0478的政府支持下完成。政府享有本发明的一些权利。
本发明的领域是涉及类视黄醇受体选择性通路的方法和组合物。
背景技术:
非甾体抗炎药(nonsteroidalanti-inflammatorydrugs,nsaid)的抗癌作用是公认的(tegeder,i.等,fasebj15(12),2057-2072(2001);kashfi,k.&rigas,b.,biochempharmacol70(7),969-986(2005))。nsaid通过抑制环氧合酶(cox-1和cox-2)阻断类花生酸产生。自从发现定期使用阿司匹林降低结肠癌发生率以后,nsaid作为理想的癌症化学预防剂就受到了重点关注。遗憾的是,伴随出现的副作用(包括已知与cox-2抑制有关的威胁生命的心血管并发症)使得nsaid的理想抗癌作用黯然失色。尽管cox-2与致癌作用之间有联系,但是nsaid诱导既不包含cox-1也不包含cox-2的癌细胞的凋亡,这表明存在另外的细胞内靶点(tegeder,i.等,fasebj15(12),2057-2072(2001);kashfi,k.&rigas,b.,biochempharmacol70(7),969-986(2005))。
技术实现要素:
实施方案涉及有关类视黄醇受体选择性通路的方法和组合物。在一些实施方案中,该通路靶向操纵肿瘤微环境。在一个实施方案中,提供了在癌细胞中诱导凋亡的方法。例如,可以提供用于预防或治疗癌症的组合物,例如本文所述的式(ii)的化合物。在一些实施方案中,本文所述的包含化合物k-80003或k-80003类似物的组合物被用于治疗癌症。
如本文所示,舒林酸硫化物(sulindacsulfide)(下文中为“舒林酸”或“舒林酸硫化物”)与化合物rxrα以临床相关浓度结合并且以rxrα依赖性方式诱导凋亡,从而证明rxrα是舒林酸作用的细胞内靶点。还如本文所示,舒林酸强烈抑制癌细胞中的关键存活激酶akt(蛋白激酶b)的活化。此外,n-端截短的rxrα(trxrα)表现出调节癌细胞中的存活信号。如本文所述,当与tnfα组合时,舒林酸抑制tnfα诱导的trxrα/p85α相互作用,引起死亡受体介导的凋亡通路活化。此外,如本文所述设计并合成的舒林酸类似物k-80003表现出增加的与rxrα的亲和力并且无cox抑制活性,而且在抑制动物的trxrα依赖性akt活化和trxrα肿瘤生长方面显示出增强的功效。
本文描述了用于癌症治疗的靶向凋亡通路的舒林酸衍生的rxrα配体。在一个实施方案中,提供了在癌细胞中诱导凋亡的方法,其包括:上调癌细胞中的肿瘤坏死因子-α(tnfα)活性,从而使癌细胞对akt抑制敏感;以及使敏化的癌细胞与化合物相接触,其中已知所述化合物与类视黄醇x受体-α(rxrα)相互作用,并且其中已知所述化合物以环氧合酶-2(cox-2)通路非依赖性方式抑制蛋白激酶b(akt)的活性。在本实施方案的一个方面中,上调tnfα活性包括将外源性tnfα引入癌细胞。在本实施方案的另一方面中,上调tnfα活性包括上调癌细胞中的内源性tnfα。在本实施方案的又一方面中,癌细胞是选自以下的癌细胞:肺癌细胞、乳癌细胞、前列腺癌细胞、肝癌细胞和结肠癌细胞。在本实施方案的又一方面中,癌细胞是选自以下的癌细胞:a549细胞、h460细胞、zr-75-1细胞、mcf-7细胞、lncap细胞、pc3细胞、hepg2细胞、caco2细胞和sw480细胞。在本实施方案的又一方面中,候选化合物是舒林酸的类似物,并且其中所述类似物表现出至少一种选自以下的特性:与rxrα结合时ic50小于舒林酸的ic50和与cox-2结合时ic50大于舒林酸的ic50。在本实施方案的又一方面中,所述类似物是选自以下的化合物:k-80001、k-80002、k-80003、k-80004和k-80005。在本实施方案的又一方面中,所述类似物是k-80003。
在另一个实施方案中,提供了一种筛选能够在癌细胞中诱导凋亡的候选化合物的方法,其包括:向癌细胞提供候选化合物;和确定候选化合物是否能够具有至少一种选自以下的活性:在癌细胞中抑制akt活性、活化胱天蛋白酶-8、活化bax、抑制cflip和降解bid。在本实施方案的一个方面中,确定候选化合物是否能够抑制akt活性包括:通过用全反式视黄酸(全反式-retinoicacid,atra)或9-顺式-ra对癌细胞进行预处理;并且在施用候选化合物之后测量癌细胞中akt水平的变化。
在又一个实施方案中,提供了一种筛选能够在细胞中诱导凋亡的候选化合物的方法,其包括:向细胞提供候选化合物;以及确定候选化合物是否能够选择性地与截短的rxrα(trxrα)蛋白结合。在本实施方案的一个方面中,候选化合物是选自以下的化合物:肽、蛋白质、核酸和小分子。
在又一个实施方案中,提供了筛选能够在细胞中诱导凋亡的候选化合物的方法,其包括:向细胞提供候选化合物;以及确定候选化合物是否能够调节trxrα蛋白。在本实施方案的一个方面中,候选化合物是选自以下的化合物:肽、蛋白质、核酸和小分子。在本实施方案的另一方面中,确定候选化合物是否能够调节trxrα蛋白包括确定候选化合物是否能够防止trxrα与p85α蛋白结合。在本实施方案的又一方面中,确定候选化合物是否能够调节trxra蛋白包括确定候选化合物是否能够防止rxrα经历蛋白质修饰。在本实施方案的又一方面中,所述蛋白质修饰包括磷酸化。在本实施方案的又一方面中,确定候选化合物是否能够调节trxrα蛋白包括确定候选化合物是否能够防止trxrα蛋白从细胞核迁移至细胞质。
在又一个实施方案中,提供了一种筛选能够在细胞中诱导凋亡的候选化合物的方法,其包括:鉴定表达trxrα的细胞;使细胞与候选化合物相接触;以及确定候选化合物是否诱导细胞凋亡。在本实施方案的一个方面中,所述候选化合物是选自以下的化合物:肽、蛋白质、核酸和小分子。在本实施方案的另一方面中,所述候选化合物是来自小分子文库的化合物。在本实施方案的又一方面中,所述候选化合物是来自肽文库的化合物。在本实施方案的又一方面中,所述细胞来自乳房或肝。
在又一个实施方案中,提供了一种筛选能够抑制肿瘤生长的候选化合物的方法,其包括:鉴定表达trxrα的肿瘤;使肿瘤与候选化合物相接触;以及确定候选化合物是否抑制肿瘤生长。在本实施方案的一个方面中,所述候选化合物是选自以下的化合物:肽、蛋白质、核酸和小分子。在本实施方案的另一方面中,所述候选化合物是来自小分子文库的化合物。在本实施方案的又一方面中,所述候选化合物是来自肽文库的化合物。在本实施方案的又一方面中,所述肿瘤是乳房或肝的肿瘤。
在又一个实施方案中,提供了一种预防对象癌症的方法,其包括:鉴定相对于一般人群具有升高的癌症风险的对象;并且向对象提供抑制akt活性的物质,其中所述物质与对象细胞表面上的rxrα的结合导致了akt活性的抑制。在本实施方案的一个方面中,所述方法还包括在施用所述物质之前向对象施用tnfα,从而使对象的癌细胞对所述物质的akt抑制敏感。在本实施方案的另一方面中,所述物质是舒林酸的类似物。在本实施方案的又一方面中,所述类似物是选自以下的化合物:k-80001、k-80002、k-80003、k-80004和k-80005。在本实施方案的又一方面中,所述类似物是k-80003。
在又一个实施方案中,提供了一种治疗哺乳动物癌症的方法,其包括:鉴定患有癌症的哺乳动物,并且向哺乳动物提供治疗有效量的物质,所述物质已知以环氧合酶-2(cox-2)通路非依赖性方式抑制akt活性。在本实施方案的一个方面中,所述方法还包括在施用所述物质之前向哺乳动物施用tnfα,从而使哺乳动物的癌细胞对所述物质的akt抑制敏感。在本实施方案的另一方面中,所述物质是舒林酸的类似物。在本实施方案的又一方面中,所述类似物是选自以下的化合物:k-80001、k-80002、k-80003、k-80004和k-80005。在本实施方案的又一方面中,所述类似物是k-80003。在本实施方案的又一方面中,所述哺乳动物是人。
在又一个实施方案中,提供了一种预防或治疗哺乳动物癌症的方法,其包括向有此需要的哺乳动物施用包含式(i)化合物的组合物,其中a为芳基或杂芳基,并且其中a可任选地被r3和0、1或2个r4取代;其中b为芳基或杂芳基,并且其中b可任选地被0、1或2个r4取代;其中r1为(cr5r6)ncooh;其中r2选自h、c1-10烷基、芳烷基、环烷基、环烷基烷基、卤烷基、烷基o、烷基s和卤烷基o;其中r3和r4独立地选自h、c1-10烷基、卤烷基、卤素、cn、芳基、杂芳基、芳烷基、杂芳烷基、烷基o、烷基s、(cr4r6)nconr7r8、oh、环烷基、环烷基烷基、环烷基o和烷氧基烷基;其中r5和r6:独立地选自h、c1-7烷基、oh、烷氧基、环烷基;或者一起形成环烷基或杂环基;并且其中n为0、1、2或3。
在又一个实施方案中,提供了一种预防或治疗哺乳动物癌症的方法,其包括向有此需要的哺乳动物施用包含式(ii)化合物的组合物,其中所述化合物表现出至少一种选自以下的特性:与rxrα结合时ic50小于舒林酸的ic50和与cox-2结合时ic50大于舒林酸的ic50。在本实施方案的一个方面中,r1选自ch2cooh和ch2ch2cooh;其中r2选自ch3和h;并且其中r3选自4-sch3、4-ch3、4-ch2ch3和4-ch(ch3)2。
在又一个实施方案中,提供了一种筛选能够以rxrα-选择性方式在癌细胞中诱导凋亡的候选化合物的方法,其包括:向癌细胞提供候选化合物;以及确定候选化合物是否能够在癌细胞中与rxrα结合并且不抑制cox-2活性。在本实施方案的一个方面中,确定候选化合物是否能够与rxrα结合包括检测癌细胞中rxrα对胰凝乳蛋白酶(chymotrypsin)消化的敏感性改变。在本实施方案的另一方面中,确定候选化合物是否能够与rxrα结合包括检测癌细胞中差示扫描量热法(differentialscanningcalorimetry,dsc)特征的改变。
在又一个实施方案中,提供了包含式(i)化合物的组合物,其中a为芳基或杂芳基,并且其中a可任选地被r3和0、1或2个r4取代;其中b为芳基或杂芳基,并且其中b可任选地被0、1或2个r4取代;其中r1为(cr5r6)ncooh;其中r2选自h、c1-10烷基、芳烷基、环烷基、环烷基烷基、卤烷基、烷基o、烷基s和卤烷基o;其中r3和r4独立地选自h、c1-10烷基、卤烷基、卤素、cn、芳基、杂芳基、芳烷基、杂芳烷基、烷基o、烷基s、(cr4r6)nconr7r8、oh、环烷基、环烷基烷基、环烷基o和烷氧基烷基;其中r5和r6独立地选自h、c1-7烷基、oh、烷氧基、环烷基;或者一起形成环烷基或杂环基;并且其中n为0、1、2或3。
在又一个实施方案中,提供了包含式(ii)化合物的组合物,其中所述组合物表现出至少一种选自以下的特性:与rxrα结合时ic50小于舒林酸的ic50和与cox-2结合时ic50大于舒林酸的ic50。
在又一个实施方案中,提供了包含式(ii)化合物的组合物,其中r1选自ch2cooh和ch2ch2cooh;其中r2选自ch3和h;并且其中r3选自4-sch3、4-ch3、4-ch2ch3和4-ch(ch3)2。在本实施方案的一个方面中,所述组合物选自k-80001、k-80002、k-80003、k-80004和k-80005。在本实施方案的又一方面中,所述组合物是k-80003。
在又一个实施方案中,提供了包含式(iii)化合物的组合物,其中r1选自ch3、f和cl;其中r2选自h、ch3、cl和f;并且其中r3选自ch3、ch2ch3、ch(ch3)2、c(ch3)3、ch2cl、och3和sch3。
在又一个实施方案中,提供了包含式(iv)化合物的组合物,其中r1选自ch3、f和cl;其中r2选自h、ch3、cl和f;并且其中r3选自ch3、ch2ch3、ch(ch3)2、c(ch3)3、ch2cl、och3和sch3。
在又一个实施方案中,提供了包含式(v)化合物的组合物,其中r1选自cooh、ch2ch2cooh、ch=chcooh、ch2-四唑、ch2-ch2-四唑、ch2cooch3、ch3、ch2conh2、ch2conhch3、ch2oh、ch2ch2oh和ch2nh2;其中r2选自h、cl、ch2ch3、och3、nh2、nhch3、cf3、ch2nh2、ch2oh、ch2cl、ch(ch3)2和och2ch3;其中r3选自h、ch=ch2、cch、c(ch3)3、cf3、oh、och3、och2ch3、nh2、nhch3、cn、nhcoch3、
在又一个实施方案中,提供了包含式(iii)化合物的组合物,其中r1选自ch3、f和cl;r2选自h、ch3、cl和f;并且其中r3选自ch3、ch2ch3、ch(ch3)2、c(ch3)3、ch2cl、och3和sch3。
在又一个实施方案中,提供了包含式(iv)化合物的组合物,其中r1选自ch3、f和cl;其中r2选自h、ch3、cl和f;并且其中r3选自ch3、ch2ch3、ch(ch3)2、c(ch3)3、ch2cl、och3和sch3。
在又一个实施方案中,提供了包含式(v)化合物的组合物,其中r1选自cooh、ch2ch2cooh、ch=chcooh、ch2-四唑、ch2-ch2-四唑、ch2cooch3、ch3、ch2conh2、ch2conhch3、ch2oh、ch2ch2oh和ch2nh2;其中r2选自h、cl、ch2ch3、och3、nh2、nhch3、cf3、ch2nh2、ch2oh、ch2cl、ch(ch3)2和och2ch3;其中r3选自h、ch=ch2、cch、c(ch3)3、cf3、oh、och3、och2ch3、nh2、nhch3、cn、nhcoch3、
在又一个实施方案中,提供了包含舒林酸类似物的组合物,其中所述类似物表现出至少一种选自以下的特性:与rxrα结合时ic50小于舒林酸的ic50和与cox-2结合时ic50大于舒林酸的ic50。
在又一个实施方案中,提供了包含选自以下化合物的组合物:3-(4-氟苯基)-2-甲基丙烯酸、3-(4-氟苯基)-2-甲基丙酸、6-氟-2-甲基-2,3-二氢茚-1-酮、2-(6-氟-2-甲基-3h-茚-1-基)乙酸乙酯、(z)-2-(3-(4-(甲硫基)苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸、(z)-2-(3-(4-甲基苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸、(z)-2-(3-(4-乙基苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸、(z)-2-(3-(4-异丙基苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸、2-(6-氟-3h-茚-1-基)乙酸乙酯、(e)-2-(3-(4-(甲硫基)苯亚甲基)-6-氟-3h-茚-1-基)乙酸、螺(二氢-2(3h)呋喃酮-5-1’(2’h)(3’h)-6-氟-二氢化茚、3-(6-氟-3h-茚-1-基)丙酸甲酯、(e)-3-(3-(4-(甲硫基)苯亚甲基)-6-氟-3h-茚-1-基)丙酸甲酯、k-80003类似物no.1、k-80003类似物no.2、k-80003类似物no.3、k-80003类似物no.4、k-80003类似物no.5、k-80003类似物no.6、k-80003类似物no.7、k-80003类似物no.8、k-80003类似物no.9、k-80003类似物no.10、k-80003类似物no.11、k-80003类似物no.12、k-80003类似物no.13、k-80003类似物no.14、k-80003类似物no.15、k-80003类似物no.16、k-80003类似物no.17、k-80003类似物no.18、k-80003类似物no.19、k-80003类似物no.20、k-80003类似物no.21、k-80003类似物no.22、k-80003类似物no.23、k-80003类似物no.24、k-80003类似物no.25、k-80003类似物no.26、k-80003类似物no.27、k-80003类似物no.28、k-80003类似物no.29、k-80003类似物no.30、k-80003类似物no.31、k-80003类似物no.32、k-80003类似物no.33、andk-80003类似物no.34。
附图说明
图1示出舒林酸与rxrα结合。(a)舒林酸与[3h]9-顺式-ra或未标记的9-顺式-ra孵育的rxrαlbd蛋白的结合。(b)如通过hplc分析所测定的,舒林酸与在稳定表达rxrα、nur77或rarβ的hek293细胞中的rxrα的结合。(c)舒林酸所致的rxrαlbd或gst-rxrα对胰凝乳蛋白酶的敏感性改变。(d)在不存在和存在rxrαlbd或nur77蛋白的情况下舒林酸的19fnmr谱比较。如通过(trepal)2-tk-cat活性(zhang等,nature358,587-591(1992a))(e)或者βrare-tk-cat活性(zhang等,nature355,441-446(1992b))(f)所测定的,舒林酸抑制rxrα同二聚体和异二聚体的反式活化(transactivation)。
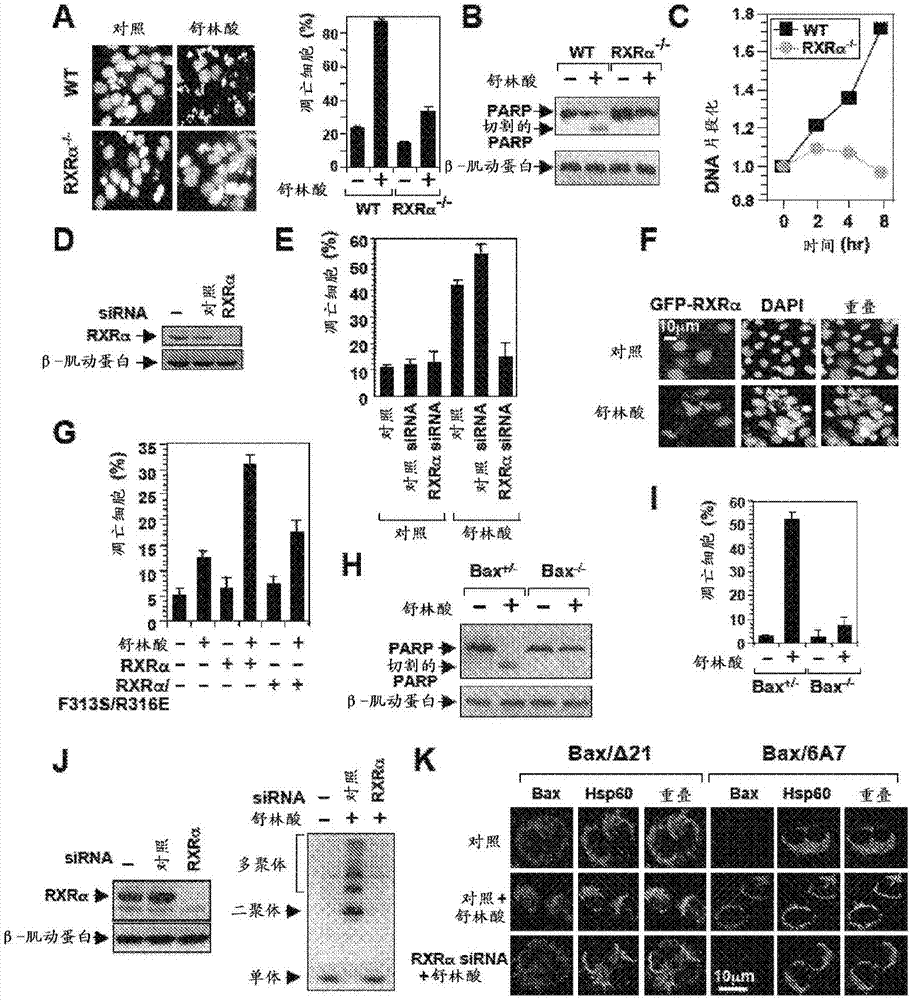
图2示出舒林酸诱导rxrα依赖性凋亡和bax活化。如通过dapi染色(a)、parp切割(b)和dna片段化(c)所分析的舒林酸在f9或缺少rxrα的f9细胞(f9rxrα-/-)中的凋亡作用。rxrαsirna抑制舒林酸诱导的凋亡。用舒林酸处理经对照或rxrαsirna(d)转染的h460肺癌细胞并通过dapi染色分析凋亡(e)。(f)rxrα的转染增强舒林酸的凋亡作用。用舒林酸处理经gfp-rxrα转染的cv-1细胞并通过dapi染色分析。(g)破坏rxrαlbp削弱舒林酸的凋亡作用。用舒林酸处理经gfp-rxrα或gfp-rxrα/f313s/r316e转染的cv-1细胞并通过dapi染色分析。评价经受体转染的细胞中凋亡的得分。bax在凋亡诱导中的作用。用或者不用舒林酸处理hct116细胞或缺少bax的hct116细胞(bax-/-)。通过parp切割(h)和dapi染色(i)测定凋亡。(j,k)rxrαsirna抑制舒林酸诱导的bax活化。通过免疫印迹揭示rxrαsirna所致的hct116细胞中的rxrα敲减(knockingdown)。用舒林酸处理经或者不经rxrαsirna或对照sirna转染的hct116细胞,并且分析bax寡聚化(j)以及使用bax/δ21、bax/6a7或抗hsp60抗体通过免疫染色/共聚焦显微镜分析bax构象改变和线粒体靶向(k)。
图3示出舒林酸抑制tnfα诱导的akt活化和trxrα-p85α相互作用。(a)舒林酸对akt活化的抑制。使hct116、sw480、hepg2、zr75-1、mcf-7、pc3、lncap、hacat和raw264.7细胞饥饿过夜并用舒林酸处理,通过免疫印迹分析akt活化。(b)rxrαsirna对基础akt活化的抑制。用舒林酸处理经rxrαsirna转染的hepg2细胞。通过免疫印迹对akt活化和rxrα表达进行分析。(c)舒林酸和rxrαsirna对tnfα诱导的akt活化的抑制。用舒林酸对经rxrα或对照sirna转染的a549肺癌细胞进行预处理并暴露于tnfα。通过免疫印迹对akt活化和rxrα表达进行分析。(d)舒林酸和tnfα对akt活化的协同抑制。用舒林酸对zr-75-1和pc3细胞进行预处理并暴露于tnfα。通过免疫印迹对akt活化进行分析。(e)用于免疫共沉淀和免疫印迹测定的抗rxrα抗体的示意图(上)。d20抗体识别n-端a/b结构域中的2-21位氨基酸,而δn197抗体识别c-端e/f结构域(下)。还示出约44kda的rxr截短蛋白。(f)多种癌细胞系中trxrα的表达。使用δn197rxrα抗体通过免疫印迹对用或者不用9-顺式-ra处理的hct116、sw480、zr75-1、mcf-7、pc3、lncap、hepg2、hacat、caco2、mef、raw和bhk细胞系进行分析。
图4示出trxrα在akt活化和非锚定依赖性细胞生长中的作用。(a)trxrα的细胞密度依赖性生产和akt活化。使用δn197抗体分析以不同细胞密度接种的mef的rxrα表达并通过免疫印迹分析akt活化。(b)在使用抗rxrα(δn197)进行免疫染色后通过共聚焦显微镜观察mef中内源性rxrα的亚细胞定位。还通过dapi对细胞进行染色以观察细胞核。(c)rxrα/1-134的稳定表达诱导rxrα切割和akt活化。用9顺式-ra对hela或稳定表达rxrα/1-134的hela细胞进行处理并对akt活化和rxrα表达进行分析。(d)在软琼脂中hela/rxrα/1-134和hela细胞的生长。(e)舒林酸抑制hela/rxrα/1-134细胞的克隆性存活。(f)与肿瘤周围组织和正常组织相比,人乳房(6个中的5个)或肝(6个中的4个)的肿瘤组织中trxrα的产生。(g)通过δn197抗体对肝肿瘤样本中rxrα的胞质定位进行免疫染色。t:肿瘤组织;s:肿瘤周围组织。
图5示出n-端截短的rxrα在tnfα活化pi3k/akt及癌细胞生长中的作用。用经myc表位标记的flag-p85α和rxrα、rxrα/δ80、或rxrα/δ100对hek293t细胞进行转染,经tnfα处理,并使用抗flag抗体通过免疫共沉淀进行分析。(b)rxrα的n-端a/b结构域与p85α相互作用。将flag-p85α与gfp-rxrα-1-134和gfp-rxrα-224-462一起共转染到hek293t细胞中,并且使用抗flag抗体通过免疫共沉淀对其相互作用进行分析。(c)rxrα/δ80是有效的akt活化剂。正如免疫印迹测定经rxrα/δ80或rxrα/δ100转染的hek293t、hela、a549和mcf-7细胞的akt活化。(d)rxrα/δ80和p85α的胞质共定位。将myc-rxrα/δ80和p85α共转染到pc3和zr-75-1细胞系中,经抗myc和抗p85α抗体免疫染色,并且通过共聚焦显微镜显示其亚细胞定位。(e)rxrα/δ80免疫沉淀物对pi3k的活化。用tnfα和/或舒林酸对经flag-p85α和myc-rxrα/δ80转染的a549细胞进行处理,通过抗myc抗体免疫沉淀,并进行体外pi3k测定。(f)rxrα/δ80的稳定表达。通过免疫印迹对经gfp-rxrα/δ80或对照gfp载体稳定转染的细胞进行分析。(g)rxrα/δ80促进癌细胞的克隆性存活。(h,i)rxrα/δ80促进裸鼠中的癌细胞生长。
图6示出舒林酸活化tnfα诱导的外在凋亡通路。(a)舒林酸/tnfα组合对凋亡的协同诱导以及rxrα配体对其的抑制。用sr11237,然后用tnfα和/或舒林酸对在具有1%fbs的培养基中培养的hepg2细胞进行处理,通过免疫印迹进行分析。(b)rxrαsirna对舒林酸/tnfα诱导的胱天蛋白酶-8切割的抑制。用tnfα和/或舒林酸对经对照或rxrαsirna转染的hepg2细胞进行处理并且通过免疫印迹进行分析。胱天蛋白酶-8抑制剂(c)和sirna(d)对舒林酸/tnfα诱导的parp切割的抑制。用tnfα和舒林酸对经对照或胱天蛋白酶-8sirna转染或经zietd-fmk预处理的hepg2细胞进行处理并且通过免疫印迹进行分析。(e)舒林酸和tnfα对bax的活化。用bax/6a7抗体对经tnfα和/或舒林酸处理的hepg2细胞进行免疫染色。(f)akt对舒林酸/tnfα诱导的胱天蛋白酶-8切割的调节。用tnfα和/或舒林酸对经ca-akt或dn-akt转染的pc3细胞进行处理,并且通过免疫印迹进行分析。tnfα和舒林酸对胱天蛋白酶-8(g)和bax(h)的活化。用tnfα和舒林酸对经ca-akt转染的hepg2细胞进行处理,并且用抗切割的胱天蛋白酶-8或bax/6a7抗体进行免疫染色。(i)tnfα和舒林酸对c-flip表达的调节。通过免疫印迹对经tnfα和/或舒林酸处理的细胞进行分析。
图7示出rxrα-选择性舒林酸类似物的设计、合成和评价。(a)参照9-顺式-ra的舒林酸硫化物与rxrα之lbp的对接。配体中
图8表明k-80003是rxrα-依赖性akt活化的强力抑制剂。(a)在tnfα存在下舒林酸或k-80003对akt活化的抑制。(b)k-80003对akt活化的rxrα依赖性抑制。用k-80003对经rxrα或rarγsirna转染的pc3细胞进行预处理后暴露于tnfα(prxrα:磷酸化rxrα)。(c)舒林酸和k-80003对rxrα/δ80与p85α相互作用的抑制。在暴露于tnfα之前,用flag-p85α和myc-rxrα/δ80对a549细胞进行转染,用舒林酸或k-80003进行处理,并且使用抗flag抗体通过免疫共沉淀进行分析。(d)舒林酸或k-80003在tnfα存在下对parp切割的诱导。用免疫印迹分析经tnfα和/或舒林酸或k-80003处理的zr-75-1细胞。(e)在tnfα存在下k-80003对胱天蛋白酶-8的活化。通过免疫印迹对经tnfα和/或k-80003处理的细胞进行分析。(f)舒林酸和k-80003对rxrα/1-134细胞和rxrα/δ80稳定克隆的克隆性存活的抑制。(g)舒林酸和k-80003对动物中rxrα/δ80肿瘤生长的抑制。
图9a-c与图1有关并且示出舒林酸与rxrα的结合以及其对rxrα反式活化的作用。
图10与图1b有关并且示出通过hplc分析测定的舒林酸与rxrα蛋白的结合。
图11a-d与图2g有关并且示出rxrα突变体rxr/f313s/r316e介导舒林酸凋亡作用的削弱的能力。
图12a-e与图3有关并且示出舒林酸对akt活化和trxrα-p85α相互作用的抑制作用。
图13与图4b和5d有关并且示出使用细胞分级测定的trxrα的胞质定位。
图14与图4有关并且示出通过rxrα/1-134的稳定表达产生内源性trxrα。
图15a-b与图5e有关并且示出trxrα在a549肺癌细胞中发生免疫沉淀物。
图16a-d与图6有关并且示出舒林酸诱导的凋亡通过死亡受体依赖性外在凋亡通路介导。
图17a-b与图6有关并且示出在hepg2和hct116癌细胞系二者中舒林酸/tnfα组合对胱天蛋白酶-8的协同活化,并且示出akt活化抑制舒林酸/tnfα组合诱导的凋亡。
图18a-b与图7有关并且示出本文所述的rxrα-选择性舒林酸类似物中一些的设计。
图19与图8有关并且示出舒林酸类似物k-80003的合成。
图20与图8有关并且示出k-80003在通过全反式视黄酸抑制akt活化方面比舒林酸更有效。
图21a-c示出口服施用k-80003对小鼠中mcf-7乳房肿瘤生长的生长抑制作用。(a)经口服k-80003或对照处理的小鼠中随时间的乳房肿瘤体积。(b)来自经对照处理小鼠的乳房肿瘤组织。(c)来自经k-80003处理的小鼠的乳房肿瘤组织。
图22a-c示出对于k-80003临床前研究的毒性和pk特征。(a)毒性数据。(b)生物利用度数据。(c)药代动力学数据。
具体实施方式
本文所述的多种实施方案一般性地针对关于类视黄醇受体选择性通路的组合物和方法。如本文所述可操纵该通路以治疗或降低患癌症的风险。
如本文所示,trxrα组成型地驻留于细胞质中,与p85α相互作用,活化akt,并且赋予细胞的非锚定依赖性生长。这些观察结果揭示了癌细胞中trxrα介导的存活通路,这为rxrα及其配体在癌症中的作用提供了新见解。rxrα的蛋白酶解加工对pi3k/akt存活通路的这种活化与截短的bid(tbid)对凋亡通路的活化以及截短的notch蛋白对notch通路的活化相似。有趣的是,bid和notch切割也改变其亚细胞定位,这与对rxrα截短的作用相似。rxrα充当舒林酸作用的细胞内靶点的发现促进了本文所述用于抑制akt活性的rxrα-选择性舒林酸衍生物的设计。例如,本文提供了舒林酸衍生的rxrα配体k-80003的设计和合成,其与rxrα具有更高的亲和力,并且在抑制akt方面具有增强的功效,但是缺少cox抑制活性。此外,如本文所述,上调内源性tnfα和/或引入外源性tnfα可用于刺激癌细胞应答。
在一些实施方案中,组合物包含具有式i的核心结构:
在一些实施方案中,a为芳基或杂芳基,并且可任选地被r3和0、1或2个r4取代。在一些实施方案中,b为芳基或杂芳基,并且可任选地被0、1或2个r4取代。在一些实施方案中,r1为(cr5r6)ncooh。在一些实施方案中,r2选自h、c1-10烷基、芳烷基、环烷基、环烷基烷基、卤烷基、烷基o、烷基s、卤烷基o、nh2和烷基n。在一些实施方案中,r3和r4独立地选自h、c1-10烷基、卤烷基、卤素、cn、芳基、杂芳基、芳烷基、杂芳烷基、烷基o、烷基s、(cr4r6)nconr7r8、oh、环烷基、环烷基烷基、环烷基o和烷氧基烷基。在一些实施方案中,r5和r6均独立地选自h、c1-7烷基、oh、烷氧基、环烷基;或者一起形成环烷基或杂环基。在一些实施方案中,n选自0、1、2或3。
在一些实施方案中,所述组合物包含具有式ii的核心结构:
在一些实施方案中,r1选自ch2cooh和ch2ch2cooh。在一些实施方案中,r2选自ch3和h。在一些实施方案中,r3选自4-sch3、4-ch3、4-ch2ch3和4-ch(ch3)2。
在一些实施方案中,所述组合物包含具有式iii的核心结构:
在一些实施方案中,n=2。在一些实施方案中,r1选自ch3、f和cl。在一些实施方案中,r2选自h、ch3、cl和f。在一些实施方案中,r3选自ch3、ch2ch3、ch(ch3)2、c(ch3)3、ch2cl、och3和sch3。在一些实施方案中,b和/或d为杂环(例如,限制于杂原子)。
在一些实施方案中,式iii中的cooh被四唑所替代。例如,在一些实施方案中,所述组合物包含具有式iv的核心结构:
在一些实施方案中,n=2。在一些实施方案中,r1选自ch3、f和cl。在一些实施方案中,r2选自h、ch3、cl和f。在一些实施方案中,r3选自ch3、ch2ch3、ch(ch3)2、c(ch3)3、ch2cl、och3和sch3。在一些实施方案中,b和/或d为杂环(例如,限制于杂原子)。
在一些实施方案中,所述组合物包含具有式v的核心结构:
在一些实施方案中,r1选自cooh、ch2ch2cooh、ch=chcooh、ch2-四唑、ch2-ch2-四唑、ch2cooch3、ch3、ch2conh2、ch2conhch3、ch2oh、ch2ch2oh和ch2nh2。在一些实施方案中,r2选自h、cl、ch2ch3、och3、nh2、nhch3、cf3、ch2nh2、ch2oh、ch2cl、ch(ch3)2和och2ch3。在一些实施方案中,r3选自h、ch=ch2、cch、c(ch3)3、cf3、oh、och3、och2ch3、nh2、nhch3、cn、nhcoch3、
在一些实施方案中,r4选自h、cl、ch3、ch2ch3、ch(ch3)2、och3、ochch3、nh2和nhch3。此外,r1至r4中任何一个可以是本领域技术人员已知的任何其它合适的基团。
在一些实施方案中,所述组合物包含具有式vi的核心结构:
其中r1选自cooh、ch2ch2cooh、ch=chcooh、ch2-四唑、ch2-ch2-四唑、ch2cooch3、ch3、ch2conh2、ch2conhch3、ch2oh、ch2ch2oh和ch2nh2。
在一些实施方案中,所述组合物包含具有式vii的核心结构:
其中r2选自h、cl、ch2ch3、och3、nh2、nhch3、cf3、ch2nh2、ch2oh、ch2cl、ch(ch3)2和och2ch3。
在一些实施方案中,组合物包含具有式viii的核心结构:
其中r3选自h、ch=ch2、cch、c(ch3)3、cf3、oh、och3、och2ch3、nh2、nhch3、cn、nhcoch3、
在一些实施方案中,所述组合物包含具有式ix的核心结构:
其中r4选自h、cl、ch3、ch2ch3、ch(ch3)2、och3、ochch3、nh2和nhch3。
本发明的一些实施方案还提供了化合物的类似物,包括实施例16中所示的化合物的类似物和衍生物,其具有式i至ix中任一个的核心结构,和/或本文提供的另一些结构。应理解可以使用已知方法对本文所述化合物做多种修饰以生成类似物。还应理解可以改变多种核心结构中的r基。还应理解本领域技术人员通过使用化学合成的已知方法并且进行构效关系(structureactivityrelationship,sar)研究,可以容易地制备本文所述的化合物的类似物。此外,本领域技术人员使用本文所述方法可容易地对多种类似物的活性进行测定。
在一些实施方案中,所述类似物与rxrα结合的ic50是舒林酸与rxrα结合时之ic50的约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%。
在一些实施方案中,所述类似物与cox-1结合的ic50比舒林酸与cox-1结合时之ic50高约5%、10%、15%、20%、25%、30%、35%、40%,45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。在一些实施方案中,所述类似物与cox-1结合的ic50比舒林酸与cox-1结合时之ic50高约1.5x、2x、2.5x、3x、3.5x、4x、4.5x、5x、6x、7x、8x、9x、10x、50x、100x、250x、500x或1000x。
在一些实施方案中,所述类似物与cox-2结合的ic50比舒林酸与cox-2结合时之ic50高约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。在一些实施方案中,所述类似物与cox-2结合的ic50比舒林酸与cox-2结合时之ic50高约1.5x、2x、2.5x、3x、3.5x、4x、4.5x、5x、6x、7x、8x、9x、10x、50x、100x、250x、500x或1000x。
列出以下定义以阐明并限定用于描述本发明的多个术语的含义和范围。
本文使用的“烷氧基”指通过氧原子与母体分子部分连接的烷基。
本文使用的“烷氧基烷基”指被一个、两个或三个烷氧基取代的烷基。
本文使用的“烷基”指衍生自直链或支链饱和烃且包含一至十个碳原子的基团。
本文使用的“芳基”指苯基或双环稠合环系统,其中环中的一个或两个为苯基。双环稠合环系统由与四至六元芳族或非芳族碳环稠合的苯环组成。本公开内容的芳基可以通过基团中任意合适的碳原子与母体分子部分连接。芳基的代表性实例包括但不限于茚满基、茚基、萘基、苯基和四氢萘基。
本文使用的“芳烷基”指被一个、两个或三个芳基取代的烷基。
本文使用的“环烷基”指具有三至十个碳原子和零个杂原子的饱和单环或双环烃环系统。环烷基的代表性实例包括但不限于环丙基、环丁基和环戊基。
本文使用的“环烷基烷基”指被一个、两个或三个环烷基取代的烷基。
本文使用的“卤”和“卤素”指f、cl、br和i。
本文使用的“卤烷基”指被一个、两个、三个或四个卤素原子取代的烷基。
本文使用的“杂环基”指包含独立选自氮、氧和硫的一个、两个或三个杂原子的五、六或七元环。五元环具有零至两个双键,六和七元环具有零至三个双键。术语“杂环基”还包括其中杂环与四至六元芳族或非芳族环或另一个单环杂环基稠合的双环基团。本公开内容的杂环基通过基团中的碳原子或氮原子与母体分子部分连接。杂芳基的实例包括但不限于苯并噻吩基、呋喃基、咪唑基、吲哚啉基、吲哚基、异噻唑基、异噁唑基、吗啉基、噁唑基、哌嗪基、哌啶基、吡唑基、吡啶基、吡咯烷基、吡咯并吡啶基(pyrrolopyridinyl)、吡咯基、噻唑基、噻吩基和硫代吗啉基。
本文使用的“可药用或治疗用载体”指不干扰活性成分生物活性效力并且对宿主或患者的毒性很小的载体介质。
本文使用的“立体异构体”指与另一种化合物具有相同分子量、化学组成和构造,但是原子聚集(group)不同的化合物。即,某些相同的化学部分在空间上取向不同,因此在纯化时能够旋转偏振光平面。但是,一些纯的立体异构体可具有轻微的旋光度使得其不能通过现有仪器检测。本文所述化合物可具有一个或更多个不对称碳原子并因此包括多种立体异构体。所有的立体异构体都包括在本发明范围内。
本文使用的“抑制”akt活性指akt活性的防止、下降、消除、或任何其他的减少。例如,抑制akt活性可包括降低akt的基础水平或抑制akt活化。
本文使用的如应用于所公开组合物的“治疗或药学有效量”指足以诱导期望生物结果的组合物的量。该结果可以是预防、缓解、或改善体征、症状、病因、或生物系统中任何其它期望的改变。例如,该结果可包括降低和/或逆转癌细胞生长。
本文使用的术语“抑制剂”可交换地用于表示“拮抗剂”。这两种术语定义了能够降低某酶活性或与所述酶的底物竞争活性或功能的组合物。
本文使用的“癌症”和“癌”指哺乳动物中细胞的任何恶性增殖。
本文所述的药物组合物可用于预防和治疗本领域技术人员已知的任何恶性肿瘤,包括激素难治性前列腺癌、前列腺癌、乳癌、卵巢癌、结肠癌、黑素瘤或其他皮肤癌、肺癌、肝癌、急性髓细胞性白血病、膀胱癌、宫颈癌、胆管癌、慢性髓细胞性白血病、结肠直肠癌、胃肉瘤、胶质瘤、白血病、淋巴癌、多发性骨髓瘤、骨肉瘤、胰腺癌、胃癌或局部肿瘤(包括不能手术的肿瘤或其中局部治疗肿瘤有益的肿瘤和实体瘤)。
对于体内应用,给定细胞毒性物质的适当剂量取决于物质及其制剂,并且在本领域的普通技术中优化给定患者的剂量和制剂是可取的。因此,例如,使用制剂的标准方法可以将这样的物质配制用于经口服、皮下、肠胃外、粘膜下、静脉内、或其他合适路径施用。不论施用是治疗的或预防的,化合物的有效量和施用方法都将根据患者的性别、年龄、重量和疾病分期、以及本领域技术人员所显而易见的其它因素而改变。
例如,根据对象体重、病痛的严重性、施用方式和处方医师的判断,本领域技术人员将得到施用的适当剂量和计划表以适应患者的具体情况和需要。通常,向患者施用的组合物的剂量范围可以为患者体重的约0.5至1000mg/kg。根据患者需要,剂量可以在一天或更多天期间给药一次或者一系列的两次或更多次。在一些实施方案中,本发明使用相同剂量,或者关于类似物已建立的人剂量的约0.1%至500%、更优选约25%至250%的剂量。合适的人剂量也可以由ed50或id50值、或者来源于体外或体内研究的其它适当值(例如,如通过动物中的毒性研究和功效研究限定的)推断。
尽管精确剂量可以基于药物-药物基础进行测定,但是在大多数情况下,可以做出关于剂量的一些概括。对于成年人患者的日剂量方案可以是,例如,口服剂量0.1mg至500mg、优选约1mg至约250mg,例如约150至约200mg。在一些实施方案中,口服剂量形式为约5mg、10mg、25mg、50mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、300mg、350mg、400mg、450mg、500mg、600mg、700mg、800mg、900mg或1000mg。可以在连续治疗期间施用化合物,例如一周或更多周,或者数月或数年。
可以单独调整剂量和间隔以提供足以维持调整作用的活性部分的血浆水平,或最小有效浓度(minimaleffectiveconcentration,mec)。对于每种化合物mec不同,但是可以通过体外数据进行估算。为了达到mec的剂量将取决于个体特征和施用路径。但是,hplc测定或生物测定可用于确定血浆浓度。
如果需要,组合物可存在于小盒或分配器装置中,其可包含含有活性成分的一种或更多种单位剂型。小盒或分配器装置可带有施用说明书。小盒或分配器装置也可带有容器有关的通知书,所述容器的形式由规范药物制造、施用或出售的政府机构规定,所述通知书表明机构对用于人或动物施用的药物形式的批准。例如,这种通知书可以是由美国食品和药物管理局批准的处方药的标记,或者是批准的产品插入物。还可以制备被配制成相容性药物载体的包含本发明化合物的组合物,放置在适当容器中,并且进行标记以治疗指示病症。
实施例
实施例1.舒林酸与rxrα的结合
进行了hek293t细胞中舒林酸与rxrα、nur77或rarβ结合的竞争性配体结合测定(图1a)和hplc分析(图1b)。在存在或不存在舒林酸或未标记的9-顺式-ra的情况下将rxrαlbd蛋白与[3h]9-顺式-ra进行孵育。通过液体闪烁计数对结合的[3h]9-顺式-ra进行定量(图1a)。用或者不用100μm舒林酸硫化物对稳定表达与c-端tap标签(stratagene,lajolla,ca)融合的rxrα的hek293t细胞进行处理3小时。处理之后,纯化细胞并通过hplc分析舒林酸硫化物的存在。使用舒林酸硫化物的标准溶液得到校准曲线。特征峰谱和驻留时间用于鉴定,并且计算了用于定量的最大峰面积(图1b和10)。舒林酸硫化物与rxrα结合的ic50为80μm(图1a),其在诱导凋亡的浓度范围中。hplc分析表明舒林酸与细胞中的rxrα,而不是其他核受体(例如rar和nur77)直接结合(图1b和10)。
在存在或不存在舒林酸或未标记的全反式-ra的情况下将纯化的rarγ.蛋白与[3h]全反式-ra进行孵育。通过液体闪烁计数对结合的[3h]全反式-ra进行定量。舒林酸不与rarγ结合,这与图1b所示的基于细胞的实验一致(图9a)。
将受体表达载体和报告基因(对于rxrα/trα异二聚体为trepal2-tk-cat(图9b),并且对于rxrα/pparγ异二聚体为dr1tk-cat(图9c))瞬时转染到cv-1细胞中。在存在或不存在舒林酸的情况下用或者不用配体(环格列酮,10-6m;t3,10-7m)对细胞进行处理。测定cat活性。舒林酸抑制rxrα/pparγ异二聚体,而不抑制rxr/tr异二聚体的反式活化(图9b,c)。
还测定了rxrα配体结合结构域(lbd)通过舒林酸(100μm)对胰凝乳蛋白酶(μg/ml)的敏感性改变(图1c);以及在不存在或存在10μmrxrαlbd或nur77蛋白的情况下比较舒林酸(100μm)19fnmr谱的差示扫描量热法(dsc)扫描(图1d)。通过舒林酸(100μm)使rxrα对胰凝乳蛋白酶消化的敏感性改变(图1c)和差示扫描量热法(dsc)(图1d)确定了与rxrα的结合。此外,测量了通过舒林酸对经sr11237(10-6m)活化的rxrα反式活化的抑制(图1f,参见实施例2)。
将nur77和/或rxrα瞬时转染到cv-1细胞中。在存在或不存在舒林酸的情况下,用或者不用sr11237(10-6m)(rxr选择性激动剂)对细胞进行处理。测定了(trepal)2-tk-cat(zhang等,nature358,587-591(1992a))(图1e)和βrare-tk-cat(zhang等,nature355,441-446(1992b))(图1f)的cat活性。在报告测定(图1e,f和图10)中舒林酸结合抑制rxrα同型二聚物和异源二聚物的反式活化,这证实舒林酸是rxrα转录拮抗剂。
实施例2.舒林酸的死亡作用
为了确定rxrα在舒林酸诱导凋亡中的作用,检查了舒林酸在f9细胞或缺少rxrα(f9-rxrα-/-)的f9细胞中的死亡作用。
为了进行核形态变化分析,对细胞进行胰蛋白酶消化,用pbs洗涤,经3.7%多聚甲醛固定,并且用dapi(4,6-二脒基-2-苯基吲哚)(1mg/ml)染色以通过荧光显微镜使核显现。通过计数至少300个具有核片段化和/或染色质凝聚的gfp阳性细胞来确定凋亡细胞的百分数。为了确定dna片段化,使用细胞死亡检测elisaplus试剂盒(celldeathdetectionelisaplus)(rocheappliedscience,penzberg,bavaria,germany)。
rxrαsirnasigenomesmarpool(m-003443-02)、rarγsirnasigenomesmarpool(m-003439-01)和sirna非特异性对照ix(d-001206-09-05)购买自dharmacon(lafayette,co)。根据制造商建议,使用oligofectamine试剂(invitrogen,carlsbad,ca)将每孔2.5μl等份的20mmsirna转染到在12孔板中生长的细胞中。转染两天后,收集细胞用于western印迹。
用舒林酸处理f9细胞或缺少rxrα(f9-rxrα-/-)的f9细胞24小时并且通过dapi染色(图2a)、聚(adp-核糖)聚合酶(parp)切割(图2b)和dna片段化(图2c)进行分析。用对照或rxrαsirna对h460肺癌细胞进行转染,用舒林酸(75μm)处理24小时,并通过dapi染色对凋亡进行分析(图2d和2e)。
用gfp-rxrα(图2f)或gfp-rxrα/f313s/r316e(图2g)对cv-1细胞进行转染,用舒林酸(75μm)处理24小时,并通过dapi染色进行分析。经gfp-rxrα转染的细胞发生大量的核片段化和凝聚(图2f)。对经受体转染的细胞中的凋亡进行计数检查(图2g和11)。破坏rxrα配体结合口袋削弱了其同二聚体的反式活化(图11a和11b)。此外,破坏rxrα配体结合口袋削弱了其异二聚体的反式活化(图11c,11d)。将rxrα(20ng)、rxrα/f313s/r316e(20ng)、β-半乳糖苷酶(100ng)和/或nur77(100ng)表达载体与(trepal)2-tk-cat(100ng)(图11a,11b)或βrare-tk-cat(100ng)(图11c,d)一起瞬时转染到cv-1细胞中。在存在或不存在升高浓度的舒林酸(10、37.5、75、150、300μm)的情况下用或者不用sr11237(10-6m)对细胞进行处理。测定cat活性。
舒林酸诱导f9细胞的大量凋亡,而对f9-rxrα-/-细胞作用很小(图2a-2c)。舒林酸的凋亡作用在经rxrαsirna转染的细胞中也降低(图2e),而rxrα的转染增强了其死亡作用(图2f,g)。rxrα/f313s/r316e不能对配体诱导的同二聚体或异二聚体的反式活化作出应答(图11),并且表明对舒林酸作出应答的凋亡减少(图2g)。因此,发现rxrα参与舒林酸诱导的凋亡。
用或者不用舒林酸(75μm)处理hct116细胞或缺少bax的细胞(bax-/-)24小时。通过parp切割(图2h)和dapi染色(图2i)对凋亡进行测定。用舒林酸处理经或者不经rxrαsirna或对照sirna转染48小时的hct116细胞6小时,并且分析bax寡聚化(图2j)以及使用bax/δ21、bax/6a7或抗hsp60抗体通过免疫染色/共聚焦显微镜分析bax构象改变和线粒体靶向(图2k)。约60%的细胞表现出bax构象改变。
舒林酸诱导hct116结肠癌细胞中而不诱导缺少bax的hct116细胞(bax-/-)中的parp切割(图2h)和凋亡(图2i)。hct116细胞缺少cox-2的事实证实舒林酸诱导的凋亡可以不依赖cox-2。免疫印迹测定表明bax在线粒体上经受大量寡聚化,其被rxrαsirna消除(图2j)。此外,使用抗bax抗体(bax/δ21)的免疫染色和bax构象敏感性抗体bax/6a7的免疫染色(nechushtan等,biochembiophysrescommun254,388-394(1999))证实舒林酸诱导的bax构象改变和线粒体靶向被rxrαsirna削弱(图2k)。总之,这些结果证实rxrα可充当介导舒林酸凋亡作用的细胞内靶点。
实施例3.rxrα突变体
为了讨论舒林酸与rxrα结合的作用,构建了rxrα突变体(rxrα/f313s/r316e),其中改变了维持rxrα配体结合口袋(lbp)功能完整性所必需的氨基酸(bourguet,w.等,molcell5(2),289-298(2000))。
使用正向引物5’-ccggaattccatgagtgctgaggggtacc-3’(seqidno:1)和反向引物5’-acgcgtcgactcatcgcctctgctgtgcat-3’(seqidno:2)通过聚合酶链式反应(pcr)构建flag-p85α。pcr产物经ecori和sali消化并被克隆到pcmv-flag载体中。通过以下寡核苷酸作为引物,使用
tggg(正向-seqidno:3)和5’-cccatctttcacagctatggactcgtgggaggaggaggcgatcagcagctcgttcc(反向-seqidno:4);rxrα/δ80,5’-ccggaattcggaccacacccaccctgggc-3’(正向-seqidno:5);和5’-ccgctcgagctaagtcatttggtgcggcg-3’(反向-seqidno:6);rxrα/δ100,5’-ccggaattcgggtcagcagcagcgaggac-3’(正向-seqidno:5);和5’-ccgctcgagctaagtcatttggtgcggcg-3’(反向-seqidno:6)。pcr产物经ecori和xhoi消化并被连接到pcmv-myc载体中。
将rxrα(20ng)、rxrα/f313s/r316e(20ng)、β-半乳糖苷酶(100ng)和/或nur77(100ng)表达载体与(trepal)2-tk-cat(100ng)(图11a)或βrare-tk-cat(100ng)(图11b)一起瞬时转染到cv-1细胞中。用或者不用sr11237(10-6m)对细胞进行处理。测定cat活性。
突变体不能对配体诱导的反式活化作出应答(图11)并且示出对舒林酸作出的应答减少(图2g)(参见实施例2)。
实施例4.舒林酸对akt活化的抑制
研究舒林酸对akt(负责癌细胞存活的关键蛋白质)活化的抑制。
使hepg2、sw480、raw264.7、hct116、lncap、pc3、zr-75-1和hacat细胞饥饿过夜并用舒林酸(100μm)处理1小时,然后通过免疫印迹分析akt活化(图3a)。也用rxrαsirna对hepg2细胞进行转染48小时,用舒林酸(100μm)处理1小时,然后通过免疫印迹分析akt活化和rxrα表达(图3b)。
使mef和mcf-7细胞饥饿过夜,用舒林酸(100μm)预处理1小时,然后用egf(100ng/ml)刺激15分钟。通过免疫印迹分析akt活化(图12a)。使mef和caco-2细胞饥饿过夜并用舒林酸(100μm)预处理30分钟,然后暴露于全反式视黄酸(atra)(10-7m)30分钟并分析akt活化(图12b)。通过免疫印迹还分析了经rxrαsirna转染后暴露于9-顺式-ra(10-7m)30分钟的zr-75-1乳癌细胞中的akt活化(图3c)。用舒林酸(100μm)对经rxrα或对照sirna转染的a549肺癌细胞(图3c)以及zr-75-1和pc3细胞(图3d)进行预处理1小时后暴露于tnfα(10ng/ml)30分钟,并且通过免疫印迹分析akt活化和rxrα表达。
在多种癌细胞系(包括cox-2阴性sw480和hct116结肠癌细胞)中观察到舒林酸对基础akt活化的显著抑制(图3a),从而表明不依赖cox-2的机制。舒林酸不能抑制通过egf的akt活化,但是强烈抑制通过视黄酸的akt活化。rxrαsirna的转染显著降低组成型akt活化(图3b),与舒林酸作用相似。用全反式-ra(atra)处理细胞30分钟强烈地诱导了akt活化,并且其被舒林酸以剂量依赖性方式(图12b)和rxrαsirna(图12c)抑制。尽管舒林酸不能抑制通过表皮生长因子诱导的akt活化(图12a),但是其以rxrα依赖性方式强烈抑制通过视黄酸诱导的akt活化(图12b,c)。因此,舒林酸可干扰ra诱导的快速rxrα依赖性akt活化。
检查舒林酸抑制tnfα诱导的akt活化。tnfα使a549肺癌细胞中的akt强烈活化,其被舒林酸和rxrαsirna强烈抑制(图3c),表明akt的tnfα活化依赖rxrα。尽管tnfα不能活化具有高基础akt活化的细胞(例如zr-75-1和pc3细胞)中的akt并且舒林酸在这些细胞中对akt活化表现出的抑制作用很小,但是舒林酸与tnfα组合协同地,并且几乎完全抑制akt活化(图3d)。因此,tnfα能够使癌细胞对通过舒林酸的akt抑制敏感,表明tnfα可能通过将akt活化由rxrα不依赖性转化为rxrα依赖性方式可促进癌细胞对舒林酸作出应答。
用9-顺式-ra(10-7m)处理mcf-7和幼仓鼠肾(bhk)细胞30分钟,并且使用d20或δn197抗rxrα抗体通过免疫共沉淀分析rxrα-p85α相互作用(图12d)。用9-顺式-ra和/或舒林酸(100μm)处理h292肺癌细胞30分钟,使用δn197抗体通过免疫共沉淀分析rxrα-p85α相互作用(图12e)。舒林酸不能抑制通过egf的akt活化,但是强烈抑制通过视黄酸的akt活化。此外,当使用δn197抗rxrα抗体,而不使用d20抗rxrα抗体时,9-顺式视黄酸促进trxrα与p85α的相互作用。
实施例5.p85α与trxrα和rxrα的相互作用
检查rxrα与p85α的相互作用。将抗rxrα抗体(santacruzbiotechnology,santacruz,ca)用于免疫共沉淀(co-ip)和western印迹(wb)测定。用atra(10-7m)处理bhk细胞30分钟。制备裂解物并使用d20抗rxrα或δn197抗rxrα抗体之一分析rxrα-p85α相互作用(图12d)。
尽管抗rxrα抗体使rxrα蛋白发生有效免疫沉淀,但是使用针对rxrα(d20)nh2端序列的抗rxrα抗体通过免疫共沉淀测定的最初尝试没能检测清楚的相互作用。但是,当使用针对rxrα(δn197)cooh端配体结合结构域(ligandbindingdomain,lbd)的另一种抗rxrα抗体时,p85α容易以tnfα(图3e)或ra依赖性方式(图12d,e)发生免疫共沉淀。d20抗rxrα抗体识别n-端a/b结构域中的2-21位氨基酸,而δn197抗rxrα抗体识别c-端e/f结构域(图3e)。通过δn197抗rxrα抗体的p85α免疫共沉淀伴随有截短的rxrα(trxrα)的免疫沉淀,而通过d20抗rxrα抗体并未检测到,这表明其缺少n-端序列(图12d)。使用δn197抗rxrα抗体,tnfα增强而舒林酸抑制p85α与trxrα和/或rxrα的相互作用(图3e)。在tnfα存在下p85α与trxrα的相互作用也被舒林酸抑制(图12e)。这些结果表明trxrα与p85α结合导致了akt活化。
实施例6.rxrα的80至100位氨基酸对干与p85α结合十分关键
检查细胞内蛋白水解切割。用或者不用9-顺式-ra(10-7m)处理细胞30分钟并且使用δn197rxrα抗体通过免疫印迹对裂解物进行分析(图3f)。免疫印迹证实在不同细胞环境和生物过程中rxrα经常在其氨基端被切割(图3f)。
用或者不用9-顺式-ra处理a549肺癌细胞30分钟。使用d20或δn197抗rxrα抗体通过免疫印迹对细胞核(nu)和细胞质(cyt)级分进行分析。为了确保制备纯度,在hsp60(细胞质特异性)和parp(细胞核特异性)蛋白的存在下也对级分进行免疫印迹(图13)。在使用抗rxrα(δn197)进行免疫染色之后,通过共聚焦显微镜观察mef中内源rxrα的亚细胞定位。还通过dapi对细胞进行染色以使细胞核显现(图4b)。
rxrα存在于质膜中(图4a,上图)并且在一些细胞的细胞膜上呈点状结构(图4a,下图)。mef中44-kdatrxrα的产生还受细胞密度调节(图4a)。以低密度培养的细胞中所观察到的44-kdatrxrα水平在细胞生长至高密度时降低,并且伴随有更小rxrα片段的出现。有趣的是,44-kdatrxrα蛋白水平与akt活化有关系(图4a),表明rxrα的细胞密度依赖性蛋白水解切割可以是调节akt活化的重要机制。与trxrα的细胞质定位一致(图13)的是,当通过δn197抗rxrα抗体对mef细胞进行免疫染色时,发现rxrα主要在细胞质中(图4b)。因此,rxrα的仅n-端末端序列缺失可改变其亚细胞定位,赋予其与p85α结合的能力。本文所述的p85α与trxrα免疫共沉淀的观察结果表明trxrα可与p85α结合,导致了trxrα依赖性akt活化。
以不同细胞密度接种mef细胞并制备裂解产物,然后通过免疫印迹分析akt活化。还使用δn197抗rxrα抗体通过免疫印迹对裂解产物进行检查(图4a)。小鼠胚胎成纤维细胞(mef)中的trxrα水平以细胞密度依赖性方式与akt活化相关联(图4a)。与trxrα的细胞质定位一致的是,mef经常表现出rxrα的质膜定位(图4b)。
为了直接研究trxrα在p85α相互作用和akt活化中的作用,构建缺失其n-端80个氨基酸的rxrα突变体(rxrα/δ80),其产生与内源性trxrα分子量相似的rxrα突变体蛋白。当将myc-标记的rxrα/δ80与flag-p85α一起共转染到细胞中时,它们发生强烈的相互作用,并进一步被tnfα增强(图5a)。相比之下,全长rxrα和缺失100个n-端氨基酸的rxrα突变体(rxrα/δ100)在相同条件下不能与flag-p85α相互作用。因此,rxrα的80至100位氨基酸对于与p85α结合十分关键。在这个支持下,rxrαn-端a/b结构域(rxrα/1-134),而不是其lbd(rxrα/224-462)与p85α相互作用(图5b)。与trxrα的细胞质定位(图13)一致的是,rxrα/δ80主要存在于细胞质中,表现出扩散的且有时为点状的质膜定位(图5d)。rxrα/δ80,而不是rxrα/δ100的转染,也强烈活化多种细胞类型中的akt(图5c)。
在体外检查rxrα/δ80免疫复合物的pi3k活性。将myc-标记的rxrα/δ80与p85α共转染到a549细胞中,并且通过抗myc抗体使含rxrα/δ80的复合物发生免疫沉淀并且测定pi3k活性。由细胞制备的特异性myc-rxrα/δ80免疫沉淀物表现出tnfα依赖性方式的强pi3k活性(图5e和15),这与其与p85α相互作用的能力(图5a)和akt活化(图5c)有很好的相关性。因此,发现tnfα诱导的trxrα/p85α相互作用活化pi3k/akt信号转导。
rxrα/δ80在sw480和hct116结肠癌细胞中稳定表达,并且所得稳定克隆sw480/rxrα/δ80和hct116/rxrα/δ80表现出升高的akt活化并且诱导其下游靶点c-myc和细胞周期蛋白d1(图5f)。使用克隆性存活测定来评价sw480/rxrα/δ80和hct116/rxrα/δ80的生长。稳定克隆比对照细胞形成的集落多得多(图5g)。在动物中检查rxrα/δ80对癌细胞生长的作用。为此,将相同数目的表达rxrα/δ80的细胞或对照细胞注入到同一裸鼠的不同肋部并且测定其生长。在动物中由sw480/rxrα/δ80和hct116/rxrα/δ80形成的肿瘤比由对照细胞形成的肿瘤生长得要快得多(图5h-i)。总之,这些结果证实n-端截短的rxrα是体内癌细胞生长的有效促进剂。
实施例7.akt活化和细胞转化中的内源trxrα
全长rxrα不能与p85α相互作用的观察结果表明在rxrα中a/b结构域中的p85α结合基序被掩蔽。因此,rxrα的n-端a/b结构域可与全长rxrα相互作用(补充图8a),揭示了分子内相互作用。
将表达载体gfp-rxrα/1-134和myc-rxrα转染到hek293t细胞中。使用抗myc抗体通过co-ip对相互作用进行分析(补充图8a)。将在其n-末端与gfp融合的全长rxrα或rxrα/1-134和在其c-末端标记有myc表位的全长rxrα共转染到hek293t细胞中。36小时之后,使用抗myc抗体通过ip和wb对细胞裂解产物进行分析。
n-端a/b结构域与rxrα结合(补充图8a)。rxrαn-端片段的表达诱导rxrα切割(补充图8b)。rxrα/1-134与全长rxrα一起转染增加了trxrα的水平(补充图8b),这可能是因为其通过竞争破坏了分子内相互作用,导致rxrαn-端中蛋白水解部位的暴露。
rxrα的n-端区域rxrα/1-134的转染可增加trxrα水平(图14)。为了研究内源trxrα的作用,使rxrα/1-134在hela细胞中稳定表达,从而显著增加稳定表达rxrα/1-134的细胞中的trxrα蛋白,并且伴随有内源全长rxrα蛋白的减少(图4c)。与亲本hela细胞相比,hela/rxrα/1-134的稳定克隆具有较高的akt活化(图4c),并且在软琼脂中生长迅速(图4d),这表明内源性trxrα在akt活化和细胞转化活性中的作用。在集落形成测定中,舒林酸强烈抑制通过稳定克隆形成的集落(图4e)。在乳癌患者的肿瘤组织中,而并非在相应的肿瘤周围组织和正常组织中存在trxrα,阐明了trxrα的的临床相关性(图4f)。在肝癌患者中得到相似的结果。人肝癌样本中rxrα的免疫组织化学分析揭示了在肿瘤组织中,而并非相应的肿瘤周围组织中有强烈的细胞质rxrα染色(图4g)。总之,这些结果证实trxrα可通过活化akt为癌细胞的生长和存活作出贡献,以及trxrα介导的活性可被舒林酸负向调节。
实施例8.舒林酸类似物的合成
rxrα充当舒林酸作用的细胞内靶点的发现为鉴定用于抑制akt活性的rxrα-选择性舒林酸衍生物提供了机会。比较舒林酸与rxrα和cox-2的结合(图7a,18b)以设计有助于rxrα结合而不利于cox结合的舒林酸类似物。比较舒林酸硫化物和吲哚美辛的二维结构(图18a)。产生在cox-2活性部位中结合的舒林酸与吲哚美辛的重叠(图18b)。与吲哚美辛类似,将舒林酸直观地模式化成与cox-2结合。
设计并合成了类似物(图19)。使用取代的苯甲醛(1)作为起始材料制备取代的茚满酮衍生物(4)。在perkin反应中,用适当酸酐处理衍生物(1)得到衍生物(2),然后通过催化加氢还原得到衍生物(3)。多聚磷酸(ppa)催化的分子内friedel-crafts酰基化封闭5元环得到1-茚满酮衍生物(4)。用由乙酸乙酯和六甲基二甲硅烷基氨基锂(lithiumhexamethyldisilylamide,lhmds)生成的烯醇化物处理衍生物(4),然后在酸性环境下脱水得到期望的乙酸酯(5)。使所产生的茚-3-乙酸酯(5)与取代苯甲醛反应(claisen-schmidt反应),酸化之后得到舒林酸类似物(z-6)。舒林酸类似物(9)合成的一步是二碘化钐(smi2)介导的1-茚满酮(4)与丙烯酸甲酯的还原偶联,得到螺内酯(7)。用催化量的对甲苯磺酸(p-tsoh)处理(7)的甲醇溶液产生脱水产物(8),经过claisen-schmidt反应和酸化得到舒林酸类似物(9)。值得注意的是,在化合物(5/8)的claisen-schmidt反应中,当r2=ch3时,主要形成化合物(6/9)的顺式(z)-异构体;而在r2=h的情况下,主要形成化合物(6/9)的反式(e)-异构体。
实施例9.舒林酸类似物的评价
参照9-顺式-ra,评价舒林酸与rxrα的lbp的对接,从而鉴定用于舒林酸结构修饰的策略以使其cox抑制与rxrα结合活性分离。图7a中示出舒林酸与rxrα的对接。将对接的舒林酸的取向和位置与9-顺式-ra、dha和bms649的晶体结构进行比较(图7b)。在模式中结合的舒林酸(其中其羧酸酯基团与所检查的所有rxrα配体中发现的羧酸酯基团匹配(图7b))与rxrαlbp中的arg316相互作用。与rxrαlbp中的疏水区域结合的舒林酸的苄基甲基硫化物部分与9-顺式-ra的紫罗兰酮环(a-ionone)重叠。在这种结合模式中,4位的-sch3基(图7c)与rxrα蛋白的范德华相互作用并非最佳,并且仍有修饰空间以改善与rxrα的结合。舒林酸前药、舒林酸亚砜和代谢物舒林酸砜不表现出cox抑制活性,而代谢物舒林酸硫化物(本文所用)为强cox抑制剂的事实(haanen,2001),完全支持了利用4位来设计rxrα选择性类似物的想法。如图7a所示,与rxrα配体dha、bms649和9-顺式-ra中的等价基团相比,舒林酸的羧酸酯基团远离arg316。用更庞大的基团例如-ch2ch2cooh代替d位的-ch2cooh将帮助羧酸酯基团更靠近arg316,从而实现如9-顺式-ra中所观察到的良好的电荷-电荷相互作用。
还通过与cox-2的晶体结构对接对候选化合物进行检查(图18)以鉴定非cox结合剂。基于这些考虑,设计并合成了五种类似物(图7c和19)。这些评价表明所有的类似物都保留rxrα结合活性,并且k-80003最强(比舒林酸高约34倍),这可能是因为其4位上的异丙基(i-pr)改善了与rxrα的螺旋7(helix7)上疏水残基的相互作用。显著地,k-80003和k-80005没有可检出的对cox活性的抑制(图7c)并且不能抑制组成型的和tnfα(图7d)或il-1β(未示出)诱导的前列腺素e2(pge2)产生。还通过19fnmr结合测定测定了k-80003与rxrα的结合(图7e)。因此,可将舒林酸的rxrα结合与其cox-结合分离开。
将a549细胞接种到带有10%胎牛血清的dmem的24孔板上。过夜培养之后,在无血清的dmem培养基中用10ng/mlil-1β刺激细胞24小时。用指示浓度的舒林酸或类似物预处理10分钟之后,在37℃用10μm花生四烯酸和舒林酸或其类似物一起处理细胞30分钟。收集培养基并立即测定。通过前列腺素e2eia单克隆试剂盒(prostaglandine2eiakit-monoclonal)根据制造商说明书(caymanchemical,annarbor,mi)测量pge2产量。将pge2产量(%)表示为在化合物存在下产生的pge2与通过单独载剂产生的pge2之比。
类似物的评价表明它们都保留rxrα结合活性,并且k-80003最强(比舒林酸高约34倍),这可能是因为4位上的异丙基(i-pr)改善了与rxrα的螺旋7(helix7)上疏水残基的相互作用。k-80003和k-80005没有可检出的对cox活性的抑制(图7c)并且不能抑制组成型的或tnfα诱导的(图7d)或il-1β诱导的前列腺素e2(pge2)产生(未示出)。比较不存在或存在10μmrxrαlbd的情况下k-80003(100μm)的19fnmr谱(图7e)。
用指示浓度的舒林酸或k-80003处理caco-2和mef细胞30分钟,然后用全反式-ra(10-7m)刺激15分钟。通过免疫印迹分析akt活化。用k-80003(50μm)对经rxrα或rarγsirna转染的pc3细胞预处理1小时,然后暴露于tnfα(10ng/ml)30分钟(prxrα:磷酸化rxrα)。用flag-p85α和myc-rxrα/δ80转染a549细胞,用舒林酸(50μm)或k-80003(50μm)处理1小时,暴露于tnfα维持30分钟,并使用抗flag抗体通过免疫共沉淀进行分析。在抑制atra诱导的akt活化(图20)和tnfα诱导的akt活化(图8a)、hela/rxrα/1-134稳定克隆的集落形成(图8b)、以及p85α与rxrα/δ80的相互作用(图8c)方面,k-80003(50μm)比舒林酸(50μm)要强得多。通过sirna降低rxrα表达大大削弱了k-80003对pc3细胞中akt活化的抑制作用。相比之下,通过rarαsirna降低rarα表达未表现出这种作用。因此,k-80003对akt活化的抑制也依赖于rxrα表达(图8b)。
免疫共沉淀测定证实在不存在或存在tnfα的情况下,与舒林酸作用相比,k-80003都强烈抑制rxrα/δ80与p85α的相互作用(图8c)。
用tnfα和/或舒林酸(75μm)或k-80003(50μm)处理zr-75-1细胞6小时并通过免疫印迹进行分析。当与tnfα一起在zr-75-1细胞中使用时,在诱导parp切割方面k-80003比舒林酸也要强得多(图8d)。与舒林酸相似,k-80003与tnfα组合协同诱导hepg2和pc3细胞中的parp切割和胱天蛋白酶-8活化(图8e)。
在克隆存活测定中,hela/rxrα/1-134稳定克隆和rxrα/δ80稳定克隆的集落形成几乎完全被k-80003抑制,揭示了其抑制细胞生长的能力(图8f)。k-80003对akt活化的抑制作用被rxrα而不是rarγsirna终止(图8f),表明rxrα在介导其作用中的角色。
用玉米油、舒林酸(60mg/kg)或k-80003(60mg/kg)处理小鼠(n=6)两周。取出肿瘤并测量。显著地,k-80003对动物的rxrα/δ80肿瘤生长表现出的抑制作用比舒林酸要强得多(图8g)。总之,rxrα选择性舒林酸类似物k-80003是rxrα介导的pi3k/akt信号和癌细胞生长的强烈抑制剂。
实施例10.在哺乳动物中筛选舒林酸类似物
选择舒林酸类似物的组以筛选能够诱导细胞凋亡的化合物。将每种候选化合物引入小鼠中并且进行分析以确定其是否能够抑制akt活性、活化胱天蛋白酶-8、活化bax、抑制cflip和/或降解细胞中的bid。在筛选期间鉴定的化合物可被用于本文所公开的进一步的筛选测定或处理方法。
实施例11.治疗人患者的癌症
鉴定有治疗癌症需要的人患者,并且施用已知与rxrα相互作用且不依赖cox-2通路起作用的化合物。监测患者由施用化合物引起的癌症的稳定或改善。施用化合物之后观察患者的抗肿瘤发生作用。
实施例12.预防人患者的癌症
鉴定相对于一般人群具有升高的患癌症风险的人患者,并指导其每天两次服用150mg包含活性成分k-80003的片剂。监测患者并且施用化合物之后不患癌症。
实施例13.tnfα诱导的外在凋亡通路的舒林酸活化
用sr11237(1μm)处理在带有1%fbs的培养基中培养的hepg2细胞1小时,然后用tnfα(10ng/ml)和/或舒林酸(75μm)处理4小时,并通过免疫印迹进行分析。用tnfα和/或舒林酸处理经对照或rxrαsirna转染的hepg2细胞并通过免疫印迹进行分析。
用舒林酸和tnfα处理hepg2肝癌细胞(图6a)和其他细胞系(图16和17)有效诱导了parp切割和胱天蛋白酶-8活化(由被切割的胱天蛋白酶-8产物p43/p41表明),而用舒林酸或tnfα单独处理这些细胞的作用很小。rxrα选择性配体sr11237(图6a)或rxrαsirna的转染(图6b)部分抑制了舒林酸/tnfα组合的凋亡作用,再次证实了rxrα的作用。
用tnfα和舒林酸处理经对照或胱天蛋白酶-8sirna转染或经zietd-fmk(40μm)预处理1小时的hepg2细胞,并通过免疫印迹进行分析。舒林酸/tnfα诱导的parp切割的完全抑制(图6c和图16b-c)。当细胞经胱天蛋白酶-8sirna转染时得到相似结果(图6d和16d)。因此,舒林酸/tnfα诱导的凋亡是由外在凋亡通路介导。
舒林酸和tnfα对bax的活化。用bax/6a7抗体对经tnfα和/或舒林酸处理的hepg2细胞进行免疫染色。约15%舒林酸处理的细胞,而约60%舒林酸/tnfα处理的细胞表现出bax染色。还检查了引起bax活化的可能的外在凋亡通路的舒林酸活化。使用构象敏感性bax/6a7抗体通过免疫染色检查了经tnfα或舒林酸单独或一起处理的hepg2细胞的bax活化。只有在用tnfα和舒林酸二者处理细胞时才观察到显著的bax染色(图6e)。外在与内在凋亡通路之间的交叉效应(cross-talk)可以通过bid切割和活化连接起来(li等,cell94(4),491-501(1998))。事实上,bid在经tnfα和舒林酸处理的细胞中显著降解(图6a),这表明舒林酸/tnfα诱导的bax活化可通过bid活化介导。
用tnfα和/或舒林酸处理经ca-akt或dn-akt转染的pc3细胞并通过免疫印迹进行分析(图6f)。舒林酸和tnfα对胱天蛋白酶-8(图6g)和bax(图6h)的活化。用tnfα和舒林酸处理经ca-akt转染的hepg2细胞,并用抗切割的胱天蛋白酶-8或bax/6a7抗体进行免疫染色。约80%未转染的和15%ca-akt转染的细胞表现出胱天蛋白酶-8染色。约60%未转染的和13%ca-akt转染的细胞表现出bax染色。组成型活性akt(constitutive-activeakt,ca-akt)的转染抑制舒林酸/tnfα诱导的parp切割,但是显性负性akt(dominant-negativeakt,dn-akt)的转染增强舒林酸/tnfα诱导的parp切割(图6f)。一致地,ca-akt抑制通过舒林酸/tnfα组合的凋亡诱导(图17b)和胱天蛋白酶-8(图6g)和bax(图6h)活化。
通过免疫印迹对经tnfα和/或舒林酸处理6小时的细胞进行分析(图6i)。对通过抑制胱天蛋白酶-8活化充当外在凋亡通路的强烈抑制剂的c-flip(akt信号的下游靶基因)的表达进行检查。用tnfα处理hepg2、a549和sw480细胞强烈诱导c-flip的短形式(c-flips)和长形式(c-flipl)二者,并且被舒林酸抑制(图6i)。因此,舒林酸可通过抑制tnfα对c-flip表达的诱导作用来诱导凋亡。
实施例14.k-80003在乳房肿瘤中的生长抑制
研究口服施用k-80003对小鼠中生长的mcf-7乳房肿瘤组织的生长抑制作用。将k-80003溶解于nahco3(ph8.0)。通过填喂法向带有mcf-7乳房肿瘤组织的小鼠施用总体积为100ul的15mg/kgk-80003、30mg/kgk-80003、60mg/kgk-80003或对照,每天一次。20天后测量的肿瘤体积表明,与经对照处理的小鼠相比,经口服k-80003处理的小鼠表现出肿瘤体积的剂量依赖性减小(图21a)。
实施例15.k-80003的临床前研究
进行k-80003的临床前研究,包括毒性、生物利用度和药代动力学的研究。k-80003表现出非常低的毒性(图22a),与静脉内制剂相比口服的生物利用度增加(图22b)和满意的pk特征(图22c)。
实施例16.类似物的生产
3-(4-氟苯基)-2-甲基丙烯酸(2a)
在0℃将丙酸酐(31.0ml,242mmol)加入碳酸钾(18.2g,132mmol)中。搅拌5分钟以混合之后,加入对氟苯甲醛(1a)(13.0ml,120mmol)。在160℃将混合物加热12小时。用冰浴冷却之后向反应混合物中加入水。过滤所得黄色沉淀物,并用etoac洗涤,产生粗品酸2a,其被原样用于下一步。通过从meoh中重结晶得到已知丙烯酸2a(40)的分析样品。2a:淡黄色晶体。熔点:155-158℃(meoh)。
ir(kbr):vmax=3429,3076,2972,1665,1596,1508,1425,1313,1298,1224cm-1;1hnmr(400mhz,cd3od)δ:2.09(s,3h,cch3),7.22-7.11(m,2h,ph-h),7.52-7.43(m,1h,ph-h),7.69(s,1h,ch=cch3)ppm;13cnmr(100mhz,cd3od)δ:12.7,114.8,115.1,131.4,131.5,132.1,132.2,137.5,161.3,163.75,170.4ppm;ms(esi)m/z179(m-h+).
3-(4-氟苯基)-2-甲基丙酸(3a)
在20个大气压的氢气下使甲醇(190ml)中粗品丙烯酸2a(14.3g,79.4mmol)和10%pd/c(1.35g)的混合物氢化10小时。滤出催化剂并浓缩滤液得到粗品3a,其被原样用于下一步。通过在硅胶上进行快速柱色谱(乙酸乙酯∶pe,1∶2)得到化合物3a(40)的分析样品。3a:无色油。
ir(film):vmax=3406,2972,2933,1701,1560,1509,1460,1406,1223cm-1;1hnmr(400mhz,cdcl3)δ:1.17(d,j=6.82hz,3h,chch3),2.77-2.61(m,2h,ch2ch),3.02(dd,j=13.18,6.35hz,1h,ch2ch),7.00-6.93(m,2h,ph-h),7.16-7.11(m,2h,ph-h)ppm;13cnmr(100mhz,cdcl3)δ:16.4,38.4,41.4,115.1,115.1,130.3,130.4,134.5,134.6,160.4,162.8,182.6ppm;ms(esi)m/z181(m-h+).
film:膜
6-氟-2-甲基-2,3-二氢茚-1-酮(4a)
将粗品丙酸衍生物3a(3.20g)和多聚磷酸(47.0g)的混合物在80℃加热4小时。将所得混合物倾入冰水中并用etoac萃取。合并的萃取物用饱和nahco3水溶液洗涤以除去初始的酸,然后用盐水洗涤,经无水na2so4干燥,过滤,并在减压下浓缩。残余物经快速柱色谱(乙酸乙酯∶pe,1∶30)纯化得到作为淡黄色油的化合物4a(40)(1.44g,50%)。用浓hcl使nahco3层酸化,用etoac萃取(3×30ml)。合并的萃取物用盐水洗涤,经无水na2so4干燥,过滤并在减压下浓缩,得到回收的原始材料3a(34%)。4a的数据:
ir(film)vmax=3064,2968,2932,2873,1716,1611,1509,1486,1444,1264,1158cm-1;1hnmr(400mhz,cdcl3)δ:1.32(d,j=7.37hz,3h,chch3),2.82-2.65(m,2h,ch2ch),3.37(dd,j=16.71,7.55hz,1h,ch2ch),7.33-7.26(m,1h,ph-h),7.44-7.36(m,2h,ph-h)ppm;13cnmr(100mhz,cdcl3)δ:16.2,34.4,42.9,76.3,109.7,109.9,122.2,122.5,127.8,127.9,138.1,148.8,149.6,161.1,163.6,208.5ppm;ms(esi)m/z187(m+na+).
2-(6-氟-2-甲基-3h-茚-1-基)乙酸乙酯(5a)
在0℃向hmds(15.0ml,56.9mmol)的无水thf(38.0ml)溶液中逐滴加入n-buli(在正己烷中的2.5m溶液,17.0ml,42.8mmol)。搅拌约30分钟之后,使混合物冷却至-78℃并加入etoac(4.20ml,42.8mmol)。在-78℃将反应物搅拌另外的30分钟。向所得混合物中逐滴加入二氢茚酮4a的无水thf(40ml)溶液。在-78℃将反应物搅拌另外的4小时,然后用饱和nh4cl水溶液停止反应。混合物用etoac萃取(3×20ml)。合并的有机层经无水na2so4干燥,过滤,并在减压下浓缩。向残余物中加入hoac/h2so4(10/1,55ml)。室温下搅拌5小时之后,用ch2cl2(3×15ml)萃取混合物。合并的萃取物依次用水、饱和nahco3和盐水洗涤,经无水na2so4干燥,过滤,并在减压下浓缩。残余物在硅胶上经快速柱色谱(乙酸乙酯∶pe,1∶30)纯化得到作为无色油的化合物5a(40)(3.26g,70%)。
ir(film)vmax=2981,2911,1736,1614,1590,1473,1368,1329,1308,1256,1154,1034cm-1;1hnmr(400mhz,cdcl3)δ:1.25(t,j=7.13hz,3h,cooch2ch3),2.12(s,3h,cch3),3.29(s,2h,phch2c),3.48(s,2h,phcch2),4.14(q,j=7.13hz,2h,cooch2ch3),6.79(ddd,j=9.62,8.12,2.41hz,1h,ph-h),6.96(dd,j=9.33,2.40hz,1h,ph-h),7.25(dd,j=8.17,4.93hz,1h,ph-h)ppm;13cnmr(100mhz,cdcl3)δ:14.1,14.3,31.5,42.1,60.9,105.6,105.9,110.2,110.4,123.6,123.7,129.6,129.6,137.2,137.2,144.6,147.8,147.9,161.2,163.6,170.7ppm;ms(esi)m/z257(m+na+).
(z)-2-(3-(4-(甲硫基)苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸
(舒林酸硫化物)(6a)
室温下向茚5a(650mg,3mmol)的meoh(4.6ml)溶液中加入2nnaome(4.6ml,9mmol)得到橙色混合物。搅拌20分钟之后,向混合物中加入对(甲硫基)苯甲醛(0.8ml,7.5mmol)。在80℃使所得混合物回流3.5小时。在减压下浓缩之后,将残余物倾入1nhcl溶液中。室温下搅拌另外的10小时之后,用etoac(3×15ml)萃取混合物。合并的有机层经无水na2so4干燥,过滤,并在减压下浓缩。残余物经闪式色谱(乙酸乙酯∶pe,1∶2.5)纯化,主要得到作为黄色固体的顺式(z)异构体6a(舒林酸硫化物)(40)(868mg,85%)。得到的反式(e)异构体为约2%。熔点182-185℃(etoac)(文献(40)熔点180-184℃)。
ir(kbr)vmax=3445,3012,2914,2850,1702,1602,1589,1465,1410,1320,1240,1171,1085cm-1;1hnmr(400mhz,dmso-d6)δ:2.15(s,3h,c=cch3),2.54(s,3h,sch3),3.57(s,2h,ch2coo),6.77-6.71(m,1h,vinylh),7.01(dd,j=9.31,2.25hz,1h,vinylh),7.25-7.46(m,5h,ph-h),12.40(s,1h,cooh)ppm;13cnmr(100mhz,cdcl3)δ:10.7,14.7,31.5,106.1,106.4,110.6,110.8,123.4,123.5,125.8,130.0,130.3,131.0,132.1,132.6,138.5,139.5,139.5,139.5,147.2,147.3,161.5,161.6,172.1ppm;ms(esi)m/z331(m+na+).
按照舒林酸硫化物(6a)所述的步骤,并且通过茚5a与适当的芳族醛缩合,分别合成了化合物k-80001至k-80003。
(z)-2-(3-(4-甲基苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸(6b)
(k-80001)
黄色固体。熔点155-158℃。产率:87%。
ir(kbr)vmax=3426,3022,2959,2915,1733,1717,1655,1599,1512,1470,1408,1381,1214,1172cm-1;1hnmr(400mhz,cdcl3)δ:2.19(s,3h,c=cch3),2.41(s,3h,ph-ch3),3.58(s,2h,ch2co2h),6.59-6.53(m,1h,vinylh),6.87(dd,j=8.98,2.40hz,1h,vinylh),7.44-7.16(m,6h,ph-h)ppm;13cnmr(100mhz,cdcl3)δ:10.61,21.43,29.73,31.44,105.54,105.77,110.48,110.71,123.73,123.83,129.21,129.32,129.78,129.80,129.84,129.87,131.00,131.02,133.48,138.29,138.95,139.76,146.13,146.22,161.84,164.29,176.68ppm;ms(esi)m/z363(m+na+).
c20h17fo2的分析计算值:c,77.90;h,5.56。测定值:c,77.88;h,5.99。
(z)-2-(3-(4-乙基苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸(6c)
(k-80002)
黄色固体。熔点159-162℃。产率:83%。
ir(kbr)vmax=3082,3024,2965,2923,1705,1604,1473,1465,1413,1312,1229,1168cm-1;1hnmr(400mhz,cdcl3)δ:1.29(t,j=7.61hz,3h,ch2ch3),2.20(s,3h,c=cch3),2.71(q,j=7.60hz,2h,ch2ch3),3.59(s,2h,ch2coo),6.60-6.54(m,1h,aromaticvinylh),6.88(dd,j=8.97,2.39hz,1h,aromaticvinylh),7.19-7.44(m,5h,ph-h)ppm;13cnmr(100mhz,cdcl3)δ:10.6,15.4,28.7,31.4,105.5,105.7,110.5,110.7,123.7,123.8,128.0,129.4,129.7,129.9,131.0,133.7,138.9,139.7,144.6,161.8,164.2,176.4ppm;ms(esi)m/z345(m+na+).
c21h19fo2的分析计算值:c,78.24;h,5.94。测定值:c,78.21;h,5.55。
(z)-2-(3-(4-异丙基苯亚甲基)-6-氟-2-甲基-3h-茚-1-基)乙酸(6d)
(k-80003)
黄色固体。熔点146-149℃。产率:79%。
ir(kbr)vmax=3025,2958,2871,1701,1629,1603,1507,1464,1412,1315,1293,1171,1134cm-1;1hnmr(400mhz,cdcl3)δ:1.31(d,j=6.95hz,6h,ch(ch3)2),2.20(s,3h,c=cch3),2.97(td,j=13.81,6.91hz,1h,ch(ch3)2),3.59(s,2h,ch2coo),6.61-6.88(m,2h,aromaticvinylh),7.19-7.46(m,6h,ph-h);13cnmr(100mhz,cdcl3)δ:10.6,23.9,31.3,34.0,76.7,105.5,105.7,110.5,110.7,123.7,123.8,126.5,129.4,129.7,129.8,131.0,133.7,139.0,139.6,146.1,146.2,149.3,161.8,164.2,176.1ppm;ms(esi)m/z359(m+na+).
c22h21fo2的分析计算值:c,78.55;h,6.29。测定值:c,78.13;h,6.02。
2-(6-氟-3h-茚-1-基)乙酸乙酯(5b)
在0℃向异丙胺(0.27ml,2mmol)的无水thf(4ml)溶液中逐滴加入n-buli(在正己烷中的2.5m溶液,0.8ml,2mmol)。搅拌约30分钟之后,使混合物冷却至-78℃并加入etoac(0.2ml,2mmol)。在-78℃搅拌另外的30分钟之后,逐滴加入无水thf(0.7ml)中的二氢茚酮4b(150mg,1mmol)。在-78℃将反应物搅拌另外的2小时,然后用饱和nh4cl停止反应。用etoac萃取(3×5ml)混合物。合并的有机层经无水na2so4干燥,过滤,并在减压下浓缩。用acoh/h2so4(10/1,3ml)取出残余物。室温下搅拌3小时之后,用ch2cl2(3×5ml)萃取混合物。合并的萃取物依次用水、饱和nahco3和盐水洗涤。有机相经无水na2so4干燥,过滤,并在减压下浓缩。残余物经硅胶上的快速柱色谱(乙酸乙酯:pe,1:30)纯化得到作为无色油的5b(99mg,49%)。
ir(film)vmax=3054,2982,2931,1704,1636,1486,1446,1369,1345,1288,1276cm-1;1hnmr(400mhz,cdcl3)δ:1.28(t,j=7.15hz,3h,ch2ch3),3.35(s,2h,ch2co2et),3.56(dd,j=2.93,1.51hz,2h,ch2ch),4.19(q,j=7.15hz,2h,ch3ch2),6.52(s,1h,c=ch),6.93-7.36(m,3h,ph-h)ppm;13cnmr(100mhz,cdcl3)δ:14.2,34.1,37.4,61.0,106.4,106.7,111.4,111.6,124.3,124.4,134.1,136.3,136.4,139.2,139.3,146.3,146.4,161.1,163.5,170.72ppm.
c13h=fo=的分析计算值:c,70.90;h,5.95。发现值:c,71.30;h,6.23。
(e)-2-(3-(4-(甲硫基)苯亚甲基)-6-氟-3h-茚-1-基)乙酸(6e)
(k-80004)
室温下向茚衍生物5b(506mg,2.50mmol)的meoh(4ml)溶液中加入2nnaome(4ml,4mmol)。搅拌20分钟之后,向所得混合物中加入对(甲硫基)苯甲醛(0.65ml,2.50mmol)。在80℃使混合物回流3.5小时。所得溶液在减压下浓缩,然后倾入1nhcl中。室温下搅拌另外的10小时之后,用etoac(3×10ml)萃取混合物。合并的有机层经无水na2so4干燥,过滤,并在减压下浓缩。残余物经硅胶上的快速柱色谱(乙酸乙酯∶pe,1∶2.5)纯化,得到作为黄色固体的反式(e)异构体6e(k-80004)(429mg,48%)。熔点180-182℃(etoac)。
1hnmr(400mhz,cdcl3)δ:2.54(s,3h,sch3),3.69(s,2h,ch2coo),7.09-7.84(m,9h,ph-h),12.52(s,1h,cooh)ppm;13cnmr(100mhz,cdcl3)δ:13.6,115.5,115.7,127.3,131.7,131.8,139.9,161.5,163.9,174.0ppm.
c19h15fo2s的分析计算值:c,69.92;h,4.63;f,5.82;o,9.80;s,9.82。测定值:c,70.16;h,4.92。
螺(二氢-2(3h)呋喃酮-5-1’(2’h)(3’h)-6-氟-二氢化茚(7a)
用氩气使6-氟-1-茚满酮4b(75.0mg,0.50mmol)、异丙醇(0.190ml,2.50mmol)和丙烯酸甲酯(0.45ml,5mmol)的thf(10ml)溶液净化20分钟并冷却至0℃。通过接种针加入sml2(1.50mmol)的thf(15ml)溶液。5分钟后,用饱和k2co3(2ml)使反应停止。所得混合物用etoac(3×3ml)萃取。合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并在减压下浓缩。残余物经硅胶上的快速柱色谱用etoac-pe(1∶6)洗脱纯化,得到作为无色油的化合物7a(74.5mg,0.37mmol,73%)。
ir(film)vmax:3058,2945,2856,1766,1603,1494,1155cm-1;1hnmr(400mhz,cdcl3)δ:2.28-2.52(m,4h,arcch2),2.77(dt,j=8.0,1.2hz,2h,arcch2ch2co),2.81-2.90(m,1h,arch2),3.00-3.09(m,1h,arch2),6.96-7.03(m,2h,ar-h),7.18-7.23(m,1h,ar-h);13cnmr(100mhz,cdcl3)δ:28.7,29.5,33.3,39.4,94.1,109.7(d,jc-f=22.4hz)116.6(d,jc-f=22.5hz),126.2(d,jc-f=8.3hz),138.8,144.7(d,jc-f=7.4hz),162.2(d,jc-f=233.5hz),176.0ppm;
c12h11fo2的分析计算值:c,69.89;h,5.38。测定值:c,69.97;h,5.62。
3-(6-氟-3h-茚-1-基)丙酸甲酯(8a)
向螺(二氢-2(3h)呋喃酮-5-1’(2’h)(3’h)-6-氟-二氢化茚7a(61mg,3mmol)的ch3oh(1.5ml)溶液中加入p-tsoh(6mg)。使混合物回流2小时。用nahco3的饱和水溶液(2.0ml)使反应停止。所得混合物用etoac(3×2ml)萃取。合并的有机相用盐水洗涤,经无水na2so4干燥,过滤,并在减压下浓缩。残余物经硅胶上的快速柱色谱用etoac-pe(1∶300)洗脱纯化,得到作为淡黄色油的化合物8a(61mg,0.28mmol,94%)。
ir(film)vmax:2959,2901,1739,1585,1606,1473,1254,1162cm-1;1hnmr(400mhz,cdcl3)δ:2.68-2.73(m,2h,ch2coo),2.82-2.88(m,2h,arcch2),3.28-3.31(m,2h,arch2),3.71(s,3h,cooch3),6.30(t,1h,j=1.6hz,arc=ch),6.83-6.91(m,1h,ar-h),7.02-7.06(m,1h,ar-h),7.33-7.38(m,1h,ar-h);13cnmr(100mhz,cdcl3)δ:22.9,32.4,37.3,51.7,106.0(d,jc-f=23.1hz),111.4(d,jc-f=22.8hz),124.4(d,jc-f=8.9hz),130.3,139.5,142.4(d,jc-f=3.0hz),146.9(d,jc-f=8.5hz),162.4(d,jc-f=240.6hz),173.4ppm;
c13h13fo2的分析计算值:c,70.90;h,5.95。测定值:c,70.50;h,5.97。
(e)-3-(3-(4-(甲硫基)苯亚甲基)-6-氟-3h-茚-1-基)丙酸甲酯(9a)
(k-80005)
用氮气使3-(6-氟-3h-茚-1-基)丙酸甲酯8a(110mg,0.5mmol)的ch3oh(1ml)溶液净化10分钟并冷却至0℃。逐滴加入新鲜配制的ch3oh(1ml)中的ch3ona(0.75mmol)。搅拌30分钟之后,逐滴加入4-(甲硫基)苯甲醛(63μl,0.6mmol)。使混合物回流2小时。冷却之后,用水(3ml)使反应停止并在室温下搅拌10分钟,用1mhcl使混合物酸化至ph=4。在减压下蒸发溶剂,并用etoac(3×5ml)萃取残余物。合并的有机层用盐水(2ml)洗涤,经无水na2so4干燥,过滤并在真空下浓缩。残余物经硅胶上的快速柱色谱用etoac-pe(1∶4)洗脱纯化,得到作为黄色固体的反式(e)-异构体9a(112mg,66%)。熔点:182-184℃(etoac);
ir(kbr)vmax:3055,2988,2925,1711,1640,1488,1445,1656,1290,1277cm-1;1hnmr(400mhz,cdcl3)δ:2.53(s,3h,sch3),2.68(t,2h,j=7.6hz,ch2coo),2.84(t,2h,j=7.6hz,arcch2),6.96-7.84(m,9h,ar-h),12.21(s,cooh);13cnmr(100mhz,cdcl3)δ:14.3,22.6,32.0,106.1(d,jc-f=23.4hz),111.5(d,jc-f=23.0hz),120.5(d,jc-f=9.2hz),122.6,125.8(2c),127.3,130.4(2c),132.8,134.1,136.4,139.4,143.2(d,jc-f=8.8hz),146.3,162.2(d,jc-f=240.5hz),173.8ppm;
c20h17fo2s的分析计算值:c,70.57;h,5.03;s,9.42。测定值:c,70.20;h,4.62;s,9.01
k-80003类似物no.1(r1变体;黄色固体):
k-80003类似物no.2(r1变体;黄色固体):
k-80003类似物no.3(r1变体;黄色固体):
k-80003类似物no.4(r1变体;黄色固体):
k-80003类似物no.5(r1变体;黄色固体):
k-80003类似物no.6(r1变体;黄色固体):
k-80003类似物no.7(r1变体;黄色固体):
k-80003类似物no.8(r2变体;黄色固体):
k-80003类似物no.9(r2变体;黄色固体):
k-80003类似物no.10(r2变体;黄色固体):
k-80003类似物no.11(r3变体;黄色固体):
k-80003类似物no.12(r3变体;黄色固体):
k-80003类似物no.13(r3变体;黄色固体):
k-80003类似物no.14(r3变体;黄色固体):
k-80003类似物no.15(r3变体;黄色固体):
k-80003类似物no.16(r3变体;黄色固体):
k-80003类似物no.17(r3变体;黄色固体):
k-80003类似物no.18(r3变体;黄色固体):
k-80003类似物no.19(r3变体;黄色固体):
k-80003类似物no.20(r3变体;黄色固体):
k-80003类似物no.21(r3变体;黄色固体):
k-80003类似物no.22(r4变体;黄色固体):
k-80003类似物no.23(r4变体;黄色固体):
k-80003类似物no.24(r4变体;黄色固体):
k-80003类似物no.25(r1变体):
k-80003类似物no.26(r1变体):
k-80003类似物no.27(r3变体):
其中r3=2-cn。
k-80003类似物no.28(r3变体):
其中r3=2-cf3。
k-80003类似物no.29(r3变体):
其中
k-80003类似物no.30(r3变体):
其中
k-80003类似物no.31(r4变体):
其中r4=et。
k-80003类似物no.32(r4变体):
其中r4=eto。
k-80003类似物no.33(r4变体):
其中r4=i-pr。
k-80003类似物no.34(r4变体):
其中r4=cl。
方法摘要
质粒
已描述了rxrα和myc-rxrα的构建(kolluri,s.k.等,procnatlacadsciusa102(7),2525-2530(2005);cao,x.,等,retinoidxreceptorregulatesnur77/tr3-dependentapoptosis[corrected]bymodulatingitsnuclearexportandmitochondrialtargeting.molcellbiol24(22),9705-9725(2004);masia,s.等,rapid,nongenomicactionsofretinoicacidonphosphatidylinositol-3-kinasesignalingpathwaymediatedbytheretinoicacidreceptor.molendocrinol21(10),2391-2402(2007);ohashi,e.等,cancerres69(8),3443-3450(2009);balkwill,f.,natrevcancer9(5),361-371(2009);han,y.h.等,oncogene25(21),2974-2986(2006))。使用正向引物5’-ccggaattccatgagtgctgaggggtacc-3’(seqidno:1)和反向引物5’-acgcgtcgactcatcgcctctgctgtgcat-3’(seqidno:2)通过聚合酶链式反应(pcr)构建flag-p85α。pcr产物经ecori和sali消化并被克隆到pcmv-flag载体中。通过以下寡核苷酸作为引物,使用
细胞培养
在补加有10%胎牛血清(fbs)的rpmi1640中培养zr-75-1人乳癌、lncap和pc3前列腺癌和h460肺癌细胞。在包含10%fbs的mem中培养hepg2肝癌和mcf-7人癌细胞。在补加有10%fbs的dmem中培养hek293t人胚肾细胞、cv-1绿猴肾细胞、mef细胞、a549人肺癌细胞、hacat人类角化细胞、bhk仓鼠崽肾细胞、caco2人结肠癌癌细胞、sw480人结肠腺癌细胞和hct116人结肠细胞。f9鼠胚胎癌细胞系具有破坏的rxrα等位基因(clifford,j.等,emboj15(16),4142-4155(1996))。使细胞培养物维持在37℃和5%co2潮湿气氛下。
抗体和试剂
anti-phospho-akt(ser473,d9e,#4060)来自cellsignalingtechnology(danvers,ma)。抗β-肌动蛋白(a1978)和抗flag(m2,f3165)抗体得自于sigma-aldrich(st。louis,mo)。抗p85α(#06-195)抗体购买自millipore(billerica,ma)。akt1(c-20)sc-1618、gfp(b-2)sc-9996、hsp60(n-20)sc-1052、c-myc(9e10)sc-40pi3,rarγ(c-19)sc-550、rxrα(d20)sc-553、rxrα(δn197)sc-774、parp(h-250)sc-7150的抗体来自santacruzbiotechnology(santacruz,ca)。ecl、抗兔和抗小鼠igg、与辣根过氧化酶连接的物种特异性抗体(horseradishperoxidase-linkedspecies-specificantibody)来自gehealthcare(littlechalfont,buckinghamshire,uk)。alexa
配体结合测定
在存在或不存在多种浓度的未标记的9-顺式-ra或舒林酸硫化物的情况下,在配体结合测定缓冲液中将细菌表达的his标记的rxrα配体结合结构域(lbd)与[3h]-9-顺式-ra(amershambiosciences,amersham,uk)一起孵育。通过涂镍珠捕获rxrαlbd蛋白。根据描述(kolluri,s.k.等,procnatlacadsciusa102(7),2525-2530(2005)),在闪烁计数器中测定结合的放射性标记的9-顺式-ra。
细胞中舒林酸硫化物与rxrα蛋白结合的hplc分析
使用fugene6转染剂(roche,basel,switzerland)将包含与c-端tap融合体融合的受体的表达载体(stratagene,lajolla,ca)转染到hek293细胞中。在补加有10%小牛血清(scs,hyclonelogan,ut)、2mm谷氨酰胺、盘尼西林(100u/ml)和链霉素(100μg/ml)的完全培养基dmem(mediatechinc.,herndon,va)中以指数生长形式培养细胞。转染两天后,将细胞转移至包含400mg/mlg418的培养基中直至转染后20天,此时对盘中的耐药性集落进行计数检查。通过免疫印迹测定rxrα融合蛋白的表达。在4个150mm板上细胞生长至饱和,随后用或者不用100mm舒林酸处理3小时。处理之后,细胞用50ml冷pbs洗涤两次,并且如interplaytm哺乳动物tap系统(stratagene,lajolla,ca)中所述进行基于链霉亲和素的纯化,其通过首先用提供的链霉亲和素结合缓冲液洗涤链霉亲和素珠来手动进行。然后加入0.1ml份的稀硫酸溶液(ph2),然后加入1.0ml的乙腈。之后使样品在涡流混合器上涡旋30秒后离心(1000g×5分钟)。然后将液体样品转移至另一支管中并在氮气流下蒸干。将残余物重新溶解到0.12ml色谱流动相中,并且将0.1ml份注射到hplc。使用microsorb-mv100-3c18100×4.6柱(varian,paloalto,ca)进行hplc分析。流动相由4%v/v的含水乙酸和乙腈(30∶70)组成,以1.0ml/min的流速泵入。使用光电池检测器(watersmodel2996,waterscorporation,milford,ma)进行舒林酸硫化物的检测,收集在200与450nm之间的谱图。使用舒林酸硫化物的标准溶液以得到校准曲线。特征峰谱和驻留时间被用于鉴定,并且通过使用millenniumchromatographymanager软件(waterscorporation,milford,ma)计算用于定量的4max处的峰面积。示出三个相似实验中的一个。
蛋白水解保护测定
如先前所述(kolluri,s.k.等,procnatlacadsciusa102(7),2525-2530(2005);zhang,x.k.等,nature355(6359),441-446(1992);zhang,x.-k.等,nature.358(6387),587-591(1992)),使用兔网织红细胞裂解产物(promega,fitchburg,wi)通过体外转录-翻译合成rxrαlbd。用溶剂(1%dmso)、舒林酸(100μm)或9-顺式-ra(10-7m)对体外转录的35[s]甲硫氨酸标记的rxrα-lbd进行预孵育30分钟,然后用指示浓度的胰凝乳蛋白酶进行消化。通过page分离消化片段。
瞬时转染测定
如所述(kolluri,s.k.等,procnatlacadsciusa102(7),2525-2530(2005);cao,x.,等,molcellbiol24(22),9705-9725(2004)),使用改良的磷酸钙沉淀方法对接种在24孔板中的细胞(1×105个细胞/孔)进行瞬时转染。
凋亡测定
对于细胞核形态变化分析,对细胞进行胰蛋白酶消化,用pbs洗涤,用3.7%多聚甲醛固定,并用dapi(4,6-二脒基-2-苯基吲哚)(1mg/ml)染色,以通过荧光显微镜对核进行观察(masia,s.等,rapid,nongenomicactionsofretinoicacidonphosphatidylinositol-3-kinasesignalingpathwaymediatedbytheretinoicacidreceptor.molendocrinol21(10),2391-2402(2007);ohashi,e.等,cancerres69(8),3443-3450(2009);balkwill,f.,natrevcancer9(5),361-371(2009))。通过计数至少300个具有核片段化和/或染色质凝聚的gfp阳性细胞来确定凋亡细胞的百分数。为了确定dna片段化,使用细胞死亡检测elisaplus试剂盒(celldeathdetectionelisaplus)(rocheappliedscience,penzberg,bavaria,germany)。示出三个相似实验中的一个。
rxrα和rarγsirna
rxrαsirnasigenomesmarpool(m-003443-02)、rarγsirnasigenomesmarpool(m-003439-01)和sirnanon-specificcontrolix(d-001206-09-05)购买自dharmacon(lafayette,co)。根据制造商建议使用oligofectamine试剂(invitrogen,carlsbad,ca)将20mmsirna以2.5μl等份/孔转染到在12孔板上生长的细胞中。转染两天后,收集细胞用于western印迹。
免疫印迹
为了免疫印迹,将细胞裂解产物在sds样品缓冲液中煮沸,通过sds-聚丙酰胺凝胶电泳分离,并转移到硝化纤维上。转移之后,将膜在包含抗体的tbst(10mmtris-hcl,ph.8.0、150mmnacl、0.05%吐温20)中的5%牛奶中封闭。然后用tbst将膜洗涤三次,然后在室温下在包含辣根过氧化物酶连接的抗免疫球蛋白的tbst中的5%牛奶中孵育1小时。
免疫共沉淀(coip)测定
为了coip测定,将细胞或经指示表达载体转染的细胞悬于裂解缓冲液(50mmtris-hci,ph7.4;150mmnacl;20mmedta;1%np-40;1mmpmsf;50mg/ml亮抑肽酶;20mg/ml抑肽酶;0.1mmna3vo4;和1mmdtt)中。通过与蛋白a/g琼脂糖珠(santacruzbiotechnology,santacruz,ca)孵育清以纯化细胞提取物,然后在4℃与适当抗体和30ml蛋白a或g琼脂糖珠一起孵育过夜。然后洗涤珠子并在laemmli凝胶负载溶液中煮沸后,使用多克隆或单克隆抗体进行sds-page/免疫印迹。使用增强化学发光系统(ecltm)(amershambiosciences,amersham,uk)通过化学发光检测免疫反应产物。
hela-rxrα/1-134稳定克隆和软琼脂测定
将rxrαn-端片段1-134克隆到pntap载体(stratagene,lajolla,ca)中。将所得pntap-rxrα/1-134转染到hela细胞中。转染48小时后,用400ng/mlg418对细胞进行选择2周。捡出单一克隆并通过免疫印迹进行检查。将helarxr/α1-134稳定克隆和经对照pntap载体转染的hela细胞以5×103个细胞/孔(6孔板)接种到补加有10%fbs和0.35%琼脂糖以及0.5%床琼脂的dmem中。在37℃孵育12天之后,用0.005%结晶紫对集落进行染色1小时并计数。
集落形成测定
将helarxr/α1-134稳定克隆和对照hela细胞接种到6孔板中,350个细胞/孔。5天之后,在0.5%血清培养基中用舒林酸(50μm)和k-80003(25μm)处理细胞3天。用pbs洗涤之后,用pbs中的4%多聚甲醛将细胞固定20分钟。用0.1%结晶紫对集落进行染色30分钟,照相并对集落进行计数。
人组织和评价
通过手术切除从癌症患者中得到乳房和肝肿瘤组织及其周围组织。组织学正常的样本(远离肿瘤结节约至少3至5cm)得自于相应患者。该研究由厦门大学生物医学研究伦理委员会认可,并且所有的患者都知情同意。
收集来自患原发性肝细胞癌(hcc,n=6)或乳癌(n=6)患者的组织用于检测rxrα的表达。为了进行免疫印迹测定,单独准备制备肿瘤及其周围组织并在改良的ripa缓冲液中进行裂解。裂解产物在8%sds-page凝胶上进行电泳并转移到pvdf膜上。将膜依次与δn197抗rxrα抗体(1∶1000)在4℃孵育过夜,与辣根过氧化物酶缀合的抗兔igg抗体(1∶5000)在室温下孵育1小时,然后通过增强化学发光(ecltm)(amershambiosciences,amersham,uk)进行检测。通过用于负载对照的单克隆抗gapdh抗体(1∶2000)对条状印迹进行重新探测。为了进行免疫组织化学分析,在4℃将组织部分与δn197抗rxrα抗体(1∶500)一起孵育过夜并在室温下通过山羊抗兔特异性免疫球蛋白(1∶100)检测30分钟。玻片用苏木精进行对比染色。
共聚焦显微镜
将经myc标记的rxrα/δ80和flag标记p85α的转染的细胞接种到室玻片(chamberslide)上过夜。在包含3.7%多聚甲醛的pbs中使细胞固定10分钟并用pbs洗涤两次。然后用pbs中的0.1%tritonx-100对细胞进行透化处理5分钟。室温下将固定的细胞在包含5%bsa的pbs中预孵育30分钟。用多克隆抗myc抗体(1∶500稀释)和抗flag抗体(1∶500稀释),然后用cy3缀合的抗兔igg(1∶1000,sigma-aldrich,st.louis,mo)或fitc标记的抗鼠igg(1∶500,sigma-aldrich,st.louis,mo)对细胞进行染色。原稿中示出的共聚焦显微镜数据表示至少三组相似实验。
亚细胞分级分离
如具有小改良的描述进行亚细胞分级分离(cao,x.,等,molcellbiol24(22),9705-9725(2004);ohashi,e.等,cancerres69(8),3443-3450(2009))。
简言之,使悬于0.5ml低渗缓冲液(250mm蔗糖、20mmhepes-koh、ph7.4,10mmkcl、10mmmgcl2、0.5mmegta、1.5mmedta,ph8.0和1mmdtt)中的细胞(1×107个细胞)与蛋白酶抑制剂混合均匀,并且在800×g下将细胞提取物离心10分钟。将包含细胞核的沉淀重悬于在低渗缓冲液和蛋白酶抑制剂的200μl1.6m蔗糖中并且在相同缓冲液的1ml2.0m蔗糖中短暂保留,然后在4℃以150,000×g离心90分钟以得到细胞核级分。在4℃以10,000×g使上清液离心30分钟以得到胞质级分。将细胞核和细胞质级分重悬于带有蛋白酶抑制剂混合物的100μl裂解缓冲液(10mmtris,ph7.4,150mmnacl,1%tritonx-100,5mmedta,ph8.0)中用于免疫印迹分析。
cox测定
cox荧光活性测定试剂盒(700200)、cox荧光抑制剂筛选测定试剂盒(700100)和前列腺素e2酶免疫测定(eia)试剂盒(514010)得自于caymanchemical(annarbor,mi)。根据制造商方案进行cox-1和cox-2活性测定。
化学合成
在brukerav400光谱仪(bremen,germany)上记录1hnmr和13cnmr谱。在指示溶剂中记录谱1hnmr,并且化学位移相对于内参me4si以百万分之一(δ)为单位表示。在nicoletavatar360ft-ir分光光度计(thermofisherscientific,waltham,ma)上记录ir谱。通过brukerdaltonesquire3000plus(esi直接喷射)(bremen,germany)记录质谱。使用variorl分析器进行元素分析。在x-4微量熔点(micromeltingpoint)设备上测定熔点且不修正。用于本研究的6-氟-1-茚满酮4b可商购。四氢呋喃在使用之前从钠苯甲酮羰游基(sodiumbenzophenoneketyl)蒸馏得到。二氯甲烷从五氧化二磷中蒸馏得到。甲醇从镁屑和碘中蒸馏得到。来自烟台硅胶厂(中国)硅胶(zhifu,300-400目)被用于柱色谱,(除非另有说明)否则用乙酸乙酯/石油醚(pe)(60-90℃)混合物或二氯甲烷/甲醇洗脱。
虽然为了清楚和理解的目的,对本发明进行了一些详细描述,但是本领域技术人员应理解在不偏离本发明真实范围的情况下可以对形式和细节做出多种变化。本文所指的所有图、表、专利、专利申请和公开其整体都通过引用并入本文。
- 还没有人留言评论。精彩留言会获得点赞!