补骨脂酚用于制备感染性心肌损伤药物的应用的制作方法
本发明涉及补骨脂酚在治疗及预防心脏疾病中的应用,特别是涉及补骨脂酚在治疗或者预防细菌性内膜炎,系统性或者其他脏器感染所致菌血症或脓毒血症等导致的心肌炎性病变心肌损伤中的一种或者多种应用。
背景技术:
补骨脂酚是从豆科植物补骨脂果实中提取的单萜烯类化合物,具有广泛的药理活性。研究表明,补骨脂酚具有抗菌活性、抗肿瘤活性、消炎作用、降糖降血脂作用、抗氧化活性、抗抑郁、植物雌激素样作用等。
技术实现要素:
发明人通过败血症细胞模型并观察炎症及心肌损伤各项指标发现,补骨脂酚可浓度依赖性的降低白介素-1(il-1)及肿瘤坏死因子-α(tnf-α)水平,恢复心肌细胞活力,减少心肌凋亡率,发挥显著地抗炎和抗心肌凋亡作用;通过败血症动物模型,证实补骨脂酚可浓度依赖性地降低小鼠血清中il-1、tnf-α、乳酸脱氢酶1(ldh1)和肌酸激酶同工酶(ck-mb)水平,提高左室射血分数(lvef%)和左室短轴缩短率(lvfs%)值,减少心肌组织破坏与炎细胞浸润,减少心肌凋亡率,发挥较强的抗炎,抗心肌坏死及凋亡,改善心脏收缩功能的作用。研究表明,补骨脂酚较强的抗炎,抗心肌坏死及凋亡,改善心脏收缩功能的作用,有着很好的临床应用前景。
本发明提供了补骨脂酚用于制备感染性心肌损伤药物或保护剂的应用。
本发明的药物或保护剂为静脉注射给药制剂。
本发明的药物或保护剂给药剂量为每千克体重25mg-100mg。
本发明的优点:
1、补骨脂酚可以抑制炎症引起的心肌细胞凋亡,具有抗炎抗凋亡作用。
2、补骨脂酚可以抑制炎症引起的心肌损伤,提高心功能,改善心脏收缩功能。
3、补骨脂酚能够激活sirt1信号通路,降低内质网应激反应,较少心肌细胞凋亡,保护心肌细胞。
附图说明
图1为不同浓度bak对lps心肌细胞损伤模型炎症因子及细胞活力的影响。(a)不同浓度的bak处理脓毒血症细胞模型后培养基中的il-1和tnf-α浓度;(b)不同浓度的bak处理脓毒血症细胞模型后的细胞活性,od值即吸光度值。结果以均数±标准差表示,n=6。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01,bbbp<0.001;与bak1μm+lps组比较cp<0.05,ccp<0.01,cccp<0.001;与bak5μm+lps组比较dp<0.05,ddp<0.01。
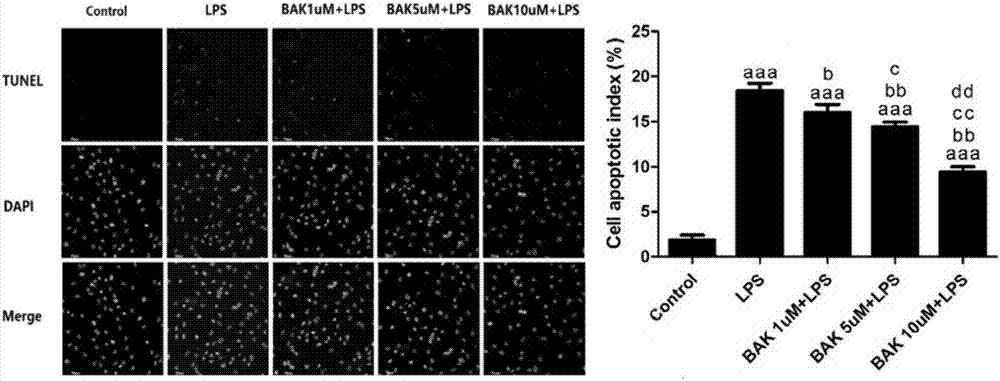
图2为不同浓度bak对lps心肌细胞损伤模型细胞凋亡的影响。结果以均数±标准差表示,n=6。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01,bbbp<0.001;与bak1μm+lps组比较cp<0.05,ccp<0.01,cccp<0.001;与bak5μm+lps组比较dp<0.05,ddp<0.01。
图3为不同浓度bak处理后小鼠心功能。(a)不同浓度bak处理后小鼠超声心动图。(b)不同浓度bak处理后小鼠左心室lvef%和lvfs%。结果以均数±标准差表示,n=20。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01,bbbp<0.001;与bak25mg/kg+lps组比较cp<0.05,ccp<0.01;与bak50mg/kg+lps组比较dp<0.05。
图4为不同浓度bak处理后小鼠血清炎症因子水平及ldh-1、ck-mb水平。(a)小鼠血清tnf-α水平(b)小鼠血清il-1水平(c)小鼠血清ldh-1水平(d)小鼠血清ck-mb。结果以均数±标准差表示,n=20。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01,bbbp<0.001;与bak25mg/kg+lps组比较cp<0.05,ccp<0.01;与bak50mg/kg+lps组比较dp<0.05,ddp<0.05。
图5为不同浓度bak处理后小鼠心肌he染色及视野内细胞核数,放大倍数200×。结果以均数±标准差表示,n=5。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01;与bak25mg/kg+lps组比较cp<0.05,ccp<0.01;与bak50mg/kg+lps组比较dp<0.05,ddp<0.05。
图6为不同浓度bak处理后小鼠心肌凋亡水平检测,放大倍数400×。结果以均数±标准差表示,n=5。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01;与bak25mg/kg+lps组比较cp<0.05,ccp<0.01;与bak50mg/kg+lps组比较dp<0.05,ddp<0.05。
图7为不同浓度bak处理后小鼠sirt1通路,ers及凋亡相关蛋白表达情况。所有数据表示为control组的倍数变化,结果以均数±标准差表示,n=6。与control组比较ap<0.05,aap<0.01,aaap<0.001;与lps组比较bp<0.05,bbp<0.01,bbbp<0.001;与bak25mg/kg+lps组比较cp<0.05,ccp<0.01,cccp<0.01;与bak50mg/kg+lps组比较dp<0.05,ddp<0.05。
具体实施方式
本发明所述的感染性心肌损伤,特别是①细菌性心内膜炎;②系统性或者其他脏器感染所致菌血症导致的心肌炎性病变;③系统性或者其他脏器感染所致脓毒血症导致的心肌炎性病变。
以下通过实施例对本发明做进一步的阐述。实施例是对本发明进行详细说明,但本发明并不受这些的任何限定。
以下实验所用的补骨脂酚购自大连美仑生物技术有限公司,纯度为hplc≥98%。
实施例1:发明人研究发现补骨脂酚能够减轻lps诱导的心肌原代细胞炎症反应,减少细胞凋亡。
方案:
采用lps处理心肌原代细胞,在细胞水平模拟细菌性心肌炎导致心肌损伤的模型,给予不同浓度补骨脂酚进行处理。
步骤:
1)大鼠心肌原代细胞分离与培养:无菌条件下取sd大鼠乳鼠心室部分,pbs漂洗后剪成0.5mm2的小块,加入ii型胶原酶消化,收集细胞,离心。将所得细胞置于含10%胎牛血清的dmem培养基中,于37℃、5%co2培养箱中贴壁60-90min,差速贴壁去除贴壁的心肌成纤维细胞,将培养基转移至明胶处理过的培养板培养,前3天加入brdu抑制成纤维细胞生长,获得心肌细胞。倒置显微镜下观察,可见到视野中细胞产生有节律自主收缩,随机选取5个视野进行计数,可自主收缩细胞占总细胞数95%以上即可视为得到较纯的原代心肌细胞。
2)细胞模型构建及给药:所得心肌原代细胞提前12h各组使用等体积无血清dmem/f12培养基换液,无菌生理盐水溶解lps制成20ug/ml母液,按照100ng/ml的终浓度进行给药,共处理12h。给予补骨脂酚组,按照1um、5um、10um浓度给予预处理4h。预处理完成后,吸弃培养基,加入与lps组等lps浓度等体积培养基。12h后共同进行取材及检测。
3)cck-8法检测细胞活性:差速贴壁完成的心肌细胞悬液接种于96孔板,控制每孔细胞数为10000-12000个之间,48h后观察并换液;各组处理后,小心吸弃各孔上清液,37℃pbs洗涤2遍;避光条件下,按照10:1比例配置dmem/f12与cck-8试剂混合液,每孔加入110ul混合液;37℃/5%co2细胞孵箱培养2h后,使用酶标仪检测各孔在450nm处吸光度;各组od值与细胞活力呈正比。
4)elisa法检测细胞培养基il-1和tnf-α水平:收集各组细胞培养基,于4℃离心机中以12000rpm离心15分钟,以除去细胞碎片等杂质,小心吸取上清;按照elisa试剂盒说明书要求,配置各工作液,分别设置空白孔、标准品对照孔及待测样品孔,每孔均设两个副孔;按照说明依次将100ul不同浓度标准品及待测培养基加入孔内,空白孔加入等体积标准品稀释液;37℃水浴90分钟;轻轻甩干孔内液体,每孔加入100ul生物素化抗体工作液,覆盖新的酶标版膜,37℃孵育60分钟;甩去孔内液体并在吸水纸上用力拍干;拍干后,每孔加入100ul酶结合工作液,覆盖酶标版膜,37℃孵育30分钟;吸弃孔内液体,甩干后,每孔使用350ul洗涤液洗板6次x2分钟,甩去孔内液体并在吸水纸上用力拍干;每孔加入100ultmb发光底物工作液加入终止液结束反应;用酶标仪检测酶标版各孔在450nm出的吸光;根据标准品浓度梯度及各自的吸光度值计算机拟合标准曲线,计算各待测样品的相应浓度。
5)tunel检测细胞凋亡:差速贴壁心肌细胞悬液,接种于激光共聚焦显微镜专用皿,48h后构建细胞模型,并按照各组方案进行给药处理;处理完成后,弃去培养基,将皿置于水平摇床上,pbs缓冲液洗涤,60rpm,5分钟;吸弃pbs,使用4%多聚甲醛固定细胞,30-60分钟;pbs缓冲液洗涤一次,60rpm,5分钟;加入0.1%tritonx-100溶液进行细胞打孔,置于冰上5分钟;按照试剂盒说明书配置tunel反应液,1号液与2号液配置比例为1:9,每皿加入200ul,37℃避光孵育2小时。后续步骤都应处于避光条件;染色完毕,使用pbs缓冲液在水平摇床上洗涤三遍,90rpm,5分钟;吸弃pbs,使用dapi染料染核,每皿加入200ul,室温孵育15分钟;染色完毕,使用pbs缓冲液在水平摇床上洗涤三遍,90rpm,5分钟;立即使用激光共聚焦显微镜高倍镜下观察荧光,随机选取5个视野计数凋亡细胞核数,计算心肌细胞凋亡率。
结果:
各组细胞培养基中il-1及tnf-α含量如图1a所示,给予bak预处理后,可观察到培养液中il-1、tnf-α含量降低(与lps组相比,p<0.05),提示大鼠心室肌原代细胞炎症反应减轻。同时可以观察到,培养液中il-1、tnf-α含量降低幅度随着bak给药浓度升高而增大,提示在10um的给药剂量内,bak抗炎作用与药物剂量呈正相关(p<0.05)。
细胞活力检测如图1b所示给予bak预处理后,细胞活力明显有所恢复(与lps组相比,p<0.05),随着bak给药剂量增加,呈现出浓度依赖性的心肌活力恢复趋势(p<0.05),但仍低于control组(p<0.05)。
细胞凋亡tunel染色结果如图2所示,给予bak预处理后,细胞凋亡比例明显降低(与lps组相比,p<0.05),各给药组组凋亡率均低于control组(p<0.05)。凋亡的降低幅度亦与bak给药剂量正相关(p<0.05),提示bak在10um剂量内表现出浓度依赖性的抗心肌凋亡功能。
实施例2:发明人研究发现补骨脂酚可以减轻lps诱导的小鼠心肌炎症,提高心功能,减少心肌细胞凋亡。
方案:
采用注射lps建立小鼠心肌损伤模型,在动物水平模拟细菌性心肌炎导致心肌损伤的模型,给予不同浓度补骨脂酚进行处理。
步骤:
1)动物模型建立:12周健康雄性c57bl/6小鼠,按照10mg/kg体重进行腹腔注射lps,6小时候行超声检测。对于需要给予补骨脂酚组,于lps给药前5天按照25mg/kg、50mg/kg、75mg/kg、100mg/kg剂量每日给予补骨脂酚腹腔注射,最后一次给药为lps注射前40分钟。使用vevo高分辨率小动物超声影像系统检测小鼠心功能,使用系统自带分析软件计算小鼠lvef%值和lvfs%值。
2)组织蛋白提取:取左心室组织,加入0.5ml预冷的pbs缓冲液;剪碎组织块至1mm3大小,吸弃大部分上清,再加入1mlpbs缓冲液洗涤一遍,4℃,3000rpm离心3min;吸弃上清,加入2400ul强效裂解液、300ul磷酸酶抑制剂和300ul蛋白酶抑制剂,使用组织研磨器插入各ep管研磨组织,后于冰上静置裂解20分钟;4℃,12000rpm离心20分钟蛋白定量。
3)心肌组织he染色:心尖部缓慢注入含肝素生理盐水,右心耳流出的液体变为透明时,将灌注液体替换为4%多聚甲醛固定液;多聚甲醛组织固定成功后,沿心脏根部剪断各血管,完整取下心脏。将心脏放入4%多聚甲醛中,进行后固定至少24小时;石蜡包埋、切片与脱蜡(按照顺序依次在30%、50%、70%、80%、95%、95%、100%乙醇中浸泡40分钟,再按照100%乙醇、100%乙醇/二甲苯1:1混合液、二甲苯浓度梯度浸泡30分钟进行组织脱水透明;按照二甲苯/软蜡1:130分钟、软蜡55分钟、硬蜡50分钟顺序进行组织透蜡包埋;切片,设置切片厚度为5um,使用捞片法将切片贴于多聚赖氨酸覆膜载玻片上,70℃烤片1h后,60℃烤片5h;将切片置于二甲苯中浸泡10分钟,更换二甲苯再次浸泡10分钟,按照100%、100%、95%、95%、80%、70%、50%、30%乙醇、去离子水的顺序依次浸泡2分钟脱蜡至水,以备染色。);心肌组织he染色(将切片浸入苏木素染液染色2分钟30秒,使用自来水轻柔冲洗3分钟;浸入1%盐酸乙醇30秒,1%氨水10秒脱色,使用自来水轻柔冲洗6分钟;浸入伊红染液染色1分钟,使用自来水轻柔冲洗6分钟;按照70%、80%、95%、95%、95%、100%、100%浓度梯度乙醇、二甲苯、二甲苯分别浸泡2分钟进行脱水透明处理;中性树胶封片。)
4)心肌组织tunel染色:将已脱蜡至水切片用pbs缓冲液洗涤3次,60rpm,每次5分钟;甩去pbs缓冲液,使用0.1%triton-100溶液打孔,时间10分钟;使用pbs缓冲液洗涤打孔完毕的组织切片3次,60rpm,每次5分钟;配置tnuel染液,每片滴加50ul,37℃水浴2h染色;染色完毕,pbs缓冲液洗涤3次,60rpm,每次10分钟;滴加50uldapi染液复染细胞核,37℃水浴10分钟;染色完毕,pbs缓冲液洗涤3次,60rpm,每次10分钟;使用50%甘油封片,放置于4℃环境中过夜。次日激光共聚焦显微镜下观察荧光,蓝色为细胞核,绿色两点为凋亡细胞染色,随机选取5个视野计数凋亡细胞核数,计算心肌细胞凋亡率。
5)细胞因子检测:炎症因子il-1和tnf-α水平采用前述elisa方法检测,ldh1及ck-mb水平使用全自动生化分析仪检测。
结果:
小鼠的左心室收缩功能,如图3所示。给予腹腔注射bak预处理后,bak25mg/kg+lps组、bak50mg/kg+lps组、bak75mg/kg+lps组、bak100mg/kg+lps组均表现出心脏收缩功能的好转,左心室lvef%、lvfs%值明显回升(与lps组相比,p<0.05),提示bak可以一定程度恢复左心收缩功能。在bak浓度25mg/kg、50mg/kg、75mg/kg三个剂量上,lvef%、lvfs%值呈现出梯度升高的趋势(p<0.05),但均低于control组(p<0.05),在bak浓度75mg/kg及100mg/kg之间并无显著性差异(p>0.05)。
小鼠血清炎性因子水平如图4a&b所示,给予bak干预组可以观察到血清炎症因子水平明显降低(p<0.05)。在bak浓度25mg/kg、50mg/kg、75mg/kg三组间呈现剂量正依赖性降低(p<0.05)但仍高于control组(p<0.05),同样的,bak75mg/kg与bak100mg/kg组间血清炎性因子并无明显差异。
小鼠血清心肌损伤指标ldh1、ck-mb水平4c&d,给予bak干预组,血清心肌坏死标志物ldh1与ck-mb出现明显下降(与lps组比,p<0.05),甚至在bak75mg/kg与bak100mg/kg浓度下接近control组小鼠的生理水平(p<0.05)。且在bak浓度25mg/kg、50mg/kg、75mg/kg三组间呈现剂量正相关,bak75mg/kg与bak100mg/kg组间各指标数值相近,并无明显差异。
小鼠心肌组织he染色结果显示(图5),给予bak后he染色可见心肌组织结构相对清晰,视野内细胞核数量减少(与lps组相比,p<0.05),肌细胞间微血管单核细胞浸润减少。单就视野内细胞核数量而言,bak25mg/kg与50mg/kg之间、bak75mg/kg与100mg/kg之间并无明显差异(p>0.05)。但是bak25mg/kg、50mg/kg两组视野内细胞核数量仍显著高于bak75mg/kg、100mg/kg两组(p<0.05)。
小鼠心肌凋亡tunel染色(图6)显示,在bak预处理组可观察到,在bak75mg/kg浓度以内,随着给药剂量增加,心肌细胞凋亡率呈现梯度性的降低(p<0.05),但仍高于control组(p<0.05)。而在bak100mg/kg浓度时,心肌凋亡率并未呈现出继续下降的趋势(与bak75mg/kg+lps组比,p>0.05)。
实施例3:发明人研究发现补骨脂酚能够激活经典心肌保护通路:sirt1信号通路,降低内质网应激(ers),减少心肌细胞凋亡。
方案:
采用注射lps建立小鼠心肌损伤模型,在动物水平模拟细菌性心肌炎导致心肌损伤的模型,给予不同浓度补骨脂酚进行处理,对心肌保护通路进行检测。
步骤:
动物模型建立及给药见前述步骤。剥离心耳与右心室,只保留左心室,进行组织蛋白提取。western检测sirt1信号通路和ers及凋亡相关蛋白表达。
结果:
图7所示lps组与control组相比,sirt1表达下调(p<0.001),其下游ac-foxo1上调(p<0.001)。ers通路perk/eif2α磷酸化增加(均p<0.001),其下游atf4/chop均被激活(atf4水平,p<0.001;chop水平,p<0.01)促凋亡蛋白bax上调(p<0.001);抗凋亡蛋白bcl-2下调(p<0.001)。给予补骨脂酚处理后,sirt1表达有所上调(与lps组比,bak25mg/kg+lps组p<0.05,余组p<0.01),但低于control组(bak25mg/kg+lps组p<0.001,bak50mg/kg+lps组p<0.01,余组p<0.05);其下游ac-foxo1下调(与lps组比,bak25mg/kg+lps组及bak50mg/kg+lps组p<0.05,余组p<0.01),高于control组(与lps组比,bak25mg/kg+lps组及bak50mg/kg+lps组p<0.01,余组p<0.05);ers通路perk磷酸化水平降低(与lps组比,bak25mg/kg+lps组及bak50mg/kg+lps组p<0.05,余给药组p<0.01),eif2α磷酸化水平降低(与lps组比,bak25mg/kg+lps组及bak50mg/kg+lps组p<0.05,bak100mg/kg+lps组组p<0.01,bak75mg/kg+lps组p<0.001),atf4水平下调(与lps组比,bak25mg/kg+lps组p<0.05,余给药组p<0.01),chop只在bak50mg/kg+lps组(p<0.05)、bak75mg/kg及bak100mg/kg组(p<0.01)有显著升高。促凋亡蛋白bax下调(与lps组比,bak25mg/kg+lps组及bak50mg/kg+lps组p<0.05,余给药组p<0.01),抗凋亡蛋白bcl-2上调(与lps组比,bak25mg/kg+lps组(p<0.05),bak50mg/kg+lps组p<0.01,余给药组p<0.001),bcl-2在bak100mg/kg剂量与75mg/kg剂量组表达量高于control组(p<0.05)。上述蛋白变化趋势在75mg/kg剂量之内呈现出剂量依赖性(相邻组间相比p<0.05,p<0.01或p<0.001),在100mg/kg剂量与75mg/kg剂量之间上述蛋白变化均无明显差异(p>0.05)。补骨脂酚可以通过恢复sirt1水平来调节炎症,减轻内质网应激,减少细胞凋亡,发挥心肌保护作用。
- 还没有人留言评论。精彩留言会获得点赞!