肺炎链球菌多糖-蛋白质缀合物及其制取方法和用途与流程
本发明涉及一种共价缀合物,尤其涉及一种多糖和蛋白质通过共价结合而得的缀合物,以及制取该种缀合物的方法,和在肺炎链球菌疫苗制取中的应用。
背景技术:
肺炎链球菌(Streptococcus pneumoniae)是链球菌属下的一种球状的革兰氏阳性菌,具有d溶血性。由肺炎链球菌引致的肺炎是在年幼或年长的人中最经常出现。肺炎链球菌也是一种普遍导致成人感染细菌性脑膜炎的病菌。此外,肺炎链球菌亦会导致不同种类的疾病,如:急性鼻窦炎、中耳炎、骨髓炎、脓毒性关节炎、心内膜炎、腹膜炎、心囊炎和蜂窝组织炎等。
治疗由肺炎链球菌疾病大多会使用B内酰胺类抗生素。早期,差不多所有肺炎链球菌的菌株都对青霉素敏感,随着抗生素使用率的提高,病菌对抗生素的抵抗亦发生上升的趋势。
自2000年起,一种七价的肺炎链球菌结合疫苗在美国被建议使用,主要适合2个月~23个月大的婴儿或2岁~5岁的孩童,可以保护孩童免受肺炎链球菌的深层感染,如:败血病及脑膜炎。
肺炎链球菌在人和动物体内可产生荚膜。根据荚膜内多糖抗原性的不同已将肺炎球菌分为91个血清型。
中国发明专利申请200680017776.8公开了一种多价肺炎球菌多糖-蛋白质缀合物组合物,其包含13种不同的多糖-蛋白质缀合物,以及生理学上可接受的载体,其中每种缀合物包含缀合到载体蛋白的来自不同血清型的肺炎链球菌的夹膜多糖,并且所述夹膜多糖从血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F制备,其中所述载体蛋白是CRM197。
肺炎链球菌荚膜多糖的相对分子质量较大,通常在1,000KD~3,000KD。对于含有多糖的免疫原性物质,多糖的相对分子质量的数值是保证抗原性的一个重要指标。相对分子质量越大,抗原性越强,相对分子质量的降低可能伴随着抗原性的损失。但对于多糖-蛋白质的缀合物,巨大的多糖分子在与蛋白质载体结合的过程中存在很多技术问题,诸如:多糖的溶解度过低、多糖溶液的粘度过高、结合反应过程中容易产生交联形成凝胶,以及结合物复杂和纯化困难等,由此导致缀合物中反应剂的残留量较大,游离多糖含量较高,反应收率较低,并且缀合物的最佳免疫原性与结合物中多糖片段的分子大小有密切关系。
技术实现要素:
本发明的一个目的在于提供一种具有免疫原性的多糖-蛋白质缀合物,便于缀合物的制取和分离,免疫原性亦得到保留。
本发明的另一个目的在于提供一种制取具有免疫原性的多糖-蛋白质缀合物的方法,优化荚膜多糖与载体蛋白的结合工艺,提高结合效率和缀合物收获率,提高缀合物原液的稳定性和免疫原性,便于后续的纯化和应用。
本发明的再一个目的在于提供一种具有免疫原性的多糖-蛋白质缀合物在制备肺炎链球菌结合疫苗中的应用。
一种具有免疫原性的多糖-蛋白质缀合物,由来自于肺炎链球菌(血清型如:1、2、3、4、5、6A、6B、7F、8、9N、9V、10A、11A、12F、14、15B、16F、17F、18C、19A、19F、20、20F、23A、23F和33F)的荚膜多糖,荚膜多糖的分子量为150,000Da~400,000Da(尤其是200,000Da~300,000Da)与蛋白质组成的缀合物。
另一种具有免疫原性的多糖-蛋白质缀合物,由来自于18C血清型肺炎链球菌荚膜多糖的分子量为150,000Da~400,000Da与CRM197蛋白质组成的缀合物。
另一种具有免疫原性的多糖-蛋白质缀合物,由来自于18C血清型肺炎链球菌荚膜多糖的分子量为200,000Da~300,000Da与CRM197蛋白质组成的缀合物。
一种制取具有免疫原性的多糖-蛋白质缀合物的方法,先采用物理剪切将肺炎链球菌荚膜多糖进行降解,再超滤富集,获得降解的荚膜多糖,再通过激活剂对降解的荚膜多糖进行活化,调整pH值,再将活化的降解的荚膜多糖与CRM197蛋白相混合,于室温,使降解的荚膜多糖与CRM197蛋白相互作用30分钟~60分钟后加入终止剂,反应体系在低温(如:2℃~8℃)下过夜(如:16小时~24小时)后,用澄清滤器过滤、超滤膜浓缩透析,从而获得肺炎球菌多糖与蛋白缀合物单价原液。
物理剪切方法如:乳化和均质(如:高压均质)。在物理剪切作用下,溶液中的大分子在强烈的剪切、撞击和空穴作用下被粉碎断链,从而导致其降解,但其结构单元基本不变。
均质的作用在于均匀分散同一体系内的不同成分,打散或细化液体中的不溶相颗粒,形成稳定均一的溶液。
物料在柱塞的推动作用下进入均质阀,在均质阀内被加压并排放。在此过程中,物料受到多种作用:气穴作用,强烈湍流的高频振动作用,与均质阀边缘的剪切作用,与均质阀挡环的撞击作用。
均质可分为:珠磨法(属于固体剪切作用,可达较高破碎率,可较大规模操作,大分子目的产物易失活,浆液分离困难)、高压均质法(属于液体剪切作用,可达较高破碎率,可大规模操作,对于少量物料<100ml,难操作)、超声破碎法(属于液体剪切作用,对酵母菌效果较差,破碎过程升温剧烈,不适合大规模操作),以及X-press法(属于固体剪切作用,破碎率高,活性保留率高,对冷冻敏感目的产物不适合)。
激活剂如:1-氰基-4-二甲氨基-吡啶四氟硼酸、溴化氰和高碘酸钠等。这些化合物单独和组合应用于本发明。用量为多糖(即降解的荚膜多糖)重量的50w/w%~100w/w%,如:但不仅限于50w/w%、55w/w%、60w/w%、65w/w%、70w/w%、75w/w%、80w/w%、85w/w%、90w/w%、95w/w%和100w/w%等,尤其是65w/w%~80w/w%。
荚膜多糖与CRM197蛋白相互作用的pH为8.90~9.60,温度为室温,时间为3分钟~5分钟。
经验证,所制取的多糖-蛋白质缀合物具有免疫原性,再加入赋形剂和助剂制成用于肺炎链球菌防治的疫苗的。
本发明技术方案实现的有益效果:
本发明采用物理降解法对纯化的荚膜多糖进行降解,具有操作简单、降解高效和可控性好的特点。经剪切的多糖相对分子质量分布集中,可以线性放大,适合大规模生产。
本发明采用物理降解法对纯化的荚膜多糖进行降解,使得参与共价结合的多糖反应物溶解度增加,溶液粘度降低,避免了反应中凝胶现象的发生,利于反应的进行,便于对多糖-蛋白质缀合物进行纯化。
附图说明
图1为本发明降解后多糖-蛋白缀合物的ELISA检测结果;
图2为本发明未降解的18C多糖-蛋白缀合物的ELISA检测结果。
具体实施方式
以下结合附图详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
实施例1
本实施例通过对比对照用标准品和供试品对1种以上血清型的肺炎球菌荚膜多糖进行定性,比如:表1列出了若干种血清型荚膜多糖的鉴别参考信息,通过核磁共振氢谱特征区域确认,对得到的图谱进行积分,并按比对对照标准品和供试品以定性。
使用的试剂:1)重水:sigma重水,纯度99%;2)标准多糖:购自丹麦血清研究所(SSI)。
测定法:取待测血清型的标准多糖5mg,加入重水1ml,复溶后充分混匀,冻干过夜。重新加入1ml重水复溶后充分混匀,即得5mg/ml标准多糖溶液。量取样品600μl于核磁管中置600M核磁共振测定。另取供试品,同法测定。
表1
实施例2
选择中国流行性最高的血清型18C肺炎球菌,通过物理剪切18C荚膜多糖,得到降解的荚膜多糖。
本实施例使用ATS均质机,具有破碎效率高、处理量大、瞬间破碎,物料停留时间少于1秒,以及在位冷却(保证出料温度低于10度)等特点。
经Sephacry1S-300(XK-50)柱分离纯化,分段收集,得到分子量区间为200,000Da~300,000Da的若干多糖链。利用高压液相技术测定分子量,从而对大分子多糖的物理剪切工艺进行优化。
实施例3
通过1-氰基-4-二甲氨基-吡啶四氟硼酸(CDAP)作为多糖活化剂,活化纯化的荚膜多糖(未降解)和经物理剪切降解的荚膜多糖,并与CRM197进行偶联结合(参见FEBS Letters,1983,154,209~210),制得多糖-CRM197蛋白缀合物。
具体方法为:未降解的18C荚膜多糖和降解后的荚膜多糖溶液(5mg/ml~10mg/ml)与CDAP溶液(CDAP用量为多糖总量的50w/w%~100w/w%)混合,用调整pH至8.90~9.60,室温激活1分钟~5分钟。然后加入CRM197蛋白,室温作用30分钟~60分钟;再加入过量甘氨酸终止反应体系,室温30分钟。最后将反应物置于2℃~8℃反应16小时~24小时。
中间取样检测KD值(表征多糖与蛋白结合率的常数),待反应结束后将反应缀合物进行澄清、浓缩及超滤透析,以去除游离蛋白和反应试剂。
对于未降解的18C荚膜多糖和降解后的荚膜多糖,其与蛋白质结合比率参见表2。
分析缀合物中糖/蛋白的比率(0.3~3.0)、结合反应产率(大于20%)及抗原性(详见一下实施例4和5)。
表2
表2中的数据,采用HPLC检测缀合物的KD值,利用蒽酮法检测原液中的总多糖含量和游离多糖含量,Lowry法检测原液中总蛋白含量,以及HPLC测定游离蛋白含量及残留试剂等。
实施例4
ELISA法检测不同大小的多糖片段对18C型肺炎链球菌多糖蛋白缀合物免疫原性的影响,试验方法如下:
(1)标准多糖涂布ELISA板,每孔100μl,置于4℃包被过夜。(2)包被结束后,取出ELISA板,弃去包被液,PBST洗板3次,加入150μl封闭液封闭,37℃温育60min。(3)封闭结束后,取出ELISA板,弃去封闭液。(4)加入免疫血清,每孔100μl,37℃温育90min。(5)洗板,方法同步骤(3)。(6)加入羊抗鼠HRP-IgG,每孔100μl,37℃温育1h。(7)洗板,方法同步骤(3)。(8)加入TMB,每孔100μl,暗处放置4.5min。(9)加入终止液中止反应。(10)在450nm~620nm进行酶标读数。
试验结果参见表3及其相应的图1。
表3降解后多糖-蛋白缀合物的ELISA检测结果
实施例5
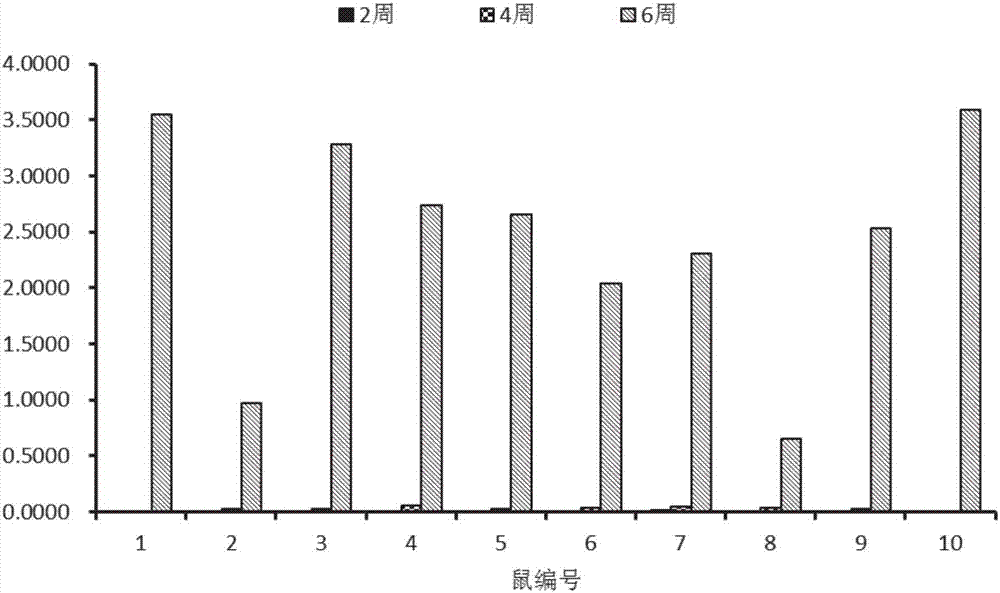
纯化的多糖蛋白缀合物免疫实验鼠,并进行取样,实验过程如下:
18C多糖-CRM缀合物原液分别在第0周、2周和4周进行腹腔注射NIH小鼠(雌性:10g~12g,30只),每次每只注射剂量0.5ml(约2.2μg缀合物),分别于第2周、4周和6周各取10只小鼠,眼球采血,离心分离血清,不高于-20℃保存。
试验结果参见表4其相应的图2。
表4未降解的18C多糖-蛋白缀合物的ELISA检测结果
通过实施例4和实施例5所得数据(表3和表4,以及相应的图1和图2)可见,每次免疫后样品抗体显著增加,到第6周抗体滴度提高最为明显。
- 还没有人留言评论。精彩留言会获得点赞!