泛素蛋白酶USP7在衰老及相关疾病方面的医药用途的制作方法
本发明属于生物技术,涉及泛素蛋白酶USP7蛋白表达的医药用途,具体涉及泛素蛋白酶USP7在衰老及相关疾病方面的医药用途,通过调节底物蛋白TPP1稳态在制备防治衰老相关疾病药物中的用途。
背景技术:
衰老相关的慢性疾病如肺纤维化、皮肤纤维损伤,是因为端粒DNA损伤、进而细胞衰老引起。染色体端粒损伤逐渐缩短是导致细胞衰老的公认机制。应激、如射线照射、抗生素等化学物质引起的DNA断裂、以及氧化应激,加速端粒损伤缩短,引起过早衰老,但几十年来、应激是如何引起端粒损伤缩短进而导致过早衰老及相关疾病的机制还不清楚。作为过早衰老相关的疾病,特发性肺纤维化的病因、先天性皮肤角化不良综合症的病因也都不清楚,临床上无治疗药物。
辐照应激,氧化应激和DNA损伤药物博来霉素已被证明引起肺纤维化,引起端粒缩短,但具体机制未知。有趣的是,不同应激可激活E3泛素连接酶FBW7降解底物蛋白包括c-myc, n-myc,Notch,cyclin E,c-Jun,Aurora-A和mTOR等癌蛋白。调控FBW7介导的泛素化及蛋白降解包括泛素化酶USP14、USP22及USP36。
USP7基因表达和蛋白质序列对不同组织具有重要调控作用,包括上皮组织和神经组织。 USP7与其它泛素蛋白酶结构类似,具有木瓜蛋白酶(Papain)样的半胱氨酸蛋白酶催化结构域,也称(Herpes virus-associated USP or HAUSP)(表1:SEQ.No.1-2)。但是,USP7 在调节p53通路中发挥重要作用,包括抑癌基因蛋白p53、PTEN、FOXO、claspin,E3泛素连接酶MDM2、Mule和表观遗传调节因子DNMT1、Tip60、UHRF1。然而,USP7是否还有其它机制调控肿瘤细胞的发生和发展还不清楚。USP7具有多个结构域,最近研究报道了抑制USP7的小分子化合物,然而USP7常以自身抑制(autoinhibition)状态存在,激活USP7的机制也还不清楚。
端粒结合蛋白TPP1(表2:SEQ.No.1-2)是覆盖端粒DNA蛋白复合体shelterin的一个重要组分。TPP1降解将可能导致端粒损伤、端粒缩短,引起细胞衰老。编码TPP1的ACD基因突变参与衰老相关疾病如先天性角化不良和骨髓衰竭。端粒损伤,包括端粒缩短、端粒功能异常,引起端粒损伤反应,参与衰老过程,加速衰老,是衰老相关疾病的重要致病前体。已经报道的与端粒异常密切相关的衰老相关疾病包括慢性阻塞性肺病如肺纤维化等纤维组织增生性疾病,肝纤维化,骨髓干细胞减少、贫血及免疫功能低下,胸腺纤维化,免疫功能低下,卵巢纤维化,卵巢早衰,骨关节纤维化,骨质疏松,血管纤维化动脉硬化,心脏疾病,肾纤维化,神经退行性损伤和疾病,糖尿病,皮肤老化如角化不良,肿瘤等(Science,350: 1193-8,2015;Clin Sci(Lond).120(10):427-40,2011)。例如,肺衰老是肺纤维化的重要前体,作为高致死率的特发性肺纤维化,TPP1含量降低,端粒损伤缩短,肺泡上皮干细胞复制、增殖和分化障碍。
技术实现要素:
本发明的目的是提供泛素蛋白酶USP7在制备防治衰老相关疾病药物中的应用,所述泛素蛋白酶USP7的氨基酸序列如SEQ.No.2所示。
所述的抑制端粒损伤包括端粒脱落,端粒“脱帽”,端粒缩短,端粒DNA重组,端粒构象变化,端粒功能异常,端粒DNA损伤反应。
所述延缓衰老的状态包括上皮组织衰老如肺上皮、肝上皮、皮肤老化等,骨髓组织衰老如骨髓干细胞、造血干细胞和免疫干细胞的衰老,器官和机体衰老如过早死亡。如气管应用 USP7基因表达慢病毒提高肺功能、防止肺组织衰老。
所述防治衰老相关疾病包括慢性阻塞性肺病和因端粒损伤或缩短引起的包括肺纤维化,心肌纤维化,肝纤维化如肝硬化,肾纤维化,骨髓纤维化,骨髓干细胞减少、贫血及免疫功能低下,胸腺纤维化,免疫功能低下,卵巢纤维化,卵巢早衰,骨关节纤维化,骨质疏松,血管纤维化动脉硬化,心脏疾病,神经退行性损伤,糖尿病,皮肤老化如皮肤皱纹、角化不良、毛发再生障碍及白发,肿瘤。如气管应用USP7基因表达慢病毒防治肺纤维化。
本发明通过保护端粒蛋白底物TPP1稳态在制备防治衰老相关疾病。具有从表达激活 USP7、或沉默USP7表达入手,系统研究并发现了USP7具有防止上皮细胞衰老、包括肺上皮,预防肺纤维化的发生。在培养肿瘤的细胞或经气管通过注入慢病毒过量表达USP7,防止应激反应如放射性辐射或博来霉素引起的端粒DNA损伤,保护TPP1免于降解,防治了应激引起的上皮组织如肺衰老,防治了应激引起的肺纤维化。相反,抑制USP7的表达则引起端粒DNA损伤,端粒缩短和细胞衰老,引发肺纤维化,增加环境因素引起肺纤维化的超敏感性。抑制USP7的表达通过引起端粒损伤反应,抑制肿瘤细胞的发生发展。USP7特异性结合 TPP1,保护其免受泛素化降解,发挥保护端粒DNA的作用。
本发明抑制USP7表达或激活USP7酶活性(SEQ.No.1-2),防止端粒蛋白降解、端粒损伤,尤其是在环境应激状态下如放射损伤或氧化应激引起的端粒蛋白降解,防止压力或应激缺氧状态下引起端粒损伤缩短、组织器官机体衰老及其相关疾病。抑制USP7表达或酶活性 (SEQ.No.1-2),防止USP7对端粒蛋白及端粒的保护作用,引起端粒缩短和损伤反应,从而引起肿瘤细胞增殖、生长抑制及衰老死亡。可在制备防治端粒功能异常药物中的应用,可抑制肿瘤发生发展、生长浸润和转移。本发明为抗衰老提供新思路和手段。
附图说明
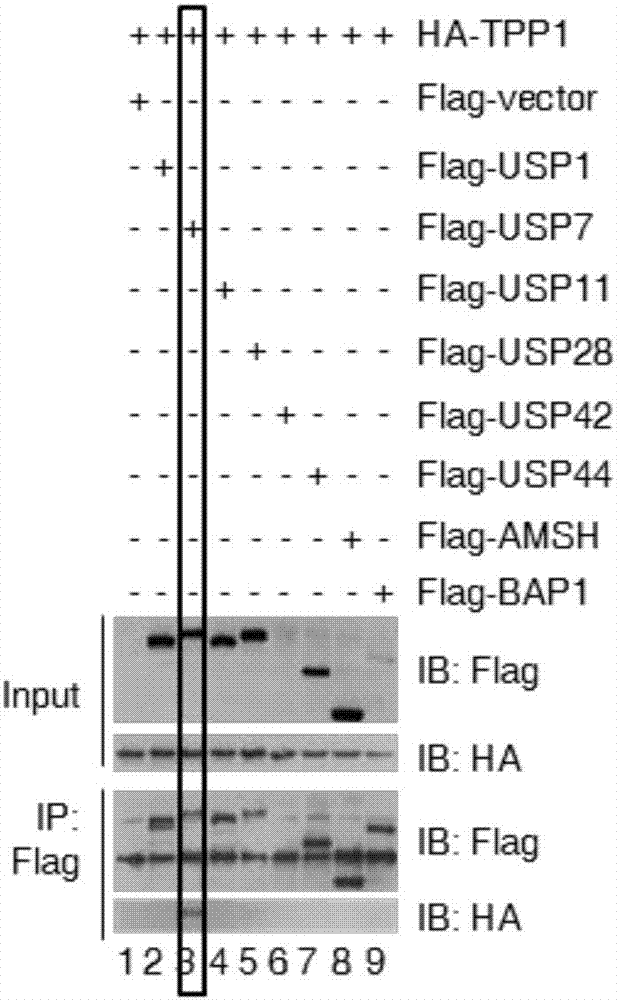
图1为在本发明的一个实施方案中,USP7与TPP1在端粒处结合。其中图1A为17个去泛素化酶对细胞周期分布的作用。图1B为去泛素化酶与TPP1的结合作用。图1C为TIN2 和TPP1与USP7的结合作用。图1D为USP7,USP11和BAP1与端粒DNA的结合。图1E、 1F和1G为USP7分别于端粒和TPP1的结合。
图2为在本发明的一个实施方案中,USP7调节TPP1泛素化降解和细胞衰老。其中图2A 和2B为抑制USP7的表达后TPP1的表达情况。图2C,2D和2E为辐照情况下TPP1和USP7 的蛋白表达及其相关性。图2F和2G为抑制USP7表达对细胞周期分布和细胞衰老的作用。
图3为在本发明的一个实施方案中,过量表达USP7对博来霉素引起的肺纤维化和肺损伤的保护。其中图3A为过量表达USP7在博来霉素处理下端粒的长度。图3B,3C和3D为上述处理条件下小鼠肺呼吸功能的检测。图3E为上述处理条件下纤维化水平的变化。图3F为上述处理条件下USP7,TPP1,HP1,SPC,-SMA,T1,Col6a和s100a4的mRNA表达情况。图3G和3H为上述处理条件下二型细胞的比例及二型细胞DNA损伤情况。图3I为上述条件下肺纤维化及肺衰老的情况。图3J为抑制USP7则显著增加肺组织衰老水平的情况。
图4为在本发明的一个实施方案中,抑制USP7减轻过量表达hTERT引起的肿瘤。其中图4A为在宫颈癌细胞株Hela中稳定过量表达hTERT并抑制USP7表达后,hTERT和USP7 的表达情况。图4B为将对照及过量表达hTERT,以及敲低USP7表达的Hela细胞及同时过量表达hTERT并敲低USP7的细胞移植于裸鼠皮下4周后,肿瘤的大小情况。图4C为上述细胞移植于裸鼠皮下4周内的肿瘤体积变化。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下属实施例仅用于说明本发明,而不应试为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行,所用试剂或仪器未注明生成厂商者,均为可以通过市购获得的常规产品。
实施例1 USP7与TPP1在端粒处结合
实验对象:HT1080细胞,293T细胞及Hela细胞。
实验方法:利用慢病毒构建稳定低表达17个去泛素化酶的HT1080细胞,利用流式检测细胞周期分布;在293T细胞中转染HA标签的TPP1和Flag标签的去泛素化酶,转染36个小时后利用免疫共沉淀检测去泛素化酶与TPP1的结合;利用染色质免疫共沉淀检测去泛素化酶与端粒DNA的结合;在Hela细胞中利用免疫荧光及FISH检测USP7与端粒及TPP1的结合。
结果显示:在筛选的17个去泛素化酶中(图1A),USP7与TPP1和端粒DNA特异性结合(图1B-D)。尽管仅有20%的USP7与端粒共定位,但是超过90%的USP7与TPP1共定位 (图1E-G)。
实施例2USP7调节TPP1泛素化降解和细胞衰老
实验对象:稳定低表达USP7的HT1080细胞及Hela细胞。
实验方法:利用慢病毒构建稳定低表达USP7的HT1080细胞,通过免疫荧光检测TPP1 的表达;利用流式检测细胞周期的分布及-gal染色检测细胞衰老;对HT1080细胞进行X- 射线照射,利用实时定量PCR和免疫印迹检测FBW7,TPP1和USP7的mRNA和蛋白表达;在Hela细胞中用针对FBW7,USP7的siRNA转染以抑制其表达,实时定量PCR检测USP7 和FBW7的干扰效率;免疫荧光检测TPP1的表达,Q-FISH检测端粒长度,IF-FISH检测端粒DNA损伤;在293T细胞中共转染Flag标签的TPP1和HA标签的泛素以及FBW7或USP7 的siRNA,免疫共沉淀检测TPP1的泛素化降解水平;在293T细胞中分别转染HA-TPP1,共转染HA-TPP1和Flag-FBW7以及三者共转染,免疫印迹检测TPP1的表达;利用免疫共沉淀检测在博来霉素(100μM)作用下TPP1与FBW7及USP7的结合。
结果显示:沉默USP7的表达降低TPP1的表达(图2A-B)。在辐照条件下,USP7与TPP1 的表达降低,尽管USP7的mRNA表达升高(图2C-D),且USP7与TPP1的结合随着USP7 的水平降低而降低(图2E)。细胞周期S期的阻滞以及细胞衰老(图2F-G)。
实施例3 USP7克服应激引起的肺衰老和纤维化
实验对象:3-6月龄野生型小鼠12只。
实验方法:取野生型小鼠12只,分为4组,每组3只,分别进行如下处理,气管灌注 control或USP7慢病毒,气管灌注PBS或博来霉素,具体方法:第一天灌注control或USP7 慢病毒,第二天灌注PBS或博来霉素,以后每隔4天灌注一次control或USP7慢病毒,第 22天对小鼠进行气管插管检测呼吸功能。提取肺组织RNA,实时定量PCR检测USP7,TPP1, HP1g,SPC,-SMA,T1,Col6a和s100a4的mRNA表达;肺组织石蜡包埋切片,Masson 和H&E染色,利用免疫荧光检测肺二型细胞的百分比(SPC阳性细胞数)及-SMA表达情况;取10mg肺组织检测羟脯氨酸含量;利用免疫荧光结合FISH检测二型细胞的端粒长度 (SPC+端粒探针)以及肺组织中的端粒DNA损伤(53BP1+端粒探针)。
结果显示:过量表达USP7增加端粒的长度,阻断博来霉素引起的端粒缩短(图3A),并改善小鼠的肺呼吸功能(图3B-D)以及博来霉素引起的肺纤维化(图3E)。与此一致的是,过量表达USP7增加TPP1,SPC和表达,降低纤维化标志物-SMA,T1,Col6a和S100a4 的表达(图3F)。此外,SPC阳性的二型上皮细胞数增加近一倍(图3G)。博莱霉素处理引起HP1阳性的二型细胞数是对照组的3倍以上,而过量表达USP7则降低了HP1阳性的二型细胞数(图3H)。同样USP7阻断博来霉素引起的肺纤维化和肺衰老(图3I)。抑制USP7 则显著增加肺组织衰老水平(图3J),与细胞中干扰USP7表达的结果一致。
实施例4 抑制USP7减轻过量表达hTERT引起的肿瘤
实验对象:稳定过量表达hTERT及对照的宫颈癌细胞株,稳定敲低USP7及过量表达 hTERT并敲低USP7表达的细胞株;裸鼠
实验方法:利用慢病毒构建过量表达hTERT及对照的宫颈癌细胞细胞株(Hela-control shRNA及Hela-hTERT control shRNA),以及稳定敲低USP7及过量表达hTERT并敲低USP7 表达的细胞株(Hela-USP7 shRNA和Hela-hTERT USP7 shRNA)。将四组细胞分别注射于裸鼠皮下(每组6只小鼠,每只小鼠注射细胞数为2×106),以形成移植瘤。待肿瘤长出后,每隔3天测量肿瘤体积并记录。4周后取肿瘤组织。
结果显示:构建的稳定株hTERT过量表达,USP7表达降低,证明稳定株构建成功(图 4A)。过量表达hTERT的Hela细胞肿瘤生长速度高于对照细胞,但将USP7在过量表达hTERT 的细胞中敲低表达后,肿瘤的体积小于对照及过量表达hTERT细胞引起的肿瘤(图4B和C),说明抑制USP7减轻过量表达hTERT引起的肿瘤。
序列表
<110> 杭州师范大学
<120> 泛素蛋白酶USP7在衰老及相关疾病方面的医药用途
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 5412
<212> DNA/RNA
<213> Homo sapiens
<400> 1
gtacgtgcgc gtctccctgc cgccgccgcc gcccgccgcg ggccgccccg gggccgccgt 60
cgccgacgac gcgcgggagg aggaggagga ggccgccccg ccgccgccgc cgccgccgcc 120
gccccggctc gccgccgccc gcccgccggg ctcgcagccc cggcccccgg ccgcaggcga 180
ggcccaggcc gcggccgaca tgaaccacca gcagcagcag cagcagcaga aagcgggcga 240
gcagcagttg agcgagcccg aggacatgga gatggaagcg ggagatacag atgacccacc 300
aagaattact cagaaccctg tgatcaatgg gaatgtggcc ctgagtgatg gacacaacac 360
cgcggaggag gacatggagg atgacaccag ttggcgctcc gaggcaacct ttcagttcac 420
tgtggagcgc ttcagcagac tgagtgagtc ggtccttagc cctccgtgtt ttgtgcgaaa 480
tctgccatgg aagattatgg tgatgccacg cttttatcca gacagaccac accaaaaaag 540
cgtaggattc tttctccagt gcaatgctga atctgattcc acgtcatggt cttgccatgc 600
acaagcagtg ctgaagataa taaattacag agatgatgaa aagtcgttca gtcgtcgtat 660
tagtcatttg ttcttccata aagaaaatga ttggggattt tccaatttta tggcctggag 720
tgaagtgacc gatcctgaga aaggatttat agatgatgac aaagttacct ttgaagtctt 780
tgtacaggcg gatgctcccc atggagttgc gtgggattca aagaagcaca caggctacgt 840
cggcttaaag aatcagggag cgacttgtta catgaacagc ctgctacaga cgttattttt 900
cacgaatcag ctacgaaagg ctgtgtacat gatgccaacc gagggggatg attcgtctaa 960
aagcgtccct ttagcattac aaagagtgtt ctatgaatta cagcatagtg ataaacctgt 1020
aggaacaaaa aagttaacaa agtcatttgg gtgggaaact ttagatagct tcatgcaaca 1080
tgatgttcag gagctttgtc gagtgttgct cgataatgtg gaaaataaga tgaaaggcac 1140
ctgtgtagag ggcaccatac ccaaattatt ccgcggcaaa atggtgtcct atatccagtg 1200
taaagaagta gactatcggt ctgatagaag agaagattat tatgatatcc agctaagtat 1260
caaaggaaag aaaaatatat ttgaatcatt tgtggattat gtggcagtag aacagctcga 1320
tggggacaat aaatacgacg ctggggaaca tggcttacag gaagcagaga aaggtgtgaa 1380
attcctaaca ttgccaccag tgttacatct acaactgatg agatttatgt atgaccctca 1440
gacggaccaa aatatcaaga tcaatgatag gtttgaattc ccagagcagt taccacttga 1500
tgaatttttg caaaaaacag atcctaagga ccctgcaaat tatattcttc atgcagtcct 1560
ggttcatagt ggagataatc atggtggaca ttatgtggtt tatctaaacc ccaaagggga 1620
tggcaaatgg tgtaaatttg atgacgacgt ggtgtcaagg tgtactaaag aggaagcaat 1680
tgagcacaat tatgggggtc acgatgacga cctgtctgtt cgacactgca ctaatgctta 1740
catgttagtc tacatcaggg aatcaaaact gagtgaagtt ttacaggcgg tcaccgacca 1800
tgatattcct cagcagttgg tggagcgatt acaagaagag aaaaggatcg aggctcagaa 1860
gcggaaggag cggcaggaag cccatctcta tatgcaagtg cagatagtcg cagaggacca 1920
gttttgtggc caccaaggga atgacatgta cgatgaagaa aaagtgaaat acactgtgtt 1980
caaagtattg aagaactcct cgcttgctga gtttgttcag agcctctctc agaccatggg 2040
atttccacaa gatcaaattc gattgtggcc catgcaagca aggagtaatg gaacaaaacg 2100
accagcaatg ttagataatg aagccgacgg caataaaaca atgattgagc tcagtgataa 2160
tgaaaaccct tggacaatat tcctggaaac agttgatccc gagctggctg ctagtggagc 2220
gaccttaccc aagtttgata aagatcatga tgtaatgtta tttttgaaga tgtatgatcc 2280
caaaacgcgg agcttgaatt actgtgggca tatctacaca ccaatatcct gtaaaatacg 2340
tgacttgctc ccagttatgt gtgacagagc aggatttatt caagatacta gccttatcct 2400
ctatgaggaa gttaaaccga atttaacaga gagaattcag gactatgacg tgtctcttga 2460
taaagccctt gatgaactaa tggatggtga catcatagta tttcagaagg atgaccctga 2520
aaatgataac agtgaattac ccaccgcaaa ggagtatttc cgagatctct accaccgcgt 2580
tgatgtcatt ttctgtgata aaacaatccc taatgatcct ggatttgtgg ttacgttatc 2640
aaatagaatg aattattttc aggttgcaaa gacagttgca cagaggctca acacagatcc 2700
aatgttgctg cagtttttca agtctcaagg ttatagggat ggcccaggta atcctcttag 2760
acataattat gaaggtactt taagagatct tctacagttc ttcaagccta gacaacctaa 2820
gaaactttac tatcagcagc ttaagatgaa aatcacagac tttgagaaca ggcgaagttt 2880
taaatgtata tggttaaaca gccaatttag ggaagaggaa ataacactat atccagacaa 2940
gcatgggtgt gtccgggacc tgttagaaga atgtaaaaag gccgtggagc ttggggagaa 3000
agcatcaggg aaacttaggc tgctagaaat tgtaagctac aaaatcattg gtgttcatca 3060
agaagatgaa ctattagaat gtttatctcc tgcaacgagc cggacgtttc gaatagagga 3120
aatccctttg gaccaggtgg acatagacaa agagaatgag atgcttgtca cagtggcgca 3180
tttccacaaa gaggtcttcg gaacgttcgg aatcccgttt ttgctgagga tacaccaggg 3240
cgagcatttt cgagaagtga tgaagcgaat ccagagcctg ctggacatcc aggagaagga 3300
gtttgagaag tttaaatttg caattgtaat gatgggccga caccagtaca taaatgaaga 3360
cgagtatgaa gtaaatttga aagactttga gccacagccc ggtaatatgt ctcatcctcg 3420
gccttggcta gggctcgacc acttcaacaa agccccaaag aggagtcgct acacttacct 3480
tgaaaaggcc attaaaatcc ataactgatt tccaagctgg tgtgttcaag gcgaggacgg 3540
tgtgtgggtg gccccttaac agcctagaac tttggtgcac gtgccctcta gccgaagtct 3600
tcagcaagag gattcgctgc tggtgttaat tttattttat tgaggctgtt cagtttggct 3660
tctctgtatc tattgactgc cctttttgag caaaatgaag atgtttttat aaagcttgga 3720
tgccaatgag agttatttta tggtaaccac agtgcaaggc aactgtcagc gcaatggggg 3780
agaagaggtt agtggatcgg gggtccctgg ctcaaggtct ctgggctgtc cctagtgggc 3840
acgagtggct cggctgcctt cctggggtcc cgtgcaccag ccctgcagct agcaagtctt 3900
gtgtttaggc tcgtctgacc tatttccttc agttatactt tcaatgacct tttgtgcatc 3960
tgttaaggca aaacagagaa actcacaacc taataaatag cgctcttccc ttcattgtgt 4020
gcattgtcgg cccttcctcg ggttctcctc ctccagctgc ctgggggctt tttaataaac 4080
ttgtctcacc tcgtcagcca ctactgtctg cagccccttt gcaaagtgga tgcactgaat 4140
acagtccgga cagacattgt gggggtcttt ttattaaatc aagaacattg ttaaattcaa 4200
ttaaggttta ctctgctgcc ttggcagact tacgatctca acagttcata cgagcaggtg 4260
aaaggattat aaatagaatt tcgttaaagt ggaacagacg acaagaaagc cttttagcaa 4320
gagggcatgc tcactagtgg ttagtaagct gtcgactttg taaaaaagtt aaaaatgaaa 4380
aaaaaaggaa aaatgaattg tatatttaat gaatgaacat gtacaatttg ccactgggag 4440
gaggttcctt tttgttgggt gagtctgcaa gtgaatttca ctgatgttga tattcattgt 4500
gtgtagtttt atttcggtcc cagccccgtt tccttttatt ttggagctaa tgccagctgc 4560
gtgtctagtt ttgagtgcag taaaatagaa tcagcaaatc actcttattt ttcatccttt 4620
tccggtattt tttgggttgt ttctgtggga gcagtgtaca ccaactcttc ctgtatattg 4680
cctttttgct ggaaaatgtt gtatgttgaa taaaattttc tataaaaatt ataattcagt 4740
gagttacgtg gaagtggagg aagatttcta ctctccctgg aaacaggcct gggaaacctt 4800
ggcatttgta acaaggtttc actgagatgt acttttcctt ctaattccgt tttgcggggg 4860
cagggtctct tgtttctttt tttttttttt ttttttttta gcctctaact agtcacattt 4920
actcttaaga aatgaaaggt tttccaggag agaactgtgt acaaataagg tgactggaga 4980
tgtgacctga tgtgtcacga ggcccttcgg ggcggcaggc gctatcgtgg gcgtggtcct 5040
tgcaccgtcc catcggcctt gccttccagc tccgtggcac ggtttcctgg tctttgggcc 5100
agtgtgtacc ttggagtgac ttcctttctc aacttccact gcagtgtgtg tgccttctgc 5160
tctgagagct gccttgtgac ccgtgtgata gaaagcaggg agtgagggtc cccgcggacc 5220
tggcccttcc ctccttcctc ccccagaaag aggagttaga gcaggggtgc gagagccgtt 5280
cgctgtgggt ttgtctttga acaaacatta aggtgtcttg tttttgttct gggctggggg 5340
ttggctgtag tcttaggtaa ctgaaagttc ctactctccc ttaaggtatt aaatgactct 5400
ttttccaaag aa 5412
<210> 2
<211> 1102
<212> PRT
<213> Homo sapiens
<400> 2
Met Asn His Gln Gln Gln Gln Gln Gln Gln Lys Ala Gly Glu Gln Gln
1 5 10 15
Leu Ser Glu Pro Glu Asp Met Glu Met Glu Ala Gly Asp Thr Asp Asp
20 25 30
Pro Pro Arg Ile Thr Gln Asn Pro Val Ile Asn Gly Asn Val Ala Leu
35 40 45
Ser Asp Gly His Asn Thr Ala Glu Glu Asp Met Glu Asp Asp Thr Ser
50 55 60
Trp Arg Ser Glu Ala Thr Phe Gln Phe Thr Val Glu Arg Phe Ser Arg
65 70 75 80
Leu Ser Glu Ser Val Leu Ser Pro Pro Cys Phe Val Arg Asn Leu Pro
85 90 95
Trp Lys Ile Met Val Met Pro Arg Phe Tyr Pro Asp Arg Pro His Gln
100 105 110
Lys Ser Val Gly Phe Phe Leu Gln Cys Asn Ala Glu Ser Asp Ser Thr
115 120 125
Ser Trp Ser Cys His Ala Gln Ala Val Leu Lys Ile Ile Asn Tyr Arg
130 135 140
Asp Asp Glu Lys Ser Phe Ser Arg Arg Ile Ser His Leu Phe Phe His
145 150 155 160
Lys Glu Asn Asp Trp Gly Phe Ser Asn Phe Met Ala Trp Ser Glu Val
165 170 175
Thr Asp Pro Glu Lys Gly Phe Ile Asp Asp Asp Lys Val Thr Phe Glu
180 185 190
Val Phe Val Gln Ala Asp Ala Pro His Gly Val Ala Trp Asp Ser Lys
195 200 205
Lys His Thr Gly Tyr Val Gly Leu Lys Asn Gln Gly Ala Thr Cys Tyr
210 215 220
Met Asn Ser Leu Leu Gln Thr Leu Phe Phe Thr Asn Gln Leu Arg Lys
225 230 235 240
Ala Val Tyr Met Met Pro Thr Glu Gly Asp Asp Ser Ser Lys Ser Val
245 250 255
Pro Leu Ala Leu Gln Arg Val Phe Tyr Glu Leu Gln His Ser Asp Lys
260 265 270
Pro Val Gly Thr Lys Lys Leu Thr Lys Ser Phe Gly Trp Glu Thr Leu
275 280 285
Asp Ser Phe Met Gln His Asp Val Gln Glu Leu Cys Arg Val Leu Leu
290 295 300
Asp Asn Val Glu Asn Lys Met Lys Gly Thr Cys Val Glu Gly Thr Ile
305 310 315 320
Pro Lys Leu Phe Arg Gly Lys Met Val Ser Tyr Ile Gln Cys Lys Glu
325 330 335
Val Asp Tyr Arg Ser Asp Arg Arg Glu Asp Tyr Tyr Asp Ile Gln Leu
340 345 350
Ser Ile Lys Gly Lys Lys Asn Ile Phe Glu Ser Phe Val Asp Tyr Val
355 360 365
Ala Val Glu Gln Leu Asp Gly Asp Asn Lys Tyr Asp Ala Gly Glu His
370 375 380
Gly Leu Gln Glu Ala Glu Lys Gly Val Lys Phe Leu Thr Leu Pro Pro
385 390 395 400
Val Leu His Leu Gln Leu Met Arg Phe Met Tyr Asp Pro Gln Thr Asp
405 410 415
Gln Asn Ile Lys Ile Asn Asp Arg Phe Glu Phe Pro Glu Gln Leu Pro
420 425 430
Leu Asp Glu Phe Leu Gln Lys Thr Asp Pro Lys Asp Pro Ala Asn Tyr
435 440 445
Ile Leu His Ala Val Leu Val His Ser Gly Asp Asn His Gly Gly His
450 455 460
Tyr Val Val Tyr Leu Asn Pro Lys Gly Asp Gly Lys Trp Cys Lys Phe
465 470 475 480
Asp Asp Asp Val Val Ser Arg Cys Thr Lys Glu Glu Ala Ile Glu His
485 490 495
Asn Tyr Gly Gly His Asp Asp Asp Leu Ser Val Arg His Cys Thr Asn
500 505 510
Ala Tyr Met Leu Val Tyr Ile Arg Glu Ser Lys Leu Ser Glu Val Leu
515 520 525
Gln Ala Val Thr Asp His Asp Ile Pro Gln Gln Leu Val Glu Arg Leu
530 535 540
Gln Glu Glu Lys Arg Ile Glu Ala Gln Lys Arg Lys Glu Arg Gln Glu
545 550 555 560
Ala His Leu Tyr Met Gln Val Gln Ile Val Ala Glu Asp Gln Phe Cys
565 570 575
Gly His Gln Gly Asn Asp Met Tyr Asp Glu Glu Lys Val Lys Tyr Thr
580 585 590
Val Phe Lys Val Leu Lys Asn Ser Ser Leu Ala Glu Phe Val Gln Ser
595 600 605
Leu Ser Gln Thr Met Gly Phe Pro Gln Asp Gln Ile Arg Leu Trp Pro
610 615 620
Met Gln Ala Arg Ser Asn Gly Thr Lys Arg Pro Ala Met Leu Asp Asn
625 630 635 640
Glu Ala Asp Gly Asn Lys Thr Met Ile Glu Leu Ser Asp Asn Glu Asn
645 650 655
Pro Trp Thr Ile Phe Leu Glu Thr Val Asp Pro Glu Leu Ala Ala Ser
660 665 670
Gly Ala Thr Leu Pro Lys Phe Asp Lys Asp His Asp Val Met Leu Phe
675 680 685
Leu Lys Met Tyr Asp Pro Lys Thr Arg Ser Leu Asn Tyr Cys Gly His
690 695 700
Ile Tyr Thr Pro Ile Ser Cys Lys Ile Arg Asp Leu Leu Pro Val Met
705 710 715 720
Cys Asp Arg Ala Gly Phe Ile Gln Asp Thr Ser Leu Ile Leu Tyr Glu
725 730 735
Glu Val Lys Pro Asn Leu Thr Glu Arg Ile Gln Asp Tyr Asp Val Ser
740 745 750
Leu Asp Lys Ala Leu Asp Glu Leu Met Asp Gly Asp Ile Ile Val Phe
755 760 765
Gln Lys Asp Asp Pro Glu Asn Asp Asn Ser Glu Leu Pro Thr Ala Lys
770 775 780
Glu Tyr Phe Arg Asp Leu Tyr His Arg Val Asp Val Ile Phe Cys Asp
785 790 795 800
Lys Thr Ile Pro Asn Asp Pro Gly Phe Val Val Thr Leu Ser Asn Arg
805 810 815
Met Asn Tyr Phe Gln Val Ala Lys Thr Val Ala Gln Arg Leu Asn Thr
820 825 830
Asp Pro Met Leu Leu Gln Phe Phe Lys Ser Gln Gly Tyr Arg Asp Gly
835 840 845
Pro Gly Asn Pro Leu Arg His Asn Tyr Glu Gly Thr Leu Arg Asp Leu
850 855 860
Leu Gln Phe Phe Lys Pro Arg Gln Pro Lys Lys Leu Tyr Tyr Gln Gln
865 870 875 880
Leu Lys Met Lys Ile Thr Asp Phe Glu Asn Arg Arg Ser Phe Lys Cys
885 890 895
Ile Trp Leu Asn Ser Gln Phe Arg Glu Glu Glu Ile Thr Leu Tyr Pro
900 905 910
Asp Lys His Gly Cys Val Arg Asp Leu Leu Glu Glu Cys Lys Lys Ala
915 920 925
Val Glu Leu Gly Glu Lys Ala Ser Gly Lys Leu Arg Leu Leu Glu Ile
930 935 940
Val Ser Tyr Lys Ile Ile Gly Val His Gln Glu Asp Glu Leu Leu Glu
945 950 955 960
Cys Leu Ser Pro Ala Thr Ser Arg Thr Phe Arg Ile Glu Glu Ile Pro
965 970 975
Leu Asp Gln Val Asp Ile Asp Lys Glu Asn Glu Met Leu Val Thr Val
980 985 990
Ala His Phe His Lys Glu Val Phe Gly Thr Phe Gly Ile Pro Phe Leu
995 1000 1005
Leu Arg Ile His Gln Gly Glu His Phe Arg Glu Val Met Lys Arg Ile
1010 1015 1020
Gln Ser Leu Leu Asp Ile Gln Glu Lys Glu Phe Glu Lys Phe Lys Phe
1025 1030 1035 1040
Ala Ile Val Met Met Gly Arg His Gln Tyr Ile Asn Glu Asp Glu Tyr
1045 1050 1055
Glu Val Asn Leu Lys Asp Phe Glu Pro Gln Pro Gly Asn Met Ser His
1060 1065 1070
Pro Arg Pro Trp Leu Gly Leu Asp His Phe Asn Lys Ala Pro Lys Arg
1075 1080 1085
Ser Arg Tyr Thr Tyr Leu Glu Lys Ala Ile Lys Ile His Asn
1090 1095 1100
- 还没有人留言评论。精彩留言会获得点赞!