具有新型自杀式连接子的基于念珠藻素的抗体药物缀合物的制作方法
本发明涉及药物化学领域,具体地涉及具有抗癌活性的化合物,并且更具体地涉及与化学治疗性大环缩肽(macrocyclicdepsipeptide)药物或毒素缀合的抗体。本发明还涉及上述化合物在体外、原位和体内诊断或治疗受癌症、自身免疫性疾病或感染性性疾病影响的哺乳动物细胞或受试者中的用途。
背景技术:
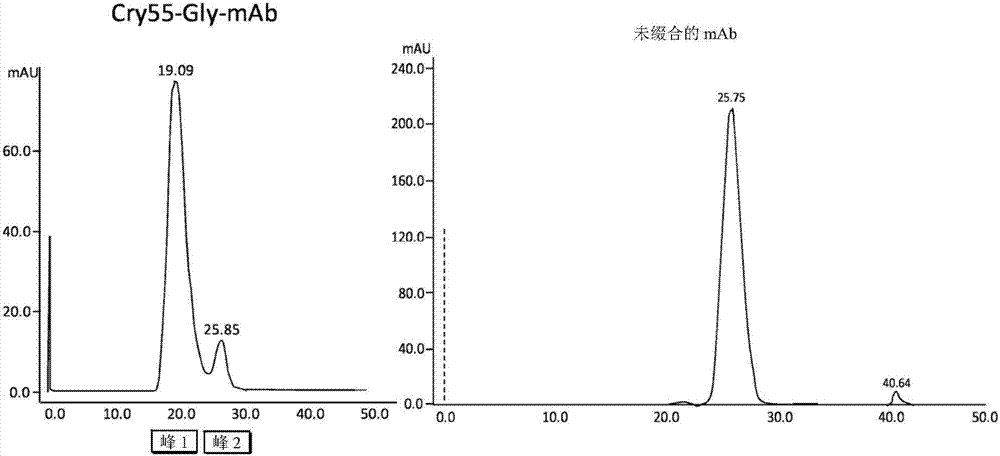
:已经建立了抗体治疗以用于具有癌症、免疫和血管生成障碍病症的患者的靶向治疗。出于该目的,已经开发了治疗性单克隆抗体(tma)(firerm.a.j.hematol.oncol.2012,5,70;mullard,a.naturerev.drugdiscov.2013,12,329)。然而,由于不足够的癌细胞毒性,许多在临床前研究中显示出希望的tma在临床上使用失败。已经建立了单克隆抗体治疗以用于具有癌症、免疫和血管生成障碍病症的患者的靶向治疗。成功的抗体治疗的示例为(曲妥珠单抗),一种来源重组dna的人源化单克隆抗体,其以高亲和力与人表皮生长因子受体2蛋白her2(erbb2)的细胞外结构域选择性结合(us5,821,337、us6,054,297、us6,407,213、us6,639,055、coussensl等人(1985)science230:1132-9;slamondj等人(1989)science244:707-12)。尽管herceptin是治疗已经接受了广泛的先前抗癌治疗的患有erbb2过表达的乳腺癌患者方面的突破,但是该群体中的大多数患者对herceptin治疗没有反应或仅有较差反应。为克服此类问题,抗体-药物缀合物(adc)领域已经呈指数规律增长,其中单克隆抗体(mab,例如曲妥珠单抗)与高度细胞毒性药物连接。adc在癌症治疗中越来越重要。三种adc已经由usfda批准:(gemtuzumabozogamicin,wyethpharmaceuticals)、(brentuximabvedotin,seattlegenetics)、和(ado-trastuzumabemtansin,roche),然而目前35种adc处于临床试验中。肿瘤选择性由mab显示,然而连接子负责生理条件下的药物释放、稳定性和总体溶解度。由连接于卡里奇霉素的hucd33抗体组成并于2000年批准用于治疗急性骨髓性白血病,但于2010年撤销。(本妥昔单抗,seattlegenetics,下式1)于2011年批准并由连接至抗cd30的抗体的一甲基澳瑞他汀e(mmae)组成,其在经典霍奇金淋巴瘤(hl)和全身性变应性大细胞淋巴瘤(salcl)中表达,(ado-trastuzumabemtansin,roche,下式2)于2013年被批准用于治疗难治性人表皮生长因子受体2(her2)阳性转移或局部晚期乳腺癌,并包含与细胞毒性剂mertansine(dm1)连接的单克隆抗体曲妥珠单抗(herceptin)。ado-trastuzumabemtansin和本妥昔单抗是目前被美国食品和药物管理局(fda)和欧洲药物管理局(ema)批准的仅有的两种adc。最近在一些专利中已经认识到念珠藻素(cryptophycin)的超常活性。endocyte获得了配备有可切割二硫键的念珠藻素叶酸缀合物(式3)的专利。此类叶酸缀合物靶向过表达叶酸受体的癌细胞系(us2009/002993)。sanofi-aventis最近公布了两项专利,所述专利公开了关于念珠藻素抗体-药物缀合物(adc)的数据(us2011/001052;fr2947269)。选择主要具有改性的芳基取代基的念珠藻素衍生物以获得具有合适官能团的念珠藻素(式4)。使用不同的连接子类型,尤其为可切割的二硫键、peg连接子、硫醚连接子和噻唑连接子。在所有情况下,连接子连接到靶向epha2受体的单克隆抗体hu2h11。还报道了抗人乳腺癌细胞系mda-mb-231的两种念珠藻素adc的ic50值。式4中所示的adc包含位阻型硫醚连接子并示出ic50值为0.710nm。另一adc包含位阻二硫键连接子(ic50:0.150nm)。已经报道了经取代的念珠藻素对耐药细胞具有不稳定的细胞毒性活性。相比之下,报道了未缀合的念珠藻素(式5)甚至针对多重耐药(mdr)癌细胞也具有非常高的细胞毒性。念珠藻素-52针对多重耐药(mdr)肿瘤细胞系显示出非常高的活性。许多mdr肿瘤细胞表达充当外排泵的p糖蛋白(p-gp)。由于抗p-gp药物的合理设计仍然是困难的,因此该活性是念珠藻素的另一个有价值的特征。第一代表性念珠藻素在1990年从念珠藻属蓝藻菌(cyanobacterianostocsp.)分离。其生物活性基于其与微管蛋白的相互作用。发现念珠藻素由于抑制微管动力学而引发细胞凋亡。因此,念珠藻素类似物被认为是潜在的抗肿瘤药。念珠藻素-52(ly355703)通过了临床i期研究,但后续临床ii期研究由于在所选剂量下缺乏体内功效、高神经毒性和剂量限制性毒性而停止。目前只有少数adc已被批准用于治疗癌症。adc的高多样性对于应对耐药性是必要的。迄今为止,基于念珠藻素的adc均还未被批准,并且还没有念珠藻素-55-甘氨酸盐被描述用于与抗体缀合。所有描述的念珠藻素缀合物仅可通过长合成途径获得(参见例如wo2011/001052)。然而,sewald和同事们描述了短且有效的合成路径(nat.prod.rep.2013,30,924-940)。仍然强烈需要提供药物缀合物,特别是抗体-药物缀合物(通常也被称为adc)和肽-药物缀合物(也通常被称为pdc),以安全用于疾病(特别是癌症、免疫性疾病、感染性疾病)的治疗。仍然强烈需要提供药物缀合物,特别是抗体-药物缀合物(通常也被称为adc)和肽-药物缀合物(也通常被称为pdc),以用于疾病(特别是癌症、免疫性疾病、感染性疾病)的诊断。另一种强烈需要是提供药物缀合物,特别是抗体-药物缀合物(通常也被称为adc)和肽-药物缀合物(也通常被称为pdc),以用于治疗发展成多重耐药性的癌症、免疫性疾病、感染性疾病的治疗。技术实现要素:现在已经发现其中氯醇(chlorohydrin)念珠藻素-55跨自杀式性肽衍生的连接子连接至单克隆抗体或肽的缀合物高度有效地抗肿瘤细胞。根据本发明的缀合物与一种或多种与肿瘤相关的抗原或细胞表面受体结合,因此其可用于诊断或治疗由于结合到肿瘤相关抗原或细胞表面受体、蛋白质或抗原而能够被诊断或治疗的那些疾病。本发明的一个目的是式(i)缀合物:其中r为–co-ch2-x-(a)n-b其中x选自nra和o,其中ra选自h和c1-c10烷基;a为自杀式连接子,n为0或1;b选自肽、多肽/蛋白质和抗体以及其药学上可接受的盐。本发明的另一个目的是药物组合物,其包含如上所述的缀合物作为具有至少一种药学上可接受的载体和/或赋形剂的混合物中的活性成分。本发明的另一个目的是如上所述的缀合物,其用作药物。本发明的另一个目的是如上所述的缀合物,其用作诊断物。现在,本发明的这些和其它目的还将借助于实施例和附图来详细描述。附图说明在附图中:图1:示出了用图中所示化合物处理her2-阳性sk-br3细胞之后的细胞活性测定。图2:示出了药物连接子-缀合抗体的纯化,其中峰2对应于念珠藻素-55-甘氨酸盐缀合抗体的单体形式并且峰1对应于念珠藻素-55-甘氨酸盐缀合抗体的低聚物形式(图2,左图),如通过与合适的蛋白质mw标准(未示出)和纯化的未缀合抗体(图2,右图)比较所评价的。图3:示出了在用本发明的缀合物与奥曲肽(octreotide)处理ar42j细胞时获得的残余细胞活性曲线。图4:示出了在用本发明的缀合物与奥曲肽处理mcf7细胞时获得的残余细胞活性曲线。图5:示出了念珠藻素或念珠藻素药物连接子对野生型和耐药性h69ar细胞系的细胞毒性。在图中,连接子73示于实施例6中,并且连接子76示于实施例5中。具体实施方式根据本发明的缀合物可以为与抗体,优选地单克隆抗体,或者与肽、多肽或蛋白质的药物缀合物。抗体,特别是单克隆抗体,在治疗中为人们所熟知,特别是用于与药物缀合。根据本发明的缀合物可以为与抗体,优选地与单克隆抗体的药物缀合物,在这种情况下,其也被简称为adc,或与肽、多肽或蛋白质的药物缀合物,在这种情况下,其也被简称为pdc。肽在治疗中为人们所熟知,特别是用于与药物缀合。根据本发明的肽、多肽或蛋白质可包含呈l-构型或d-构型或这两种构型的天然氨基酸、以及人工肽。在本发明的优选的实施方案中,在缀合物中,抗体为单克隆抗体或纳米抗体。根据本发明的其它实施方案,纳米抗体选自单结构域抗体和骆驼抗体(camelidantibody)。在本发明的特别优选的实施方案中,在抗体药物缀合物(adc)中,单克隆抗体选自曲妥珠单抗(trastuzumab)、吉妥单抗(gemtuzumab)、本妥昔单抗(brentuximab)、利妥昔单抗(rituximab)、西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)、奥美珠单抗(ofatumumab)、奥替珠单抗(obinutuzumab)、依托单抗(pertuzumab)。在本发明的优选的实施方案中,肽b结合到生长抑素(somatostatin)受体。在本发明的特别优选的实施方案中,所述肽选自奥曲肽(octreotide)、帕瑞肽(pasireotide)或兰瑞肽(lanreotide)。在本发明的实施方案中,在缀合物中,所述自杀式连接子a为式(ii)的部分:其中r1选自h、(c1-c10)烷基,r2任选地连同r1一起为氨基酸侧链的残基,r3选自h、(c1-c10)烷基,r4任选地连同r3一起为氨基酸侧链的残基。在优选的实施方案中,在缀合物中,所述自杀式连接子a选自:和在本发明的另一实施方案中,所述缀合物具有式(iii):其中r1、r2、r3和r4如上定义,x选自nh、n-(c1-c10)-烷基、o;mab表示单克隆抗体或纳米抗体、或肽或多肽。在本发明的另一实施方案中,所述缀合物具有式(iv):在本发明的另一实施方案中,所述缀合物具有式(v):其中,r1选自h、(c1-c10)烷基,r4任选地连同r1一起为氨基酸侧链的残基;x选自nh、n-(c1-c10)烷基-o;mab表示单克隆抗体、肽或多肽。在本发明的另一实施方案中,所述缀合物具有式(vi):在本发明的实施方案中,缀合物用于治疗选自癌症、自身免疫性疾病和感染性疾病的疾病。在本发明的实施方案中,缀合物用于诊断选自癌症、自身免疫性疾病和感染性疾病的疾病。除了体外之外,根据本发明的缀合物也可用于体外或原位诊断。在术语c1-c10烷基的情况下,意指直链或支链烷基。烷基的示例是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基以及它们的全部异构体。根据本发明,药学上可接受的盐是本领域熟知的并且不需要特别公开。本领域技术人员已知盐是否适用于本发明的目的,并且可以诉诸于广泛的参考文献、指南、手册等。例如pharmaceuticalsalts:properties,selection,anduse,p.heinrichstahl(编辑),camilleg.wermuth(编辑),wiley。在本发明的优选方面,使用念珠藻素-55-甘氨酸盐或念珠藻素乙醇酸盐。其示出细胞毒性,所述细胞毒性不显著低于念珠藻素-55的细胞毒性(表1),并且另选地,具有适用于缀合的官能团的有益效果。经由该官能团,念珠藻素-55-甘氨酸盐或念珠藻素-55-乙醇酸盐可经由蛋白酶可切割的自杀式连接子缀合到单克隆抗体(例如,曲妥珠单抗示出针对her2受体的高选择性,所述her2受体在所有乳腺肿瘤的20-25%中过表达)。自杀式连接子在设计药物缀合物,特别是设计抗体-药物缀合物(adc)和肽-药物缀合物中为人们所熟知,参见例如us6214345和相关参考文献;或者carlp.l.等人(1982)。连接子由附接位点构成(马来酰亚胺、活性酯等),所述附接位点对于存在于能够释放念珠藻素-55、念珠藻素-55-甘氨酸盐、念珠藻素-55-乙醇酸盐、或其它拟肽类念珠藻素-55衍生物的蛋白质(硫醇、胺等)、亲水性间隔基(例如基于乙二醇的)、蛋白酶裂解位点(例如val-cit)、二肽单元(方案2)或三肽单元(方案2)中的官能团是反应性的。假设念珠藻素-55转换成念珠藻素-52。方案1.通过蛋白酶切割释放二酮哌嗪和念珠藻素-55衍生物(例如甘氨酸盐)(r1=h、烷基,r2=任何氨基酸侧链,r3=h、(c1-c10)烷基、r4=任何氨基酸侧链,x=nh、n(c1-c10)烷基、o)。方案2.用蛋白酶切割释放二酮哌嗪(x=nh或n-(c1-c10)烷基)或二酮吗啉(x=o)和念珠藻素-55(r1=h、(c1-c10)烷基,r4=任何氨基酸侧链,x=nh、n(c1-c10)烷基、o)本发明的缀合物可以根据本领域熟知的常规技术制备。例如,可根据weissc等人,(2012)beilsteinjournaloforganicchemistry8:2060-6和weissc等人,(2013)naturalproductreports30:924-40中公开的路径来制备念珠藻素-52。念珠藻素-55可以由念珠藻素-52开始,例如通过打开念珠藻素-55的环氧乙烷环制备。打开环氧乙烷环以便引入卤原子是本领域技术人员所熟知的。例如可以使用盐酸。反应介质通常是适用于这种反应,以及反应条件和引起期望的产物的反应和分离的有机溶剂。念珠藻素-55-甘氨酸盐也可根据熟知的合成方法来制备,例如通过相应的三氟乙酸盐(参见,liangj等人,(2005)investigationalnewdrugs213-224)。适用于本发明的自杀式连接子及其制备也为人们所熟知。在本发明的优选实施方案中,可以根据seitzo等人(1997)journaloforganicchemistry62:813-826中公开的方法合成叔丁基-15-羟基-4,7,10,13-四氧杂十五烷酸酯。可根据warneckea,(2002)dissertation来合成叔丁基-15-马来酰亚胺-4,7,10,13-四氧杂十五烷酸酯。可根据warneckea,(2002)dissertation制备15-马来酰亚胺-4,7,10,13-四氧杂十五烷酸。在本发明的优选实施方案中,可根据标准fmocspps来合成马来酰亚胺-peg-val-cit-pro-gly[fieldsg和noblerl,(2009)internationaljournalofpeptideandproteinresearch33,3:161-214]。其它熟知的自杀式连接子可用于本发明。此后,可通过熟知的马来酰亚胺缀合法来制备念珠藻素-55-甘氨酸肽。可根据本领域的常识来制备与念珠藻素-55-甘氨酸盐的抗体-药物缀合物(adc)。例如,在利用tcep(三(2-羧乙基)膦)方法部分还原抗体链间二硫键或利用2-mea(2-巯基乙胺·hcl)方法部分还原抗体链间二硫键时。可方便地使用任何其它方便的方法。根据本发明的肽-药物缀合物(pdc)也可用常规方法来制备。可通过体内方法(例如,对于adc而言,在识别抗体的所选细胞系上,对pdc而言,在呈现通过肽识别的受体的所选细胞系上),或体外方法(使用实验室动物模型)测试本发明的adc和pdc的效应。根据本发明的念珠藻素-55-甘氨酸盐adc示出比曲妥珠单抗高得多的对her2阳性乳腺癌细胞系(sk-br3)的细胞毒性。不同于与念珠藻素-55和念珠藻素-55-甘氨酸盐,与mcf7(具有低her2表达的乳腺癌细胞系)或hct116(具有低her2表达的结肠癌细胞系)相比,adc细胞毒性效应对her2阳性sk-br3细胞系是高度选择性的。根据本发明的基于念珠藻素的缀合物提供多个优点:释放的念珠藻素衍生物已经在纳摩尔或亚纳摩尔浓度下示出针对肿瘤细胞的细胞毒性效应。释放的念珠藻素衍生物不是pgp的底物并且因此对念珠藻素的抗性可能较低。合成路径基于念珠藻素-55-甘氨酸盐,一种在缀合之前不必对其骨架进行化学改性的念珠藻素。经由抗体选择性处理her2-过表达乳腺癌细胞系是可能的。在酶促裂解连接子之后,adc提供另选的药物释放机制,其中形成二酮哌啶衍生物或类似物。念珠藻素衍生物可用于合成不同的缀合物,因此提供药物缀合物的较高多样性。根据本发明的缀合物可借助于药物组合物来给药,其中有效量的缀合物与至少一种药学上可接受的载体和/或至少一种药学上可接受的赋形剂混合。所述组合物适用于兽医或人类给药。本发明的组合物可以呈允许将组合物给药于受试者(动物或人)的任何形式。例如,所述组合物可以呈固体、液体或气体(气溶胶)的形式。典型的给药途径包括但不限于口服给药、局部给药、肠胃外给药、舌下给药、直肠给药、阴道给药、眼部给药和鼻内给药。肠胃外给药包括皮下注射、静脉内给药、肌肉内给药、胸骨内注射或输注技术。优选地,将组合物肠胃外给药,更优选静脉内给药。可配制本发明的药物组合物以便使本发明的缀合物在给药时是生物可利用的。组合物可采用一个或多个剂量单位的形式。用于制备药物组合物的材料的用量应当是非毒性的。药物组合物中的活性成分的剂量取决于各种因素,诸如待给药的受试者的类型(例如,人类)、本发明的缀合物的具体形式、给药方式和所用的组合物。药学上可接受的载体和赋形剂是本领域所熟知的,并且不需要进一步描述。它们可以呈固体,例如颗粒形式,或可以为液体,例如口服糖浆或可注射液体。此外,载剂或载体可以是气态的,以便提供可用于例如吸入性给药的气溶胶组合物。当旨在用于口服给药时,组合物优选呈固体或液体形式,其中半固体、半液体、悬浮液和凝胶形式包括在本文认为是固体或液体的形式中。作为用于口服给药的固体组合物,组合物可被配制成粉末、颗粒、压片、丸剂、胶囊、咀嚼胶、薄片等形式。此类固体组合物通常包含一种或多种惰性稀释剂。此外,可以存在以下中的一种或多种:粘合剂,如羧甲基纤维素、乙基纤维素、微晶纤维素或明胶;赋形剂,如淀粉、乳糖或糊精,崩解剂,如海藻酸、海藻酸钠、玉米淀粉等;润滑剂,如硬脂酸镁;助流剂,如胶体二氧化硅;甜味剂,诸如蔗糖或糖精,风味剂如薄荷、水杨酸甲酯或橙子风味剂,以及着色剂。当组合物呈胶囊形式,例如明胶胶囊时,除了上述类型的材料之外,其还可包含液体载剂,诸如聚乙二醇、环糊精或脂肪油。组合物可以呈液体形式,例如酏剂、糖浆、溶液、乳剂或悬浮液。液体可用于口服给药或通过注射递送。当旨在用于口服给药时,组合物可包含一种或多种甜味剂、防腐剂、染料/着色剂和风味增强剂。在用于通过注射给药的组合物中,还可包括表面活性剂、防腐剂、润湿剂、分散剂、悬浮剂、缓冲剂、稳定剂和等渗剂中的一种或多种。本发明的液体组合物(无论其是溶液、悬浮液还是其它形式)还可包括下列中的一种或多种:无菌稀释剂,诸如注射用水、盐水溶液(优选地生理盐水)、林格氏溶液、等渗氯化钠、固定油(诸如可用作溶剂或悬浮介质的合成甘油单酯或甘油二酯)、聚乙二醇、甘油、环糊精、丙二醇或其它溶剂;抗菌剂,诸如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张度(tonicity)的试剂,诸如氯化钠或右旋糖。肠胃外组合物可以封闭在安瓿、一次性注射器或由玻璃、塑料或其它材料制成的多剂量小瓶中。生理盐水是优选的助剂。可注射组合物优选为无菌的。有效治疗特定疾病或病症的本发明缀合物的量将取决于疾病或病症的性质,并且可通过标准临床技术来测定。此外,体外或体内测定可任选用于帮助鉴定最佳剂量范围。组合物中使用的精确剂量还将取决于给药途径、和疾病或病症的严重性,并且应当根据从业医生的判断和每个患者的情况来决定。根据本发明的组合物包含有效量的本发明的缀合物,使得将获得合适的剂量。剂量可以通过待给药的受试者的体重或身体表面来确定。一般来讲,剂量通常为动物体重的约0.1mg/kg至约250mg/kg。在另一实施方案中,可通过在肿瘤的位点(或原位点)或自身免疫疾病的表现处直接注射来给药。在另一实施方案中,本发明的缀合物可以在囊泡,特别是脂质体中递送(参见,langer,science249:1527-1533(1990);treat等人,inliposomesinthetherapyofinfectiousdiseaseandcancer,lopez-berestein和fidler(编辑),liss,newyork,第353-365页(1989);lopez-berestein,同上,第317-327页;一般参见同上。)在另一实施方案中,本发明的缀合物可以在受控释放系统中递送。在一个实施方案中,可以使用泵(参见langer,同上;sefton,crccrit.ref.biomed.eng.14:201(1987);buchwald等人,surgery88:507(1980);saudek等人,n.engl.j.med.321:574(1989))。在另一实施方案中,可使用聚合物材料(参见medicalapplicationsofcontrolledrelease,langer和wise(编辑),crcpress,bocaraton,florida(1974);controlleddrugbioavailability,drugproductdesignandperformance,smolen和ball(编辑),wiley,newyork(1984);ranger和peppas,j.macromol.sci.rev.macromol.chem.23:61(1983);还参见levy等人,science228:190(1985);during等人,ann.neurol.25:351(1989);howard等人,j.neurosurg.71:105(1989))。在另一实施方案中,受控释放系统可放置在本发明化合物或组合物的靶(例如,脑)附近,因此,仅需要全身剂量的一部分(参见,例如goodson,inmedicalapplicationsofcontrolledrelease,同上,第2卷,第115-138页(1984))。可使用在评述中由langer(science249:1527-1533(1990))讨论的其它可控释放系统。术语载剂是指与本发明的缀合物一起施用的稀释剂、助剂或赋形剂。此类药物载剂可以是液体,例如水和油,包括石油、动物、植物或合成源的那些,例如花生油、大豆油、矿物油、芝麻油等。载剂可以是盐水、阿拉伯树胶、明胶、淀粉浆料、滑石、角蛋白、胶体二氧化硅、尿素等。此外,可使用辅助剂、稳定剂、增稠剂、润滑剂和着色剂。在一个实施方案中,当给药于动物时,本发明的化合物或组合物和药学上可接受的载剂是无菌的。当本发明化合物静脉内给药时,水是优选的载剂。盐溶液和含水葡萄糖和甘油溶液也可用作液体载剂,特别是用于可注射溶液。合适的药物载剂还包括赋形剂,诸如淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、干脱脂乳、甘油、丙二醇,水、乙醇等。如果需要,本发明的组合物还可包含少量润湿剂或乳化剂或ph缓冲剂。本发明的组合物可以采用溶液、悬浮液、乳剂、片剂、丸剂、粒料、和胶囊的形式,所述胶囊包含液体、粉末、缓释制剂、栓剂、乳液、气溶胶、喷雾剂、悬浮液或任何适用的其它形式。一般可参考e.w.mart的“remington'spharmaceuticalsciences”。以下实施例进一步说明本发明。实施例1在利用tcep(三(2-羧乙基)膦)方法部分还原抗体链间二硫键时制备念珠藻素-55-甘氨酸盐adc由新鲜制备的pbs-edta缓冲液,ph7.2,制备tcep-pbs-edta-溶液[3mmtcep(sigma-aldrich)的100μlpbs-edta溶液]和mab-pbs-edta-溶液(9mg/ml曲妥珠单抗的0.8mlpbs-edta溶液;62μm曲妥珠单抗)。将tcep-pbs-edta-溶液加入mab-pbs-edta-溶液中,并将所得溶液在25℃下温育60分钟。试剂的最终浓度如下:8mg/ml被还原的曲妥珠单抗(55μm)、290μmtcep。使用仪器在pbs-edta-缓冲液(ph7.2)中预平衡的hitrapdesaltingsephadexg25-5ml(gehealthcare/amersham)柱上进行脱盐,并且在pbs-edta-缓冲液中收集0.25ml体积的级分。测试所有级分的蛋白质含量(将2μl的每种级分加入200μlbradford-溶液中)。将含蛋白质的级分合并,通过bradford测定重新确定抗体浓度,获得3.3mg/ml(22.8μm),并回收5mg总抗体(70%回收率)。游离-sh的浓度使用elmann试剂dtnb(5,5'-二硫代双(2-硝基苯甲酸),sigma-aldrich/fluka)和具有l-cys的标准曲线(40-50-100-200-400-800μm)来确定。总-sh浓度为68.24μm,每抗体平均3个游离-sh。如上所述重复链间二硫键的部分还原,并将马来酰亚胺-peg-val-cit-pro-gly-念珠藻素-55-甘氨酸盐溶液(1.5mm的dmso溶液;100μl)直接滴加到样品(900μl)中,在4℃下连续搅拌2小时,获得10%dmso中150μl的最终浓度,从而获得相对于游离-sh基团的1:1摩尔比和相对于抗体的3:1摩尔比(抗体最终浓度为50μm,等同于150μm的总游离sh)。并行地,s-s还原抗体对照样品保留未缀合作为对照。在温育时间结束时,将每个样品立即装载到hitrapsephadexg25柱上,并如上进行脱盐。如上所述对合并的级分进行bradford和elmann测定,结果总结如下。在选择的免疫偶联反应条件下,sh/igg的平均数从2.7降至0.5,从而表明与药物连接子的结合在药物-抗体比(dar)为约2的情况下发生。然后使用仪器进行制备型凝胶排除色谱法。使用pbs-edtaph7.2作为色谱缓冲液并应用0.5ml/min的流速,将500μl的念珠藻素-55-甘氨酸盐-缀合的和未缀合的mab样品加载到superdex20010/300gl柱(gehealthcare/amersham)上。收集250μl级分。纯化药物连接子缀合的抗体导致两个蛋白质峰,峰2对应于念珠藻素-55-甘氨酸盐-缀合抗体的单体形式且峰1对应于念珠藻素-55-甘氨酸盐-缀合抗体的低聚物形式,如通过与合适的蛋白质mw标准(图2,左图)比较进行评估的。相反,未缀合的mab样品导致单峰,其对应于抗体的单体形式(“mab对照”(图2,右图))。合并峰分数并通过bradford分析测定蛋白质浓度。结果总结如下。实施例2在利用2-mea(2-巯基乙胺·hcl)法部分还原抗体链间二硫键时,制备念珠藻素-55-甘氨酸盐adc由新鲜制备的pbs-edta缓冲液(137mmnacl;2.7mmkcl;10mmna2hpo4;2mmkh2po4;10mmedta;ph=7.2),制备2-mea-pbs-edta-溶液(6mg2-mea的100μlpbs-edta溶液)和mab-pbs-edta-溶液(10mg曲妥珠单抗的1mlpbs-edta-溶液;68.7μm曲妥珠单抗)。将2-mea-pbs-edta-溶液(300μl)加入mab-pbs-edta-溶液(1ml)中,所得溶液在37℃下温育90分钟。试剂的终浓度如下:7.7mg/ml还原的曲妥珠单抗(53μm),13.8mg2-mea(122mm)。然后在hitrapdesaltingsephadexg255cm柱(pbs-edta-缓冲液)上脱盐,收集0.5ml体积的级分。目视测试所有级分的蛋白质含量(将2μl的每种级分加入200μlbradford溶液中)。合并含蛋白质级分并加入马来酰亚胺-peg-val-cit-pro-gly-念珠藻素-55-甘氨酸盐溶液(1.82mm,dmso;150μl)。在6℃下温育2小时,然后将溶液浓缩至小于1.5ml的体积。在纯化器(superdex200高负载16/60柱;pbs-edta-缓冲液)上纯化导致两个级分,将其浓缩至mab-cry-55-连接子-峰1(1.54μg/μl)和mab-cry-55-连接子-峰2(0.32μg/ul)。峰1和2对应于上述两种抗体聚集状态。实施例3细胞活性测定肿瘤细胞系(乳腺癌细胞系skbr-3和mcf7以及结肠癌细胞系hct116)得自美国典型培养物保藏中心,并根据标准方案生长。已知skbr-3细胞表达高her2水平,因此是曲妥珠单抗敏感的,而mcf7和hct116细胞示出较低的her2表达,因此耐曲妥珠单抗。根据制造商方案,使用发光细胞活性测定(promega)评估念珠藻素-55-甘氨酸盐adc缀合物对肿瘤细胞活性的影响。为了能够检测未缀合的曲妥珠单抗和曲妥单抗adc之间的差异,先前已经确定了实验条件(浓度范围、温育时间),在所述实验条件下曲妥珠单抗仅影响skbr-3细胞活性约30%,然而游离念珠藻素55同样对所有肿瘤细胞系有效。将细胞接种在黑壁的96孔板中(就skbr-3和mcf7而言,每孔5000个细胞;就hct116而言,每孔2000个细胞),并使其在37℃下在5%co2的潮湿气氛中附着过夜。然后移除培养基,并用包含递增浓度的曲妥珠单抗adc、未缀合的曲妥珠单抗或游离的念珠藻素类似物(cry-55,cry55-gly)的新鲜培养基置换,并将细胞在37℃下在5%co2中温育96小时。每个实验条件记录五到八个三次重复测定数据点。在温育结束时,使用perkinelmerwallac1450microbetatrilux检测器测量发光。以与用pbs(抗体)或0.1%dmso(化合物)处理的细胞进行比较来评价化合物细胞毒性。通过使用kaleidagraph软件利用四参数logistic方程拟合活性数据来计算cc50值。在用不同化合物处理sk-br3细胞时获得的残余细胞活力曲线图示于图1中。新型念珠藻素-55-甘氨酸盐adc(图1,下图)示出比裸曲妥珠单抗(图1,右上图)高得多的对该her2阳性乳腺癌细胞系的细胞毒性效应,这与由念珠藻素-55和念珠藻素-55-甘氨酸盐所示的细胞毒性相当(图1,分别为上左图和中间图)。不同于念珠藻素-55和念珠藻素-55-甘氨酸盐,相比于her2-低mcf7和hct116细胞系,adc细胞毒性效应对her2阳性sk-br3细胞是高选择性的(表1)。表1:cc50值实施例4念珠藻素-52的制备m=669.20g·mol-1c36h45cln2o8根据由weissc等人(2012)beilsteinjournaloforganicchemistry8:2060-6和weissc等人(2013)naturalproductreports30:924-40所公布的路径制备念珠藻素-52。念珠藻素-55的制备m=705.67g·mol-1c36h46cl2n2o8将念珠藻素-52(40mg;60μmol;1当量)在高真空中干燥,随后溶于纯(abs.)dcm(1ml)中。将溶液冷却至-50℃,并加入hcl(4m的二噁烷中,74.7μl;0.30mmol;5当量)。搅拌2小时后,使溶液温热至室温(rt),并在减压下除去挥发物。柱层析法(sio2;pe/etoac1:3)产生为无色固体的念珠藻素-55(43mg;60μmol;定量)。rf(pe/etoac1:3)=0.27;1h-nmr(600mhz,氯仿-d,tms)δ[ppm]=7.41-7.34(m,5h,ua-carh);7.21(m,1h,uc-nh);7.22(d,1h,j=2.2hz,ub-c2′h);7.08(dd,1h,j=8.3/2.1hz,ub-c6′h);6.86(d,1h,j=8.4hz,ub-c5′h);6.78(ddd,1h,j=15.1/10.6/4.4hz,ua-cβh);5.78(dd,1h,j=15.1/1.8hz,ua-cαh);5.52(d,1h,j=7.9hz,ub-nh);5.16(ddd,1h,j=10.6/8.2/2.0hz,ua-cδh);4.93(dd,1h,j=10.2/3.5hz,ud-cαh);4.75(ddd,1h,j=7.9/7.7/5.2hz,ub-cαh);4.65(d,1h,j=9.6hz,ua-cηh);4.01(dd,1h,j=9.7/1.9hz,ua-cζh);3.88(s,3h,ub-och3);3.38(dd,1h,j=13.4/8.2hz,uc-chahbnh);3.18(dd,1h,j=13.5/3.8hz,uc-chahbnh);3.14(dd,1h,j=14.5/5.2hz,ub-cβhahb);3.06(dd,1h,j=14.4/7.6hz,ub-cβhahb);2.70(m,1h,ua-cγhahb);2.49(m,1h,ua-cεh);2.38(ddd,1h,j=14.5/10.9/10.9hz,ua-cγhahb);1.78(ddd,1h,j=14.0/4.5/4.0hz,ud-cβhahb);1.72(m,1h,ud-cγh);1.43(ddd,1h,j=14.0/8.7/3.5hz,ud-cβhahb);1.23(s,3h,uc-c(ch3)2);1.17(s,3h,uc-c(ch3)2);1.04(d,3h,j=6.9hz,ua-cεhch3);0.93(d,3h,j=1.4hz,ud-cδh3);0.92(d,3h,j=1.2hz,ud-cδh3)。念珠藻素-55-甘氨酸三氟乙酸盐的制备m=875.28g·mol-1c40h50cl3f3n3o11根据liangj等人(2005)investigationalnewdrugs213-22进行念珠藻素-55-甘氨酸三氟乙酸盐的制备,然而合成在第一反应步骤之后不进行纯化的情况下进行。此外,产物不利用柱层析而是利用rp-hplc纯化以产生念珠藻素-55-甘氨酸三氟乙酸盐。1h-nmr(500mhz,氯仿-d,tms)δ[ppm]=7.37-7.32(m,3h,ua-carh);7.29(dd,2h,j=7.3/2.3hz,ua-carh);7.22(m,1h,uc-nh);7.20(d,1h,j=2.2hz,ub-c2′h);7.06(dd,1h,j=8.4/2.2hz,ub-c6′h);6.84(d,1h,j=8.5hz,ub-c5′h);6.60(bs,1h,ub-nh);6.53(ddd,1h,j=15.2/10.9/4.2hz,ua-cβh);5.74(dd,1h,j=15.3/1.8hz,ua-cαh);5.45(dm,1h,j=10.1hz,ua-cζh);4.94(dd,1h,j=10.4/2.9hz,ud-cαh);4.85–4.79(m,2h,ua-cδh/ua-cηh);4.54(ddd,1h,j=8.1/8.1/5.3hz,ub-cαh);3.87(s,3h,ub-och3);3.63(d,1h,j=16.7hz,gly-chahb);3.30(m,1h,uc-cβha);3.20(m,1h,uc-cβhb);3.16–3.06(m,2h,gly-chahb/ub-cβha);2.91(dd,1h,j=14.5/8.6hz,ub-cβhb);2.64(m,1h,ua-cεh);2.53(m,1h,ua-cγha);2.22(m,1h,ua-cγhb);1.93(m,1h,ud-cβha);1.70(m,1h,ud-cγh);1.65(m,1h,ud-cβhb);1.18(s,3h,uc-ch3);1.12(s,3h,uc-ch3);1.00(d,3h,j=7.2hz,ua-cεhch3);0.98(d,3h,j=6.7hz,ch3);0.93(d,3h,j=6.5hz,ch3)。自杀式连接子的制备m=322.39g·mol-1c15h30o7根据seitzo等人(1997)journaloforganicchemistry62:813-826中公布的程序合成叔丁基-15-羟基-4,7,10,13-四氧代十五烷酸酯。向四乙二醇(40.61ml;45.64g;235mmol)的纯thf(125ml)溶液中加入一片钠(1/4cm)。钠完全反应后,在20分钟内滴加叔丁基丙烯酸酯(11.98ml;10.57g;82.5mmol),并将所得溶液在室温下搅拌过夜。用naoh溶液(1n)将ph调节至7-8并且在真空中除去溶剂。将残余物溶于饱和nacl溶液(75ml)中并用etoac(3×100ml)萃取。将合并的有机层在mgso4上干燥并且蒸发溶剂后,获得无色油形式的叔丁基-15-羟基-4,7,10,13-四氧代十五烷酸酯(21.87g;67.8mmol;基于叔丁基丙烯酸酯计为82%)。1h-nmr(500mhz,氯仿-d,tms)δ[ppm]=3.77-3.57(m,18h;och2);3.01(bs,1h,oh);2.51(t,2h,j=6.6hz,ch2cootbu);1.45(s,9h,c(ch3)3);13c{1h}-nmr(126mhz,氯仿-d,tms)δ[ppm]=171.1(coo);80.7(c(ch3)3);72.6/70.8/70.7/70.6/70.5/67.0(och2);61.9(hoch2);36.4(ch2co);28.2(c(ch3)3)。m=401.45g·mol-1c19h31no8根据warneckea,(2002)dissertation合成叔丁基-15-马来酰亚胺基-4,7,10,13-四氧代十五烷酸酯。将ph3p(1.09g;4.14mmol;1当量)溶于纯thf(25ml)并将所得溶液冷却至-70℃。在1分钟内添加diad(0.8ml;4.14mmol;1当量),并且在-70℃下将黄色溶液搅拌5分钟。然后加入叔丁基-15-羟基-4,7,10,13-四氧代十五烷酸酯(2.0g;6.20mmol;1.5当量)并且将溶液搅拌另外的5分钟,然后加入马来酰亚胺(401mg;4.14mmol;1当量)。在-70℃下搅拌另外的5分钟后,移除冷却浴,使混合物升温至室温。在室温下继续搅拌18小时,然后在真空除去溶剂,并且通过柱色谱法(sio2;pe/etoac1:3)纯化油状残余物。获得无色油形式的叔丁基-15-马来酰亚胺基-4,7,10,13-四氧代十五烷酸酯(0.61g;1.51mmol;36%)。rf(pe/etoac1:3)=0.27;rf(pe/etoac1:1)=0.19;1h-nmr(500mhz,氯仿-d,tms)δ[ppm]=6.70(s,2h,ch=ch);3.71(m,4h,ch2);3.66–3.53(m,14h,ch2);2.49(t,2h,j=6.6hz,ch2cootbu);1.44(s,9h,c(ch3)3);13c{1h}-nmr(126mhz,氯仿-d,tms)δ[ppm]=171.0(ch2cootbu);170.8(coch=chco);134.3(ch=ch);80.6(c(ch3)3);70.8/70.73/70.70/70.65/70.5/70.2/68.0/67.1(och2);37.3(nch2);36.4(ch2cootbu);28.3(c(ch3)3)。m=345.35g·mol-1c15h23no8根据warneckea,(2002)dissertation制备15-马来酰亚胺-4,7,10,13-四氧代十五烷酸。将叔丁基-15-马来酰亚胺-4,7,10,13-四氧代十五烷酸酯(1.74g;4.33mmol)溶于纯dcm(8ml)中并且添加tfa(8ml)。将溶液在室温下搅拌1小时。接着,在真空中除去挥发性化合物,并将残余物再次溶于dcm(20ml)中。将amberlysta-21(6g)加入溶液中,并将所有物质在室温下搅拌1小时。接着滤出固体并将滤液浓缩至到干燥。获得深黄色油形式的15-马来酰亚胺-4,7,10,13-四氧杂十五烷酸(1.46g;4.23mmol;98%)。1h-nmr(500mhz,氯仿-d,tms)δ[ppm]=9.38(bs,1h,cooh);6.71(s,2h,ch=ch);3.75(dt,4h,j=21.6/5.8hz,nch2/ch2);3.68–3.58(m,14h,ch2);2.63(t,2h,j=6.1hz,ch2cooh)。m=755.81g·mol-1c33h53n7o13根据标准fmocspps[fieldsgandnoblerl,(2009)internationaljournalofpeptideandproteinresearch33,3:161-214]来合成马来酰亚胺-peg-val-cit-pro-gly。详见下表。从树脂中裂解之后,通过rp-hplc纯化残余物并且获得无色冻干物形式的马来酰亚胺-peg-val-cit-pro-gly(0.61g;0.81mmol;70%)。1h-nmr(500mhz,dmso-d6)δ[ppm]=12.24(bs,1h,cooh);8.10(dd,1h,j=6.1/5.8hz,gly-nh);8.06(d,1h,j=7.3hz,cit-nhco);7.81(d,1h,j=8.9hz,val-nhco);7.02(s,2h,ch马来酰亚胺);6.02(bm,1h,cit-nh);4.43(dd,1h,j=13.4/7.5hz,cit-ch);4.31(dd,1h,j=8.3/3.9hz,pro-ch);4.20(dd,1h,j=8.8/6.7hz,val-cαh);3.78(dd,1h,j=17.5/6.1hz,gly-cha);3.69(m,1h,pro-cγha);3.68(dd,1h,j=17.5/5.8hz,gly-chb);3.62–3.53(m,5h,peg-ch2/pro-cγhb);3.53–3.41(m,16h,peg-ch2);3.00–2.90(m,2h,cit-ch2nh);2.45(m,1h,peg-chahbconh);2.34(m,1h,peg-chahbconh);2.01(m,1h,pro-cβha);1.97–1.87(m,2h,val-cβh/pro-cδha);1.87–1.79(m,2h,pro-cβhb/pro-cγhb);1.67(m,1h,cit-cβha);1.49(m,1h,cit-cβhb);1.44–1.36(m,2h,cit-cγh2);0.81(d,3h,j=6.8hz,val-ch3);0.79(d,3h,j=6.8hz,val-ch3);13c{1h}-nmr(126mhz,dmso-d6)δ[ppm]=172.0(pro-co);171.3(cooh);171.0(val-co);170.9(马来酰亚胺-co);170.1(cit-conh);170.0(peg-conh);158.9(cit-conh2);134.6(马来酰亚胺-ch);69.8/69.77/69.72/69.66/69.5/69.4/67.0(peg-ch2);59.3(pro-cα);57.1(val-cα);50.2(cit-cα);46.8(pro-cγ);40.6(gly-ch2);30.7(val-cβ);29.2(pro-cβ);28.3(cit-cβ);26.1(cit-cγ);24.4(pro-cδ);19.2(val-cγ);18.1(val-cγ);hrms(esi-ft-icr):测量的[m·z-1]=778.35962[c33h53n7o13+na]+计算的[m·z-1]=778.35936[c33h53n7o13+na]+。用于马来酰亚胺缀合的念珠藻素-55-甘氨酸肽m=1500.51g·mol-1c71h100cl2n10o21将念珠藻素-55-甘氨酸三氟乙酸盐(10mg;13.1μmol;1当量)和马来酰亚胺-peg-val-cit-pro-gly(29.7mg;39.3μmol;3当量)溶于纯dmf(0.5ml)中。缓慢加入dipea(10μl;52.4μmol;4当量)、tbtu(12.6mg;39.3μmol;3当量)和hobt·h2o(5.3mg;39.3μmol;3当量)的纯dmf(0.5ml)溶液。在室温下搅拌过夜后,再次加入dipea、tbtu和hobt·h2o(与上述相同的量)。再次搅拌另外2小时,然后通过rp-hplc直接纯化反应溶液。获得无色冻干物形式的马来酰亚胺-peg-val-cit-pro-gly-念珠藻素-55-甘氨酸盐(11.8mg;8μmol;60%)。hrms(esi-ft-icr):测量的[m·z-1]=1521.63460[c71h100cl2n10o21+na]+计算的[m·z-1]=1521.63338[c71h100cl2n10o21+na]+。实施例5合成念珠藻素55-奥曲肽缀合物:-4-戊炔酰-奥曲肽(1):如先前由tailhades等人,angew.chem.int.ed.engl.2010,49,117所述来制备奥曲肽的直链前体。在fmoc-d-phe-oh偶联后,用哌啶/dmf(3:7,2±10分钟)移除fmoc基团,随后用dmf(6×1min)和ch2cl2(1x1min)洗涤。在室温下搅拌4小时下,在oxyma(4当量)和dic(4当量)的存在下,将4-戊炔酸(4当量)偶联。接着,树脂用dmf(6×1min)、ch2cl2(1×1min)洗涤,用et2o干燥。树脂在室温下用tfa/phoh/h2o/tis(88:5:5:2)裂解2小时。在tfa蒸发并用冷et2o沉淀后,将肽用h2o/ch3cn溶解并冻干。将粗肽溶解于磷酸盐缓冲液中(ph=7.4,100mm,每毫克肽2ml),并将混合物在室温下搅拌48小时。所述肽通过rp-hplc纯化(方法1,下文)并冻干。hplc:tr=5.02min(方法a,下文)maldi-tofms:1099.5[m+h]+,1121.6[m+na]+,1137.5[m+k]+-peg间隔基(2和3):根据osswaldb.,(2015)dissertation(https://pub.uni-bielefeld.de/publication/2733900)制备15-叠氮基-4,7,10,13-四氧代十五烷酸叔丁酯。将叔丁基-15-羟基-4,7,10,13-四氧代十五烷酸酯(1.50g;4.65mmol;1当量)溶于纯thf(10ml)中并将所得的溶液冷却至0℃。滴加甲磺酰氯(0.54ml;6.98mmol;1.5当量)和三乙胺(0.97ml;6.98mmol;1.5当量)并将溶液在0℃下搅拌30分钟,然后在室温下过夜。将nahco3(0.27g;3.20mmol;0.7当量)和nan3(0.45g;6.98mmol;1.5当量)与蒸馏水(10.5ml)一起加入混合物中并且所得溶液在室温下搅拌20min。在真空中除去thf并将剩余的溶液在80℃下搅拌4小时。冷却后,混合物用dcm(3×30ml)萃取,合并的有机层在mgso4上干燥并蒸发溶剂。通过柱色谱法(sio2;pe/etoac1:1)纯化淡黄色油状残余物。获得无色油形式的15-叠氮基-4,7,10,13-四氧代十五烷酸叔丁酯(0.74g;2.12mmol;46%)。rf(pe/etoac1:3)=0.69rf(pe/etoac1:1)=0.41h-nmr(500mhz,cdcl3)δ[ppm]=1.44(s,9h,c(ch3)3),2.50(t,2h,j=6.6hz,ch2cootbu),3.39(t,2h,j=5.1hz,ch2n3),3.57-3.74(m,16h)。根据warneckea,(2002)dissertation制备15-叠氮基-4,7,10,13-四氧杂十五烷酸。将15-叠氮基-4,7,10,13-四氧代十五烷酸叔丁酯(0.22g;0.63mmol)溶于纯dcm(5ml)中并添加tfa(5ml)。将溶液在室温下搅拌1.5小时。接着,在真空中除去挥发性化合物,将残余物溶于二乙醚(10ml)中并蒸发溶剂(重复2次)。将溶液浓缩至干燥。获得无色油形式的15-叠氮基4,7,10,13-四氧杂十五烷酸(0.18g;0.62mmol;98%)。1h-nmr(500mhz,cdcl3)δ[ppm]=2.63(t,2h,j=6.2hz,ch2cooh),3.39(t,2h,j=5.1hz,ch2n3),3.58-3.71(m,14h),3.76(t,2h,j=6.2hz,ch2ch2cooh).-自杀式连接子(4):根据标准的fmocspps合成叠氮基-teg-val-cit-gly-pro-oh4。详情参见下表。从树脂裂解之后,残余物通过rp-hplc纯化并且以无色冻干物的形式接收叠氮基-egeg-val-cit-gly-pro-oh(0.05g;0.07mmol;70%)。maldi-tofms:702.3[m+h]+,724.3[m+na]+-叠氮基-teg-val-cit-gly-pro-gly-念珠藻素-55(5):将念珠藻素-55-甘氨酸三氟乙酸盐(5mg;5.7μmol;1当量)和叠氮基-teg-val-cit-gly-pro-oh(16.0mg;22.8μmol;4当量)溶于纯dmf(0.5ml)中。缓慢加入dipea(5.0μl;34.2μmol;6当量)、pybop(11.9mg;22.8μmol;4当量)和hobt·h2o(3.5mg;22.8μmol;4当量)的纯dmf(0.5ml)溶液。反应混合物在室温下搅拌3.5小时,然后溶液通过rp-hplc直接纯化。获得无色冻干物形式的叠氮基-teg-val-cit-gly-pro-念珠藻素-55-甘氨酸盐(6.2mg;4.3μmol;75%)。hplc:tr=7.06min(方法a)maldi-tofms:1467.6[m+na]+-念珠藻素-55-奥曲肽缀合物(6):将叠氮基官能化的念珠藻素5(1.5mg,1.04μmol,1.0当量)和4-戊炔酰基-奥曲肽1(1.14mg,1.04μmol,1.0当量)的混合物溶于tbuoh/h2o(1ml,2:1v/v)中。加入铜粉(2.0mg),并且将混合物在室温下搅拌48小时。然后,将反应混合物用h2o/can(5ml,1:1v/v)稀释并通过过滤。将滤液冻干,并且随后通过rp-hplc纯化。获得白色固体形式的念珠藻素-55-奥曲肽缀合物6(0.55mg,16%收率)。hplc:tr=6.79min(方法a)esi-ms(m/z):2546.6[m+h]+,1273.7[m+2h]2+,1284.7[m+h+na]2+,1292.7[m+h+k]2+,862.1[m+2h+k]+hrms:对于c121h170cl2n22o30s2计算的[m+2h]2+1272.56304;发现为1272.56468对于c121h170cl2n22o30s2na计算的[m+2h+na]3+856.03843;发现为856.03890分析hplc:分析hplc在配备有phenomenexjupiterc18柱(尺寸4.6mm(id)×250mm,粒径5μm)的thermoseparationproductshplc单元(控制器sn4000,泵p4000,自动进样器as100,检测器uv6000lp,在λ=274nm处测量的uv吸收)上进行。使用以下洗脱液:洗脱液a:h2o/ch3cn/tfa95:5:0.1洗脱液b:h2o/ch3cn/tfa5:95:01方法a:流量:700μl/min制备型hplc:制备型rp-hpl-色谱在配备有macherey-nagelc18-柱(尺寸10mm(id)×250mm,粒径7μm)的merck-hitachi单元(控制器:d-7000,泵:l7150,检测器:l7420,在l=220nm处测量的uv吸收)上进行。方法1(洗脱剂a和b,如分析hplc):流量:4ml/minesi-ms:使用配备有标准esi/apci源的esquire3000离子阱质谱仪(brukerdaltonikgmbh,bremen,germany)记录esi/apci质谱。用注射泵直接输注来引入样品。氮气既用作喷雾器气体又用作干燥气体。氮气由bruker氮气发生器ngm11产生。通过多个单一光谱(如引用的)的累积和平均,由brukerdaltonikesquirent5.2esquire控制软件记录本文所示的光谱。dataanalysistm软件3.4用于处理光谱。hrms:在thermo-fisher-scientificorbitrapltqxl中记录精确的esi质谱。实施例6念珠藻素-55-奥曲肽缀合物的合成:重复实施例5但使用以下自杀式连接子:实施例7rna纯化和定量rt-pcr从美国典型培养物保藏中心获得肿瘤细胞系(大鼠胰腺肿瘤细胞系ar42j和人乳腺癌细胞系mcf7),并根据标准方案生长。根据制造商的建议,使用包括dnasei处理剂(qiagen)的rneasymini试剂盒(qiagen,germantown,md)从细胞中提取总rna。在96孔光学板中组装一步rt-pcr反应。如下一式三份进行定量rt-pcr。制备40μl反应混合物,其包含25μl的2xmastermix,0.5μl的100xrt(quantitectprobert-pcr试剂盒,qiagen)和2.5μl的以下qpcr测定中的每一种(appliedbiosystems/thermofisher):大鼠sstr2(rn01464950_g1)、人sstr2(hs00265624_s1)、大鼠gapdh(rn01775763_g1)和人gapdh(hs04420632_g1)。然后以50ul的最终反应体积加入10μl浓度为3ng/ul的总rna,并使用abi7900ht实时热循环仪(perkinelmer)进行定量rt-pcr(50℃30min,95℃10min,之后进行40个循环:95℃15秒,60℃1min)。通过使用2^(-δδc-t)方法对gapdh归一化的mrna表达值进行定量计算。rt-qpcr结果,其中mcf7细胞中的sstr2表达水平表示为ar42j细胞中测得的相应值(设为100%)的百分比。rt-qpcr结果证实ar42j细胞表达相对高水平的sstr2mrna,然而在mcf7细胞中,表达水平低得多(约0.6%)。实施例8细胞活性测定根据制造商方案,使用发光细胞活性测定(promega)评估实施例5的念珠藻素-55-甘氨酸盐-奥曲肽缀合物对肿瘤细胞系ar42j(sttr2高)和mcf7(sstr2低)的活性的影响。将细胞接种在黑壁96孔板中(每孔5000个细胞),并使其在37℃,5%co2的潮湿气氛中粘附过夜。然后移除培养基,并用包含增加浓度的念珠藻素-55-甘氨酸盐-奥曲肽缀合物(cry55-gly-oct)、未缀合的奥曲肽或游离的念珠藻素-55-甘氨酸盐(cry55-gly)的新鲜培养基代替,并且细胞在37℃下在5%co2中温育120小时。对于每个实验条件(对于cry55-gly和cry55-gly-oct而言为0.0015nm至10nm,对于未缀合的奥曲肽而言为0.0015nm至10um),记录了九个一式三份1:3连续稀释数据点。在温育结束时,使用perkinelmerwallac1450microbetatrilux检测器测量发光。与用0.1%的dmso处理的细胞相比,评估化合物细胞毒性。通过使用kaleidagraph软件利用四参数logistic方程拟合活性数据来计算ic50值。利用不同化合物处理ar42j和mcf7时获得的残余细胞活性曲线分别示于图3和图4中。对于sttr2高ar42j肿瘤细胞系,新型念珠藻素-55-甘氨酸盐-奥曲肽缀合物(图3,左上图)示出比裸奥曲肽高得多的细胞毒性效应(图3,下图),其中ic50值(0.9nm)非常类似于由念珠藻素-55-甘氨酸盐化合物(图3,右上图)所示的。对于mcf7,未缀合奥曲肽完全无效,如预料的(图4,下图)。与对ar42j细胞观察到的不同,55-甘氨酸盐-奥曲肽缀合物(图4,左上图)抑制mcf7细胞活性,其中ic50值显著低于用念珠藻素-55-甘氨酸盐化合物测得的ic50值(90倍)(图4,右上图)。此外,虽然念珠藻素-55-甘氨酸盐化合物以相似的效力抑制两种细胞系的活性(比较图3和图4,右上图),但相比于sstr2低mcf7细胞,缀合的奥曲肽细胞毒性效应对sttr2高ar42j细胞具有很大选择性(比较图4和图3,左上图),其中ic50值分别为0.9nm和27nm。所有化合物对两种测试细胞系的ic50值总结于表中。实施例9念珠藻素-55-甘氨酸盐和念珠藻素-55-甘氨酸盐药物连接子分子对多重耐药性肿瘤细胞系的活性h69细胞和耐药性配对物h69ar购自美国典型培养物保藏中心,并根据标准方案生长。根据制造商方案,使用发光细胞活性测定(promega)评估念珠藻素和念珠藻素缀合物对野生型和耐药性肿瘤细胞系的活性的影响。将细胞接种在黑壁96孔板中(每孔5000个细胞),并使其在37℃下在5%的co2的潮湿气氛中粘附过夜。然后移除培养基并用包含增加浓度的念珠藻素类似物或多柔比星作为对照的新鲜培养基代替。将细胞与化合物在37℃下在5%co2中温育120小时。对于每个实验条件(对于cry55-gly、cry55-gly-连接子73和cry55-gly-连接子76为0.05nm至10nm,对于多柔比星为1.2nm至2700nm),记录了八个一式三份1:3连续稀释数据点。在温育结束时,使用perkinelmerwallac1450microbetatrilux检测器测量发光。与用0.1%dmso处理的细胞进行比较来评价化合物细胞毒性。如下表和图5中所示,念珠藻素和念珠藻素药物连接子示出对野生型和耐药性血细胞的相似细胞毒性,然而用作对照的多柔比星选择性影响野生型细胞的细胞活性并且对耐药性h69ar细胞系仅具有微小影响。化合物h69细胞ic50(nm)h69ar细胞ic50(nm)cry550.10.23cry55‐gly0.090.15实施例51.73.6实施例61.74.1多柔比星36.0>2000当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1